Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680
Medicina (B. Aires) vol.74 supl.1 Ciudad Autónoma de Buenos Aires ago. 2014
SUPLEMENTO
Guía Argentina de urticaria y angioedema
Jorge Máspero1, Hugo Cabrera2, Ledit Ardusso3, Mónica De Gennaro1, Ramón Fernández Bussy4, José Galimany5, Daniel Galimberti6, Marcelo Label7, Marta La Forgia8, Iris Medina9, Hugo Neffen10, Patricia Troielli11
1Fundación CIDEA, Buenos Aires,
2Cátedra de Dermatología, Facultad de Medicina, Universidad de Buenos Aires,
3Facultad de Ciencias Médicas, Universidad Nacional de Rosario y Hospital Provincial del Centenario, Rosario, Santa Fe,
4Cátedra de Dermatología, Universidad Nacional de Rosario y Hospital Provincial del Centenario, Rosario, Santa Fe,
5Sanatorio Británico de Rosario, Santa Fe,
6Hospital Italiano de Buenos Aires,
7Hospital Ramos Mejía, Buenos Aires,
8Hospital Dr. J. M. Penna, Buenos Aires,
9Especialista consultor en Alergia e Inmunología Clínica,
10Hospital de Niños Orlando Alassia, Santa Fe,
11Facultad de Medicina, Universidad de Buenos Aires, Argentina
Dirección postal: Paraguay 2035, 3° Cuerpo 2° Subsuelo, 1121 Buenos Aires, Argentina
Fax: (54-11) 4961-5495 e-mail: jorge.maspero@fundacionidea.org.ar
Resumen
Se actualiza el diagnóstico de la urticaria crónica (UC) y los conceptos, definiciones y sugerencias basados en la evidencia para su tratamiento. La urticaria ocurre en al menos 20% de la población en algún momento de la vida. Su etiología difiere en la forma aguda (menos de 6 semanas), y en la crónica. No es posible pronosticar si las formas agudas evolucionarán a UC, ya que todas son agudas al comienzo. La UC ocurre como espontánea (UCE) o inducible (UCI). El diagnóstico es sencillo, pero incluye un minucioso estudio para descartar diagnósticos diferenciales; para UCI son útiles las pruebas de provocación en la caracterización y manejo. Los estudios complementarios se deben limitar y orientar según sospecha clínica. El tratamiento se divide en tres enfoques: evitación, eliminación o tratamiento del estímulo desencadenante o de la causa, y tratamiento farmacológico. Recientemente éste se modificó, con empleo de antihistamínicos de segunda generación como primera línea y aumento de dosis de antihistamínicos H1 no sedantes, hasta 4 veces, como segunda línea. Los antihistamínicos son fundamentales para tratar la UC; sin embargo, un 40% de los pacientes no logra un buen control pese al aumento de dosis y requiere otro medicamento adicional. La evidencia más reciente considera que un grupo de fármacos puede utilizarse como tercera línea en estos casos, para mejorar la calidad de vida y limitar la toxicidad por el uso frecuente o crónico de esteroides sistémicos. Se recomiendan para esta tercera línea solo 3 fármacos: omalizumab, ciclosporina A o antileucotrienos.
Palabras clave: Urticaria crónica; Angioedema; Urticaria crónica espontánea; Urticaria crónica inducible; Omalizumab.
Abstract
Argentine Guidelines for Urticaria and Angioedema. This interdisciplinary paper summarizes the news in the diagnosis and treatment of chronic urticaria (CU), and provides concepts, definitions and evidence-based suggestions for its management. Urticaria occurs in at least 20% of the population at some point in their lives. Acute urticaria (less than 6 weeks' duration), differs from CU in its etiology, but the onset of this disease is always acute. CU may occur as spontaneous (SCU) or induced (ICU). The diagnosis is simple, although a careful evaluation is necessary for differential diagnosis. ICU´s diagnosis is mainly clinical, even if provocation tests can be useful. Supplementary studies should be limited and based on the clinical suspicion. Treatment may be divided into three approaches: avoidance, elimination or treatment of the cause, and pharmacological treatment. Recently treatment has been modified with the use of second-generation antihistamines as first-line and increased doses of nonsedating H1 antihistamines, up to 4 times, as second line. Antihistamines are essential to treat CU; however, 40% of patients do not achieve good control despite increased doses and require additional treatment. The most recent evidence indicates a group of drugs to be used as third line in these cases, to improve quality of life and to limit toxicity from frequent or chronic use of systemic steroids. Only 3 drugs are recommended as third line: omalizumab, cyclosporin A or anti-leukotrienes.
Key words: Chronic urticaria; Angioedema; Spontaneous chronic urticaria; Induced chronic urticaria; Omalizumab.
Este documento interdisciplinario es fruto del esfuerzo de dos sociedades científicas: la Asociación Argentina de Alergia e Inmunología Clínica (AAAeIC) y la Sociedad Argentina de Dermatología (SAD), y de la dedicación de sus autores, revisores y editores, especialistas de ambas disciplinas.
Su finalidad es acercar, tanto al médico general como a los especialistas, una síntesis actual y práctica de las últimas novedades en el diagnóstico y tratamiento de la urticaria crónica, buscando aportar conceptos, definiciones y sugerencias útiles y basadas en la evidencia, para el manejo de este grupo de pacientes, reconociendo las similitudes y diferencias que deben tomarse en cuenta para diagnosticar y tratar los diferentes tipos de urticaria.
Algunos conceptos prácticos
La mayoría de los conceptos enunciados a continuación se encuentran desarrollados en esta guía. Se resumen en esta sección solo a efectos didácticos, pero no reemplazan la lectura del documento. En particular destacaremos algunas recomendaciones acerca de la evaluación y el tratamiento.
Educación del paciente
La urticaria es una enfermedad que desafía muy especialmente al médico en su rol de guía y educador de sus pacientes. Es central que el profesional brinde al paciente y a su familia información calificada y jerarquizada sobre las características de esta enfermedad, su evolución y tratamiento. Todo esfuerzo terapéutico se verá limitado si el paciente no comprende las causas y desencadenantes de su enfermedad -cuando se identifican- así como los objetivos del tratamiento y la importancia de seguir las indicaciones y controles en el largo plazo.
Uso y abuso de exámenes complementarios en urticaria crónica espontánea
Se deben limitar, inicialmente, los estudios complementarios, y orientar los estudios accesorios según la sospecha clínica. No tiene sentido realizar enorme cantidad de estudios de laboratorio ni tests de alergia extensos a la mayoría de los pacientes en forma sistemática. Las biopsias deben limitarse a los casos de sospecha de vasculitis o, de ser necesarias, para diagnóstico diferencial.
Recomendaciones sobre dietas
Solo ante fuerte evidencia de alergia alimentaria se recomienda indicar que se evite el alimento involucrado. Las dietas libres de pseudoalergenos han demostrado ser útiles en algunos pacientes y deben ser consideradas como prueba terapéutica en pacientes con síntomas marcados y diarios.
Definición de exacerbación de la urticaria crónica
Es la situación clínica en la cual se produce un aumento marcado de síntomas por sobre el nivel usual del paciente, que no puede ser controlado por el aumento de dosis o el agregado de otros antihistamínicos al tratamiento habitual, y que requiere del empleo de esteroides sistémicos para su control.
Recomendación sobre el empleo de antihistamínicos
Se recomienda el uso de antihistamínicos de segunda generación -no sedativos- como primera línea de tratamiento de la urticaria. En los pacientes que no logran controlar la urticaria con dosis estándar se debe aumentar la dosis hasta el cuádruple como segunda línea de tratamiento. Se recomienda especialmente el uso continuo (diario) de los antihistamínicos, ya que el resultado es superior al del uso reactivo o a demanda. Se desaconseja el empleo de antihistamínicos de primera generación o sedativos por el riesgo de efectos colaterales, tanto en adultos como en niños.
Recomendaciones sobre el uso de esteroides sistémicos
Los esteroides sistémicos se deben limitar al tratamiento de las exacerbaciones. En estos casos se recomienda el empleo de esteroides orales (prednisona o meprednisona) entre 4 y 7 días. No se aconseja el uso de esteroides sistémicos inyectables de depósito, ya que no tienen eficacia adicional a los orales y presentan un mayor riesgo de afectar la función adrenal.
Recomendación sobre el empleo de omalizumab
Omalizumab es eficaz en la mayoría de los pacientes con urticaria crónica espontánea, pero por razones exclusivas de costos su uso debe limitarse a aquellos pacientes con formas graves que no controlan su afección con dosis de antihistamínicos de segunda generación hasta 4 veces las habituales, o que presentan efectos colaterales con estas dosis no aprobadas; es decir, como tercera línea de tratamiento.
Se recomienda el empleo de dosis de 300 mg, aunque es evidente que existen pacientes que responden adecuadamente a 150 mg. Asimismo, se enfatiza que aún están en curso estudios destinados a evaluar si el mantenimiento de largo plazo puede hacerse con 150 mg una vez controlada la enfermedad.
Urticaria crónica: definiciones y clasificación actual
La urticaria es una entidad diagnosticada comúnmente, que ocurre en al menos un 20% de la población. La denominación urticaria comprende un grupo heterogéneo de afecciones que suelen no ser reconocidas. Esta es una de las razones que, entre otras, dificultan el diagnóstico y el progreso del tratamiento de esta enfermedad.
Urticaria y angioedema
La lesión de urticaria puede resultar sencilla de identificar a primera vista. Se trata de una pápula (elevación circunscripta de la piel) de coloración eritematosa, tamaño y forma variable, que pica y se conoce como "roncha". Las claves para su diagnóstico son la variación en el tiempo de aparición y desaparición de las lesiones. Las ronchas son evanescentes, no permanecen más de 24 horas y la respuesta al prurito, por rascado con frotamiento, no lastima la piel. Una vasodilatación localizada produce el enrojecimiento, y el reflejo axónico por vasodilatación arteriolar, el eritema periférico. El incremento del flujo genera calor y aumenta la permeabilidad vascular responsable del edema y del blanqueamiento central (los hallazgos de la triple respuesta de Lewis)1. Una variedad de sustancias -entre ellas cininas, prostaglandinas, leucotrienos y enzimas proteolíticas- se asocian a la histamina, el principal desencadenante de las reacciones urticarianas dependientes de una activación anormal de los mastocitos cutáneos.
El angioedema, que muy frecuentemente acompaña a la urticaria2, se expresa como una deformidad, reflejo del edema más profundo, que ocurre en cualquier parte del tegumento y puede comprometer el tracto respiratorio. Suele tener una resolución más lenta que las lesiones de urticaria y manifestarse como una desagradable sensación de distensión, no necesariamente pruriginosa.
Epidemiología
Las urticarias constituyen una de las veinte enfermedades cutáneas más frecuentes. En algún momento de la vida, más del 20% de la población general tendrá un episodio de urticaria, angioedema, o ambos. Sin embargo, según los distintos autores, la prevalencia difiere ampliamente. Las formas agudas son más frecuentes que las crónicas (18.9%-0.59%, respectivamente)3. Las formas agudas son también frecuentes en la infancia y afectan entre el 15% y 20% de los niños antes de la adolescencia4. Las crónicas tienden a ser más comunes entre la tercera y la sexta década, con un pico a los 40 años, particularmente entre las mujeres, probablemente debido a que del 35% al 40% de las urticarias crónicas (UC) tienen origen autoinmune, enfermedades de mayor prevalencia en mujeres5.
Histopatología
Si bien no se recomienda como procedimiento de rutina, la biopsia cutánea en la urticaria muestra edema dérmico y dilatación de los vasos capilares y linfáticos en la piel afectada. La diferencia entre las lesiones de UC y urticaria aguda (UA) es la presencia de un infiltrado celular mixto perivascular, compuesto en su mayoría por células mononucleares, que rodea las vénulas post-capilares dérmicas. El número de mastocitos en las lesiones puede ser mayor que en la dermis normal aunque no hay acuerdo definitivo sobre esta cuestión6.
La biopsia debe realizarse siempre ante lesiones de duración mayor a 24 horas, estándar de oro para el diagnóstico de urticaria vasculitis, que demuestra evidencia histológica de vasculitis leucocitoclástica (edema endotelial de las vénulas post-capilares, polvillo nuclear, depósito de fibrina y diapédesis de eritrocitos). Una práctica que optimiza el diagnóstico es la diascopía de las lesiones posibles de biopsiar, con toma de muestras donde se refleje púrpura7.
Además de la urticaria vasculitis, la biopsia también es útil en el diagnóstico de la dermatitis urticariana, un particular subgrupo de patrones de reacción por hipersensibilidad cutánea no restringida a una simple entidad, más frecuentemente asociado a eczemas y reacción por drogas8.
La definición histológica propuesta para la dermatitis urticariana es la de una combinación de inflamación linfocitaria con eosinófilos de la dermis superficial con mínima espongiosis.
Definiciones y clasificación
Según la duración de los síntomas, la urticaria se divide en dos tipos principales: aguda es aquella que dura menos de 6 semanas y crónica, la que persiste por un período mayor. Los pacientes tienen UC intermitente o recurrente cuando los síntomas son persistentes pero interrumpidos por intervalos libres, de pocos días de duración.
Las guías recientemente publicadas ayudan a clarificar distintos aspectos de la urticaria y el angioedema en cuanto a clasificación, diagnósticos diferenciales y determinación del nivel de actividad, entre otros9. La UC ocurre como espontánea (UCE) -antes denominada idiopática, común u ordinaria- o inducible (UCI). Este último grupo, en el cual la aparición de las lesiones es provocada por un estímulo, incluye a las urticarias físicas: dermografismo sintomático, urticaria por frío, urticaria demorada por presión, urticaria solar, urticaria por calor y angioedema vibratorio, la urticaria colinérgica, la acuagénica y por contacto. Las urticarias espontáneas, es decir aquellas que no tiene un provocador, pueden ser de causa reconocida o desconocida10 (Tabla 1).
Tabla 1. Urticaria crónica. Clasificación

Abordaje clínico en relación a la patogenia
La UC, ya sea espontánea o inducible, siempre involucra la participación de los mastocitos, su activación por diversos mecanismos y la consiguiente liberación de mediadores preformados y sintetizados de novo. La histamina desempeña un papel importante, aunque otros mediadores, tales como leucotrienos y factor activador de plaquetas, también están implicados en el desencadenamiento de los síntomas.
En ciertas circunstancias clínicas, como los trastornos autoinflamatorios que pueden cursar con urticaria, y en la urticaria vasculitis, los habones son provocados por otros mecanismos y deben considerarse en el diagnóstico diferencial. Asimismo, en ciertas formas de angioedema sin urticaria -como el angioedema hereditario o adquirido o angioedema debido a inhibidores de la enzima convertidora de angiotensina- los síntomas no dependen de la activación de mastocitos, sino que se deben a la acumulación de bradicinina, y no responden a antihistamínicos.
La presencia de síntomas asociados a la UC, como malestar general, dolor de articulaciones o fiebre recurrente de causa desconocida, obligan a considerar el diagnóstico diferencial con enfermedad autoinflamatoria (raras). Ante lesiones de más de 24 horas de duración es necesario investigar, ya que éste es un signo de urticaria vasculitis. Se indicará biopsia para confirmar el diagnóstico con el hallazgo de signos histopatológicos de vasculitis. A continuación se debe diferenciar la urticaria espontánea de la inducible10 (Figura 1).
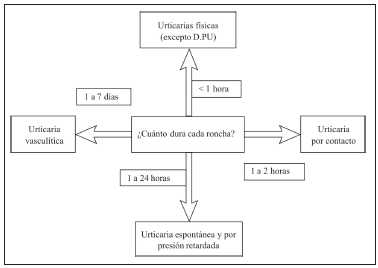
Fig. 1. Diagnóstico diferencial de la urticaria según la duración de cada roncha
Uno de los factores recientemente reconocidos, que produce la degranulación de los mastocitos en la UC, es la presencia de autoanticuerpos IgG contra la α-subunidad del receptor de alta afinidad IgE (FcεRIα) o contra de la IgE, demostrado en el 50% de los pacientes con UC11. Informes recientes revelan que los pacientes con UC muestran signos de generación de trombina y activación de la vía del factor tisular de la cascada de coagulación. El dímero D es un producto de degradación de fibrina, formado durante la lisis del trombo, que se ha observado aumentado en UC12. Criado y col. observaron dicho aumento en pacientes con UC activa y urticaria vasculitis, respecto de controles con psoriasis13.
En los pacientes con angioedema sin ronchas, ante la posibilidad de angioedema mediado por bradicinina, se debe pesquisar la toma del inhibidor de la enzima convertidora de angiotensina y estudiar los factores del complemento2.
Angioedema
Con el nombre de angioedema deben reconocerse el relacionado con los inhibidores de la enzima convertidora de angiotensina (IECA), el angioedema hereditario (AEH) y el adquirido (AEA).
Angioedema IECA
El IECA ocurre en 1 de cada 1000 tratamientos con dichas drogas y es más común en pacientes africanos/ afro-americanos. Además del edema en párpados, labios, lengua, faringe y laringe, se puede observar a veces también dolor abdominal. La urticaria concurrente es muy rara. La relación con la droga es poco reconocida, ya que el episodio puede ocurrir meses o años después del inicio del tratamiento. La activación del complemento no está involucrada, pero sí la acumulación de bradiquinina. Este ubicuo y potente agente de vasopermeabilidad actúa sobre los receptores vasculares B2 y es degradado en los pulmones por la ECA en péptidos inactivos. El mecanismo específico de los IECA causantes de la elevación de la bradiquinina en sangre y tejidos conduce al angioedema. La razón de la reacción en una pequeña minoría de usuarios no está clara, pero se sospecha de polimorfismos de ECA o de otras enzimas responsables de la degradación de cininas14, 15.
Angioedema hereditario o adquirido
Se reconocen en la actualidad distintas variantes de angioedema causado por mecanismos diferentes a la liberación de mediadores de los mastocitos. En primer lugar se identificó el AEH, enfermedad de baja prevalencia y heterogeneidad en la gravedad del cuadro clínico, producido por una alteración en el gen que codifica la proteína inhibidora de la C1esterasa activada (C1-INH), provocando su síntesis deficiente o anómala y evitando la activación del sistema del complemento. Además de regular la cascada del complemento, también modula la vía de la coagulación, la vía generadora de cininas y el sistema fibrinolítico, interrelacionadas entre sí, al inactivar el factor XIIa, la plasmina y la calicreína plasmática, previniendo la producción de bradicinina. Se transmite de forma autosómica dominante y se desencadena por estrés emocional, trauma -aún mínimo-, cambios hormonales, drogas o infecciones. El comienzo suele ocurrir en los primeros años de la vida, con la aparición recurrente de angioedema indoloro, no pruriginoso y no depresible (de 48-72 horas de duración, aunque raramente, puede persistir hasta 5 días) de carácter leve, moderado o grave, localizados en piel, y además en tracto gastrointestinal y vías respiratorias superiores, con compromiso de vida.
Se reconocen tres tipos de AEH. En el tipo 1 (80-85% de los casos), los niveles séricos del IHE-C1 son bajos. El tipo 2 representa 25% de los casos y los niveles del IC1 pueden ser normales o incluso encontrarse elevados, pero su función es anormal. El tipo 3 representa el 1% de los casos y los pacientes tienen niveles normales del IC1, la mayoría son mujeres, con pocas excepciones. Se lo relaciona con actividad estrogénica, con niveles y función del INH C1 normales y, probablemente, con la mutación del factor XII, al menos en un subset16.
El AEA se caracteriza bioquímicamente por bajas concentraciones del INH C1 y de los componentes C1, C1q, C2 y C4, con niveles normales de los componentes terminales C3-C9, ausencia de evidencia de herencia, e instauración de síntomas en la edad mediana. Tiene dos formas de presentación: tipo1, donde los niveles bajos del INH C1 son debidos a la activación de C1 por complejos inmunes circulantes o a la interacción de C1 con antígenos de superficie de células tumorales (se asocia con linfoma no Hodgkin, leucemia linfocítica crónica, macroglobulinemia de Waldenström, linfosarcoma, crioglobulinemia esencial, linfoma linfocítico y mieloma), y tipo 2, donde existen autoanticuerpos dirigidos contra el INH C1 que interfieren con su actividad funcional17.
Relación urticaria/angioedema con anafilaxis
La presencia de angioedema con o sin UA requiere considerar la posibilidad de progresión a anafilaxis cuando la actividad de activación mastocitaria no queda confinada a la piel, como resultado de un precipitante exógeno como drogas (35%), alimentos (32%), picaduras de insecto (19%), entre otros. El angioedema es frecuentemente facial con edema de labios, lengua o faringe, así como de laringe, miembros o genitales. Los síntomas sistémicos incluyen tos o disnea causada por broncoespasmo, náuseas, vómitos, retortijones o diarrea (los dos últimos más comunes) e hipotensión. Un episodio de anafilaxis debe ser adecuadamente documentado en base a la observación personal, registros del shock room, pruebas de función pulmonar y la demostración de elevación aguda y transitoria de la triptasa sérica durante el episodio18, 19.
Urticaria aguda y crónica: fisiopatogenia
La urticaria puede ser clasificada tanto por el tiempo de evolución como por la etiología subyacente. Las etiologías y mecanismos que llevan a la aparición de la urticaria no son idénticos en la forma aguda y en la crónica. De hecho, las reacciones mediadas por IgE, por ejemplo frente a alimentos, son más comunes en la urticaria aguda y mucho más raros en la forma crónica. En la práctica, no es posible pronosticar si la urticaria aguda evolucionará a crónica, ya que todas las urticarias son agudas en su comienzo.
Si bien el mecanismo que lleva a su activación puede variar, prácticamente en todas las formas de urticaria aguda y crónica la sintomatología se debe a la liberación de mediadores preformados y neo sintetizados por parte de los mastocitos de la piel.
La urticaria con o sin angioedema puede ser la resultante de una variedad de estímulos desencadenantes, o parte de una enfermedad adquirida (urticarias para-infecciosas por ejemplo por Helicobacter pylori, o urticarias paraneoplásicas) o hereditaria.
En base a la fisiopatogenia podemos agrupar los mecanismos de activación del mastocito en inmune, no inmune e idiopático (Tabla 2).
Tabla 2 . Clasificación de la urticaria según el mecanismo que ocasiona las lesiones (activación de mastocitos)*

*Modificado de Saini SS. Chronic spontaneous urticaria: etiology and pathogenesis. Immunol Allergy Clin North Am 2014; 34: 33-52.
La principal célula efectora es el mastocito, que puede degranularse en respuesta a diferentes estímulos (Fig. 2). Los mastocitos tienen receptores de membrana que, al interactuar con sus ligandos, activan vías de transducción de señales:
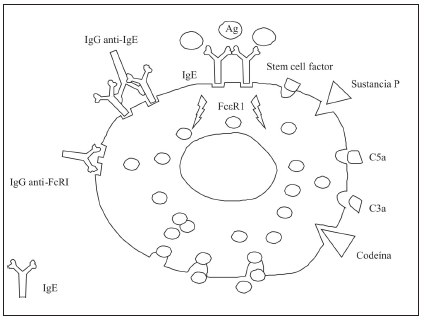
Fig, 2. Estímulos desencadenantes de la degranulación de los mastocitos.
Las reacciones de hipersensibilidad inmediata o tipo I que involucran la unión de un alérgeno sobre IgE cuyos fragmentos cristalizables (Fc) se encuentran en los receptores de los mastocitos (FcεR1). Están muy bien documentadas desde hace años para algunos casos de urticaria aguda, pero no parecen ser tan importantes en la patogénesis de la urticaria crónica y recurrente. En aproximadamente el 50% de los pacientes con urticaria crónica idiopática se detectan auto-anticuerpos contra el receptor de IgE o hacia la IgE
• receptores de inmunoglobulinas
• neurotransmisores, neurohormonas y neuropéptidos (puede explicar las exacerbaciones de los episodios de urticaria con el estrés emocional)
• receptores para moléculas del complemento especialmente C3a y C5a (anafilotoxinas)
• receptores toll-like capaces de interactuar con microorganismos (las infecciones pueden inducir la activación de los mastocitos)
• drogas, compuestos químicos secretagogos y proteasas
Una vez activados los mastocitos y/o basófilos, los gránulos se transfieren a la periferia de su citoplasma, donde gránulos adyacentes se funden formando un complejo. Las membranas de estos gránulos se adhieren con las del citoplasma, descargan sus compuestos almacenados, liderados por la histamina, y también sintetizan productos que luego serán liberados. Todos ellos son responsables de la formación de las lesiones que caracterizan a este síndrome reaccional: pápulas eritemato-edematosas (ronchas, en inglés hives) y angioedema, en un 40% de los pacientes. Esta expresión clínica se observa en múltiples afecciones de diverso origen. Además de la vasodilatación y el edema (dérmico en las pápulas, más profundo en el angioedema), la urticaria se asocia con un moderado infiltrado perivascular de células T, monocitos, neutrófilos y eosinófilos.
En general, en las urticarias inmunes (alérgicas), por mecanismos predominantemente tipo I (IgE), así como también en las pseudoalérgicas por drogas, el curso de la urticaria es agudo. En cambio, las desencadenadas por autoinmunidad, vasculitis y estímulos físicos suelen seguir un curso crónico.
En las urticarias crónicas, aun cuando la etiología no se conozca, los síntomas pueden desencadenarse en respuesta a drogas, estímulos físicos o presentarse como un componente de enfermedades inflamatorias o hereditarias. En un 50 a 55% de los casos no se llega a determinar cuál es el desencadenante y se las denomina de causa desconocida o idiopáticas.
Urticarias inmunes alérgicas
Se denominan urticarias alérgicas a aquellas que están mediadas por mecanismos tipo 1 con la presencia de anticuerpos específicos de la clase E (IgE) que se adhieren a los receptores (FcεRIα) en la membrana de mastocitos y basófilos (Fig. 2). Si luego el Ag contacta con los fragmentos Fab de estas inmunoglobulinas, produce señales de membrana y ocurre la degranulación de estas células. Actualmente este mecanismo dejó de considerarse como el principal y se considera muy poco frecuente en urticaria crónica y más común en casos agudos.
La causa que más frecuentemente desencadena las crisis agudas de urticaria es la infección, particularmente del tracto respiratorio superior (aproximadamente 40% de los casos), y le siguen en frecuencia las drogas, las picaduras de insectos, los alimentos y los conservantes20, 21. Los medicamentos que con más frecuencia se responsabilizan de episodios de urticaria y/o angioedema agudos son los antimicrobianos (particularmente la penicilina y sus derivados, y las sulfonamidas), los anti-inflamatorios no esteroides, los analgésicos, los inhibidores de la angiotensina y los hemoderivados o sustitutos de la sangre.
Sin embargo, la urticaria crónica no involucra habitualmente la unión de la IgE a un alérgeno exógeno22, si bien puede ocurrir frente a antígenos endógenos como la tioperoxidasa, ya que algunos pacientes tienen IgE contra esta enzima.
Los basófilos sanguíneos probablemente no tienen un papel primordial en la etapa inicial de formación de la pápula (roncha) pero pueden amplificar y mantener las lesiones migrando hacia el área de la lesión, como se observa en las fases tardías23.
La liberación de mediadores biológicos almacenados incluye histamina, proteoglicanos (heparina y condroitin sulfato E), proteasas (triptasa α y β, quimasa, carboxipeptidasa A, kininogenasa, arilsulfatasa B, catepsina G), y peroxidasa, el factor quimiotáctico de eosinófilos en la anafilaxia (ECF-A), que estimula la quimiotaxis, la activación de eosinófilos y el aumento de expresión de receptores de C3b.
La histamina (β-aminoetilimidazol) se encuentra preformada en los gránulos. Es una potente bioamina que desempeña múltiples funciones tanto en los procesos biológicos cuanto en los patológicos. Sus efectos farmacológicos son mediados por cuatro subtipos de receptores: H1 a H4, que tienen una expresión diferente en los distintos tejidos.
Entre los efectos más notorios de la histamina que promueven el desarrollo de los procesos alérgicos podemos citar:
• Estimula las terminaciones nerviosas (prurito/dolor).
• Incrementa la permeabilidad vascular (edema).
• Contrae la musculatura lisa bronquial (broncoespasmo).
• Relaja la musculatura lisa vascular (hipotensión arterial).
• Actúa sobre las células dendríticas, inhibiendo su capacidad de estimular la diferenciación de las células T CD4+ en un perfil Th1 y promoviendo su diferenciación hacia un perfil Th2.
Otros mediadores son sintetizados al momento de la reacción. Algunos se producen en cuestión de minutos como los derivados del metabolismo del ácido araquidónico por las vías de la ciclo-oxigenasa y 5-lipoxigenasa (eicosanoides: prostaglandina D2 y leucotrienes LTC4, D4 y E4). También produce el factor activador de plaquetas. Esto contribuye a los fenómenos inflamatorios posteriores. La prostaglandina D2 y el leucotriene C4 estimulan la contracción de la musculatura lisa bronquial, producen hipotensión y estimulan las secreciones mucosas por las células epiteliales. El factor activador de plaquetas estimula la contracción de la musculatura lisa bronquial, incrementa la permeabilidad capilar y promueve la quimiotaxis de neutrófilos, eosinófilos y monocitos.
Otros mediadores se presentan después de horas, como la variedad de citoquinas:
• las interleuquinas 1,2,3,4,5,6,7,8,10,12,13,15,18,21,23; el TNF-α y β, IFN- 1 e IFN-γ
• múltiples quimioquinas: CCL1, CCL2, CCL3, CXCL8 y CXCL10
• la expresión de factor de necrosis tumoral α y de interleuquina 3 están incrementadas y esto puede promover la respuesta inflamatoria regulando en exceso la expresión de moléculas de adhesión vascular como las integrinas, la molécula de adhesión leucocitaria de los endotelios (ELAM-1) y la molécula de adhesión intercelular (ICAM-1)24.
Patogénesis de la urticaria crónica
La patogénesis de la urticaria crónica en la mayoría de los casos permanece desconocida. Durante años se la relacionó con la intolerancia a alimentos y/o conservantes, también a distress emocional o ansiedad, o a infecciones subyacentes. Como consecuencia de ello se ha sometido a los pacientes a dietas restrictivas, estudios parasitológicos y micológicos seriados de materia fecal, tratamientos contra el H. pylori y estudios radiológicos dentales, incluso seguido de extracciones de granulomas apicales o piezas dentarias, con poco o nulo beneficio25.
En muchos pacientes se producen exacerbaciones o pérdida del control por exposición a medicamentos (anti-inflamatorios no esteroides), infecciones virales o bacterianas y aditivos alimentarios o pseudo-alérgenos que pueden empeorar la sintomatología de la urticaria crónica pero no son su causa. Los anti-inflamatorios no esteroides, incluyendo el ácido acetilsalicílico, agravan la urticaria crónica en 20 al 30% de los casos durante la fase de actividad de la enfermedad, y no tanto durante su remisión.
Si bien existen múltiples teorías acerca de la patogénesis, ninguna ha sido establecida de modo concluyente. Las más sólidas examinan el rol de la autoinmunidad, de anomalías en los mastocitos y basófilos, como también el de algunas infecciones crónicas. Se analizarán brevemente estos aspectos.
Urticaria como enfermedad autoinmune
Muchas enfermedades autoinmunes son más prevalentes en pacientes con UCE, entre ellas las siguientes se encuentran más frecuentemente en pacientes que en la población control: alteraciones tiroideas, enfermedad celíaca, síndrome de Sjögren, lupus eritematoso sistémico, artritis reumatoidea y diabetes tipo 1.
Los desórdenes de la tiroides merecen un párrafo aparte. La frecuencia de hipotiroidismo (9.8%) y de hipertiroidismo (2.6%) duplican como mínimo la de la población general. Hay evidencias de mayor prevalencia de anticuerpos anti-tiroideos en pacientes con UC (antiperoxidasa y antimicrosomal) que en la población general, si bien la mayoría de los pacientes suelen tener función tiroidea normal. La interpretación actual de estas asociaciones es que reflejan la tendencia a formar auto anticuerpos comunes a las dos enfermedades y no una relación causal entre urticaria y tiroiditis.
¿Cómo impactan estas evidencias en nuestro conocimiento? De un modo esquemático, si descartamos la urticaria vasculítica y las UI (dermografismo, colinérgica, etc.), el resto de los casos puede dividirse entre las UCE de causas conocidas, por ejemplo autoinmunes (45%) y las de causas desconocidas (55%)26. Esto es porque en aproximadamente el 45% de los pacientes con UC se puede demostrar la presencia de anticuerpos con capacidad de estimular la degranulación de mastocitos y basófilos, pero en el otro 50% no se puede establecer con certeza cuál es el mecanismo que provoca la liberación de histamina y otros mediadores. El método habitual disponible en Argentina para evaluar a estos pacientes es el llamado test del suero autólogo, que se describe con mayor detalle en otra sección. Brevemente, el test del suero autólogo (ASST), consiste en la inyección intradérmica de 50 microlitros del propio suero del paciente, con la obtención de habón y eritema, ante la presencia de auto anticuerpos funcionales. Se realiza una lectura a los 30 minutos y se considera positiva cuando genera una reacción mayor a 2mm del control negativo. En una proporción variable de pacientes con enfermedad activa (40 a 60%) se obtuvieron ASST + y el suero de algunos pacientes con UC indujo liberación de histamina en cultivos de basófilos de sujetos sanos. Ambos fenómenos han sido atribuidos a la presencia de anticuerpos IgG circulantes frente al receptor de alta afinidad de IgE sobre los mastocitos y basófilos, y frente a la IgE.
Debe mencionarse también que no hay mayores diferencias en las características histopatológicas descriptas en biopsias obtenidas de pacientes con y sin evidencia serológica de urticaria autoinmune.
La urticaria autoinmune y su patogenia se desarrollan con más detalles en otra sección, un esquema que resume algunos aspectos de la fisiopatogenia se muestra en las Figuras 3 y 4.
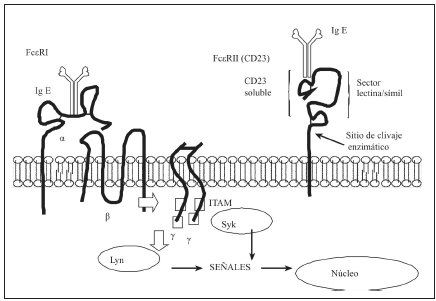
Fig. 3. Receptores de IgE (FcεR)
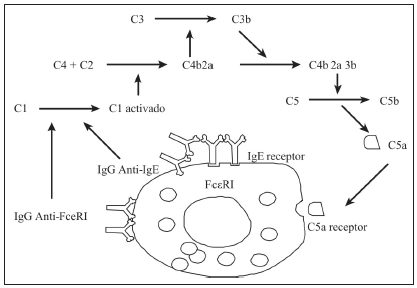
Fig. 4. Urticaria crónica, fisiopatogenia: auto anticuerpos y complemento
Adaptado de Kaplan AP, Greaves M. Pathogenesis of chronic urticaria. Clin Exp Allergy 2009; 39: 777-87
Relevancia de los auto anticuerpos anti IgE y anti FceRI en urticaria crónica inducible
Ambos tipos de anticuerpos pueden producir entrecruzamientos de los receptores FceRI y desencadenar la degranulación de los mastocitos o pueden activar el complemento generando la formación de los subproductos denominados anafilotoxinas. Además, las fracciones C5a (anafilotoxinas) incrementan la liberación de productos vasoactivos inducidos previamente por los autoanticuerpos anti FcεRI. Dichos anticuerpos fueron detectados en 25% de los pacientes con UCI27.
Alteraciones de mastocitos y basófilos
La cantidad de mastocitos por milímetro cúbico es similar en el área afectada que en las tomas de piel sana28. El contenido de histamina de la piel, sin embargo, está elevado en las lesiones. Los mastocitos no están aumentados en la UCE pero sí está potenciada su capacidad de liberar mediadores. Un rol para los basófilos ha sido establecido recientemente al demostrarse su presencia en biopsias de lesiones de UCE, pero también en piel sin lesiones exclusivamente en pacientes con UCE. En sangre periférica se ha descripto basopenia que correlaciona con la gravedad de la UCE y aparenta reflejar el reclutamiento de basófilos desde la sangre hacia las lesiones. Cuando la urticaria mejora o remite la basopenia desaparece.
Se ha corroborado que los basófilos sanguíneos de los pacientes con UCE tienen reducida su capacidad para liberar histamina luego de ser estimulados a través de la activación del receptor de IgE. Esta situación paradojal se encuentra limitada al mecanismo dependiente de activación a través del receptor de IgE y no es evidente cuando las células se activan por otras vías. Se han dividido las poblaciones de basófilos en dos subpoblaciones, respondedoras y no respondedoras. Esta última no degranula eficazmente por estímulo de la vía IgE, ya que posee elevados niveles de las fosfatasas regulatorias inhibitorias del receptor de IgE SHIP-1 y SHIP-2. Estos fenotipos funcionales son estables en la UCE activa pero la hiporespuesta mejora en remisión espontánea o provocada por omalizumab. Esto da soporte a la idea que considera relevante la respuesta de los basófilos con la patogénesis de la urticaria29, 30.
Patogénesis de las urticarias físicas
Las urticarias desencadenadas por estímulos externos y denominadas inducibles comprenden las denominadas urticarias físicas, ya comentadas anteriormente. Factores locales incluyendo calor y presión pueden estimular la vasopermeabilidad y facilitar la extravasación de proteínas, incluso anticuerpos hacia la dermis, en una concentración suficiente como para inducir degranulación de los mastocitos.
El mecanismo íntimo por el cual se produce la degranulación de los mastocitos después de estímulos físicos, como la exposición al frío, todavía no se ha dilucidado en su totalidad, aunque en algunos casos la transferencia pasiva de suero ha demostrado inmunoglobulinas capaces de activar a los mastocitos y provocar la degranulación de los mismos (dermografismo, urticarias por frío, solares). Otros autores no pudieron demostrar la presencia de anticuerpos en dermografismos sintomáticos y urticaria colinérgica y lo relacionan a mayor reactividad y facilidad de degranulación de los pacientes que padecen dichas urticarias31.
Urticarias y coagulación
En los pacientes con UC se activa la cascada de la coagulación por vía extrínseca con la participación de células inflamatorias, conduciendo a la activación de trombina que es responsable de la generación de fragmentos C5a y de un incremento en la permeabilidad vascular.
Aunque la liberación de histamina mediada por anticuerpos es el principal mecanismo patogénico en pacientes con UC con síntomas graves, otros activadores intervienen en la mayoría de los pacientes y el principal parece ser la activación de la cascada extrínseca de la coagulación con la generación de trombina.
En recientes estudios se ha encontrado activación de la cascada de la coagulación en forma paralela a la gravedad de la enfermedad. El mecanismo de activación involucrado está relacionado con el factor tisular expresado por los eosinófilos presentes en el infiltrado inflamatorio. En algunos pacientes la activación puede ser suficientemente intensa como para elevar los niveles plasmáticos del dímero-D, un marcador de fibrinolisis. La trombina es capaz de activar los mastocitos, gatillando su degranulación. La medición del dímero-D es un procedimiento disponible y representa un potencial marcador pronóstico ideal para pacientes con UC grave, en particular si es refractaria a antihistaminicos32, 33.
Urticaria crónica inducible
Generalidades y clasificación
Si utilizamos la clasificación de urticaria que cuenta mayor consenso en la actualidad34, las UCI se subdividen en urticarias físicas y otras desencadenadas por estímulos externos no físicos.
Las UCI se definen como aquellas que, compartiendo las mismas características clínicas de cualquier otro tipo de urticaria, son desencadenadas por factores físicos externos que incluyen los estímulos mecánicos (fricción, presión y vibración), térmicos (frío, calor) y radiación electromagnética (radiación solar)35 u otros estímulos tales como agua, sustancias o aún, aumento del calor corporal (Tabla 3).
Tabla 3 Clasificación de la urticaria crónica inducible

§Sinónimo: urticaria facticia
*Algunos autores incluyen esta condición dentro de las UCI (Zuberbier T. Chronic urticaria. Curr Allergy Asthma Rep 2012; 12: 267-272.)
La urticaria colinérgica, que es también una forma inducible de la urticaria, no está incluida dentro de las urticarias físicas, dado que sus síntomas se producen como respuesta a un aumento de la temperatura corporal central. Los signos y síntomas de la urticaria colinérgica típicamente son provocados por baños o duchas de agua caliente o ejercicio que genere sudoración y no por desencadenantes físicos exógenos actuando sobre la piel.
En las urticarias físicas, las ronchas y/o el angioedema aparecen rápidamente (es decir, en pocos minutos) después de la exposición a un gatillante específico en ese sitio y permanecen por un corto tiempo (menos de 2 horas, excepto la urticaria demorada por presión). Las urticarias físicas como las colinérgicas comprenden hasta un 25% y 5% de los casos de UC, respectivamente. Ocurren más frecuentemente en adultos jóvenes. Es común, en algunos pacientes, la presencia simultánea de distintas variantes (agrupamiento) o con urticaria espontánea36.
Si bien reconocidas como enfermedades desde hace muchos años, las causas subyacentes de la urticaria física y de la colinérgica siguen siendo poco comprendidas. En algunos casos se cree que el estímulo físico induciría la liberación de un neoantígeno no identificado37. La activación de mastocitos de la piel y la liberación de histamina y otros mediadores proinflamatorios son los factores más relevantes, sin embargo, se desconoce en gran medida cómo y por qué los estímulos físicos o el aumento de la temperatura corporal son capaces de activar esas células38.
El diagnóstico es eminentemente clínico y las pruebas de provocación con los distintos gatillantes resultan de utilidad para conocer el umbral de respuesta de la piel a esos estímulos y, eventualmente, la respuesta al tratamiento.
El tratamiento se basa en dos principios básicos: evitar la exposición a los desencadenantes e inhibir la acción de la histamina y otros mediadores liberada por mastocitos. El primero es a menudo imposible o impacta sensiblemente en la calidad de vida del paciente y el segundo se logra generalmente con el uso de antihistamínicos H1 no sedantes de segunda generación. Estos compuestos son las drogas de elección para el tratamiento sintomático, y en algunos casos se deben utilizar dosis mayores a las estándar para controlar los síntomas39.
Urticarias físicas "clásicas"
Dermografismo sintomático o urticaria facticia
Es la forma más frecuente de urticarias físicas (aproximadamente el 50%) con una prevalencia estimada en la población general del 5%6. La palabra dermografismo precisamente significa "escribir en la piel", dado que la enfermedad se caracteriza por aparición de picazón o ardor de la piel y lesiones en forma de pápulas lineales luego de una presión deslizante que actúa sobre la piel como por ejemplo al rascarse o frotarse. La máxima respuesta ocurre entre los 5 y los 10 minutos y desaparece entre 30 y 60 minutos después. La afección puede durar meses o años, con un promedio de entre 20 meses y 5 años según distintos estudios, y puede también presentarse intermitentemente37.
Debe diferenciarse del dermografismo simple donde se produce una pápula pero no prurito, y la presión a ejercer sobre la piel generalmente debe ser mayor que en el dermografismo sintomático. También debe diferenciarse del dermografismo blanco, una respuesta vascular alterada (vasoconstricción) que se observa en los pacientes con dermatitis atópica40, 41.
La prueba de provocación es mandatoria ante la sospecha de dermografismo sintomático e incluye la evaluación de niveles umbrales, esto es, el menor esfuerzo de presión deslizante necesaria para causar pápulas35. Esta evaluación debería realizarse tanto en la primera visita como en las siguientes, a fin de monitorear la evolución de la enfermedad y evaluar la eficacia de la terapia. El sitio donde se recomienda realizarla es la piel de la región volar del antebrazo o la región superior de la espalda. Se puede utilizar una espátula de madera o algún elemento con punta roma que no cause daño a la piel. Para obtener resultados reproducibles debería usarse un dermografómetro. Si bien existen diferentes dispositivos, hasta hoy no están disponibles en nuestro medio.
Si se dispone de un dermografómetro, deben hacerse tres de las líneas paralelas (hasta 10 cm de largo) con tres diferentes presiones, 20, 36 y 60 g/mm2.
La reacción se considera positiva cuando aparece un habón en el sitio de la reacción luego de ejercer una presión de 36 gmm2 (353 kPa) o menos. El paciente debe estar libre de antihistamínicos y la lectura de la prueba se realiza a los 10 minutos. Una respuesta con pápula sin prurito obtenida con una presión de 60 g/mm2 (589 kPa) o mayor, indica dermografismo simple.
Urticaria retardada por presión
La urticaria retardada por presión se caracteriza por la aparición de inflamación y eritema que pueden ser parecidos al angioedema después de la aplicación de un estímulo de presión sostenida a la piel36. Es la única urticaria física que no se presenta con las pápulas o ronchas características del resto de las urticarias. Es poco común (1% al 2% de las urticarias), pero se asocia en un porcentaje mayor al 37% con UCE u otras urticarias físicas. Si bien el edema se manifiesta en sitios de la piel expuestos a la presión, también puede ocurrir en membranas mucosas. Hasta un tercio de los pacientes con UCE refieren agravamiento de sus síntomas en los sitios de piel expuestos a presión, como la correa o el sostén. El edema es producido por la presión vertical y puede estar asociado a prurito, ardor o dolor. Las situaciones típicas que provocan el síntoma en los pacientes que presentan este tipo de urticaria es cuando llevan objetos con correa sobre el hombro (mochilas o bolsas), caminan en zapatos apretados, están parados, por ejemplo, con los pies descalzos sobre una escalera, o permanecen sentados durante un tiempo prolongado en una silla. La alteración de la calidad de vida en estos pacientes es la mayor de este grupo. Las respuestas se producen entre 30 minutos y 12 horas (generalmente 6 a 8 horas) después de la exposición y pueden durar hasta 72 horas.
El principio de la prueba de provocación diagnóstica es la aplicación de presión sostenida a la piel. Se puede suspender pesos por encima del hombro (7 kg en una correa de 3 cm de ancho sobre el hombro, aplicar barras con diferentes pesos en la espalda, muslos o antebrazo, o utilizar un dermografómetro). Los dos últimos métodos permiten mediciones reproducibles y la evaluación de los niveles umbrales. La prueba debe considerarse positiva si en el sitio de presión se observa un edema palpable, rojo, seis horas después del desafío.
Urticaria/edema vibratorio
Se define por la presencia de prurito y edema unos minutos luego de que un sitio de la piel se expuso a algún tipo de vibración42. Es una muy rara variante de urticaria física, descripta inicialmente en casos familiares (forma autosómica dominante), habiéndose encontrado esporádicamente formas adquiridas. A los fines diagnósticos, puede reproducirse mediante un vórtex o agitador de laboratorio, aplicando el antebrazo del paciente sobre la placa plana del agitador durante 10 minutos. El sitio de aplicación debe ser evaluado 10 minutos después de la prueba.
Urticaria por frío
La urticaria por frío, o urticaria adquirida por frío, se define por la aparición de pápulas en respuesta al contacto con un elemento frío (solido, líquido o incluso aire frío) sobre la piel43, 44. En muchos casos la exposición extensa y prolongada puede dar origen a reacciones sistémicas con pérdida de conciencia, e incluso causar la muerte, en particular por natación o inmersión en agua fría, esquí acuático, etc. Hasta 72% de los pacientes han sufrido algún tipo de reacción sistémica.
Correspondería al 2% de las urticarias según algunos estudios, y resulta más común en adultos jóvenes, aunque puede ocurrir en niños. Se cree que el frio posiblemente expondría alguna proteína normal o anormal no detectable por la IgE en condiciones normales.
Si bien en la mayoría de los casos la enfermedad es idiopática, en un número variable de pacientes la aparición de la enfermedad puede estar precedida por un proceso infeccioso (sífilis, borreliosis, varicela, hepatitis, infección por virus de Epstein Barr, citomegalovirus, HIV, etc.)45. La duración promedio varía de 4.8 a 7.9 años de acuerdo con diversos autores.
El método diagnóstico también es una prueba de provocación que se realiza en la piel de la región volar del antebrazo. Debe realizarse mediante la aplicación de un estímulo frío sobre la piel del antebrazo volar. Los métodos de provocación incluyen el tradicional cubo de hielo, envuelto en un film plástico delgado37, o un paquete refrigerante utilizado generalmente para mantener la cadena de frio en el trasporte de medicación. Existen dispositivos especiales que permiten establecer con mayor precisión los umbrales de temperatura necesarios para desencadenar la reacción en cada paciente como el Temp Test® y que permiten monitorear la respuesta terapéutica con mayor precisión, lamentablemente no están disponibles en la Argentina.
El test del cubo de hielo prueba debe realizarse durante 5 minutos. En pacientes con una prueba de cubo de hielo negativa, donde la sospecha diagnóstica es fuerte, se puede por ejemplo sumergir un brazo en agua fría (5 a 10 °C) durante 10 minutos.
La prueba debe ser leída 10 minutos después del final de la exposición; se considera positiva si en el sitio donde se aplicó el frío aparece una pápula claramente visible y palpable, generalmente acompañada de prurito asociado con una sensación de ardor34. Resulta muy raro encontrar una crioproteína en una urticaria por frío típica, pero deben solicitarse crioglobulinas. En pacientes añosos, ante sospecha de mieloma o leucemia, también deben solicitarse hemograma, dosaje de inmunoglobulinas y proteinograma electroforético.
Urticaria por calor
La urticaria localizada por calor es la más rara de las urticarias físicas, y se define por la aparición de pápulas minutos después de la exposición de la piel al contacto con un objeto caliente46.
La prueba de la provocación debe realizarse mediante la aplicación de un estímulo caliente sobre la piel de la cara volar del antebrazo. La forma clásica de hacerlo es llenando un envase de plástico o metal con agua caliente o directamente sumergir el antebrazo en agua caliente, a 45 °C durante 5 minutos.
Se llevan informados menos de cien casos en la literatura, incluyendo niños, y el caso atípico de urticaria familiar localizada retardada por calor.
Urticaria solar
También es una forma rara de urticaria física, caracterizada por pápulas pruriginosas que se producen inmediatamente (generalmente dentro de 5 minutos) después de la exposición de luz (UV y/o luz visible) y resuelve en menos de 24 horas.
La prueba de la provocación debe realizarse mediante la exposición de la piel a la radiación ultravioleta y visible. Se pueden usar simuladores solares con filtros (UV-A y UV-B) o monocromador (UV-A y UV-B, luz visible). La región sugerida es la zona de glúteos. La provocación debe hacerse en las nalgas, probando por separado UV-A (6 J/cm2), UV-B (60 J/cm2) y el rango de luz visible.
En pacientes con una reacción negativa se debe probar luz visible mediante el uso de un proyector (por ejemplo, proyector de diapositivas, a 10 cm de distancia). Una provocación positiva lleva a una rápida respuesta de urticaria en el sitio de la exposición (generalmente dentro de los 10 minutos).
Urticaria colinérgica
La urticaria colinérgica es una urticaria inducible muy frecuente (hasta 11% de una población universitaria), pero la mayoría de los casos son muy leves y solo el 22%de los afectados consultó alguna vez por ello. Se define por picazón y pequeñas ronchas, tras un aumento de temperatura corporal inducido activamente (por ejemplo, ejercicio) o pasivamente (por ejemplo, baño caliente). Es muy rara la presencia de angioedema.
Debe diferenciarse de la urticaria/anafilaxia inducida por el ejercicio, que es provocada por el ejercicio pero no por aumento térmico pasivo y se asocia más a menudo con síntomas sistémicos.
Es un desorden de los adultos jóvenes y en la mayoría de los pacientes los síntomas van haciéndose más leves conforme pasan los años, hasta desaparecer totalmente. Algunos autores relatan que la gravedad de la enfermedad muestra cambios estacionales, con síntomas más leves en el verano.
Los pacientes que presentan urticaria colinérgica desarrollan pápulas pequeñas, entre 1 a 3 mm, rodeadas o no de halo, con o sin parches eritematosos confluentes y salpicados de ronchas, de corta duración (entre 15 a 60 minutos), comúnmente localizadas en las extremidades y el tronco unos minutos después del ejercicio o calentamiento pasivo.
En algunos pacientes también pueden servir como gatillantes el estrés emocional, la ingesta de comida picante o bebidas alcohólicas.
La atopia, hiperreactividad bronquial inespecífica y la hipohidrosis generalizada, parece acompañar frecuentemente a pacientes con urticaria colinérgica.
Estudios japoneses sugieren varias subclases de urticaria colinérgica: (1) con oclusión poral, (2) con hipohidrosis, (3) con alergia contra el sudor, (4) idiopática47, 48.
En relación a la causa alérgica, algunos estudios sugieren que podría ser debida a una reacción de hipersensibilidad a algunos componentes del sudor humano. Eso fue demostrado con pruebas intradérmicas positivas y ensayos de degranulación de basófilos obtenidas con diferentes diluciones de sudor autólogo49, 50. Otros trabajos han podido comunicar presencia de IgE específica para diversos componentes del sudor, en pacientes con urticaria colinérgica, pero no en controles sanos.
Para realizar el diagnóstico y poder diferenciarla de la urticaria/anafilaxia inducida por ejercicio, el paciente debe primero realizar un ejercicio físico moderado, adecuado a su edad y estado general, hasta el momento en que comience a sudar, y mantener el ejercicio durante 15 minutos más. Se considera la prueba como positiva si aparecen ronchas típicas de urticaria a los 10 minutos de haber detenido el ejercicio. Para completar el proceso, luego se debe realizar una segunda prueba, al menos 24 horas después de la primera, reproduciendo un calentamiento corporal pasivo. Para ello el paciente debe realizar un baño por inmersión en agua a 42 °C durante 15 minutos35. La urticaria/anafilaxia inducida por ejercicio no se manifiesta por calentamiento corporal pasivo.
Otras formas de urticarias inducibles
La urticaria acuagénica es una urticaria física extremadamente rara que ocurre por el contacto con distintas sustancias acuosas como agua corriente, agua destilada, agua de pileta de natación, lágrimas, sudor y saliva, independientemente de su temperatura y minutos después del contacto. Se afectan especialmente el tronco superior y el cuello, y se respeta la cara. Las ronchas pueden provocarse con una gasa humedecida a temperatura corporal en las partes del cuerpo donde se manifiestan, o con un baño a temperatura corporal. Debe diferenciarse del prurito acuagénico (que puede estar asociado con policitemia vera) porque en esta entidad hay ausencia de ronchas y el brote predomina en piernas y tronco.
De la urticaria/anafilaxia por ejercicio nos hemos ocupado brevemente al referirnos a la urticaria colinérgica.
Finalmente, la urticaria por contacto aparece dentro de los 10 a 30 minutos del contacto con diferentes agentes tales como pelos de animales, textiles (seda), níquel presente en alimentos o directamente alimentos (clara de huevo), látex, medicamentos y derivados vegetales como el Bálsamo del Perú51, 52. Persiste entre 1 y 5 horas y el mecanismo postulado en otras publicaciones es una reacción de Tipo I o una reacción no inmunológica con liberación directa de mediadores.
Se debe pensar en esta entidad cuando se presentan ronchas agudas y localizadas, ya que es muy poco probable que se manifieste en forma generalizada.
Tratamiento de las urticarias físicas
En general se basa en dos premisas, la eliminación del estímulo y la farmacoterapia sintomatológica.
Eliminación del estímulo
Cuando se llega al diagnóstico de algunos de los tipos de urticarias físicas descriptos en este capítulo, siempre que sea posible, resulta razonable evitar el estímulo que lo desencadena. Si bien esa indicación se debe realizar, no siempre es fácil de llevar a cabo y ello puede alterar la calidad de vida del paciente tanto o más que la propia sintomatología. Se debe tener en cuenta el nivel umbral que tiene cada paciente, en particular para el desencadenante de la urticaria que, como se ha referido, varía de paciente en paciente, en un mismo paciente a lo largo de su vida e, inclusive, también puede variar el tipo de manifestación36. Para aquellos cuadros clínicos con expresión sistémica que pueda comprometer la vida se deberá ser más estricto en la recomendación para que se tomen los recaudos necesarios a fin de evitar el desencadenante.
Farmacoterapia sintomatológica
Por los múltiples efectos secundarios capaces de producir, se debe evitar el uso de antihistamínicos de primera generación.
La utilización de los antihistamínicos de segunda generación en dosis licenciadas como primera línea terapéutica tiene en la actualidad un fuerte sustento científico por el elevado perfil de seguridad que presentan, aun utilizándolos diariamente por tiempo prolongado (años). Cuando esas dosis resultan insuficientes, las guías actuales recomiendan como segunda medida aumentar la dosis hasta cuatro veces la sugerida para el tratamiento de la rinitis alérgica. Existen estudios diseñados para urticaria con diversos antihistamínicos de segunda generación con dosis mayores que las habituales, por ejemplo con desloratadina, levocetirizina, rupatadina y bilastina cuyos resultados de eficacia y seguridad permiten sostener esta recomendación. Además, es indudable que la utilización diaria de los antihistamínicos en la mínima dosis requerida para mantener al paciente asintomático resulta ser claramente más beneficiosa que usarlos solo a demanda.
La respuesta de los diferentes tipos de urticarias físicas a los antihistamínicos de segunda generación lamentablemente es diferente según el paciente y, fundamentalmente, según el tipo de urticaria física.
Como tercera línea terapéutica aparecen omalizumab, ciclosporina, montelukast y esquemas cortos de esteroides orales.
Urticaria autoinmune
La nomenclatura actual de la urticaria se basa fundamentalmente en una clasificación clínica en lugar de una de carácter etiológico para reconocer cuáles de los pacientes con UCE podrían tener una causa autoinmune en lugar de una etiología idiopática34.
El término idiopático se debería reservar solo para aquellos casos donde han sido excluidos definitivamente todos los posibles agentes causales, lo cual a menudo no se realiza. Ese sería el motivo por el cual la prevalencia de la urticaria idiopática en la literatura difiere ampliamente, entre 30% y 90% de todos los casos de UC53.
Desde hace años se han descripto mecanismos de autorreactividad, incluyendo autoinmunidad mediada por autoanticuerpos funcionales, como posibles causas de muchos casos de UCE27, 54.
El primer autor en sugerir la etiología autoinmune de la UC fue Lezhoff y col.55, quienes describieron una asociación entre la enfermedad tiroidea, la presencia de anticuerpos antitiroideos, y la UC.
Los anticuerpos antitiroglobulina y/o antiperoxidasa tiroidea están presentes en el 3-6% de la población general, y en el 15-30% de los pacientes con urticaria crónica. La presencia de autoanticuerpos tiroideos, que con frecuencia precede al desarrollo de la tiroiditis de Hashimoto o de otras enfermedades autoinmunes, condujo a un número de investigadores a preguntarse si la UC en algunos pacientes podía llegar a ser una enfermedad autoinmune per se.
El concepto de AU está siendo reconocido cada vez más fuertemente. Resta aún establecer una definición apropiada que genere el consenso de la mayoría de los expertos en el tema.
Recientemente, un panel de expertos de la Academia Europea de Alergia e Inmunología Clínica (EACCI), publicó una revisión de la evidencia sobre datos de laboratorio y estudios clínicos en el subgrupo de pacientes con UCE disponible en la literatura. Se consideró si existía suficiente evidencia tanto directa, como indirecta y circunstancial, para definir a la UCE como una enfermedad autoinmune y/o avalar su etiología autoinmune56.
Describiremos brevemente las evidencias encontradas hasta el momento.
Auto anticuerpos funcionales en urticaria crónica espontánea
Los primeros autores en demostrar autoanticuerpos en pacientes con urticaria crónica, urticaria vasculítica y urticaria por frío, y proponer que los mismos podrían jugar un rol patogénico, fueron Gruber y col.57.
Ellos demostraron por inmunoensayo la presencia de autoanticuerpos de tipo IgG y/o IgM anti IgE, y la capacidad de inducir liberación de histamina en basófilos y mastocitos provenientes de donantes sanos no atópicos por IgM y, años más tarde, por IgG58. Esa capacidad vasoactiva de los sueros de algunos pacientes con UCE se demostró luego in vivo, al comprobarse que la aplicación de suero autólogo en la piel de los propios pacientes era capaz de inducir eritema y pápula.
En años posteriores a esas publicaciones aparecieron datos provenientes de distintos grupos que mostraban que muchos de los autoanticuerpos de tipo IgG, eran específicos para el receptor de alta afinidad de la IgE (FcεRI).
Aproximadamente entre el 35 y el 40% de los pacientes con urticaria crónica tienen autoanticuerpos de tipo IgG para el receptor de alta afinidad de la IgE, especialmente contra la subunidad α del FcεRI, y del 5 al 10% tienen autoanticuerpos de tipo IgG directamente para la molécula de IgE59, 60.
Tanto los anticuerpos anti FcεRIacomo los anti IgE pertenecen a las subclases IgG1 e IgG3, y son capaces de causar el "puenteo" receptores adyacentes induciendo así la activación de mastocitos y basófilos con liberación de histamina y otros mediadores inflamatorios. No obstante, para esa activación, aparentemente también sería necesaria la activación de la cascada del complemento a través de la vía clásica, ya que el bloqueo del receptor para la fracción C5a en mastocitos como la depleción total del complemento es capaz de inhibir la liberación de histamina61, 62.
Otros autoanticuerpos, anti-FcεRII/CD23, anti endotelio, anti peroxidasa de tiroides y anti nucleares, entre otros, han sido descriptos en pacientes con UCE63-65 aunque no se conoce con precisión si participan en la fisiopatogenia o simplemente representan un epifenómeno de una enfermedad autoinmune subyacente.
Funcionalidad de los anticuerpos autoinmunes en urticaria crónica espontánea
Los basófilos, tanto como los mastocitos de donantes sanos, han sido utilizados en pruebas biológicas para evaluar sueros de pacientes con urticaria crónica y analizar la presencia de auto anticuerpos anti-IgE o anti-FcεRIα. Actualmente se considera a la activación ex vivo de estas células el estándar de oro para la caracterización de los sueros de pacientes con UC como funcionales o no funcionales.
Después de analizar datos disponibles de diferentes estudios, se puede decir que los auto anticuerpos anti-FcεRI se encuentran en el 49.2% (41.6-72%) de los pacientes con UCE; un 26.4% (20-52%) tiene ambos autoanticuerpos y un ensayo de liberación de histamina por basófilos positivo, mientras que en el 16.5% (0-22.7%) de los pacientes los niveles de anticuerpos en este ensayo son indetectables56.
Asociación entre urticaria crónica espontánea y enfermedades autoinmunes
La UCE tiene una mayor incidencia en mujeres que en hombres, similar a lo que ocurre en otras enfermedades autoinmunes, con una relación aproximada de 2 a 166, 67 o aún de 4 a 1, de acuerdo con diversos autores68. Numerosas condiciones autoinmunes han sido asociadas a UCE incluyendo enfermedad de tiroides, enfermedad celíaca y artritis reumatoidea.
Dado que muchas enfermedades auotinmunes coexisten en el tiempo, es que se sugirió que la UCE podría estar asociada a otros procesos autoinmunes.
La enfermedad de tiroides es la condición autoinmune que ha sido más estudiada en relación a la UCE a partir de los primeros informes realizados por Leznoff y Sussman en la década del '8069. El hipotiroidismo y el hipertiroidismo se encuentran presentes en el 10% y 2.6% de los pacientes con UCE, respectivamente. Estos porcentajes son significativamente más frecuentes que en la población general (2.2 y 0.5%, respectivamente)70. Los pacientes que tienen asociadas ambas enfermedades, tiroiditis autoinmune y UCE, generalmente tienen una urticaria más grave y más prolongada71.
Si bien existen diferentes hipótesis, el mecanismo de esa asociación aún se desconoce.
Algunos autores han sugerido que el tratamiento con levotiroxina en pacientes con tiroiditis autoinmune y UCE podría reducir significativamente la sintomatología cutánea así como la respuesta inflamatoria en muchas otras enfermedades crónicas asociadas a la tiroiditis72, aunque no existen trabajos debidamente diseñados que avalen aún esta conducta terapéutica.
Otras enfermedades autoinmunes se han asociado a UCE. La artritis reumatoidea es la segunda enfermedad autoinmune más comúnmente asociada a pacientes con UCE. En un estudio se documentó artritis reumatoidea en el 1.9% de mujeres con UCE, porcentaje significativamente mayor que el encontrado tanto en el grupo control como en la población general (0.5 a 1.1%)73. Del mismo modo, el factor reumatoide fue positivo significativamente más a menudo en mujeres y hombres con UCE, en comparación con sujetos controles.
La diabetes mellitus Tipo I, el síndrome Sjögren, y el lupus eritematoso sistémico, también se han comunicado como más frecuentes en mujeres con UCE que en las mujeres controles y hay informes aislados de asociación con vitíligo, anemia perniciosa, enfermedad de Graves, y enfermedad celiaca56.
La alta prevalencia de enfermedades autoinmunes en pacientes con UCE refuerza la hipótesis de que la misma podría pertenecer a este grupo de enfermedades (Tabla 4).
Tabla 4. Enfermedades autoinmunes en pacientes con urticaria crónica espontánea y sujetos controles*

*Modificado de Confino-Cohen R, Chodick G, Shalev V, Leshno M, Kimhi O, Goldberg A. Chronic urticaria and autoimmunity: associations found in a large population study. J Allergy Clin Immunol 2012; 129: 1307-13.
Cuando las enfermedades autoinmunes se superponen, la segunda o tercer enfermedad aparece a menudo mientras que la primera de ellas está aún activa, incluso si el paciente está recibiendo tratamiento inmunosupresor. No es infrecuente encontrar comunicaciones de casos donde la UCE fue la primera manifestación de una enfermedad autoinmune diagnosticada tiempo después, sobre todo, la tiroiditis autoinmune.
Teniendo en cuenta los datos obtenidos de la misma población analizada en el trabajo de Confino-Cohen R et al., algunos marcadores de laboratorio sirven en la práctica diaria como indicadores adicionales de la existencia de un proceso autoinmune e inflamatorio (Tabla 5).
Tabla 5. Marcadores serológicos anormales encontrados en pacientes con urticaria crónica espontánea y sujetos controles*
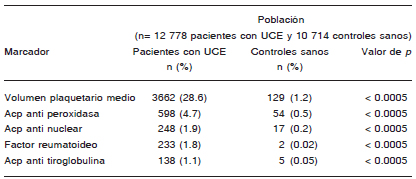
UCE: Urticaria crónica espontánea; Acp= anticuerpo
*Modificado de Confino-Cohen R, Chodick G, Shalev V, Leshno M, Kimhi O, Goldberg A. Chronic urticaria and autoimmunity: associations found in a large population study. J Allergy Clin Immunol 2012; 129: 1307-13.
Tabla 6. Diagrama de flujo para la realización del test de suero autólogo*

* Modificado de Konstantinou GN, Asero R, Maurer M, Sabroe RA, Schmid-Grendelmeier P, Grattan CE. EAACI/GA(2)LEN task force consensus report: the autologous serum skin test in urticaria. Allergy 2009; 64:1256-68.
Diagnóstico
La inyección de suero autólogo recogido durante la actividad de la enfermedad de algunos pacientes con UCE en piel clínicamente normal provoca una respuesta inmediata con pápula y eritema; esta observación ha proporcionado una demostración convincente de que existe un factor o factores circulantes que serían relevantes para la patogenia, el diagnóstico y manejo de la enfermedad.
Esta metodología diagnóstica in vivo, denominada comúnmente Test de Suero Autólogo (TSA), es ampliamente utilizada en la actualidad, aunque no existe consenso acerca de su valor como herramienta diagnóstica, ni sobre la mejor metodología o el criterio de positividad del test73. En la Tabla 6 se muestra el diagrama de flujo a seguir para realizar el TSA.
Debería considerárselo como una prueba para autorreactividad en lugar de una prueba específica para UA. Tiene solo una moderada especificidad como marcador de autoanticuerpos funcionales contra IgE o el receptor de IgE de alta afinidad (FcεRI) detectados por ensayo de liberación de histamina por basófilos, pero un alto valor predictivo negativo para los pacientes UCE que no los poseen.
El TSA es generalmente negativo en otros subtipos de urticaria, incluyendo aquellas inducidas por un estímulo físico. También se ha encontrado TSA positivo en pacientes con intolerancia múltiple a drogas, con alergia respiratoria y controles sanos, aunque las implicancias clínicas de estos hallazgos son inciertas.
Ningún examen por sí solo, ni de laboratorio ni el TSA, puede ser considerado como suficientemente robusto como para utilizarlo como prueba diagnóstica definitiva de UA. Cada uno de ellos tiene sus limitaciones. Para superarlas, el panel de expertos de la EAACI, propone que el "estándar de oro" diagnóstico para UA debería ser una combinación de: 1) un bioensayo positivo (ensayo de liberación de histamina por basófilos o marcador de activación de basófilos) que demuestre funcionalidad in vitro; 2) una demostración de autorreactividad in vivo con degranulación de mastocitos cutáneos (TSA positivo) y 3) un inmunoensayo positivo para autoanticuerpos IgG contra receptor FcεRIa y/o anti-IgE para demostrar la especificidad de los anticuerpos56.
El TSA negativo es un marcador útil de la ausencia de auto anticuerpos funcionales circulantes, por lo que se recomienda utilizarlo como una herramienta clínica confiable para excluir su presencia.
El problema de la urticaria crónica espontánea: calidad de vida
La calidad de vida relacionada con la salud (CVRS) no es simplemente una medición del estado de salud, sino una percepción del individuo respecto del impacto de la enfermedad o del tratamiento en su vida. Involucra el bienestar físico y emocional en relación con el funcionamiento social. Es una experiencia única y personal, no fácilmente evaluable clínicamente74.
La definición de la CVRS se ha mostrado elusiva y controvertida, como también lo han sido sus conceptos afines, como el estado de salud, el estado funcional y la salud percibida.
Con el objetivo de incluir dentro estos conceptos en una única definición, se creó el término "resultados informados por el paciente" (patient reported outcomes, PRO), que enfoca el objeto de medición en la fuente de información, que en este caso es la percepción de la propia persona o paciente sobre su estado de salud y sus factores relacionados, su funcionalidad o su satisfacción con el tratamiento y el cuidado recibido. Los PRO se definen como "alguna información del estado de salud del paciente que proviene directamente del paciente, sin la interpretación de sus respuestas por parte de un clínico ni de ninguna otra persona" 75.
Los PRO han adquirido recientemente una gran atención en la investigación clínica y en los organismos reguladores por su relevancia en la evaluación de la eficacia del tratamiento en general. Un aspecto crítico en la gestión de la UCE es su impacto en la experiencia diaria del paciente. Los síntomas clásicos pueden afectar el sueño y la concentración, interferir con las actividades de la vida, y causar vergüenza. Por otra parte, debido a la presencia de exacerbaciones, la imprevisibilidad de los ataques, la necesidad de tomar la medicación, y cambiar los hábitos y estilo de vida, los pacientes con UCE puede experimentar ansiedad, tensión e irritabilidad. Aunque la UCE representa un problema que interfiere con el bienestar subjetivo y la vida cotidiana, su evaluación se ha centrado generalmente en los puntos finales clínicos.
La evaluación de los PRO debe ser llevada a cabo utilizando instrumentos validados para asegurar la capacidad de respuesta, la validez de constructo, su confiabilidad, consistencia interna y aceptabilidad.
La posición oficial del Global Allergy and Asthma European Network (GA2LEN) proporciona información sobre los instrumentos disponibles para las evaluaciones de los PRO en la urticaria y brinda recomendaciones para su evaluación en los ensayos clínicos y de rutina del cuidado del paciente. El grupo de trabajo recomienda utilizar los PRO en ensayos clínicos como un resultado primario, co-primario o secundario76, 77.
Medidas para evaluar calidad de vida relacionada con la salud
El impacto de la CVRS puede objetivarse a través de tres tipos de cuestionarios: aquellos en los que se analizan variables referidas a la salud del individuo en general, los que fueron diseñados para el conjunto de las enfermedades cutáneas, o bien aquellos elaborados en forma específica para una dermatosis concreta.
En estos cuestionarios se recogen datos sobre dimensiones tales como funciones de tipo físico (discapacidad, limitaciones funcionales, intensidad de los síntomas), aspectos sociales (relaciones interpersonales y actividades) y factores emocionales (ansiedad, depresión, alteraciones relacionadas con la enfermedad).
Los cuestionarios genéricos como el Short Form-36- Medical Outcomes Survey, el Sickness Impact Profile, el Nottingham Health Profile (NHP), o el General Health Questionnaire (GHQ) abarcan una excelente evaluación psicométrica para la mayoría de las condiciones médicas pero carecen de especificidad para enfermedades cutáneas78.
Los cuestionarios específicos para dermatología, como el Índice de Calidad de Vida de Dermatología (Dermatology Life Quality Index, DLQI) 79, el Skindex en sus distintas versiones o el VQ-Dermato, han sido diseñados con la intención de interpretar la repercusión global de la enfermedad dermatológica en la CVRS80.
El único instrumento especifico validado, originalmente desarrollado en Italia, es el Cuestionario de Calidad de Vida Específico para Urticaria Crónica (Chronic urticaria-quality of life questionnaire, CU- Q2oL)81.
El score de actividad de la urticaria (Urticaria activity score, UAS), documenta el número de pápulas (puntuación 0-3) y la gravedad del prurito (0-3) diariamente, con un puntaje máximo semanal de 42 (UAS7). Ha demostrado ser una herramienta válida para medir y monitorear la actividad de la enfermedad en pacientes con urticaria crónica82.
El cuestionario de calidad de vida específica de la enfermedad angioedema recurrente, AE- QoL, evalúa 4 dominios (funcionamiento, fatiga/estado de ánimo, miedos/vergüenza, alimentos), y se lo considera una herramienta valiosa para futuros estudios clínicos y en la práctica clínica80,83.
Impacto de la UCE en la CVRS
El impacto de la UCE sobre la CVRS se ha evaluado comparando enfermedades no dermatológicas, como se puede ver en el pionero estudio publicado por O'Donnell y col., donde se evidenció que los enfermos coronarios presentaban un impacto negativo de su CVRS similar en relación a perdida de energía, repercusión social y emocional; la interferencia con el sueño fue inclusive superior en los pacientes con UC74, 84.
En relación a la comparación de la CVRS con otras enfermedades dermatológicas, podemos decir que aunque es ampliamente aceptado que la dermatitis atópica y la psoriasis pueden afectar gravemente la calidad de vida, el deterioro grave en la urticaria crónica es a menudo subestimado, y en varias dimensiones es comparable con el deterioro sufrido por los pacientes con dermatitis atópica y psoriasis, y significativamente peor que en muchas dermatosis85, 86.
Existe una amplia gama de factores que afectan a los pacientes debido a su urticaria. O'Donnel y col. señalan que frente a la pregunta "¿cuál es el peor aspecto de su urticaria?", las respuestas fueron: angioedema (59%), prurito (42%), dolor (22%), cansancio, irritabilidad, debilidad o sensación de pérdida de control sobre su vida (22%), imprevisibilidad de los episodios (20%). Otras respuestas fueron las restricciones sociales (18%), sensación de vergüenza (13%), impacto en el trabajo/tiempo libre (7%), restricción de alimentos o vestimenta (7%), efectos secundarios de los medicamentos (5%), incapacidad para relajarse o sentarse (3.6%)85.
Impacto de la UCE sobre la CVRS en la población pediátrica
La UC es menos común en los niños que en los adultos (0.1%-3% de los niños); hay pocos estudios sobre el impacto de la enfermedad en este grupo etario.
Un estudio comparativo muestra que los niños con UCE tenían un diagnóstico más frecuente de enfermedad psiquiátrica (70% vs 30%), más comúnmente ansiedad social, trastornos de ansiedad por separación y fobias específicas. Los puntajes relacionados a depresión, rasgos de ansiedad, estado de ansiedad, comportamiento de internalización como son las quejas somáticas y la ansiedad/depresión, fueron significativamente mayores en los niños con UC87.
Utilizando el cuestionario Índice de Calidad de Vida en Niños (Children's Dermatology Life Quality Index) como herramienta de evaluación, se ha demostrado que el deterioro de la CVRS en niños con enfermedad crónica de la piel es por lo menos igual a la experimentada por los niños con muchas otras enfermedades crónicas de la infancia88.
Diagnósticos diferenciales
Aunque usualmente el diagnóstico de urticaria no acarrea inconvenientes, en muchos pacientes se plantean dificultades y se hace necesario un minucioso estudio para descartar un listado cada vez más numeroso de diagnósticos diferenciales. Veremos las enfermedades cutáneas que pueden manifestarse con lesiones urticariformes.
Dermatitis urticariana
La dermatitis urticariana fue descripta por Kossard y col.89 en 2006 como un cuadro caracterizado por pápulas y placas eritematosas pruriginosas que remedan a la urticaria, pero que duran más de 24 horas y algunas veces se acompañan de lesiones eccematosas. Es un cuadro de hipersensibilidad con un patrón de respuesta predominantemente dérmico, más que epidérmico90. El estudio histopatológico de las lesiones urticarianas muestra una dermatitis linfocitaria perivascular, con un neto predominio del edema de la dermis papilar y mínima espongiosis. El infiltrado en dermis papilar tiene un predominio de eosinófilos, y también pueden observarse neutrófilos. La edad promedio de los pacientes ronda los 60 años. Las lesiones persisten por días a semanas, son bilaterales y simétricas, localizadas en tronco a predominio superior y raíz de miembros. En ocasiones algunas lesiones tienen aspecto "targetoide" o en escarapela, con descamación periférica. Pueden coexistir con pápulas eritematosas excoriadas, tipo prurigo. Las causas pueden ser similares a la urticaria, destacando la picadura de artrópodos y su asociación con enfermedades autoinmunes y malignidad (10%)91,92. El diagnóstico diferencial es básicamente clínico, ya que la histopatología es similar, y debe estar basado en la diversidad de las lesiones y su persistencia.
Dermatitis de contacto urticariforme
Las dermatitis de contacto son debidas al contacto de la piel con una sustancia química, pudiendo producirse por diferentes mecanismos patogénicos; es así que se conocen cuatro tipos principales: irritativas, alérgicas, fototóxicas y fotoalérgicas. La mayoría tienen aspecto eccematoso; sin embargo, particularmente las alérgicas, pueden adoptar otros patrones clínicos: urticariforme, liquenoide, etc. El diagnóstico diferencial corresponde hacerlo con el tipo urticariforme, principalmente por la historia clínica, que refiere la exposición al contactante, los límites bastante netos de la dermatosis, en el sitio del contacto y la ayuda histopatológica, que puede demostrar algún foco de dermatitis espongiforme y/o necrosis de queratinocitos. Por otra parte, recordemos que existen auténticas urticarias de contacto93.
Eritema polimorfo o multiforme
Es un síndrome inflamatorio cutáneo-mucoso agudo o crónico recurrente, de naturaleza inmunológica, por citotoxicidad celular, desencadenado en respuesta a infecciones (herpes virus, micoplasma, lepra) y, más raramente, a fármacos94. La clínica varía desde una erupción leve, autolimitada, benigna (eritema polimorfo menor), a una forma seria, grave, que puede llegar a comprometer la vida (eritema polimorfo mayor). El inicio de las lesiones es precedido con frecuencia de pródromos consistentes en fiebre, malestar, odinofagia, cefalea y tos. Al cabo de 1 ó 2 semanas aparece una erupción acral, en la forma menor o diseminada y simétrica en la mayor. La lesión característica es una placa eritematosa circinada con límite neto y centro más claro o violáceo, que le otorga un aspecto en blanco de tiro o diana. En las formas graves hay ampollas en el centro de estas lesiones y sobre piel clínicamente sana, y como característica distintiva toman semi-mucosas y mucosas, en particular labial y ocular. Las lesiones iniciales pueden confundirse con la urticaria figurada, pero son más duraderas, al menos 7 a 10 días, y el prurito no tiene la intensidad del que se presenta en la urticaria. La aparición de las ampollas es concluyente. Histológicamente, en el eritema polimorfo se observa necrosis focal de queratinocitos basales, exocitosis epidérmica moderada o intensa y un infiltrado linfohistiocitario dérmico muy abundante. Hay una dermatitis de interfase que, en los casos intensos, puede dar lugar a la formación de ampollas. Los queratinocitos suelen tener linfocitos adheridos probablemente responsables de la muerte de los mismos por apoptosis. Este cuadro histológico también es diferencial95.
Prurigo
Se denomina así a un grupo de dermatosis caracterizadas por pápulas que exhiben una vesícula en su cúspide (seropápula de Tomasoli). Es más frecuente en niños y usualmente se debe a picadura de insectos (Cimex lectularius o chinche, Pulex irritans o pulga, mosquitos); también se invocan a artrópodos, sobre todo ambientales, y factores emocionales condicionantes (especialmente en las formas subagudas de adultos). Los alérgenos presentes en la saliva del insecto inducen una sensibilización del paciente desencadenando estas reacciones de hipersensibilidad, especialmente en atópicos96. La histopatología muestra una vesícula epidérmica espongiótica con una reacción dérmica con infiltración perivascular de linfocitos y eosinófilos. Hay edema, que si es abundante se traduce por un aspecto clínico urticariforme. La vesícula central y duración de las lesiones (días) hacen el diagnóstico diferencial.
Reacción exantemática a drogas
Las farmacodermias pueden tener un patrón clínico urticariforme: son placas eritemato-papulosas fijas generalmente en tronco, con distribución simétrica y bilateral, y tendencia a confluir. Cuando involucionan suelen dejar hiperpigmentación residual. Pueden ser pruriginosas. La histopatología muestra un infiltrado inflamatorio predominantemente mononuclear alrededor de los vasos superficiales, con algunos eosinófilos. En la epidermis puede haber linfocitos dispersos y queratinocitos apoptóticos. A diferencia de la urticaria, son más persistentes y carecen del aspecto edematoso de la misma. Los cambios epidérmicos no se ven en la urticaria.
Pápulas y placas urticariformes del embarazo. Erupción polimorfa del embarazo
Es la más frecuente de las dermatosis específicas el embarazo. Se ve usualmente en primíparas en el último trimestre de la gestación. Típicamente se inicia como pápulas en el trayecto de las estrías del abdomen, respetando la zona umbilical, y progresa hasta tomar el tronco y raíz de las extremidades. Son pápulas de aspecto urticariforme, pequeñas (1 a 2 mm) y fijas, pruriginosas, que progresivamente se unen formando placas. Sin embargo también puede presentarse como vesículas, lesiones en diana o policíclicas. El estudio anatomopatológico muestra espongiosis e infiltrado linfohistiocítico perivascular con eosinófilos y edema dérmico. No se detectan inmunocomplejos depositados; la inmunofluorescencia directa es negativa. Suele remitir espontáneamente en semanas97, 98. La aparición en la gestante, con topografía característica, induce el diagnóstico correcto, diferenciándolo de la urticaria. La aparición de otras lesiones elementales (ampollas) es de ayuda y la histopatología, con los cambios epidérmicos, colabora.
Penfigoide ampollar prodromal
El penfigoide ampollar es una enfermedad cutánea ampollar subepidérmica autoinmunitaria que habitualmente se presenta en personas mayores. Se caracteriza por presentar ampollas tensas grandes sobre piel normal o eritematosa, con o sin prurito. En estadio temprano, descripto por Bean en 197699, no tiene vesículas o ampollas como el clásico, y puede manifestarse como prurito generalizado100, eczemas, máculas eritematosas, placas urticarianas, eritema figurado o lesiones eritema polimorfo símil, con límites netos y distribución preferencia en raíz de miembros inferiores (región inguinal y muslos), que duran semanas a meses101. En el estudio histológico pueden apreciarse dos patrones: 1) dermatitis espongiótica eosinofílica sin despegamiento epidérmico; 2) infiltrado eosinofílico en dermis sin despegamiento epidérmico. La inmunofluorescencia directa es confirmatoria, demuestra depósito de IgG con predominancia de IgG4102, y C3 en la zona de la membrana basal. Por consiguiente, si bien la clínica puede confundir, los estudios histológicos e inmunofluorescentes son totalmente diferentes a los de la urticaria.
Finalmente, mencionamos otros cuadros que lejanamente pueden recordar a la urticaria: urticaria pigmentosa, dermatosis neutrofílica urticariforme, y otras dermatosis urticariformes de los síndromes autoinflamatorios.
Otras entidades reconocidas con la denominación de urticaria
Urticaria vasculitis
La urticaria vasculitis, que es mucho más frecuente en mujeres, se considera rara ya que se observa en 1% a 3% de los pacientes referidos por diagnóstico de UC. Sin embargo, tal vez esté subdiagnosticada, ya que en ocasiones los hallazgos clínicos resultan indistinguibles de la urticaria espontánea, excepto por la duración de las lesiones y la falta de respuesta a antihistamínicos H1. Las diferencias clínicas incluyen ronchas con focos purpúricos, induración, hiperpigmentación y otros hallazgos como angioedema, livedo reticularis, nódulos sobre el olecranon, ampollas y lesiones tipo eritema multiforme. Los síntomas incluyen prurito, ardor y dolor.
La investigación etiológica del cuadro, además de la biopsia confirmatoria, incluye FAN para conectivopatías, serología de hepatitis B y C, endoscopía para enfermedad inflamatoria intestinal, proteinograma electroforético para descartar paraproteinemia, crioglobulinemia, estudio de complemento C4, CH50, anti C1q, complejos inmunes circulantes, orina y sedimento, Rx de tórax y función pulmonar103. El hallazgo de una disminución del complemento plantea el diagnóstico de urticaria vasculitis hipocomplementémica. Los anticuerpos anti C1q actúan como marcadores diagnósticos de esta entidad, pero también pueden ser hallados en el 30% de los lupus eritematosos sistémicos y en el 80 % de ellos, cuando cursan con glomerulonefritis104.
Urticaria papular
Urticaria papular es una denominación que induce a confusión. No es una urticaria, y no se incluye dentro de las formas de UC a que se refiere esta guía. También se denomina prurigo agudo o estrófulo y liquen urticarian. Puede definirse como la erupción crónica o recurrente de pápulas pruriginosas, vesículas y ronchas que resultan de la hipersensibilidad a las picaduras de insectos o ácaros105. Los causantes más frecuentes son las pulgas y chinches de mascotas, o los mosquitos106. Los niños pequeños (2 a 10 años) son los más frecuentemente afectados. La erupción típica que, según algunos autores, ocurre con mayor frecuencia en los meses de primavera y verano, consiste en pápulas, vesículas y lesiones de aspecto urticariano pero no evanescentes, que son intensamente pruriginosas y se ubican de forma agrupada. El prurito puede dar lugar a excoriaciones por rascado y eventual impetiginización de las lesiones107.
Se cree que el cuadro depende de hipersensibilidad IgE mediada a la saliva de los mosquitos, por ejemplo, y que existe una secuencia patogénica con un período inicial de sensibilización, sin lesiones, seguido de otro de aparición de lesiones inmediatas (ronchas) y retardadas (pápulas/pápulo-vesículas), luego un período de reacción solo inmediata. Finalmente se desarrollaría la tolerancia sin lesiones108.
Urticaria pigmentosa
Es la más común de las mastocitosis cutáneas, una de las variantes cutáneas de la mastocitosis. Las mastocitosis son enfermedades raras, más frecuentes en la infancia. Las formas cutáneas son las de mejor pronóstico. Las mastocitosis están asociadas a un incremento patológico del número de mastocitos (las células efectoras de la urticaria) y a la liberación de sus mediadores. Los mastocitos se originan de progenitores hematopoyéticos de MO CD34+ Kit+ en presencia del SCF (stem cell factor). De allí se mueven a los tejidos vascularizados donde requieren el SCF para sobrevivir. Los mastocitos tisulares son células de larga vida, especialmente asociados a los vasos, glándulas y nervios.
Existen siete variantes de mastocitosis: cutánea, indolente sistémica, sistémica con asociación a enfermedad hematológica clonal con células no mastocíticas, sistémica agresiva, leucemia de mastocitos, sarcoma mastocitario y mastocitoma extracutáneo109. Las formas de manifestación cutánea (maculopapular o urticaria pigmentosa, mastocitoma solitario y difusa) son propias de la infancia y, ocasionalmente, suelen acompañarse de síntomas generales, muchas veces sin infiltración sistémica. La urticaria pigmentosa se manifiesta como múltiples máculas amarronadas, anaranjadas, ubicadas primero en el tronco, luego simétricamente en las extremidades, que se urtican al roce (signo de Darier). El estudio histopatológico demuestra, a nivel de las lesiones, el acúmulo de mastocitos agrupados (> 15 células) o dispersos (> 20 células por campo de 400x); también se puede demostrar mutación del cKit a nivel del codón 816 en la piel lesional.
Las lesiones deben clasificarse como mastocitosis en la piel hasta descartar compromiso sistémico. En los niños basta con dosaje de triptasa sérica, pero si ésta supera persistentemente los 20 ng/dl o 11.4 ng/ml para otros autores se requiere biopsia de médula ósea; en caso contrario se controla hasta la resolución o hasta que el niño alcanza la pubertad. En los adultos, son necesarios el dosaje de triptasa sérica y la biopsia de médula ósea110.
Relación erupciones de tipo urticariano con síndromes autoinflamatorios
La categoría de desórdenes autoinflamatorios es una clasificación relativamente nueva que describe a un grupo de enfermedades caracterizadas por episodios recurrentes de inflamación producida por una disregulación de la inmunidad innata con activación del inflamosoma y que involucra producción y activación anormal de citocinas s e inflamación neutrofílica. Están caracterizados por episodios de fiebre e inflamación crónica e intermitente en piel, articulaciones y varios órganos. La mayor complicación que resulta de la inflamación crónica es la amiloidosis A. Los pacientes tienen importantes alteraciones en su calidad de vida.
De las seis categorías de síndromes autoinflamatorios agrupados en base a clínica, las que presentan erupciones tipo urticariano son:
1. Síndromes de fiebre periódica clásicos hereditarios, la fiebre mediterránea familiar; síndrome periódico asociado al receptor de factor de necrosis tumoral, deficiencia de mevalonato quinasa/hiperinmunoglobulinemia D y síndrome de fiebre periódica.
2. Síndromes periódicos asociados a criopirina, que comprenden el síndrome autoinflamatorio familiar por frío, el síndrome de Muckle-Wells y la enfermedad inflamatoria multisistémica de inicio neonatal.
La erupción urticariana en estas afecciones muestra diferencias con la UC. Las lesiones son más achatadas, sin halo, o solamente son parches eritematosos, de más de 24 horas de duración y raramente asociadas a angioedema. Además del incremento de los reactantes de fase aguda velocidad de eritrosedimentación y proteína C reactiva y del aumento en los neutrófilos, otros síntomas se asocian: inflamación de ojo anterior o uveítis que resulta en ojo rojo doloroso, edema periorbital, serositis, estomatitis (aftas), inflamación meníngea que causa cefalea, dolor abdominal y diarrea, artralgia, mialgia, linfadenopatía y fiebre. El problema es que los síntomas pueden presentarse por separado111.
Evaluación del paciente con urticaria y angioedema
La urticaria aguda es un proceso autolimitado que no suele requerir ningún otro estudio diagnóstico más que la anamnesis y exploración física.
Es en las urticarias recidivantes y crónicas donde estará indicada la realización de hemograma, reactantes de fase aguda, y sedimento urinario. El análisis de series amplias de pacientes con urticaria y angioedema ha puesto de manifiesto que la realización de una batería más amplia de estudios analíticos no está indicada, por el pobre rendimiento diagnóstico. La determinación de IgE específica (RAST) y las pruebas cutáneas tipo PrickTest e intradermorreacción están indicadas cuando la historia del cuadro sugiera alergias específicas a fármacos, alimentos y sustancias inhaladas. En los casos de sospecha de urticaria por agentes físicos se puede realizar una prueba de provocación con el agente correspondiente para confirmar el diagnóstico. En aquellas urticarias crónicas que no responden a los antihistamínicos habituales se deberán descartar enfermedades sistémicas como colagenosis, hiper o hipotiroidismo, tumores malignos, vasculitis cutánea y activación del sistema de la cooagulación.
En los pacientes con angioedema sin urticaria se determinarán los niveles de C4, C1 esterasa y actividad del inhibidor de C1.
Un hemograma completo, la velocidad de eritrosedimentación, dosaje de actividad de complemento y proteína C reactiva, por ejemplo, pueden ser útiles para detectar selectivamente la urticaria vasculitis y sospechar infección asociada. Análisis adicionales del complemento, autoanticuerpos, electroforesis sérica o función renal y hepática con análisis de orina podrían estar indicados en casos de vasculitis urticante confirmada. Como primera evaluación del angioedema recurrente sin urticaria son esenciales los análisis inmunoquímicos y funcionales de inhibidor C1.
Pruebas para detección de alergia
Las pruebas de Prick y el RAST solo aportarán información sobre reacciones de hipersensibilidad inmediata que pueden guardar o no relación con el cuadro de urticaria, ya que pueden detectarse sensibilizaciones no etiológicamente relacionadas con la urticaria. Carecen de utilidad, por ejemplo, sobre la vasculitis urticariana, que se supone es una reacción de inmunocomplejos, o sobre reacciones citotóxicas observadas con algunos fármacos o posteriores a transfusiones sanguíneas.
Estudios de provocación
Son sobre todo muy útiles para definir las urticarias físicas, como se ha comentado más en detalle en la sección sobre el tema. La provocación puede estar indicada para confirmar la causa de otros tipos de urticaria, cuando las pruebas alérgicas han resultado ser o no concluyentes o negativas.
Algunos centros especializados emplean la provocación seriada y progresiva con una serie de cápsulas que contienen conservantes alimentarios, colorantes o pequeñas dosis de ácido acetilsalicílico, que se alternan con cápsulas de placebo. Estas pruebas de provocación son difíciles de interpretar, a no ser que la urticaria no esté en fase activa o que el paciente no esté tomando medicación.
Estudios histológicos
Biopsia por punch de 4 mm
En la urticaria pueden aparecer diversas alteraciones histológicas, desde un escaso infiltrado celular mixto con edema dérmico, hasta un intenso edema dérmico con infiltrado moderadamente denso de neutrófilos, linfocitos y eosinófilos. Se han descripto casos de escasa inflamación linfocitaria dérmica perivascular, con o sin eosinófilos, e incluso de vasculitis necrotizante franca, siendo útil para el diagnóstico de la urticaria vasculitis112.
El diagnóstico etiológico de una urticaria crónica es un verdadero desafío para el dermatólogo y el alergo-inmunólogo. El primer interrogatorio será dirigido hacia un nuevo fármaco que esté tomando el paciente o a los alimentos con conservantes, colorantes o aditivos incorporados recientemente.
Los estudios a realizar en estos pacientes estarán dirigidos hacia una orientación etiológica posible, por tal motivo se considerará evaluar los siguientes de acuerdo con la sospecha derivada de la anamnesis:
• Test para descartar procesos infecciosos (VDRL cuantitativas, Proteína C reactiva, Virus hepatitis C y B, exudado de fauces con cultivo), acompañados de una buena historia clínica
• Colagenograma mínimo en inicio que incluya FAN, Artritest, C3, C4.
• Anticuerpos para enfermedad celíaca (anti transglutaminasa y anti endomisio)
• Anticuerpos antitiroideos
• Biopsia de piel si sospechamos una urticaria vasculitis
Evaluación de los distintos tipos de urticaria crónica
Para cada tipo de urticaria crónica inducible se pueden realizar algunas pruebas semiológicas que orientarán al médico a la confirmación diagnóstica.
Algunos pacientes pueden padecer dos formas de urticaria al mismo tiempo, por ejemplo, urticaria al frío y dermografismo. Un alto porcentaje, en especial los niños, tiene antecedentes de atopía. El diagnóstico se realiza por el interrogatorio y pruebas de provocación113, 114.
Como se ha comentado en la sección correspondiente, en la urticaria por frío el diagnóstico se confirma aplicando un hielo sobre la piel del antebrazo, lo que provocará la aparición de la roncha urticariana en los próximos 10 a 15 minutos. El resultado es positivo si aparece una lesión sobre elevada, habonosa, en el área de aplicación. Es importante determinar el tiempo mínimo de exposición necesario para inducir una reacción positiva, tiempo umbral de estimulación, al haberse demostrado que existe una relación inversa con la gravedad de la reacción. Por otra parte, el tiempo umbral puede servirnos para monitorizar la respuesta al tratamiento y valorar la evolución de la enfermedad. Un tiempo umbral de estimulación menor de tres minutos se correlaciona con mayor riesgo de presentar una reacción sistémica. Hasta el momento hay descriptas tres formas familiares, todas ellas muy poco frecuentes y de herencia autosómica dominante, pero se caracterizan por tener el test de estimulación con frío negativo113, 114. Cuando nos encontramos con un paciente que tiene una historia que sugiere una urticaria por frío, pero la respuesta a los test de exposición convencionales -como el cubito de hielo- es negativa, pueden hacerse con extremo cuidado otros tests de provocación de áreas más amplias (bloques fríos o introducir el brazo en agua fría). Si son negativos o de respuesta atípica, debe sospecharse una urticaria por frío atípica. Para ello, la Tabla 7 adaptada de Veleiro Pérez y col.113, puede ser útil para llegar a un diagnóstico más certero.
Tabla 7. Formas especiales de urticaria por frío

Para evaluar dermografismo, se sumerge un brazo en agua a <4° durante 10 minutos, para obtener una reacción cutánea confirmatoria diagnóstica. Antes de realizar todos estas pruebas se deben suspender todos los antihistamínicos por lo menos con 48 horas de antelación. Los estudios analíticos deben restringirse a aquellos pacientes en los que la historia clínica sugiere la existencia de una enfermedad subyacente. Si está indicado, solicitaremos un hemograma, bioquímica y perfil hepático, marcadores de inflamación como PCR y VSG, crioglobulinas, ANA y serologías virales y bacterianas. En la mayoría de los pacientes los estudios de laboratorio no mostrarán ninguna causa subyacente113, 115.
La urticaria por calor se provoca aplicando una bolsa con agua caliente a 50 °C durante 1 a 5 minutos, logrando así la aparición de la roncha y confirmación diagnóstica.
La urticaria solar se caracteriza por la aparición de una erupción eritematosa, pruriginosa en las zonas de exposición a los rayos ultravioletas y que se desarrollan a los pocos minutos de la exposición al sol, persistiendo por más de 30 a 60 minutos luego de aparecida la reacción. Rara vez tiene síntomas sistémicos y mayormente reacciona frente a un espectro UVB de 290 a 330 nm. Se confirma con el foto-test, que consiste en reproducir las lesiones a los minutos de la exposición a una fuente de luz natural (sol) o artificial (lámpara de cuarzo o tubo fluorescente). El uso de filtros puede separar la reactividad en sus diferentes tipos. La respuesta pasadas las 24 horas y durante varios días nos diferencia a los pacientes con erupción polimorfa solar. Debe hacerse diagnóstico diferencial con protoporfiria eritropoyética pidiendo porfiria en materia fecal, con fotosensibilidad a medicamentos, erupción polimorfa solar y urticaria colinérgica114.
El diagnóstico de la urticaria colinérgica es siempre clínico. Un método útil es que el paciente haga ejercicios para desencadenar la urticaria. Se debe realizar el diagnóstico diferencial con la urticaria de contacto y la acuagénica.
Para confirmar el diagnóstico de urticaria acuagénica, una prueba que se puede realizar es aplicar sobre la piel agua a temperatura ambiente ó 37 °C durante 20 minutos115.
Los tests diagnósticos recomendados según el subtipo de urticaria se pueden observar en Tabla 8.
Tabla 8. Estudios complementarios en urticaria
*Adaptado de Zuberbier T, Asero R, Bindslev-Jensen C et al. EAACI/GA(2)LEN/EDF/WAO guideline: definition, classification and diagnosis of urticaria. Allergy 2009; 64:1417-26 y de Mlynek A, Zalewska-Janowska A, Martus P, Staubach P, Zuberbier T, Maurer M. How to assess disease activity in patients with chronic urticaria? Allergy 2008; 63: 777-80
Angioedema
El diagnóstico de angioedema, con o sin urticaria, se basa principalmente en una historia clínica cuidadosa y un buen examen físico. Los factores desencadenantes de los episodios agudos de angioedema pueden ser de tipos diversos: infecciones, traumatismos físicos, intervenciones quirúrgicas, procedimientos como la anestesia con intubación o la endoscopia superior, extracciones dentarias, estrés, o algunos fármacos, especialmente aquellos que contienen estrógenos, ya se trate de anticonceptivos o de terapia sustitutiva, y los IECA, destinados a hacer descender la presión cardiovascular, que pueden desencadenar episodios graves de angioedema debido a que afectan a la metabolización de la bradiquinina.
A menudo transcurre mucho tiempo hasta que se diagnostica esta enfermedad, especialmente si no hay historia familiar, ya que los síntomas de los episodios agudos son similares a los de enfermedades más frecuentes, como angioedemas de origen alérgico o, en el caso de los ataques abdominales, como la apendicitis. Un síntoma importante que puede orientar al médico al diagnóstico es la respuesta nula de un edema a los antihistamínicos o a los preparados de cortisona, lo cual permite un diagnóstico diferencial frente a las reacciones alérgicas.
El diagnóstico definitivo se obtiene mediante el análisis en laboratorio de una muestra de sangre del paciente, que generalmente no consiste en determinar la carencia de INH C1, sino un valor reducido del factor de complemento C4. Este factor se emplea en el curso de la cadena de reacciones del sistema complemento de las defensas inmunitarias, y a causa de la falta de regulación del INH C1, presenta valores alterados.
Para el diagnóstico de angioedema sin urticaria podemos seguir la Figura 5, adaptada de Pedraz y col.116.

Fig. 5. Diagnóstico de angioedema sin urticaria
Tratamiento
Un factor importante en la clasificación de la urticaria, que estará muy relacionado con la conducta terapéutica, es la actividad de la enfermedad. En la urticaria física y en la urticaria colinérgica, así como en la anafilaxia/urticaria inducida por ejercicio, el umbral del factor desencadenante debe ser determinado. Estos umbrales permiten, tanto a los pacientes como a los médicos, evaluar la actividad de la enfermedad y la respuesta al tratamiento. Para la urticaria aguda y crónica espontánea, la evaluación de la actividad de la enfermedad es más compleja. Varios sistemas de puntuación han propuesto el uso de escalas de 0-3 o hasta 10 puntos. El sistema de puntuación UAS, ya comentado, es un unificado y sencillo sistema de puntuación que ha sido validado33,83, y es adecuado para la evaluación de de la actividad de la enfermedad por los pacientes y sus médicos tratantes Como en la urticaria los síntomas cambian con frecuencia en intensidad, se aconseja a los pacientes documentar 24 horas de autoevaluación y tener en cuenta las calificaciones de 7 días consecutivos33, 114, 117, 118. El UAS se debe utilizar en la práctica clínica de rutina (Tabla 9)33, 117.
Tabla 9. Evaluación de la actividad de la enfermedad en pacientes con urticaria

Suma de puntos (urticaria + prurito) = 0 a 6
Adaptado de Zuberbier T, Asero R, Bindslev-Jensen C et al. EAACI/GA(2)LEN/EDF/WAO guideline: definition, classification and diagnosis of urticaria. Allergy 2009; 64: 1417-26.
El tratamiento se puede dividir en tres enfoques fundamentales que deben considerarse en cada paciente: evitación, eliminación o tratamiento del estímulo desencadenante o de la causa. Este enfoque es el más aconsejable debido a que es curativo pero, lamentablemente, no es aplicable a la mayoría de los pacientes, ya que a menudo se desconoce el estímulo exacto y ven perjudicada su calidad de vida con esta enfermedad.
En la urticaria aguda con o sin angioedema podemos tener en cuenta la Tabla 10, adaptada de Kanani y col.119, con el agregado de los nuevos antihistamínicos.
Tabla 10. Antihistamínicos más utilizados para el tratamiento de la urticaria*
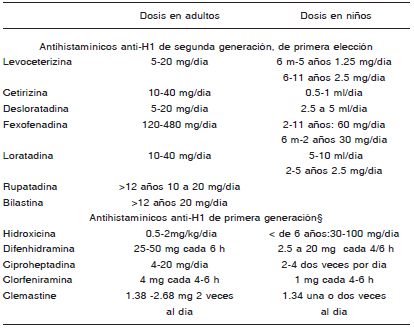
*Adaptada de Kanani A, Schellenberg R, Warrington R. Urticaria and angioedema. Allergy, Asthma Clin Immunol 2011; 7: Suppl 1:S9
§Para pacientes excepcionales, ya que su uso en general se desaconseja por sus efectos colaterales
Cuando se produce una exacerbación de urticaria, es decir, cuando se origina un aumento marcado de síntomas de urticaria y o angioedema, compatible con un score UAS de 5 a 6 y que no se puede resolver solamente con antihistamínicos, deberán utilizarse esteroides sistémicos. Su uso debe estar limitado en lo posible a esteroides orales de vida media breve a moderada, por ejemplo prednisona o metilprednisolona en dosis diarias de 0.5 a 1 mg/kg/día, por periodos que no deberían exceder los 7 días. Por razones de seguridad del paciente, el uso de esteroides inyectables de depósito se desaconseja taxativamente.
En el tratamiento de la urticaria crónica debemos evitar los posibles desencadenantes o agravantes inespecíficos como el calor, el estrés, el alcohol y algunos fármacos como el ácido acetilsalicílico, los AINES, o la codeína. Pueden utilizarse lociones refrescantes antipruriginosas como calamina o mentol al 1% en crema acuosa33. Para el tratamiento, es recomendable seguir el algoritmo de la Figura 6.
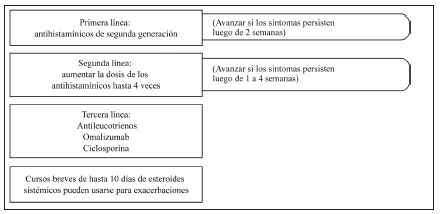
Fig. 6. Manejo farmacológico de la urticaria según WAO-EAACI 2013
A partir de la cuarta reunión de consenso para la actualización de las guías de UCE, realizada el mes de noviembre de 2012 en Berlín, se introdujeron algunos cambios en el algoritmo de manejo de la UC, que figuraban en versiones anteriores. Por ejemplo, se ha retirado la recomendación del empleo de dapsona así como de los antihistamínicos H2. Se recomienda el aumento de la dosis de los antihistamínicos H1no sedantes hasta 4 veces la dosis licenciada, y se mantiene como segunda línea de tratamiento exclusivamente el empleo de omalizumab, ciclosporina A o antileucotrienos (Figura 7)117.

Fig. 7. Algoritmo de manejo de la urticaria crónica
* Basado en el algoritmo de tratamiento de la urticaria crónica espontánea publicados en las directrices actuales117
Control de urticaria
Diferentes características de la UCE y su frecuencia de aparición nos podrán orientar para evaluar el control de la enfermedad (Tabla 11).
Tabla 11. Cómo estimar el control de la urticaria
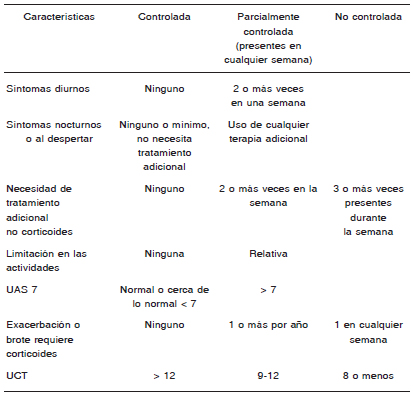
Tratamiento con antihistamínicos
En las diferentes formas de urticaria, si bien los mecanismos patogénicos que intervienen son complejos y algunos aspectos moleculares subyacentes no se han aclarado por completo aún, se sabe que el protagonista de la enfermedad es el mastocito y, la histamina, su mediador principal. La histamina es responsable de la mayor parte de la reacción urticariana, caracterizada por la vasodilatación con consecuente eritema localizado, el aumento de la permeabilidad vascular, que conduce a la formación de la roncha, el prurito por reflejo axonal local con dilatación de arteriolas peri lesionales, y la tendencia a la propagación de las manifestaciones clínicas por liberación de sustancia P. La histamina ejerce sus efectos a través de la activación de receptores conocidos como receptores de histamina (HR, su sigla en inglés)29, 120.
Receptores H1
Los receptores de histamina se localizan en distintas células y constituyen los blancos de los antihistamínicos. Hasta el momento se han identificado 4 subtipos de receptores de histamina: HR1, HR2, HR3 y HR4121, 122. En términos generales, los receptores de histamina pertenecen a la familia de receptores transmembrana asociados a proteína G (GPCR, su sigla en inglés), que traducen las señales extracelulares a través de la proteína G y de sistemas intracelulares de segundos mensajeros123. Todos los receptores existen en 2 estados que se encuentran en perfecto equilibrio: estado activo y estado inactivo124, 125. Los agonistas son aquellas sustancias que muestran afinidad por el estado activo del receptor y que al unirse a él lo estabilizan en la conformación activa produciendo una señal de activación continua. Por el contrario, los agonistas inversos son sustancias con afinidad por el estado inactivo del receptor. Por ende, su unión lo estabiliza en esta conformación y produce el bloqueo de la transducción de la señal a través del receptor126. Resulta interesante mencionar que los HR tienen actividad intrínseca, es decir que son capaces de activar cascadas celulares en ausencia de un agonista124, 127.
El receptor de histamina 1 (HR1) se expresa en neuronas del SNC, en células endoteliales y epiteliales, en células del sistema inmunitario (neutrófilos, eosinófilos, linfocitos T y B, macrófagos, monocitos y células dendríticas), en células musculares lisas de los tractos respiratorio, gastrointestinal y vascular, así como a nivel cardiovascular128-130. Está codificado por un gen localizado en el brazo corto del cromosoma 3 (3p25b). En su estado activado estimula las vías de señalización del inositol con la consecuente formación de IP3 (1,4,5-inositol trifosfato) y DAG (diacilglicerol), y aumento intracelular de calcio responsable de la producción de óxido nítrico y de la liberación de ácido araquidónico a partir de fosfolípidos.131 Asimismo, activa las fosfolipasas A2 y D y es capaz de estimular la transcripción del NF-κβ (factor nuclear-κβ)132. Estos procesos conducen a cambios en la permeabilidad vascular, broncoconstricción y alteraciones inmunológicas, que median enfermedades alérgicas como la rinitis, la dermatitis atópica, la conjuntivitis, el asma, la urticaria y la anafilaxia133, 134. Despiertan particular interés por representar el blanco principal de los antihistamínicos anti-H1.
Antihistamínicos anti-H1
Como su nombre lo indica, los antihistamínicos son fármacos destinados a bloquear o contrarrestar los efectos de la histamina, y constituyen el tratamiento de elección de la urticaria tanto aguda como crónica. Las guías terapéuticas internacionales actuales establecen que los antihistamínicos anti-H1 de segunda generación son la primera línea de tratamiento de todas las formas de urticaria122, 135.
Clasificación
Los antihistamínicos pueden clasificarse en base a su estructura química o a su función.
Si se considera el punto de vista estructural los antihistamínicos anti-H1 se clasifican en 6 grupos (Tabla 12): alquilaminas (clorfenamina), etanolaminas (difenhidramina), etilendiaminas (tripelenamina), fenotiacinas (prometacina), piperidinas (ciproheptadina), piperacinas (hidroxicina)136. Desde el punto de vista funcional, los antihistamínicos se clasifican en sedativoso de primera generación y no sedativos, o de segunda generación. Esta forma de clasificarlos resulta más práctica. En términos generales, los antihistamínicos de primera generación son lipofílicos, tienen menor peso molecular y una carga eléctrica positiva, todas condiciones que favorecen su pasaje a través de la barrera hematoencefálica con consecuente efecto sedativo. Cabe mencionar que los pacientes pueden presentar cierta tolerancia a este efecto al recibir dosis sucesivas de estos fármacos o incluso reacciones paradójicas con excitación e insomnio. Además, a diferencia de los antihistamínicos no sedativos, los de primera generación poseen escasa especificidad por los receptores H1 y ejercen efectos a nivel de receptores muscarínicos, colinérgicos, α-adrenérgicos y serotoninérgicos, produciendo una serie de efectos adversos relacionados, ausentes en la segunda generación137.
Tabla 12. Antihistamínicos H1. Clasificación química y funcional
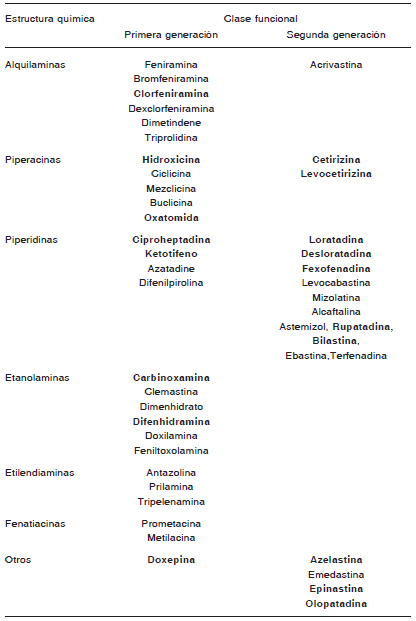
Los antihistamínicos resaltados en negrita son los disponibles en Argentina. La doxepina, además de ser un antihistamínico, es un antidepresivo tricíclico, pues tiene actividad sobre los receptores H2 e inhibe la recaptación de serotonina y norepinefrina.
Farmacocinética y farmacodinamia
Las características farmacocinéticas de los antihistamínicos están mejor estudiadas y establecidas para los antihistamínicos de segunda generación y se detallan en la Tabla 13. La cetirizina, levocetirizina, desloratadina, fexofenadina, loratadina, rupatadina y bilastina son los que mayor cantidad de estudios controlados randomizados y prospectivos presentan.
Tabla 13. Farmacocinética y farmacodinamia
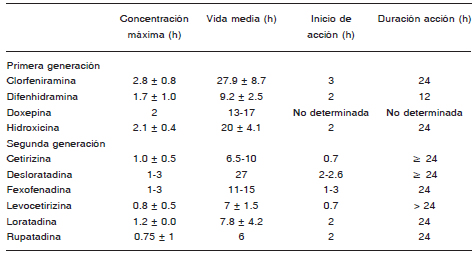
Como conceptos generales, los antihistamínicos tienen buena y rápida absorción a nivel del tracto digestivo, y alcanzan el pico plasmático entre 0.7 y 2.6 horas luego de su administración. Su biodisponibilidad puede verse alterada en función de la expresión de proteínas transportadoras localizadas en la superficie luminal de las células intestinales. Un ejemplo claro es la fexofenadina, cuya absorción depende de la glicoproteína p transportadora. Por consiguiente, los inductores de esta proteína (rifampicina) disminuyen su absorción y los inhibidores (eritromicina o ketoconazol) la aumentan; además, por ser un ácido orgánico, no debe administrarse junto con antiácidos que contengan aluminio o magnesio pues se liga a éstos disminuyendo su absorción138. El volumen de distribución, la unión a proteínas plasmáticas y la vida media de eliminación son muy variables entre los distintos fármacos. El metabolismo es fundamentalmente hepático, dependiente de la enzima citocromo p-450, con lo cual inhibidores de esta enzima (macrólidos, eritromicina, imidazoles y ketoconazol) aumentan la concentración plasmática de antihistamínicos sin metabolizar y pueden generar toxicidad.
Es interesante mencionar que algunos antihistamínicos se relacionan entre sí; por ejemplo la acrivastatina deriva de la triprolidina, la levocetirizina es un enantiómera de la hidroxicina y, la desloratadina es un metabolito de la loratadina y la rupatadina.
Los antihistamínicos se excretan por vía renal y fecal y algunos de ellos lo hacen sin metabolizar como ser el 50% de la cetirizina, el 85% de la levocetirizina y el 80% de la fexofenadina139, 140.
En cuanto a su farmacodinamia (Tabla 13), los antihistamínicos son fármacos dosis dependiente. Como se mencionó con anterioridad, los antihistamínicos de segunda generación son los mejor estudiados y se ha establecido que alcanzan rápidamente la concentración máxima en piel luego de su administración oral, comienzan a actuar 1 a 2 h después con un pico de supresión máximo a las 5 a 8 h141, 142. La duración de la acción de la mayoría de los antihistamínicos de segunda generación es por lo menos de 24 h y puede aumentar en caso de disfunción hepática o renal requiriendo ajustes de dosis. Más aún, se ha observado que este grupo de antihistamínicos presenta efecto residual de supresión a nivel cutáneo una vez suspendidos, que es de un día para loratadina y desloratadina, y de hasta tres a cuatro días para cetirizina o levocetirizina121,125.
Efectos adversos
Los efectos adversos de los antihistamínicos son numerosos y se relacionan en forma directa con su estructura química y su funcionalidad. La mayoría se observa con el uso de antihistamínicos de primera generación que atraviesan la barrera hematoencefálica con facilidad produciendo sedación y efectos colaterales neurológicos, aún en dosis terapéuticas, y que, por su escasa especificidad, ejercen efectos sobre receptores distintos de los HR1, como ser receptores colinérgicos, muscarínicos, α-adrenérgicos y serotoninérgicos, con el consecuente abanico de efectos colaterales que se mencionan a continuación. Se acepta que, a diferencia de estos, los antihistamínicos de segunda generación no solo no producen los efectos adversos que se mencionarán sino que además no presentan riesgo de toxicidad ni muerte por sobredosis. Es importante recordar que los únicos dos antihistamínicos pertenecientes a este grupo (astemizol y terfenadina) que presentaron efectos adversos cardíacos (torsades de pointes y otras arritmias ventriculares) fueron retirados del mercado a nivel mundial.
- Acción sobre receptores H1 del SNC: el bloqueo de la transmisión histaminérgica a nivel neuronal produce somnolencia, alteraciones de la cognición, del alerta y de la memoria, mareo, cefalea y una disminución general de las capacidades psicomotoras del paciente143, 144. Es importante destacar que el consumo simultáneo de etanol y benzodiacepinas puede exacerbarlos144.
- Acción sobre receptores muscarínicos colinérgicos: su bloqueo produce sequedad de fauces, dificultad en la micción y taquicardia sinusal.
- Acción sobre receptores serotoninérgicos: produce aumento del apetito y del peso.
- Acción sobre receptores α-adrenérgicos: produce mareo e hipotensión ortostática.
- Bloqueo de canales iónicos cardíacos: produce prolongación del intervalo QT con riesgo de arritmias cardíacas auriculares y ventriculares, torsades de pointes, fibrilación ventricular y muerte.
Sobredosis y toxicidad
Al igual que sucede con los efectos adversos, la sobredosis accidental o intencional y la toxicidad secundaria solo se relacionan con la ingesta de antihistamínicos de primera generación. No hay casos informados de toxicidad y muerte por sobredosis de antihistamínicos de segunda generación145.
El cuadro clínico se caracteriza por el predominio de efectos anticolinérgicos como sequedad de boca, dilatación pupilar, fiebre, retención urinaria, disminución de la motilidad intestinal, hipotensión y taquicardia. En los niños puede observarse un cuadro de excitación, irritabilidad, alucinaciones y convulsiones seguido de confusión, mareo, coma y depresión respiratoria146, 147.
Debido al riesgo de muerte por toxicidad cardíaca, es necesario monitorear a los pacientes en forma permanente hasta tanto se normalicen los parámetros148.
Otras consideraciones
Los ancianos, los niños menores de 6 años y las mujeres embarazadas o en periodo de lactancia constituyen un grupo de pacientes en quienes es necesario evaluar el riesgo-beneficio de utilizar antihistamínicos de primera generación149,150. Se recomienda el uso de antihistamínicos de segunda generación que están ampliamente estudiados en estos grupos y que carecen o al menos presentan menos efectos adversos que sus antecesores de primera generación.
Uso en urticaria
• Se desaconseja el uso de antihistamínicos sedativos o de primera generación ya que, si bien son eficaces, su perfil de seguridad y alta potencialidad para efectos adversos limita su uso rutinario y de largo plazo.
• Se recomienda como primera línea de tratamiento el empleo de antihistamínicos no sedativos a dosis estándar en todos los pacientes.
• Muchos pacientes no lograrán un control aceptable de los síntomas y se recomienda entonces aumentar hasta 4 veces la dosis habitual.
• En particular este enfoque se aplica en muchos casos de urticarias físicas.
• Se recomienda el uso regular de antihistamínicos y no el uso reactivo o gatillado por la sintomatología.
• No se recomienda el uso de antihistamínicos H2 pues su supuesto efecto es pobre, en el mejor de los casos. Tampoco se recomienda combinar diferentes antihistamínicos.
• En el caso de pacientes embarazadas con síntomas que requieran tratamiento se sugiere usar loratadina o desloratadina y/o cetirizina o levocetirizina a dosis estándar, circunstancia en la cual la evidencia actual no muestra aumento de malformaciones congénitas.
Tratamientos no convencionales
Los antihistamínicos son la piedra angular del tratamiento de la UC; sin embargo, un 40% de los pacientes con UC no logran un buen control con tratamiento antihistamínico. Estos pacientes requieren otros tratamientos para controlar su enfermedad. Un grupo de fármacos se utiliza para tratar a tales pacientes con UC refractaria. Desafortunadamente, la evidencia que apoya a la mayoría de estos agentes alternativos es limitada. Pese a estas limitaciones, pueden utilizarse como coadyuvantes en el tratamiento para mejorar su calidad de vida y limitar la toxicidad del uso frecuente o crónico de esteroides sistémicos.
Veremos la evidencia, las consideraciones prácticas para la elección, la seguridad y el uso de algunos de los agentes alternativos más comúnmente utilizados en la UC refractaria. Varios de ellos pueden poseer múltiples mecanismos de acción (antiinflamatorio e inmunosupresor). Podemos clasificar arbitrariamente estos tratamientos en una de las siguientes categorías: antiinflamatorio, inmunosupresor e inmunomodulador151.
Agentes antiinflamatorios
Corticoides
El principal efecto de los corticoides proviene de su actividad antiinflamatoria, que logra por mecanismos diversos, ya sea promoviendo la transcripción o no transcripción de determinados genes (vía genómica), o por otros mecanismos (vía no genómica). En general se atribuyen los efectos antiinflamatorios a la inhibición de la transcripción y los efectos secundarios a la activación de la transcripción. Los mecanismos de acción a nivel celular se traducen en una serie de efectos sobre la respuesta del sistema inmunitario, inhibiendo la acción de mediadores proinflamatorios y estimulando la acción de mediadores antiinflamatorios.
No existen estudios controlados del uso de los corticosteroides en el tratamiento de la urticaria/angioedema pero su efectividad generalmente se acepta como tal (grado de recomendación D).
En un estudio retrospectivo, prednisona a dosis de aproximadamente 0.3 a 0.5 mg/kg indujo una remisión de la enfermedad, que se logró controlar posteriormente, en alrededor del 50% de los casos, con antihistamínicos en las dosis autorizadas. La mayor parte de los pacientes respondieron bien, pero recayeron cuando se disminuían las dosis, o al finalizar el curso de corticosteroides. En aproximadamente un tercio de respondedores temporales, un segundo ciclo de prednisona indujo una remisión persistente de la enfermedad. Los efectos clínicos fueron evidentes ya el día después de la primera dosis de 25 mg. En vista de los efectos secundarios graves asociados con el tratamiento a largo plazo (diabetes, hipertensión, osteoporosis, y sangrado gastrointestinal), los corticosteroides orales deben ser usados por períodos cortos y en la dosis mínima eficaz152.
Se recomienda su prescripción en pautas descendentes en el tratamiento de exacerbaciones graves de la UC, especialmente cuando se acompaña de angioedema. También pueden administrarse cuando existen dificultades en el control de los síntomas con antihistamínicos en monoterapia o cuando se desea obtener una mejoría clínica rápida. Se han utilizado asimismo en el tratamiento de la urticaria vasculitis. Los corticosteroides tópicos no deben utilizarse en la UC153.
La recomendación de esta guía es evitar su uso prolongado, limitándolo en lo posible solo a las exacerbaciones. Se deben preferir los corticoides orales (prednisona o metilprednisona) y evitar taxativamente las formulaciones inyectables de depósito o acción prolongada, por sus evidentes riesgos que incluyen afectación de la función adrenal.
Antagonistas de los receptores de los leucotrienos (antileucotrienos)
Los leucotrienos pueden tener un rol en la patogénesis de la UC como se sugiere por el hecho de que los cisteinil leucotrienos cuando se inyectan en la piel causan un habón y una respuesta de erupción. Los antileucotrienos son un grupo de fármacos que inhiben la acción proinflamatoria de los leucotrienos, por diferentes mecanismos; el zileuton (inhibe la 5-lipoxigenasa), y el montelukast y zafirlukast (antagonizan los receptores cisteinil-leucotrienos).
El más utilizado es el montelukast, que se ha empleado en el tratamiento del asma, la rinitis alérgica y en la urticaria, si bien el uso en esta última enfermedad no está aprobado por las autoridades regulatorias. Existe muy poca evidencia de su eficacia en monoterapia39, 154. Pueden asociarse a antihistamínicos H1 en urticarias de difícil control. Aquí se han planteado algunas críticas en relación con el costo de la combinación con altas dosis de antihistamínicos H1.
Aunque su respuesta es poco predecible, existen estudios que sugieren que el montelukast puede ser efectivo en el tratamiento de algunos pacientes con urticaria autoinmune, urticaria por presión retardada y en la urticaria complicada con intolerancia al ácido acetilsalicílico o a colorantes alimentarios. Se ha utilizado para tratar la urticaria eosinofílica. En resumen, la evidencia existente de su eficacia es limitada, y la calificación de recomendación para su uso es baja.
Hidroxicloroquina
La hidroxicloroquina es un agente antiinflamatorio que se utiliza para prevenir y tratar los ataques agudos de malaria. También para tratar lupus eritematoso sistémico, lupus eritematoso crónico cutáneo y artritis reumatoide en los pacientes cuyos síntomas no han mejorado con otros tratamientos. Se desconoce con exactitud su mecanismo de acción. Sin embargo, se ha sugerido que el principal efecto consiste en la interrupción del procesamiento de los antígenos por parte de las células presentadoras de antígenos.
Un estudio doble ciego, aleatorizado, controlado con placebo, mostró una mejoría significativa en las puntuaciones de calidad de vida en los pacientes con urticaria crónica tratados con hidroxicloroquina, aunque las puntuaciones de actividad de la urticaria no cambiaron significativamente155. Se ha utilizado en el tratamiento del síndrome urticaria vasculitis hipocomplementémica156. Es un fármaco seguro, bien tolerado y económico. Los eventos adversos más comunes incluyen alteraciones gastrointestinales tales como náuseas, diarrea, anorexia, dolor abdominal, y rara vez vómitos. El riesgo de retinopatía es bajo en los primeros 5 años de uso, en dosis de hasta 6.5 mg/kg, pero después de 5 años de uso es de aproximadamente 1%. Puede evitarse mediante un adecuado control oftalmológico.
Dapsona
Las sulfonas son un grupo de fármacos que pueden actuar como antibióticos y como antiinflamatorios. La dapsona es la sulfona con la estructura química más sencilla y actúa inhibiendo la síntesis del folato, con lo que inhibe el crecimiento de los microorganismos. Sus efectos antiinflamatorios se producen a través de diversos mecanismos que finalmente interfieren en el acúmulo de dos tipos de células del sistema inmunitario: los neutrófilos y los eosinófilos.
En dermatología, la dapsona se utiliza para el tratamiento de una gran variedad de procesos. Inicialmente se utilizó como antibiótico para el tratamiento de la lepra, el actinomicetoma y la leishmaniasis cutánea. Posteriormente se fue descubriendo su eficacia en una gran variedad de dermatosis inflamatorias, sobre todo en la dermatitis herpetiforme.
En el tratamiento de la urticaria, la dapsona sola o combinada con otros tratamientos se considera una alternativa terapéutica. En algunos informes y estudios pequeños se ha visto mejoría de la urticaria crónica idiopática y la urticaria por presión retardada157. Ha sido eficaz en diferentes tipos de urticaria crónica/angioedema, incluyendo urticaria crónica espontánea a dosis de 25 a 50 mg por día158. En un estudio abierto aleatorizado, la combinación de dapsona con desloratadina no redujo las puntuaciones de actividad de urticaria en comparación con desloratadina sola, pero se asoció con una tasa significativamente más alta de remisiones completas159.
La dapsona es generalmente bien tolerada, pero rara vez puede causar anemia relacionada con la dosis, junto con neuropatía periférica, erupción cutánea, malestares gastrointestinales, hepatotoxicidad, metahemoglobinemia, discrasias sanguíneas, y reacción cutánea con eosinofilia y síntomas sistémicos (DRESS). Antes del inicio del tratamiento con dapsona se recomienda la determinación del nivel de glucosa-6-fosfato deshidrogenasa (G6PD), dado que la dapsona debe evitarse en pacientes con deficiencia de G6PD por el riesgo de hemólisis grave. Se recomienda monitorización continua de laboratorio para anemia y hepatotoxicidad. En resumen, su uso requiere un seguimiento cuidadoso de los pacientes160.
Sulfasalazina
La sulfasalazina es un antiinflamatorio derivado del ácido 5-aminosalisílico. Se desconoce su mecanismo de acción en la urticaria crónica. Podría ser a través de la disminución de la producción de leucotrienos y prostaglandinas, inhibiendo la degranulación de los mastocitos mediada por IgE y la proliferación de linfocitos B. Se ha utilizado durante muchos años para el tratamiento de enfermedades inflamatorias del intestino y de la artritis reumatoide.
Algunos autores sugieren la eficacia de este fármaco en la urticaria crónica. Hasta 2 g/día son necesarios para un tratamiento eficaz y la respuesta ocurre dentro de1 mes de tratamiento161, 162. Podría ser útil como fármaco para ahorrar en el uso corticosteroides163. En otro trabajo se afirma que la eficacia y la seguridad de la terapia con sulfasalazina en urticaria crónica idiopática es comparable a la de la ciclosporina164.
Los principales efectos adversos incluyen náuseas, vómitos, dispepsia, anorexia y cefalea, con menor frecuencia anormalidades hematológicas, proteinuria, neurotoxicidad y hepatotoxicidad.
Metotrexate
Es un agente antiinflamatorio que también tiene actividad inmunosupresora. El mecanismo de acción poco dilucidado incluye el aumento de los niveles de la adenosina, que inducen apoptosis en las células T CD4+ activadas, y disminución en la quimiotaxis de los neutrófilos. Puede ser de utilidad en algunos casos para no indicar corticosteroides en pacientes con urticaria crónica cortico-dependiente a dosis de 10-15 mg semanales, y en aquellos que no responden a la terapia convencional165, 166.
El metotrexate a dosis bajas se asoció frecuentemente con problemas del tracto gastrointestinal, estomatitis, cefalea, fatiga y anormalidades hematológicas. Complicaciones serias como hepatotoxicidad, toxicidad pulmonar y mielosupresión son menos comunes pero pueden ocurrir inclusive con las dosis utilizadas en la urticaria crónica. Se requiere un control frecuente al usar metotrexate.
Colchicina
Se indica para prevenir las crisis de gota en adultos y para aliviar el dolor de las crisis de gota, cuando ocurren. También para tratar la poliserositis familiar recurrente en adultos y en niños de 4 años o más. Los efectos inhibidores de la colchicina en la urticaria podrían ser debidos a un efecto dual: un bloqueo de la quimiotaxis de los neutrófilos y una reducción de la degranulación de los mastocitos. Ha sido utilizada en algunos pacientes con urticaria vasculitis118.
El evento adverso más común es la diarrea, los efectos adversos graves son poco comunes, y el monitoreo es mínimo.
Agentes inmunosupresores
Ciclosporina
Es un inhibidor de la calcineurina, proteína con actividad fosfatasa que permite la entrada del factor nuclear de células T del citoplasma al núcleo y la expresión del gen de la IL-2 que activa las células T y estimula la secreción de interferón gamma, factor estimulador de colonias de granulocitos y macrófagos. Actúa entonces bloqueando la síntesis de IL-2 provocando una situación de inmunosupresión celular y humoral167, 168. La ciclosporina inhibe la degranulación de mastocitos, como parte de sus efectos. Está indicada en pacientes con urticaria crónica que no han respondido a antihistamínicos y eventualmente en los pocos que no responden al omalizumab. Se usa a dosis de 3-5 mg/kg/día por lo menos durante dos meses. Las dosis y la duración óptima del tratamiento no han sido definidas y no existen criterios predictivos de respuesta169.
Una de las principales preocupaciones con la ciclosporina se relaciona con la seguridad. Una dosis de ciclosporina mayor de 5 mg/kg/día se asocia con aumento en malignidades, infecciones, hipertensión y nefrotoxicidad. Efectos menos graves son más comunes e incluyen hirsutismo, cefalea, parestesias, náusea, y dolor abdominal. Dados estos efectos adversos, la presión sanguínea, la función renal y los niveles de ciclosporina deben evaluarse periódicamente. También debe controlarse la posibilidad de presentar alteraciones metabólicas como hiperglicemia o hiperlipidemia.
La ciclosporina es el agente alternativo con mayor evidencia de eficacia y su uso en pacientes complicados solo está limitado por su toxicidad.
Tacrolimus
Es otro inhibidor de la calcineurina. De forma similar a la ciclosporina, también demostró inhibir la degranulación de células cebadas y de basófilos. Se ha usado con éxito para el tratamiento de la urticaria crónica cortico-dependiente a dosis de 0.5-2 mg/kg/día en 2 tomas170. Un estudio observacional encontró que puede ser eficaz en pacientes que no responden a antihistamínicos171. El tacrolimus tiene efectos adversos graves similares a la ciclosporina; aunque, con menor riesgo de hirsutismo e hiperplasia gingival.
Micofenolato
Es un pro-fármaco del ácido micofenólico, agente inmunosupresor. Este ácido impide la síntesis de las purinas en los linfocitos al inhibir, de forma no competitiva, la enzima inosina monofosfato deshidrogenasa. En la urticaria crónica puede ser efectivo en la disminución del prurito, la duración, el número de habones y los episodios de urticaria/angioedema. Se han utilizado dosis de 500 mg/cada 12 horas durante 2-4 semanas. Tiene pocos efectos secundarios, principalmente gastrointestinales, aunque estos mejoran con el tiempo172. Los pacientes tratados con micofenolato tienen riesgo de infecciones oportunistas, como citomegalovirus y herpes. Se asocia a abortos y a malformaciones congénitas cuando se usa en el embarazo; por lo tanto debe evitarse en mujeres que intentan embarazarse.
Ciclofosfamida
La ciclofosfamida es un agente antineoplásico que también tiene propiedades inmunosupresoras. Pertenece al grupo de las mostazas nitrogenadas. Es un pro-fármaco que necesita ser activado por el sistema de enzimas microsomales hepáticas para ser citotóxico. Se ha comunicado buena eficacia en pacientes con urticaria cortico dependiente por vía intravenosa y oral173, 174. Los efectos adversos son frecuentes y varían en relación con la dosis utilizada y la vía de administración. Se recomienda la administración intravenosa. La mayoría de los efectos secundarios son reversibles con la supresión del fármaco. Los más frecuentes son toxicidad gonadal, urológica y medular, neoplasias e infecciones. Otras manifestaciones tóxicas de menor trascendencia pero frecuentes son alopecia, náuseas y vómitos.
Agentes inmunomoduladores
Omalizumab
Se aborda en detalle en la sección siguiente.
Inmunoglobulina endovenosa
Posee una variedad de actividades inmunomoduladoras que pueden tener potencialmente un rol en la urticaria crónica, como la modulación en la adhesión, la función del complemento, los niveles de citocinas y autoanticuerpos.
Se ha utilizado en urticaria crónica grave, sin respuesta a otros tratamientos, a dosis de 400 mg/kg/día durante 5 días con mejoría clínica que se sostuvo a largo plazo175. También se ha observado buena respuesta en pacientes con urticaria por presión retardada y urticaria solar176. Es relativamente segura con eventos adversos predecibles relacionados a la infusión y rara vez reacciones más graves como reacciones anafilactoides, meningitis aséptica o falla renal. Sin embargo, los datos sobre la eficacia en general son limitados. Aunque de forma típica por lo general es bien tolerada, su costo alto y el requerimiento de infusiones prolongadas limitan su rol en el tratamiento de la urticaria crónica.
Otros agentes inmunomoduladores
Los datos de estos agentes inmunomoduladores se limitan a comunicaciones de casos o series de casos. Los inhibidores del FNT (Inhibidores del factor de necrosis tumoral: etanercept, infliximab, adalimumab) fueron hallados eficaces en un solo paciente con urticaria por presión retardada y en tres pacientes con UC que fueron refractarios a otros agentes alternativos. Rituximab es un anticuerpo monoclonal que tiene como blanco las células B y por lo tanto reduce la producción de anticuerpos. La experiencia sobre su uso en urticaria crónica es limitada. Fue eficaz en dos pacientes con urticaria crónica y angioedema y con poca respuesta a antihistamínicos H1177, 178, mientras que en otro paciente no logró controlar la enfermedad179. Los tratamientos anti IL-1 (anakinra) son tratamientos establecidos en síndromes auto inflamatorios, pero solo pocos informes de casos sugieren la eficacia de la anakinra en la urticaria idiopática por frío y la urticaria por presión retardada.
Otros tratamientos
Anticoagulación/antifibrinolítico
En algunos pacientes con urticaria crónica grave y poca respuesta a antihistamínicos existe un aumento de la trombina debido a la activación de la cascada de la coagulación por la vía extrínseca, y también signos de fibrinólisis con niveles de dímero D aumentados en plasma180,181. Se ha propuesto que la trombina podría incrementar la permeabilidad vascular, activando la degranulación de los mastocitos y la cascada del complemento en ausencia de C3. El dímero D podría servir como marcador de este grupo de pacientes. En ellos, el tratamiento combinado con anticoagulante (heparina) y antifibrinolítico (ácido traxenámico) podría ser de utilidad182. Su eficacia de largo plazo y su inocuidad están lejos aún de ser demostrados.
Plasmaféresis
La plasmaféresis es un procedimiento extracorpóreo, en el cual se separa la sangre extraída del paciente en sus componentes plasma y elementos celulares. Su objetivo principal es remover elementos específicos del plasma que se considera que son mediadores de procesos patológicos. En la urticaria crónica, corresponderían a los autoanticuerpos liberadores de histamina. La plasmaféresis se ha utilizado en UC resistente a tratamiento183. Debe emplearse en combinación con fármacos inmunosupresores. No se recomienda su indicación rutinaria.
Fototerapia
La fototerapia es la terapéutica basada en el uso de fuentes de radiación electromagnética que pueden estar combinadas o no con elementos químicos. Puede realizarse con UVA, UVB o UVB de banda estrecha durante 1-3 meses. Los rayos ultravioletas abarcan una longitud de onda entre 400-100 nanómetros y se subdividen en tres tipos de rayos, que se denominan UVA (400-315 nm), UVB (315-280 nm) y UVC (280-100 nm). La fototerapia reduce el número de mastocitos cutáneos en la dermis superficial. Con UVB de banda estrecha se han visto buenos resultados en la urticaria crónica como tratamiento complementario junto a antihistamínicos. En algunos casos se ha observado una eficacia a largo plazo184.
Nifedipino
Pertenece a los medicamentos llamados bloqueadores de los canales de calcio. Se indica como antihipertensivo y también en ocasiones para tratar el parto prematuro y el síndrome de Raynaud. En la urticaria crónica actuaría modificando la entrada de calcio a los mastocitos cutáneos. Los resultados sobre su utilidad en el tratamiento de la urticaria son contradictorios185, 186.
Antidepresivos tricíclicos
Además de la acción antidepresiva, tienen una potente acción antihistamínica. El más empleado en la urticaria crónica es la doxepina que tiene propiedades de antagonista H1 y H2 a dosis de 10-30 mg/día. Su uso está limitado por sus efectos sedantes y anticolinérgicos que se potencian con el uso de alcohol, y por el riesgo relativo de arritmias cardíacas secundarias al alargamiento del intervalo QT. El tratamiento no debe suspenderse de forma brusca, por riesgo de originar un brote depresivo.
En la Tabla 14 se resume para cada uno de los tratamientos alternativos hasta aquí detallados, la calidad de la evidencia, la fuerza de recomendación, si está autorizado su empleo por la autoridad regulatoria para el tratamiento de la UC y si se encuentra disponible en nuestro país.
Tabla 14. Tratamientos no convencionales en urticaria crónica
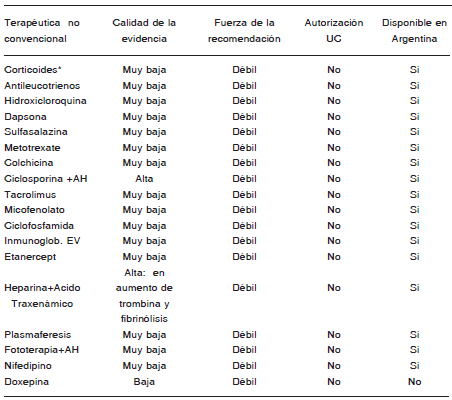
*Corticoides: se recomienda su prescripción a ciclos cortos y en pautas descendentes en el tratamiento de exacerbaciones severas de la UC, especialmente cuando se acompaña de angioedema por el riesgo de dificultad respiratoria secundaria.
Misceláneas
La UC frecuentemente se asocia a una variedad de procesos infecciosos e inflamatorios. En cuanto a las infecciones, la más estudiada es el H. pylori. A pesar de que la asociación con urticaria crónica se confirmó por medio de varios estudios y un metaanálisis39, la erradicación de esta infección en los pacientes afectados no supone automáticamente la desaparición de la urticaria crónica. Otras infecciones bacterianas de nasofaringe, o infecciones dentales, también pueden provocar urticaria. El papel de las infecciones virales, por ejemplo, hepatitis A y B, y las de parásitos, depende en gran medida de la población. En Europa y América del Norte, estos factores no desempeñan un papel importante. Además de intervenir en la patogenia de la urticaria crónica, las infecciones, en especial las virales agudas del tracto respiratorio superior, pueden exacerbar un caso existente de urticaria crónica. La candidiasis intestinal fue considerada una causa importante de urticaria en el pasado, pero no existe evidencia publicada alguna derivada de estudios adecuadamente realizados que respalde su papel etiológico o agravante de la misma.
Los procesos inflamatorios crónicos no infecciosos pueden causar urticaria en un número bajo de pacientes, de forma particular aquellos que sufren de esofagitis por reflujo, gastritis, inflamación de vías biliares y vesícula biliar o, en casos raros, otros trastornos autoinmunes tales como lupus eritematoso sistémico187, 188.
La UC por alimentos mediada por IgE es rara. La exclusión de alimentos de la dieta solo se justifica en aquellos pacientes en los cuales existe una sensibilización comprobada frente a un alimento clínicamente relevante e indudable. En los pacientes con urticaria crónica se observan reacciones pseudoalérgicas a ingredientes alimentarios y aditivos. En estos casos es recomendable la dieta baja en pseudoalergenos naturales y artificiales. Esta dieta debe mantenerse por un periodo mínimo de 4 semanas189. Se ha demostrado que una dieta baja en pseudoalérgenos es útil en el 30-60% de los que sufren urticaria; no obstante, aproximadamente el 50% no muestra una desaparición total de los síntomas, sino solo una reducción de la gravedad de los síntomas187,190,191.
Omalizumab en urticaria crónica
Descripción del fármaco
Omalizumab es un anticuerpo monoclonal (mab) humanizado, que se une selectivamente a la inmunoglobulina E humana (IgE). Su peso molecular es de 149 kD; se obtiene mediante tecnología de ADN recombinante, a partir de una línea celular de ovario de hamster chino192.
κque combina regiones de estructura humana (95%) con regiones determinantes de complementariedad de origen murino (5%) que constituyen el fragmento de unión al antígeno (antigen binding fragment) (Fab) por el cual se une a la IgE. La región Fab de omalizumab se une de manera específica al dominio constante 3 de la cadena pesada de la IgE (Cε3), sitio de la inmunoglobulina que se fija a sus receptores específicos, tanto los de alta como los de baja afinidad (FcεRI, FcεRII, respectivamente)193.
El receptor FcεRI tiene una estructura tetramérica de una cadena a, una cadena β y dos cadenas γ, y se expresa de forma constitutiva en mastocitos y basófilos, células que participan en la fase efectora de la respuesta alérgica. Como se mencionaba anteriormente, es el dominio Cε3 de la cadena pesada de la IgE es el que se fija a los dominios 1 y 2 de la cadena γ de ese receptor. La cadena β aumenta la estabilidad de la unión y la señalización, mientras que el dímero de cadenas γ, compartido por otros receptores para el fragmento Fc de inmunoglobulinas, tiene secuencias de activación basadas en tirosina que participan en la conducción de la señal en el interior de la célula.
La interacción de la IgE con los receptores celulares aumenta la expresión de los mismos, amplificando de esta manera la activación de las células efectoras de la reacción alérgica.
Existe una forma trimérica del receptor que se expresa de modo variable en células presentadoras de antígenos como monocitos, células de Langerhans y células dendríticas periféricas194.
La activación de los receptores FcεRI de la superficie de células dendríticas por IgE aumenta la capacidad presentadora de alérgenos de estas células a linfocitos T y B.
Acción farmacológica y farmacocinética
Se han descripto dos mecanismos de acción principales de omalizumab que intervienen en la inhibición de la respuesta alérgica:
• producción de la cantidad de IgE libre en plasma
• disminución de la expresión de los receptores FcεRI en las células blanco
Se ha demostrado claramente que los inmunocomplejos IgE libre-omalizumab formados en circulación no son capaces de activar el sistema del complemento ni se pueden unir a los receptores de IgE, ya que omalizumab ocupa el sitio Cε3 de la cadena pesada de la inmunoglobulina.
El efecto terapéutico tanto en asma como en rinitis se debería principalmente a estos dos mecanismos. Esto justificaría que la reducción significativa de los síntomas en ambas afecciones tratadas con esta droga se alcance en alrededor de 12 a 16 semanas195.
Se ha comprobado que omalizumab reduce tanto la fase temprana como la tardía de la respuesta inducida por alérgeno en modelos de piel y pulmón. En individuos alérgicos inhibe tanto la fase temprana (24%) como la tardía (63%) de la intradermorreacción; en asmáticos, este efecto es mayor en la fase temprana (80%) de la respuesta alérgica que en la fase tardía (65%).
El mecanismo farmacológico de omalizumab en UC no está totalmente dilucidado y aún es tema de estudio, si bien su actividad anti IgE y la disminución de la expresión de los receptores FcεRI son parte de los mecanismos responsables de la desactivación de los mastocitos y las demás células que participan en la patogenia de la urticaria196,197.
La eficacia de la droga en urticaria es independiente de los niveles de IgE sérica, si bien como ya mencionamos, omalizumab se une a la IgE sérica libre y no a la fijada a células. En varios estudios se comprobó la disminución de la expresión de los receptores de IgE en basófilos y mastocitos. La media de disminución de la expresión de los receptores fue del 73%, con un máximo de inhibición a los 14 días de tratamiento. Se postula que la reducción de los receptores FcεRI podría explicar la eficacia de omalizumab en el tratamiento de la urticaria crónica autoinmune que presenta anticuerpos contra dicho receptor 198,199.
Los datos clínicos y de laboratorio recientes sugieren que el mecanismo de acción de omalizumab en la UC sería multifactorial e involucraría diferentes células y vías de señales que merecen ser estudiados. Como ejemplo, los pacientes con UC activa tienen una repuesta anormal de basófilos y una falla en la vía supresora de la activación del receptor FcεRI, relacionado al déficit de proteína SHIP (src homology 2-containing inositol phosphatase), cursan con basopenia y con reclutamiento de basófilos en las áreas de piel afectadas Cuando la urticaria entra en remisión, la basopenia y expresión de los receptores se revierte.
En la Tabla 15 se resumen algunos de los mecanismos potenciales por los cuales omalizumab actuaría en pacientes con UC.
Tabla 15. Potenciales mecanismos farmacológicos del efecto de omalizumab en pacientes con urticaria crónica espontánea

Racional de la indicación de omalizumab en urticaria crónica
En junio de 2002 omalizumab obtuvo su primera licencia para el tratamiento del asma alérgico moderado a grave en adolescentes y adultos, que en 2009 se extendió a niños a partir de los 6 años.
En la actualidad está indicado como tratamiento adicional para mejorar el control del asma alérgico persistente en adultos, adolescentes y niños de más 6 años200.
A partir del 2006 se informan los primeros pacientes con urticaria alérgica tratados con omalizumab como indicación off label. Tres estudios principales, dos publicados en 2008 y uno en 2011, demostraron beneficios del tratamiento con omalizumab en el 70% de los pacientes con UC que presentaban IgE antitiroperoxidasa201-203.
En la actualidad existe un gran número de casos informados y dos estudios aleatorizados controlados con placebo sobre el uso de omalizumab en UC 204.
El estudio Mystique, con 90 pacientes con UCE, fue un estudio de fase II, de rango de dosis, prospectivo, multicéntrico, aleatorizado (1:1:1:1), doble ciego y controlado con placebo. Se incluyeron cuatro grupos de pacientes aleatorizados con dosis de 600 mg, 300 mg, 150 mg y 75 mg. Cada uno fue evaluado en paralelo contra placebo.
Se administró omalizumab en única dosis al inicio de las cuatro semanas de duración total del tratamiento. Los pacientes fueron seguidos durante 12 semanas.
El objetivo primario del estudio fue el cambio en el UAS7 desde el inicio hasta la semana 4. La reducción en el UAS7 fue de -19,93 para el grupo tratado con omalizumab 300 mg, versus -6,91 para el grupo placebo (p < 0.001). En este estudio se observó que la dosis de 600 mg omalizumab no fue superior en eficacia a la de 300 mg.
En la evaluación de los parámetros de seguridad se observó que experimentaron al menos un efecto adverso 44% de los pacientes en el período de tratamiento y 40.7% en el período de seguimiento. La mayoría de los efectos adversos fueron leves o moderados y no se consideraron relacionados con el fármaco estudiado. No hubo efectos adversos graves clínicos o de laboratorio, ni pacientes fallecidos205.
Basado en los resultados obtenidos en Mystique la FDA aceptó la ejecución de un programa de desarrollo clínico de fase III que comprendió tres estudios diferentes aleatorizados a doble ciego y controlados con placebo, que involucraron a 978 pacientes, denominados Asteria I, Asteria II y Glacial206-208.
En 2014, la Agencia Europea de Medicamentos aprobó el uso de omalizumab como tratamiento de segunda línea de la UCE en pacientes adultos y adolescentes mayores de 12 años con respuesta inadecuada al tratamiento con antihistamínicos H1, tomando como evidencia los 3 estudios pivotales de Fase III en UCE.
Programa de desarrollo clínico
Asteria I, Asteria II y Glacial
Asteria I y Asteria II son dos estudios de eficacia con diseño similar y diferente duración. En Asteria I el período de tratamiento fue de 24 semanas con 4 meses de seguimiento, y en Asteria II la duración del tratamiento fue de 12 semanas, con un periodo de seguimiento de 4 meses. En los dos estudios se compararon las tres dosis de omalizumab (300, 150 y 75 mg) versus placebo. En Asteria I y Asteria II, los pacientes ingresados continuaron con el tratamiento de base, antihistamínicos H1 a dosis aprobadas. Se evaluaron al inicio del estudio la presencia de prurito, los habones hasta ≥ 8 semanas, el UAS7 ≥ 16 durante al menos cuatro de los 7 días en la semana previa a la aleatorización y la puntuación semanal del prurito ≥ 8 durante los siete días previos a la aleatorización. En el estudio Glacial se evaluó la seguridad de omalizumab a dosis de 300 mg durante 24 semanas y con seguimiento posterior a los cuatro meses. Los pacientes incluidos recibieron antihistamínicos H1 hasta cuatro veces la dosis aprobada más un bloqueador H2/antagonista del receptor de leucotrieno. La Tabla 16 resume el diseño de los tres estudios.
Tabla 16. Omalizumab y urticaria crónica. Estudios Fase III
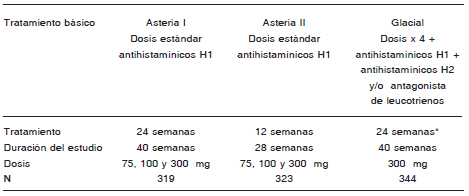
•12 semanas endpoint = eficacia
Al inicio se evaluaron la presencia de prurito y habones hasta > 6 semanas, el UAS7 ≥ 16 durante al menos cuatro de los 7 días en la semana previa a la aleatorización y la puntuación semanal del prurito ≥ 8 durante los siete días previos a la aleatorización.
Las características demográficas de los pacientes en los tres estudios fueron comparables: predomino de mujeres, etnia blanca, edad promedio 42 años e índice de masa corporal elevado, superior a 29.
La mayor parte de los pacientes presentaron urticaria moderada grave, con UAS7 de 31.1 (DE 6.6) en los pacientes de Asteria I; 30.7 (DE 6.8) en los de Asteria II; y 30.9 (DE 6.6) en Glacial.
La media del score semanal de gravedad del prurito (ISS) fue de 14.3 (DE 3.5) en los pacientes de Asteria I; 14.0 (DE 3.7) en Asteria II; y 14.0 (DE 3.6) en Glacial. El 47.5% de los pacientes en Asteria I, 40% de los de Asteria II y 53.1% de los de Glacial presentaron angioedema.
El objetivo primario de los dos estudios Asteria fue el cambio en la puntuación semanal del score de gravedad del prurito (ISS) desde el inicio a la semana 12.
El objetivo primario del estudio Glacial fue evaluar la seguridad. Los tres estudios tuvieron como objetivo secundario evaluar el cambio en el UAS7 entre el inicio y la semana 12; el tiempo transcurrido hasta la respuesta con diferencia mínima importante (MID) en el score semanal de gravedad del prurito (ISS), el cambio en el número de ronchas, el porcentaje de pacientes con UAS7 ≤ 6, los porcentajes de respondedores semanales para la MID de la ISS, los porcentajes de pacientes con días libres de angioedema hasta la semana 12 y el porcentaje de respondedores completos (UAS7 = 0).
Para evaluar el impacto del tratamiento con omalizumab, los pacientes debieron completar el cuestionario de calidad de vida dermatológico. Dentro de los resultados se destaca la mejoría en la reducción del ISS desde el inicio hasta la semana 12 con omalizumab 300 mg, que en Asteria I fue para omalizumab -9.4 versus placebo -3.6 (p < 0.0001), en Asteria II omalizumab -9.8 versus placebo -5.1 y Glacial omalizumab -8.6 versus placebo -4.0 (p < 0.0001).
El tiempo de mejoría fue rápido y la eficacia se mantuvo durante el periodo de tratamiento (12 y 24 semanas). Al suspender el tratamiento en la semana 8 en Asteria II y en la semana 20 en Glacial los síntomas reaparecieron 6 semanas después.
La dosis de 300 mg alcanzó los mejores resultados. En Asteria II el 65.8% los pacientes que recibieron omalizumab a dosis de 300 mg alcanzaron el UAS7 ≤ 6 en la semana 12, en comparación con los tratados con 150 mg (42.7%), 75mg (26.8%) y placebo (19.0%). Los respondedores completos que alcanzaron una UAS7 = 0 en la semana 12 fueron similares en Asteria II (omalizumab 300 mg 44.3%; 150 mg 22.0%; 75 mg 15.95%, placebo 5.1 %). En Glacial el 33.7% de los pacientes alcanzó UAS7 = 0 en la semana 12 versus 4.8% de los que recibieron placebo.
El perfil de seguridad en los tres estudios fue similar y no se hallaron nuevos efectos adversos distintos de los conocidos con omalizumab en el tratamiento del asma alérgico.
En cuanto a los resultados informados por el paciente a través del DLQI y el cuestionario de calidad de vida en UC (CU-Q2oL) hubo una fuerte evidencia del efecto de omalizumab en mejorar la calidad de vida de los pacientes. Con la dosis de 300 mg se observó el mayor cambio del DLQI a la semana 12 en los tres estudios.
Frente a al alto nivel de evidencia, las guías de tratamiento de 2013 de EAACI/GA(2)LEN/EDF/WAO recomiendan incluir a omalizumab como opción de tercera línea en UC33, 209.
En un reciente análisis clínico retrospectivo, por un periodo de 4 años, se evaluó la efectividad de omalizumab 150 mg en pacientes con UCE y UCI grave, en la vida real. En este análisis se evaluaron 51 pacientes con UCE y UCI (14 hombres y 37 mujeres), con diferentes tipos de UCI, como colinérgica, demorada por presión, dermografismo, por frio, solar y por calor. De los 30 pacientes con UCE, 10 tenían formas asociadas de UCI, y 1 paciente tenía dos tipos de UCI. Los 21 pacientes restantes tenían UCI y 1 paciente tenía dos tipos de UCI: colinérgica y por frio. Todos habían recibido antihistamínicos H1 y muchos de ellos recibieron tratamientos de segunda y tercera línea, según las definiciones de las guías de manejo de la urticaria9. No se incluyeron pacientes de ensayos clínicos y el costo del tratamiento estuvo a cargo del seguro de salud.
Se evaluó la eficacia de omalizumab en 21 pacientes con UCE con un registro diario del paciente, número de ronchas y gravedad del prurito 7 días antes de iniciar el tratamiento y 8 semanas de seguimiento al finalizar. Se definió "respuesta completa" de la UCE a la reducción del 90% o más en el UAS7, "mejoría significativa" a la reducción del 30 al 90%, y "no mejoría" a una reducción inferior al 30%. Se obtuvo el score de actividad de urticaria diario y semanal (UAS7 y US1) según las guías EAACI/GA2LEN/EDF/WAO.
En UCI se definió "respuesta completa" a la ausencia de ronchas y de síntomas en la evaluación global del paciente después del test de provocación, "mejoría significativa" a la reducción del 50% o más, o la reducción de los síntomas después de la provocación.
Con omalizumab 150 mg, 25 pacientes con UCE tuvieron repuesta completa, 21 estuvieron controlados, el intervalo óptimo entre dosis fue de cuatro semanas en 15 pacientes, y en 4 se pudo extender a 6-8 semanas pero uno tuvo que acortarse a dos semanas por recaída. De los 15 pacientes con dosis inicial de 150 mg, solo 2 requirieron aumentar la dosis para lograr la remisión completa.
Omalizumab tuvo rápido inicio de acción y los pacientes demostraron mejoría a la semana del tratamiento.
Los pacientes con diversos tipos de UCI se comportaron en forma similar a los pacientes con UCE, con mejorías en las dos primeras semanas. Los pacientes con dermografismo y urticaria por presión parecen responder mejor a omalizumab que aquellos con urticaria colinérgica y urticaria por frío. En los pacientes con angioedema la evolución de los episodios disminuyó en paralelo con la mejoría de la urticaria. El período de recaída de los síntomas fue de 4 a 8 semanas. Los niveles de IgE en plasma demostraron ser irrelevantes en el seguimiento.
Dosis
La dosis aprobada del fármaco en asma es de 0.016 mg/kg por UI/ml de IgE, que se asocia con una reducción de la concentración basal de IgE cercana al 95%.
En urticaria, la estrategia de dosis es diferente. Se buscan dosis fíjas de 300 mg cada 4 semanas, en base a las evidencias clínicas que muestran que los niveles de IgE en plasma en pacientes con UC no son relevantes al momento de elegir la dosis de omalizumab, a diferencia de lo que ocurre en la indicación para su uso en asma.
La mayoría de los pacientes controla los síntomas con la dosis de 300 mg y un porcentaje menor logra el mismo efecto con 150 mg cada 4 semanas. La opinión de los expertos difiere en cuanto a dosis de inicio y estrategia en el tiempo. Sin embargo, la dosis de 300 mg ha demostrado ser más efectiva y es la aprobada por los organismos regulatorios aun cuando muchos pacientes responden bien a 150 mg. No está aún resuelto si los pacientes que mejoran con 300 mg pueden mantener el control disminuyendo a 150 mg, o si se puede comenzar el tratamiento con 150 mg y, eventualmente, aumentar a 300 mg cuando no exista mejoría clínica. Es claro que este debate solo tiene justificación por los costos de la medicación, ya que la seguridad de ambas dosis es similar y la eficacia de la dosis de 300 mg es claramente mayor.
Omalizumab no está aprobado para el tratamiento de las urticarias físicas pero existe abundante evidencia de eficacia de series y pequeños estudios. En una comunicación de tres casos con test positivo de provocación por frío se utilizó la dosis de 300 mg cada dos semanas, en cuatro inyecciones subcutáneas. Todos los pacientes mejoraron después de la primera dosis y obtuvieron completo control de los síntomas después de la segunda aplicación. No hubo efectos adversos, solo eritema en el sitio de aplicación.
Omalizumab fue efectivo para controlar rápidamente los síntomas y restablecer la calidad de vida de los pacientes. Debe mencionarse que, en general, la enfermedad retorna gradualmente al suspenderse el tratamiento, pero se ha demostrado que al reiniciarlo se logra recuperar el control rápidamente.
Seguridad
Se han descripto escasos efectos secundarios y la mayoría de carácter leve. Las reacciones adversas más frecuentes en los ensayos clínicos fueron las reacciones cutáneas en el sitio de inyección, dolor, eritema, tumefacción en el 40% de los pacientes y la aparición de urticaria en el 4.9% de los pacientes (Tabla 17).
Tabla 17. Reacciones adversas descriptas con omalizumab*

Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de frecuencia. Las categorías de frecuencia se definen como: muy frecuentes (≥ 1/10), frecuentes (≥ 1/100 a < 1/10), poco frecuentes (≥ 1/1.000 a < 1/100), raras (≥ 1/10.000 a a < 1/1.000 y muy raras (< 1/10.000). Las reacciones notificadas en la fase de poscomercialización se enumeran con frecuencia no conocida (no puede estimarse a partir de datos disponibles).
a Muy frecuentes en niños de 6 a < 12 años de edad
b En niños de 6 a < 12 años de edad
* Modificada de Francés L, Leiva-Salinas M, Silvestre F. Omalizumab en el tratamiento de la urticaria crónica. Actas Dermo-Sifiliogr2013; 105: 45-52
La anafilaxia es la reacción más grave y se debe a la fracción murina presente en el anticuerpo monoclonal. La Academia Americana de Asma, Alergia e Inmunología creó un registro a partir de 2007 para la denuncia de anafilaxia asociada a omalizumab; la incidencia observada de estos eventos fue del 0.2% en pacientes tratados por asma.
El 61% de los casos ocurrieron dentro de las dos primeras horas posteriores a las tres primeras aplicaciones y el 14% dentro de los primeros 30 minutos luego de la cuarta aplicación o subsiguientes199.
Impacto económico de la urticaria crónica
Aspectos epidemiológicos
La urticaria fue descripta por primera vez por Hipócrates (460-377 a.C.) cuando habló de unas lesiones en la piel producidas por ortigas y mosquitos. Es causa frecuente de consulta en departamentos de emergencia, clínicos generales, pediatras, dermatólogos y alergólogos210. Sin embargo, los estudios epidemiológicos para evaluar la prevalencia de la UA y UC aún son escasos en la literatura internacional.
Luego del estudio retrospectivo realizado por Champion211 basado en la revisión de 554 pacientes en 1969, y el trabajo de Hellgren212 publicado en 1972, se han publicado muy pocos trabajos de prevalencia. Estos dos trabajos informaron para UA tasas del 20% y 17.02% respectivamente, sin precisar la prevalencia estimada de UC. Algunos trabajos, también retrospectivos213, fueron publicados posteriormente con cifras similares. Estos trabajos no diferencian entre distintos tipos de urticaria, adultos o niños.
En Estados Unidos se publicó en 2000, The Practice Parameter for Management of Urticaria and Angioedema, donde se estimó que la prevalencia de urticaria aguda oscilaría entre el 15% y el 24%, sin incluir datos de prevalencia de urticaria crónica.
Más recientemente, la Sociedad Española de Alergia e Inmunología Clínica66 llevó a cabo un estudio poblacional, transversal, en el cual se obtuvo una prevalencia del 0.6% para UC, y una frecuencia cuatro veces mayor en mujeres que en hombres; la incidencia acumulada para UA del 18.72%, con mayor frecuencia en mujeres pero con menor diferencia entre sexos, es muy similar a los datos publicados en 1969 y 1972.
No existen datos latinoamericanos ni argentinos publicados sobre prevalencia de UA y UC en la población de nuestra región.
Impacto económico
Indudablemente, los escasos datos de prevalencia de UC imposibilitan una evaluación global del impacto económico de esta enfermedad crónica. Como toda enfermedad crónica la urticaria ocasiona costos directos e indirectos que se describen a continuación (Tabla 18).
Tabla 18. Costos directos e indirectos de la urticaria crónica

Los estudios farmacoeconómicos para evaluar el costo directo de las enfermedades deben realizarse en cada país, porque los gastos referentes a hospitalización, visitas a emergencias, medicamentos y/o consultas médicas, son diferentes en cada país. Lo mismo ocurre con el análisis de los costos indirectos.
En 2008, Delong y col.214 estimaron que los costos del cuidado de la salud directos e indirectos de 50 pacientes con urticaria crónica, que no habían estado bajo tratamiento con corticoides sistémicos u otros inmunosupresores en el mes precedente, incluyeron como costos directos: medicación utilizada, visitas a consultorios, visitas a emergencias/costos hospitalarios, tests de laboratorio y dos aspectos de los costos indirectos: pérdidas de ganancias ocasionadas por viajes de pacientes ambulatorios y ausentismo, que totalizaron un costo promedio de US$ 2048.56.
El promedio del costo global de la medicación fue de US$ 1280 (antihistamínicos no sedantes y también sedantes, corticoides orales, doxepina, adrenalina autoinyectable, antihistamínicos bloqueadores de H2 y antileucotrienos). El promedio del costo anual de las visitas al consultorio del médico fue de US$ 280, las visitas a emergencias US$ 148 y los test de laboratorio US$ 17. El promedio anual de pérdidas de ganancias relacionadas con el ausentismo laboral fue de US$ 252 y los costos de viaje para asistir a las visitas clínicas US$ 70.
La conclusión de este estudio afirma que el costo de la medicación (US$ 1280) significa el 62.5% de los costos directos totales.
En Latinoamérica no existen datos que evalúen los costos directos para el manejo de la urticaria aguda y crónica, pero podríamos comparar los datos precedentes con los gastos ocasionados para la atención no programada del asma bronquial persistente en adultos, en 10 países de Latinoamérica, que ascienden a US$ 769/año215, sin incluir la medicación.
En Estados Unidos se estimó el costo de la urticaria crónica analizando en los seguros de salud, el uso de atención médica y tratamiento por parte de los asociados, y se halló que aún en pacientes relativamente jóvenes (36 años de edad promedio), y carentes de otras enfermedades, los costos de atención médica son significativos ascienden aproximadamente a US$ 1700 por año en relación directa con el cuidado y el tratamiento de la urticaria216.
Se puede afirmar casi con total seguridad que los costos están subestimados, ya que no se ha incluido la medicación de venta libre, especialmente los antihistamínicos no sedantes. En pacientes con sintomatología, bajo tratamiento con inmunosupresores, es necesario considerar un incremento de los gastos generados por los test de laboratorio, consultas clínicas y la posibilidad de hospitalizaciones.
Debido a que la urticaria crónica es una enfermedad de difícil manejo, los pacientes con cuadros graves necesitan un tratamiento especializado y requieren estrategias farmacológicas de alto costo, como ciclosporina y omalizumab38.
Las terapias inmunomoduladoras, para las cuales hay menos evidencia disponible, incluyen metotrexato, azatioprina, ciclofosfamida y dapsone. Inclusive la plasmaféresis se utilizó con resultado satisfactorio. Los costos asociados con estos tratamientos no se evaluaron formalmente y son significativos.
La UC afecta en grado considerable la calidad de vida de quien la padece, produciendo insatisfacción, ansiedad, pérdida de autoestima, depresión, trastornos del sueño, incapacidad para el desarrollo de las tareas productivas y/o educativas, lo cual impacta en los denominados costos intangibles de las enfermedades crónicas217.
En conclusión, los datos epidemiológicos y el impacto económico de la urticaria crónica son de difícil evaluación, dado la carencia de datos al respecto. Coincidimos con las recomendaciones de la reciente publicación de la Academia Europea de Alergia, donde se requiere el diseño de estudios epidemiológicos que evalúen la prevalencia en niños y adultos y las consecuencias socioeconómicas de la UA y UC, como áreas de investigación a desarrollar en el futuro9.
Aspectos pediátricos del diagnóstico y tratamiento de la urticaria y el angioedema
Si bien la UC en niños tiene una forma de presentación similar a la de los adultos, existen ciertos aspectos distintivos en cuanto a etiología y tratamiento que deben tenerse especialmente en cuenta en este grupo etario.
Suele afectar negativamente la calidad de vida de los pacientes y de su familia del mismo modo que otras enfermedades crónicas como la dermatitis atópica grave, epilepsia, diabetes y asma. Los costos directos son altos y están relacionados a las frecuentes consultas médicas, numerosos exámenes de laboratorio y múltiples tratamientos.
Epidemiología
Existen pocos estudios bien diseñados en niños pero en general se considera que si bien la UA en pediatría es relativamente frecuente (2.1% a 6.7%),218 la UC es una entidad mucho más rara que afecta al 0.1%-0.3 % de los niños219.
La mayoría de los estudios pediátricos disponibles incluyen niños entre 6 y 11 años, pero en realidad el rango de prevalencia es relativamente más amplio, comienza en los primeros años de vida y llega hasta la adolescencia220.
Según algunos autores221, se estima que entre el 50% y 60% de los casos de UC son idiopáticos, 35% a 40% son urticarias físicas y 5% son urticarias vasculíticas aunque, especialmente en los niños, estas últimas son aún menos frecuentes.
Patogénesis de la urticaria crónica en pediatría
En la patogénesis de la UC está involucrada la degranulación de mastocitos y basófilos causando semiológicamente la formación de las típicas ronchas.
En las reacciones de hipersensiblidad inmediata, los individuos se vuelven sensibles a determinados alérgenos produciendo inmunoglobulina E (IgE) alérgeno específica. En un segundo contacto con el agente ofensor, los receptores de alta afinidad de los mastocitos (FcεRI) se activan y, a través de la formación de puentes, producen la liberación de mediadores preformados como histamina y triptasa y otros sintetizados de novo como prostaglandinas y leucotrienos, junto a quimioatractantes y citoquinas. Esto causa vasodilatación, eritema y ronchas.
Otros estímulos reconocidos en la génesis de la urticaria son los anticuerpos de tipo inmunoglobulina G (IgG) anti IgE y anti FcεRI, que actúan también a través de la IgE y del receptor de alta afinidad de los mastocitos. Esto ocurre en la UA.
Existen otros estímulos no inmunológicos como los opiáceos, componentes del complemento (C5 anafilotoxina) y algunos neuropéptidos como la sustancia P que pueden causar la degranulación de los mastocitos por unión a receptores diferentes del FcεRI222. Cualquiera de estos mecanismos puede estar involucrado en la génesis de la UC en pediatría.
Factores etiológicos asociados a urticaria crónica en niños
En los niños, la etiología de la UC solo puede identificarse en aproximadamente el 25% de los casos, a pesar de las múltiples herramientas diagnósticas. El resto de las veces se la identifica como urticaria crónica idiopática.
Infecciones
Si bien representan una causa importante en los casos de urticaria aguda en Pediatría, en los casos de UC su participación es menos clara. Sackensen y col. señalan que las infecciones fueron responsables de un 35% de las UC en 17 casos223 mientras que Kilic y col. no encontraron portadores de infecciones en una casuística de 40 niños con UC224.
La presencia del agente infeccioso muchas veces es poco evidente. De hecho, se ha encontrado más frecuentemente serología positiva para Chlamydia pneumoniae y H. pylori en pacientes asintomáticos que en sintomáticos.
Dentro de los agentes causales se distinguen una amplia variedad de virus (Epstein-Barr), bacterias como estafilococo, estreptococo, H. pylori., Escherichia coli, y parásitos (Blastocystis hominis)24. Hay estudios donde se detectaron exámenes parasitológicos positivos para Toxocara canis, Giardia lamblia y Dientamoeba fragilis en heces de niños con UC225. Muchas veces estas infecciones son silentes y solo algunos de los niños tratados por sus infecciones, sobre todo las parasitarias, resuelven la urticaria.
Drogas
La hipersensibilidad a medicamentos es causa de UC hasta en 17% de los casos pediátricos226. Los agentes terapéuticos usualmente implicados son antibióticos e antiinflamatorios no esteroides. Como estas drogas se indican durante un proceso infeccioso, distinguir como agente causal verdadero entre el agente infeccioso y la droga resulta muchas veces dificultoso.
En el caso de los antiinflamatorios, su mecanismo de acción es a través de la inhibición de la ciclo-oxigenasa, provocando una sobreproducción de leucotrienos (LT) de los cuales el LTC4, LTD4 y LTE4 pueden causar la producción de ronchas por acción directa sobre los vasos sanguíneos pequeños. Esto, más que causa, parecería ser un agravante de la presencia de ronchas en un subgrupo de pacientes con UC.
Alimentos y aditivos
La alergia alimentaria como causa de UC es controversial, en parte porque existen dificultades en distinguir entre alergia verdadera y pseudoalergia, e intolerancia tanto por clínica como por pruebas diagnósticas como son los desafíos a ciertos alimentos.
Como causa de UC, la alergia alimentaria parece ser menos frecuente que en dermatitis atópica. En la literatura, fundamentalmente proveniente de países orientales, se encuentran datos sobre positividad de test cutáneos en 35.1% de 94 pacientes. De ellos, los alimentos más frecuentemente implicados fueron camarón, cangrejo, y otros productos del mar225.
Según Sackensen y col.,223 aproximadamente el 10% de los niños incluidos en su estadística tenían alergia alimentaria. Sin embargo, esta cifra no resulta absolutamente verídica ya que solo se basó en la historia clínica y la IgE positiva, y no en el desafío con el alimento supuestamente ofensor que es el gold standard para el diagnóstico de alergia alimentaria.
Existen algunos estudios que intentaron puntualizar el rol de los aditivos alimentarios, colorantes y preservantes. Su prevalencia oscila entre 21%227 y 2.6%228. Sin embargo, el número de pacientes incluidos en esos estudios es muy pequeño, lo cual impide tener una idea concluyente y recomendar una dieta de evitación como rutina.
Aeroalérgenos
Solo deben ser considerados en casos muy excepcionales como causantes de UC. Solo Volonakis y col.227 han descripto la resolución de la urticaria en niños con alergia a aeroalérgenos cuando la época de polinización finalizó.
Síndromes periódicos asociados a criopirinas
Son síndromes raros que a veces tienen erupciones urticarianas como manifestación sintomática. Son autoinflamatorios y están caracterizados por una desregulación en la liberación de citoquinas debidos a una mutación en el gen CIAS-1 que codifica para criopirinas.
Los pacientes con síndrome autoinflamatorio familiar por frío, síndrome de Muckle-Wells, y enfermedad multisistémica autoinflamatoria de inicio neonatal pueden presentar lesiones urticarianas atípicas y no pruriginosas que empeoran por la noche. En la biopsia de las lesiones predomina un infiltrado neutrofílico en la dermis intersticial reticular. Sin tratamiento, estos pacientes evolucionan con urticaria atípica asociada potencialmente al daño orgánico por inflamación crónica228.
Neoplasias
Algunos estudios asocian UC con neoplasia subyacente en niños. Se ha descripto la asociación con leucemia mieloide aguda, astrocitoma y colangiocarcinoma. Sin embargo, no hay suficiente evidencia determinada por estudios grandes para establecer si existe relación entre UC y neoplasias en edad pediátrica.
Enfermedades autoinmunes
En la bibliografía existen varias enfermedades autoinmunes que se han asociado a UC en Pediatría, incluyendo enfermedad tiroidea, artritis reumatoide juvenil, lupus, diabetes tipo 1 y enfermedad celíaca. Estas asociaciones son menos frecuentes que en los adultos, probablemente debido a que la incidencia de autoinmunidad aumenta junto con la edad y con el desarrollo del sistema inmune. La prevalencia de enfermedad tiroidea autoinmune en niños que padecen UC es variable, oscila entre 14.8%224 y 4.3%229. La mayoría de los pacientes con tiroiditis autoinmune son eutiroides, por lo que los autoanticuerpos parecen determinar una predisposición autorreactiva más que ser una causa por sí mismos.
Caminiti y col. informaron 5% de niños con enfermedad celíaca entre los pacientes con UC.230 Los niños que cumplieron una dieta libre de gluten por 5 a 10 semanas remitieron completamente la UC. Esto parece soportar la hipótesis de que existe una interacción entre la dieta, el aparato gastrointestinal y la piel, que constituye un factor clave en la patogénesis de la urticaria.
Las asociaciones entre la UC y otras enfermedades autoinmunes no han sido suficientemente investigadas.
Desencadenantes físicos
Son la causa más frecuentemente documentada en UC en niños, que puede llegar al 53% de los casos223. Los principales tipos incluyen la urticaria dermográfica, colinérgica, acuagénica, por frio, solar, retardada por presión, vibratoria y la inducida por ejercicio.
Khakoo y col.219 distinguieron en niños tres subtipos principales por su frecuencia: dermográfica (38%), colinérgica (19%) y mixta (17%). En el 67% de los pacientes, la urticaria se acompañó de angioedema. Estos autores señalaron que los niños con urticaria física tienen un curso más prolongado y grave que los que padecen otros tipos de UC.
La urticaria por frío habitualmente es idiopática, aunque existen formas secundarias a infecciones generalmente virales o a crioglobulinemia. La gravedad de los síntomas de la UC por frio en niños no debe ser subestimada, ya que suelen ser graves y pueden ocurrir hasta un 30% de casos de anafilaxia. Incluso se ha recomendado a los niños que padecen urticaria por frío el uso de autoinyectores de adrenalina231.
Cómo estudiar al niño con urticaria crónica
Está uniformemente aceptado que los pilares del diagnóstico son un exhaustivo interrogatorio y un examen físico detallado, ambos tendientes a identificar los agentes causales. La utilidad de los estudios de laboratorio ha sido objeto de una revisión sistemática incluyendo 6.462 pacientes de todas las edades232. Allí se determinó que los estudios de laboratorio son útiles cuando se relacionan con la anamnesis.
Los tests de alergia y la IgE especifica solo se realizan si la historia clínica lo justifica, ya que existe alta probabilidad de resultados falsos positivos.
Si se sospecha autorreactividad se puede solicitar test del suero autológo (ASST) o test de liberación de histamina por los basófilos (BHRA), ya que su positividad podría sugerir la presencia de auto anticuerpos. Su utilidad es muy discutida en niños y el ASST es generalmente mal tolerado en esta etapa de la vida. Por el contrario, si se sospecha urticaria física, la provocación sobre la piel con un objeto romo, con un cubo de hielo, o ejercicio físico, son pruebas útiles, económicas y prácticos para diagnosticar dermografismo, urticaria por frío y urticaria colinérgica, respectivamente.
En algunos casos, acorde a la sugerencia que ofrece una detallada anamnesis, pueden ser útiles un hemograma completo, análisis de orina, marcadores de inflamación, estudios de funcionalidad hepática, estudios para enfermedad celíaca, función tiroidea y anticuerpos antitiroideos, test de provocación física, dietas de eliminación, anticuerpos antinucleares, biopsia de piel, complemento, crioproteínas séricas y screening para enfermedad infecciosa.
Tratamiento
Es muy útil explicar a los pacientes qué es la urticaria y asegurarle que en la mayoría de los casos no hay una enfermedad subyacente grave. Es importante explicar que las causas son difícilmente identificadas, y que el cuadro que padece el niño no es meramente alérgico. A pesar de que los padres suelen tener miedo a la muerte sobre todo si se asocia angioedema, la adrenalina no está indicada. Suele ser útil solicitarles a los pacientes que generen un diario de síntomas detallando cada episodio y los posibles factores desencadenantes153. Si alguno es identificado, se impone intentar evitarlo.
El tratamiento farmacológico tiene como objetivo controlar los síntomas. Los antihistamínicos son la piedra angular para lograr este cometido. Los de primera generación como clorfeniramina y difenhidramina no se recomiendan pues tienen efectos anticolinérgicos, causan deterioro cognitivo y alteran el patrón del sueño en los niños particularmente. Estos efectos fueron particularmente destacados por el GA(2)LEN145. Los antihistamínicos no sedantes de segunda generación son la primera línea de tratamiento. En casos refrectarios, la dosis estándar se aumenta hasta en cuatro veces. Hay que destacar que esta recomendación no tiene suficiente respaldo de alta calidad científica en la población pediátrica. Existen estudios pediátricos con cetirizina, levocetirizina y desloratadina para disminuir los episodios de urticaria en niños con dermatitis atópica233, 234 .
Es necesario realizar estudios a gran escala y comparativos entre los diferentes antihistamínicos para establecer la ecuación riesgo/beneficio de estas drogas en la edad pediátrica para el tratamiento de UC.
Con respecto a los antagonistas anti receptores H2 como cimetidina y ranitidina, no hay evidencias de su utilidad en UC en pediatría. Más aún, algunos autores destacan que es más útil incrementar la dosis de los anti H1 antes que agregar anti H2153.
Otras opciones terapéuticas incluyen ciclosporina y prednisolona como segunda línea de tratamiento235. Sin embargo, la experiencia con drogas inmunomoduladoras es limitada y los corticoides, si bien son efectivos para controlar los síntomas, no deben usarse por períodos prolongados debido a sus conocidos efectos adversos.
Montelukast puede ser utilizado en niños pero su eficacia para controlar los síntomas de UC en población pediátrica no ha sido estudiada suficientemente. A pesar de ello, varias guías recomiendan su utilización junto a antihistamínicos anti H139.
Omalizumab (anti IgE) es una alternativa que se ha probado en adultos y adolescentes con UC207. En un estudio de fase II donde se incluyeron niños de 12 años se informó mejoría significativa del UAS205.
En relación a otros tratamientos que algunas veces han mostrado utilidad en UC en adultos, incluyendo metotrexato, mofetil micofenolato e inmunoglobulina intravenosa, no hay evidencia publicada sobre la utilidad en el tratamiento de UC en pediatría.
Evolución
Los niños con UC y sus padres suelen preguntar si se van a mejorar y si es así, cuándo. Si bien no hay una respuesta certera, es necesario darles una respuesta razonable. En general, los antecedentes personales de alergia y los episodios de recurrencia frecuente se asocian a peor pronóstico236.
Conflicto de intereses: Los autores del presente trabajo declaran que no hubo participación de ningún patrocinador en la preparación del manuscrito y en la decisión de envío para la publicación. Jorge Máspero declara haber recibido honorarios como consultor de Allergy Therapeutics y Sanofi, y subsidios para investigación de Allergy Therapeutics, Novartis, FAES Pharma, AstraZeneca, GlaxoSmithKline y TEVA. Hugo Cabrera declara haber recibido honorarios por conferencias de Novartis. Ledit Ardusso declara haber recibido becas para viajes de asistencia a congresos médicos de GlaxoSmithKline y Merck Sharp & Dohme, honorarios por ensayos clínicos de Novartis, GlaxoSmithKline, Sanofi Aventis y FAES Farma y honorarios por conferencias de Nycomed-Takeda, Casasco y GlaxoSmithKline. Mónica De Gennaro declara haber recibido honorarios por conferencias de FAES Pharma y honorarios por la realización de ensayos de investigación clínica de GlaxoSmithKline. Ramon A. Fernández Bussy declara no tener conflicto de intereses. José Galimany declara honorarios por conferencias de GlaxoSmithKline y Merck Sharp & Dohme, y honorarios por la realización de ensayos de investigación clínica de Novartis. Daniel Galimberti declara subsidios para investigación clínica de Novartis y Eli Lilly. Marta Patricia La Forgia declara honorarios por conferencias de Eurolab, becas para viajes de asistencia a congresos médicos de Panalab y Andrómaco y honorarios por realización de ensayos de investigación clínica de Andrómaco. Iris Medina declara no tener conflicto de intereses. Hugo Neffen declara honorarios por conferencias y becas para viajes de asistencia a congresos médicos de: GlaxoSmithKline, AstraZeneca, MSD y Novartis, y honorarios por realización de ensayos de investigación clínica de GlaxoSmithKline, AstraZeneca, Novartis, Schering-Plough, Aventis Pharma, FAES FARMA S.A., J. URIACH y Compañía S.A., MSD e IVAX Research. Marcelo Label declara honorarios por conferencias del laboratorio ISDIN. Patricia Adriana Troielli declara honorarios por conferencias de Galderma, Allergan, Stiefel-GSK, Janssen-Cilag, Bayer, Beiersdorf, Schering-Plough, La Roche-Posaye ISDIN. Declara participación en estudios de investigación de Galderma, Stiefel-GSK, Janssen-Cilag, La Roche-Posaye ISDIN.
1. Lewis T. The blood vessels of the human skin and their responses. London: Shaw and Sons Ltd., 1927, p 47. [ Links ]
2. Maurer M, Magerl M, Metz M, Zuberbier T. Revisions to the international guidelines on the diagnosis and therapy of chronic urticaria. J Dtsch Dermatol Ges 2013; 11: 971-8. [ Links ]
3. Ring J, Cifuentes L, Möhrenschlage M. Epidemiology in urticaria and angioedema. In: Kaplan A, Greaves M eds. Urticaria and angioedema. New York: Informa Healthcare, 2009, p 15-30. [ Links ]
4. Tamayo-Sanchez L, Ruiz-Maldonado R, Laterza A. Acute annular urticaria in infants and children. Pediatr Dermatol 1997; 14:231-34. [ Links ]
5. Poulos LM, Waters AM, Correl PK, Loblay RH, Marks GB. Trends in hospitalizations for anaphylaxis, angioedema, and urticaria in Australia, 1993-1994 to 2004-2005. J Allergy Clin Immunol 2007; 120: 878-84. [ Links ]
6. Stewart GE. Histopathology of chronic urticaria. Clin Rev Allergy Immunol 2002; 23:195-200. [ Links ]
7. Dahl MV. Clinical pearl: diascopy helps diagnose urticarial vasculitis. J Am Acad Dermatol 1994; 30: 481-2. [ Links ]
8. Kossard S, Hamann I, Wilkinson B. Defining urticarial dermatitis: a subset of dermal hypersensitivity reaction pattern. Arch Dermatol 2006; 142: 29-34. [ Links ]
9. Zuberbier T, Aberer W, Asero R et al. The EAACI/GA2 LEN/EDF/WAO Guideline for the definition, classification, diagnosis, and management of urticaria. Allergy 2014; 69: 868-87. [ Links ]
10. Maurer M, Bindslev-Jensen C, Gimenez-Arnau A, et al. Chronic idiopathic urticaria (CIU) is no longer idiopathic: time for an update. Br J Dermatol 2013; 168: 455-6. [ Links ]
11. Sabroe RA, Fiebiger E, Francis DM, et al. Classification of anti-FcepsilonRI and anti-IgE autoantibodies in chronic idiopathic urticaria and correlation with disease severity. J Allergy Clin Immunol 2002; 110: 492-9. [ Links ]
12. Cugno M, Marzano AV, Asero R, Tedeschi A. Activation of blood coagulation in chronic urticaria: pathophysiological and clinical implications. Intern Emerg Med 2010; 5: 97-101. [ Links ]
13. Criado P, Antinori L, Maruta C, Reis VM. Evaluation of D-dimer serum levels among patients with chronic urticaria, psoriasis and urticarial vasculitis. An Bras Dermatol 2013, 88: 355-60. [ Links ]
14. Pavletic A. Late angio-oedema in patients taking angiotensin-converting-enzyme inhibitors. Lancet 2002; 360: 493-4. [ Links ]
15. Nussberger J, Cugno M, Amstutz C, Cicardi M, Pellacani A, Agostini A. Plasma bradykinin in angio-oedema. Lancet 1998; 351: 1693-7. [ Links ]
16. Caballero T, Baeza ML, Cabañas R, et al. Consensus statement on the diagnosis, management, and treatment of angioedema mediated by bradykinin. Part I. Classification, epidemiology, pathophysiology, genetics, clinical symptoms, and diagnosis. J Investig Allergol Clin Immunol 2011; 21: 333-47. [ Links ]
17. Kaplan AP, Greaves MW. Angioedema. J Am Acad Dermatol 2005; 53: 373-88. [ Links ]
18. Wiggins CA, Dykewicz MS, Patterson R. Idiopathic anaphylaxis: classification, evaluation, and treatment of 123 patients. J Allergy Clin Immunol 1988; 82: 849-55. [ Links ]
19. Patterson R, Stoloff RS, Greenberger DA, Grammer LC, Harris KE. Algorithms for the diagnosis and management of idiopathic anaphylaxis. Ann Allergy 1993; 71:40-4. [ Links ]
20. Zuberbier T, Maurer M. Urticaria: current opinions about etiology, diagnosis and therapy. Acta DermVenereol 2007; 87:196-205. [ Links ]
21. Kulthanan K, Chiawsirikajorn Y, Jiamton S. Acute urticaria: etiologies, clinical course and quality of life. Asian Pac J Allergy Immunol 2008; 26:1-9. [ Links ]
22. Grattan CE, Sabroe RA, Greaves MW. Chronic urticaria. J Am Acad Dermatol 2002; 46: 645-57. [ Links ]
23. Charlesworth EN, Hood AF, Soter NA, Kagey-Sobotka A, Norman PS, Lichtenstein LM. Cutaneous late-phase response to allergen. Mediator release and inflammatory cell infiltration. J Clin Invest 1989; 83: 1519-26. [ Links ]
24. Haas N, Schadendorf D, Henz BM. Differential endothelial adhesion molecule expression in early and late whealing reactions. Int Arch Allergy Immunol 1998; 115: 210-4. [ Links ]
25. Shakouri A, Compalati E, Lang DM, Khan DA. Effectiveness of Helicobacter pylori eradication in chronic urticaria: evidence-based analysis using the Grading of Recommendations Assessment, Development, and Evaluation system. Curr Opin Allergy Clin Immunol 2010; 10: 362-9. [ Links ]
26. Grattan CEH, Francis DM. Autoimmune urticaria. Adv Dermatol 1999; 15: 311-40. [ Links ]
27. Hide M, Francis DM, Grattan CE, Hakimi J, Kochan JP, Greaves MW. Autoantibodies against the high-affinity IgE receptor as a cause of histamine release in chronic urticaria. N Engl J Med 1993; 328: 1599-604. [ Links ]
28. Ormerod AD, Kobza Black A, Dawes J, et al. Prostaglandin D2 and histamine release in cold urticaria unaccompanied by evidence of platelet activation. J Allergy Clin Immunol 1988; 82: 586-9. [ Links ]
29. Kaplan AP, Greaves M. Pathogenesis of chronic urticaria. Clin Exp Allergy 2009, 39: 777-87. [ Links ]
30. Eckman JA, Hamilton RG, Gober LM, Sterba PM, Saini SS. Basophil phenotypes in chronic idiopathic urticaria in relation to disease activity and autoantibodies. J Invest Dermatol 2008; 128: 1956-63. [ Links ]
31. Fraser K, Robertson L. Chronic urticaria and autoimmunity. Skin Therapy Lett 2013; 18: 5-9. [ Links ]
32. Alpay A, Solak Tekin N, Tekin IÖ, Altinyazar HC, Koca R, Cinar S. Autologous serum skin test versus autologous plasma skin test in patients with chronic spontaneous urticaria. Dermatol Res Pract 2013; 2013: 267278. [ Links ]
33. Asero R, Tedeschi A, Riboldi P, Griffini S, Bonanni E, CugnoM. Severe chronic urticaria is associated with elevated plasma levels of D-dimer. Allergy 2008; 6:176-80. [ Links ]
34. Zuberbier T, Asero R, Bindslev-Jensen C et al. EAACI/GA(2)LEN/EDF/WAO guideline: definition, classification and diagnosis of urticaria. Allergy 2009; 64: 1417-26. [ Links ]
35. Magerl M, Borzova E, Gimenez-Arnau A, et al. The definition and diagnostic testing of physical and cholinergic urticarias-EAACI/GA2LEN/EDF/UNEV consensus panel recommendations. Allergy 2009; 64: 1715-2. [ Links ]
36. Abajian M, Schoepke N, Altrichter S, Zuberbier HC, Maurer M. Physical urticarias and cholinergic urticaria. Immunol Allergy Clin North Am 2014; 34: 73-88. [ Links ]
37. Kobza Black A. Physical and cholinergic urticarias. In: Kaplan A, Greaves M eds. Urticaria and angioedema. New York: Informa Healthcare, 2009, p 181-216. [ Links ]
38. Cohen RW, Rosenstreich DL. Discrimination between urticaria-prone and other allergic patients by intradermal skin testing with codeine. J Allergy Clin Immunol 1986; 77: 802-7. [ Links ]
39. Zuberbier T, Asero R, Bindslev-Jensen C, et al. EAACI/GA(2)LEN/EDF/WAO guideline: management of urticaria. Allergy 2009; 64:1427-43. [ Links ]
40. Steinhoff M, Steinhoff A, Homey B, Luger TA, Schneider SW. Role of vasculature in atopic dermatitis. J Allergy Clin Immunol 2006; 118:190-7. [ Links ]
41. Kanwar AJ, Dhar S, Kaur S. Evaluation of minor clinical features of atopic dermatitis. Pediatr Dermatol 1991; 8:114-6. [ Links ]
42. Mathelier-Fusade P, Vermeulen C, Leynadier F. Vibratory angioedema. Ann Dermatol Venereol 2001; 128:750-2. [ Links ]
43. Mathelier-Fusade P, Leynadier F. Cold urticaria. Ann Dermatol Venereol 1994; 121: 429-33. [ Links ]
44. Wanderer AA. Cold urticaria syndromes: historical background, diagnostic classification, clinical and laboratory characteristics, pathogenesis, and management. J Allergy Clin Immunol 1990; 85: 965-81. [ Links ]
45. Wedi B, Raap U, Wieczorek D, Kapp A. Urticaria and infections. Allergy Asthma Clin Immunol 2009; 5:10. [ Links ]
46. Abajian M, Mlynek A, Maurer M. Physical urticaria. Curr Allergy Asthma Rep 2012; 12: 281-7. [ Links ]
47. Bito T, Sawada Y, Tokura Y. Pathogenesis of cholinergic urticaria in relation to sweating. Allergol Int 2012; 61 :539-44. [ Links ]
48. Horikawa T, Fukunaga A, Nishigori C. New concepts of hive formation in cholinergic urticaria. Curr Allergy Asthma Rep 2009; 9:273-9. [ Links ]
49. Adachi J, Aoki T, Yamatodani A. Demonstration of sweat allergy in cholinergic urticaria. J Dermatol Sci 1994; 7: 142-9. [ Links ]
50. Takahagi S, Tanaka T, Ishii K, et al. Sweat antigen induces histamine release from basophils of patients with cholinergic urticaria associated with atopic diathesis. Br J Dermatol 2009; 160: 426-8. [ Links ]
51. Guerra L, Rogkakou A, Massacane P, et al. Role of contact sensitization in chronic urticaria. J Am Acad Dermatol 2007; 56: 88-90. [ Links ]
52. Magen E, Mishal J, Menachem S. Impact of contact sensitization in chronic spontaneous urticaria. Am J Med Sci 2011; 341:202-6. [ Links ]
53. Zuberbier T. Chronic Urticaria. Curr Allergy Asthma Rep 2012; 12: 267-72. [ Links ]
54. Fiebiger E, Hammerschmid F, Stingl G, Maurer D. Anti-FcepsilonRIalpha autoantibodies in autoimmune-mediated disorders. Identification of a structure-function relationship. J Clin Invest 1998; 101: 243-51. [ Links ]
55. Lezhoff A, Jasse RG, Denburg J, Dolovich J. Association o chronic urticaria and angioedema with thyroid autoimmunity. Arch Dermatol 1983; 119: 636-40. [ Links ]
56. Konstantinou GN, Asero R, Ferrer M et al. EAACI taskforce position paper: evidence for autoimmune urticaria and proposal for defining diagnostic criteria. Allergy 2013; 68: 27-36. [ Links ]
57. Grattan CE, Francis DM, Hide M, Greaves MW. Detection of circulating histamine releasing autoantibodies with functional properties of anti-IgE in chronic urticaria. Clin Exp Allergy1991; 21: 695-704. [ Links ]
58. Du Toit G, Prescott R, Lawrence P, et al. Autoantibodies to the high-affinity IgE receptor in children with chronic urticaria. Ann Allergy Asthma Immunology 2006; 96: 341-4. [ Links ]
59. Brunetti L, Francavilla R, Miniello VL, et al. High prevalence of autoimmune urticaria in children with chronic urticaria. J Allergy Clin Immunology 2004; 114: 922-7. [ Links ]
60. Sabroe RA, Fiebiger E, Francis DM et al. Classification of anti-FcepsilonRI and anti-IgE autoantibodies in chronic idiopathic urticaria and correlation with disease severity. J Allergy Clin Immunol 2002; 110: 492-9. [ Links ]
61. Ferrer M, Nakazawa K, Kaplan AP. Complement dependence of histamine release in chronic urticaria. J Allergy Clin Immunol 1999; 104: 169-72. [ Links ]
62. Puccetti A, Bason C, Simeoni S et al. In chronic idiopathic urticaria autoantibodies against Fc epsilonRII/CD23 induce histamine release via eosinophil activation. Clin Exp Allergy 2005; 35: 1599-1607. [ Links ]
63. Grattan CE, D'Cruz DP, Francis DM, Whiston C, Hughes GR, Greaves MW. Antiendothelial cell antibodies in chronic urticaria. Clin Exp Rheumatol 1995; 13: 272-3. [ Links ]
64. Altrichter S, Peter HJ, Pisarevskaja D, Metz M, Martus P, Maurer M. IgE mediated autoallergy against thyroid peroxidase - a novel pathomechanism of chronic spontaneous urticaria? PLoS One 2011; 6: e14794. [ Links ]
65. Yasnowsky KM, Dreskin SC, Efaw B, et al. Chronic urticaria sera increase basophil CD203c expression. J Allergy Clin Immunol 2006; 117: 1430-4. [ Links ]
66. Gaig P, Olona M, Muñoz Lejarazu D, et al. Epidemiology of urticaria in Spain. J Investig Allergol Clin Immunol 2004; 14:214-20. [ Links ]
67. Najib U, Bajwa ZH, Ostro MG, Sheikh J. A retrospective review of clinical presentation, thyroid autoimmunity, laboratory characteristics, and therapies used in patients with chronic idiopathic urticaria. Ann Allergy Asthma Immunol 2009; 103: 496-501. [ Links ]
68. Leznoff A, Sussman GL. Syndrome of idiopathic chronic urticaria and angioedema with thyroid autoimmunity: a study of 90 patients. J Allergy Clin Immunol 1989; 84: 66-71. [ Links ]
69. Hollowell JG, Staehling NW, Flanders DW, et al. Serum TSH, T(4), and thyroid antibodies in the United States population (1988 to 1994): National Health and Nutrition Examination Survey. J Clin Endocrinol Metab 2002; 87: 489-99. [ Links ]
70. Dreskin SC, Andrews KY. The thyroid and urticaria. Curr Opin Allergy Clin Immunol 2005; 5: 408-12. [ Links ]
71. Aversano M, Caiazzo P, Iorio G, Ponticiello L, Laganá B, Leccese F. Improvement of chronic idiopathic urticaria with L-thyroxine: a new TSH role in immune response? Allergy 2005: 60; 489-93. [ Links ]
72. Tobón GJ, Youinou P, Saraux A. The environment, geo-epidemiology, and autoimmune disease: Rheumatoid arthritis. Autoimmun Rev 2010; 9: A288-92. [ Links ]
73. Konstantinou GN, Asero R, Maurer M, Sabroe RA, Schmid-Grendelmeier P, Grattan CE. EAACI/GA(2)LEN task force consensus report: the autologous serum skin test in urticaria. Allergy 2009; 64:1256-68. [ Links ]
74. O'Donnell B. Urticaria: impact on quality of life and economic cost. Immunol Allergy Clin North Am 2014; 34: 89-104. [ Links ]
75. Castellvi P, Ferrer M, Alonso J et al. The patient-reported outcomes in research: definition, impact, classification, measurement and assessment. Med Clin (Barc) 2013; 141: 358-65. [ Links ]
76. Baiardini I, Braido F, Bindslev-Jensen C et al. Recommendations for assessing patient-reported outcomes and health-related quality of life in patients with urticaria: a GA(2)LEN taskforce position paper. Allergy 2011; 66: 840-4. [ Links ]
77. Baiardini I, Bousquet PJ, Brzoza Z, et al. Recommendations for assessing patient-reported outcomes and health-related quality of life in clinical trials on allergy: a GA(2)LEN taskforce position paper. Allergy 2010; 65: 290-5. [ Links ]
78. Both H, Essink-Bot ML, Busschbach J, Nijsten T. Critical review of generic and dermatology-specific health-related quality of life instruments. J Invest Dermatol 2007; 127: 2726-39. [ Links ]
79. Finlay AY, Khan GK. Dermatology Life Quality Index (DLQI)-a simple practical measure for routine clinical use. Clin Exp Dermatol 1994; 19: 210-6. [ Links ]
80. Weldon D. Quality of life in patients with urticaria and angioedema: Assessing burden of disease. Allergy Asthma Proc 2014; 35: 4-9. [ Links ]
81. Baiardini I, Pasquali M, Braido F, et al. A new tool to evaluate the impact of chronic urticaria on quality of life: chronic urticaria quality of life questionnaire (CU-QoL). Allergy 2005; 60: 1073-8. [ Links ]
82. Mlynek A, Zalewska-Janowska A, Martus P, Staubach P, Zuberbier T, Maurer M. How to assess disease activity in patients with chronic urticaria? Allergy 2008; 63: 777-80. [ Links ]
83. Weller K, Groffik A, Magerl M, et al. Development and construct validation of the angioedema quality of life questionnaire. Allergy 2012; 67: 1289-98. [ Links ]
84. O'Donnell BF, Lawlor F, Simpson J, Morgan M, Greaves MW. The impact of chronic urticaria on the quality of life. Br J Dermatol 1997; 136:197-201. [ Links ]
85. Conrad R, Geiser F, Haidl G, Hutmacher M, Liedtke R, Wermter F. Relationship between anger and pruritus perception in patients with chronic idiopathic urticaria and psoriasis. J eur Acad Dermatol Venereol 2008; 22: 1062-9. [ Links ]
86. Grob JJ, Revuz J, Ortonne JP, Auquier P, Lorette G. Comparative study of the impact of chronic urticaria, psoriasis and atopic dermatitis on the quality of life. Br J Dermatol 2005; 152: 289-95. [ Links ]
87. Hergüner S, Kiliç¸ G, Karakoç S, Tamay Z, Tüzün U, Güler N. Levels of depression, anxiety and behavioural problems and frequency of psychiatric disorders in children with chronic idiopathic urticaria. Br J Dermatol 2011; 164: 1342-7. [ Links ]
88. Beattie PE, Lewis-Jones MS. A comparative study of impairment of quality of life in children with skin disease and children with other chronic childhood diseases. Br J Dermatol 2006; 155:145-51. [ Links ]
89. Kossard S, Hamann I, Wilkinson B. Defining urticarial dermatitis: a subset of dermal hypersensitivity reaction pattern. Arch Dermatol 2006; 142: 29-34. [ Links ]
90. Fung MA. The clinical and histopathologic spectrum of "dermal hypersensitivity reactions", a nonspecific histologic diagnosis that is not very useful in clinical practice, and the concept of a "dermal hypersensitivity reaction pattern". J Am Acad Dermatol 2002; 47:898-907. [ Links ]
91. Rietschel RL. A clinician's view of urticarial dermatitis. Arch Dermatol 2006; 142: 932-3. [ Links ]
92. Tharp MD. Top-accessed article: Defining urticarial dermatitis. Arch Dermatol 2011; 147:1436. [ Links ]
93. Helaskoski E, Suojalehto H, Virtanen H, et al. Occupational asthma, rhinitis, and contact urticaria caused by oxidative hair dyes in hairdressers. Ann Allergy Asthma Immunol 2014; 112: 46-52. [ Links ]
94. Urosevic-Maiwald M, Kerl K, Harr T, Bogdan Allemann I. Dapsone-induced erythema multiforme with neutropenia in a patient with linear IgA dermatosis: case report and review of the literature. Int J Dermatol 2013; 52: 1369-71. [ Links ]
95. Rodríguez-Pazos L, Gómez-Bernal S, Rodríguez-Granados MT, Toribio J. Photodistributed erythema multiforme. Actas Dermosifiliogr 2013; 104: 645-53. [ Links ]
96. Iking A, Grundmann S, Chatzigeorgakidis E, Phan NQ, Klein D, Ständer S. Prurigo as a symptom of atopic and non-atopic diseases: aetiological survey in a consecutive cohort of 108 patients. J Eur Acad Dermatol Venereol 2013; 27: 550-7. [ Links ]
97. Lehrhoff S, Pomeranz MK. Specific dermatoses of pregnancy and their treatment. Dermatol Ther 2013; 26: 274-84. [ Links ]
98. Ghazeeri G, Kibbi AG, Abbas O. Pruritic urticarial papules and plaques of pregnancy: epidemiological, clinical, and histopathological study of 18 cases from Lebanon. Int J Dermatol 2012; 51: 1047-53. [ Links ]
99. Bean SF, Michel B, Furey N, Thorne G, Meltzer L. Vesicular pemphigoid. Arch Dermatol 1976; 112: 1402-4. [ Links ]
100. Ikeda T, Okamoto K, Furukawa F. Case of atypical bullous pemphigoid with generalized pruritus and eczema as the prodrome for 10 years. J Dermatol 2012; 39: 720-1. [ Links ]
101. Mussani F, Siddha S, Rosen CF. Figurate erythema: an unusual presentation of the nonbullous phase of bullous pemphigoid. J Cutan Med Surg 2012; 16: 61-3. [ Links ]
102. Lamb PM, Patton T, Deng JS. The predominance of IgG4 in prodromal bullous pemphigoid. Int J Dermatol 2008; 47: 150-3. [ Links ]
103. Kaplan A, Greaves M, Grattan C. Diagnostic Technique for Urticaria. In: Kaplan A, Greaves M eds. Urticaria and angioedema. New York: Informa Healthcare, 2009, p 141-52. [ Links ]
104. Siegert CE, Kazatchkine MD, Sjöholm A, Würzner R, Loos M, Daha MR. Autoantibodies against C1q: view on clinical relevance and pathogenic role. Clin Exp Immunol 1999; 116: 4-8. [ Links ]
105. Reunala T. Papular urticaria and angioedema. In: Kaplan A, Greaves M, eds. Urticaria and angioedema. New York: Informa Healthcare, 2009, p 243-50. [ Links ]
106. Hernandez RG, Cohen BA. Insect bite-induced hypersensitivity and the SCRATCH principles: a new approach to papular urticaria. Pediatrics 2006; 118: e189-96. [ Links ]
107. Howard R, Frieden IJ. Papular urticaria in children. Pediatr Dermatol 1996; 13: 246-9. [ Links ]
108. Peng Z, Simons FE. A prospective study of naturally acquired sensitization and subsequent desensitization to mosquito bites and concurrent antibody responses. J Allergy Clin Immunol 1998; 101: 284-6. [ Links ]
109. Valent P, Akin C, Escribano L, et al. Standards and standardization in mastocytosis: consensus statements on diagnostics, treatment recommendations and response criteria. Eur J Clin Invest 2007; 37: 435-53. [ Links ]
110. Martinez B, Metcalfe D, Wilson T. Systemic Mastocytosis, In: Kaplan A, Greaves M, eds. Urticaria and angioedema. New York: Informa Healthcare, 2009, p 409-24. [ Links ]
111. Krause K, Grattan CE, Bindslev-Jensen C, et al. How not to miss autoinflammatory diseases masquerading as urticaria. Allergy 2012; 67: 1465-74. [ Links ]
112. Chow SK. Management of chronic urticaria in Asia: 2010 AADV consensus guidelines. Asia Pac Allergy 2012; 2: 149-60. [ Links ]
113. Veleiro Pérez B, Rico Díaz MA, Vila Sexto L. Alergia, urticaria de contacto y síndromes urticariformes inducidos por frío. Galicia Clin 2012; 73: 151-9. [ Links ]
114. Gimenez-Arnau A, Maurer M, De la Cuadra J, Maibach H. Immediate contact skin reactions, an update of contact urticaria, contact urticaria syndrome an protein contact dermatitis - "A Never Ending Story". Eur J Dermatol 2010; 20: 522-62. [ Links ]
115. Leech S. Recurrent urticaria. Paediatr Child Health 2011; 22: 281-6. [ Links ]
116. Pedraz J, Daudén E, García-Diez A. Manejo práctico del déficit de C1 inhibidor. Actas Dermosifiliogr 2007; 98: 240-9. [ Links ]
117. Álvarez Amador G, Medeiros Marques SR, Curbelo Alonso M. Urticaria: definición, clasificación, diagnóstico y tratamiento. En:http://bvs.sld.cu/revistas/fdc/vol5_3_11/fdc06311.htm; consultado el 17/07/2014. [ Links ]
118. Curto-Barredo L, Silvestre JF, Giménez-Arnau AM. Actualización en el tratamiento de la urticaria crónica. Actas Dermosifiliogr 2014; 105: 469-82. [ Links ]
119. Kanani A, Schellenberg R, Warrington R. Urticaria and angioedema. Allergy Asthma Clin Immunol 2011; 7 Suppl 1: S9. [ Links ]
120. Kaplan AP. Clinical practice. Chronic urticaria and angioedema. N Engl J Med 2002; 346: 175-9. [ Links ]
121. Simons FE, Akdis CA. Histamine and H1-antihistamines. In: Adkinson NF, Bochner B, Wesley Burks A, Busse W, Holgate ST, Lemanske R, and O'Hehir R, eds. Middleton´s Allergy: principles and practice, 8th ed. Philadelphia, Elsevier Saunders, 2014, p 1503-33. [ Links ]
122. Simons FE, Simons KJ. Histamine and H1-antihistamines: celebrating a century of progress. J Allergy Clin Immunol 2011; 128: 1139-50. [ Links ]
123. Le Coniat M, Traiffort E, Ruat M, Arrang JM, Berger R. Chromosomal localization of the human histamine H1-receptor gene. Hum Genet 1994; 94: 186-8. [ Links ]
124. Nijmeijer S, Leurs R, Vischer HF. Constitutive activity of the histamine H(1) receptor. Methods Enzymol 2010; 484: 127-47. [ Links ]
125. Simons FE. Advances in H1-antihistamines. N Engl J Med 2004; 351: 2203-17. [ Links ]
126. Ash AS, Schild HO. Receptors mediating some actions of histamine. Br J Pharmacol Chemother 1966; 27: 427-39. [ Links ]
127. Milligan G, Bond RA, Lee M. Inverse agonism: pharmacological curiosity or potential therapeutic strategy? Trends Pharmacol Sci 1995; 16: 10-3. [ Links ]
128. Togias A. H1-receptors: localization and role in airway physiology and in immune functions. J Allergy Clin Immunol 2003; 112: S60-8. [ Links ]
129. Leurs R, Smit MJ, Timmerman H. Molecular and pharmacological aspects of histamine receptors. Pharmacol Ther 1995; 66: 413-63. [ Links ]
130. Smit MJ, Hoffmann M, Timmerman H, Leurs R. Molecular properties and signalling pathways of the histamine H1 receptors. Clin Exp Allergy 1999; 29 Suppl 3: 19-28. [ Links ]
131. Bakker RA, Schoonus SB, Smit MJ, Timmerman H, Leurs R. Histamine H(1)-receptor activation of nuclear factor-kappa B: roles for G beta gamma- and G alpha (q/11)-subunits in constitutive and agonist-madiated signaling. Mol Pharmacol 2001; 60: 1133-42. [ Links ]
132. Aoki Y, Qiu D, Zhao GH, Kao PN. Leukotriene B4 mediates histamine induction of NF-kappaB and IL-8 in human bronchial epithelial cells. Am J Physiol 1998; 274: L1030-9. [ Links ]
133. O´Mahony L, Akdis M, Akdis CA. Regulation of the immune response and inflammation by histamine receptors. J Allergy Clin Immunol 2011; 128: 1153-62. [ Links ]
134. MacGlashan D Jr. Histamine: A mediator of inflammation. J Allergy Clin Immunol 2003; 112: S53-9. [ Links ]
135. Church MK. Comparative inhibition by bilastine and cetirizine of histamine-induced wheal and flare responses in humans. Inflamm Res 2011; 60: 1107-12. [ Links ]
136. Pigatto P, Valsecchi RH. Urticarias. In: Giannetti A, Galimberti R, eds. Tratado de dermatología Vol 2. Padova: Piccin-Nuova Libraria, 2011, p 989-1008.
137. Church MK, Gillard M, Sargentini-Maier ML, Poggesi I, Campbell A, Benedetti MS. From pharmacokinetics to therapeutics. Drug Metab Rev 2009; 41: 455-74. [ Links ]
138. Bailey DG. Fruit juice inhibition of uptake transport: a new type of food-drug interaction. Br J Clin Pharmacol 2010; 70: 645-55. [ Links ]
139. Simons FE, Simons KJ. Levocetirizine: pharmacokinetics and pharmacodynamics in children age 6 to 11 years. J Allergy Clin Immunol 2005; 116: 355-61. [ Links ]
140. Gupta SK, Kantesaria B, Banfield C, et al. Desloratadine dose selection in children aged 6 months to 2 years: comparison of population pharmacokinetics between children and adults. Br J Clin Pharmacol 2007; 64: 174-84. [ Links ]
141. Jones DH, Romero FA, Casale TB. Time-dependent inhibition of histamine-induced cutaneous responses by oral and intramuscular diphenhydramine and oral fexofenadine. Ann Allergy Asthma Immunol 2008; 100: 452-6. [ Links ]
142. Simons FE, Silver NA, Gu X, Simons KJ, et al. Skin concentrations of H1-receptor antagonists. J Allergy Clin Immunol 2001; 107: 526-30. [ Links ]
143. McDonald K, Trick L, Boyle J. Sedation and antihistamines: an update. Review of inter-drug differences using proportional impairment ratios. Hum Psychopharmacol 2008; 23: 555-70. [ Links ]
144. Weiler JM, Bloomfield JR, Woodworth GG, et al. Effects of fexofenadine, diphenhydramine, and alcohol on driving performance. A randomized, placebo-controlled trial in the Iowa driving simulator. Ann Intern Med 2000; 132: 354-63. [ Links ]
145. Church MK, Maurer M, Simons, et al. Risk of first-generation H(1)-antihistamines: a GA(2)LEN position paper. Allergy 2010; 65: 459-66. [ Links ]
146. Wyngaarden JB, Seevers MH. The toxic effects of anthistaminic drugs. J Am Med Assoc 1951; 145: 277-82. [ Links ]
147. Bebarta VS, Blair HW, Morgan DL, Maddry J, Borys DJ. Validation of the American Association of Poison Control Centers out of hospital guideline for pediatric diphenhydramine ingestions. Clin Toxicol (Phila) 2010; 48: 559-62. [ Links ]
148. Woosley RL. Cardiac actions of antihistamines. Annu Rev Pharmacol Toxicol 1996; 36: 233-52. [ Links ]
149. Stevenson J, Cornah D, Evrard P, et al. Long-term evaluation of the impact of the h1-raceptor antagonist cetirizine on the behavioral, cognitive and psychomotor development of very young children with atopic dermatitis. Pediatr Res 2002; 52: 251-7. [ Links ]
150. Weber-Schoendorfer C, Schaefer C. The safety of cetirizine during pregnancy. A prospective observational cohort study. Reprod Toxicol 2008; 26: 19-23. [ Links ]
151. Khan DA. Alternative agents in refractory chronic urticaria: evidence and considerations on their selection and use. J Allergy Clin Immunology Pract 2013; 1: 433-40. [ Links ]
152. Asero R, Tedeschi A. Usefulness of a short course of oral prednisone in antihistamine-resistant chronic urticaria: a retrospective analysis. J Investig Allergol Clin Immunol 2010; 20:386-90. [ Links ]
153. Powel RJ, Du Toit GL, Siddique N, et al. BSACI guidelines for the management of chronic urticaria and angiooedema. Clin Exp Allergy 2007; 37: 631-50. [ Links ]
154. Poonawalla T, Kelly B. Urticaria. A review. Am J Clin Dermatol 2009; 10: 9-21. [ Links ]
155. Reeves GE, Boyle MJ, Bonfield J, Dobson P, Loewenthal M. Impact of hydroxychloroquine therapy on chronic urticaria: chronic autoimmune urticaria study and evaluation. Intern Med J 2004; 34:182-6. [ Links ]
156. Lopez LR, Davis KC, Kohler PF, Schocket AL. The hypocomplementemic urticarial-vasculitis syndrome: therapeutic response to hydroxychloroquine. J Allergy Clin Immunol 1984; 73: 600-3. [ Links ]
157. Boehm I, Bauer R, Bieber T. Urticaria treated with dapsone. Allergy 1999; 54: 765-6. [ Links ]
158. Cassano N, D'Argento V, Filotico R, Vena GA. Low-dose dapsone in chronic idiopathic urticaria: preliminary results of an open study. Acta Derm Venereol 2005; 85: 254-5. [ Links ]
159. Engin B, Ozdemir M. Prospective randomized non-blinded clinical trial on the use of dapsone plus antihistamine vs. antihistamine in patients with chronic idiopathic urticaria. J Eur Acad Dermatol Venereol 2008; 22: 481-6. [ Links ]
160. Sánchez-Borges M, Asero R, Ansoategui IJ et al. Diagnosis and treatment of urticaria and angioedema: a worldwide perspective. World Allergy Organ J 2012; 5: 125-47. [ Links ]
161. Jaffer AM. Sulfasalazine in the treatment of corticosteroid-dependent chronic idiopathic urticaria. J Allergy Clin Immunol 1991; 88: 964-5. [ Links ]
162. McGirt LY, Vasagar K, Gober LM, Saini SS, Beck LA. Successful treatment of recalcitrant chronic idiopathic urticaria with sulfasalazine. Arch Dermatol 2006; 142:1337-42. [ Links ]
163. Hartmann K, Hani N, Hinrichs R, Hunzelmann N, Scharffetter-Kochanek K. Successful sulfasalazine treatment of severe chronic idiopathic urticaria associated with pressure urticaria. Acta Derm Venereol 2000; 81:71. [ Links ]
164. Orden RA, Timble H, Saini SS. Efficacy and safety of sulfasalazine in patients with chronic idiopathic urticaria. Ann Allergy Asthma Immunol 2014; 112: 64-70. [ Links ]
165. Perez A, Woods A, Grattan CE. Methotrexate: a useful steroid-sparing agent in recalcitrant chronic urticaria. Br J Dermatol 2010; 162: 191-4. [ Links ]
166. Sagi L, Solomon M, Baum S, Lyakhovitsky A, Trau H, Barzilai A. Evidence for methotrexate as a useful treatment for steroid-dependent chronic urticaria. Acta Derm Venereol 2011; 91: 303-6. [ Links ]
167. Casolaro V, Spadero G, Patella V, Marone G. In vivo characterization of the anti-inflammatory effect of cyclosporine A on human basophils. J Immunol 1993; 151: 5563-73. [ Links ]
168. Stellato C, de Paulis A, Ciccarelli A, et al. Anti-inflammatory effect of cyclosporin A on human skin mast cells. J Invest Dermatol 1992; 98: 800-4. [ Links ]
169. Di Gioacchino M, Di Stefano F, Cavallucci E, et al. Treatment of chronic idiopathic urticaria and positive autologous serum skin test with cyclosporine: clinical and immunological evaluation. Allergy Asthma Proc 2003; 24: 285-90. [ Links ]
170. Stanaland BE. Treatment of patients with chronic idiopathic urticaria. Clin Rev Allergy Immunol 2002; 23: 233-41. [ Links ]
171. Kessel A, Bamberger E, Toubi E. Tacrolimus in the treatment of severe chronic idiopathic urticaria: an open-label prospective study. J Am Acad Dermatol 2005; 52: 145-8. [ Links ]
172. Zimmerman AB, Berger EM, Elmariah SB, Soter NA. The use of mycophenolate mofetil for the treatment of autoimmune and chronic idiopathic urticaria: experience in 19 patients. J Am Acad Dermatol 2012; 66: 767-70. [ Links ]
173. Bernstein JA, Garramone SM, Lower EG. Successful treatment of autoimmune chronic idiopathic urticaria with intravenous cyclophosphamide. Ann Allergy Asthma Immunol 2002; 89: 212-4. [ Links ]
174. Asero R. Oral cyclophosphamide in a case of cyclosporin and steroid-resistant chronic urticaria showing autoreactivity on autologous serum skin testing. Clin Exp Dermatol 2005; 30: 582-3. [ Links ]
175. O'Donnell BF, Barr RM, Black AK, et al. Intravenous immunoglobulin in autoimmune chronic urticaria. Br J Dermatol 1998; 138: 101-6. [ Links ]
176. Adamski H, Bedane C, Bonnevalle A, et al. Solar urticaria treated with intravenous immunoglobulins. J Am Acad Dermatol 2011; 65: 336-40. [ Links ]
177. Arkwright PD. Anti-CD20 or anti-IgE therapy for severe chronic autoimmune urticaria. J Allergy Clin Immunol 2009; 123: 510-1. [ Links ]
178. Chakravarty SD, Yee AF, Paget SA. Rituximab successfully treats refractory chronic autoimmune urticaria caused by IgE receptor auto antibodies. J Allergy Clin Immunol 2011; 128: 1354-5. [ Links ]
179. Mallipeddi R, Grattan CE. Lack of response of severe steroid-dependent chronic urticaria to rituximab. Clin Exp Dermatol 2007; 32: 333-4. [ Links ]
180. Asero R, Tedeschi A, Riboldi P, Cugno M. Plasma of patients with chronic urticaria shows signs of thrombin generation, and its intradermal injection causes wheal-and-flare reactions much more frequently than autologous serum. J Allergy Clin Immunol 2006; 117: 1113-7. [ Links ]
181. Takahagi S, Mihara S, Iwamoto K, et al. Coagulation/fibrinolysis and inflammation markers are associated with disease activity in patients with chronic urticaria. Allergy 2010; 65: 649-56. [ Links ]
182. Asero R, Tedeshi A, Cugno M. Heparin and tranexamic acid therapy may be effective in treatment-resistant chronic urticaria with elevated d-dimer: a pilot study. Int Arch Allergy Immunol 2010; 152: 384-9. [ Links ]
183. Grattan CE, Francis DM, Slater NG, Barlow RJ, Greaves MW. Plasmapheresis for severe, unremitting, chronic urticaria. Lancet 1992; 339: 1078-80. [ Links ]
184. Engin B, Ozdemir M, Balevi A, Mevlitoglu I. Treatment of chronic urticaria with narrowband ultraviolet B phototherapy: a randomized controlled trial. Acta Derm Venereol 2008; 88: 247-51. [ Links ]
185. Bressler RB, Sowell K, Huston DP. Therapy of chronic idiopathic urticaria with nifedipine: demonstration of beneficial effect in a double-blinded, placebo-controlled, crossover trial. J Allergy Clin Immunol 1989; 83: 756-63. [ Links ]
186. Grattan C, Powell S, Humphreys F, British Association of Dermatologists. Management and diagnostic guidelines for urticaria and angio-oedema. Br J Dermatol 2001; 144: 708-14. [ Links ]
187. Zuberbier T, Chantraines-Hess S, Hartmann K, Czarnetzki BM. Pseudoallergen-free diet in the treatment of chronic urticaria. Acta Derm Venereol 1995; 75:484-7. [ Links ]
188. Bruno G, Andreozzi P, Graf U. Exercise induced urticaria-angioedema syndrome: a role in gastro esophageal reflux. In: Vena GA, Puddu P, eds. Proceedings of the International Symposium on Urticaria. Bari: Publ Scientif, 1998, p 85-9. [ Links ]
189. Magerl M, Pisarevskaja D, Scheufele R, Zuberbier T, Maurer M. Effects of a pseudoallergen-free diet on chronic spontaneous urticaria: a prospective trial. Allergy 2010; 65: 78-83. [ Links ]
190. Juhlin L. Recurrent urticaria: clinical investigation of 330 patients. Br J Dermatol 1981; 104: 369-81. [ Links ]
191. Pigatto PD, Valsecchi RH. Chronic urticaria: a mystery. Allergy 2000; 55: 306-8. [ Links ]
192. Presta LG, Lahr SJ, Shields RL, et al. Humanization of an antibody directed against IgE. J Immunol 1993; 151: 2623-32. [ Links ]
193. Johansson SG. The discovery of immunoglobulin E. Allergy Asthma Proc 2006; 27: S3-6. [ Links ]
194. Novak N, Kraft S, Bieber T. IgE recepts. Curr Opin Immunol 2001; 13:721-6. [ Links ]
195. MacGlashan DW Jr, Bochner BS, Adelman DC, Jardieu PM, et al. Down-regulation of Fc(epsilon)RI expression on human basophils during in vivo treatment of atopic patients with anti-IgE antibody. J Immunol 1997; 158: 1438-45. [ Links ]
196. Beck LA, Marcotte GV, MacGlashan D, Togias A, Saini S. Omalizumab-induced reductions in mast cell Fcepsilon RI expression and function. J Allergy Clin Immunol 2004; 114: 527-30. [ Links ]
197. Hamilton RG, Marcotte GV, Saini SS. Immunological methods for quantifying free and total serum IgE levels in allergy patients receiving omalizumab (Xolair) therapy. J Immunol Methods 2005; 303: 81-91. [ Links ]
198. Saavedra M, Sur S. Down regulation of the high-affinity IgE receptor associated with successful treatment of chronic idiopathic urticaria with omalizumab. Clin Mol Allergy 2011; 9:2. [ Links ]
199. Francés L, Leiva-Salinas M, Silvestre JF. Omalizumab en el tratamiento de la urticaria crónica. Actas Dermosifiliogr 2014; 105: 45-52. [ Links ]
200. Xolair, omalizumab. European Medicines Agency. En: http://www.ema.europa.eu/ema/index.jsp?curl=pages/medicines/human/medicines/000606/human_med_001162.jsp&mid=WC0b01ac058001d124; consultado el 17/07/14.
201. Gober LM, Sterba PM, Eckman JA, Saini SS. Effect of Anti-IgE (Omalizumab) in Chronic Idiopathic Urticaria (CIU) Patients. J Allergy Clin Immunol 2008; 121: S147. [ Links ]
202. Kaplan AP, Joseph K, Maykut RJ, Geba GP, Zeldin RK. Treatment of chronic autoimmune urticaria with omalizumab. J Allergy Clin Immunol 2008; 122: 569-73. [ Links ]
203. Maurer M, Altrichter S, Bieber T et al. Efficacy and safety of omalizumab in patients with chronic urticaria who exhibit IgE against thyroperoxidase. J Allergy Clin Immunol 2011; 128: 202-9. [ Links ]
204. Ivyanskiy I, Sand C, Thomsen SF. Omalizumab for chronic urticaria: a case series and overview of the literature. Case Rep Dermatol 2012; 4: 19-26. [ Links ]
205. Saini S, Rosen KE, Hsieh Hj et al. A randomized, placebo-controlled, dose-ranging study of single-dose omalizumab in patients with H1-antihistamine-refractory chronic idiopathic urticarial. J Allergy Clin Immunol 2011; 128: 567-73. [ Links ]
206. Maurer M. Phase III randomized, double-blind, placebo-controlled study evaluating efficacy and safety of omalizumab in H1-antihistamine-refractory chronic idiopathic/spontaneous urticarial. European Academy of Dermatology and Venereology (EADV) annual meeting 2013. Oral Presentation. 5 October 2013, 11: 30 a.m. [ Links ]
207. Maurer M, Rosén K, Hsieh HJ et al. Omalizumab for the treatment of chronic idiopathic or spontaneous urticaria. N Engl J Med 2013; 368: 2340-1. [ Links ]
208. Kaplan A, Ledford D, Ashby M, et al. Omalizumab in patients with symptomatic chronic idiopathic/spontaneous urticaria despite standard combination therapy. J Allergy Clin Immunol 2013; 132: 101-9. [ Links ]
209. Metz M, Ohanyan T, Church MK, Maurer M. Omalizumab is an effective and rapidly acting therapy in difficult-to-treat chronic urticaria: A retrospective clinical analysis. J Dermatol Science 2014; 73: 57-62. [ Links ]
210. Gupta R, Sheikh A, Strachan D, Anderson HR. Increasing hospital admissions for systemic allergic disorders in England: analysis of national admissions data. BMJ 2003; 327: 1142-3. [ Links ]
211. Champion RH, Roberts SO, Carpenter RG, Roger JH. Urticaria and angio-oedema. A review of 554 patients. Br J Dermatol 1969; 81: 588-97. [ Links ]
212. Hellgren L. The prevalence of urticaria in the total population. Acta Allergol 1972; 27: 236-40. [ Links ]
213. Quaranta JH, Rohr AS, Rachelefsky GS, et al. The natural history and response to therapy of chronic urticaria and angioedema. Ann Allergy 1989; 62: 421-4. [ Links ]
214. Delong LK, Culler SD, Saini SS, Beck LA, Chen SC. Annual direct and indirect health care costs of chronic idiopathic urticaria: a cost analysis of 50 nonimmunosuppressed patients. Arch Dermatol 2008; 144: 35-9. [ Links ]
215. Neffen H, González SN, Fritscher CC, Dovali C, Williams AE. The burden of unscheduled health care for asthma in Latin America. J Investig Allergol Clin Immunol 2010; 20: 596-601. [ Links ]
216. Zazzali JL, Broder MS, Chang E, Chiu MW, Hogan DJ. Cost, utilization, and patterns of medication use associated with chronic idiopathic urticaria. Ann Allergy Asthma Immunol 2012; 108: 98-102. [ Links ]
217. Bickers DR, Lim HW, Margolis D et al. The burden of skin diseases: 2004 a joint project of the American Academy of Dermatology Association and the Society for Investigative Dermatology. J Am Acad Dermatol 2006; 55: 490-500. [ Links ]
218. Pite H, Wedi B, Borrego LM, Kapp A, Raap U. Management of childhood urticaria: current knowledge and practical recommendations. Acta Derm Venereol 2013; 93: 500-8. [ Links ]
219. Khakoo G, Sofianou-Katsoulis A, Perkin MR, Lack G. Clinical features and natural history of physical urticaria in children. Pediatr Allergy Immunol 2008; 19: 363-6. [ Links ]
220. Thomas P, Perkin MR, Rayner N, et al. The investigation of chronic urticaria in childhood: which investigations are being performed and which are recommended? Clin Exp Allergy 2008; 38: 1061-2. [ Links ]
221. Greaves MW, Tan KT. Chronic urticaria: recent advances. Clin Rev Allergy Immunol 2007; 33: 134-43. [ Links ]
222. Deacock SJ. An approach to the patient with urticaria. Clin Exp Immunol 2008; 153: 151-61. [ Links ]
223. Sackesen C, Sekerel BE, Orhan F, Kocabas CN, Tuncer A, Adaioglu G. The etiology of different forms of urticaria in childhood. Pediatr Dermatol 2004; 21: 102-8. [ Links ]
224. Kilic G, Guler N, Suleyman A, Talay Z. Chronic urticaria and autoimmunity in children. Pediatr Allergy Immunol 2010; 21: 837-42. [ Links ]
225. Jirapongsananuruk O, Pongpreuksa S, Sangacharoenkit P, Visitsunthorn N, Vichyanond P. Identification of the etiologies of chronic urticaria in children: a prospective study of 94 patients. Pediatr Allergy Immunol 2010; 21: 508-14. [ Links ]
226. Kauppinen K, Juntunen K, Lanki H. Urticaria in children. Retrospective evaluation and follow-up. Allergy 1984; 39: 469-72. [ Links ]
227. Volonakis M, Katsarou-Katsari A, Stratigos J. Ethiologic factors in childhood chronic urticaria. Ann Allergy 1992; 69: 61-5. [ Links ]
228. Shinkai K, McCalmont TH, Leslie KS. Cryopyrin-associated periodic syndromes and autoinflammation. Clin Exp Dermatol 2008; 33: 1-9Links ] Helvetica, sans-serif">.
229. Levy Y, Segal N, Weintrob N, Danon YL. Chronic urticaria: association with thyroid autoimmunity. Arch Dis Child 2003; 88: 517-9. [ Links ]
230. Carminiti L, Passalacqua G, Magazzu G, et al. Chronic urticaria and associated celiac disease in children: a case control study. Pediatr Allergy Immunol 2005; 16: 428-32. [ Links ]
231. Alangari AA, Twarog FJ, Shih MC, Schneider LC. Clinical features and anaphylaxis in children with cold urticaria. Pediatrics 2004; 113: e313-7. [ Links ]
232. Kozel MM, Bossuyt PM, Mekkes JR, Bos JD. Laboratory tests and identified diagnoses in patients with physical and chronic urticaria and angioedema: A systematic review. J Am Acad Dermatol 2003; 48: 409-16. [ Links ]
233. Simons FE. Early Prevention of Asthma in Atopic Children Study Group. H1-antihistamine treatment in young atopic children: effect on urticaria. Ann Allergy Asthma Immunol 2007; 99: 261-6. [ Links ]
234. Bloom M, Staudinger H, Herron J. Safety of desloratadine syrup in children. Curr Med Res Opin 2004; 20: 1959-65. [ Links ]
235. Leech S, Grattan C, Loyd K, et al. The RCPCH care pathway for children with urticaria, angio-oedema or mastocytosis: an evidence and consensus based national approach. Arch Dis Child 2011; 96: i34-7. [ Links ]
236. Church MK, Weller K, Stock P, Maurer M. Chronic spontaneous urticaria in children: itching for insight. Pediatr Allergy Immunol 2011; 22: 1-8. [ Links ]














