Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina (Buenos Aires)
Print version ISSN 0025-7680
Medicina (B. Aires) vol.75 no.2 Ciudad Autónoma de Buenos Aires Apr. 2015
CASUÍSTICA
Neurofibromatosis tipo I. Mutación de splicing detectada por MLPA y secuenciación en la Argentina
Sergio Laurito1, José Di Pierri2, María Roqué1
1Instituto de Histología y Embriología (IHEM)-CCT CONICET Mendoza, Universidad Nacional de Cuyo, Mendoza,
2Sección Genética y Bioantropología, Instituto de Biología de la Altura, Universidad Nacional de Jujuy, Jujuy, Argentina
Dirección postal: Dra. María Roqué, Instituto de Histología y Embriología, (IHEM)-CCT CONICET Mendoza, Av. Ruiz Leal s/n, Parque General San Martín, 5500 Mendoza, Argentina
Fax: (54 0261) 449-4117 e-mail: mroque@mendoza-conicet.gob.ar
Recibido: 10-X-2014
Aceptado: 29-XII-2014
Resumen
La neurofibromatosis tipo 1 (NF1) es un desorden genético autosómico dominante, con una prevalencia de 1 en 2500-3000 nacidos vivos. La dificultad diagnóstica se debe al tamaño extenso del gen NF1 con pocos sitios hot-spot, la ausencia de una clara relación genotipo-fenotipo y rasgos clínicos con un espectro muy heterogéneo. Un caso sospechoso de NF1 procedente de la provincia de Jujuy fue analizado por MLPA (multiplex ligation-dependent probe amplification) en nuestro laboratorio. Mujer, adolescente mestiza (Amerindia/Europea), con un osteoma maxilar, lordosis lumbar, neurofibromas cutáneos y manchas café con leche. Por MLPA se detectó una alteración en el exón 13 del gen NF1. Por secuenciación del exón 13 se identificó una mutación "missense" en la posición 1466 del ARNm (NM_000267.3:c.1466A>G) que introduce un sitio de splicing aberrante. La patogenicidad de la mutación fue corroborada en la base de datos de variantes clínicas del National Center for Biotechnology Information. En nuestro conocimiento, este es el primer registro de una mutación NF1 en un paciente proveniente de poblaciones mestizas del Noroeste Argentino. La alteración ha sido reportada en individuos de otras poblaciones de origen muy disímil al del caso presentado, como la europea, sugiriendo que el sitio podría considerarse un sitio hot-spot del gen. Donde exista baja disponibilidad de diagnósticos moleculares, como en nuestro caso, se puede aplicar un algoritmo que comience por el estudio del gen NF1 por MLPA, metodología relativamente sencilla y de costo accesible. Con ella se evita enviar muestras al extranjero para análisis genéticos.
Palabras clave: Neurofibromatosis; MLPA; Splicing.
Abstract
Neurofibromatosis type 1. Splicing mutation detected by MLPA and DNA sequencing in Argentina. Neurofibromatosis type 1 (NF1) is a dominant autosomic genetic disorder, with a birth incidence of 1 in 2500-3000. Diagnosis is difficult because of the size of gene NF1 that has few hot-spots sites, the absence of a clear genotype-phenotype relation, and a heterogeneous clinical manifestation. A NF1 suspected case from Jujuy province was analyzed by multiplex ligation-dependent probe amplification (MLPA). Mestizo female teenage (Amerindian/European), with a maxilar osteoma, lumbar lordosis, cutaneous neurofibromas and café au lait spots. MLPA detected an alteration in exon 13 of the NF1 gene. By sequencing of exon 13, a missense mutation (NM_000267.3:c.1466A>G) was found which introduces an aberrant splicing site and is registered as pathogenic in the clinical variants database of NCBI. As far as we are aware, this is the first report of a NF1 mutation in mestizo population of Northwest Argentina. 1466A>G has been described before in patients of European origin, suggesting that the affected site could be a hot-spot site of the gene. For countries as Argentina, with limited availability of molecular diagnostic methods, we propose a diagnosis algorithm by starting the mutational analysis of NF1 with MLPA. This methodology is relatively simple and of low cost, avoiding to send samples abroad for genetic analyses.
Key words: Neurofibromatosis; MLPA; Splicing.
La neurofibromatosis tipo 1 (NF1) (OMIM 162200) es un desorden genético autosómico dominante con una prevalencia de 1 en 2500-3000 nacidos vivos1. Las características clínicas son manchas café con leche, nódulos de Lisch y neurofibromas cutáneos. Aproximadamente un 50% de los pacientes presentan además problemas de aprendizaje.
NF1 se asocia con alteraciones en el gen NF1 (NM_001042492.1), localizado en el cromosoma 17q11.2, con una extensión de 360kb, integrado por 58 exones y transcripto a un ARNm de 11-13kb que codifica para la proteína neurofibromina de 2818 aminoácidos. La proteína tiene un rol controlador en la vía proliferativa Ras-MAPK, actuando como regulador negativo de Ras2. NF1 es uno de los genes de mayor extensión del genoma humano. Presenta una elevada tasa de mutaciones de novo (1x10-4 por gameta por generación), por lo que se infiere que entre un tercio y la mitad de los pacientes NF1 son producto de mutaciones de novo3.
La dificultad diagnóstica para NF1 se debe a: 1) el tamaño extenso del gen (58 exones) con un limitado número sitios hot-spot; 2) que no existe una clara relación genotipo-fenotipo, observándose variaciones de manifestación clínica en integrantes de la misma familia1; 3) que los rasgos clínicos presentan un espectro muy heterogéneo, variando desde simples manchas café con leche, hasta complicaciones neurológicas mayores. Esta extrema heterogeneidad clínica hace que se requieran más investigaciones que permitan explicar su comportamiento y desarrollo.
La búsqueda de mutaciones en NF1 no está muy desarrollada por varias causas, como el gran tamaño del gen, la presencia de pseudogenes y la limitada presencia de sitios hot-spot. En Argentina, en nuestro conocimiento, la determinación de mutaciones en el gen NF1 no se ofrece como servicio. La secuenciación completa del gen es costosa y laboriosa, y habiendo pocas regiones hot-spot, el análisis resulta técnicamente complejo.
Nuestro grupo ha sido pionero en nuestro país en la puesta en marcha de la metodología MLPA (multiplex ligation-dependent probe amplification), una estrategia que permite determinar cambio en el número de copias de varias regiones genómicas de manera simultánea4-8. Si bien las deleciones/duplicaciones de exones no son las alteraciones más frecuentes, la propuesta fue incluir en el país al estudio MLPA como primer abordaje.
Caso clínico
En la Sección Genética y Bioantropología del Instituto de Biología de la Altura de la Universidad Nacional de Jujuy, se estudió un caso sospechoso de NF1 que fue derivado para consulta y asesoramiento genético por el médico dermatólogo. Mujer, adolescente de 16 años, mestiza (amerindia/europea) que al examen clínico dismorfológico presenta osteoma maxilar izquierdo, lordosis lumbar, neurofibromas cutáneos (dos) y manchas café con leche diseminadas (seis) y dificultades de aprendizaje. No se observa ninguna otra particularidad en el fenotipo de la paciente. Su madre de 54 años, con diagnóstico clínico de NF1, presentaba también múltiples manchas café con leche (más de cinco) mayores a 15 mm y neurofibromas cutáneos (dos) en franco aumento tanto en número como en tamaño. El padre y la hermana de 13 años resultan a la fecha asintomáticos. Una muestra de sangre periférica de la paciente se derivó a nuestro laboratorio para realizar análisis genéticos moleculares.
Mediante la metodología Multiplex Ligation Probe Amplification (MLPA) (Kit P081-P082-B2, MRC-Holland) se analizó el estado de los 58 exones del gen NF1. Para esto se utilizaron sondas para cada uno de los exones, y para regiones de referencia fuera del cromosoma 17. En resumen, el ADN de la paciente fue extraído mediante bromuro de hexadeciltrimetilamonio (CTAB) y se incubó con las sondas que hibridan de a pares y en forma adyacente en cada exón a estudiar. Estas fueron amplificadas por un único par de primers marcados con fluorescencia. Los productos fueron luego resueltos por electroforesis capilar en un secuenciador automático ABI- 3130 (Applied Biosystems, USA). El proceso de cuantificación se realizó normalizando los datos respecto de las regiones genómicas de referencia y calculando la tasa de cada región estudiada respecto de una muestra control sana, utilizando el programa GeneMarker v1.75 (Softgenetics, USA). De esta manera pudo detectarse que el par de sondas para el exón 13 presentaba una disminución del 50% de señal fluorescente en la muestra de la paciente (Fig. 1A y B). La disminución de un solo par de sondas no permite inferir una deleción del exón, pues la disminución puede deberse a una mutación puntual o SNP (single nucleotide polimorphism) que afecte la eficiencia de hibridación de la sonda. Se propuso por lo tanto secuenciar el exón 13 en la muestra de la paciente. Para esto, se seleccionaron primers forward y reverse que permitieran analizar ambas hebras de ADN, según lo publicado por Pasmant y col.9. El análisis por secuenciación reveló la presencia de una mutación missense NM_000267.3:c.1466A>G (según base de datos genoma humano GRCh38), posición 1466 del ARNm (Fig. 2A y B), sitio que coincide con el último nucleótido de la sonda izquierda utilizada en MLPA para el exón 13 (Fig. 2C).
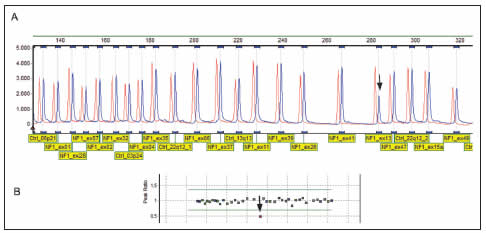
Fig. 1. 1A. Ensayo de MLPA: Electroferograma obtenido en un secuenciador automático. Los picos azules corresponden a la muestra del paciente, y cada uno representa un exón del gen NF1 y regiones control en otros cromosomas. Los picos rojos corresponden a una muestra control sana. La flecha negra indica una disminución del pico azul de la muestra del paciente, correspondiente al exón 13 del NF1. 1B. Análisis de la tasa entre la señal de pico de la muestra y el control. El punto rojo por debajo de la línea verde horizontal inferior corresponde al exón 13 de la muestra, y revela un 50% de señal respecto del control, permitiendo inferir que la sonda para el exón 13 no ha hibridado en uno de los alelos de la muestra en estudio.

Fig. 2. 2A. Ensayo de secuenciación con primer forward: Electroferograma obtenido en un secuenciador automático. La flecha negra indica la presencia de un sitio heterocigota A/G. 2B. Ensayo de secuenciación con primer reverse: Electroferograma obtenido en un secuenciador automático. La flecha negra indica la presencia de un sitio heterocigota T/C, confirmando observación del panel superior. 2C. Esquema del sitio de hibridación del par de sondas de MLPA dentro del exón 13 de NF1. La flecha negra muestra el sitio de la mutación 1466A>G que coindice con el último nucleótido de la sonda MLPA izquierda, reduciendo la eficiencia de hibridación al 50%.
La patogenicidad de la mutación hallada fue corroborada en la base de datos de Variantes Clínicas del NCBI (www.ncbi.nlm.nih.gov/clinvar), donde la variante NM_000267.3 (NF1):c.1466A>G (pTyr489Cys) fue clasificada con significación patógena.
Discusión
La mutación NM_000267.3:c.1466A>G ha sido previamente descripta por otros, relacionada con la clínica de NF1 y ha sido incluso considerada un posible sitio hot-spot en pacientes de EE.UU. y Bélgica10. La mayoría de las mutaciones en NF1 generan proteínas truncas por codones de terminación prematuros. Estos se producen, entre otras causas, por errores de splicing del ARN. Se ha propuesto que los errores de splicing representan una fracción significativa (37%) en NF13 y que se encuentran sub-detectados al realizarse la mayoría de los estudios solamente en ADN.
El cambio A > G en la posición 1466 crea un nuevo sitio donante de splicing (CT/GTAAG), provocando en el ARN la pérdida de 62nt desde la posición nucleotídica 1466 a 1527, resultando en la formación de un codón de terminación prematuro a la altura del codón 489. Varias mutaciones missense, nonsense o silenciosas, a nivel de ADN genómico, generan errores de splicing en el ARN11. De hecho, la nomenclatura de la mutación hallada en este trabajo (Y489C) hace pensar en una mutación missense, cuando estrictamente es una mutación de splicing. Es importante destacar que la predicción del sitio donante de splicing tiene un puntaje de 0.86 en el caso de la secuencia normal y de 0.97 para la secuencia mutante, lo que indicaría el potencial patogénico de dicha mutación10.
El caso presentado en este trabajo, es un individuo mestizo del Noroeste Argentino12. Hasta nuestro conocimiento, este es el primer registro de una mutación NF1 en un paciente con estas características de ancestros.
Sorprendentemente, la alteración que porta ha sido hallada en individuos de otras poblaciones de origen muy disímil al del caso en estudio, como la europea10. Esto permite suponer que el exón 13 es susceptible de sufrir estas alteraciones de splicing, y sustenta la hipótesis de que el sitio 1466 es un sitio hot-spot del gen. Estos datos alientan a iniciar estudios mutacionales en este exón.
Como se mencionó anteriormente, la frecuencia de mutaciones de novo es alta (30%-50%) para el gen NF1. Sin embargo, en el caso presentado, la madre de la paciente fue diagnosticada clínicamente para neurofibromatosis tipo I, y con un fenotipo similar al de la paciente, por lo cual es posible inferir un origen hereditario en la mutación. No se han realizado estudios genéticos moleculares en la madre o en algún otro familiar de la paciente.
En Argentina, en nuestro conocimiento, no existe el screening completo del gen NF1 por secuenciación. La mayoría de los diagnósticos son resueltos por criterio clínico, dado que los costos y trámites de envío de muestras al exterior son muy altos. Nuestro grupo propone un algoritmo local que comience por el estudio del gen NF1 por MLPA. Esta metodología es relativamente sencilla, de costo accesible, y puede ser realizada en un laboratorio con equipamiento de biología molecular. Con esta técnica, una región de unos 40-50nt de cada exón es analizada por pares de sondas. No solo deleciones y duplicaciones pueden ser detectados por MLPA, sino cualquier otro cambio que afecte la hibridación de sondas en esa región. En caso de requerirse, una posterior secuenciación dirigida solo al exón en estudio permite corroborar los hallazgos. Los costos de MLPA y secuenciación de un único exón son muy accesibles para los sistemas de salud de nuestro país.
En resumen, con la presentación de este caso pretendemos mostrar la utilidad diagnóstica de MLPA en la búsqueda de mutaciones en regiones genómicas extensas, como lo es el gen NF1, y cómo esta metodología combinada con secuenciación, es una herramienta útil, de fácil implementación en el país para la realización de estudios genéticos moleculares.
Conflicto de intereses: Ninguno para declarar
1. Williams VC, Lucas J, Babcock MA, et al. Neurofibromatosis type 1 revisited. Pediatrics 2009; 123: 124-3. [ Links ]
2. Le LQ, Parada LF. Tumor microenvironment and neurofibromatosis type I: connecting the GAPs. Oncogene 2007; 26: 4609-16. [ Links ]
3. Ars E, Serra E, Garcia J, et al. Mutations affecting mRNA splicing are the most common molecular defects in patients with neurofibromatosis type 1. Hum Mol Genet 2000; 9: 237-47. [ Links ]
4. Schouten JP, McElgunn CJ, Waaijer R, et al. Relative quantification of 40 nucleic acid sequences by multiplex ligation-dependent probe amplification. Nucleic Acids Res 2002; 30:e57. [ Links ]
5. Marzese DM, Mampel A, Gomez LC, et al. Detection of deletions and duplications in the Duchenne muscular dystrophy gene by the molecular method MLPA in the first Argentine affected families. Genet Mol Res 2008; 7: 223-33. [ Links ]
6. Laurito S, Goldschmidt E, Marquez M, et al. Deletion of the LIS1, ASPA, TRPV1 and CAMTA2 genes in region 17p13.3 in a patient with Miller-Dieker syndrome. Rev Neurol 2011; 52: 189-91. [ Links ]
7. Laurito S, Branham T, Herrero G, et al. Detection of a Williams Beuren syndrome case by MLPA. Medicina (B Aires) 2013; 73: 47-50. [ Links ]
8. Gomez LC, Marzese DM, Adi J, et al. MLPA mutation detection in Argentine HNPCC and FAP families. Fam Cancer 2009; 8: 67-73. [ Links ]
9. Pasmant E, Sabbagh A, Masliah-Planchon J, et al. Role of noncoding RNA ANRIL in genesis of plexiform neurofibromas in neurofibromatosis type 1. J Natl Cancer Inst 2011; 103: 1713-22. [ Links ]
10. Messiaen LM, Callens T, Roux KJ, et al. Exon 10b of the NF1 gene represents a mutational hotspot and harbors a recurrent missense mutation Y489C associated with aberrant splicing. Genet Med 1999; 1: 248-53. [ Links ]
11. Messiaen LM, Callens T, Mortier Gxvnm, et al. Exhaustive mutation analysis of the NF1 gene allows identification of 95% of mutations and reveals a high frequency of unusual splicing defects. Hum Mutat 2000; 15: 541-55. [ Links ]
12. Wang S1, Ray N, Rojas W, et al. Geographic patterns of genome admixture in Latin American Mestizos. PLoS Genet 2008; 4: e1000037 [ Links ]














