Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Medicina (Buenos Aires)
versão impressa ISSN 0025-7680
Medicina (B. Aires) vol.75 no.2 Ciudad Autónoma de Buenos Aires abr. 2015
CASUÍSTICA
Síndrome de Hughes-Stovin
Sonia Pankl1, Ana Meraldi1, Paola Pegoraro1, Geofredo Earsman1, 2, Julio E. Bruetman1, José Ceresetto3, Martín Bosio4, Gustavo Lyons5, Pablo Young1
1Servicio de Clínica Médica,
2Servicio de Reumatología,
3Servicio de Hematología,
4Servicio de Neumonología,
5Servicio de Cirugía de Tórax, Hospital Británico de Buenos Aires, Argentina
Dirección postal: Dr. Pablo Young, Servicio de Clínica Médica, Hospital Británico, Perdriel 74, 1280 Buenos Aires, Argentina
Fax: (54-11) 4304-3393 e-mail:pabloyoung2003@yahoo.com.ar
Recibido: 31-XII-2014
Aceptado: 23-I-2015
Resumen
El síndrome de Hughes-Stovin es una entidad infrecuente caracterizada por trombosis venosa profunda y aneurismas de la arteria pulmonar, siendo su etiología y patogenia desconocida. Algunos autores la consideran una variante de la enfermedad de Behcet. Su curso natural es generalmente fatal. Se presenta con tos, disnea, hemoptisis, dolor torácico y fiebre. El tratamiento es con esteroides y agentes citotóxicos hasta la cirugía. Presentamos el caso de un hombre de 41 años que consultó por disnea, hemoptisis y dolor torácico, llegándose al diagnóstico de trombosis venosa profunda de miembro inferior derecho, trombo-embolismo de pulmón y aneurismas de arterias pulmonares. Recibió tratamiento con corticoides en altas dosis y 6 pulsos de ciclofosfamida de 1 gramo durante 6 meses, con regresión completa de los aneurismas y de la sintomatología.
Palabras clave: Vasculitis; Trombosis venosa profunda; Aneurismas de arterias pulmonares; Hemoptisis; Enfermedad de Behcet.
Abstract
Hughes-Stovin Syndrome, a case report. The Hughes-Stovin syndrome is a rare entity characterized by deep vein thrombosis and pulmonary artery aneurysms of unknown etiology and pathogenesis. Some authors considered a variant of Behcet's disease. Its natural course is usually fatal. The symptoms are cough, dyspnea, hemoptysis, chest pain and fever. The treatment goes from steroids and cytotoxic agents to surgery. We present the case of a 41 year old man who shows dyspnea, hemoptysis, and chest pain leading to the diagnosis of deep venous thrombosis of the right leg, lung thromboembolism and pulmonary artery aneurysms. He was treated with high-dose corticosteroids and 6 cyclophosphamide pulses of 1 gram each per 6 months with complete regression of aneurysms and symptomatology.
Key words: Vasculitis; Deep vein thrombosis; Pulmonary artery aneurysms; Hemoptysis; Behcet's disease.
La asociación entre aneurismas de arterias pulmonares (AAP) y trombosis venosa profunda (TVP) fue descripta por primera vez en 1959 por los médicos John Patterson Hughes y Peter George Ingle Stovin y de allí su nombre de síndrome de Hughes-Stovin (SHS)1. Esta combinación también ha sido descripta en pacientes con enfermedad de Behcet (EB), postulándose que el SHS podría ser una forma de presentación de dicha entidad2-6.
La causa de la enfermedad es desconocida, se ha propuesto origen autoinmune o viral. Su prevalencia es desconocida, hay menos de 60 casos publicados en la literatura mundial7.
Presentamos un caso de un hombre con trombosis venosa profunda, tromboembolismo de pulmón y aneurismas de arterias pulmonares que fue tratado con inmunosupresores durante 6 meses, logrando regresión completa de los aneurismas y de su sintomatología.
Caso clínico
Se presenta un hombre de 41 años de edad con antecedentes de hipertensión arterial. Consultó por dolor torácico y fiebre de 5 días de evolución asociado a dolor y aumento de temperatura en miembro inferior derecho. Se diagnosticó trombosis venosa femoral común y poplítea, por eco-Doppler venoso y trombosis en ramas segmentarias y subsegmentarias de la arteria pulmonar derecha y en ramas subsegmentarias de la arteria pulmonar izquierda por tomografía computarizada. Inició tratamiento anticoagulante con acenocumarol. La analítica fue normal, incluyendo hemograma, ionograma, hepatograma, eritrosedimentación (VSG), proteína C reactiva (PCR), factor antinuclear, factor reumatoideo, anticuerpos contra citoplasma del neutrófilo (ANCA), homo-cisteína. Las pruebas del virus de la inmunodeficiencia Humana (HIV), derivado proteico purificado (PPD) y los estudios de trombofilia fueron negativos. La tomografía axial computarizada (TAC) de tórax, abdomen y pelvis con contraste no mostró otros hallazgos patológicos. A los 4 meses evolucionó con episodios de hemoptisis sin descompensación hemodinámica en el contexto de una Razón Normalizada Internacional (INR) de 2.4. La rinoscopia no evidenció lesiones y la fibrobroncoscopia mostró restos de sangre sin evidencia del sitio de sangrado. Se realizó una angiotomografía de tórax (angio-TAC) que detectó aneurismas de la arteria segmentaria posterobasal del lóbulo inferior derecho con hemorragia alveolar localizada (Figs. 1 y 2). Un ecocardiograma Doppler color presentó una presión sistólica de la arteria pulmonar (PSAP) de 26 mmHg. Se revirtió la anticoagulación y con sospecha de SHS inició prednisolona 1 mg/kg/día endovenoso (EV) y ciclofosfamida 1 gramo EV. Continuó con dosis en descenso de corticoides orales y, tras recibir 1 gramo de ciclofosfamida mensual durante 6 meses, se realizó una angiotomografía de tórax control que reveló regresión completa de los aneurismas. El paciente evolucionó clínicamente asintomático, continuando con ciclofosfamida en dosis de 1 gramo EV mensual por 3 meses. Ahora, a los 9 meses del diagnóstico, debe continuar tres meses más con pulsos y luego pasar a azatioprina.
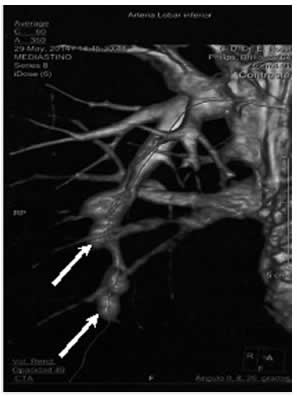
Fig. 1. AngioTAC de tórax con reconstrucción: aneurismas de la arteria segmentaria posterobasal del lóbulo inferior derecho (flechas).
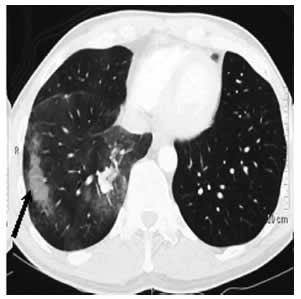
Fig. 2. TAC de tórax: hemorragia alveolar localizada en lóbulo inferior derecho (flecha).
Discusión
En 1959, Hughes y Stovin describieron 4 casos de hemoptisis por rotura de AAP y TVP recurrente1. El rango etario de presentación va desde los 12 a los 48 años, con mayor frecuencia en hombres7. Se desconoce si existe predisposición genética, en un solo caso se describió la asociación de HLA-B51 y SHS7.
La etiología y patogenia son desconocidas. La hipótesis más aceptada es la vasculitis como proceso primario5, 7. Varios autores sugieren que el SHS es una manifestación incompleta de la EB ya que no cumple con los criterios diagnósticos de dicha enfermedad2-8. Ambas, junto a la arteritis de células gigantes de la temporal (ACG), son las únicas vasculitis que presentan aneurismas de arterias pulmonares. Sobre el origen de los aneurismas se han postulado otras hipótesis, como la degeneración de la pared arterial a consecuencia de abscesos y embolias sépticas, o secundario a angiodisplasias que provoquen daño de los vasa-vasorum y del tejido elástico ante una inadecuada nutrición3, 6-11.
No existen formalmente descriptos criterios diagnósticos o parámetros específicos para el SHS. Generalmente se caracteriza por clínica sucesiva de TVP, formación de AAP y/o bronquiales y posteriormente ruptura de los mismos con hemoptisis masiva y muerte8-10. Tanto la TVP como la formación de aneurismas deben estar presentes para el diagnóstico de SHS, mientras que la hemoptisis es el resultado final en pacientes no tratados o no diagnosticados5. Además puede haber tos, disnea, dolor torácico, fiebre e hipertensión pulmonar. Existen casos con convulsiones, diplopía y cefalea secundaria a hipertensión endocraneana por trombosis de senos venoso cerebrales5-7.
Los aneurismas pueden ser simples, múltiples, unilaterales o bilaterales, en arterias pulmonares o bronquiales o, más raramente, en otros sitios de la circulación sistémica, como en arteria hepática o ilíaca7, 8. La hemoptisis puede desencadenarse por ruptura de aneurismas, vasculitis activa con trombosis y oclusión de la arteria pulmonar7. La hemoptisis generalmente indica inestabilidad del aneurisma y es un indicador de la necesidad de intervención terapéutica.
La TVP recurrente involucra generalmente grandes vasos, pudiendo evolucionar a embolia pulmonar en el 25% de los casos. Existen informes de trombosis en venas ilíaca, femoral, cava y en cámaras cardíacas5, 6, 10.
La patogenia de la trombosis es desconocida, aunque se postulan diferentes mecanismos, como el descenso progresivo de células progenitoras endoteliales, la injuria endotelial directa, el incremento de la actividad plaquetaria, la fibrogenólisis aberrante, además de niveles de expresión anormal de trombomodulina, factor de crecimiento endotelial vascular, activación de E-selectina y niveles variables de óxido nítrico7. La presencia de hiperhomocisteinemia es un factor de riesgo independiente para el tromboembolismo venoso en SHS7.
No existen parámetros de laboratorio ni anticuerpos específicos asociados al SHS. Puede haber leucocitosis, anemia, VSG y PCR elevadas3-8. Al igual que en la EB, el SHS puede tener ANCA positivos. La radiografía simple de tórax solo permite la sospecha diagnóstica, al detectarse anormalidades vasculares torácicas o signos indirectos como hipertrofia o dilatación del ventrículo derecho y silueta cardiaca triangular (silueta de Laubry y Bordet) debido a la rotación del corazón por la dilatación de la arteria pulmonar. El eco-Doppler venoso de miembros inferiores es útil para detectar trombosis periférica. La angioTAC es el estudio de elección para visualizar aneurismas de arterias pulmonares por encima de la arteriografía, por ser un método no invasivo y no exponer al paciente al riesgo de ruptura de los mismos4-10. La angio-resonancia magnética es relativamente menos sensible que la TC para mostrar pequeños aneurismas. En pacientes con presencia de hemoptisis, la broncoscopia puede mostrar tumores pulsátiles, vasos ectásicos u obstrucciones bronquiales por masas submucosas7, 8. Histopatológicamente presenta dilatación y oclusión parcial de aneurismas arteriales, infiltración perivascular linfomonocítica, esclerosis proliferativa difusa y contenido denso de neutrófilos en las paredes vasculares. Estos hallazgos coinciden con los encontrados en pacientes con EB1, 7.
No existen guías de manejo para el SHS. Debido a que, como se dijo anteriormente, el SHS comparte ciertas características con la EB, se toman los lineamientos terapéuticos descriptos para dicha enfermedad12-14. La primera línea de tratamiento es la inmunosupresión con glucocorticoides EV y luego oral con prednisolona 1 mg/kg/día y reducción gradual posterior, asociado a ciclofosfamida EV mensual con dosis calculada de acuerdo a la superficie corporal. Según la evolución clínica se pueden discontinuar los corticoides y seguir con ciclofosfamida por lo menos durante 1 año13, 15. La Unión Europea contra el Reumatismo (EULAR) recomienda continuar con ciclofosfamida por 2 años y seguir con azatioprina12. No está recomendado el tratamiento con antibióticos ni antiagregantes plaquetarios, y la anticoagulación está formalmente contraindicada por el riesgo de hemoptisis masiva, excepto en casos con resolución quirúrgica previa o luego de un tratamiento inmunosupresor completo8, 11.
Existen casos descriptos que implementaron el abordaje quirúrgico ante hemoptisis masiva secundaria a aneurismas en un segmento, lóbulo pulmonar o en un pulmón4. El tratamiento invasivo debe evaluarse en cada caso por la alta morbimortalidad de la cirugía y la incidencia de recurrencia de aneurismas en el sitio de anastomosis7. Por último, se ha informado la embolización por cateterismo arterial para pacientes con hemoptisis masiva recurrente o severa que no son candidatos a cirugía7, 15.
El diagnóstico precoz y el tratamiento temprano pueden modificar la historia natural de la enfermedad. Nuestro caso refleja cómo un abordaje multidisciplinario temprano puede favorecer el pronóstico de esta patología.
El diagnóstico diferencial en esta entidad se debe realizar con otras afecciones que producen AAP, como aneurismas traumáticos, cardiopatías congénitas (ductus arterioso persistente entre otros), anormalidades estructurales (síndrome de Marfan), otras vasculitis como la ACG, hipertensión pulmonar grave, síndrome antifosfolípido primario, enfermedad de Erdheim-Chester, enfermedad de Rendu-Osler-Weber, infecciones (aneurismas distales en la tuberculosis o de Rasmussen o proximales en la sífilis, entre otras infecciones) y fibrosarcoma de la arteria pulmonar que simula un aneurisma9, 16. En aquellos pacientes que presenten AAP y TVP el diagnóstico se restringe a tres entidades a saber: el fibrosarcoma de la arteria pulmonar, la EB y el SHS16. Dado el avance de los métodos de imágenes nos enfrentamos a estos cuadros de manera más frecuente.
Conflicto de intereses: Ninguno para declarar
1. Hughes JP, Stovin PG. Segmental pulmonary artery aneurysms with peripheral venous thrombosis. Br J Dis Chest 1959, 53: 19-27. [ Links ]
2. Durieux P, Bletry O, Huchon G, Wechsler B, Chretien J, Godeau P. Multiple pulmonary arterial aneurysms in Behcet´s disease and Hughes-Stovin syndrome. Am J Med 1981; 71: 736-41. [ Links ]
3. Golden B. Behcet-type vasculopathy in a patient without the diagnostic features of Behcet´s disease. Arthitis Reumatism 1996; 39: 1926-30. [ Links ]
4. Kapoor S. Hughes-Stovin syndrome: a rare and often overlooked cause of hemoptysis and pulmonary artery aneurysms. Thorac Cardiovasc Surg 2014; 62: 456-7. [ Links ]
5. Silva R, Escobar A, Vega R, Tapia R. Síndrome de Hughes-Stovin. Caso clínico. Rev Med Chile 2013; 141: 922-6. [ Links ]
6. Emad Y, Ragab Y, ShawkiAel H, Gheita T, El-Marakbi A, Salama MH. Hughe-Stovin syndrome: is it incomplete Behcet´s? Report of two cases and review of the literature. Clin Rheumatol 2007; 26: 1993-6. [ Links ]
7. Khalid U, Saleem T. Hughes-Stovin syndrome (Review). Orphanet J Rare Dis 2011; 6: 15. [ Links ]
8. Al-Jahdali H. Massive hemoptysis and deep venous thrombosis presenting in a woman with Hughes-Stovin syndrome: a case report. J Med Case Rep 2010; 4: 109-12. [ Links ]
9. Ossés JM. ¿Qué sabemos de los aneurismas de la arteria pulmonar? RAMR 2014; 1: 92-3. [ Links ]
10. Lee WY, Hoon CS, Kim HR. Massive hemoptysis caused by atypical Behcet´s disease. Korean J Thorax Cardiovasc Surg 2014; 47: 178-80. [ Links ]
11. Erkan F, Gül A, Tasali E. Pulmonary manifestations of Behcet´s disease. Thorax 2001, 56: 572-8. [ Links ]
12. Hatemi G, Silman A, Bang D, et al. Management of Behcet disease: a systematic literature review for the European League against Rheumatism evidence-based recommendations for the management of Behcet disease. Ann Rheum Dis 2009, 68: 1528-34. [ Links ]
13. Ali-Munive A, Varón H, Maldonado D, Torres-Duque C. Aneurismas gigantes de la arteria pulmonar y trombosis venosa periférica (síndrome de Hughes-Stovin): regresión con tratamiento inmunosupresor. Arch Bronconeumol 2001; 37: 508-10. [ Links ]
14. Lee J, Noh JW, Hwang JW, et al. Successful cyclophosphamide therapy with complete resolution of pulmonary artery aneurism in Hughes-Stovin syndrome patient. Clin Rheumatol 2008, 27: 1455-8. [ Links ]
15. Krokidis M, Spiliopoulos S, Ahmed I, Gkoutzios P, Sabharwal T, Reidy J. Emergency endovascular management of pulmonary artery aneurysms and pseudoaneurysms for the treatment of massive haemoptysis. Hellenic J Cardiol 2014; 55: 204-10. [ Links ]
16. Erlij D, Michalland S, Neira O, Fernández C, Wolff V. Fibrosarcoma de arteria pulmonar simulando un síndrome de Hughes Stovin. Rev Med Chile 2014; 142: 1478-81. [ Links ]














