Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680
Medicina (B. Aires) vol.75 no.4 Ciudad Autónoma de Buenos Aires ago. 2015
ARTÍCULO ORIGINAL
Clopidogrel versus prasugrel en síndrome coronario agudo tratado con angioplastia
Nicolas Lalor1, Leandro Rodríguez1, Pablo Elissamburu1, Eduardo Filipini1, Diego Conde1, Gerardo Nau2, Fernando Cura2, Marcelo Trivi1
1Servicio de Cardiología Clínica,
2Servicio de Cardiología Intervencionista y Terepéuticas Endovasculares, Instituto Cardiovascular de Buenos Aires, Sanatorio Anchorena, Buenos Aires, Argentina
Dirección postal: Dr. Nicolás Lalor, Servicio de Cardiología Clínica, Sanatorio Anchorena, Dr. Tomás M. de Anchorena 1872, 1425 Buenos Aires, Argentina
e-mail: nicolaslalor@gmail.com
Recibido: 16-III-2015
Aceptado: 1-VII-2015
Resumen
Al uso del clopidogrel se han agregado nuevos antiagregantes como prasugrel y ticagrelor. El objetivo de este estudio fue comparar la incidencia de eventos isquémicos y hemorrágicos en pacientes que han recibido clopidogrel o prasugrel.Se incluyeron de manera consecutiva todos los pacientes con angioplastia durante la internación por síndrome coronario agudo entre diciembre 2011 y diciembre 2012.Fueron incluidos 398 pacientes. No se observaron diferencias en la mortalidad de causa cardiovascular (clopidogrel 2.5% vs. prasugrel 2.9%, p = 0.48). El grupo prasugrel presentó una reducción en la tasa de infarto (1.9% vs. 6.8%, p = 0.01) con sangrado totales (18.5% vs. 8.5%, p = 0.001) a expensas de sangrados menores (12.4% vs. 3.4%, p < 0.001), sin diferencia en sangrados mayores (p = 0.27) y sangrados con peligro de vida (p =.0.20). Por análisis multivariado los predictores independientes de mortalidad cardiovascular fueron edad (odds ratio 1.08, intervalo de confianza, IC, 95% 1.02-1.16, p = 0.02) insuficiencia renal (odds ratio 6.98, IC 95% 1.23-39.71, p < 0.0001). En cuanto al sangrado total se identificaron la edad (odds ratio 1.06, IC 95% 1.02-1.09, p = 0.002), elevación del segmento ST (odds ratio 1.99, IC 95% 1.05-3.79, p = 0.02), insuficiencia renal (odds ratio 3.32, IC 95% 1.62-6.78, p = 0.002) y utilización de prasugrel (odds ratio 3.97, IC 95% 1.87-8.41, p < 0.0001). La utilización de prasugrel se asocia a una menor tasa de infarto agudo de miocardio al año de seguimiento, con incremento de hemorragias menores. No se observaron diferencias significativas en la mortalidad cardiovascular entre ambos grupos.
Palabras clave: Antiagregantes de plaquetas; Angioplastia coronaria; Síndrome coronario agudo.
Abstract
Clopidogrel versus prasugrel in acute coronary syndrome treated with coronary angioplasty
Greater antithrombotic potency new antiplatelet agents have been added such as prasugrel (PR) and ticagrelor to the traditional use of clopidogrel (CL) in the treatment of acute coronary syndrome (ACS). This study was aimed at comparing the incidence of long term ischemic and hemorrhagic events in patients treated with CL or PR during hospitalization. Retrospective ACS data base analysis performed by our cardiology service was completed prospectively. There were consecutively included all patients with percutaneous coronary intervention (PCI) during hospitalization due to ACS from December 2011 thru December 2012. A total of 398 ACS patients who underwent PCI with stent implantation were recruited. No differences in cardiovascular related deaths were observed in both groups (PR 2.9% vs. CL 2.5%, p = 0.48). PR group showed less re-infraction (1.9% vs. 6.8%, p = 0.01) with more total bleedings (18.5% vs. 8.5%, p = 0.001) and minor bleedings (12.4% vs. 3.4%, p < 0.001) with no differences in major and life threatening bleedings (p = ns). Multivariate analysis showed that independent predictors of cardiovascular mortality were age (OR 1.08, CI 95% 1.02-1.16) and renal failure (OR 6.98, CI 95% 1.23-39.71). Independent predictors for total bleeding were age (OR 1.06, CI 95% 1.02-1.09),ST segment elevation myocardial infarction (OR 1.99, CI 95% 1.05-3.79), renal failure (OR 3.32, CI 95% 1.62-6.78) and prasugrel use (OR 3.97, CI 95% 1.87-8.41). Use of prasugrel, in the ACS that requires PCI with stent, is associated with a lower myocardial infarction a year after follow-up, and it also leads to an increase of milder hemorrhage. No significant differences were observed in the cardiovascular mortality of both groups.
Key words: Platelet antiaggregants; Coronary angioplasty; Acute coronary syndrome.
Debido al carácter aterotrombótico del síndrome coronario agudo (SCA), la inhibición de actividad plaquetaria juega un papel fundamental en el tratamiento1-3. Varios estudios han demostrado el beneficio de la doble terapia anti-agregante (DAP) para la prevención de complicaciones trombóticas en pacientes con SCA sometidos a angioplastia transluminal coronaria (ATC)4-6. A pesar de este beneficio, muchos presentan recurrencia de eventos trombóticos aun recibiendo la DAP1, esto estaría relacionado con el retardo en el inicio de la acción del clopidogrel y con su variabilidad interindividual en los grados de inhibición plaquetaria7-9. Actualmente, la introducción de nuevos anti-agregantes plaquetarios, como el prasugrel
y ticagrelor, permite una mejor inhibición plaquetaria a la obtenida con el clopidogrel, reduciendo los eventos trombóticos, aunque elevando el riesgo hemorrágico10-12. Estudios recientes han identificado pacientes con un mayor riesgo de sangrado con el uso de nuevos antiagregantes, permitiendo individualizar la decisión sobre la selección de los mismos acorde al riesgo hemorrágico e isquémico13, 14.
Hasta el momento, existe poca información acerca de la seguridad y eficacia de los nuevos anti-agregantes en la práctica cotidiana comparados con el clopidogrel.
El objetivo del presente estudio fue comparar las características basales y el resultado clínico de los pacientes con SCA que requirieron ATC con implante de stent, tratados con clopidogrel o prasugrel.
Materiales y métodos
Se incluyeron en forma consecutiva a los pacientes con SCA derivados a dos centros de alta complejidad cardiovascular que requirieron revascularización percutánea con implante de stent durante la internación. Se realizó un análisis retrospectivo de la base de datos, incluyendo los pacientes internados desde diciembre de 2011 a diciembre de 2012. La población incluida en el análisis se dividió en dos grupos de acuerdo al tipo de antiagregación: 236 tratados con aspirina y clopidogrel (grupo CL), y 162 tratados con aspirina y prasugrel (grupo PR). No se incluyeron a los tratados con ticagrelor.
Los criterios de exclusión para administrar prasugrel fueron: a) pacientes mayores de 75 años, b) pacientes con peso menor de 60 kilos o c) con antecedente de accidente cerebrovascular (ACV) por considerarlos pacientes de alto riesgo hemorrágico15. La decisión sobre la utilización de los diversos antiagregantes e inhibidores de la glicoproteína IIb/IIIa se dejó a criterio del operador y al equipo tratante, teniendo en cuenta el riesgo hemorrágico e isquémico de cada paciente y las contraindicaciones para el uso de prasugrel15.
El seguimiento clínico se efectuó mediante consulta clínica o telefónica durante los meses de mayo y junio de 2013. Los eventos se clasificaron en: 1. Muerte cardiovascular. 2. Infarto agudo de miocardio (IAM): de acuerdo a la tercera definición universal propuesta en el año 201216. 3. El ACV se definió como pérdida focal de la función neurológica causada por un evento hemorrágico o isquémico con persistencia de los síntomas al menos 24 horas. 4. Trombosis de stent confirmada según AcademicResearchConsortium17: síndrome coronario agudo con documentación angiográfica o anatomopatológica de trombosis del stent. 5. Sangrado con peligro de vida: sangrados fatales, sangrado intracraneal o intrapericárdico con taponamiento cardíaco, asociado a shock hipovolémico, hipotensión grave con requerimiento de drogas vasopresoras o cirugía, a un descenso de hemoglobina ≥5 g/dl, transfusión ≥ 4 unidades de glóbulos rojos. 6. Sangrado mayor: sangrado con descenso de hemoglobina de 3 a 5 g/dl, requerimiento de transfusión de 2 a 3 unidades de glóbulos rojos o sangrados con severa repercusión clínica (ejemplo: perdida completa de la visión por sangrado intraocular). 7. Sangrado menor: cualquier tipo de sangrado que requirió una intervención médica, pero sin cumplir los criterios de los sangrados mayores.Para describir los datos cuantitativos se utilizaron medias y desviaciones estándar (DE) o medianas y rangos intercuartiles (RIQ). Las variables categóricas se describieron utilizando números absolutos y porcentajes. La comparación de variables continuas se realizó mediante la prueba T de Student o mediante la prueba U de Mann-Whitney. Las variables categóricas se compararon con la prueba de Chi cuadrado de Pearson. Se consideraron estadísticamente significativos los valores de p < 0.05. Para evaluar la influencia del PR en la mortalidad cardiovascular y en el sangrado total se utilizaron modelos de regresión logística multivariados, que incluyeron potenciales confundidores. Se empleó el paquete estadístico SPSS 11.0.
Resultados
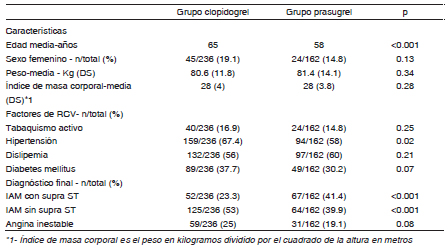
De 398 pacientes incluidos, 120 (30%) presentaron SCA con elevación del segmento ST, de los cuales 53 (44%) recibieron clopidogrel y 67 (56%) prasugrel. Un total de 278 (70%) presentaron SCA sin elevación del ST, de los cuales 183 (66%) recibieron clopidogrel (grupo CL) y 95 (34%) recibieron prasugrel (grupo PR). Las características basales demográficas de los dos grupos se detallan en la Tabla 1. En el grupo de PR los pacientes eran más jóvenes (58 años vs. 65.3 años, p < 0.001), presentando menor tasa de hipertensión arterial que el grupo de CL (58% vs. 67.4%, p 0.02). No se observaron diferencias entre los grupos en términos de género, peso o índice de masa corporal del paciente, tasa de diabetes, dislipemia o tabaquismo.
Tabla 1. Características basales de los pacientes, acorde al grupo tratamiento
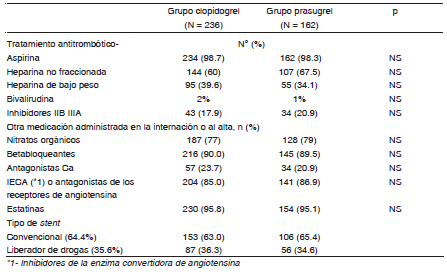
Todos recibieron uno o más stents, que fueron liberadores de drogas en un 35.6% de los casos. No hubo diferencias en términos de tipo de stent implantado entre los dos grupos.
Los pacientes recibieron aspirina y heparina como tratamiento antitrombótico antes de la angioplastia. El uso de inhibidores glicoproteicos de los receptores IIb/IIIa fue ligeramente más frecuente en el grupo PR (20.9% vs. 17.9%), aunque sin diferencias significativas (Tabla 2)
Tabla 2. Tratamientos, procedimientos según el grupo
Un 98% presentó seguimiento alejado (mediana 307días; RIC 25-75%: 211 - 397días). La tasa de DAP al final del seguimiento fue de 352 (83%). En 14 se debió interrumpir la DAP por sangrado, 10 del grupo PR y 4 del grupo CL; en el resto se discontinuó por indicación médica o por cumplir el tiempo estipulado por las guías18, 19.
Del grupo de PR, 11 pacientes fueron pasados al grupo CL por sangrado menor, indicación del médico de cabecera durante el seguimiento o cuestiones socioeconómicas.
No se observaron diferencias en el punto final combinado de muerte, infarto y ACV (2.5% vs. 2.9%, p = ns). No se observaron diferencias en la mortalidad de causa cardiovascular entre los dos grupos (CL 2.5% vs. PR 2.9%, p = ns) (Tabla 3). Sin embargo, se observó una reducción significativa en la tasa de IAM por parte del grupo PR en el corto (30 días) y largo plazo (1.9% vs. 6.8%, p = 0.01) (Fig. 1). Se observaron 5 casos de trombosis intra stent definitivas (1.18%), uno de ellos discontinuó el clopidogrel 8 días previo al evento, el resto no interrumpió la DAP.
Tabla 3. Eficacia y punto final combinado en el seguimiento
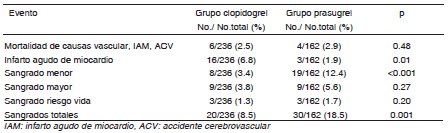
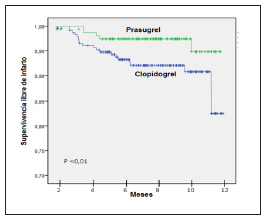
Fig. 1. Eventos isquémicos en el seguimiento. Curva de Kaplan Meyer.
Como se muestra en la Tabla 3, hubo un mayor número de sangrados totales en el grupo PR (18.5% vs. 8.5%,
p = 0.001) a expensas de una mayor tasa de sangrado menor (12.4% vs. 3.4%, p < 0.001). No se observaron diferencias significativas en el sangrado mayor (5.6% vs.3.8%, p = 0.20) y sangrado con peligro de vida (1.7% vs. 1.3%, p = 0.20) respectivamente.
Como se observa en la Fig. 2, la diferencia en el sangrado se mantuvo durante el seguimiento hasta el año de la ATC con stent.
Por análisis logístico multivariado, los predictores independientes de mortalidad cardiovascular fueron la edad (OR 1.08, CI 95% 1.02-1.16, p = 0.02) y la insuficiencia renal (OR 6.98, CI 95% 1.23-39.71, p < 0.0001).
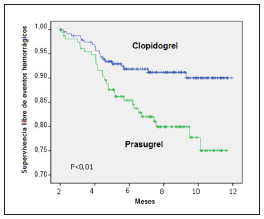
Fig. 2. Eventos hemorrágicos en el seguimiento. Curva de Kaplan Meyer.
En cuanto al sangrado total se identificaron la edad (OR 1.06, CI 95% 1.02-1.09, p = 0.002), SCACEST (OR 1.99, CI 95% 1.05-3.79, p = 0.02), insuficiencia renal, Cr > 1.39 mg% (OR 3.32, CI 95% 1.62-6.78, p = 0.002) y la utilización de prasugrel (OR 3.97, CI 95% 1.87-8.41, p < 0.0001).
La incidencia de infarto al momento del seguimiento fue de 4.6%. También fueron analizados los predictores de riesgo de infarto en la evolución, identificándose como única variable independiente, al tratamiento con clopidogrel, OR 4.24, CI 95% 1.21-14.79, p < 0.01.
Discusión
La DAP con prasugrel y aspirina provoca una potente inhibición plaquetaria, y su administración en pacientes con SCA sometidos a revascularización percutánea se traduce en una importante reducción de los eventos isquémicos comparado con el uso de clopidogrel13. Sin embargo el riesgo hemorrágico es mayor con el prasugrel que con el clopidogrel. Se ha propuesto que una selección individualizada del régimen de DAP (evitar el prasugrel en ancianos, personas de bajo peso o con antecedentes de accidentes cerebrovasculares) podría permitir una reducción de los eventos isquémicos sin aumentar el riesgo hemorrágico19. En nuestra población, el uso de prasugrel fue más frecuente en jóvenes y en pacientes con SCA con elevación del segmento ST. Estos hallazgos ilustran una clara intención médica de utilizar dicho fármaco en casos de bajo riesgo de sangrado y alto riesgo trombótico. Pero a pesar de haber seleccionado y excluido a la población de mayor riesgo hemorrágico (mayores de 75 años, bajo peso < 60 kg y antecedentes de ACV, AIT), los pacientes tratados con prasugrel en nuestro estudio presentaron una mayor tasa de sangrado total, con una tasa similar de sangrado mayor o sangrado con peligro de vida. Es probable que el criterio médico en la selección del régimen antiagregante individualizado en cada paciente15, haya influenciado en la reducción del riesgo hemorrágico grave del prasugrel evidenciado en los estudios aleatorizados que lo compararon con clopidogrel13, en donde el uso de prasugrel se asoció con un incremento significativo en el sangrado mortal. Pero también puede ocurrir que por el menor tamaño de la muestra las diferencias no alcancen significación estadística para el sangrado grave.
El aspecto más novedoso de nuestro estudio se puede observar en las curvas de supervivencia libre de eventos (Figs. 1 y 2). El beneficio del prasugrel sobre los eventos isquémicos se concentra en los primeros meses. A partir del 6o. mes las curvas se igualan con el clopidogrel porque ya no hay prácticamente más eventos isquémicos, al alejarse de la etapa aguda y subaguda de los síndromes coronarios agudos. En cambio, el perjuicio de mayor sangrado con el prasugrel se mantiene durante todo el seguimiento.
De hecho, el riesgo de sangrado parece ser continuo mientras dure la DAP (Fig. 2). Estos datos avalan la tendencia a intentar reducir el tiempo de doble antiagregación plaquetaria con los stents de última generación, de menor trombosis en el seguimiento.
Al igual que en el estudio TRITON TIMI 38, no hubo diferencias en términos de mortalidad cardiovascular entre los dos grupos. El beneficio del prasugrel fue primordialmente la reducción del infarto, sin impacto sobre la mortalidad cardiovascular. Teniendo en cuenta la definición de infarto que se utilizó16, sólo favoreció la reducción de eventos de menor relevancia clínica.Es posible que la presencia de una mayor tasa de sangrado menor refleje un grupo de pacientes de mayor riesgo de muerte o simplemente que el desarrollo de sangrado menor impacte de alguna manera en la supervivencia de los pacientes. Por otro lado, la mortalidad cardiovascular fue baja en ambos grupos, siendo identificados como predictores independientes la edad y la presencia de insuficiencia renal. La presencia de una baja tasa de mortalidad anual en nuestra población probablemente sea el producto de la interacción de diversos factores, como el riesgo basal de la población, el porcentaje de éxito de la ATC y bajas tasas de sangrado grave y de eventos trombóticos.
Dentro de las limitaciones de este trabajo se objeta el carácter observacional y retrospectivo.
La utilización de criterios para recibir prasugrel como también que la administración de uno u otro antiagregante quedó a criterio del médico tratante y que la limitante económica haya influido en la administración o no de estas drogas.
En conclusión, la utilización de prasugrel en pacientes con síndromes coronarios agudos tratados con angioplastia con stent se asocia a una menor tasa de infarto al seguimiento alejado comparado con clopidogrel. Sin embargo, también se asocia con un incremento de la tasa de hemorragias, que es constante mientras dura la doble antiagregación, aun habiendo excluido los pacientes de mayor riesgo.
Conflicto de intereses: Ninguno para declarar
1. Yusuf S, Zhao F, Mehta SR, et al. Effects of clopidogrel in addition to aspirin in patients with acute coronary syndromes without ST-segment elevation. N Engl J Med 2001; 345: 494-502. [Errata, N Engl J Med 2001; 345: 1506, 1716. [ Links ]]
2. Chen ZM, Jiang LX, Chen YP, et al. Addition of clopidogrel to aspirin in 45852 patients with acute myocardial infarction: randomised placebo-controlled trial. Lancet 2005; 366: 1607-21. [ Links ]
3. Sabatine MS, Cannon CP, Gibson CM, et al. Addition of clopidogrel to aspirin and fibrinolytic therapy for myocardial infarction with ST-segment elevation. N Engl J Med 2005; 352: 1179-89. [ Links ]
4. Mehta SR and Yusuf S. Short- and longterm oral antiplatelet therapy in acute coronary syndromes and percutaneous coronary intervention. J Am Coll Cardiol 2003; 41:Suppl S: 79S-88S. [ Links ]
5. Steinhubl SR, Berger PB, Mann JT III, et al. for the CREDO Investigators. Early and sustained dual oral antiplatelet therapy following percutaneous coronary intervention: a randomized controlled trial. JAMA 2002; 288: 24. [ Links ]
6. Fox KA, Mehta SR, Peters R, et al. Benefits and risks of the combination of clopidogrel and aspirin in patients undergoing surgical revascularization for non–ST-elevation acute coronary syndrome: the Clopidogrel in Unstable angina to prevent Recurrent ischemic Events (CURE) Trial. Circulation 2004; 110: 1202-8.
7. Angiolillo DJ, Fernández-Ortiz A, Bernardo E, et al. High clopidogrel loading dose during coronary stenting: effects on drug response and interindividual. Eur Heart J 2004; 25: 1903-10. [ Links ]
8. Gurbel PA, Bliden KP, Hayes KM, Yoho JA, Herzog WR,Tantry US. The relation of dosing to clopidogrel responsiveness and the incidence of high post-treatment platelet aggregation in patients undergoing coronary stenting. J Am Coll Cardiol 2005; 45: 1392-6. [ Links ]
9. Serebruany VL, Steinhubl SR, Berger PB, Malinin AI, Bhatt DL, Topol EJ. Variability in platelet reponsiveness to clopidogrel among 544 individuals. J Am Coll Cardiol 2005; 45: 246-51. [ Links ]
10. Kuliczkowski V, Witkowski A, Polonski L, et al. Interindividual variability in the response to oral antiplatelet drugs: a position paper of the Working Group on antiplatelet drugs resistance appointed by the Section of Cardiovascular Interventions of the Polish Cardiac Society, endorsed by the Working Group on Thrombosis of the European Society of Cardiology. Eur Heart J 2009; 30: 426-35. [ Links ]
11. Wallentin L, Varenhorst Ch, James S, et al. Prasugrel achieves greater and faster P2Y12 receptor- mediated platelet inhibition than clopidogrel due to more efficient generation of its active metabolite in aspirin- treated patients with coronary artery disease. Eur Heart J 2008; 29: 21-30. [ Links ]
12. Jernberg T, Payne Ch, Winters KJ, et al. Prasugrel achieves greater inhibition of platelet aggregation and a lower rate of non-responders compared with clopidogrel in aspirin-treated patients with stable coronary artery disease. Eur Heart J 2006; 27: 1166-73. [ Links ]
13. Wiviott SD, Braunwald E, McCabe CH, et al. Prasugrel versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2007; 357: 2001-15. [ Links ]
14. Wallentin L, Becker RC, Budaj A, et al.Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2009; 361: 1045-57. [ Links ]
15. Windecker S, Kolh Ph, Alonso F, et al. 2014 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J 2014; 35, 2541-619. [ Links ]
16. Thygesen K, Alpert JS, Jaffe AS, Simoons ML, Chaitman BR, White HD. Third universal definition of myocardial infraction. Eur Heart J 2012; 33: 2551-67. [ Links ]
17. Cutlip D, Windecker S, Mehran R, et al. Clinical end points in coronary stent tials: a case for standardized definitions. Circulation 2007; 115: 2344-51. [ Links ]
18. Hamm CW, Bassand JP, Agewall S, et al. ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: The Task Force for the management of acute coronary syndromes (ACS) in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC).Eur Heart J 2011; 32: 2999-3054. [ Links ]
19. Task Force on the management of ST-segment elevation acute myocardial infarction of the European Society of Cardiology (ESC), Steg PG, James SK, Atar D, et al. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J 2012; 33: 2569-619. [ Links ]














