Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina (Buenos Aires)
Print version ISSN 0025-7680
Medicina (B. Aires) vol.75 no.5 Ciudad Autónoma de Buenos Aires Oct. 2015
SERIE DE CASOS
Rituximab e hipogammaglobulinemia
Diego S. Fernández Romero1, 2, María Gabriela Torre1, 2, Blas J. Larrauri2, Eloisa Malbrán1, 2, María Cecilia Juri1, 2, Alejandro Malbrán2
1Servico de Alergia e Inmunología, Hospital Británico de Buenos Aires,
2Unidad de Alergia, Asma e Inmunología Clínica, Argentina
Dirección postal: Diego S. Fernández Romero, Peña 2562 4° 10, 1425 Buenos Aires, Argentina
e-mail: dfromero@live.com.ar
Recibido: 5-VI-2015
Aceptado: 12-VIII-2015
Resumen
El rituximab (RTX), un anticuerpo quimérico anti-CD20 que induce la depleción de linfocitos B, es utilizado para el tratamiento de enfermedades linfoproliferativas y autoinmunes. La inmunodeficiencia humoral relacionada al tratamiento con RTX comenzó a ser un motivo de derivación a nuestro Servicio, por lo que decidimos analizar a los pacientes con el antecedente de haber sido tratados con RTX que consultaron por hipogammaglobulinemia o infecciones recurrentes desde noviembre de 2010 hasta diciembre de 2014. Evaluamos a ocho pacientes, siete mujeres y un varón. El tiempo promedio de seguimiento fue de 19.3 ± 18.8 meses, rango 1 a 54, con una mediana de 13. Tres tenían proteinogramas normales previo a la administración de RTX, tres hipogammaglobulinemia, y de dos no hay datos. A ninguno se le realizó una determinación cuantitativa de inmunoglobulinas previa al tratamiento. Cuatro recibieron RTX por linfoma B no Hodgkin, dos por leucemia linfocítica crónica, uno por púrpura trombocitopénica autoinmune y otro por poliangeítis microscópica. A seis se les diagnosticó hipogammaglobulinemia y a uno deficiencia de IgM, IgA e IgG2. Cinco presentaron infecciones, cuatro con buena respuesta al tratamiento de reemplazo con gammaglobulina. La inmunodeficiencia humoral relacionada a RTX es una causa de consulta cada vez más frecuente. Resulta fundamental disponer de los niveles de inmunoglobulinas previo al inicio de su administración para poder establecer una relación etiológica y durante el seguimiento, para disminuir el retraso diagnóstico. El tratamiento con gammaglobulina en dosis sustitutivas parece ser de utilidad en pacientes con infecciones graves o recurrentes.
Palabras clave: Rituximab; Inmunodeficiencia humoral; Hipogammaglobulinemia.
Abstract
Rituximab and hypogammaglobulinemia.
Rituximab, a chimeric monoclonal antibody against CD20, induces the depletion of B lymphocytes. It is used for the treatment of lymphoproliferative and autoimmune diseases. Antibody immunodeficiency associated to RTX treatment is a new motif for consultation to our service. We decided to study those patients that having been treated with RTX, consulted for hypogammaglobulinemia or recurrent infections between November 2010 and December 2014. We evaluated eight patients, seven female and one male. The average follow up time was 19.3 ± 18.8 months, range 1 to 54, median 13. Three had a normal electrophoretic proteinogram before receiving RTX, three had hypogammaglobulinemia and in two data was not available. None of them had a quantitative determination of immunoglobulins before receiving RTX. Four received RTX as a treatment of non Hodking lymphoma, two as a treatment of chronic lymphocytic leukemia, one for immune thrombocytopenic purpura and other for microscopic polyangiitis. Six were diagnosed with hypogammaglobulinemia and one with combined IgM, IgA and IgG2 deficiency. Five presented infections, four of them with good response to intravenous immunoglobulin. RTX related antibody deficiency consultations are increasing. It is important to determine the immunoglobulin levels previously to RTX use in order to establish an etiologic relationship with RTX and a quick diagnosis of antibody deficiency. The substitutive treatment with gammaglobulin seems to be useful in patients with severe or recurrent infections.
Keywords: Rituximab; Antibody deficiency; Hypogammaglobulinemia.
Las inmunodeficiencias humorales comprenden a un grupo de enfermedades caracterizadas por la imposibilidad de desarrollar una respuesta inmune efectiva mediada por anticuerpos. Se clasifican en primarias, producidas por un defecto intrínseco del sistema inmune, y secundarias cuando son consecuencia de otra enfermedad o por el uso de un fármaco. La principal manifestación clínica son las infecciones por bacterias extracelulares capsuladas, principalmente del tracto respiratorio1.
El rituximab (RTX) es un anticuerpo quimérico anti-CD20 que generalmente induce la depleción completa de los linfocitos B en sangre periférica por un periodo de seis a nueve meses. Comenzó siendo utilizado con éxito para el tratamiento de linfomas y luego su uso se extendió a diversas enfermedades autoinmunes2. En los estudios iniciales, en grupos limitados de pacientes, no se observaron alteraciones clínicamente significativas de los niveles de gammaglobulina circulante, explicado por la ausencia de expresión del CD20 en plasmocitos. Sin embargo, en los últimos años y en plazos de seguimiento más prolongados, se han comenzado a informar casos de hipogammaglobulinemia secundarias a su uso, algunos asociados a infecciones graves o recurrentes que requirieren tratamiento sustitutivo con gammaglobulina3-6.
Dado que la hipogammaglobulinemia relacionada con RTX comenzó a ser un motivo de derivación, decidimos analizar las historias clínicas de todos los pacientes con el antecedente de haber sido tratados con RTX, que consultaron por hipogammaglobulinemia o infecciones recurrentes al Servicio de Alergia e Inmunología del Hospital Británico de Buenos Aires desde noviembre de 2010, fecha en que recibimos el primer paciente, hasta diciembre de 2014, con el fin de establecer sus características epidemiológicas y clínicas.
Casos
Durante el periodo del estudio evaluamos a ocho pacientes, siete mujeres y un varón. Se registraron los diagnósticos y las edades en la primera consulta en nuestro Servicio, en el momento de aplicación de RTX, de aparición de infecciones y de detección de inmunodeficiencia. Estos datos, el tiempo de seguimiento, el número de ciclos de RTX, y los valores de la fracción gamma previo a su administración se muestran en la Tabla 1.
Tabla 1 . Pacientes con inmunodeficiencia humoral relacionada a RTX
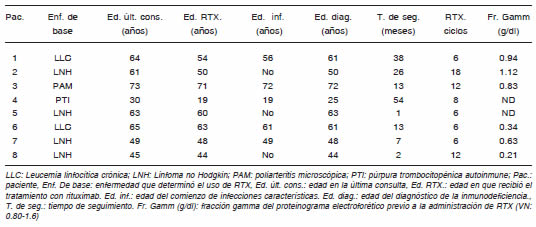
El tiempo promedio de seguimiento de los pacientes fue de 19.3 ± 18.8 meses, rango 1 a 54 con una mediana de 13.
Tres pacientes (pacientes 1, 2 y 3) tenían proteinogramas normales previo a la administración del RTX, tres (pacientes 6, 7 y 8) tenían hipogammaglobulinemia previo al tratamiento con RTX, y de los dos restantes (pacientes 4 y 5) no hay datos. A ninguno se le realizó una determinación de inmunoglobulinas cuantitativa previa a la administración del RTX.
Los niveles de inmunoglobulinas al momento del diagnóstico de la inmunodeficiencia y las poblaciones linfocitarias se describen en la Tabla 2.
Tabla 2. Pacientes con inmunodeficiencia humoral relacionada a RTX. Valores de inmunoglobulinas y de poblaciones linfocitarias al momento del diagnóstico e inicio del seguimiento

El paciente 1, con diagnóstico de leucemia linfocítica crónica (LLC) en abril de 2000, fue tratado con fludarabina con buena respuesta inicial, tuvo una recaída en septiembre de 2004 y fue re-tratado con fludarabina, ciclofosfamida y RTX. En marzo de 2006, en mayo de 2007 y dos veces en 2008 se le diagnosticó neumonía. En diciembre de 2008 presentó hipogammaglobulinemia en un proteinograma. Continuó con infecciones recurrentes de vías aéreas superiores hasta el diagnóstico de inmunodeficiencia en septiembre de 2011, cuando se comenzó con gammaglobulina endovenosa en forma sustitutiva, lo que disminuyó la frecuencia y gravedad de sus infecciones.
El paciente 2 fue tratado en noviembre de 2003 solo con RTX por un linfoma B no Hodgkin (LNH). En 2004 presentó una recaída por lo que recibió RTX, fludarabina y ciclofosfamida. En 2005, a los 50 años, se le detectó hipogammaglobulinemia en un proteinograma. Nunca tuvo infecciones.
El paciente 3, con diagnóstico de poliarteritis microscópica en diciembre de 2010, fue tratado concomitantemente con meprednisona, ciclofosfamida y RTX con buena respuesta. En marzo de 2012 se le detectó hipogammaglobulinemia y en noviembre fue tratado nuevamente con RTX por una recaída de su enfermedad de base con buena evolución. En junio de 2012 se constató disminución en los niveles de inmunoglobulinas. En junio de 2013 se le diagnosticó una neumonía que requirió internación en unidad de cuidado intensivo donde se le indicó terapia sustitutiva con gammaglobulina endovenosa; posterior a la infusión presentó deterioro de la función renal asociado a edema agudo de pulmón, por lo que se decidió su suspensión.
El paciente 4, único varón de la serie, con diagnóstico de púrpura trombocitopénica autoinmune (PTI) en 2004, a los 19 años, presentó una respuesta parcial al tratamiento con corticoide y a la esplenectomía por lo cual fue tratado con RTX con buena respuesta. Evolucionó sin recaídas hasta el 2007 cuando fue nuevamente tratado con RTX. Desde 2004 presentó múltiples infecciones respiratorias siendo internado en cinco oportunidades entre 2008 y 2011. En abril de 2012 se consultó a nuestro Servicio por hipogammaglobulinemia previa a la realización de una lobectomía inferior izquierda por bronquiectasias. Se diagnosticó deficiencia de IgM, IgA e IgG2 y se comenzó tratamiento sustitutivo con gammaglobulina. El paciente evolucionó con disminución de la frecuencia y severidad de sus infecciones bajo tratamiento pero desarrolló un bajo nivel de IgG total.
El paciente 5 realizó tratamiento de un LNH con RTX, ciclofosfamida, doxorubicina, vincristina y prednisona (R-CHOP) en abril 2010. En noviembre del 2012 presentó un cuadro de encefalitis autoinmune, motivo por el cual fue tratado con meprednisona en altas dosis quedando como secuela con un deterioro cognitivo severo. En mayo de 2014 se le realizó una gastrostomía por neumonías aspirativas a repetición secundarias a un supuesto trastorno de la deglución. En agosto se le diagnosticó hipogammaglobulinemia, y falleció en septiembre por progresión de su mal estado general.
Los pacientes 6, 7 y 8 presentaban bajos niveles de gammaglobulinas en el proteinograma previo al tratamiento con RTX.
El paciente 6, con diagnóstico de LLC que no requirió tratamiento en agosto del 2006, a los 57 años, comenzó con infecciones a los 61 años presentando hipogammaglobulinemia en un proteinograma. A los 63 años fue tratado con RTX por su LLC, y en noviembre de 2013 consultó a nuestro Servicio por hipogammaglobulinemia e infecciones recurrentes. Se le diagnosticó inmunodeficiencia humoral y comenzó tratamiento sustitutivo con gammaglobulina endovenosa evolucionando con disminución del número y severidad de las infecciones.
El paciente 7 fue tratado con RTX por LNH en noviembre de 2013, un mes antes había presentado hipogammaglobulinemia en un proteinograma. Evolucionó asintomático hasta diciembre de 2014 cuando fue internado por neumonía en unidad de cuidados intensivos donde recibió antibióticos y gammaglobulina endovenosa con buena evolución.
El paciente 8, con diagnóstico de LNH, fue tratado en junio del 2012 con R-CHOP presentando buena evolucionó sin infecciones. Un mes antes del diagnóstico del LNH se le había detectado hipogammaglobulinemia en un proteinograma.
Discusión
El número de pacientes adultos en seguimiento con inmunodeficiencias humorales se ha incrementado considerablemente en los últimos años a expensas de pacientes con inmunodeficiencias primarias derivados de centros pediátricos. Las inmunodeficiencias secundarias representan menos del 10% del total de los pacientes en seguimiento, en la literatura no hay datos sobre su incidencia, posiblemente por ser una complicación infrecuente en distintas especialidades. Las más comunes son las asociadas a enfermedades linfoproliferativas, presentando hipogammaglobulinemia el 15% de los pacientes con LNH, y hasta el 85% de los pacientes con LLC en algún momento de su enfermedad4, 7, 8.
El tratamiento con RTX constituye una nueva causa de hipogammaglobulinemia, la cual se ha reportado en casi el 40% de los pacientes tratados por LNH, y en el 26 al 34% de los tratados por enfermedades autoinmunes (IgG <500 mg/dl)4, 5, 9. En la artritis reumatoidea (AR) una disminución de IgM e IgG se ha observado en el 12 al 40%, y en el 3 al 7% respectivamente de los pacientes tratados con RTX10, 11. La incidencia de la hipogamma-globulinemia secundaria a RTX posiblemente aumente en forma concomitante con el aumento de su utilización en diferentes enfermedades; en nuestra serie esto se pone de manifiesto al considerar que el primer paciente estudiado por sospecha de inmunodeficiencia secundaria a RTX consultó en noviembre de 2010 y en que el tiempo promedio de seguimiento de nuestros pacientes fue de menos de 20 meses.
El diagnóstico de inmunodeficiencia secundaria a RTX en pacientes con enfermedades linfoproliferativas puede ser dificultoso debido a que éstas de por sí son la principal causa de hipogammaglobulinemia secundaria; asimismo, la quimioterapia oncológica y los tratamientos concomitantes con inmunosupresores y altas dosis de corticoides en las enfermedades autoinmunes, constituyen variables de confusión para la confirmación etiológica de la hipogammaglobulinemia. Dadas estas dificultades diagnósticas para poder establecer una posible relación entre la hipogammaglobulinemia y el uso de RTX resulta fundamental disponer de los niveles de inmunoglobulinas previo al inicio de la administración del RTX. En nuestro estudio, en ningún paciente se había realizado una determinación de inmunoglobulinas previo a la administración de RTX, poniendo de manifiesto que la misma no parece ser una práctica frecuente, y en los tres casos en que se detectó hipogammaglobulinemia previa a la administración fue por la estimación semi-cuantitativa propia del método electroforético.
La ausencia de infecciones observada en los dos pacientes con LNH e hipogammaglobulinemia de nuestra serie, al igual que en las hipogammaglobulinemias secundarias a enfermedades linfoproliferativas, podría ser una causa de sub-diagnóstico7. En nuestro estudio un paciente comenzó con infecciones a los dos años de haber recibido RTX, sugiriendo que en algunos casos las infecciones podrían ser una manifestación tardía.
Algunos autores sostienen que el tratamiento con RTX puede poner de manifiesto o profundizar la hipogammaglobulinemia en la inmunodeficiencia común variable (IDCV)12, 13. La PTI, donde la indicación de RTX es cada vez más frecuente, puede ser la primera manifestación de una IDCV14, 15; este podría ser el caso de nuestro paciente que comenzó con PTI y evolucionó con disminución de las tres series de inmunoglobulinas. El tratamiento con RTX, sin la determinación previa de inmunoglobulinas, en pacientes con IDCV o con PTI como manifestación de IDCV no diagnosticada, podría hacer atribuir erróneamente la causa de la hipogammaglobulinemia al RTX.
El tiempo medio desde la administración de RTX hasta el diagnóstico de hipogammaglobulinemia fue estimado en 1.4 años4. En nuestra serie, al paciente que comenzó con infecciones a los dos años de la administración de RTX se le diagnosticó hipogammaglobulinemia siete años después, por lo que presentó infecciones por cinco años sin diagnóstico, lo cual pone de manifiesto la importancia de considerar este evento adverso de la droga y de la determinación periódica de las inmunoglobulinas en el seguimiento post-tratamiento.
Las infecciones graves se observan en el 5% de los pacientes con AR tratados con RTX, y en el 14 al 38% de los pacientes con vasculitis asociadas a ANCA9, 15. En estos últimos suelen darse durante el primer año y se relacionan con la actividad de la enfermedad, el compromiso pulmonar y renal, el tratamiento concomitante con altas dosis de corticoides y con ciclofosfamida9. En el paciente con vasculitis de nuestra serie, las infecciones fueron una complicación tardía, posiblemente más relacionada con la hipogammaglobulinemia que con los otros factores.
El tratamiento de reemplazo con gammaglobulina endovenosa en dosis sustitutivas, al igual que en los pacientes con inmunodeficiencias humorales primarias, se indica por hipogammaglobulinemia e infecciones graves en el 3 al 6.6% de los pacientes tratados con RTX4, 5. El mismo ha demostrado eficacia para disminuir el número de infecciones, como sucedió en los pacientes de nuestra serie.
En conclusión, la inmunodeficiencia secundaria a RTX es una causa de consulta cada vez más frecuente, dado su mayor utilización y mayor tiempo de evolución de los pacientes tratados. La determinación de inmunoglobulinas resulta fundamental previo a su utilización y durante el seguimiento de los pacientes, permitiendo establecer con mayor claridad la etiología de la hipogammaglobulinemia, y disminuyendo el retraso diagnóstico de la misma. El tratamiento con gammaglobulina en dosis sustitutivas parece ser de utilidad en pacientes con infecciones graves o recurrentes.
Conflicto de intereses: Ninguno para declarar
1. Bonilla FA, Bernstein IL, Khan DA, et al. Practice parameter for the diagnosis and management of primary immunodeficiency. Ann Allergy Asthma Immunol 2005; 94: S1–S63.
2. McLaughlin P, Grillo-López AJ, Link BK, et al. Rituximab chimeric anti-CD20 monoclonal antibody therapy for relapsed indolent lymphoma: half of patients respond to a four-dose treatment program. J Clin Oncol 1998; 16: 2825-33. [ Links ]
3. Walker AR, Kleiner A, Rich L, et al. Profound hypogammaglobulinemia 7 years after treatment for indolent lymphoma. Cancer Invest 2008; 26: 431-3. [ Links ]
4. Casulo C, Maragulia J, Zelenetz AD. Incidence of hypogammaglobulinemia in patients receiving rituximab and the use of intravenous immunoglobulin for recurrent infections. Clin Lymphoma Myeloma Leuk 2013; 13: 106-11. [ Links ]
5. Marco H, Smith RM, Jones RB, et al. The effect of rituximab therapy on immunoglobulin levels in patients with multisystem autoimmune disease. BMC Musculoskelet Disord 2014; 15: 178. [ Links ]
6. Kaplan B, Kopyltsova Y, Khokhar A, Lam F, Bonagura V. Rituximab and immune deficiency: case series and review of the literature. J Allergy Clin Immunl Pract 2014; 2: 594-600. [ Links ]
7. Fernández Romero DS, Juri MC, Paolini MV, Malbrán A. Inmunodeficiencias humorales. Un estudio en tres Centros de Inmunología Clínica de adultos en la Ciudad de Buenos Aires. Medicina (B Aires) 2011; 71: 350-6. [ Links ]
8. Hamblin AD, Hamblin TJ. The immunodeficiency of chronic lymphocytic leukaemia. Br Med Bull 2008; 87: 49-62. [ Links ]
9. Roberts DM, Jones RB, Smith RM. Rituximab-associated hypogammaglobulinemia: incidence, predictors and outcomes inpatients with multi-system autoimmune disease. J Autoimmun 2015; 57: 60-5. [ Links ]
10. Popa C, Leandro MJ, Cambridge G, Edwards JC. Repeated B lymphocyte depletion with rituximab in rheumatoid arthritis over 7 yrs. Rheumatology (Oxford) 2007; 46: 626-30. [ Links ]
11. vanVollenhoven RF, Emery P, Bingham CO 3rd, Keystone EC, et al. Long-term safety of rituximab in rheumatoid arthritis: 9.5-year follow-up of the global clinical trial programme with a focus on adverse events of interest in RA patients. Ann Rheum Dis 2013; 72: 1496-502. [ Links ]
12. Diwakar L, Gorrie S, Richter A, et al. Does rituximab aggravate pre-existing hypogammaglobulinemia? J Clin Pathol 2010; 63: 275-7. [ Links ]
13. Mogensen TH, Bernth-Jensen JM, Petersen CC, et al. Common variable immuno deficiency unmasked by treatment of immune thrombocytopenic purpura with Rituximab. BMC Hematol 2013; 13: 4. [ Links ]
14. Levy R, Mahévas M, Galicier L, et al. Profound symptomatic hypogammaglobulinemia: a rare late complication after rituximab treatment for immune thrombocytopenia. Report of 3 cases and systematic review of the literature. Autoimmun Rev 2014; 13: 1055-63. [ Links ]
15. Besada E, Koldingsnes W, Nossent JC. Serum immunoglobulin levels and risk factors for hypogammaglobulinaemia during long-term maintenance therapy with rituximab in patients with granulomatosis with polyangiitis. Rheumatology (Oxford) 2014; 53: 1818-24. [ Links ]













