Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) vol.76 no.1 Ciudad Autónoma de Buenos Aires feb. 2016
ARTÍCULO ORIGINAL
Síndrome pulmonar por hantavirus en Buenos Aires, 2009-2014
Ayelén A. Iglesias, Carla M. Bellomo, Valeria P. Martínez
Laboratorio de Hantavirus, Servicio de Biología Molecular, Departamento de Virología, Instituto Nacional de Enfermedades Infecciosas, ANLIS Dr. Carlos G. Malbrán, Buenos Aires, Argentina
Dirección postal: Lic. Ayelén A. Iglesias, Laboratorio de Hantavirus, Servicio de Biología Molecular, INEI-ANLIS Dr. Carlos G. Malbrán, Av. Vélez Sarsfield 563, 1281 Buenos Aires, Argentina e-mail: aiglesias@anlis.gov.ar
Recibido: 18-XI-2015
Aceptado: 18-XII-2015
Resumen
El virus Andes es el agente causante del síndrome pulmonar por hantavirus en Argentina y países limítrofes. Existen varios genotipos característicos en las cuatro regiones endémicas del país. En la provincia de Buenos Aires, zona central, co-circulan tres genotipos: AND-BsAs, AND-Lechiguanas y AND-Plata. A partir de los casos confirmados por ELISA y PCR en tiempo real durante el período 2009-2014 en Buenos Aires, se evaluó la distribución anual, la letalidad y la distribución geográfica dentro de la provincia; mediante RT-PCR y secuenciación nucleotídica se analizaron los genotipos implicados. También se estudió la evidencia epidemiológica para determinar la ruta de infección en casos agrupados. Se analizaron 1386 muestras de casos sospechosos de la provincia de Buenos Aires, confirmándose 88 casos de Síndrome Pulmonar por Hantavirus durante el período 2009-2014. El promedio general fue de 14.3 casos por año. El análisis del genotipo viral se realizó en el 30.7% de los casos confirmados, AND-BsAs fue el de mayor incidencia, caracterizado en el 72% de los casos estudiados. Se confirmó la ocurrencia de un brote de síndrome pulmonar por hantavirus Buenos Aires durante el año 2013, con un registro de casos 3 veces mayor respecto al promedio anual del período 2009-2012, con tendencia a normalizarse durante 2014. La letalidad general fue del 25.6%, con un valor máximo de 45.5% en 2011. Se evaluaron los datos epidemiológicos y los resultados obtenidos del análisis de comparación de genomas virales en 3 agrupamientos de 2 casos cada uno, sugiriendo fuertemente transmisión persona a persona.
Palabras clave: Hantavirus; Buenos Aires; Brote; Transmisión interhumana.
Abstract
Hantavirus pulmonary syndrome in Buenos Aires, 2009-2014.
Andes virus is the causative agent of hantavirus pulmonary syndrome (HPS) in Argentina and neighboring countries. In our country four different areas are affected: Northwest, Southwest, Central and Northeast, where distinct Andes virus genotypes were characterized. Three genotypes were described in Buenos Aires province (Central area): AND-Buenos Aires, AND-Lechiguanas and AND-Plata. In this work, we considered all HPS cases confirmed by ELISA and real time RT-PCR during the period 2009-2014 in Buenos Aires province. The annual distribution, fatality rate and geographic distribution were analyzed. We also analyzed the genotypes involved by RT-PCR and nucleotide sequencing. Finally we evaluated epidemiological data in order to establish the route of transmission. We analyzed 1386 suspect cases of hantavirus infection from Buenos Aires province and we confirmed 88 cases of Hantavirus Pulmonary Syndrome during 2009-2014. The overall average was 14.3 cases per year. The occurrence of a HPS outbreak was confirmed in Buenos Aires province during 2013, showing a 3 fold increase in case number compared to the annual average between 2009 and 2012, tending to normalize during 2014. The overall lethality was 25.6%, with a maximum value of 45.5% in 2011. Genotype analysis was performed in 30.7% of confirmed cases, AND-BsAs show the highest incidence, it was characterized in 72% of the studied cases. Epidemiological data and results of viral genome comparison strongly suggest person-to-person transmission in the three clusters of two cases described in our study.
Key words: Hantavirus; Buenos Aires; Outbreak; Person-to-person transmission.
El virus Andes (ANDV), género Hantavirus, familia Bunyaviridae, es responsable de una de las infecciones virales humanas más patógenas, el síndrome pulmonar por hantavirus (SPH), que afecta a la Argentina y gran parte de Sudamérica. Los hantavirus son virus con envoltura, en su interior presentan una nucleocápside helicoidal con genoma ARN monocatenario de polaridad negativa y dividida en tres segmentos de diferente longitud: S, M y L. El segmento S (del inglés small: "pequeño") codifica la proteína N o nucleoproteína. El segmento M (medium: "medio") codifica las glicoproteínas: G1 y G2 y el segmento L (large: "grande") codifica la ARN polimerasa1-3.
Existen distintas especies de hantavirus productoras de síndrome pulmonar, como el virus Sin Nombre, que afecta otras regiones de América; también existen especies no patógenas. En Asia y Europa las infecciones por hantavirus en humanos se asocian a un grupo de enfermedades conocidas como fiebres hemorrágicas con síndrome renal (FHSR), con distinta severidad según los virus asociados: virus Hantaan, Puumala, Seoul y Dobrava4-6. El SPH fue reconocido por primera vez en 1993, durante un brote de síndrome de distrés respiratorio agudo en el suroeste de los EE.UU.7-10. Luego se identificaron casos de SPH en otros países de América, se describieron diferentes hantavirus y distintas especies de roedores que actúan como reservorio en la naturaleza11-20. En Argentina, ANDV fue caracterizado en 1995 a partir de muestras obtenidas de un paciente fallecido luego de un brote ocurrido en la zona andina de la región patagónica12. Desde entonces se han publicado diversos reportes describiendo casos ocurridos en diferentes regiones del país21-27. En Argentina hay 4 regiones afectadas por el SPH que comprenden las siguientes provincias: en el centro, Buenos Aires, Santa Fe y Entre Ríos; en el sudoeste, Neuquén, Río Negro y Chubut; en el noroeste, Salta y Jujuy; y en el noreste, Misiones. ANDV es el causante de la mayoría de los casos de SPH en el país, existen genotipos característicos de este virus en cada región: AND-Sur en la región suroeste; AND-BsAs, AND-Lec, y AND-Plata en la región central; y AND-Orán, AND-Bermejo y el virus Laguna Negra en la región noroeste. En la región noreste se han registrado pocos casos causados por virus Juquitiba y AND-Lec. De los tres linajes que co-circulan en la provincia de Buenos Aires, AND-BsAs es el mayoritario22. Existe un amplio espectro de severidad entre los casos de SPH, se han registrado algunos casos atípicos con cuadros moderados y en menor medida, algunos leves o asintomáticos. La letalidad varía entre 17 y 40% según la región y aumenta de norte a sur26.
En América, los hantavirus son, en la mayoría de los casos, transmitidos al hombre por roedores sigmodontinos. Sin embargo, la transmisión persona a persona es un mecanismo de infección poco frecuente que ha sido demostrado en 1996 para el linaje ANDV-Sur, prevalente en la región Suroeste de Argentina, y en 2002 para el genotipo ANDV-BsAs en la provincia de Buenos Aires28-30. Desde entonces, varios eventos de casos agrupados fueron reportados tanto en Argentina como en Chile y en varios de ellos pudo ser confirmada la transmisión de persona a persona13, 26, 31, 32.
La distribución de casos de SPH en la zona Central del país varía año a año de acuerdo a factores aún no establecidos. Desde la descripción de SPH en Argentina el registro anual de casos mostró períodos con aumentos significativos; sin embargo, no ha sido posible establecer su regularidad. En un trabajo previo de nuestro laboratorio se detectaron aumentos notables en los años 1999 y 200226. El objetivo del presente trabajo fue evaluar la incidencia del SPH en la provincia de Buenos Aires durante el período 2009-2014, analizando la distribución anual de casos, la letalidad, la distribución geográfica dentro de la provincia, los genotipos implicados y posibles agrupamientos con transmisión persona a persona.
Materiales y métodos
Se analizaron 1386 muestras de pacientes procedentes de la provincia de Buenos Aires durante el período 2009-2014, con sospecha de SPH. Se consideró caso sospechoso de SPH a pacientes con presencia de fiebre mayor a 38 °C acompañada de algún signo de compromiso respiratorio y con antecedentes epidemiológicos. En cada caso se analizó la información clínica y epidemiológica requerida en la ficha clínica-epidemiológica para SPH elaborada por el Ministerio de Salud de la Nación. Las muestras fueron enviadas desde las diferentes Regiones Sanitarias o directamente desde hospitales o centros privados de salud ubicados en diferentes localidades de la provincia.
La confirmación de laboratorio fue realizada teniendo en cuenta el criterio de caso agudo confirmado de SPH: presencia de anticuerpos IgM específicos para ANDV mediante la técnica de ELISA de captura de cadena μ en muestras de suero, y de anticuerpos IgG específicos mediante la técnica de ELISA directa según lo descripto previamente33. Los casos positivos para IgM pero negativos para IgG se confirmaron por seroconversión en segunda muestra o por detección de ARN viral mediante RT-PCR en tiempo real. El ARN se extrajo a partir de 200 μl de sangre entera usando TRIzol (Invitrogen) y purificado por medio del kit RNaid kit (QBioGene, Solon, Ohio) siguiendo las instrucciones recomendadas por el fabricante. Para la detección de genoma viral se realizó RT-PCR en tiempo real (RT-qPCR), química TaqMan, utilizando el equipo MyiQ single color PCR detection system (BioRad, Hercules, CA). Los cebadores y sondas fueron diseñados en base a la región conservada del segmento viral S34. Se utilizó el kit qScript™One-Step qRT-PCR (Quanta BioSciences, USA) con cebadores en concentración 1 mM, sonda 100 nM, 12.5 μl del buffer 2X, 2 μl de ARN, y agua libre de RNasas hasta completar un volumen final de 25 μl. Cada muestra fue analizada en duplicado.
La caracterización de genotipo viral se realizó amplificando secuencias mediante RT-PCR seguida de PCR anidada específica para un fragmento parcial del segmento M (nt 2715-2941), correspondiente a la glicoproteína Gc según se describió previamente18.
Los productos de la amplificación fueron separados por electroforesis en gel de agarosa, purificados, y secuenciados en secuenciador automático capilar ABI Prism R3500 utilizando el kit comercial ABI PRISM Big Dye Terminator Sequencing kit (Applied Biosystems, UK). Las reacciones fueron realizadas en un termociclador Applied Biosystems 2720 Thermal Cycler. Las secuencias obtenidas fueron analizadas y comparadas con secuencias de casos previos ocurridos en la zona utilizando diferentes herramientas del programa MEGA 6.06.
Resultados
Durante el periodo en estudio se analizaron en total 1386 muestras de casos sospechosos de infección por hantavirus provenientes de la provincia de Buenos Aires, confirmándose 88 casos de SPH. Del total de casos, 81 fueron confirmados por detección de IgM e IgG en la primera muestra (IgM+/IgG+). Los 7 casos restantes mostraron presencia de IgM y ausencia de IgG (IgM+/IgG-), 5 de ellas fueron confirmadas por seroconversión en una segunda muestra y 2 por RT-qPCR. Uno de los casos cuyo diagnóstico confirmatorio se realizó por RT-qPCR fue un paciente fallecido del cual no fue posible obtener una segunda muestra y el restante un paciente en el cual no se detectó seroconversión (Fig. 1).
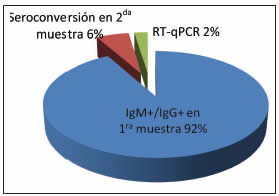
Fig. 1. Porcentaje de casos confirmados de SPH por diagnóstico serológico en primera muestra, seroconversión o diagnóstico molecular. Total de casos confirmados: 88.
Entre los pacientes sospechosos para SPH analizados no se detectaron casos sin respuesta de IgM pero con títulos de IgG (IgM-/IgG+); sin embargo, 3 fueron descartados por presentar respuesta de IgM pero no de IgG (IgM+/IgG-), y ausencia de genoma viral en muestras agudas; además, en uno de los casos el análisis de una segunda muestra no evidenció variación de título de IgM ni seroconversión.
En todos los casos, los síntomas registrados durante la fase prodrómica de la enfermedad coincidieron con el cuadro clínico descripto anteriormente para SPH25, 31, 35-37, caracterizado por la presencia de fiebre, cefalea y mialgias; esta fase fue seguida por diferentes grados de compromiso respiratorio en el 94.3% de los casos (83/88) y de otros órganos o sistemas: el 34% de los pacientes (30/88) presentó compromiso hepático; el 29.5% (26/88) compromiso renal; el 19.3% (17/88) síntomas hemorrágicos; el 95.4% (84/88) presentó plaquetopenia con un rango entre 10 000 y 142 000/mm3 (valor promedio: 59 064; mediana: 52 000), un paciente, varón adulto mostró recuento de plaquetas levemente superior al valor mínimo normal (177 000/mm3) y un niño de 2 años recuento normal de plaquetas; en los otros dos casos este dato fue desconocido por no encontrarse detallado en la ficha clínico-epidemiológica correspondiente. Tal como se informó anteriormente26, el recuento de plaquetas resultó un indicador importante para reconocer probables casos de SPH. El promedio de días de evolución de la primera muestra enviada para diagnóstico, establecidos desde la fecha de inicio de síntomas hasta la fecha de extracción, fue de 6.3 días (n = 60), con un rango entre 2 y 19 días; en algunos casos (n = 28) no fue posible precisar el tiempo de evolución por falta de información en la ficha clínico-epidemiológica recibida al momento del ingreso de la muestra al laboratorio.
La caracterización del genotipo viral se realizó en el 30.7% (27/88) de los casos confirmados. Se verificó la circulación de los tres linajes reportados previamente para la provincia de Buenos Aires18. Por otro lado, se confirmaron dos casos con genotipo AND-Sur, uno de ellos con residencia en la Ciudad de Buenos Aires pero con historia de viaje reciente a áreas endémicas de las provincias de Río Negro y Chubut; el otro, un niño con domicilio en la provincia de Río Negro que se encontraba en la Ciudad de Buenos Aires al momento del inicio de los síntomas. Como antecedente epidemiológico, el padre del niño fue previamente confirmado como caso de SPH y fallecido 31 días antes del inicio de síntomas de su hijo. Tanto el niño como el padre realizaron actividades de recreación al aire libre, acampando a orillas del Lago Steffen (Río Negro). Estos dos casos fueron excluidos para los análisis posteriores por ser de genotipo AND-Sur, característico de la zona suroeste de nuestro país.
Con respecto a los genotipos circulantes en la provincia de Buenos Aires, la mayor incidencia y más amplia distribución geográfica correspondió al genotipo AND-BsAs, caracterizado en el 72% de los casos analizados; AND-Lec fue caracterizado en el 20% y asociado principalmente a casos de localidades del litoral del río Paraná y del Río de La Plata (Fig. 4); AND-Plata fue detectado solo en el 8% de los casos (Tabla 1). Estos resultados coinciden con datos publicados previamente22.
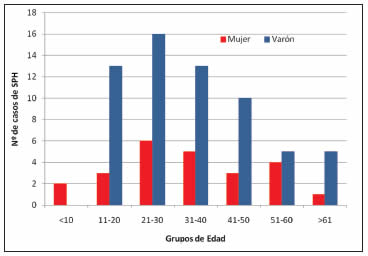
Fig. 4. Distribución de casos de SPH por género y grupos de edad durante el período 2009-2014.
Tabla 1 . Incidencia de los genotipos circulantes en la provincia de Buenos Aires durante el período 2009-2014

Se analizó el genotipo en 25 de los 86 casos confirmados para la provincia
Considerando la información suministrada en la ficha epidemiológica de cada paciente se analizaron los posibles eventos de exposición. Dentro de los factores de riesgo reportados con mayor frecuencia se encuentran: actividades de recreación al aire libre (camping, pesca), limpieza de depósitos o viviendas deshabitadas y residir en zonas rurales. Además, tres pacientes indicaron haber estado en contacto con casos con diagnóstico confirmado de SPH, por lo tanto se evaluó la posibilidad de transmisión interhumana en estos casos, para lo cual se definieron 3 agrupamientos de 2 casos cada uno, con relación conyugal, implicando un único evento de transmisión por agrupamiento. Agrupamiento 1 (A1): ambos pacientes residentes de la ciudad de San Antonio de Padua y con antecedente de viaje reciente a la costa atlántica; el caso índice (A1-H) presentó síntomas 14 días después de regresar del viaje. Agrupamiento 2 (A2): los pacientes residían en zona urbana en el partido de Berazategui; sin embargo, el caso índice (A2-H) trabajaba en una fábrica ubicada en zona rural en el partido limítrofe de Florencio Varela. Agrupamiento 3 (A3): los pacientes no compartían el lugar de residencia; el caso índice (A3-H) trabajaba y residía en el partido de Castelli, provincia de Buenos Aires y su cónyuge (A3-M) residía en la localidad de Merlo, provincia de San Luis, ambos mantuvieron contacto al momento de la internación del caso índice. El lapso de inicio de la enfermedad entre ambos casos fue de 24 días para A1, 23 días para A2 y 27 días para A3 (Fig. 2). A partir del análisis de lugares probables de infección dentro del rango de tiempo reconocido de incubación y del mapa de riesgo del SPH en la provincia de Buenos Aires, se identificó como lugar más probable de infección del caso índice para A2 y A3 el lugar de trabajo de cada uno, y para A1 la zona de veraneo. A partir del análisis de las secuencias nucleotídicas parciales del genoma viral obtenido de muestras de sangre de estos seis pacientes se identificó el genotipo AND-BsAs y se comprobó un 100% de identidad dentro de cada agrupamiento, por lo cual no se pudo demostrar que la infección de los 3 casos secundarios tuviera un origen diferente al caso índice. Sin embargo, analizando los tiempos de inicio de los síntomas para los casos secundarios de cada agrupamiento, se considera improbable que la infección haya ocurrido en el mismo sitio para A1 y A2. La información epidemiológica obtenida sobre A3, indica que el caso secundario pudo haber contraído la infección por contacto directo con el caso índice o por haber visitado su lugar de residencia durante la etapa aguda de su enfermedad.

Fig. 2. Eventos de transmisión persona a persona. Entre los casos confirmados de SPH relacionados entre sí se analizó la posibilidad de transmisión interhumana. A1, A2 y A3: tres diferentes agrupamientos con relación conyugal; A1-H, A2-H y A3-H son casos índices varones y A1-M, A2-M y A3-M son casos secundarios mujeres.
El análisis de la distribución anual del SPH en la provincia de Buenos Aires mostró un promedio de 9.5 casos por año entre 2009 y 2012 y luego un aumento significativo de la incidencia en 2013 arrojando un registro de 29 casos confirmados (Tabla 2). Este registro implica un aumento de más de 3 veces en el número anual de casos con respecto a la media del período 2009-2012. En 2014, el total de casos también resultó mayor a dicho período pero con tendencia a normalizarse (Fig. 3). El promedio general del período 2009-2014 fue de 14.3 casos por año.
Tabla 2 . Distribución anual de casos y letalidad anual y total

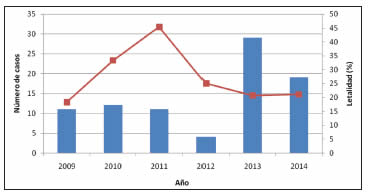
Fig. 3. Distribución anual del número de casos de SPH (barras) y letalidad anual (línea).Total de casos confirmados para la provincia de Buenos Aires: 86.
La letalidad general observada durante el período 2009-2014 fue del 25.6% (22/86), con un valor máximo en 2011. Del total de casos confirmados para los linajes circulantes en Buenos Aires, el 72.1% (62/86) correspondió a hombres y el 27.9% (24/86) a mujeres, con una letalidad de 19% (12/63) en hombres y 40% (10/25) en mujeres.
El rango de edad de los pacientes confirmados fue de 1 a 72 años, con una media de 35 años. El 10.4% (9/86) de los casos ocurrió en niños (≤16 años). El grupo de edad con mayor incidencia fue entre 21 y 30 años para ambos sexos (Tabla 3, Fig. 4), esto coincide con datos publicados anteriormente26.
Tabla 3. Distribución de casos y letalidad por género y grupos de edad

Total de casos analizados: 86
El análisis de la distribución geográfica del SPH dentro de la provincia de Buenos Aires indicó que la zona más afectada fue la Región Sanitaria XI. Esta región registró el 54.6% (47/86) de los casos confirmados entre 2009 y 2014, de los cuales el 53.2% (25/47) ocurrió en el partido de La Plata (Fig. 5). Otros partidos de dicha Región afectados, pero en menor medida, fueron Chascomús, Castelli, San Miguel del Monte, Ensenada, Berisso y Pila. El resto de los casos se encontró distribuido entre diferentes localidades del Conurbano Bonaerense y sus alrededores, predominantemente en la franja noreste de la provincia.

Fig. 5. Distribución geográfica de Regiones Sanitarias de la provincia de Buenos Aires (A); fuente: página web del Ministerio de Salud de la Provincia de Buenos Aires (www.ms.gba.gov.ar); linajes virales de virus Andes y número de casos de SPH registrados en cada partido durante el período en estudio (B).
Discusión
El SPH es una enfermedad grave, sin tratamientos preventivos ni antivirales específicos. En Argentina su incidencia anual es baja y variable, de forma independiente en cada zona endémica y estaría asociada a diferentes factores como la actividad humana y características geográficas y climáticas38, 39. Los reservorios en la naturaleza de los hantavirus patogénicos son roedores silvestres; por lo tanto, considerando que las características del hábitat y la disponibilidad de alimento determinan las condiciones de abundancia poblacional y estructura demográfica dentro de las poblaciones de roedores, su distribución y ecología también influiría en la epidemiología del SPH40, 41. Por otro lado, características propias del virus como su forma de transmisión ex vivo, sin vector intermediario, también influirían en la variación de la incidencia. En experimentos in vitro, ANDV ha mostrado una alta estabilidad de su capacidad infectiva ex vivo por períodos prolongados en condiciones de humedad elevada; dicha estabilidad mostró una correlación inversa con el aumento de la temperatura (Bellomo CM, Padula PJ, Martínez VP; "El hantavirus Andes mostró una prolongada estabilidad ex vivo y alta susceptibilidad a la inactivación química", XI Congreso Argentino de Virología - II Congreso Latinoamericano de Virología, 23 al 26 de junio de 2015, Buenos Aires). Por lo tanto es de esperarse que las fluctuaciones ambientales interanuales en los valores de temperatura y humedad relativa sean factores influyentes en la variación de la incidencia anual y también en los valores de letalidad por SPH. En la Argentina existen 4 zonas con climas de alta humedad, y en todas ellas existen registros de casos de SPH.
En este trabajo se confirmó un incremento de más de 3 veces en el número de casos de SPH registrados durante el año 2013 con respecto a la media del período 2009-2012 para la provincia de Buenos Aires. El análisis de la distribución geográfica durante dicho brote no mostró cambios significativos con respecto a otros años, siendo el área de mayor incidencia la zona periférica de La Plata y partidos aledaños. Contrariamente, en el año 2012 se observó un registro significativamente menor de casos en la provincia de Buenos Aires. Desde el año 1995 se han observado brotes similares en la región sin poder establecerse un patrón regular de variación interanual22, 26. Las diferencias observadas en la distribución anual de casos podrían explicarse a partir de las fluctuaciones interanuales en las condiciones climáticas, determinadas por la humedad relativa, el volumen de precipitaciones y la temperatura, registradas durante las diferentes estaciones del año; las condiciones climáticas podrían influir tanto en la estabilidad del virus en el ambiente como en el tamaño y la dinámica de las poblaciones de roedores y en las condiciones de transmisión del virus dentro de dichas poblaciones. Por otro lado, parte de las variaciones en el registro anual de casos podría asociarse al grado de sospecha clínica de SPH; a su vez, el sub-registro podría estar relacionado con brotes de otras enfermedades con sintomatología compatible tales como dengue e influenza.
La letalidad ha mostrado un descenso a lo largo del período analizado. La experiencia de la comunidad médica tanto en la sospecha rápida como en el tratamiento de soporte aplicado tempranamente en casos de SPH podría jugar un rol importante en el descenso de la letalidad. Sin embargo, no puede descartarse una subestimación de la letalidad, ya que los registros del presente trabajo recopilan la información recibida al momento de comunicar el resultado del diagnóstico confirmatorio y en muchos casos no se cuenta con información sobre la evolución definitiva del paciente.
La respuesta humoral en pacientes con SPH suele ser temprana y se evidencia en la mayoría de los casos con altos títulos de anticuerpos IgM, IgA e IgG18. En nuestro laboratorio se realiza el diagnóstico serológico en base a la nucleoproteína viral recombinante del ANDV para la detección de anticuerpos IgM e IgG específicos contra el principal agente causal del SPH en la Argentina33. Se ha comunicado que los pacientes que no desarrollan anticuerpos de tipo IgG presentan mal pronóstico en cuanto a la evolución clínica5, 18, 42, por lo cual, en estos casos, para la confirmación definitiva se requiere detectar seroconversión en una muestra posterior o detectar genoma viral en la primera muestra. Esta metodología diagnóstica permitió en el presente trabajo descartar dos casos positivos para IgM y negativos para IgG y detección de genoma viral.
La infección por hantavirus ocurre en su gran mayoría por inhalación de aerosoles contaminados, producidos a partir de excretas de roedores infectados. Por este motivo, se considera al SPH como una enfermedad que afecta principalmente zonas rurales o silvestres como el área periférica de La Plata y partidos aledaños donde se desarrollan actividades agrícolas; en un trabajo previo se han descripto diversas actividades de riesgo que incluyen tareas rurales relacionadas con la agricultura y limpieza de depósitos26. La transmisión desde el roedor al hombre es un evento accidental y poco frecuente, esto determina que normalmente los casos de SPH ocurran en forma aislada. Cuando se informan varios casos relacionados entre sí, se sospecha la posibilidad de transmisión persona a persona; sin embargo, la infección por exposición a la misma fuente también es posible y debe ser evaluada. Se deben tener en cuenta los datos epidemiológicos, el tiempo transcurrido entre el inicio de síntomas del caso índice y el/los caso/s secundario/s y el análisis de similitud genética viral obtenido de cada paciente. En este trabajo se evaluó el mecanismo de transmisión en tres agrupamientos diferentes, en base a los datos epidemiológicos y el período de tiempo transcurrido entre el inicio de síntomas del caso índice y el caso secundario en cada agrupamiento, se sugiere una alta probabilidad de que la infección del caso secundario haya ocurrido por transmisión persona a persona y no por exposición a una fuente común de infección en el lugar de residencia. El análisis genético no reveló diferencias nucleotídicas; por lo tanto, no se pudo descartar la transmisión interhumana en ninguno de los agrupamientos analizados. En un trabajo previo30, se analizaron 4 agrupamientos, confirmándose 3 eventos de transmisión interhumana en base al análisis genético y epidemiológico. En uno de dichos eventos esta confirmación fue posible principalmente debido al prolongado período transcurrido de inicio de síntomas entre los dos casos, al igual que lo observado en los 3 agrupamientos del presente trabajo. Los eventos de exposición a la misma fuente suelen mostrar pocos días de diferencia entre los períodos de inicio de síntomas de los casos que conforman un agrupamiento. El porcentaje de ocurrencia de este mecanismo de transmisión en el período estudiado sería de 3.5%, levemente mayor al reportado previamente para todo el país, 2.5% en el período 1995-200826. La transmisión persona a persona de ANDV también ha sido informada en Chile en diferentes oportunidades13, 32, 43.
Si bien la zona más afectada fue el partido de La Plata y sus alrededores, la distribución de SPH en la provincia de Buenos Aires es amplia y abarca localidades con alta densidad poblacional, por lo cual la población con riesgo de exposición es grande. Considerando que no existen tratamientos preventivos ni antivirales efectivos, frente a la sospecha de infección por hantavirus el diagnóstico rápido y efectivo constituye una herramienta fundamental para la aplicación del tratamiento de soporte de forma temprana en los casos graves. Una completa evaluación epidemiológica alrededor de cada caso confirmado también resulta imprescindible para la detección a tiempo de casos secundarios de transmisión interhumana. Por otro lado, profundizar la investigación de los factores ambientales y climáticos que determinan variaciones en la distribución e incidencia anual resultaría en un gran aporte al conocimiento acerca de la dinámica de los hantavirus aplicables a la prevención del SPH.
Conflicto de intereses: Ninguno para declarar
Agradecimientos: Este estudio fue parcialmente financiado por FONCyT (PICTO N° 0112-2011).
Bibliografia
1. Schmaljohn CS, Dalrymple JM. Analysis of Hantaan virus RNA: evidence for a new genus of bunyaviridae. Virology 1983; 131: 482-91. [ Links ]
2. Plyusnin A, Vapalahti O, Vaheri A. Hantaviruses: genome structure, expression and evolution. J Gen Virol 1996; 77: 2677-87. [ Links ]
3. Bouloy M. Bunyaviridae: genome organization and replication strategies. Adv Virus Res 1991; 40: 235-75. [ Links ]
4. Butler JC, Peters CJ. Hantaviruses and hantavirus pulmonary syndrome. Clin Infect Dis 1994; 19: 387-94; quiz 395. [ Links ]
5. Macneil A, Nichol ST, Spiropoulou CF. Hantavirus pulmonary syndrome. Virus Res 2011; 162: 138-47. [ Links ]
6. Haemorrhagic fever with renal syndrome: memorandum from a WHO meeting. Bull World Health Organ 1983; 61: 269-75. [ Links ]
7. Nichol ST, Spiropoulou CF, Morzunov S, et al. Genetic identification of a hantavirus associated with an outbreak of acute respiratory illness. Science 1993; 262: 914-7. [ Links ]
8. Khan AS, Ksiazek TG, Peters CJ. Hantavirus pulmonary syndrome. Lancet 1996; 347: 739-41. [ Links ]
9. Khan AS, Khabbaz RF, Armstrong LR, et al. Hantavirus pulmonary syndrome: the first 100 US cases. J Infect Dis 1996; 173: 1297-303. [ Links ]
10. Peters CJ, Khan AS, Zaki SR. Hantaviruses in the United States. Arch Intern Med 1996; 156: 705-7. [ Links ]
11. Hjelle B, Torrez-Martinez N, Koster FT. Hantavirus pulmonary syndrome-related virus from Bolivia. Lancet 1996; 347: 57. [ Links ]
12. Lopez N, Padula P, Rossi C, Lazaro ME, Franze-Fernandez MT. Genetic identification of a new hantavirus causing severe pulmonary syndrome in Argentina. Virology 1996; 220: 223-6. [ Links ]
13. Toro J, Vega JD, Khan AS, et al. An outbreak of hantavirus pulmonary syndrome, Chile, 1997. Emerg Infect Dis 1998; 4: 687-94. [ Links ]
14. da Silva MV, Vasconcelos MJ, Hidalgo NT, et al. Hantavirus pulmonary syndrome. Report of the first three cases in Sao Paulo, Brazil. Rev Inst Med Trop Sao Paulo 1997; 39: 231-4. [ Links ]
15. Johnson AM, de Souza LT, Ferreira IB, et al. Genetic investigation of novel hantaviruses causing fatal HPS in Brazil. J Med Virol 1999; 59: 527-35. [ Links ]
16. Johnson AM, Bowen MD, Ksiazek TG, et al. Laguna Negra virus associated with HPS in western Paraguay and Bolivia. Virology 1997; 238: 115-27. [ Links ]
17. Vincent MJ, Quiroz E, Gracia F, et al. Hantavirus pulmonary syndrome in Panama: identification of novel hantaviruses and their likely reservoirs. Virology 2000; 277: 14-9. [ Links ]
18. Padula PJ, Colavecchia SB, Martinez VP, et al. Genetic diversity, distribution, and serological features of hantavirus infection in five countries in South America. J Clin Microbiol 2000; 38: 3029-35. [ Links ]
19. Iversson LB, da Rosa AP, Rosa MD, Lomar AV, Sasaki Mda G, LeDuc JW. Infecçäo humana por Hantavirus no sul e sudeste do Brasil. Rev Assoc Med Bras 1994; 40: 85-92. [ Links ]
20. Lopez N, Padula P, Rossi C, et al. Genetic characterization and phylogeny of Andes virus and variants from Argentina and Chile. Virus Res 1997; 50: 77-84. [ Links ]
21. Levis S, Rowe JE, Morzunov S, Enria DA, St Jeor S. New hantaviruses causing hantavirus pulmonary syndrome in central Argentina. Lancet 1997; 349: 998-9. [ Links ]
22. Martínez VP, Colavecchia S, García Alay M, et al. Síndrome pulmonar por hantavirus en la Provincia de Buenos Aires. Medicina (B Aires) 2001; 61: 147-56. [ Links ]
23. Sosa-Estani S, Martínez VP, González Della Valle M, et al. Hantavirus en población humana y de roedores en un área endémica para el síndrome pulmonar por Hantavirus en la Argentina. Medicina (B Aires) 2002; 62: 1-8. [ Links ]
24. Levis S, Garcia J, Pini N, et al. Hantavirus pulmonary syndrome in northwestern Argentina: circulation of Laguna Negra virus associated with Calomys callosus. Am J Trop Med Hyg 2004; 71: 658-63. [ Links ]
25. Lázaro ME, AJ Resa, CM Barclay, et al. Síndrome pulmonar por Hantavirus en el sur andino argentino. Medicina (B Aires) 2000; 60: 289-301. [ Links ]
26. Martínez VP, Bellomo CM, Cacace ML, Suárez P, Bogni L, Padula PJ. Hantavirus pulmonary syndrome in Argentina, 1995-2008. Emerg Infect Dis 2010; 16: 1853-60. [ Links ]
27. Bellomo C, Nudelman J, Kwaszka R, et al. Expansión geográfica del síndrome pulmonar por Hantavirus en la Argentina. Informe del caso más austral. Medicina (B Aires) 2009; 69: 647-50. [ Links ]
28. Padula PJ, Edelstein A, Miguel SD, López NM, Rossi CM, Rabinovich RD. Brote epidémico del síndrome pulmonar por Hantavirus en la Argentina. Evidencia molecular de la transmisión persona a persona del virus Andes. Medicina (B Aires) 1998; 58 Suppl 1: 27-36. [ Links ]
29. Padula PJ, Edelstein A, Miguel SD, López NM, Rossi CM, Rabinovich RD. Hantavirus pulmonary syndrome outbreak in Argentina: molecular evidence for person-to-person transmission of Andes virus. Virology 1998; 241: 323-30. [ Links ]
30. Martínez VP, Bellomo C, San Juan J, et al. Person-to-person transmission of Andes virus. Emerg Infect Dis 2005; 11: 1848-53. [ Links ]
31. Pinna DM, Martínez VP, Bellomo CM, López C, Padula P. Nueva evidencia epidemiológica y molecular a favor de la transmisión interhumana para el linaje Sout del hantavirus Andes. Medicina (B Aires) 2004; 64: 43-6. [ Links ]
32. Ferres M, Vial P, Marco C, et al. Prospective evaluation of household contacts of persons with hantavirus cardiopulmonary syndrome in Chile. J Infect Dis 2007; 195: 1563-71. [ Links ]
33. Padula PJ, Rossi CM, Della Valle MO, et al. Development and evaluation of a solid-phase enzyme immunoassay based on Andes hantavirus recombinant nucleoprotein. J Med Microbiol 2000; 49: 149-55. [ Links ]
34. Safronetz D, Hegde NR, Ebihara H, et al. Adenovirus vectors expressing hantavirus proteins protect hamsters against lethal challenge with andes virus. J Virol 2009; 83: 7285-95. [ Links ]
35. Campos GM, Borges AA, Badra SJ, et al. Síndrome pulmonar e cardiovascular por hantavírus: aspectos clínicos de uma doença emergente no sudeste brasileiro. Rev Soc Bras Med Trop 2009; 42: 282-9. [ Links ]
36. Silva-Vergara ML, Costa JC Jr, Barata CH, Curi VG, Tiveron CG Jr, Teixeira AC. Hantavirus pulmonary syndrome in Uberaba, Minas Gerais, Brazil. Mem Inst Oswaldo Cruz 2002; 97: 783-7. [ Links ]
37. Riquelme R, Riquelme M, Torres A, et al. Hantavirus pulmonary syndrome, southern Chile. Emerg Infect Dis 2003; 9: 1438-43. [ Links ]
38. Busch M, Cavia R, Carbajo AE, Bellomo C, González Capria S, Padula P. Spatial and temporal analysis of the distribution of hantavirus pulmonary syndrome in Buenos Aires Province, and its relation to rodent distribution, agricultural and demographic variables. Trop Med Int Health 2004; 9: 508-19. [ Links ]
39. Padula P, Figueroa R, Navarrete M, et al. Transmission study of Andes hantavirus infection in wild sigmodontine rodents. J Virol 2004; 78: 11972-9. [ Links ]
40. Glass GE, Yates TL, Fine JB, et al. Satellite imagery characterizes local animal reservoir populations of Sin Nombre virus in the southwestern United States. Proc Natl Acad Sci U S A 2002; 99: 16817-22. [ Links ]
41. Riquelme R, Rioseco ML, Bastidas L, et al. Hantavirus pulmonary syndrome, Southern Chile, 1995-2012. Emerg Infect Dis 2015; 21: 562-8. [ Links ]
42. Bharadwaj M, Nofchissey R, Goade D, Koster F, Hjelle B. Humoral immune responses in the hantavirus cardiopulmonary syndrome. J Infect Dis 2000; 182: 43-8. [ Links ]
43. Martinez-Valdebenito C, Calvo M, Vial C, et al. Person-to-person household and nosocomial transmission of andes hantavirus, Southern Chile, 2011. Emerg Infect Dis 2014; 20: 1629-36. [ Links ]














