Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) vol.76 no.1 Ciudad Autónoma de Buenos Aires feb. 2016
ARTÍCULO ORIGINAL
Piomiositis primaria
Revisión de 32 casos diagnosticados por ecografía
Nora Méndez1, Elisa Gancedo1, Mirna Sawicki1, Nora Costa2, Rosalinda Di Rocco3
1 Sector Ecografía de la División Radiodiagnóstico,
2 Unidad Bacteriología,
3 Unidad Cirugía, Hospital de Infecciosas Francisco J. Muñiz, Buenos Aires, Argentina
Dirección postal: Dra. Nora A. Méndez, Bogotá 2021 4° Piso A, 1406 Buenos Aires, Argentina
e-mail: namendez@fibertel.com.ar
Recibido: 23-IX-2015
Aceptado: 5-XI-2015
Resumen
La piomiositis primaria es la infección bacteriana por vía hematógena del músculo estriado. Está relacionada con factores de riesgo como HIV/sida y otras enfermedades inmunodepresoras, pudiendo estar asociados a factores locales de estrés muscular. El agente etiológico más frecuente es Staphylococcus aureus. Su retardo diagnóstico puede ocasionar una evolución fatal. En esta serie se evaluaron 32 pacientes con piomiositis primaria diagnosticados por ecografía. El factor de riesgo más frecuente fue el HIV/sida (61%). Los factores locales se detectaron en 21 casos (66%): en primer lugar, la práctica de futbol. La forma monofocal se observó en 19 (59%) los músculos más frecuentemente afectados fueron cuádriceps, gemelos y psoas. Se obtuvieron muestras para estudio bacteriológico en 30 casos, 27 de material del absceso y 22 hemocultivos. En los 30 casos se aisló el agente etiológico. El Staphylococcus aureus representó el 83.3% (25 casos) y Escherichia coli, Nocardia spp., Streptococcus agalactiae, Micobacteria no tuberculosa y Pseudomonas aeruginosa fueron aislados en un caso cada uno. Recibieron tratamiento quirúrgico 17 pacientes, punciones aspirativas, 9; antibióticos solamente, 4. Presentaron buena evolución 28 de los 30 pacientes (93.3%), óbitos, 2 (6.6%); desconocida, 2. Este estudio concluyó que: ante la etiología diversa y cambiante de las piomiositis primarias es importante reconocer el agente involucrado y su sensibilidad antibiótica. La ecografía realiza la evaluación en tiempo real y puede ser utilizada como guía de punción facilitando el diagnóstico inmediato. Esto la diferencia de otras técnicas, transformándola en un método de primera línea para el estudio de esta enfermedad.
Palabras clave: Piomiositis; Ultrasonografía; HIV/sida; Staphylococcus aureus.
Abstract
Primary pyomyositis. Review of 32 cases diagnosed by ultrasound.
Primary pyomyositis is a bacterial infection of striated muscle which is acquired by hematogenous route. It is related to risk factors such as HIV/aids and other immuno suppressing diseases, and can be associated with local muscle stress factors. The most frequent etiology is Staphylococcus aureus. Its diagnostic delay may cause a fatal evolution. In this series 32 patients with primary pyomyositis diagnosed by ultrasound were evaluated. The most frequent risk factor was HIV/aids (61%). Local factors were detected in 21 (66%) cases: first, the practice of football. The monofocal form was observed in 19 (59%), the most commonly affected muscles were quadriceps, calves and psoas. Samples for bacteriological study were obtained in 30 cases, 22 blood culture and 27 abscess materials. In 30 cases the etiologic agent was isolated. Staphylococcus aureus accounted for 83.3% (25 cases) and Escherichia coli, Nocardia spp., Streptococcus agalactiae, nontuberculous mycobacteria, Pseudomonas aeruginosa were isolated in one case each. Seventeen patients received surgical treatment, aspirative punctures, 9; antibiotics alone, 4. Twenty eight (93.3%) patients had a good evolution; deaths, 2 (6.6%); unknown, 2. Main conclusions of this study were: due to the diverse and changing etiology of the primary pyomyositis it is important to recognize the etiological agent involved and their antibiotic susceptibility.The ultrasound performed the study in real time so it can be used to guide the puncture and to facilitate the immediate diagnosis. This makes the difference with other techniques and transforms it into a first-line method for the study of this disease.
Key words: Pyomyositis; Ultrasonography; HIV/aids; Staphylococcus aureus.
La piomiositis primaria es la infección bacteriana del músculo estriado con formación de abscesos, ocasionada por diseminación hematógena del agente causal. Esta entidad fue descripta por Scriba en 1885 en países tropicales y se la denominó piomiositis tropical1, 2. En la actualidad se la relaciona a condiciones que deterioran los mecanismos generales de defensa del huésped, como HIV/sida, diabetes, desnutrición, neoplasias, enfermedades autoinmunes, hepatopatías crónicas, drogadicción endovenosa, uso de esteroides, pudiendo asociarse a factores locales, como injurias musculares, micro traumatismos o estrés muscular. Se la denomina piomiositis no tropical3-10. El cuadro clínico se caracteriza por fiebre, síntomas locales como dolor, tumefacción y aumento de tamaño del músculo y puede ser causa de fiebre de
origen desconocido1, 2. En los estadios iniciales, cuando los músculos afectados son profundos, la aponeurosis muscular y la fascia profunda retardan transitoriamente el compromiso del tejido celular subcutáneo y la piel, los signos inflamatorios superficiales suelen estar ausentes. El diagnóstico diferencial debe hacerse con trombosis venosa profunda, desgarro muscular, celulitis con abscesos profundos, fascitis, osteomielitis, hematomas o tumores, y en los pacientes HIV(+) deben incluirse también los linfomas. En los casos de piomiositis del músculo psoas ilíaco, el diagnóstico diferencial debe establecerse con otras entidades que produzcan fiebre, dolor (lumbar, fosa ilíaca derecha, cadera o muslo) espontaneo o a la movilización del miembro inferior11,12. Para el diagnóstico se requiere de la sospecha clínica y del aporte de las imágenes. Su retraso puede ocasionar una evolución fatal.
Los ecógrafos actuales, utilizando transductores de alta resolución, permiten realizar estudios de alto detalle anatómico de las estructuras músculo-esqueléticas, convirtiendo al método en una herramienta útil para un primer abordaje.
El presente trabajo analiza una serie de pacientes con piomiositis primarias diagnosticadas por ecografía en un Hospital de Enfermedades Infecciosas de la Ciudad de Buenos Aires entre los años 2001 y 2015. El objetivo es evaluar las características de esta población enfocado en los aspectos clínicos, epidemiológicos y diagnósticos.
Materiales y métodos
En un estudio observacional retrospectivo se analizaron las historias clínicas de pacientes internados que presentaron piomiositis primaria diagnosticados por ecografía, en un período de 14 años, entre febrero de 2001 y abril de 2015.
El diagnóstico de piomiositis fue establecido por el hallazgo ecográfico de colección intramuscular, confirmado por punción percutánea, drenaje quirúrgico y/o aislamiento microbiológico.
Los exámenes fueron realizados con Ecógrafos Philips HD11, Aloka SSD2000 y Esaote MyLab 40; utilizando transductores lineales y convexos de 3 a 12 MHz con doppler color.
Se tabularon las siguientes variables: sexo, edad, factores de riesgo, factores locales, comorbilidades, probable puerta de entrada, presencia de fiebre, dolor local, tumefacción o masa palpable, nivel de hemoglobina, glóbulos blancos, plaquetas y albúmina, serología para HIV y nivel de LTCD4, ultrasonografía músculo-esquelética, ecocardiogramas, estudios bacteriológicos, otras imágenes, tratamiento y evolución.
Diagnóstico microbiológico
El diagnóstico bacteriológico consistió en la observación microscópica y el cultivo del material obtenido por punción y/o hemocultivos. Los extendidos de las muestras se colorearon con Gram y Ziehl-Neelsen para la búsqueda y caracterización de bacterias de acuerdo a su morfología y caracteres tintoriales. Cada muestra de partes blandas se sembró en una placa de agar sangre, agar chocolate, agar CLDE, caldo tioglicolato y medios de cultivo específicos para bacterias anaerobias (agar anaerobios) y se incubaron hasta 7 días. Los hemocultivos se realizaron por el procesamiento de dos muestras de sangre, las cuales se inocularon en un frasco para hemocultivo aeróbico y otro anaeróbico, respectivamente.
Las colonias aisladas se identificaron según la metodología habitual con pruebas bioquímicas y/o tarjetas de un sistema automatizado (Vitek2-Biomérieux-Francia). Se realizaron pruebas de sensibilidad antibiótica según el método de Kirby-Bauer y el sistema automatizado (Vitek2-Biomérieux-Francia). Para la búsqueda de micobacterias, los materiales se sembraron en Löwenstein-Jensen y Stonebrink y se incubaron a 37 °C dos meses; los cultivos fueron analizados macro y microscópicamente (velocidad y temperatura de crecimiento, morfología y pigmentación de las colonias, pruebas bioquímicas). La identificación se realizó por pruebas de biología molecular (PRA).
El análisis estadístico fue efectuado con el programa SPSS 20.0. Se aplicó el de Mann-Whitney para comparar medianas. El nivel de significación considerado fue 0.05.
El trabajo fue autorizado por el Comité de Docencia e Investigación del Hospital de Infecciosas F. J. Muñiz.
Resultados
El estudio incluyó a 32 pacientes con criterios diagnósticos de piomiositis primaria: 23 varones (72%) y 9 mujeres (28%). Edad promedio: 32 años (rango 14-44), mediana (Me) 33 años. Factores de riesgo: HIV (+), 19/31 (61%); HIV (-), 12/31 (39%); HIV no determinado, 1; alcoholismo, 8 (25%); hepatopatías crónicas, 6 (19%); diabetes, 6 (19%); consumo de drogas inhalatorias y/o endovenosas, 4 (12%); desnutrición (hipoalbuminemia, < 3.5 g/l), en 17 de 18 pacientes; tratamiento con esteroides e inmunosupresores, 3 (9%) con diagnóstico de glomerulopatía rápidamente evolutiva, pénfigo y pancitopenia respectivamente. Esplenectomía en un caso. La correlación entre los factores de riesgo y la infección por HIV se encuentra expresada en la Tabla 1. Los factores locales pudieron determinarse en 21 pacientes (66%): actividades deportivas, 7/21 (33%); postración, 4/21 (19%); trabajos de esfuerzo muscular, 4/21 (19%); traumatismos previos, 3/21 (14%); hematomas espontáneos, 2/21 (10%); post parto, 1. Se observaron lesiones altamente sospechosas de puerta de entrada en 25 pacientes (78%); las mismas fueron de piel y partes blandas en 19 casos (forunculosis en 7, lesiones eritematocostrosas por porfiria cutánea tarda en 3 y lesiones por pénfigo vulgar, síndrome linfangítico nodular por feohifomicosis (Fig. 1), síndrome de Steven Johnson, celulitis abscedada, úlceras genitales, picadura de insecto, lesiones traumáticas infectadas, foliculitis, escoriaciones en manos (en un caso cada una) y en 6 casos antecedentes de internaciones en el último mes con vías de administración parenteral.
Tabla 1. Factores de riesgo en relación con HIV(n:31)

*Dosaje de albúmina en 11/19 **Dosaje de albúmina en 8/12

Fig. 1. Varón de 46 años con lesiones en piel por feohifomicosis. Signo del psoas (+). Antecedente de tratamiento con inmunosupresores por glomerulopatía rápidamente evolutiva. Albuminemia 1.9g/l. Aislamiento: SAMR de hemocultivo. Punción dirigida de absceso de psoas izquierdo.
Al ingreso se detectaron fiebre y dolor local en los 32 pacientes, tumefacción en 27, dolor lumbar irradiado a muslo en 4 y signo del psoas (flexión antálgica del muslo y pierna sobre el abdomen) en un paciente (Fig. 1). Dos pacientes fueron internados por neumopatías con presencia de nódulos cavitados de distribución aleatoria compatibles con embolias sépticas en la tomografía de tórax. Dos pacientes fueron internados por sepsis grave.
Laboratorio: Hemoglobina promedio 9.78 g/l (rango 5.5-13.8), (Me)10.9 g/l; leucocitos promedio 11 909/ml (rango 2400-30 000), Me 11 500/ml; neutrófilos promedio 72% (rango 60-90), M2 80%; plaquetas 272 772/ml (rango 10 000-580 000), Me175 000/ml; albúmina realizada en 19/32 pacientes, promedio 2.4 g/l (rango 1.1-3.7), Me 2.3 g/l; LTCD4 determinado a los pacientes HIV(+), 18/19, promedio 65 cél/ml, rango (2-260), Me 37 cél/ml. La relación entre las determinaciones de laboratorio y HIV figuran en la Tabla 2.
Tabla 2 . Determinaciones de laboratorio en relación con HIV

*La diferencia es significativa con p < 0,05 (0,00000017)
Estudios por imágenes
Ultrasonografía: Se observaron colecciones intramusculares desde pequeñas y múltiples hasta grandes abscesos. Las lesiones fueron monofocales (un solo músculo afectado) en 19 pacientes (59%) y multifocales en 13 (41%) (Fig. 2a y 2b). Músculos comprometidos: cuádriceps en 14 (44%); gemelos, 8 (25%); iliopsoas, 6 (19%): bíceps Fig. 3a y 3b) y flexores del antebrazo, 4 (12,5%); pectorales, 3 (9%) (Fig. 4a); escapular, 3 (9%); posteriores del muslo, 2 (7%); masetero, lumbares, intercostales, glúteos y aductores del muslo en un caso cada uno.

Fig. 2. Niña de 14 años, práctica de natación, HIV (-), albuminemia 2,9 g/l. Aislamiento: SAMRCo del material del absceso. Ecografía: a) Piomiositis pectoral. b) Piomiositis gemelar.

Fig. 3. Mujer de 50 años, diabética tipo II y pénfigo vulgar en tratamiento con inmunosupresores. Aislamiento: Nocardia spp del material del absceso. Ecografía: piomiositis de bíceps. a) Corte longitudina b) Corte transversal.
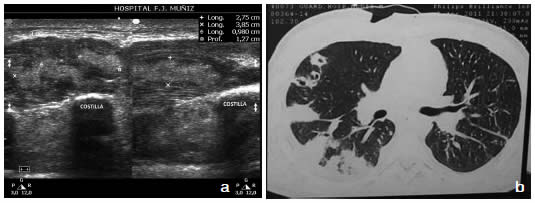
Fig. 4. Varón de 21 años, obrero maderero con escoriaciones en la mano. Albuminemia 3.3 g/l. Aislamiento: SAMRCo del material del absceso y hemocultivo. a) Ecografía: piomiositis pectoral. b) TC tórax: embolias sépticas múltiples.
TC abdomino pelviana con contraste oral y endovenoso realizada a pacientes con abscesos del músculo psoas ilíaco, 6, que corroboraron los hallazgos ecográficos.
RM de columna dorsolumbar en pacientes con absceso del psoas ilíaco, 2, descartando el compromiso óseo en ambos.
TC tórax se efectuó en 8 pacientes. Se observó compromiso pulmonar grave con múltiples infartos sépticos en 2 casos (Fig. 4b) y consolidación con derrame en un caso. Se descartaron: en un caso de piomiositis intercostal, afectación peri pleuropulmonar, y en un caso de piomiositis de los músculos de la escápula, lesión pleuropulmonar y ósea. No se observaron lesiones pleuropulmonares relacionadas en 3.
Ecocardiogramas: 24; endocarditis mitral: 1.
La relación topográfica de las lesiones con los factores locales se detalla en la Tabla 3.
Tabla 3. Relación entre factor local y topografía de las lesiones.

Se hicieron estudios bacteriológicos en 30 de los 32 casos estudiados. Se obtuvo material del absceso por punción percutánea (Fig. 5a y 5b) o intraquirúrgico de 27 pacientes y hemocultivos en 22 pacientes. En tres de estos 30 casos, el hemocultivo fue la única muestra procesada. En los 30 casos se detectó el agente etiológico por el cultivo del material purulento y/o del hemocultivo y fue recuperada una sola especie bacteriana por material estudiado.

Fig. 5. Varón de 38 años. Internación previa con vías de administración parenteral, práctica de futbol. HIV (+), LTCD4 2 cél/ml. Albuminemia 1.9 g/l. Aislamiento: Pseudomonas aeruginosa del material del absceso y hemocultivo. Ecografía: piomiositis del cuádriceps. a) Corte longitudinal. b) Punción dirigida.
El detalle de las especies bacterianas recuperadas figura en la Tabla 4.
Tabla 4. Rescate microbiológico en materiales estudiados

SAMR Staphylococcus aureus meticilino resistente. SAMRCo Staphylococcus aureus meticilino resistente con perfil de sensibilidad de la comunidad. SAMS Staphylococcus aureus meticilino sensible.
La variación de la sensibilidad antibiótica de los S. aureus aislados fue: hasta el año 2010 el Staphylococcus aureus meticilino resistente con perfil de sensibilidad de la comunidad (SAMRCo) representó el 7% (1/14 aislamientos), a partir del año 2011 el 100% (11/11).
La antibioticoterapia fue el único tratamiento en 4 pacientes, drenaje por punción aspirativa percutánea ecoguiada en 9 y tratamiento quirúrgico (colocación de catéter o desbridamiento) en 17.
Evolución: buena en 28 pacientes. Óbitos: 2 (6.6%), un paciente caquéctico en estadio terminal de sida y un paciente HIV(+) esplenectomizado, diabético, por complicaciones de la sepsis. Evolución desconocida: 2 (derivados).
Discusión
La piomiositis primaria es una infección bacteriana del músculo estriado con formación de abscesos ocasionada por diseminación hematógena del agente causal. No incluye a la infección secundaria a lesiones penetrantes o a focos contiguos como hueso, piel o tejido celular subcutáneo1, 2.
Dentro de los factores de riesgo, Ansaloni y col. señalan la importancia de la infección por HIV1 y observan una prevalencia del 33.4% del virus en 35 pacientes con piomiositis estudiados3. Christin y Sarosi, en una revisión de 95 pacientes con piomiositis en EE.UU., encuentran una prevalencia de HIV del 17%4.
En nuestra población, el HIV fue el factor de riesgo más frecuente (61%) de los casos. Esta observación está relacionada con la alta prevalencia del virus en los pacientes internados en el Hospital evaluado (47.9%), con un promedio de 2140 internaciones por sida por año en el período concomitante13. Estos pacientes presentaban un grave inmuno compromiso, todos en estadio sida, con bajos niveles de LTCD4, con un promedio de 65 cél/ml y una Me de 37 cél/ml. Este hallazgo es coincidente con diferentes publicaciones, Crum5, en su revisión de piomiositis en EE.UU., observa un nivel de LTCD4 < 100 cél/ml en los pacientes con HIV de la población estudiada. Casado y col. evalúan 74 pacientes con HIV con manifestaciones reumatológicas, los relacionan con el nivel de LTCD4, observando que las piomiositis y los linfomas presentaban LTCD4 < 150 cél/ml14.
Observamos hipoalbuminemia en la totalidad de las determinaciones (11/11), interpretada en el contexto como marcador biológico de desnutrición. Estos pacientes también presentaban concomitantemente otros factores de riesgo. Crum5, en su revisión de pacientes HIV (-) con piomiositis en EE.UU., observa que el 48% de ellos tenían enfermedades subyacentes como diabetes, enfermedades malignas o reumáticas. En nuestro análisis, los pacientes HIV (-) presentaron algún factor de riesgo en el 88% de los casos. La desnutrición objetivada por el bajo nivel de albúmina en sangre fue el hallazgo más frecuente, siendo el único antecedente en 5 casos.
Factores locales: se han reportado casos de piomiositis en pacientes jóvenes que practican deportes de alto contacto físico (jugadores de rugby, luchadores y atletas)15. En nuestra observación se detectaron factores locales en el 66% de los pacientes, asociados más frecuentemente a prácticas deportivas y, dentro de éstas, al futbol.
Los músculos comúnmente afectados son los grandes grupos musculares de la cintura pelviana y de miembros inferiores, pudiendo ser unifocal o multifocal1. En nuestra población el compromiso monofocal fue el más frecuente (59%) y los músculos más afectados fueron cuádriceps, gemelos y psoas. Hubo una evidente correlación entre los factores locales y las diferentes localizaciones.
La enfermedad presenta tres estadios evolutivos: infección muscular difusa, formación de absceso y sepsis. En la segunda etapa es cuando habitualmente se llega al diagnóstico1, 2, 6. En nuestro estudio el diagnóstico se realizó en la etapa supurativa en el 90% de la serie, y en tres casos en la 3ra etapa. Estos últimos fueron internados por complicaciones de la sepsis. Si bien la leucocitosis es el hallazgo de laboratorio más frecuente2-5, los pacientes con HIV en general presentan un recuento de leucocitos normal o disminuido18. En la población estudiada la leucocitosis estuvo presente en todos los pacientes HIV (-) con una Me de 20 150 cél/ml. En los pacientes HIV (+) el número de leucocitos fue menor, Me de 6500 cél/ml, (diferencia significativa, p < 0.05).
Etiología: según la serie de Bickels y col.1, en 452 aislamientos en pacientes con piomiositis primaria, el principal agente etiológico fue S. aureus (77%), siguiendo en frecuencia estreptococos (11%), Escherichia coli (2.4%), y menor al 2% Salmonella enteritidis, Mycobacterium tuberculosis,Streptococcus pneumoniae. Otros microorganismos involucrados en casos aislados han sido Klebsiella pneumoniae, Yersinia enterocolitica, Neiseria gonorrhoeae, Aeromonas hydrophila, anaerobios y hongos1, 16-23. En pacientes HIV(+) se han reportado casos por S. aureus meticilino resistente8, Nocardia24, Salmonella enteritidis25, Streptococcus pneumoniae26, E. coli27, Streptococcus milleri 28, Cryptococcus neoformans29, Histoplasma capsulatum30, Mycobacterium avium (per se o como manifestación de síndrome de reconstitución inmune)31-33 y angiomatosis bacilar34,35. En el presente trabajo, el principal agente involucrado fue el S. aureus (83.3%). Esta prevalencia está relacionada con el alto número de lesiones abiertas de piel y vías de administración parenteral, constatadas en un 78% de los casos e interpretadas como probables puertas de entrada. Diferentes publicaciones en nuestro país y en el mundo han advertido acerca del aumento de las infecciones por SAMRCo definiéndolo como un patógeno emergente. Este ha sido asociado a infecciones invasoras de piel y tejidos blandos36-42. En nuestra serie, el SAMRCo representó el 48% de los S. aureus aislados. Analizando su evolución a través del tiempo, se observó que a partir del año 2011 representaron el 100%.
Las etiologías menos frecuentes estuvieron asociadas a un evidente factor de riesgo: E. coli en una paciente diabética, P. aeruginosa en un paciente con sida, Streptococcus agalactiae en un paciente diabético y enolista con hepatopatía crónica, Nocardia spp en una paciente con pénfigo tratada con inmunosupresores y una micobacteria no tuberculosa en un paciente HIV con síndrome de reconstitución inmune.
Diagnóstico por imágenes: la radiografía simple posibilita observar el tumor de partes blandas y lesiones óseas como fracturas, osteomielitis y tumores.
La tomografía computarizada permite evaluar los planos de lesión y es útil para el estudio de los músculos profundos como el psoas ilíaco. El contraste endovenoso puede demostrar el anillo de realce diferenciando las áreas necróticas del músculo viable43-45.
La resonancia magnética facilita la discriminación de los planos fasciales y el diagnóstico de fascitis necrotizante. Es el método más sensible para detectar cambios inflamatorios de la fase inicial presupurativa, estando indicado para el diagnóstico precoz de piomiositis. Su dificultad radica en el alto costo y baja accesibilidad43, 44, 46, 47.
La ecografía permite detectar en forma inmediata los focos de supuración intramusculares, evaluar el plano de la lesión y su dimensión. Su utilidad es mayor en la etapa supurativa y como guía para la punción diagnóstica y/o evacuadora. Contribuye al diagnóstico diferencial con desgarros musculares, celulitis, colecciones y fascitis. Puede inferir el compromiso óseo al identificar alteraciones en la cortical ósea. El doppler descarta trombosis venosa profunda y caracteriza otras lesiones como hematomas o tumores48-51.
Es de gran importancia realizar una minuciosa semiología para examinar ecográficamente la zona del dolor o tumefacción, ya que en los casos con impactos múltiples y colecciones pequeñas estas podrían ser interpretadas como simples mialgias52.
En nuestra serie todos los pacientes fueron diagnosticados por ecografía en la primera observación, a excepción de un caso cuyo diagnóstico ecográfico fue tardío debido a la dificultad técnica por obesidad.
Considerando las nuevas tendencias, otra ventaja adicional del método es que puede ser realizado por médicos capacitados en ecografía de urgencia53.
Tratamiento
El tratamiento en la fase inicial puede ser exclusivamente antibioticoterapia endovenosa de amplio espectro como vancomicina, linezolid, clindamicina54, 55 Cuando el absceso ya está conformado está indicado el drenaje percutáneo o desbridamiento quirúrgico asociado al tratamiento antibiótico55.
En conclusión, ante la etiología diversa y cambiante de las piomiositis primarias es importante reconocer el agente involucrado y su sensibilidad antibiótica. En este aspecto, como lo demuestra nuestra serie, la emergencia de S. aureus meticilino resistente de la comunidad tiene un particular impacto. La alta resolución de los equipos actuales de ecografía, la posibilidad de realizar el estudio en tiempo real correlacionando la imagen con el examen físico e interrogatorio al paciente, y la toma de muestra por punción guiada permiten el diagnóstico inmediato. Esto distingue a la ecografía de otras técnicas diagnósticas y la transforma en el método de primera línea en el estudio de esta afección.
1. Bickels J, Ben-Sira L, Kessler A, Weintroub S. Primary pyomyositis. J Bone Joint Surg 2002; 84-A: 2277-86. [ Links ]
2. Ansaloni L. Tropical Pyomyositis. World J Surg 1996; 20: 613-7. [ Links ]
3. Ansaloni L, Acaye GL, Re MC. High HIV seroprevalence among patients with pyomyositis in northem Uganda. Trop Med Int Health 1996; 1: 210-2. [ Links ]
4. Christin L, Sarosi GA. Pyomyositis in North America: case reports and review. Clin Infec Dis 1992;15: 668-77. [ Links ]
5. Crum N F. Bacterial pyomyositis in the United States. Am J Med 2004; 117: 420-8. [ Links ]
6. Drosos G. Pyomyositis. A literature review. Acta Orthop Belg 2005; 71: 9-16. [ Links ]
7. Hall RL, Callaghan JJ, Moloney E. Pyomyositis in a temperate climate. Presentation, diagnosis, and treatment. J Bone Joint Surg Am 1990; 72: 1240-4. [ Links ]
8. Corti M, Villafañe MF, Esquivel P, Palmieri O. Piomiositis asociada a infección por VIH. Enferm Infecc Microbiol Clin 2004; 22: 503-4. [ Links ]
9. Walling DM, Kaelin WG Jr. Review Pyomyositis in patients with diabetes mellitus. Rev Infect Dis 199; 13: 797-802. [ Links ]
10. Gomez-Reino JJ, Aznar JJ, Pablos JL, Diaz-Gonzalez F, Laffon A. Nontropical pyomyositis in adults. Semin Arthritis Rheum 1994; 23: 396-405 [ Links ]
11. Navarro Lopez V, Ramos J, Meseguer V, et al. Microbiology and outcome of illiopsoas abscess in 124 patients. Medicine 2000; 88: 120-30. [ Links ]
12. Pasternack M, Swartz M. Miositis y mionecrosis. En: Mandel G, BennetJ, Dolin R. Enfermedades Infecciosas. Séptima edición. Barcelona: Elsevier, 2013, p 1321-4. [ Links ]
13. División Estadística. Sección Recolección y elaboración de datos. Sección Archivo de Historias Clínicas, Hospital de Infecciosas F. J. Muñiz. Consultado abril 2015. [ Links ]
14. Casado E, Olivé A, Holgado S, et al. Musculo eskeletal monifestations in patients positive for human immunodeficiency virus: correlation with CD4 count. J Rheumatol 2001; 28: 802-4. [ Links ]
15. Nguyen DM, Mascola L, Bancroft E. Recurring methicillin resistant Staphylococcus aureus infections in a football team. Emerg Infect Dis 2005; 11: 528-32. [ Links ]
16. Crum-Cianflone NF. Bacterial, fungal, parasitic and viral myositis. Clin Microbiol Rev 2008; 21: 473-94. [ Links ]
17. Back SA, ONeill T, Fishbein G, Gwinup G. A case of group B streptococcal pyomyositis. Rev Infect Dis 1990; 12: 784-7. [ Links ]
18. Al-Tawfiq JA, Sarosi GA, Cushing HE. Pyomiositis in the acquired immunodeficiency síndrome. South Med J 2000; 93: 330-4. [ Links ]
19. Adams EM, Gudmundsson S, Yocum DE, Haselby RC, Craig WA, Sundstrom WR. Streptococcal myositis. Arch Intern Med 1985; 145:1020-3. [ Links ]
20. ONeill KM, Ormsby AH, Prayson RA. Cryptococcal myositis: a case report and review of the literature. Pathology 1998; 30: 316-7. [ Links ]
21. Voloshin DK, Lacomis D, McMahon D. Disseminated histoplasmosis presenting as myositis and fasciitis in a patient with dermatomyositis. Muscle Nerve 1995,18: 531-5. [ Links ]
22. Reboli AC, Reilly RF, Jacobson RJ. Aspergillus myositis in a patient with a myelodysplastic syndrome. Mycopathology 1987; 97: 117-9. [ Links ]
23. Pearl GS, Sieger B. Granulomatous Pneumocystis carinii myositis presenting as an intramuscular mass. Clin Infect Dis 1996; 22: 577-8. [ Links ]
24. Corti M, Solari R, De Carolis L, Cangelosi D, Bianchi M, Negroni R. Disseminated nocardiosis with psoas abscessin a patient with AIDS: first reported case. Rev Inst Med Trop Sao Paulo 2008; 50: 131-3. [ Links ]
25. Medina F, Fuentes M, Jara JL, Barile L, Miranda JM, Fraga A. Salmonella pyomyositis in patients with the human immunodeficiency virus. Br J Rheumatol 1995; 34: 568-71. [ Links ]
26. Chatterjee S, Al-Hihi M. Pneumococcal pyomyositis in a patient infected with human immunodeficiency virus. Am J Med 2007; 20: e5-6. [ Links ]
27. Vilades C, Garcia-Queralt R, Rivas I, Vidal F, Richart C. Pyomyositis due to Escherichia coli in a patient infected by HIV. Br J Rheumatol 1994; 33: 404-5. [ Links ]
28. Yassin M, Yadavalli GK, Alvarado N, Bonomo RA. Streptococcus anginosus (Streptococcus milleri Group) pyomyositis in a 50-year-old man with acquired immunodeficiency syndrome: case report and review of literature. Infection 2010; 38: 65-8. [ Links ]
29. Barber BA, Crotty JM, Washburn RG, Pegram PS. Cryptococcus neoformans myositis in a patient with AIDS. Clin Infect Dis 1995; 21: 1510-1. [ Links ]
30. Goel D, Prayaga AK, Rao N, Damodaram P. Histoplasmosis as a cause of nodular myositis in an AIDS patient diagnosed on fine needle aspiration cytology. A case report. Acta Cytolog 2007; 51: 89-91. [ Links ]
31. Miralles G, Bregman Z. Necrotizing pyomyositis caused by Mycobacterium avium complex in a patient with AIDS. Clin Infect Dis 1994; 18: 833-4. [ Links ]
32. Chen WL, Lin YF, Tsai WC, Tsao YT. Unveiling tuberculous pyomyositis: an emerging role of immune reconstitution inflammatory syndrome. Am J Emerg Med 2009; 27: 251.e1-2. [ Links ]
33. Lawn SD, Bicanic TA, Macallan DC. Pyomyositis and cutaneous abscesses due to Mycobacterium avium: Animmune reconstitution manifestation in a patient with AIDS. Clin Infect Dis 2004; 38: 461-3. [ Links ]
34. Husain S, Singh N. Pyomyositis associated with bacillary angiomatosis in a patient with HIV infection. Infection 2002; 30: 50-3. [ Links ]
35. Whitfeld MJ, Kaveh S, Koehler JE, Mead P, Berger TG. Bacillary angiomatosis associated with myositis in a patient infected with human immunodeficiency virus. Clin Infet Dis 1997; 24: 562-4. [ Links ]
36. King MD, Humphrey BJ, Wang YF, Kourbatova EV, Ray SM, Blumberg HM. Emergence of community-acquired methicillin-resistant Staphylococcus aureus USA 300 clone as the predominant cause of skin and soft-tissue infections. Ann Intern Med 2006; 144: 309-17. [ Links ]
37. Wallin TR, Hern HG, Frazee BW. Community-associated methicillin-resistant Staphylococcus aureus. Emerg Med Clin North Am 2008; 26: 431-55. [ Links ]
38. Brezzo C, Cecchini D, Bisciones F, Orduna T, Costa N, Quinteros M. Enfermedad invasora por Staphylococcus aureus meticilino resistente adquirida en la comunidad. Medicina (B Aires) 2006; 66: 443-6 [ Links ]
39. Sokolov KM, Kreye E, Miller LG, Choi C, Tang AW. Postpartum iliopsoas pyomyositis due to community-acquired methicillin-resistant Staphylococcus aureus. Obstet Gynecol 2007; 110: 535-8. [ Links ]
40. Paganini H, Della Lattaa M, Muller Opet B, et al.Estudio multicéntrico sobre las infecciones pediátricas por Staphylococcus aureus meticilino-resistente provenientes de la comunidad en la Argentina. Arch Argent Pediatr 2008; 106: 397-403. [ Links ]
41. Lopez Furst MJ. Staphylococcus aureus resistente a la meticilina en la comunidad: la emergencia de un patógeno. Medicina (B Aires) 2011; 71: 585-6. [ Links ]
42. de Vedia L, Lista N, Piovano G, et al. Staphylococcus aureus meticilino resistente adquirido en la comunidad: una nueva amenaza. Rev Am Med Resp 2012; 4: 131-9. [ Links ]
43. Gordon BA, Martinez S, Collins AJ. Pyomyositis: characteristics at CT and MR imaging. Radiology 1995; 197: 279-86. [ Links ]
44. Wu CM, Davis F, Fishman EK. Musculoskeletal complications of the patient with acquired immunodeficiency syndrome (AIDS): CT evaluation. Semin Ultrasound CT MR 1998; 19: 200-8. [ Links ]
45. Restrepo S, Lemos D, Gordillo H, Odero R. Imaging findings in musculoskeletal complications of AIDS. Radiographics 2004; 24: 1029-49. [ Links ]
46. Schmid MR, Kossmann T, Duewell S. Differentiation of necrotizing fasciitis and cellulitis using MR imaging. Am J Roentgenol 1998 Mar;170: 615-20. [ Links ]
47. Ali SZ, Srinivasan S, Peh WCG. MRI in necrotizing fasciitis of the extremities. Br J Radiol 2014; 87: 20130560. [ Links ]
48. Chaua C, Griffithb J. Musculoskeletal infections: ultrasound appearances. Clin Radiol 2005; 60: 149-59. [ Links ]
49. Van Sonnenberg E, Wittich GR, Casola G, Cabrer OA, Gosink BB, Resnick DL. Sonography of thigh abscess: detection, diagnosis, and drainage. AJR 1987; 149: 769-72. [ Links ]
50. Bureau N, Chem R, Cardinal E. Musculoeskeletal infections US manifestations. Radiographics 1999; 19: 1585-92. [ Links ]
51. Robben SG. Ultrasonography of musculoskeletal infections in children. Eur Radiol 2004; 14: L65-7. [ Links ]
52. Méndez N, Sawicki M, Gancedo E, Magistochi C. Piomiositis: Importancia de la ecografia. Rev Arg Ultrasonido 2012; 11: 5. [ Links ]
53. Richter A, Riley D. Emergency department diagnosis of a quadriceps intramuscular loculated abscess/pyomyositis using dynamic compression bedside ultrasonography. Crit Ultrasound J 2013; 5: 3. [ Links ]
54. Consenso SADI-SAM-SAD-CACCVE. Guía para el manejo racional de las infecciones de piel y partes blandas. Rev Panam Infectol 2009; 11: 50-5. [ Links ]
55. Stryjewski ME, Chambers HF. Skin and soft-tissue infections caused by community-acquired methicillin-resistant Staphylococcus aureus. Clin Infect Dis 2008; 46: S368-77. [ Links ]














