Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina (Buenos Aires)
Print version ISSN 0025-7680On-line version ISSN 1669-9106
Medicina (B. Aires) vol.76 no.3 Ciudad Autónoma de Buenos Aires June 2016
ARTÍCULO ESPECIAL
Insulinización en la diabetes mellitus tipo 2
Alternativas de intensificación
Graciela V. Fuente1, Isaac Sinay2, José E. Costa Gil3, Félix Puchulu4, Guillermo Dieuzeide5, Martín Rodríguez6, María C. Faingold7, León E. Litwak8
1Unidad de Nutrición, Hospital Carlos Durand, Buenos Aires,
2Unidad Diabetes, Instituto Cardiovascular de Buenos Aires,
3Posgrado Universidad Favaloro, Buenos Aires,
4Hospital de Clínicas José de San Martín, Buenos Aires,
5Centro de Atención Integral en Diabetes, Endocrinología y Metabolismo, Servicio de Endocrinología y Diabetes Hospital Nuestra Señora del Carmen, Chacabuco, Buenos Aires,
6Hospital Universitario, Universidad Nacional de Cuyo, Mendoza,
7Servicio de Endocrinología y Metabolismo de la Unidad Asistencial Dr. César Milstein, Buenos Aires,
8Servicio de Endocrinología, Metabolismo y Medicina Nuclear, Sección Diabetes y Metabolismo, Hospital Italiano de Buenos Aires, Argentina
Dirección postal: Graciela V. Fuente, Dr. Nicolás Repetto 669, 1405 Buenos Aires, Argentina
e-mail: gvfuente@intramed.net
Recibido: 30-X-2015
Aceptado: 19-IV-2016
Resumen
La diabetes mellitus se asocia con complicaciones vasculares y elevadas tasas de morbimortalidad. La terapia oportuna con insulina y su intensificación cuando es necesaria, representan estrategias apropiadas para evitar o retardar la aparición de dichas complicaciones. Sin embargo, la incidencia de hipoglucemia y las dificultades en la adherencia al tratamiento representan barreras para alcanzar el éxito terapéutico. Las nuevas combinaciones de análogos de insulina constituyen tratamientos que presentarían ventajas farmacocinéticas y farmacodinámicas, logrando beneficios clínicos tales como un mejor control metabólico, la disminución de eventos hipoglucémicos y, por su simplicidad, potencialmente una mayor adherencia al tratamiento.
Palabras clave: Insulina; Combinación de drogas; Insulina aspártica; Insulina degludec; Insulinoterapia; Insulina bifásica.
Abstract
Insulinization in type 2 diabetes mellitus. Intensification options.
Diabetes mellitus is associated with vascular complications and high rates of morbidity and mortality. Timely insulin therapy, intensified when necessary, represent appropriate measures to prevent or delay the onset of complications. However, the incidence of hypoglycemia and difficulties in treatment adherence represent barriers to achieve therapeutic success. Premixes analogs and, specially, combinations of insulin analogues are associated with pharmacokinetic and pharmacodynamic advantages, that translate into clinical benefits such as improved metabolic control, decreased hypoglycemic events and, for their simplicity, potentially greater adherence.
Key words: Insulin; Combination drugs; Aspart insulin; Degludec insulin; Insulin-therapy; Biphasic insulin.
Las enfermedades crónicas no transmisibles son responsables de alrededor del 75% de los casos de mortalidad en el continente americano1. Entre estas afecciones se destaca la diabetes mellitus (DM) que genera, si no está debidamente controlada, complicaciones micro y macrovasculares con elevada morbimortalidad y con un alto impacto social y económico2. En ensayos prospectivos a mediano y a largo plazo, efectuados en el marco de distintos grupos poblacionales y sistemas de salud, el control estricto de la glucemia desde las primeras etapas de la DM evita o retrasa la aparición de dichas complicaciones3, 4.
En la DM tipo 1 (DM1) se produce una destrucción autoinmune de las células beta del islote pancreático, generando deficiencia absoluta de insulina. En cambio, los pacientes que presentan DM tipo 2 (DM2) evidencian un complejo mecanismo patogénico con grados variables de resistencia a la insulina y déficit (absoluto o relativo) de su producción5. Así, los pacientes con DM1 requieren el uso de insulina o sus análogos desde el inicio de la enfermedad6, mientras que, en los individuos con DM2, esta estrategia terapéutica puede o no ser necesaria durante el transcurso de la evolución de la enfermedad. Esta necesidad se presenta cuando no es posible alcanzar las metas terapéuticas, pese al tratamiento optimizado con cambios en el estilo de vida y uso de fármacos no insulínicos combinados entre sí5.
La falla en el logro de los objetivos de control glucémico se correlaciona con el deterioro progresivo de la función de la célula beta; según lo observado en el estudio UKPDS, al tercer año del diagnóstico, aproximadamente el 50% de los pacientes necesitará más de un agente farmacológico para lograr los objetivos, y al noveno año el 75% necesitará terapia múltiple7. A su vez, en una subpoblación del mismo estudio, se observó que luego de seis años de tratamiento con una sulfonilurea, el 53% de los pacientes requirieron el agregado de insulina para lograr los objetivos glucémicos; no obstante, solo el 28% de los pacientes con insulina mantuvo la hemoglobina glicosilada (HbA1C) < 7% luego de 9 años de tratamiento8. Debe destacarse que, en el grupo tratado con insulina sola, 3.2 de cada 100 pacientes/año presentaron hipoglucemia grave, en comparación con solo 0.16/100 pacientes/año en el grupo tratado con sulfonilurea (± insulina) (p = 0.017)8.
Insulinoterapia en DM2
La mayoría de la guías coinciden en que la insulinización de los pacientes con DM2, cuando esté indicada, debería comenzar con la administración de insulina basal, ya sea insulina neutra protaminizada (NPH) o bien análogos de acción prolongada, para los cuales se ha demostrado un menor riesgo de hipoglucemias graves y nocturnas5. Se sugiere iniciar con una dosis de 10 unidades diarias o 0.2 unidades/kg/día, por lo general en horas de la noche (con la cena o al acostarse). La titulación se debe hacer cada 3 a 4 días, en función de los valores de glucemia plasmática en ayunas (GPA), o capilar, hasta lograr valores de entre 80 y 130 mg/dl. Por lo tanto es necesario mantener un contacto frecuente con el paciente, ya que esto constituye un factor determinante para el resultado adecuado de este tipo de farmacoterapia5.
Se recomienda indicar el uso de insulina en las siguientes situaciones: a) como estrategia de inicio, junto con los cambios en el estilo de vida, en individuos con síntomas catabólicos y niveles de HbA1c > 9% al momento del diagnóstico, b) en quienes no se logre un adecuado control glucémico con el máximo de dosis tolerada de una combinación doble o triple de agentes orales (AOs) y/o agonistas del receptor del péptido similar al glucagón tipo 1 (GLP-1), y c) cuando por alguna razón no puedan indicarse AOs y/o inyectables no insulínicos (embarazo, insuficiencia renal, entre otros).
En la mayoría de los individuos con DM2 se propone como objetivo un adecuado control metabólico (glucémico), tratando de lograr una HbA1c < 7% y niveles de GPA y glucemia preprandial <110 mg/dl, con el menor riesgo de hipoglucemia posible. Los objetivos deben individualizarse en función de variables tales como la edad, el estado funcional del paciente, el tiempo de evolución de la enfermedad, la coexistencia de otras enfermedades, la presencia de complicaciones y el riesgo de hipoglucemia6, 9, 10.
El perfil de los análogos de insulina de acción prolongada se asemeja más al patrón fisiológico, en comparación con la insulina NPH, para la cual se describe una duración de acción intermedia y una elevada variabilidad intra e interindividual11. En diferentes estudios clínicos se ha demostrado que los análogos de insulina (glargina, detemir) son superiores a la insulina NPH en términos del menor riesgo de hipoglucemia (tanto diurnas como nocturnas), al tiempo que reducen la variabilidad glucémica. Estos beneficios han sido descriptos tanto en pacientes con DM2 que requieren terapia insulínica, como en individuos con DM112-15. Entre los análogos de insulina basal se encuentra la insulina degludec (IDeg), caracterizada por un período de acción ultra-prolongado, que cubre las necesidades basales a lo largo de las 24 horas para todos los pacientes, con una única inyección diaria16. Sus principales propiedades farmacocinéticas se resumen en la Tabla 1; recientemente se han diseñado presentaciones de mayor concentración de alguno de los análogos antes mencionados (insulina glargina U30017 e insulina degludec U20016), como también se han desarrollado biosimilares a la insulina glargina U10018, 19.
Tabla 1. Propiedades farmacocinéticas de la insulina degludec16

En pacientes que han logrado una GPA aceptable (80-130 mg/dl), con la dosis de insulina basal, pero en los que persisten valores de HbA1c por encima del objetivo luego de 3-6 meses de iniciada la insulinoterapia, se deben sospechar hiperglucemias prandiales, y debería considerarse la asociación con análogos de acción rápida (lispro, aspártica [IAsp], glulisina) administrados en forma de bolos preprandiales previamente a la comida principal (basal/plus), o al resto de las comidas (basal-bolo o basal/prandial). Las dosis de insulina administradas antes de las comidas permiten el control de las excursiones de la glucemia prandial, de un modo similar al patrón fisiológico de secreción insulínica en personas sin DM.
En algunos pacientes se podría considerar la administración de un agonista del receptor de GLP-1 (por ejemplo exenatide, liraglutida, lixisenatide, exenatide LAR, etc.), que complementaría el efecto de la insulina controlando las glucemias postprandiales, sobre todo en pacientes con un índice de masa corporal aumentado, donde este grupo terapéutico ofrecería un beneficio adicional sobre el peso corporal, que va más allá del control glucémico20.
Otra alternativa es efectuar una transición hacia una modalidad de intensificación mediante la utilización de premezclas de insulinas, con la administración de al menos dos dosis diarias de insulinas análogas bifásicas en proporciones 25/75, 30/70 o 50/506. Al margen de la administración de insulina basal en asociación con dosis de insulina rápida (terapia basal-bolo), las premezclas de insulinas son un recurso eficaz y simple, sobre todo en pacientes con DM2 con rutinas y hábitos predecibles. En estudios de comparación directa entre la terapia basal-bolo y las premezclas en los cuales participaron sujetos con DM2 con inadecuado control metabólico, naive de insulina, ambas estrategias lograron una disminución comparable de la HbA1c21.
Sin embargo, en dos metanálisis realizados explorando esta misma comparación, se observó que los pacientes tratados con insulinas premezclas o esquemas prandiales podrían alcanzar mayores reducciones de HbA1C, con igual o mayor riesgo de hipoglucemia22, 23.En el estudio 4T, que fue un ensayo aleatorizado, abierto, multicéntrico, de 3 ramas, en el cual se comparó un esquema terapéutico con insulina basal (determir) vs. un esquema con premezcla de insulina (IAsp bifásica) o un esquema de insulina prandial (IAsp) en pacientes mal controlados con dosis máximas de metformina y sulfonilureas, se observaron resultados similares24.
Si bien al cabo de tres años la media de HbA1C fue semejante en los tres grupos, la tasa de hipoglucemia fue mayor en los regímenes con insulina prandial y premezclas con respecto al esquema basal. El aumento de peso fue mayor en el grupo asignado a insulinas prandiales y premezclas vs. insulinas basales25. En la Tabla 2 se resumen las ventajas/desventajas de cada régimen.
Tabla 2. Ventajas y desventajas de los distintos esquemas de insulinas disponibles

Se advierte con frecuencia la necesidad de aplicación asociada de insulinas de acción rápida con insulinas de acción prolongada para alcanzar las metas deseadas de tratamiento. No obstante, las insulinas glargina y detemir no pueden mezclarse en una misma formulación con insulinas de acción corta, ya que esto alteraría sus características farmacológicas26.
Novedades en la terapia combinada
Han quedado demostrados los beneficios del tratamiento oportuno en pacientes con DM, de allí que en la transición entre el uso de AOs y/o agonistas del receptor de GLP-1 y la administración de insulina basal, es relevante evitar la inercia clínica habitual en el abordaje de estos pacientes5. Entre los factores asociados con la inercia durante el inicio o la intensificación de la insulinoterapia, se reconoce no solo a la hipoglucemia sino también a la percepción del equipo de salud sobre la complejidad del régimen de administración de la insulina y a la falta de guías claras para su implementación27. A tal fin, las principales sociedades científicas han elaborado recomendaciones basadas en la evidencia, generando algoritmos prácticos, a fin de facilitar la insulinización oportuna y su posterior progresión y titulación5, 6, 9, 28.
Al igual que las premezclas, las combinaciones de insulinas constituyen una alternativa interesante y útil en el tratamiento de los pacientes con DM2 que requieren ser intensificados con un esquema basal/plus o basal-bolo. En el caso de una combinación de insulinas, a diferencia de una premezcla, cada una de las moléculas combinadas mantiene sus propiedades farmacocinéticas y farmacodinámicas en forma independiente, al igual que sus características morfológicas y moleculares. En la combinación de IDeg e IAsp, la proporción es 70/30; es decir 70% IDeg y 30% IAsp29.
La IAsp es un análogo de insulina, en la cual la sustitución de un aminoácido produce una absorción y un inicio de acción más rápidos que la insulina humana regular, ofreciendo un control más adecuado de las excursiones glucémicas prandiales30. La IDeg se caracteriza por una duración de acción ultra prolongada, con una vida media que duplica a la de la insulina glargina y una actividad hipoglucemiante que puede extenderse más allá de las 42 horas16. Estas características farmacocinéticas se atribuyen a la formación de multihexámeros en el tejido celular subcutáneo inmediatamente después de su administración; este mecanismo único de protracción, permite que estas estructuras conserven su estabilidad y no interaccionen con los hexámeros solubles de IAsp cuando se encuentran en formulaciones combinadas16, 29-31. Consecuentemente, luego de la inyección subcutánea de esta solución combinada, la IDeg mantiene sus propiedades farmacocinéticas absorbiéndose de un modo lento y continuo, mientras que el componente de IAsp también conserva sus propiedades, se absorbe y ejerce su efecto hipoglucemiante de manera idéntica a cuando es administrada en forma independiente (Fig. 1)30.
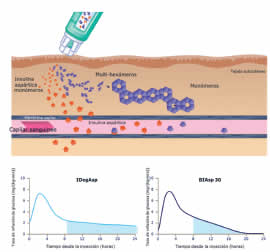
Fig. 1. Perfiles de la tasa media de infusión de glucosa para IDegAsp (estado de equilibrio, izquierda) y para insulina bifásica aspártica30 (BIAsp 30) (única dosis, derecha) en sujetos con DM1. A) Mecanismo de protracción de la combinación Ideg/Asp; B) Efecto de la reducción de la glucemia prandial y basal de Ideg/Asp vs. IAsp bifásica en pacientes con DM1.
Adaptado de:Heiseet et al. Diabetes 2013; 62(Suppl.1): A235 y de Heiseet et al. Diabetes 2013; 62 (Suppl.1): A241.
Por consiguiente, una terapia combinada agrega ventajas a los beneficios de las premezclas, tales como la posibilidad de aplicar un menor número diario de inyecciones, cubrir las necesidades basales de insulina durante las 24 horas y reducir el riesgo de hipoglucemia, debido a su perfil farmacocinético favorable32. En modelos clínicos de análisis farmacodinámico, estos beneficios se atribuyeron a la acción diferenciada entre el pico de actividad propio del componente de IAsp y un efecto basal, separado y estable, de la IDeg30.
En individuos con DM2 previamente tratados con insulina pero con inadecuado control metabólico, la coformulación IDeg/Asp se ha caracterizado por lograr una mejoría en los parámetros de control glucémico, así como una menor incidencia de hipoglucemia, en comparación con la administración de IAsp bifásica31. En un estudio multinacional, aleatorizado, abierto, de tratamiento hasta el objetivo (treat to target), en pacientes con DM2 previamente tratados con insulina (basal, premezcla o automezcla administrada una o dos veces/día), IDeg/Aspno resultó inferior para logar la meta de HbA1c, pero fue significativamente más eficaz para la reducción de la GPA. Asimismo, la dosis diaria total de insulina fue significativamente menor para la coformulación IDeg/Asp en comparación con la terapia con IAsp bifásica31.
Es importante destacar que el tratamiento con formulaciones combinadas como las descriptas, constituiría un recurso más sencillo que los clásicos esquemas basal/plus o basal-bolo en pacientes en los que fuera necesario intensificar la insulinoterapia, especialmente cuando resulta difícil cumplir con esquemas más complejos, ya que implicaría realizar menos inyecciones diarias y automonitoreos glucémicos que los esquemas mencionados. Finalmente, y en comparación con las premezclas existentes, logra mejores glucemias matinales con menor dosis de insulina diaria32-34.
Otra opción es la combinación de IDeg y liraglutida (IdegLira) en una misma formulación farmacéutica, la cual ha demostrado que las propiedades farmacocinéticas de cada uno de los componentes individuales se mantienen, al igual de lo que sucede con la combinación de IDeg con IAsp35.
IdegLira se administra una vez al día, independientemente de las comidas, en una única inyección. Se titula en "unidades de dosis", donde cada unidad contiene 1 U de IDeg y 0.036 mg de liraglutida. La dosis diaria máxima de IdegLira es de 50 unidades de dosis (50 U de IDeg y 1.8 mg de liraglutida), determinada por la dosis máxima permitida de liraglutida para el tratamiento de la diabetes36. Esta combinación ha sido estudiada en un extenso programa clínico denominado DUALTM, donde demostró una mejoría adicional del control glucémico en pacientes naive de insulina37 y en sujetos con insulina basal, sin aumentar el riesgo de hipoglucemia y con un perfil beneficioso sobre el peso comparado con insulina degludec38.
Discusión
El control glucémico apropiado constituye la meta fundamental del tratamiento de los pacientes con DM, con el fin de evitar o retrasar el desarrollo de las complicaciones de esta enfermedad3, 4, 39. Las limitaciones para alcanzar este objetivo son complejas. Por otra parte, la intensificación del tratamiento con insulina se acompaña de mayor riesgo de hipoglucemias, que a su vez han sido asociadas con elevada morbilidad cardiovascular y mayor probabilidad de hospitalizaciones40. La necesidad de múltiples aplicaciones diarias de insulina es otra variable que se asocia con disminución de la adherencia al tratamiento27. La utilización de análogos de insulina y las premezclas ya existentes, han sido un avance en este sentido, por sus ventajas farmacocinéticas, farmacodinámicas y clínicas. A su vez, la combinación IDeg/Asp se caracteriza por la ausencia de interacciones moleculares entre sus componentes y una cobertura adecuada durante 24 horas para el componente basal29. Estas propiedades farmacológicas se traducen en beneficios clínicos, en términos de un control glucémico comparable a los esquemas convencionales de insulinización, pero con menor incidencia de hipoglucemias (especialmente nocturnas) con una reducción del número de aplicaciones diarias de insulina31-34, 41, 42. Además, la terapia con IDeg/Asp permite reducir las excursiones de glucemia postprandial, la cual se correlaciona de forma independiente con el riesgo cardiovascular en los pacientes con diabetes43. A su vez, la simplificación del esquema de tratamiento podría mejorar la adherencia terapéutica, minimizar la inercia clínica y mejorar la satisfacción con esta modalidad de insulinoterapia.
A modo de síntesis, se enfatiza que la insulinización oportuna constituye un recurso de gran relevancia en el enfoque de los pacientes con DM2, que busca evitar la inercia médica tanto durante el inicio como en la etapa de intensificación del tratamiento. El uso de premezclas y de combinaciones facilitaría este tipo de terapéutica en pacientes con DM2. Estos beneficios observados en estudios de corto y mediano plazo deberán confirmarse en futuros ensayos de seguimiento prolongado y con participación de poblaciones especiales.
Agradecimientos
Los autores expresan su agradecimiento al equipo de Agencia Médica, por su colaboración en la preparación y edición del manuscrito, y declaran que el apoyo editorial fue financiado por Novo Nordisk A/S.
Conflicto de intereses: Graciela V. Fuente es disertante para las empresas farmacéuticas: Abbott, Merck Sharp & Dohme, Novartis, Novo Nordisk, TRB Pharma; también es integrante del Advisory Board de Bristol-Myers Squibb, Merck Sharp & Dohmey Novo Nordisk.
Isaac Sinay es miembro de Advisory Boards de Novo Nordisk, Eli Lilly, Sanofi Aventis, Merck Sharp & Dome, Astra Zeneca, Boheringher Ingelheim, Jansen, Novartis y Servier. Es también conferencista para todos los mencionados. Es investigador principal en diferentes Estudios de Seguimiento Clínico, es miembro del Comité de Operaciones del estudio TECOS (Merck Sharp & Dome) y del estudio HARMONY (Glaxo Smith Kline).
José E. Costa Gil ha obtenido una beca para investigación en Eli Lilly, ha desarrollado actividades en Grupos Consultivos de Novo Nordisk, Sanofi Aventis y Boehringer Ingelhei, además de disertaciones para Novartis, Medtronic, Merck-Serono y Abbott. Félix Puchulu es disertante para Novo Nordisk, Sanofi Aventis, Astra Zeneca, Novartis y Montpellier, así como miembro de Advisory Boards de Novo Nordisk, Sanofi Aventis, Astra Zeneca,
Guillermo Dieuzeide ha sido investigador principal en protocolos de Aztra Zeneca/BMS,Takeda,Daiicho Sanyo y Novo Nordisk. Ha participado en Advisory Board de Novo Nordisk, Merck Sharp Dohme y Glaxo, ha dictado conferencias para Novo Nordisk, Glaxo y Aztra Zeneca/BM.
Martín Rodríguez es disertante para Eli Lilly, Novo Nordisk, Bristol-Myers Squibb, Astra Zeneca, Merck Sharp & Dohme, Glaxo Smith Klein y Sanofi Aventis, así como miembro de Advisory Boards de Novo Nordisk, Glaxo Smith Klein, Eli Lilly, Sanofi Aventis y Bristol-Mayers Squibb. Ha participado como investigador principal en estudios para Eli Lilly, Novo Nordisk, Novartis, Icon, Bristol Myers Squibb y Boehringer Ingelheim.
María C. Faingold es disertante para Novo Nordisk, Astra Zeneca, Sanofi Aventis, Merck Sharp & Dohme y Novartis, e integrante del Advisory Board de Astra Zeneca, Sanofi Aventis, Merck Sharp & Dohme y Novo Nordisk. Sus conflictos de interés declarados incluyen también su actividad como conferencista en actividades organizadas por los laboratorios mencionados.
León Litwak es miembro del AdvisoryBoard latinoamericano de Eli Lilly, Astra Zeneca y BMS, así como miembro del Board nacional de Novo Nordisk, Sanofi Aventis, Pfizer, BMS, Astra Zeneca. Adicionalmente, se ha desempeñado como investigador principal de protocolos de investigación pertenecientes a Eli Lilly, Novo Nordisk, Novartis, Glaxo, Takeda, PPD, Pfizer, Merck Sharp &Dohme, Amgen, Roche, MiniMed, Quintiles.
1. Organización Panamericana de la Salud. Enfermedades no transmisibles en las Américas - Indicadores básicos 2011. En: http://ais.paho.org/chi/brochures/2011/BI_2011_ESP.pdf; consultado el 20/3/2015. [ Links ]
2. Gagliardino JJ, Costa Gil JE, Faingold MC, Litwak L, Fuente GV. Insulina y control de la diabetes en Argentina. Medicina (B Aires) 2013; 73: 520-8. [ Links ]
3. Gray A, Raikou M, McGuire A, et al. Cost effectiveness of an intensive blood glucose control policy in patients with type 2 diabetes: economic analysis alongside randomized controlled trial (UKPDS 41). United Kingdom Prospective Diabetes Study. BMJ 2000; 320: 1373-8. [ Links ]
4. Gaede P, Valentine WJ, Palmer AJ, et al. Cost-effectiveness of intensified versus conventional multifactorial intervention in type 2 diabetes: results and projections from the Steno-2 study. Diabetes Care 2008; 31: 1510-5. [ Links ]
5. Guías ALAD sobre el diagnóstico, control y tratamiento de la diabetes mellitus tipo 2 con Medicina Basada en Evidencia (Edición 2013). Rev ALAD 2013; 1-142 En: http://issuu.com/alad-diabetes/docs/guias_alad_2013?e=3438350/5608514; consultado el 20/3/2015. [ Links ]
6. American Diabetes Association. Approaches to Glycemic Treatment. Diabetes Care 2015; 38(S1): S41-S48. [ Links ]
7. AACE Comprehensive Diabetes Management Algorithm. Endocr Pract 2013; 19(S2): 1-48. [ Links ]
8. Heise T, Nosek L, Rønn BB, et al: Lower within-subject variability of insulin detemir in comparison to NPH insulin and insulin glargine in people with type 1 diabetes. Diabetes 2004; 53: 1614-20. [ Links ]
9. Riddle MC, Rosenstock J, Gerich J, Insulin Glargine 4002 Study Investigators. The treat-to-target trial: randomized addition of glargine or human NPH insulin to oral therapy of type 2 diabetic patients. Diabetes Care 2003; 26: 3080-6. [ Links ]
10. Hermansen K, Davies M, Derezinski T, Martinez Ravn G, Clauson P, Home P. A 26-week, randomized, parallel, treat-to-target trial comparing insulin detemir with NPH insulin as add-on therapy to oral glucose-lowering drugs in insulin-naive people with type 2 diabetes. Diabetes Care 2006; 29: 1269-74. [ Links ]
11. Philis-Tsimikas A, Charpentier G, Clauson P, Ravn GM, Roberts VL, Thorsteinsson B. Comparison of once-daily insulin detemir with NPH insulin added to a regimen of oral antidiabetic drugs in poorly controlled type 2 diabetes. Clin Ther 2006; 28: 1569-81. [ Links ]
12. Home P, Bartley P, Russell-Jones D, et al. Insulin detemir offers improved glycemic control compared with NPH insulin in people with type 1 diabetes: a randomized clinical trial. Diabetes Care 2004; 27: 1081-7. [ Links ]
13. Lasserson DS, Glasziou P, Perera R, Holman RR, Farmer AJ. Optimal insulin regimens in type 2 diabetes mellitus: systematic review and meta-analyses. Diabetologia 2009; 52: 1990-2000. [ Links ]
14. Mathieu C, Rodbard HW, Cariou B, et al. A comparison of adding liraglutide versus a single daily dose of insulin aspart to insulin degludec in subjects with type 2 diabetes (BEGIN: VICTOZA ADD-ON). Diabetes Obes Metab 2014; 16: 636-44. [ Links ]
15. Miser WF, Arakaki R, Jiang H, et al. Randomized, open-label, parallel-group evaluations of basal-bolus therapy versus insulin lispro premixed therapy in patients with type 2 diabetes mellitus failing to achieve control with starter insulin treatment and continuing oral anti hyperglycemic drugs: a non inferiority intensification substudy of the DURABLE trial. ClinTher 2010; 32: 896-908. [ Links ]
16. Insulina degludec [información para prescribir] Novo Nordisk A/S. En: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/002498/WC500138940.pdf [ Links ]
17. Toujeo [información para prescribir] En: http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Product_Information/human/000309/WC500047935.pdf [ Links ]
18. Abasaglar [información para prescribir] En: http://ec.europa.eu/health/documents/community-register/2015/20151209133677/anx_133677_es.pdf [ Links ]
19. http://www.fda.gov/NewsEvents/Newsroom/ComunicadosdePrensa/ucm478020.htm [ Links ]
20. Giugliano D, Maiorino MI, Bellastella G, Chiodini P, Ceriello A, Esposito K. Efficacy of insulin analogs in achieving the hemoglobin A1c target of < 7% in type 2 diabetes: meta-analysis of randomized controlled trials. Diabetes Care 2011; 34: 510-7. [ Links ]
21. Miser WF, Arakaki R, Jiang H, Scism-Bacon J, Anderson PW, Fahrbach JL. Randomized, open-label, parallel-group evaluations of basal-bolus therapy versus insulin lispro premixed therapy in patients with type 2 diabetes mellitus failing to achieve control with starter insulin treatment and continuing oral antihyperglycemic drugs: a noninferiority intensification substudy of the DURABLE trial. ClinTher 2010; 32: 896-908. [ Links ]
22. Holman RR, Thorne KI, Farmer AJ, et al. Addition of biphasic, prandial, or basal insulin to oral therapy in type 2 diabetes. N Engl J Med 2007; 357: 1716-30. [ Links ]
23. Holman RR, Farmer AJ, Davies MJ, et al.Three-year efficacy of complex insulin regimens in type 2 diabetes. N Engl J Med 2009; 361: 1736-47. [ Links ]
24. Ma Z, Parkner T, Christiansen JS, Laursen T. IDegAsp: a novel soluble insulin analogs combination. Expert Opin Biol Ther 2012; 12: 1533-40. [ Links ]
25. Keating GM. Insulin Degludec and Insulin Degludec/Insulin Aspart: A review of their use in the management of diabetes mellitus. Drugs 2013; 73: 575-93. [ Links ]
26. Havelund S, Ribel U, Hubálek F, Hoeg-Jensen T, Wahlund PO, Jonassen I. Investigation of the physico-chemical properties that enable co-formulation of basal insulin degludec with fast-acting insulin aspart. Pharm Res 2015; 32: 2250-8. [ Links ]
27. Peyrot M, Barnett AH, Meneghini LF, Schumm-Draeger PM. Insulin adherence behaviours and barriers in the Multinational Attitudes of Patients and Physicians in Insulin Therapy study. Diabet Med 2012; 29: 682-9. [ Links ]
28. NovoRapid [información para prescribir] Novo Nordisk Pharma Argentina S.A. (disposición 4053, Mayo 2015). En:http://novodiabetes.com.ar/web/sites/default/files/files/NovoRapid-P-FP-FT.pdf; último acceso enero 2016 [ Links ]
29. Liebl A, Davidson J, Mersebach H, Dykiel P, Tack CJ, Heise T. A novel insulin combination of insulin degludec and insulin aspart achieves a more stable overnight glucose profile than insulin glargine: results from continuous glucose monitoring in a proof-of-concept trial. J Diabetes Sci Technol 2013; 7: 1328-36. [ Links ]
30. Heise T, Nosek L, Hastruo H, Chenji S, Klein O, Haahr H. IDegAsp shows distinct prandial and basal glucose-lowering effects at steady state in subjects with type 1 diabetes. Diabetes 2013; 62 (Suppl 1): A235 (abstract 926-P) [ Links ]
31. Fulcher GR, Christiansen JS, Bantwal G, et al. Comparison of insulin degludec/insulin aspart and biphasic insulin aspart 30 in uncontrolled, insulin-treated type 2 diabetes: a phase 3a, randomized, treat-to-target trial. Diabetes Care 2014; 37: 2084-90. [ Links ]
32. Dardano A, Bianchi C, Del Prato S, Miccoli R. Insulin degludec/insulin aspart combination for the treatment of type 1 and type 2 diabetes. Vasc Health Risk Manag 2014; 10: 465-75. [ Links ]
33. Cooper JG, Pieber TR, Cariou B, Endahl L, Zacho J, Rodbard H. Treatment intensification with IDegAsp BID vs. IDeg OD plus IAsp in insulin-treated patients with type 2 diabetes: a randomised, controlled phase 3 trial. Diabetologia 2014; 57 (Suppl 1): S69 (Abstract 147). [ Links ]
34. Rodbard H, Pieber T, Cariou B, Endahl L, Zacho J, Cooper J. Treatment intensification with IDegAsp BID vs. IDeg OD plus IAsp in insulin-treated patients with type 2 diabetes: a randomised, controlled phase 3 trial. Diabetes Res Clin Prac 2014;106 (Suppl 1): S222-S223. [ Links ]
35. Kapitza C, Bode BW, Ingwersen SH, et al. Preserved pharmacokinetic properties and distinct glycaemic effects of insulin degludec and liraglutide in IDegLira, a fixed ratio combination product. Diabetologia 2014; 57:(Suppl 1): S392-393 (abstract #959). [ Links ]
36. Xultophy R. Summary of Product Characteristics. Novo Nordisk A/S. Bagsvard, Denmark, 2014. En: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/002647/WC500177657.pdf [ Links ]
37. Gough SCL, Bode B, Woo V, et al; On behalf of NN9068-3697 (DUAL-I) trial investigators. Efficacy and safety of a fixed-ratio combination of insulin degludec and liraglutide (IDegLira) compared with its components given alone: results of a phase 3, open-label, randomised, 26-week, treat-to-target trial in insulin naïve patients with type 2 diabetes. Lancet Diabetes Endocrinol 2014; 2: 885-93. [ Links ]
38. Buse JB, Vilsboll T, Thurman J, et al; on behalf of NN9068-3912 (DUAL-II) Trial Investigators. Contribution of liraglutide in the fixed-ratio combination of insulin degludec and liraglutide (IDegLira). Diabetes Care 2014; 37: 2926-33. [ Links ]
39. The Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993; 329: 977-86. [ Links ]
40. Budnitz DS, Lovegrove MC, Shehab N, Richards CL. Emergency hospitalizations for adverse drug events in older Americans. N Engl J Med 2011; 365: 2002-12. [ Links ]
41. Onishi Y, Ono Y, Rabøl R, Endahl L, Nakamura S. Superior glycaemic control with once-daily insulin degludec/insulin aspart versus insulin glargine in Japanese adults with type 2 diabetes inadequately controlled with oral drugs: a randomized, controlled phase 3 trial. Diabetes Obes Metab 2013; 15: 826-32. [ Links ]
42. Hirsch IB, Bode B, Courreges JP, et al. Insulin degludec/insulin aspart administered once daily at any meal, with insulin aspart at other meals versus a standard basal-bolus regimen in patients with type 1 diabetes: a 26-week, phase 3, randomized, open-label, treat-to-target trial. Diabetes Care 2012; 35: 2174-81. [ Links ]
43. Glucose tolerance and cardiovascular mortality: comparison of fasting and 2-hour diagnostic criteria. DECODE study group. Arch Intern Med 2001; 161: 397-405. [ Links ]














