Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina (Buenos Aires)
Print version ISSN 0025-7680On-line version ISSN 1669-9106
Medicina (B. Aires) vol.76 no.6 Ciudad Autónoma de Buenos Aires Dec. 2016
ARTÍCULO ORIGINAL
Resistencia de HIV-1 a drogas antirretrovirales en gestantes del área metropolitana de Buenos Aires*
Inés Zapiola1, Diego Cecchini2, Silvina Fernández Giuliano1, Marina Martínez2, Claudia Rodríguez2, Maria Belén Bouzas1
1Unidad Virología, Hospital de Infecciosas Dr. F. J. Muñiz,
2Grupo de Trabajo en la Prevención de la Transmisión Vertical, Hospital Argerich, Buenos Aires, Argentina
Dirección postal Lic. Inés Zapiola, Hospital de Infecciosas Dr. F. J. Muñiz, Uspallata 2272, 1282 Buenos Aires, Argentina
e-mail: izapiola@hotmail.com
*Este estudio fue presentación oral en el XV Congreso Argentino de la Sociedad Argentina de Infectología - SADI2015, Buenos Aires Argentina. ABS-275.
Recibido: 10-V-2016
Aceptado: 18-VIII-2016
Resumen
Se determinó la frecuencia de mutaciones asociadas a resistencia de HIV-1 a antirretrovirales en embarazadas del área metropolitana de Buenos Aires, 2008–2014. Se incluyeron 136 mujeres con carga viral ≥ 500 copias/ml: 77 (56.6%) eran naïve; las otras 59 (43.4%) eran expuestas, ya sea con tratamiento en curso (n: 24) o previo (n: 35). Se realizó análisis de resistencia genotípica basal en plasma de pacientes naïve y con experiencia de tratamiento antirretroviral. Las mutaciones se identificaron según las listas de la Organización Mundial de la Salud y la International Antiviral Society, respectivamente. Se comparó la frecuencia de mutaciones detectadas en los subperíodos 2008-2011 vs. 2012-2014. Un total de 37 (27.2%) mujeres presentaron ≥ 1 mutación asociada a resistencia: 25/94 (26.5%) en 2008-2011 y 12/42 (28.5%) en 2012-2014 (p > 0.05). Entre las naïve, 15 (19.5%) tenían ≥ 1 mutación: 10/49 (20.4%) en el subperíodo 2008-2011 y 5/28 (17.8%) en 2012-2014 (p > 0.05). Las mutaciones encontradas en pacientes naïve estuvieron asociadas a inhibidores no nucleosídicos de la transcriptasa reversa, y, como en estudios anteriores, K103N fue la más frecuente a lo largo de todo el período. Entre las pacientes expuestas, 22/59 (37.3%) presentaron ≥ 1 mutación asociada a resistencia. Este estudio demuestra una alta frecuencia de mutaciones asociadas a resistencia que se mantuvo estable a lo largo del período. Los niveles detectados sugieren una mayor circulación en nuestro medio de cepas de HIV-1 resistentes a antirretrovirales con respecto a los niveles previamente observados en Argentina.
Palabras clave: Mujeres embarazadas; HIV-1; Mutaciones de resistencia; Tratamiento antirretroviral; Transmisión vertical.
Abstract
HIV-1 resistance to antiretroviral drugs in pregnant women from Buenos Aires metropolitan area
The study aimed to determine the prevalence of antiretroviral resistance associated mutations in HIV-1 infected pregnant woman treated in Buenos Aires metropolitan area (period 2008-2014). A total of 136 women with viral load ≥ 500 copies/ml were included: 77 (56.6%) were treatment-naïve and 59 (43.4%) were antiretroviral-experienced patients either with current (n: 24) or previous (n = 35) antiretroviral therapy. Genotypic baseline resistance was investigated in plasma of antiretroviral-naïve patients and antiretroviral-experienced patients. The resistance mutations were identified according to the lists of the World Health Organization and the International Antiviral Society, respectively. Frequencies of resistance associated mutations detected in 2008-2011 and 2012-2014 were compared. A total of 37 (27.2%) women presented at least one resistance associated mutation: 25/94 (26.5%) in 2008-2011 and 12/42 (28.5%) in 2012-2014 (p > 0.05). Among naïves, 15 (19.5%) had at least one mutation: 10/49 (20.4%) in the period 2008-2011 and 5/28 (17.8%) in 2012-2014 (p > 0.05). The resistance mutations detected in naïves were associated with non nucleoside reverse transcriptase inhibitors, being K103N the most common mutation in both periods. In antiretroviral experienced patients, 22/59 (37.3%) had at least one resistance mutation. This study demonstrates a high frequency of resistance associated mutations which remained stable in the period analyzed. These levels suggest an increased circulation of HIV-1 antiretroviral resistant strains in our setting compared to previous reports from Argentina.
Key words: Pregnancy; HIV-1; Mutation; Antiretroviral therapy; Vertical transmission.
En Argentina, desde 1992 la provisión de tratamiento antirretroviral (TARV) está garantizada por el estado en forma gratuita para todos los pacientes HIV positivos. La administración de TARV está recomendada para todas las mujeres embarazadas infectadas por HIV a fin de prevenir la transmisión de madre a hijo1-3. Un descenso significativo en la tasa de transmisión perinatal se ha observado en Argentina desde 1995, atribuible tanto a la utilización sistemática de TARV profiláctico como a la puesta en vigencia de legislación específica que establece la obligatoriedad del ofrecimiento de la prueba de HIV a todas las mujeres embarazadas4. La población estimada de personas infectadas con HIV en nuestro país es de aproximadamente 110 000 casos, el 44.4% de los cuales corresponde al área metropolitana de Buenos Aires (Ciudad Autónoma de Buenos Aires y Gran Buenos Aires)4.
La aparición de mutaciones en el genoma viral es una causa importante de resistencia a los antirretrovirales (ARVs), que a su vez puede conducir al fracaso del tratamiento. Por lo tanto, la presencia de mutaciones asociadas a resistencia (MARs) en mujeres embarazadas puede aumentar el riesgo de transmisión perinatal de la infección (debido a una insuficiente supresión viral peri-parto) y afectar las opciones futuras de tratamiento de las mujeres y los niños5. Estudios recientes en Argentina han encontrado evidencia de resistencia primaria y secundaria, incluso en embarazadas, población pediátrica y recién nacidos de madres sin TARV durante el embarazo6-9. Por otro lado, las pacientes con embarazos previos presentan mayor riesgo de resistencia, en particular aquellas mujeres expuestas a una dosis única de nevirapina durante el parto o con interrupción posparto no estructurada de tratamiento antirretroviral10. Por estas razones, las guías internacionales recomiendan la realización de una prueba de resistencia para todas las mujeres embarazadas con carga viral detectable para guiar la elección de las drogas ARVs11. En Argentina, el acceso a las pruebas de resistencia para mujeres embarazadas ha sido limitado, y hasta hace poco, era recomendado exclusivamente para gestantes con fracaso virológico12. Los datos sobre frecuencia de MARs en esta población vulnerable de nuestro país, particularmente en pacientes naïve de TARV son escasos. Por lo tanto, el objetivo de este estudio fue determinar la frecuencia de MARs en mujeres embarazadas atendidas en un hospital público de la Ciudad Autónoma de Buenos Aires y determinar posibles variaciones a lo largo del período estudiado (2008-2014).
Materiales y métodos
A fin de llevar a cabo el estudio, se estableció un vínculo de colaboración entre el Grupo de Prevención de la Transmisión Vertical del Hospital Cosme Argerich y la Unidad de Virología del Hospital de Infecciosas Francisco J. Muñiz, ambos pertenecientes al sistema público de salud de la Ciudad Autónoma de Buenos Aires. El Hospital Cosme Argerich es un centro de atención médica de alta complejidad, que se encuentra en el sur de la ciudad, cerca del límite con la provincia de Buenos Aires. Este hospital asiste a población con bajos ingresos, tanto de la ciudad como de la provincia de Buenos Aires. Las pacientes fueron evaluadas entre febrero de 2008 y septiembre de 2014 en el contexto de su asistencia infectológica por su condición de gestantes. Se incluyeron mujeres embarazadas infectadas con HIV con carga viral ≥ 500 copias/ml, independientemente de su edad, edad gestacional e historia de exposición al TARV.
Las mujeres fueron clasificadas como naïve si nunca habían estado expuestas a TARV o, como expuestas, si habían tenido exposición previa a TARV o estaban bajo TARV al momento del estudio. Se recolectaron datos epidemiológicos en todos los casos, incluido el historial de la terapia previa o actual.
Se recolectaron muestras de sangre con EDTA en la primera visita de las pacientes, el plasma fue separado por centrifugación y almacenado a -80 °C hasta su procesamiento. La carga viral se determinó utilizando el ensayo Versant® HIV-1 RNA 3.0 Assay (Siemens Healthcare Diagnostics, Tarrytown, NY, EE.UU.) que posee un límite de detección de 50 copias de ARN de HIV-1/ml. Todas las muestras con carga viral ≥ 500 copias/ml fueron secuenciadas utilizando el ensayo TRUGENETM HIV-1 Genotyping Kit (Siemens). Brevemente, el ARN fue extraído de 140 μl de plasma utilizando el equipo QIAamp® Viral RNA Mini Kit (Qiagen, Hilden, Alemania) de acuerdo a las instrucciones del fabricante. En muestras con carga viral < 1000 copias/ml, el virus se concentró a partir de 1 ml de plasma por centrifugación durante 1 hora a 17 000 rpm. El equipo TRUGENETM HIV-1 Genotyping Kit se utilizó en conjunto con el programa OpenGene automated DNA Sequencing System (Siemens) para secuenciar el gen de la transcriptasa inversa del HIV-1 del codón 40 al 247 y el gen de la proteasa del codón 1 al 99, siguiendo las instrucciones del fabricante.
Las MARs fueron identificadas de acuerdo al listado de la Organización Mundial de la Salud para vigilancia de resistencia en pacientes no tratados13. En las muestras de pacientes con TARV en curso o previo, las MARs se identificaron siguiendo el listado de mutaciones de la International Antiviral Society (IAS-USA)14. Las secuencias obtenidas fueron analizadas utilizando la herramienta informática REGA versión 2.0 (Instituto Rega de la Universidad Católica de Leuven, Bélgica) con el objetivo de realizar la subtipificación de HIV-115.
El estudio fue aprobado por el Comité de Ética del Hospital Argerich.
Las secuencias de HIV-1 fueron evaluadas y se estimó el número y porcentaje de muestras con MARs identificadas individualmente o en combinación. Los datos fueron procesados utilizando los programas Excel y Statistix 7.0. Se aplicó el Wilcoxon Rank-Sum Test para la comparación de medianas y prueba de χ2 para la comparación de proporciones.
Resultados
Durante el período de estudio un total de 9077 mujeres embarazadas fueron atendidas en el Hospital Cosme Argerich, de las cuales 156 (1.7%) estaban infectadas con HIV-1. Un total de 20 mujeres fueron excluidas del estudio debido a carga viral basal < 500 copias/ml o falta de muestra basal. Las muestras de plasma correspondientes a 136 pacientes fueron estudiadas para resistencia en la visita de inicio, 77 (56.6%) de las cuales eran naïve de TARV. Dentro de este grupo, 57 mujeres (74%) fueron diagnosticadas en el embarazo, incluso dos durante el curso de la infección primaria. De las restantes 59 (43.4%) pacientes, 24/59 (40.7%) se encontraban en TARV al momento de la toma de la muestra y 35/59 (59.3%) habían recibido TARV en el pasado.
En cuanto a la procedencia, el 50% de las mujeres residía en la provincia de Buenos Aires. Las principales características de la población estudiada se muestran en la Tabla 1.
Tabla 1. Características de las mujeres embarazadas HIV-1 positivas incluidas en el estudio de resistencia genotípica. Los valores están expresados en mediana (rango) salvo aclaración
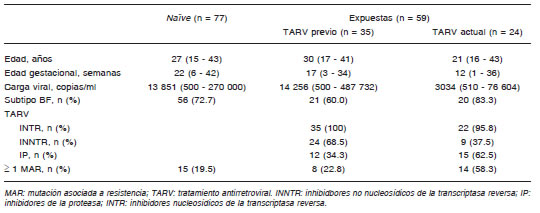
La mediana de la carga viral plasmática fue 10 804 copias/ml (rango = 500 - 487 732). El análisis filogenético de la secuencia en la región pol demostró intersubtipo recombinante BF en 97 muestras (71.3%), subtipo B en 32 (23.5%), subtipo F en 1 (0.7%), subtipo C en 1 (0.7%), e intersubtipo CB en 1 (0.7%). En cuanto a la exposición a las distintas familias de drogas, el 100% de las pacientes con TARV actual o pasado recibieron inhibidores análogos de nucleósidos de la transcriptasa reversa (INTR), el 71.2% inhibidores no nucleosídicos de la transcriptasa reversa (INNTR) y el 50.8% inhibidores de la proteasa (IP).
Se observó una mediana de carga viral menor en las pacientes con TARV actual en comparación con las pacientes naïve y las pacientes con TARV previo (p < 0.05). El grupo de pacientes naïve presentó una mediana de edad gestacional mayor que el grupo de pacientes con TARV previo o actual (p < 0.05).
Sobre la base de las listas de referencia consultadas, 37/136 (27.2%) embarazadas presentaron al menos una mutación asociada a resistencia, 25 (26.5%) en el subperíodo 2008-2011 y 12 (28.5%) en el subperíodo 2012-2014 (Tabla 2). No se encontraron diferencias significativas entre ambos períodos (p > 0.05).
Tabla 2. Frecuencia de mutaciones asociadas a resistencia en una población de mujeres embarazadas HIV-1 positivas del Área Metropolitana de Buenos Aires, Argentina. Los valores están expresados en totales (porcentajes)

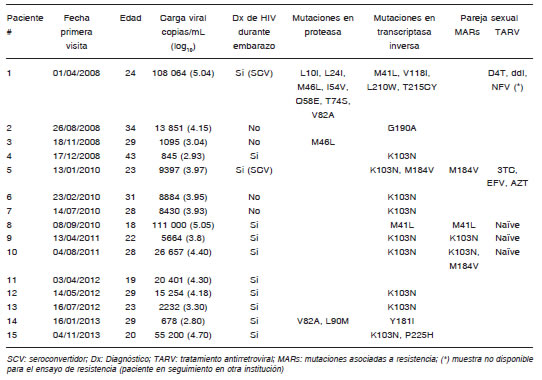
En el grupo de las pacientes naïve, 15/77 (19.5%) evidenciaron al menos una mutación primaria asociada a resistencia, 10 (20.4%) en el subperíodo 2008-2011 y 5 (17.8%) en el subperíodo 2012-2014 (p > 0.05). En este grupo, las mutaciones encontradas en ambos subperíodos estaban asociadas principalmente con los INNTR, 14.3% en 2008-2011 y 17.8% en 2012-2014 y, en menor medida con los IP, 4.1% en 2008-2014 y 3.5% en 2012-2014. Se encontraron mutaciones asociadas a los INTR únicamente en el período 2008-2011 (6.1%). Las MARs primarias encontradas en el gen de la transcriptasa reversa asociadas a los INNRTI fueron K103N (12.9%), seguida por G190A (2.6%), Y181I (1.3%), y P225H (1.3%) mientras que las asociadas a resistencia a los INRTI fueron M41L (2.6%), M184V (1.3%), L210W (1.3%) y T215C (1.3%). En cuanto a las MARs en el gen de la proteasa, la más frecuentemente encontrada fue V82A (2.6%) seguida de L24I (1.3%), M46I (1.3%), I54V (1.3%) y L90M (1.3%). También fueron secuenciadas muestras de sangre HIV positivas de las parejas sexuales de cuatro de las mujeres naïve incluidas en el estudio (tres de las parejas eran también naïve del tratamiento). Las mutaciones encontradas en las parejas coincidieron con las encontradas en sus respectivas mujeres embarazadas. Los patrones de mutaciones encontrados en las pacientes naïve de TARV y en sus parejas se muestran en la Tabla 3. Del total de mujeres naïve diagnosticadas durante el embarazo, 11/57 (19.3%) evidenciaron al menos una MAR, incluidas aquellas pacientes con infección primaria.
Tabla 3. Mutaciones asociadas a resistencia en mujeres embarazadas HIV-1 positivas naïve de tratamiento antirretroviral, Buenos Aires, Argentina
En el grupo de pacientes con TARV actual o pasado, 22/59 (37.2%) presentaron al menos una MAR incluida en el listado de la IAS-USA (Tabla 2): 14 en el grupo con TARV actual y 8 en el grupo con TARV previo, cinco de las cuales habían suspendido el tratamiento al menos 12 meses antes del ingreso al estudio. En el grupo de las pacientes con TARV actual, 12/24 (50%) presentaron resistencia asociada con los INTR y 11 (45.8%) con los INNTR, mientras que en el grupo con TARV previo 17.1% de las mujeres presentaron resistencia asociada con los INNTR. No se observaron diferencias estadísticamente significativas en la frecuencia de MARs en mujeres expuestas a TARV entre ambos subperíodos. La MAR más frecuente encontrada en el grupo con TARV actual fue M184V (29.2%) seguido por K103N, presente en el 25% de las pacientes, mientras que en el grupo con TARV previo, la mutación K103N fue encontrada en 6 (17.1%) mujeres. La MAR en el gen que codifica para la proteasa más frecuente fue L90M: se la encontró en 7/59 (11.9%) de las pacientes expuestas, 5 (20.8%) en el grupo con TARV actual y 2 (5.7%) en el grupo con TARV previo. Dos pacientes expuestas pero sin exposición previa a los IP evidenciaron mutaciones primarias asociadas con resistencia a esta familia de drogas (L90M y I54V/I84V/L90M).
Discusión
Este estudio proporciona información sobre la frecuencia de las MARs en mujeres embarazadas asistidas en el sistema público de salud en la Ciudad Autónoma de Buenos Aires (que incluye proporciones similares de pacientes residentes en la Ciudad Autónoma de Buenos Aires y en sus alrededores de la Provincia de Buenos Aires). Dado que las mujeres embarazadas infectadas por HIV son consideradas una población vulnerable, hay que destacar varios aspectos de este estudio. Como era de esperar, la mediana de la carga viral en el grupo de pacientes con TARV actual fue menor que en el grupo con TARV previo y en el grupo naïve, tal como se informa en estudios previos16, 17. La edad gestacional al momento del estudio fue menor en el grupo tratado con respecto al grupo de las mujeres naïve, probablemente debido a que las pacientes tratadas, conscientes de su estado serológico, asisten a la consulta médica rápidamente una vez que el embarazo se sospecha o se confirma.
De acuerdo a nuestros resultados, el 27.2% de las mujeres embarazadas portadoras de HIV-1 atendidas en un hospital público de la Ciudad Autónoma de Buenos Aires presentan al menos una MAR. Esta frecuencia se mantuvo estable a lo largo del período de estudio y es mayor que la observada en mujeres embarazadas de la región previamente publicadas. Duran y col.16 encontraron una frecuencia de MARs del 16.1% en gestantes infectadas por HIV-1 de los países de América Latina y el Caribe, que recibieron tratamiento profiláctico para evitar la transmisión perinatal, entre 2002 y 2005. Sin embargo, es importante destacar que en nuestro país se ha observado una frecuencia del 22.7% de MARs en lactantes con diagnóstico reciente de HIV9, 17. La frecuencia global encontrada en el presente estudio se halla en concordancia con estas publicaciones.
La frecuencia de MARs en mujeres naïve de TARV fue alta con un 19.5 % a lo largo del estudio. Las MARs más frecuentes estaban asociadas a INNTR (15.6%), y no se observaron variaciones significativas a lo largo del período. Esta frecuencia es algo superior a la encontrada en nuestro país para población adulta naïve de TARV. Cecchini y col. reportaron una frecuencia de MARs del 12.1% en pacientes adultos naïve de tratamiento asistidos entre 2011 y 2013 en un centro privado del AMBA18. Otro estudio llevado a cabo recientemente en diferentes centros de nuestro país encontró una frecuencia del 13% de resistencia primaria (datos no publicados, Programa Nacional de SIDA). Al analizar resultados de estudios previos en poblaciones naïve de tratamiento de diferentes países de América Latina, Murillo y col. encontraron en Honduras una frecuencia de MARs del 7% en pacientes recientemente diagnosticados: 5% para los INNTR, 3% INTR, y 0.5% para los IP19. En Brasi, no se encontraron MARs entre embarazadas naïve provenientes de la región centro-oeste, estudiadas durante 200320. Esto contrasta con el 10% de resistencia primaria observado en pacientes naïve en 2007-200821 y con el 25% observado en 2013 en mujeres embarazadas naïve de la misma región22. Como en otras partes del mundo, el aumento de la resistencia primaria observado en Brasil a lo largo del tiempo refleja el creciente nivel de exposición de los pacientes a los tratamientos antirretrovirales20.
Es importante destacar que en el 74% de las mujeres naïve de nuestro estudio la infección HIV se detectó durante el embarazo. Del total de mujeres diagnosticadas durante el embarazo, 11/57 (19.3%) presentaban al menos una MAR. Esta característica nos permite comparar nuestros datos con estudios previos realizados en población recientemente diagnosticada. En Argentina se ha descripto un aumento en la frecuencia de mutaciones tales como K103N, M41L y V108I. No obstante, dichos estudios describen frecuencias globales de resistencia primaria inferiores a la aquí descripta23-25. En conjunto, los niveles de resistencia primaria asociada principalmente a los INNTR comunicados en Buenos Aires han aumentado en los últimos años, debido probablemente al alto nivel de cobertura de TARV y a la creciente utilización de esa familia de drogas en nuestro país.
Se encontró además evidencia de transmisión de resistencia a IP en pacientes naïve y expuestas. L90M es la MAR asociada a resistencia a IP más prevaleciente (3.4%), seguida de V82A (2.3%) lo que podría indicar un aumento de la transmisión de cepas resistentes a IP en nuestra población.
Entre las limitaciones de este estudio podemos mencionar en primer lugar que el mismo se realizó en un solo centro hospitalario. Sin embargo, cabe destacar que el Hospital Argerich atiende una amplia población de mujeres embarazadas HIV positivas residentes en la Ciudad Autónoma de Buenos Aires y en la Provincia de Buenos Aires, y realiza el 11.5% de todos los partos de mujeres HIV positivas que se producen en la Ciudad Autónoma de Buenos Aires26. En segundo lugar, este estudio fue de corte transversal lo que nos impidió evaluar respuesta virológica de las mujeres tratadas y la tasa de transmisión perinatal. Por lo tanto, la influencia de la resistencia a los antirretrovirales en la prevención de la transmisión de madre a hijo del HIV merecería un estudio especial.
En conclusión, este estudio describe una frecuencia elevada de MAR en mujeres embarazadas tanto naïve de TARV como expuestas a TARV. La frecuencia encontrada en la población naïve evidencia un aumento substancial de la circulación de cepas de HIV-1 resistentes en la ciudad de Buenos Aires con respecto a los niveles observados con anterioridad. El valor encontrado también supera ampliamente el 15% sugerido por la Organización Mundial de la Salud como un alto nivel de resistencia transmitida27. Nuestros resultados confirman la importancia de la incorporación de las pruebas genotípicas en esta población para orientar la elección de un régimen antirretroviral óptimo.
Conflicto de intereses: Ninguno para declarar
1. Connor EM, Sperling RS, Gelber R, et al. Reduction of maternal infant transmission of human immunodeficiency virus type 1 with zidovudine treatment. N Engl J Med 1994; 331: 1173-80. [ Links ]
2. Guay LA, Musoke P, Fleming T, et al. Intrapartum and neonatal single-dose NVP compared with zidovudine for prevention of mother-to-infant transmission of HIV-1 in Kampala, Uganda: HIVNET-012 randomized trial. Lancet 1999; 354: 795-802. [ Links ]
3. Lallemant M, Jourdain G, Le Coeur S, et al. Single-dose perinatal nevirapine plus standard zidovudine to prevent mother-to child transmission of HIV-1 in Thailand. N Engl J Med 2004; 351: 217-28. [ Links ]
4. Ministerio de Salud, Presidencia de la Nación. Boletín sobre VIH-sida en Argentina. 2014. Nº 31. En: http://www.msal.gov.ar/images/stories/bes/graficos/0000000601cnt-2015-01-29_boletin-epidemiologico-vih-2014.pdf; consultado el 22/04/2016. [ Links ]
5. Lyons F, Coughlan S, Byrne C, Hopkins S, Hall W, Mulcahy F. Emergence of antiretroviral resistance in HIV-positive women receiving combination antiretroviral therapy in pregnancy. AIDS 2005; 19: 63-7. [ Links ]
6. Petroni A, Deluchi G, Lopardo G, et al. HIV resistance surveillance on recently infected drug-naïve patients from Argentina. XVII International AIDS Conference, Mexico DF, August 2008 [abstract TUPE0073]. En: http://library.iasociety.org/AbstractView.aspx?confID=2008&abstractId=4604; consultado el 22/04/2016.
7. Figueroa MI, Sued O, Laufer N, et al. RT mutations patterns associated with cross resistance to NRTI or NNRTI in samples of experienced HIV patients from Buenos Aires. Poster Discussion. XVII International AIDS Conference, Mexico DF, August 2008 [abstract TUPDA204]. En: http://library.iasociety.org/AbstractView.aspx?confID=2008&abstractId=12806; consultado el 22/04/2016.
8. Soto-Ramirez LE, Rodriguez-Diaz R, Durán AS, et al. Antiretroviral resistance among HIV type 1-infected women first exposed to antiretrovirals during pregnancy: plasma versus PBMCs. AIDS Res Hum Retroviruses 2008; 24: 797-804. [ Links ]
9. Vignoles M, Barboni G, Agosti MR, et al. High frequency of primary mutations associated with antiretroviral drug resistance in recently diagnosed HIV-infected children. Antivir Ther 2007; 12: 1133-7. [ Links ]
10. Lockman S, Hughes MD, McIntyre J, et al. Antiretroviral Therapies in Women after Single-Dose Nevirapine Exposure. N Engl J Med 2010; 363: 1499-509. [ Links ]
11. Hirsch MS, Günthard HF, Schapiro JM, et al. Antiretroviral drug resistance testing in adult HIV-1 infection: 2008 recommendations of an International AIDS Society-USA panel. Clin Infect Dis 2008; 47: 266-85. [ Links ]
12. Bruno M, Cecchini D, Ceriotto M, et al. Transmisión vertical. Capítulo 9. IV Consenso Argentino de TARV, Sociedad Argentina de Infectología, 2014-2015. En: http://www.sadi.org.ar/recomendaciones-y-consensos/item/273-consenso-argentino-de-terapia-antirretroviral-2014-2015; consultado el 22/04/2016. [ Links ]
13. Bennett DE, Camacho RJ, Otelea D, et al. Drug Resistance Mutations for Surveillance of Transmitted HIV-1 Drug-Resistance: 2009 Update. PLoS One 2009; 4: e4724. [ Links ]
14. Johnson VA, Brun-Vézinet F, Clotet B, et al. Update of the Drug Resistance Mutations in HIV-1. Top HIV Med 2008; 16: 138-45. [ Links ]
15. de Oliveira T, Deforche K, Cassol S, et al. REGA HIV-1 Subtyping Tool - Version 2.0. En: http://www.bioafrica.net/rega-genotype/html/index.html; consultado el 22/04/2016. [ Links ]
16. Duran AS, Losso MH, Salomon H, et al. Drug resistance among HIV-infected pregnant women receiving antiretrovirals for prophylaxis. AIDS 2007; 21: 199-205. [ Links ]
17. Vignoles M, Barboni G, Agosti MR, et al. Análisis de mutaciones primarias asociadas a resistencia a los antirretrovirales en niños con diagnóstico reciente de HIV-1. Actualizaciones en SIDA 2009; 63: 28-38. [ Links ]
18. Cecchini D, Castillo S, Vecchio C, et al. Resistencia primaria de HIV en el área metropolitana de Buenos Aires. Medicina (B Aires) 2015; 75: 163-8. [ Links ]
19. Murillo W, Paz-Bailey G, Morales S, et al. Transmitted drug resistance and type of infection in newly diagnosed HIV-1 individuals in Honduras. J Clin Virol 2010; 49: 239-44. [ Links ]
20. Cardoso LP, Pereira GA, Viegas AA, Schmaltz LE, Stefani MM. HIV-1 primary and secondary antiretroviral drug resistance and genetic diversity among pregnant women from Central Brazil. J Med Virol 2010; 82: 351-7. [ Links ]
21. Cardoso LP, Queiroz BB, Stefani MM. HIV-1 pol phylogenetic diversity and antiretroviral resistance mutations in treatment naïve patients from Central West Brazil. J Clin Virol 2009; 46: 134-9. [ Links ]
22. da Costa ZB, de Lima YA, Martelli CM, Stefanni MM. Transmitted HIV resistance among pregnant young women infected with HIV-1 in Brazil AIDS patient care and STDs 2013; 27: 439-41. [ Links ]
23. Dilernia DA, Lourtau L, Gomez AM, et al. Drug-resistance surveillance among newly HIV-1 diagnosed individuals in Buenos Aires, Argentina. AIDS 2007; 21: 1355-60. [ Links ]
24. Petroni A, Deluchi G, Pryluka D, et al. Update on Primary HIV-1 Resistance in Argentina: Emergence of Mutations Conferring High-Level Resistance to Nonnucleoside Reverse Transcriptase Inhibitors in Drug-Naïve Patients. J Acquir Immune Defic Syndr 2006; 42: 506-10. [ Links ]
25. Rodriguez-Rodrigues N, Duran A, Bouzas MB, et al. Increasing trends in primary NNRTI resistance among newly HIV-1-diagnosed individuals in Buenos Aires, Argentina. J Int AIDS Soc 2013; 16: 18519. [ Links ]
26. Coordinación SIDA, Ministerio de Salud de la Ciudad Autónoma de Buenos Aires. Situación epidemiológica del VIH-SIDA en la Ciudad de Buenos Aires Diciembre 2014. En: http://www.buenosaires.gob.ar/sites/gcaba/files/boletin_sida_2014_web.pdf; consultado el 22/04/2016. [ Links ]
27. Bennett DE, Myatt M, Bertagnolio S, Sutherland D, Gilks CF. Recommendations for surveillance of transmitted HIV drug resistance in countries scaling up antiretroviral treatment. Antivir Ther 2008; 13 (Suppl 2): 25-36. [ Links ]














