Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) vol.76 no.6 Ciudad Autónoma de Buenos Aires dic. 2016
ARTÍCULO ESPECIAL
Cribado, diagnóstico y tratamiento de la hepatitis por virus C en la práctica clínica
Ezequiel Ridruejo1, 2, 3, Hugo Fainboim3, 4, Alejandra Villamil3, 5
1Sección Clínica Médica y Sección Hepatología, Departamento de Medicina Interna, Centro de Educación Médica e Investigaciones Clínicas, Norberto Quirno CEMIC,
2Unidad de Hepatología y Trasplante Hepático, Hospital Universitario Austral, Pilar,
3Asociación Argentina para el Estudio de las Enfermedades del Hígado (AAEEH),
4Unidad de Hepatología, Hospital Francisco J. Muñiz,
5Unidad de Hepatología y Trasplante Hepático, Hospital Italiano, Buenos Aires, Argentina
Dirección postal: Ezequiel Ridruejo, San Martin 617 1° A, 1004 Buenos Aires, Argentina
e-mail: eridruejo@gmail.com, secretaria@aaeeh.org.ar
Recibido: 28-IV-2016
Aceptado: 8-IX-2016
Resumen
La hepatitis crónica por el virus de la hepatitis C (HCV) es un problema de salud mundial. En el mundo, 170 millones de personas están infectadas. En Latinoamérica la prevalencia se estima entre 1.0 y 2.3% y en Argentina es en promedio 1.0 a 1.5%. La eficacia del tratamiento de esta enfermedad ha mejorado sustancialmente en los últimos 2 a 3 años. Con los nuevos antivirales de acción directa (AAD) disponibles actualmente, pueden lograrse tasas de respuesta viral sostenida (RVS) mayores al 90-95% prácticamente con pocos efectos adversos. Para poder acceder a estos tratamientos con una alta tasa de curación, y así lograr reducir la carga de la enfermedad en la salud pública, es necesario aumentar el número de pacientes diagnosticados y que estos accedan a un cuidado adecuado. El rol de los médicos de atención primaria es fundamental: deben sospechar la infección, diagnosticarla y complementar su atención con la derivación al especialista. El trabajo conjunto de generalistas y especialistas optimizará el manejo de los recursos disponibles, permitiendo que cada vez más personas infectadas con el HCV sean diagnosticadas y tratadas adecuadamente.
Palabras clave: Hepatitis C; Cribado; Diagnóstico; Tratamiento.
Abstract
Screening, diagnosis and treatment of chronic hepatitis C in clinical practice
Chronic hepatitis C (HCV) is a global health problem. Worldwide, 170 million people are chronically infected. In Latin America its prevalence is estimated between 1.0 and 2.3%, and in Argentina between 1.0 and 1.5%. Treatment efficacy has considerably improved in the last 2 or 3 years. Sustained virological response (SVR) rates around 90-95% can be achieved with the new direct acting antiviral agents (DAAs) currently available, with few side effects. It is necessary to increase the number of diagnosed patients, linking them to adequate management and treatment. Raising treatment rates will increase the percentage of cured patients, reducing the burden of disease. Primary care physicians´ role is essential to achieve this goal. They must identify persons at risk, diagnose them and work with specialists to continue their medical care. Team working of generalists and specialists will permit that more HCV infected people can access to adequate care and treatment.
Key words: Hepatitis C; Screening; Diagnosis; Treatment.
La hepatitis crónica por el virus de la hepatitis C (HCV) es un problema de salud mundial. Se estima que 170 millones de personas están infectadas en el mundo, y la prevalencia global de anticuerpos anti-HCV varía entre 2.3 y 2.8%1. La prevalencia es mayor en el centro-este de Asia, en el norte de África y en medio Oriente (> 3.5%), y es menor en Europa occidental y América del Norte (1.5-3.5%)1. En Latinoamérica la prevalencia se estima entre 1.0 y 2.3%2, 3 y en Argentina entre 1.0 y 1.5%4.
La infección comienza con una forma aguda, mayoritariamente asintomática y que evoluciona a la cronicidad en la mayoría de los pacientes (80-85%). Una vez establecida la infección crónica, la enfermedad progresa en forma lenta, y puede llevar a la cirrosis, enfermedad hepática descompensada y carcinoma hepatocelular (HCC) luego de varios años de evolución5, 6. Esto ha llevado a que la infección por HCV se transforme en una de las principales causas de trasplante hepático y muerte por enfermedad hepática avanzada en el mundo7. Además, últimamente se ha incrementado la morbi-mortalidad por HCV y se estima que seguirá incrementándose en los próximos años8. Por otra parte, la enfermedad por HCV se vincula a una reducción de la calidad de vida en las personas afectadas por ella9.
La eficacia del tratamiento ha mejorado considerablemente en los últimos 2 o 3 años. El tratamiento previo se basó en el uso de la combinación de peg-interferón y ribavirina con una tasa de curación global (respuesta viral sostenida, RVS) de 50%. En el año 2011 se agregó a este tratamiento los primeros antivirales de acción directa (AAD), los inhibidores de proteasa (IP) de primera generación: boceprevir y telaprevir. Con esto la RVS se incrementó al 75%, pero con un elevado número de efectos adversos. Los nuevos AAD disponibles actualmente pueden lograr una RVS mayor al 90-95%, con pocos efectos adversos10.
Para poder acceder a estos tratamientos con una alta probabilidad de curación, y así lograr reducir la carga de la enfermedad en la salud pública, es necesario aumentar el número de pacientes diagnosticados y que estos accedan a un cuidado adecuado. Para lograr esto son necesarios 2 grupos de profesionales: los generalistas y los especialistas. Los generalistas son los médicos clínicos, de familia, gastroenterólogos e infectólogos que participan en el cribado (screening) de la infección por HCV, en la confirmación del diagnóstico y en la derivación a lol especialistas. Estos últimos, la mayoría hepatólogos, se ocupan de evaluar la gravedad de la enfermedad hepática y de decidir el tratamiento adecuado. En esta revisión actualizaremos la información referente al rol del médico generalista en la evaluación del paciente con hepatitis crónica por HCV.
Cribado de HCV en la práctica clínica
Muchos pacientes asintomáticos concurren al consultorio a realizar chequeos de salud. De acuerdo a la edad y a los antecedentes, se decide cuáles son los exámenes médicos a realizar. Existen varias herramientas que asisten al médico para decidir los estudios complementarios de laboratorio a realizar11. La primera pregunta es si es recomendable testear la presencia del HCV en los pacientes asintomáticos dentro de un control de rutina.
Entendemos aquí por cribado a la estrategia aplicada para detectar una enfermedad en individuos sin síntomas de tal enfermedad. En general, es conveniente realizarlo en aquellas enfermedades en las que el diagnóstico temprano y el inicio precoz de un tratamiento efectiv, puede prevenir el desarrollo de complicaciones. En el caso de la infección crónica por HCV, la detección temprana puede cambiar el impacto de la enfermedad sobre la salud pública al reducir la morbilidad, la mortalidad y/o la tasa de transmisión. Por lo tanto, en este caso está justificado el cribado, aunque las poblaciones a testear pueden variar en los distintos países.
En EE. UU. el 76% de los pacientes infectados nacieron entre 1945 y 1965, esta población es conocida como Baby Boomers12. A partir de esto, la US Prevention Services Task Force (USPSTF), el Centers for Disease Control and Prevention (CDC), y la American Association for the Study of Liver Diseases (AASLD) recomiendan realizar el cribado de HCV en este grupo de pacientes una vez en la vida, independientemente de los factores de riesgo que puedan presentar13-15. La USPTF no lo recomienda en la población adulta asintomática (población general) ya que la prevalencia de la enfermedad es baja, la mayoría de las personas infectadas no tendrán complicaciones a largo plazo y que no hay evidencia que se asocie con una mejor evolución de la enfermedad a largo plazo13.
La USPTF, el CDC, la AASLD y la European Association for Study of Liver (EASL) recomiendan además el cribado en las personas portadoras de factores de riesgo para la infección por HCV13-16. Estos son:
– Uso de drogas intravenosas actuales o pasados
– Receptores de transfusiones de sangre o hemoderivados antes de 1992
– Hemodiálisis
– Hijo de madre HCV positiva
– Exposiciones percutáneas (tatuajes no seguros, etc.)
– Uso de drogas intranasales
– Personas privadas de su libertad
– Conductas sexuales de riesgo
En nuestro país, la Asociación para el Estudio de las Enfermedades del Hígado (AAEEH) recomienda el cribado en los mismos grupos de alto riesgo4. La AAEEH no establece ningún grupo etario como de mayor riesgo, y sugiere el cribado universal al menos una vez en la vida en la población adulta4.
El cribado debe realizarse a través de la detección de los anticuerpos del HCV por el método de ELISA de 3a. generación4. Este método tiene una sensibilidad del 98% y un valor predictivo positivo del 95% cuando hae riesgo (relativamente alta prevalencia esperada) y de un 50% cuando no lo hay y los niveles de alanina aminotransferasa (ALT) son normales. Pueden suceder reacciones falso-positivas ya que hay reactividad cruzada con anticuerpos no necesariamente específicos17. Puede haber resultados falsos negativos en personas con una infección reciente, que estén inmunosuprimidas o en hemodiálisis. En estos casos deberá realizarse la detección de ARN viral.
Ante un ELISA para HCV positivo, debe realizarse la detección de ARN viral con un método de alta sensibilidad (nivel de detección > 12-25 UI/ml). Si la detección es positiva, se trata de un portador crónico del HCV. Si la detección es negativa, puede tratarse de una infección resuelta o de un falso positivo4 (Fig. 1). Los métodos serológicos suplementarios para anti-HCV (Immunoblot, conocido como RIBA o LIA) se encuentran en desuso, debido a que se trata de determinaciones costosas y laboriosas en su procedimiento, y con valor diagnóstico limitado ya que resultados positivos por estos métodos no permiten confirmar una infección presente4.
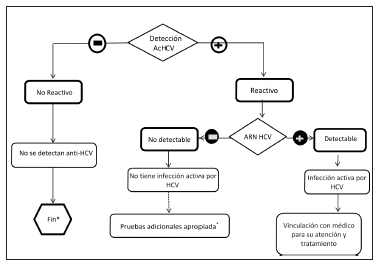
Fig. 1. Algoritmo para la interpretación de pruebas diagnósticas en HCV
Epidemiología en Argentina
La situación epidemiológica en nuestro país es muy variable. Como en la mayoría de los países de la región, no hay estudios epidemiológicos diseñados y realizados a tal fin. Por eso la información depende de estudios poblacionales y de los bancos de sangre. Según los datos del Ministerio de Salud de la Nación (MSAL), la prevalencia en donantes de sangre fue de 0.36% en el año 201218. A su vez, en un estudio realizado en los análisis prenupciales, la prevalencia fue de 0.26% (IC95% 0.10-0.43)19. Debe tenerse en cuenta que estos son grupos seleccionados de muy bajo riesgo de infección.
Se estima que la prevalencia en nuestro país es de 1.5% en la población general, y si se considera solo la población adulta sería de 2.0-2.5%2. Estas cifras varían cuando se estudian poblaciones de riesgo. En adictos endovenosos puede llegar al 56%, en pacientes en hemodiálisis al 26% y en hemofílicos al 19%4, 18, 20.
Vale la pena destacar que en distintos estudios realizados en diversas ciudades del interior del país se encuentran zonas de alta endemicidad. En estas las prevalencias son muy variables, pero en general mayores que las estimadas en el promedio del país. En diversas ciudades de Córdoba en los años 2004-2005 se encontró una prevalencia entre el 5.6% y 6.4%21, 22. En la ciudad de Rufino (Provincia de Santa Fe) se encontró una prevalencia del 2.2%23, en la ciudad de O´Brien (Partido de Bragado, Provincia de Buenos Aires) del 5.7%24 y en la ciudad de Wheelwright, (Provincia de Santa Fe) del 4.9%25 (Tabla 1).
Tabla 1. Estudios de prevalencia HCV en la Argentina
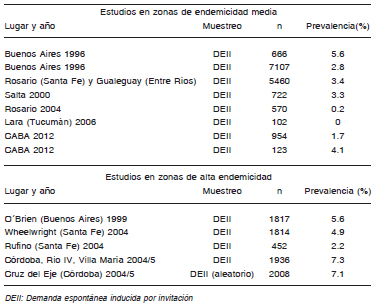
En los estudios realizados en la población general, las tasas de prevalencia se acercan al promedio nacional. El único estudio realizado a tal fin evaluó la prevalencia en la localidad de Derqui en la provincia de Buenos Aires en el año 2003; esta fue del 0.87%26. En pruebas de demanda espontánea inducida por invitación en distintas ciudades la prevalencia fue: Buenos Aires, 1996, 2.8%27; Ciudad Autónoma de Buenos Aires, 2012, 1.69%28; Salta, 2000, 3.3%29; Rosario, 2004, 0.18%30 (Tabla 1).
Efecto de la enfermedad por HCV en la Argentina
En muchos países, a pesar de que el número de nuevas infecciones ha disminuido drásticamente, la morbilidad y mortalidad por HCV están en aumento8. Esta tendencia se debe al envejecimiento de la población. Esto lleva a un aumento de la mortalidad por cualquier causa, resultando en la disminución del número total de pacientes infectados. El envejecimiento de la población lleva a un aumento de las muertes relacionadas con enfermedad hepática avanzada a medida que el daño hepático progresa en los pacientes infectados por HCV8, 31.
En EE.UU., la mortalidad por HCV supera a la mortalidad por la infección por el virus del HIV32. En ese país se espera un aumento de los casos de carcinoma hepatocelular (HCC) del 45.0% para el 2030 y un aumento de los casos de cirrosis del 30.5% para el 202033. Se calculan proyecciones similares en varios países de la región y del mundo, con aumento de los casos de HCC, cirrosis, cirrosis descompensada, y muerte por enfermedad hepática avanzada por HCV con picos entre los años 2020 y 203034-36.
La situación en Argentina es similar. El pico de incidencia de dio en 1989, y para 201, se redujo en un 90%. Se estima que para el año 2030 la población de personas infectadas se reducirá en un 30% por aumento de la mortalidad. Para el 2030 se proyecta un aumento de los casos de cirrosis del 55%, de los casos de cirrosis descompensada del 85% y de los casos de HCC del 65%37 (Fig. 2).
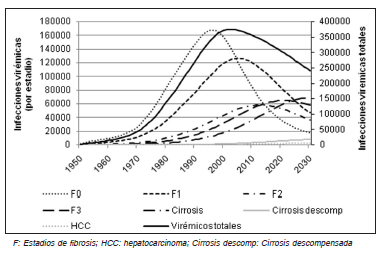
Fig. 2. Proyección de carga de la enfermedad por HCV en la Argentina
Nuevos tratamientos
En los últimos años se ha vivido una revolución en el tratamiento de la hepatitis C. Se han aprobado múltiples fármacos que en distintas combinaciones pueden utilizarse para tratar los distintos genotipos del HCV. La familia del HCV está compuesta, principalmente, por 6 genotipos que se numeran del 1 al 6. Además, estos se sub-clasifican en subtipos y se nombran con letras minúsculas de la "a" en adelante38. El genotipo más prevalente a nivel global es el 1 (46.2%) seguido por el 3 (30.1%); los genotipos 2, 4 y 6 son responsables del 22.8% de las infecciones y el 5 de < 1%39. Estos porcentajes varían de acuerdo a los diferentes países; en Argentina la prevalencia estimada es: genotipo 1, 72% (G1a 51%; G1b 49%); genotipo 2, 6%; genotipo 3, 17%; y genotipo 4, 4%18. El genotipo y el subtipo son fundamentales a la hora de decidir el tratamiento a utilizar.
Inicialmente, el tratamiento se basó en el uso de la combinación de peg-interferón (peg-IFN) y ribavirina (RBV) con una tasa de respuesta virológica sostenida (RVS) del 50%. En el año 2011 se agregaron a este tratamiento los primeros antivirales de acción directa (AAD), los inhibidores de proteasa (IP) de primera generación: boceprevir y telaprevir. Con esto la tasa de RVS se incrementó al 75%, pero con una elevada tasa de efectos adversos. Los nuevos AAD disponibles actualmente no requieren la combinación con peg-IFN, y muchos de ellos tampoco necesitan la combinación con RBV. Con estos regímenes libres de IFN pueden lograrse tasas de RVS mayores al 90-95% prácticamente sin efectos adversos10.
Los AAD se clasifican de acuerdo a su mecanismo de acción, según que enzima inhiben dentro del ciclo de replicación celular del HCV. El HCV es un virus ARN de una sola cadena de sentido positivo. Este se traduce en una poliproteína df 3011 aminoácidos que es clivada por proteasas celulares y virales en 3 proteínas estructurales (core, E1, y E2) y en 7 proteínas no estructurales (p7, NS2, NS3, NS4A, NS4B, NS5A, y NS5B)40. Estas proteínas no estructurales son los principales blancos de los AAD.
En la actualidad hay múltiples antivirales aprobados para su uso o en fases avanzadas de investigación (Tabla 2). La disponibilidad de los AAD varía según la aprobación por las autoridades regulatorias en los distintos países. A enero de 2016, en Argentina se encuentran disponibles el daclatasvir, el simeprevir y el sofosbuvir. Si bien están disponibles el boceprevir y el telaprevir, estos no se utilizan más dado que los nuevos AAD son más seguros y efectivos. Los AAD disponibles en nuestro país pueden usarse en distintas combinaciones según los genotipos y la situación clínica del candidato a recibir el tratamiento. Los regímenes recomendados en Argentina en pacientes naïve de tratamiento o no respondedores a peg-IFN + RBV, mono o coinfectados con HIV se resumen en la Tabla 341. Estos regímenes varían en el caso del tratamiento en pacientes con cirrosis descompensada, pos-trasplante hepático e insuficiencia renal. Existe más información sobre los esquemas de tratamiento15, 16, 41.
Tabla 2. Antivirales de acción directa disponibles y en desarrollo

Tabla 3. Esquemas de tratamiento recomendados en Argentina en pacientes naïve de tratamiento o no respondedores a Peg-IFN + ribavirina

Impacto del tratamiento en la carga de la enfermedad
El principal objetivo del tratamiento es lograr la curación de la infección por HCV. La curación virológica, RVS, se asocia con beneficios clínicosy con una reducción de la mortalidad por cualquier causa del 76% (IC95% 86-51%, p < 0.001; y con una reducción del riesgo de morir por enfermedad hepática avanzada o necesitar un trasplante hepático del 94% (IC95% 98-81%, p < 0.001)42. Las personas que lograron una RVS tienen una incidencia acumulada a 10 años de morir por enfermedad hepática avanzada o necesitar un trasplante hepático del 1.9% comparada con una del 27.4% en aquellos que no alcanzan una RVS (p < 0.001). Además, la incidencia de HCC a 10 años es de 5.1% comparado con un 21.8%, respectivamente (p < 0.001)42.
Estos beneficios clínicos, ¿pueden reducir el impacto de la enfermedad en la salud pública? Para que esto suceda, debe incrementarse en forma significativa el número de pacientes tratados. Si en el año 2010 se hubieran tratados todos los pacientes con HCV en EE.UU. con los tratamientos disponibles en ese momento, se reducirían para 2020 los riesgos de progresión a la cirrosis, descompensación de la enfermedad hepática, desarrollo de HCC y muertes por enfermedad hepática avanzada en un 16, 42, 31, y 36%, respectivamente32.
Con los tratamientos disponibles en la actualidad, que son más eficaces que los utilizados previamente, es esperable que estos porcentajes de reducción de la carga de la enfermedad puedan mejorarse. Con el uso de modelos epidemiológicos puede evaluarse esta hipótesis. Resultados publicados en más de 50 países demuestran que alcanza solo con aumentar las tasas de RVS, reflejando la eficacia de los mismos. Es necesario incrementar el número de pacientes diagnosticados y tratados34-36.
Al aplicar este modelo epidemiológico en nuestro país vemos que si aumentamos las tasas de RVS a 90-95%, pero mantenemos el número de pacientes tratado en la actualidad, solo reducimos la mortalidad, los casos de cirrosis descompensada y los casos de HCC en < 1%43. En cambio, si logramos aumentar en 10 veces el número de pacientes tratados por año, lograríamos una reducción para 2030 del 55% de la mortalidad por hepatopatías, del 55% de los casos de cirrosis descompensada y del 60% los casos de HCC43.
Este objetivo es muy ambicioso en vista de los resultados que tenemos hasta el momento. En nuestro país menos de un 0.5% de los pacientes con hepatitis crónica por HCV han sido tratados2. Estos resultados son similares en otros países de la región. Si bien en los países desarrollados la situación es mejor, dista de ser la ideal. En EE.UU. se calcula que solo el 50% de los pacientes han sido diagnosticados, de estos el 32 al 38% son derivados a especialistas para ser evaluados, y finalmente solo el 7 al 11% es tratado44. Según los datos del estudio NHANES, solo el 3.7% de los pacientes son diagnosticados por sospecha de enfermedad a partir de un factor de riesgo de infección por HCV45.
Estrategias para mejorar el acceso al diagnóstico y el tratamiento: rol de la atención primaria en salud y del especialista
Para poder reducir el impacto de la enfermedad es necesario establecer políticas que lleven a lograr un aumento en la detección de portadores del HCV, y que estos sean derivados para su adecuada evaluación y posterior tratamiento, como ha sucedido en el caso de la infección por HIV31. Hay varias acciones que pueden llevarse a cabo para lograr que esto suceda.
El primer paso es aumentar el número de pacientes diagnosticados, ya que se estima que en nuestro país menos del 20% de las personas potencialmente infectadas habrían sido diagnosticadas2. Esto puede lograrse de diversas maneras, pero la principal es establecer políticas claras de cribado, sencillas y que sean costo-efectivas. Por esto en EE.UU. se recomienda realizar el cribado en base al año de nacimiento, abarcando de esta manera a la mayoría de los pacientes, sin tener que identificar factores de riesgo individuales12-15. Otros países han tomado medidas similares; en Brasil, el Ministerio de Salud recomienda realizar el cribado de HCV a todos los mayores de 40-45 años46. Estudios realizados en nuestro país muestran que la mayoría de los pacientes infectados tienen entre 40 y 75 años43, 47. Estos resultados coinciden con los de Brasil, y probablemente sería conveniente testear a los mayores de 40-45 años, nacidos después de 1940. Realizarlo en base al año de nacimiento simplificaría mucho la realización del mismo y permitiría aumentar el número de pacientes diagnosticados sin sobrecargar al equipo médico. En el resto de los pacientes, deberá realizarse en base a los factores de riesgo antes mencionados.
Lo segundo es lograr el acceso del paciente diagnosticado al cuidado por un especialista capacitado en el manejo de la enfermedad hepática asociada al HCV. Una vez detectado el anti-HCV y teniendo la confirmación de la infección a través de la detección del ARN de HCV, el paciente debería ser evaluado por un especialista. Este determinará la gravedad de la enfermedad hepática y la necesidad de tratamiento. Este es el paso limitante en la atención de estos pacientes. Es fundamental la información brindada por el médico que realiza el diagnóstico al paciente en cuanto a su enfermedad, su pronóstico y sus posibilidades terapéuticas. Como vimos, entre < 1 y 10% de los pacientes diagnosticados acceden a ser tratados. En un programa realizado en 5 centros de EE.UU. a través de un seguimiento con asistentes médicos, enfermeras y una historia clínica electrónica, se consiguió que el 90% de los pacientes conociera el diagnóstico por parte del médico de atención primaria, que el 78% fuera derivado y que el 62% fuera atendido por un especialista48.
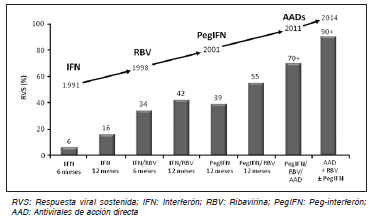
Fig. 3. Evolución del tratamiento HCV
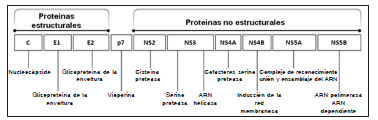
Fig. 4. Estructura molecular del HCV, sitios de acción de los AAD
En muchos lugares de nuestro país faltan especialistas capacitados en el manejo de la enfermedad hepática, dificultando el acceso de los pacientes a la atención médica. Esto puede solucionarse derivando al paciente a otro lugar para la atención o capacitando nuevos especialistas. También puede solucionarse más fácil y rápido a través de programas de telemedicina, para lograr una supervisión del especialista al médico de atención primaria en la asistencia de los pacientes con HCV. Este modelo conocido como proyecto ECHO (Extension for Community Healthcare Outcomes) desarrollado por la Universidad de Nuevo México en EE.UU. ha sido implementado en muchos países con muy buenos resultados49-51, y está siendo implementado en nuestro país para facilitar la atención en zonas que no cuentan con especialistas.
En tercer lugar, es fundamental la educación, no solo de los médicos de atención primaria sino también de la población en general. Deben realizarse campañas públicas de concientización, que estimulen la prevención, la detección temprana de la enfermedad y la asistencia a los centros de salud para realizar las pruebas correspondientes.
Y por último, debemos lograr que el paciente diagnosticado y evaluado acceda al tratamiento. Hoy en día el tratamiento se basa principalmente en antivirales por vía oral libres de peg-IFN. Estos tratamientos son muy efectivos y seguros pero con un costo mayor que los usados anteriormente. Además, como se pueden aplicar en casi todos los pacientes, se va a incrementar el número de pacientes tratados. Inicialmente, con algunos de estos tratamientos disponibles en nuestro país, se deberá priorizar a los pacientes con mayor riesgo de complicaciones de su enfermedad hepática52. En una situación ideal, todos los enfermos en algún momento deberían recibir tratamiento antiviral. Es probable, que a medida que se traten los más comprometidos, pueda acceder al tratamiento una mayor proporción de casos menos graves. Además, con la llegada de nuevos antivirales al país, podrían disminuir los precios, lo que facilitaría el acceso al tratamiento de un mayor número de casos.
En conclusión, la enfermedad hepática por HCV ha pasado a ser una de las enfermedades con mayor avance en su terapéutica en el mundo. Actualmente, el principal desafío no es su tratamiento, sino su diagnóstico y el acceso de los enfermos a un cuidado adecuado. Para esto, el rol de los médicos de atención primaria es fundamental. Ellos son los que deben sospechar la infección, diagnosticarla y complementar su atención con la derivación al especialista. Hay varias guías de cribado, diagnóstico y evaluación clínica que facilitan el manejo de estos pacientes. El trabajo conjunto mejorará el manejo de los recursos disponibles, permitiendo que cada vez más personas infectadas con el HCV sean diagnosticadas y tratadas adecuadamente.
1. Mohd Hanafiah K, Groeger J, Flaxman AD, Wiersma ST. Global epidemiology of hepatitis C virus infection: New estimates of age specific antibody to HCV seroprevalence. Hepatology 2013; 57: 1333-42. [ Links ]
2. Kershenobich D, Razavi HA, Sánchez-Avila JF, et al. Trends and projections of hepatitis C virus epidemiology in Latin America. Liver Int 2011; 31 (Suppl 2): 18-29. [ Links ]
3. Szabo SM, Bibby M, Yuan Y, et al. The epidemiologic burden of hepatitis C virus infection in Latin America. Ann Hepatol 2012; 11: 623-35. [ Links ]
4. Reggiardo MV, Tanno F, Mendizabal M, Galdame O. Consenso Argentino de Hepatitis C 2013. Acta Gastroenterol Latinoam 2014; 44: 154-73. [ Links ]
5. Hajarizadeh B, Grebely J, Dore GJ. Epidemiology and natural history of HCV infection. Nat Rev Gastroenterol Hepatol 2013; 10: 553–62.
6. Zaltron S, Spinetti A, Biasi L, et al. Chronic HCV infection: Epidemiological and clinical relevance. BMC Infect Dis 2012; 12 (Suppl 2): S2. [ Links ]
7. Perz JF, Armstrong GL, Farrington LA, et al. The contributions of hepatitis B virus and hepatitis C virus infections to cirrhosis and primary liver cancer worldwide. J Hepatol 2006; 45: 529-38. [ Links ]
8. Hatzakis A, Chulanov VP, Gadano AC, et al. The present and future disease burden of hepatitis C virus (HCV) with today’s treatment paradigm. J Viral Hepat 2015; 22 (Suppl 1): 26-45.
9. Bezemer G, Van Gool AR, Verheij-Hart E, et al, and the DITTO-HCV Study Group. Long-term effects of treatment and response in patients with chronic hepatitis C on quality of life. An international, multicenter, randomized, controlled study. BMC Gastroenterol 2012; 12: 11. [ Links ]
10. Asselah T, Boyer N, Saadoun D, et al. Direct-acting antivirals for the treatment of hepatitis C virus infection: optimizing current IFN-free treatment and future perspectives. Liver Int 2016; 36 (Suppl 1): 47-57. [ Links ]
11. U.S. Preventive Services Task Force. Information for Health Professionals. En: http://www.uspreventiveservicestaskforce.org/Page/Name/tools-and-resources-for-better-preventive-care; consultado el 20/13/2016. [ Links ]
12. Ward JW. The epidemiology of chronic hepatitis C and one-time hepatitis C virus testing of persons born during 1945 to 1965 in the United States. Clin Liver Dis 2013; 17: 1-11. [ Links ]
13. Moyer VA; USPSTF. Screening for hepatitis C virus infection in adults: U.S. Preventive Services Task Force recommendation statement. Ann Intern Med 2013; 159: 349-57. [ Links ]
14. Smith BD, Morgan RL, Beckett GA, et al. Recommendations for the identification of chronic hepatitis C virus infection among persons born during 1945-1965. MMWR Recomm Rep 2012; 61: 1-32. [ Links ]
15. AASLD/IDSA HCV Guidance Panel. Hepatitis C guidance: AASLD-IDSA recommendations for testing, managing, and treating adults infected with hepatitis C virus. Hepatology 2015; 62: 932-54. [ Links ]
16. European Association for Study of Liver. EASL Recommendations on Treatment of Hepatitis C 2015. J Hepatol 2015; 63: 199-236. [ Links ]
17. Alter MJ, Kuhnert WL, Finelli L. Guidelines for laboratory testing and result reporting of antibody to hepatitis C virus. Centers for Disease Control and Prevention. MMWR Recomm Rep 2003; 52: 1-16. [ Links ]
18. Hepatitis Virales de Argentina - Ministerio de Salud de la Nación. En: http://www.msal.gob.ar/sida/images/stories/4-publicaciones/pdf/2014-09_estado-de-las-artes-hepatitis-argentina.pdf; consultado el 20/3/2016. [ Links ]
19. Prevalencia de hepatitis virales y sífilis en personas que se realizan estudios prenupciales en Argentina. En: http://publicaciones.ops.org.ar/publicaciones/prev_control_enfermedades/PrenupcialHepatitsSifilis.pdf; consultado el 20/3/2016. [ Links ]
20. Fassio E, Schroder T; Asociación Argentina para el Estudio de las Enfermedades del Hígado. Conclusiones del Consenso Argentino Hepatitis C 2007. Acta Gastroenterol Latinoam 2008; 38: 56-74. [ Links ]
21. Mengarelli S, Correa G, Farias A, et al. ¿Por qué el virus C en Cruz del Eje? Congreso Argentino de Gastroenterología 2006, Buenos Aires, Argentina. [ Links ]
22. Mengarelli S, Kohn J, Coorea G, et al. Circulación del virus C en la provincia de Córdoba. Congreso Argentino de Gastroenterología 2006, Buenos Aires, Argentina. [ Links ]
23. Ramadan A, Rossi L, Lura G, et al. Prevalencia de Infección por HCV en Rufino, Santa Fe. Congreso Argentino de Hepatología 2006, Buenos Aires, Argentina.
24. Picchio GR, Bare PC, Descalzi V, et al. High prevalence of infection with a single hepatitis C virus genotype in a small rural community of Argentina. Liver Int 2006; 26: 660-5. [ Links ]
25. Golemba MD, Di Lello FA, Bessone F, et al. High prevalence of hepatitis C virus genotype 1b infection in a small town of Argentina. Phylogenetic and Bayesian coalescent analysis. PLoS One 2010; 5: e8751. [ Links ]
26. O´Flaherty M, Frontera Vaca M, Camino A, et al. La prevalencia de la infección por el virus de la hepatitis c y el impacto de las prácticas parenterales no seguras en la atención de la salud. Acta Gastroenterol Latinoam 2005; 35: PO8545. [ Links ]
27. Fay O, González J, Rey J. Hemodonantes y población general. Acta Gastroenterol Latinoam 2005; 35: S11-2. [ Links ]
28. Fainboim H, Tadey L, Dirchwolf M, et al. Primer estudio en la población de Buenos Aires de prevalencia de virus B, virus C y esteatosis hepática no alcohólica. Acta Gastroenterol Latinoam 2013; 43: s9. [ Links ]
29. Fassio E, Schroder T, y la Asociación Argentina para el Estudio de las Enfermedades del Hígado. Conclusiones del Consenso Argentino Hepatitis C 2007. Acta Gastroenterol Latinoam 2008; 38: 56-74. [ Links ]
30. Fay F, Prieto B, Linpozzi R, et al. Prevalencia de marcadores de HCV y HBV en aspirantes a servicio militar voluntario de la provincia de santa fe concurrentes al comando del segundo cuerpo de ejército argentino con asiento en Rosario. Acta Gastroenterol Latinoam 2005; 35: P8544. [ Links ]
31. Saraswat V, Norris S, de Knegt RJ, et al. Historical epidemiology of hepatitis C virus (HCV) in select countries – volume 2. J Viral Hepat 2015; 22: 6-25.
32. Ly KN, Xing J, Klevens RM, et al. The increasing burden of mortality from viral hepatitis in the United States between 1999 and 2007. Ann Intern Med 2012; 156: 271-8. [ Links ]
33. Davis GL, Alter MJ, El-Serag H, et al. Aging of hepatitis C virus (HCV)-infected persons in the United States: a multiple cohort model of HCV prevalence and disease progression. Gastroenterology 2010; 138: 513-21. [ Links ]
34. Wedemeyer H, Duberg AS, Buti M, et al. Strategies to manage hepatitis C virus (HCV) disease burden. J Viral Hepat 2014; 21 (Suppl 1): 60-89. [ Links ]
35. Gane E, Kershenobich D, Seguin-Devaux C, et al. Strategies to manage hepatitis C virus (HCV) infection disease burden - volume 2. J Viral Hepat 2015; 22 (Suppl 1): 46-73. [ Links ]
36. Alfaleh FZ, Nugrahini N, Matičič M, et al. Strategies to manage hepatitis C virus infection disease burden - volume 3. J Viral Hepat 2015; 22 (Suppl 4): 42-65. [ Links ]
37. Ridruejo E, Daruich JR, Estes C, et al. Hepatitis C Virus (HCV) Infection in Argentina: Burden of Chronic Disease. Hepatology 2014; 60 (Suppl 1): 928A. [ Links ]
38. Simmonds P. Genetic diversity and evolution of hepatitis C virus-15 years on. J Gen Virol 2004; 85: 3173-88. [ Links ]
39. Messina JP, Humphreys I, Flaxman A, et al. Global distribution and prevalence of hepatitis C virus genotypes. Hepatology 2015; 61: 77-87. [ Links ]
40. Manns MP, Foster GR, Rockstroh JK, et al. The way forward in HCV treatment —finding the right path. Nat Rev Drug Discov 2007; 6: 991-1000.
41. Ridruejo E, Galdame O. AAEEH: Actualización de las Recomendaciones para el Tratamiento de la Hepatitis Crónica por Virus C. En: http://www.aaeeh.org.ar/neweb/profesionales_guia_tratamiento_hepatitis_c_cronica.php; consultado el 20/3/2016. [ Links ]
42. van der Meer AJ, Veldt BJ, Feld JJ, et al. Association between sustained virological response and all-cause mortality among patients with chronic hepatitis C and advanced hepatic fibrosis. JAMA 2012; 308: 2584-93. [ Links ]
43. Ridruejo E, Bessone F, Daruich JR, et al. Hepatitis C Virus (HCV) Infection in Argentina: Burden of Chronic Disease. World J Hepatol 2016; 8: 649-58. [ Links ]
44. Asrani SK, Davis GL. Impact of birth cohort screening for hepatitis C. Curr Gastroenterol Rep 2014; 16: 381. [ Links ]
45. Denniston MM, Klevens RM, McQuillan GM, et al. Awareness of infection, knowledge of hepatitis C, and medical follow-up among individuals testing positive for hepatitis C: National Health and Nutrition Examination Survey 2001-2008. Hepatology 2012; 55: 1652-61. [ Links ]
46. Novo Protocolo para Hepatite C e coinfecções está em Consulta Pública. En: http://www.aids.gov.br/noticia/2015/novo-protocolo-para-hepatite-c-e-coinfeccoes-esta-em-consulta-publica; consultado el 20/3/2016 [ Links ]
47. Rey J, Castro M, Tomeo A, et al. ¿Se justificaría en nuestro medio el estudio del anti HCV a las personas nacidas entre 1945 y 1965? Acta Gastroenterol Latinoam 2013; 43: s22. [ Links ]
48. Coyle C, Viner K, Hughes E, et al. Identification and linkage to care of HCV-infected persons in five health centers - Philadelphia, Pennsylvania, 2012-2014. MMWR Morb Mortal Wkly Rep 2015; 64: 459-63. [ Links ]
49. Arora S, Thornton K, Murata G, et al. Outcomes of treatment for hepatitis C virus infection by primary care providers. N Engl J Med 2011; 364: 2199-207. [ Links ]
50. Scott JD, Unruh KT, Catlin MC, et al. Project ECHO: a model for complex, chronic care in the Pacific Northwest region of the United States. J Telemed Telecare 2012; 18: 481-4. [ Links ]
51. Mitruka K, Thornton K, Cusick S, et al. Expanding primary care capacity to treat hepatitis C virus infection through an evidence-based care model--Arizona and Utah, 2012-2014. MMWR Morb Mortal Wkly Rep 2014; 63: 393-8. [ Links ]
52. Ridruejo E, Galdame O. AAEEH: Actualización de las Recomendaciones para el Tratamiento de la Hepatitis Crónica por Virus C: Esquemas libres de Interferón: Indicaciones de Tratamiento. En: http://aaeeh.org.ar/neweb/docs/Actualizacion-Recomendaciones-Hep-Cronica-por-virus-C.pdf; consultado el 20/3/2016. [ Links ]














