Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Medicina (Buenos Aires)
Print version ISSN 0025-7680On-line version ISSN 1669-9106
Medicina (B. Aires) vol.77 no.1 Ciudad Autónoma de Buenos Aires Feb. 2017
ARTÍCULO ORIGINAL
Herpes zoster en adultos mayores en un hospital privado de la ciudad de Buenos Aires, junio 2013 - mayo 2014
Miriam Rozenek, Adriana Romani, Sandra Aronson, María Del Carmen Ramilo, Valeria Abellán, María Andrea Pérez, Luis Cámera
Sección Geriatría, Servicio de Clínica Médica, Hospital Italiano de Buenos Aires, Buenos Aires, Argentina
Dirección postal: Miriam Rozenek, Jufré 216, 1414 Buenos Aires, Argentina
e-mail: miriamrozenek@gmail.com
Recibido: 23-X-2015
Aceptado: 17-VIII-2016
Resumen
El herpes zoster (HZ) se produce por reactivación del virus varicela zoster. Sus principales factores de riesgo son edad avanzada y presencia de comorbilidades (diabetes, inmunodepresión). Existen escasos datos de HZ en Sudamérica, y especialmente en adultos mayores. Analizamos retrospectivamente las características epidemiológicas y clínicas de 340 pacientes mayores de 60 años atendidos por HZ, entre junio 2013 y mayo 2014. La edad promedio de consulta fue de 74 años (60-100), localización torácica 210 (62%); el 75% (255) de las consultas iniciales se realizaron en guardias. El 68%, 143, presentaron dolor y vesículas, y 4% (14) solo dolor al inicio; el dolor persistió luego de finalizar el episodio en el 41% (139) de los pacientes. El diagnóstico se realizó entre 1 y 3 días de iniciado el cuadro en el 53% (180). El promedio de consultas por episodio fue de 3.6 (1-24). Tratamiento antiviral se indicó en 91% (309) de los pacientes [en 49% (167) fue inadecuado en tiempo o dosis], y tratamiento para el dolor en el 66% (224) de los casos: drogas más usadas (solas o en combinación) AINES (43%, 146), pregabalina (30%, 102), opiáceos (24%, 82), y corticoides (12%, 41). Solo el 9% (31) presentó comorbilidades y el 27% (126) dolor post episodio (duración promedio: 138.7 días). El diagnóstico fue tardío, dificultando el uso correcto de antivirales. El dolor post episodio fue más frecuente que en la literatura consultada; sin embargo, son pocos los datos en este grupo etario.
Palabras clave: Herpes zoster; Adultos mayores; Neuralgia posherpética; Epidemiología.
Abstract
Herpes zoster in elderly adults in a community hospital in Buenos Aires. June 2013-May 2014
Herpes zoster (HZ) is caused by reactivation of the varicella zoster virus. Its main risk factor is increasing age and comorbidities. There are limited data on the characteristics of HZ in South America, especially in the elderly. We analyzed epidemiological and clinical characteristics of 340 patients over 60 years assisted for HZ, between June 2013 and May 2014. The average age was 74 years (60-100), 62% (210) had thoracic location; 75% (255) of the initial consultations were held in guards; 68% (143) had pain and vesicles, and 4% (14) only pain at baseline. Pain persisted after finishing the episode in 41% (139). The diagnosis was made between 1 and 3 days from the beginning of the episode in 53% (180 patients). Average number of visits per episode was 3.6 (1-24). Antiviral treatment was supplied to 91% (309); however it was inadequate in dose or time in 49.1% (167 cases). Pain treatment was indicated in 66% (224). Most frequently used drugs (alone or in combination) were non-steroidal painkillers (43%, 146), pregabalin (30%, 102), opiates (24%, 82), and steroids (12%, 41); 9% (31) presented comorbidities; 27% (126) experienced pain after the ending of the episode, with an average duration of 138.7 days. In general, diagnosis was done late, making it difficult to use antivirals correctly. The presence of pain was more frequent than reported in other publications, however there are few data in this age group.
Key words: Herpes zoster; Elderly; Post herpetic neuralgia; Epidemiology.
El herpes zoster (HZ) es la enfermedad causada por el virus varicela zoster (VVZ), cuya edad de presentación más frecuente es a partir de los 50 años.
El VVZ es un virus ADN bicatenario, que pertenece a la familia Herpesviridae, subfamilia Alphaherpesvirinae. Es uno de los más frecuentes en la especie humana, ubicuo, cuyo único reservorio es el hombre.
La primera infección que causa es la varicela, altamente contagiosa, febril, caracterizada por un exantema vesicular pruriginoso; se da predominantemente en niños con picos en invierno y primavera. La transmisión es a través de la vía respiratoria, y menos frecuentemente por contacto con vesículas infectadas. La tasa de infectividad media es del 75%, siendo máxima a las 24-48 horas antes del inicio del exantema y continuando los siguientes 3-4 días1-3.
El VVZ llega a distribuirse por todo el organismo. Más del 99% de los adultos mayores de 40 años en los EE.UU. son inmunes al VVZ4 ya que la varicela genera inmunidad de por vida, por lo que segundos episodios son raros, incluso en pacientes inmunocomprometidos5. Luego de la primoinfección, el VVZ puede reactivarse y producir así el HZ (vulgarmente conocido como culebrilla). Dicha reactivación se produce a partir del virus latente desde el ganglio anexo a la raíz dorsal. El virus inicia su replicación en el ganglio, produce destrucción neuronal, y desencadena una respuesta inmune tanto celular como humoral6. La respuesta inmune celular es clave en la protección de la enfermedad; cuando ésta declina resulta el escenario adecuado para el desarrollo del episodio. Es infrecuente la recurrencia de HZ, solo se produce entre el 1 y el 5% de los pacientes7, 8.
El episodio en sí mismo funciona estimulando la inmunidad celular, como si fuera un refuerzo natural que protege al paciente de nuevos episodios. Tanto la incidencia como la gravedad de los episodios aumentan con la edad9, 10.
Se calcula que el 20%-35% de las personas desarrollarán HZ durante su vida11, 12. Si bien no es una enfermedad de denuncia obligatoria, se calcula una incidencia de 1.5 a 4.0 casos por 1000 personas por año13 en base a datos generados sobre todo en EE.UU. y Europa, ya que los datos locales y de Latino América son escasos14.
La incidencia es mayor en mujeres, y aumenta con la edad. A los 20 años se calcula en 0.4 a 1.6%, mientras que a los 80 años aumenta de 4.5 a 11.0%. Alrededor del 3% de los pacientes requieren hospitalización15. La gravedad y complicaciones del HZ son más frecuentes en adultos mayores. Cerca del 60% de los casos de HZ ocurre en mayores de 60 años, y el 50% de los episodios de neuralgia post herpética se produce en adultos mayores16. En pacientes inmunocomprometidos la incidencia de HZ aumenta, especialmente en aquellos con tratamientos inmunosupresores, corticoides, onco-hematológicos, y que viven con HIV. En estos casos la incidencia puede ser 20 y hasta 100 veces superior a la de huéspedes normales, con mayores riesgos de complicaciones, diseminación, y compromiso visceral, como hepatitis, meningoencefalitis y neumonía17.
Las manifestaciones clínicas más frecuentes en pacientes inmunocompetentes son las vesículas, el dolor y las parestesias; estas últimas pueden aparecer varios días antes de las manifestaciones cutáneas. Puede haber otros signos y síntomas como fiebre, malestar general y adenopatías satélites. En la mayoría de los casos el diagnóstico es clínico, aunque a veces puede requerirse técnicas de detección de antígenos como la inmunofluorescencia, o la detección de ADN viral por PCR18.
La neuralgia post herpética (NPH) es consecuencia directa del daño producido por el VVZ sobre el nervio periférico y una de las complicaciones más frecuentes en los adultos mayores. Los distintos autores la definen como la persistencia del dolor más allá de 30, 60 y 90 días de la erupción; su duración puede variar desde meses hasta años e influye en la calidad de vida19. Según algunos autores el 20% de los pacientes presentan dolor a los 3 meses del inicio de los síntomas, y de éstos en el 15% persiste hasta 2 años después del exantema20-23. El manejo farmacológico de esta entidad es de eficacia variable y escasa respuesta en la mayoría de los casos.
Nuestro objetivo fue evaluar las características epidemiológicas y clínicas de HZ en los adultos mayores de 60 años, atendidos en nuestro hospital de junio 2013 a mayo 2014, la utilización de antivirales, dosis, intervalos inter dosis y duración de los tratamientos y la incidencia de complicaciones. Asimismo evaluamos la indicación y medicación analgésica utilizada.
Materiales y métodos
Se realizó un análisis retrospectivo de las historias clínicas de los adultos mayores de 60 años que consultaron por HZ en el Hospital Italiano de Buenos Aires entre el 1° de junio de 2013 y el 31 de mayo de 2014. De los 352 pacientes que consultaron, 340 fueron evaluables.
Se incluyó a todo paciente mayor de 60 años que hubiera consultado por HZ, la búsqueda de casos se realizó a través de la base de datos del Hospital. El diagnóstico de HZ fue clínico.
Los datos recolectados de la historia clínica fueron: filiación, comorbilidades y características clínicas del episodio (localización de las lesiones, consulta inicial, presencia o no de dolor, tratamientos indicados, dolor post episodio y duración del mismo).
Con respecto a los tratamientos indicados, se evaluó si éstos fueron adecuados e iniciados precozmente (dentro de las 72 h de iniciados los síntomas). Se definió tratamiento adecuado: aciclovir 800 mg 5 veces por día o valaciclovir 1 g 3 veces por día. El uso de aciclovir tópico no se consideró tratamiento adecuado 24, 25.
La NPH se definió como persistencia del dolor más allá de los 60 días del exantema. Se realizó un análisis estadístico para evaluar variables asociadas al desarrollo de NPH, las pruebas utilizadas fueron chi cuadrado y t-test. Se consideró significativa una p < 0.05.
El protocolo fue aprobado por el Comité de Ética de Protocolos de Investigación del Hospital Italiano de Buenos Aires.
Resultados
En el período analizado consultaron por HZ 352 de los 62 256 pacientes mayores de 60 años afiliados al Plan de Salud. Solo fueron evaluables 340 por falta de datos en las historias clínicas. La incidencia total fue de 5.5 cada 1000 pacientes, en la Tabla 1 se muestra discriminada por grupo etario. La mediana de edad fue de 74 años (60 - 100) y la relación varón / mujer de 1/3.
Tabla 1. Incidencia de herpes zoster estratificada por edades años 2013 / 2014

La localización fue torácica en 211 pacientes (62.1%), lumbar 48 (14.1%), cabeza y cuello 32 (9.4%), 25 en extremidades (7.4%), oftálmica en 20 (5.9%) y otras localizaciones (genital y diseminado) en 4 (1.1%).
El diagnóstico se realizó en consultorios de atención inmediata en el 79.1% de los casos (269), 14 pacientes fueron diagnosticados en consultas ulteriores. El retardo diagnóstico fue de 1 a 3 días en el 53% (179), hasta de 8 días en el 16% (56), entre 9 y 30 días en el 7% (23) y no se pudo recabar el dato en los restantes.
En el seguimiento consultaron en más de una oportunidad 161 (47%); el promedio de visitas por episodio fue de 3.6 (mediana 3.0), con un rango de 1 a 24 por episodio y por paciente. Los médicos más frecuentemente visitados fueron los de atención primaria, dermatólogos, oftalmólogos y especialistas en dolor.
En la primera consulta 250 pacientes presentaron dolor, ya sea solo o acompañado de vesículas (Fig.1); siguieron con dolor después de finalizado el episodio 138 (40.6%) y en 15 (4.4%) no figuraba el dato. Presentaron dolor post episodio (NPH) 92 pacientes (27.0%) con una duración promedio de 138.7 días (rango 60 días a 24 meses).

Fig. 1. Signos y síntomas en la primera consulta por herpes zoster (valores expresados en porcentajes sobre un total de 340 pacientes)
Trecientos diecinueve pacientes (93.8%) no presentaron ninguna condición que afectara su estado inmunológico. Los 21 pacientes restantes (6.2%) presentaban diabetes II: ocho; enfermedad oncológica activa: ocho; cuatro estaban en tratamiento inmunosupresor por enfermedad reumatológica o trasplante, y uno era HIV positivo.
Fueron medicados con antivirales 311 pacientes (91.5%); el más utilizado fue el aciclovir por vía oral en 292 (85.9%). Recibieron dosis adecuadas de antivirales 241 (70.9%) con una duración promedio de 8 días (7 a 21 días) (Fig. 2).

Fig. 2. Indicación de tratamiento antiviral en pacientes que consultaron por herpes zoster (valores expresados en porcentajes sobre un total de 340 pacientes)
Cabe destacar que 27 (7.9%) pacientes recibieron también algún tipo de tratamiento alternativo como tinta china local u otros. La sobreinfección ocurrió en 10 pacientes (3%) y fue tratada con cremas antibióticas locales. En el 10% (34) de los casos se utilizó la combinación de tratamiento antiviral oral con local.
En la consulta inicial 216 (63.5%) pacientes recibieron tratamiento analgésico y otros 24 (0.7%) en consultas posteriores; la variable tratamiento analgésico no pudo recabarse en el resto de las historias clínicas. Las drogas más usadas fueron los analgésicos no esteroides (AINES) seguidas de pregabalina/gabapentina, opiáceos y corticoides.
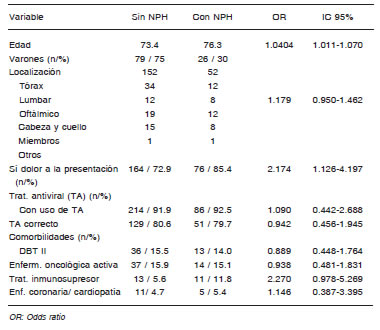
El hecho de haber instaurado tratamiento para el dolor y la elección del fármaco no tuvieron relación estadísticamente significativa con la presencia de NPH (Tabla 2).
Tabla 2. Comparación entre población con NPH y sin NPH en 340 casos (t-test)

Discusión
Los datos obtenidos de este análisis resultan similares en incidencia, características clínicas y epidemiológicas a los de la literatura internacional. Hubo significativamente más casos en mujeres, coincidiendo con publicaciones anteriores25. La mayor incidencia y prevalencia de HZ en mujeres podría interpretarse asociada a la mayor expectativa de vida, y también a la mayor demanda de atención de la población femenina de todas las edades26, 27.
Esta población fue analizada desde la perspectiva de la atención primaria. El principal factor asociado al desarrollo de HZ fue la edad, Tabla 1; solo 21 pacientes (6.2%) presentaban otros factores de riesgo.
El 75% (255) de los pacientes consultaron inicialmente a la guardia donde recibieron diagnóstico y tratamiento inicial, tanto antiviral como analgésico. El 39% (11.4%) de los pacientes consultaron más allá de los 3 días de iniciado el cuadro, motivo por el cual no fueron pasibles de tratamiento antiviral adecuado; sin embargo, no se encontró relación estadísticamente significativa entre tratamiento antiviral precoz o tardío, ni adecuado o inadecuado en relación con la aparición de NPH, a diferencia de lo que figura en la literatura. El diseño retrospectivo pudo haber sido una limitante para documentar adecuadamente estas variables.
De los 250 (73.5%) pacientes que tuvieron dolor en la consulta inicial, 216 (86.4%) recibieron tratamiento analgésico de inicio y 34 (13.6%) en consultas ulteriores. De los 90 (26.5%) pacientes restantes 26 (7.6%) no recibieron tratamiento para el dolor, mientras que en 64 historias (18.8%) no figuraba el dato (Fig. 3).

Fig. 3. Indicación de analgésicos al inicio del tratamiento (expresado en número de pacientes)
Tanto al inicio como en el caso de que se agregara tratamiento en consultas posteriores, los fármacos más usados fueron los analgésicos no esteroides (AINES) (Fig. 4).
El hecho de haber instaurado tratamiento para el dolor y qué droga se usó no tuvo relación estadísticamente significativa con la presencia de NPH como se observa en la Tabla 2. En el análisis univariado fueron la edad (p: 0.0058) y la inmunosupresión por drogas (p: 0.051) los factores asociados; en el análisis multivariado (Tabla 3), se asociaron la edad, la presencia de dolor al inicio, y el tratamiento inmunosupresor. No observamos relación estadísticamente significativa entre la presencia y tipo de tratamiento antiviral (p: 0.873) y NPH. En nuestra población el dolor agudo y NPH fueron más frecuentes que lo reportado en la literatura, lo que interpretamos asociado al grupo etario evaluado28, 29.
Tabla 3. Análisis multivariado de factores asociadas a NPH en 340 casos
El HZ no es de denuncia obligatoria, por lo tanto es posible que haya subreporte de casos; además, podría haber dificultad en la recolección de datos ya que se trata de un estudio retrospectivo, y existir variables confundidoras a la hora del análisis de la NPH como por ejemplo la cantidad de analgésicos y su relación con la intensidad del dolor y no con su persistencia.
El tratamiento precoz en las primeras 72 h protege contra el desarrollo de NPH, sin embargo un alto porcentaje de nuestros pacientes consultaron tardíamente perdiéndose así la posibilidad de un tratamiento antiviral adecuado en tiempo y forma. Destacamos el gran porcentaje de tratamientos antivirales incorrectos en dosis, intervalo o duración. Por todo esto queremos destacar la importancia de alertar y educar a los médicos de atención primaria sobre el HZ para realizar un correcto y precoz diagnóstico y tratamiento.
Al momento del estudio no estaba disponible en Argentina la vacuna atenuada de HZ, razón por la cual no se pudo diferenciar pacientes inmunizados de aquellos que no hubieran recibido la vacuna30, 31.
Son necesario estudios prospectivos para poder interpretar mejor nuestra realidad local en relación a esta patología.
Agradecimientos: Agradecemos a la Dra. Claudia Alonzo por la corrección de este manuscrito.
Conflicto de intereses: Ninguno para declarar
1. Cohen JI, Brunell PA, Strauss SE, Krause PR. Recent advances in varicella-zoster virus infection. Ann Intern Med 1999; 130: 922-32. [ Links ]
2. Liesegang T. Varicella zoster viral disease. Mayo Clin Proc 1999; 74: 983- 99. [ Links ]
3. Oxman M. Zoster vaccine: Current status and future prospects. Clin Infect Dis 2010; 51: 197-213. [ Links ]
4. Kilgore PE, Kruszon Moran D, Seward JF, et al. Varicella in americans from NHANES III; implications for control through routine immunization. J Med Vir 2003; 70 (Suppl 1): 111-8. [ Links ]
5. Gershon AA, Steinberg SP, Gelb L. Clinical reinfection with varicela zoster virus. J Infect Dis 1984; 149: 241-54. [ Links ]
6. Whitley RJ. Varicella Zoster virus. Chap 137. En: Mandell, Douglas, and Beneth, Principles and practice of Infectious Diseases. 7th ed. Philadelphia: Mosby, 2010. [ Links ]
7. Levin M, Murray M, Rotbart H, et al. Immune response of elderly individuals to a live attenuated varicela vaccine. J Infect Dis 1992; 166: 253-9. [ Links ]
8. Yawn B, Wollan P, Kurland M. Herpes Zoster recurrences more frequent than previously reported. Mayo Clin Proc 2011; 86: 88-93. [ Links ]
9. Levin M, Barber D, Goldblat E, et al. Use of live attenuated varicela vaccine to boost varicela specific immune responses in seropositive people 55 years of age and older: duration of boosted effect. J Infect Dis 1998; (Suppl 1): 109-12. [ Links ]
10. Trannoy E, Berger R, Hollander G, et al. Vaccination in immunocompetent elderly subjects with a live attenuated Oka strain of varicela zoster virus: a randomized controlled dose response trial. Vaccine 2000; 18: 1700-6. [ Links ]
11. Brisson M, Edmunds WJ, Law B, et al. Epidemiology of varicela zoster virus infection in Canada and the United Kingdom. Epidemiol Infect 2001; 127: 305-14. [ Links ]
12. Boletín informativo. Comisión vacunas. Buenos Aires: Sociedad Argentina de Infectología; 2015. En: www.sadi.org.ar. [ Links ]
13. Kimberlin D, Whitley R. Varicella zoster vaccine for the prevention of herpes zoster. N Engl J Med 2007; 356:1338-43. [ Links ]
14. Vujacich C, Poggi E, Cecchini D, Luchetti P, Stamboulian D. Herpes zoster epidemiologia y clínica. Medicina (B Aires) 2008; 68: 125-8. [ Links ]
15. Cohen J. Herpes zoster. N Engl J Med 2013; 369: 255-63. [ Links ]
16. Katz J, Cooper E; Walther R, Sweeney E, Dworkin R. Acute pain in herpes zoster and its impact on health related quality of life. Clin Infect Dis 2004; 39: 342-8. [ Links ]
17. Schmader K. Epidemiology and impact on quality of life of postherpetic neuralgia and painful diabetic neuropathy. Clin J Pain 2002; 18: 350-4. [ Links ]
18. Balfour H. Varicella zoster virus infections in immunocompromised hosts. A review of natural history and management. Am J Med 1998; 85: 68-73. [ Links ]
19. Gnann J, Whitley R. Herpes zoster. N Engl J Med 2002; 345; 340-6. [ Links ]
20. Johnson R, Rice A. Postherpetic neuralgia. N Engl J Med 2014; 371: 1526-33. [ Links ]
21. Van Wijck A, Opstelten W, Moons K, et al. The Pine Study of epidural steroids and local anaesthetics to prevent post herpetic neuralgia: a randomised controlled trial. Lancet 2006; 367: 219-24. [ Links ]
22. Sampathkumar P, Drage L, Martin D. Herpes zoster (shingles) and postherpetic neuralgia. Concise review for clinicians. Mayo Clin Proc 2009; 84: 274-80. [ Links ]
23. Duracinsky M, Paccalin M, Gavazzi G, et al. Arizona study. Is the risk of post herpetic neuralgia and its burden increased in the most elderly patients?. BMC Infectious Diseases 2014; 14: 529. En: http://www.biomedcentral.com/1471-2334/14/529. [ Links ]
24. Dworkin R, Johnson R, Breuer J, et al. Recommendations for the management of Herpes Zoster. Clin Infect Dis 2007; 44: (Suppl 1): 1-26. [ Links ]
25. Wood M, Kay R, Dworkin R, Soong J, Whitley R. Oral acyclovir therapy accelerates pain resolution in patients with herpes zoster: A meta-analysis of placebo-controlled trials. Clin Infect Dis 1996; 22: 341-7. [ Links ]
26. Yawn B, Wollan P, Kurland M, St. Sauver J, Saddier P. A population based study of the incidence and complication rates of herpes zoster before zoster vaccine introduction [published correction in Mayo Clin Proc 2008; 83: 255]. Mayo Clin Proc 2007; 82: 1341-9. [ Links ]
27. Insinga R, Itzler R, Pellissier J, Saddier P, Nikas A. The incidence of herpes zoster in a United States administrative database. J Gen Intern Med 2005; 20: 748-53. [ Links ]
28. Wareham D, Breuer J. Herpes zoster. BMJ 2007; 334: 1211-5. [ Links ]
29. Katz J, Cooper E, Walther R, Sweeney E, Dworkin R. Acute pain in herpes zoster and its impact on health related quality of life. Clin Infect Dis 2004; 39: 342- 8. [ Links ]
30. Oxman M, Levin M, Johnson G, et al. A vaccine to prevent herpes zoster and postherpetic neuralgia in older adults. N Engl J Med 2005; 352: 227-84. [ Links ]
31. Schmader K, Johnson G, Saddier P, et al. Efect of zoster vaccine on herpes zoster related inteference with funtional status and health related quality of life measures in older adults. JA Ger Soc 2010; 58: 1634-41. [ Links ]














