Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) vol.77 no.2 Ciudad Autónoma de Buenos Aires abr. 2017
ARTÍCULO ESPECIAL
Recomendaciones para la prevención de infecciones asociadas a artoplastia electiva en adultos
Juan Carlos Chuluyán1*, Andrea Vila2*, Ana Laura Chattás3*, Marcelo Montero3*, Claudia Pensotti4*+, Claudia Tosello5*, Marisa Sánchez6*, Cecilia Vera Ocampo7*, Guillermina Kremer8*, Rodolfo Quirós8*, Guillermo A. Benchetrit9*, Carolina Fernanda Pérez10*, Ana Laura Terusi11*, Francisco Nacinovich12*
1Grupo de Trabajo Infectología, Hospital General de Agudos Dr. T. Álvarez,
2Servicio de Infectología, Hospital Italiano de Mendoza,
3Hospital General de Agudos Dr. Pirovano,
4Clínica Monte Grande,
5Hospital de Clínicas José de San Martín, UBA,
6Hospital Italiano de Buenos Aires,
7Sanatorio Dupuytren,
8Hospital Universitario Austral,
9Instituto de Investigaciones Médicas A. Lanari, UBA,
10Policlínico del Docente-Centro Médico Huésped,
11Instituto César Milstein,
12Instituto Cardiovascular de Buenos Aires, Centros Médicos Dr. Stamboulian, Argentina
*En representación del grupo de trabajo en infecciones osteoarticulares de la Sociedad Argentina de Infectología
+In memoriam
Dirección postal: Juan Carlos Chuluyan, Grupo de Trabajo Infectología, Hospital General de Agudos Dr. T. Álvarez, J. F. Aranguren 2701, 1406 Buenos Aires, Argentina
e-mail: jcchulu@gmail.com
Recibido: 16-VIII-2016
Aceptado: 29-XI-2016
Resumen
Las infecciones del sitio quirúrgico que complican las cirugías ortopédicas con implante prolongan la estadía hospitalaria y aumentan tanto el riesgo de readmisión como el costo de la internación y la mortalidad. Las presentes recomendaciones están dirigidas a: (i) optimizar el cumplimiento de normas y la incorporación de hábitos en cada una de las fases de la cirugía, detectando factores de riesgo para infecciones del sitio quirúrgico potencialmente corregibles o modificables; y (ii) adecuar la profilaxis antibiótica preoperatoria y el cuidado intra y postoperatorio.
Palabras clave: Prevención; Infección; Artroplastia electiva.
Abstract
Recommendations for prevention of surgical site infections in adult elective arthroplasty
Surgical site infections complicating orthopedic implant surgeries prolong hospital stay and increase risk of readmission, hospitalization costs and mortality. These recommendations are aimed at: (i) optimizing compliance and incorporating habits in all surgery phases by detecting risk factors for surgical site infections which are potentially correctable or modifiable; and (ii) optimizing preoperative antibiotic prophylaxis as well as intraoperative and postoperative care.
Key words: Prevention; Infection; Elective arthroplasty.
Para las presentes recomendaciones se realizó una revisión sistemática y discusión de la literatura, evaluando la fuerza de la recomendación acorde a lo realizado por otras sociedades científicas1.
El presente documento no incluye recomendaciones respecto de manejo de materiales de ortopedia, desinfección de alto nivel y controles de material esterilizado, porque estos temas exceden su alcance. Tampoco se incluye higiene quirúrgica de manos porque fue recientemente revisada en el Consenso Inter-institucional (2015) “Actualización sobre Medidas de Prevención de Infecciones de Sitio Quirúrgico” (www.sadi.org.ar)2.
Si bien las presentes sugerencias son aplicables a todas las cirugías osteoarticulares con colocación de implantes, es oportuno destacar que en algunas situaciones, como la colocación de osteosíntesis luego de fractura expuesta, se requieren consideraciones especiales que no han sido contempladas en este documento. Por otra parte, cada institución deberá adaptar las presentes sugerencias a su realidad económica y posibilidades de funcionamiento.
Anualmente se implantan en el mundo más de un millón de prótesis articulares y más de 500 000 elementos de fijación2. Actualmente se dispone de prótesis para muñeca, codo, hombro, tobillo, rodilla y cadera3-5.
Las infecciones de sitio quirúrgico (ISQ) se definen como aquellas que ocurren en el sitio de incisión o su contigüidad dentro de los 30 días de la cirugía, o dentro del primer año cuando se ha colocado un implante y la infección parece estar relacionada con la cirugía6. Las ISQ que complican cirugías ortopédicas con implante prolongan la estadía hospitalaria, aumentan 5 veces el riesgo de readmisión, triplican el costo de la internación y duplican la mortalidad3, 7-9. El riesgo de infección protésica es mayor en rodilla (1-2%) que en cadera (0.3-1.3%).
Las presentes recomendaciones invitan al cumplimiento de normas e incorporación de hábitos en cada una de las fases de la cirugía.
Fase preoperatoria
Se recomienda la evaluación infectológica rutinaria de todo paciente en plan de cirugía limpia con colocación de implante ortopédico con el objeto de detectar factores de riesgo para ISQ potencialmente corregibles o modificables, infecciones ocultas, colonización por Staphylococcus aureus, y adecuar la profilaxis preoperatoria. La evaluación debe ser realizada al menos 14 días antes del procedimiento, de modo de contar con el tiempo necesario principalmente para el control de infecciones activas (A-III)3.
Factores de riesgo para desarrollar ISQ post-artroplastia electiva
Si bien es necesario retrasar la artroplastia en algunos pacientes con alto riesgo de ISQ, no hay evidencia suficiente respecto del umbral exacto para tomar esta decisión. Se debe balancear el dolor y la incapacidad con el riesgo de desarrollar infección10, 11, 12-15. Algunas instituciones han desarrollado sistemas de puntuación para mejorar la toma de decisión y justificar lo más objetivamente posible el retraso de la cirugía; tal es el caso del índice de riesgo de desarrollo de ISQ propuesto por Berbari y col., que demuestra buena capacidad predictiva16, 17. Este incluye los siguientes factores que contribuyen al riesgo de infección:
• el índice de masa corporal (IMC)
• el antecedente de cirugía previa sobre la articulación
• la presencia de inmunosupresión
• la puntuación ASA (American Society of Anesthesiologists)*
• la duración del procedimiento.
*(ASA physical status classification system: Last approved by the ASA House of Delegates on October 15, 2014. https://www.asahq.org/resources/clinical-information/asa-physical-status-classification-system)
Infección activa en la articulación o tejidos locales
Se asocia a significativo aumento de ISQ. Se debe demorar la artroplastia electiva hasta completar el tratamiento de la infección y confirmar su erradicación (A-III)5,18.
Focos infecciosos a distancia
Las bacteriemias intraoperatorias originadas en focos distantes pueden colonizar el material protésico y desarrollar ISQ. Las infecciones locales o sistémicas deben ser identificadas y tratadas y la cirugía se debe posponer, si es posible, hasta la completa resolución de las mismas (A-II)5. Si esto no es posible, la profilaxis con antibióticos (ATB) se debe adecuar a las bacterias presentes en el foco clínico2, 3. En estas situaciones se recomienda iniciar el tratamiento antes de la cirugía y continuarlo en el postoperatorio el tiempo necesario3.
Antecedente de artritis infecciosa en la articulación a operar
Se debe descartar artritis séptica previa en pacientes con indicación de artroplastia (A-III) solicitando hemograma, velocidad de sedimentación globular, proteína C reactiva cuantitativa y examen bacteriológico de muestra de punción articular (A-III)18, así como de muestras tisulares obtenidas durante la artroplastia. Dado que no existen elementos que permitan aseverar categóricamente la erradicación de infección, el ATB pre-quirúrgico debería cubrir el microorganismo causante de la infección previa (C-III).
Si se utiliza cemento para fijar la prótesis, se sugiere el uso de cemento cargado con ATB (CCA) acorde a la documentación microbiológica previa (A-III). En caso de que los cultivos tomados durante la cirugía resultaren positivos el paciente deberá recibir tratamiento acorde a antibiograma.
Edad
Las infecciones protésicas tienen distribución bimodal, presentando mayores tasas de ISQ en grupos menores de 55 y mayores de 74 años de edad18.
Cirugía o irradiación previa en el sitio quirúrgico
El entorno de la herida y los tejidos pueden estar comprometidos en pacientes con procedimientos quirúrgicos previos en la articulación afectada, lo que contribuiría al desarrollo de ISQ luego de una artroplastia5, 19. Asimismo, la irradiación previa en el sitio quirúrgico aumentaría el riesgo de ISQ debido a isquemia y daño tisular crónico local20.
Malnutrición
Se asocia a retraso en la cicatrización de heridas, prolongación tanto de la internación como del tiempo quirúrgico
y aumento de la susceptibilidad a las infecciones. Debe investigarse el estatus nutricional mediante determinación de albúmina, transferrina, linfocitos totales y prealbúmina5. Se sugiere optimizar el estado nutricional en el preoperatorio con supervisión de especialista (B-III) y minimizar el tiempo de restricción de ingesta oral en el postoperatorio21.
Consumo de alcohol y drogas intravenosas
El consumo excesivo de alcohol aumenta el riesgo de ISQ en artroplastia17, probablemente como consecuencia de malnutrición proteica e inmunosupresión de origen multifactorial. En pacientes alcohólicos la inmunocompetencia se recupera a las 2-6 semanas de la cesación de la ingesta, mientras que la capacidad de curación de heridas se normaliza a las 3-4 semanas. Se debe recomendar el cese de ingesta al menos 4 semanas antes de la cirugía para revertir las anormalidades asociadas con su consumo excesivo (B-III)3, 5, 22.
Los pacientes adictos a drogas intravenosas sometidos a artroplastia electiva tienen riesgo hasta cerca de 30% mayor de ISQ que la población general23.
Enfermedad hepática activa
La enfermedad hepática activa, sintomática o asintomática, se asocia a mayor riesgo de complicaciones postoperatorias incluyendo ISQ post-artroplastia23. Se sugiere solicitar serología para hepatitis C en artroplastia electiva debido a que tienen un riesgo 30% mayor de cualquier complicación postoperatoria que la población general (A-II)3, 24.
Insuficiencia renal crónica
Los pacientes en hemodiálisis y aquellos con trasplante renal presentan riesgo elevado de ISQ5, 25, por lo que se recomienda especial adherencia a las medidas preventivas. Se recomienda evaluar cuidadosamente la indicación de artroplastia en pacientes en hemodiálisis por su elevada morbimortalidad (B-III).
Se sugiere, en lo posible, evitar el uso de drogas nefrotóxicas como gentamicina y vancomicina3, 22.
Hiperglucemia y diabetes
Se asocian a mayor riesgo de complicaciones, particularmente infecciosas, debido al deterioro de la inmunidad tanto humoral como celular2, 5. 22, 26, 27. El control agresivo de la glucemia con bomba de infusión restaura la función de los neutrófilos in vivo28. La hiperglucemia (> 180 mg%) perioperatoria, independientemente de la presencia de diabetes, es un factor de riesgo para ISQ en artroplastia2, 5, 27, 28-30. Se sugiere mantener niveles adecuados de glucemia durante todo el período perioperatorio independientemente del antecedente de diabetes (A-II). Aunque no está claramente establecido el momento de inicio y finalización de la bomba de infusión de insulina en los individuos que la requieren, una opción razonable es hacerlo desde la internación (o 24-48 horas antes del procedimiento si el paciente está hospitalizado) y hasta el momento del alta institucional (no más de 7 días del post-operatorio) (C-III).
Los pacientes diabéticos tienen 50% mayor posibilidad de desarrollar ISQ que los no diabéticos31, 32. Por lo tanto, se sugiere optimizar el control en el preoperatorio y diferir el procedimiento hasta obtener niveles de HbA1C < 7%2, 3, 19. En pacientes diabéticos con úlcera con infección activa en la extremidad a operar es recomendable posponer la artoplastia electiva3, 27.
Obesidad
El efecto de la obesidad (IMC > 30 kg/m2) en el aumento de las ISQ en artroplastias2, 5, 33, 34 es proporcional al aumento del IMC15. El riesgo relativo (RR) de ISQ en pacientes obesos sometidos a artroplastia es 4.2 para reemplazo total de rodilla y 6.7 para reemplazo total de cadera35, 36.
En pacientes con obesidad extrema (IMC > 40 kg/m2) que requieren artroplastia se podría indicar cirugía bariátrica3. Se sugiere realizar la cirugía bariátrica en una primera etapa, ya que la implementación de ambas cirugías en conjunto se asocia a un RR de infección 3.5 veces mayor37. Si bien los estudios son contradictorios38, es deseable lograr un IMC <40 kg/m2 antes de la cirugía5. 22.
La profilaxis con ATB debe ser ajustadas al peso del paciente (A-I)3, 5. Los ATB hidrofílicos (β-lactámicos, glicopéptidos y aminoglucósidos) se calculan según el peso “magro” (teórico o ideal), mientras que los lipofílicos (clindamicina y quinolonas) deben ser administrados según peso real39.
Tabaquismo
Su efecto vasoconstrictor y protrombótico se asocia a reducción en la capacidad de transporte de oxígeno de la sangre, hipoperfusión, hipoxemia, retraso en la cicatrización y aumento en la morbimortalidad postoperatoria40. Cesar de fumar 6-8 semanas antes de una artroplastia se asocia con menores complicaciones de la herida (5% versus 31%), menor estadía operatoria y menos reoperaciones respecto de aquellos pacientes que continúan fumando41. Comparados con pacientes que nunca fumaron, los fumadores sometidos a artroplastia tienen mayor riesgo de aflojamiento mecánico (RR 3.0), ISQ profunda (RR 3.71) y revisión por todas las causas (RR 2.58)42. Se debe recomendar dejar de fumar 4-8 semanas antes de la cirugía (A-II)2, 5, 11.
Colonización por Staphylococcus aureus
S. aureus es comensal natural de fosas nasales, fauces, axilas e ingles. Entre el 15 y el 30% de los adultos sanos presentan colonización nasal por S. aureus meticilino-sensible (SAMS)43, 44 y 1-3% por S. aureus meticilino-resistente (SAMR) 44. La colonización por S. aureus puede ser permanente (20%) o intermitente (30%) y puede ocurrir por cepas tanto SAMS como SAMR. La colonización por SAMS es 20-30 veces más frecuente que por SAMR (30% vs. 1.5%).
S. aureus es el agente etiológico más frecuente de ISQ post-artroplastia, por lo que su erradicación de portación nasal y cutánea es una de las medidas más importantes para prevenir ISQ45. Las narinas, el sitio de colonización más frecuente, son el sitio tradicional de muestreo y permiten identificar 66% de los portadores. Si se combina hisopado de narinas con hisopado inguinal se logra 82% de sensibilidad diagnóstica.
Los pacientes programados para cirugía de artroplastia deben ser evaluados para detección de colonización por S. aureus. Si bien la recolonización es usual, ocurre luego de semanas o meses44.
La colonización nasal por S. aureus es un factor de riesgo independiente para desarrollar ISQ post artroplastia. Los portadores tienen riesgo 9 veces mayor que los no portadores de desarrollar ISQ por S. aureus46. Se ha demostrado correlación etiológica específica de esta asociación mediante estudios moleculares de las cepas documentadas en narinas e ISQ simultáneamente45, 47.
Un estudio multicéntrico, prospectivo, de cohorte con más de 40 000 pacientes evaluó el efecto de la decolonización preoperatoria de S. aureus en pacientes programados para cirugía cardíaca y artroplastia, con mupirocina nasal y baños de clorhexidina durante 5 días preoperatorios. Los pacientes no colonizados realizaban baño con clorhexidina la noche previa y el día de la cirugía. El grupo de pacientes con artroplastia mostró reducción significativa en las tasas postoperatorias de ISQ profunda por S. aureus luego de la introducción del programa de tamizaje y decolonización (RR, 0.48: 95% IC, 0.29-0.80)48.
Si bien las guías norteamericanas, en contraste con las británicas, no lo recomiendan, la búsqueda y decolonización de S. aureus es una estrategia que ha mostrado costo-eficacia en la reducción de ISQ en artroplastia electiva(A-II). Sugerimos no realizar decolonización en forma empírica con mupirocina de manera universal, debido al potencial desarrollo de resistencia a este antimicrobiano45-49. Se debe recordar que las cepas SAMR adquiridas en la comunidad (SAMR-AC) parecen tener especial afinidad por colonizar sitios no nasales, especialmente ingle y periné50.
Si bien, como se dijo más arriba, la portación nasal de S. aureus es un factor de riesgo independiente para el desarrollo de ISQ en cirugía ortopédica, y el riesgo de ISQ es elevado para portadores de S. aureus independientemente de la sensibilidad del mismo, la mayoría de las guías orientan hacia la búsqueda y decolonización de los individuos con SAMR. Esto se debe a que las ISQ por SAMR tienen 3-4 veces más riesgo de muerte y su costo duplica las ISQ por SAMS51.
Se sugiere realizar tamizaje para SAMR y SAMS en todos los individuos que van a ser sometidos a artroplastia programada2,11, 52.
Sitios anatómicos a pesquisar
Se sugiere realizar al menos hisopado nasal e inguinal por tratarse de sitios en los que múltiples estudios han mostrado que el genotipo documentado en la ISQ y en el sitio colonizado eran idénticos44.
Adecuación de las normas según los recursos de la Institución (C-III)
Las instituciones que cuenten con los recursos apropiados pueden realizar, además de hisopados nasal e inguinal, hisopado axilar (especialmente indicado en artroplastia electiva de miembro superior) y fauces. En instituciones con recursos escasos o dificultad para realizar el tamizaje en tiempo y forma, el antecedente de infección o colonización reciente (último mes) sería suficiente para implementar estrategias de decolonización dirigida.
Técnica para diagnóstico de colonización por S. aureus
La muestra debe ser tomada con hisopo de dacrón humedecido en solución fisiológica estéril, y procesada según alguna de las técnicas disponibles para detección de SAMS y SAMR.
Momento de realización del tamizaje
Se sugiere realizarlo 7-10 días antes del procedimiento quirúrgico con el objeto de implementar la decolonización adecuadamente2.
Tratamiento decolonizante
Ante un resultado positivo, la decolonización de S. aureus preoperatoria con mupirocina nasal y baños de clorhexidina logra, comparada con placebo, una disminución de las ISQ luego de una cirugía general (3.4% vs 7.7%)53. Se recomienda indicar tratamiento decolonizante ante aislamiento de cepas de SAMS o SAMR en las muestras de vigilancia2.
Decolonización nasal
Mupirocina es el único agente aprobado para la decolonización nasal por S. aureus. Está disponible en forma de ungüento nasal (formulación al 2% en base de parafina). Debe ser aplicada 2-3 veces por día durante los 5 días previos a la cirugía (A-II). Su eficacia en la decolonización nasal de portadores es de 94% a la semana de realizado. El fallo suele estar asociado a la presencia de colonización en otros sitios anatómicos (con recolonización precoz), estadía hospitalaria prolongada (con transmisión horizontal) o resistencia a mupirocina (fallo primario). El protocolo de decolonización con mupirocina de 5 días en el preoperatorio inmediato acompañado de baños con clorhexidina mostró una eficacia a los 155 días luego de la cirugía de 72.2% para SAMS y 61.5% para SAMR54.
Decolonización cutánea
Se realiza con solución jabonosa de clorhexidina al 4% o paños de clorhexidina al 2% luego de la ducha habitual una vez por día durante 5 días. Se emplea junto con la mupirocina nasal.
Antibióticos por vía sistémica
Los ATB sistémicos usualmente no alcanzan concentraciones apropiadas para erradicar la portación nasal de S. aureus; por ello deben ser combinados con tratamiento tópico. El riesgo de resistencia y efectos adversos deben ser considerdos antes de tomar la decisión44. Se ha utilizado rifampicina, minociclina, trimetoprima, clindamicina, doxiciclina. No se ha demostrado con suficiente evidencia que un agente fuera más eficaz que otros44. La decolonización oral está indicada junto con mupirocina tópica en individuos con “colonización complicada”55, como aquellos en los que ha fracasado la decolonización tópica exclusiva, pacientes con colonización en múltiples sitios no nasales, pacientes con antecedentes de infecciones recurrentes por S. aureus.
La rifampicina no debe ser empleada sola (por rápido desarrollo de resistencia) sino asociada a otras drogas como la trimetoprima o minociclina.
Modificación de la profilaxis según el resultado de los cultivos de vigilancia
Si se documenta colonización por SAMR o en el caso de que no se haya realizado tamizaje pero el paciente presenta ¨alto riesgo” de colonización por SAMR, se sugiere agregar vancomicina o teicoplanina a la profilaxis preoperatoria2. No se debe administrar un glicopéptido como único agente profiláctico por su deficiente cobertura para SAMS; siempre deben ser administrados en forma combinada con clindamicina o cefalosporinas de primera generación2 (A-III).
Infecciones orales
Las infecciones dentales son focos potenciales de siembra en prótesis e implantes y han sido documentadas infecciones protésicas ocasionadas por patógenos comúnmente aislados en la cavidad oral. La incidencia de ISQ en artroplastias secundarias por foco dental ha sido escasamente estudiada y parece ser baja. No hay recomendaciones formales respecto de la necesidad de evaluación odontológica en el preoperatorio de artroplastia electiva.
Se recomienda examen odontológico en pacientes con cuatro de los siguientes factores de riesgo para enfermedad dental activa: ancianos, ausencia de control odontológico en los últimos 12 meses, drogadicción, malos hábitos de higiene dentaria, tabaquismo crónico, historia de una o más extracciones dentarias3, 56. Estos pacientes deberían ser referidos al odontólogo para su evaluación y tratamiento completo antes de la artroplastia3. Los pacientes ancianos presentan alta prevalencia de enfermedad periodontal, por lo que se recomienda optimizar la higiene oral indicando cepillado, buches antisépticos y uso de hilo dental3.
Bacteriuria asintomática
Si bien las infecciones urinarias pueden provocar bacteriemias transitorias e ISQ, no se ha demostrado asociación significativa entre bacteriuria asintomática e ISQ profunda en artroplastia. Se ha descripto aumento de ISQ en pacientes con bacteriuria, pero no se ha observado correlación entre los microorganismos del urocultivo y el agente etiológico de ISQ, por lo que el mayor riesgo de infección en pacientes con bacteriuria podría relacionarse con la presencia de comorbilidades de base2, 5.
La indicación de urocultivo y tratamiento previo a la cirugía en pacientes asintomáticos es controvertida y no parece razonable realizarla de rutina, salvo en pacientes con antecedente de infección urinaria, anomalías anatómicas de la vía urinaria, litiasis renal, vejiga neurogénica y/o síntomas de infección urinaria (B-III)57. Por otra parte, la presencia de bacteriuria no sería motivo para posponer la cirugía2, 5, 58-61.
Lesiones cutáneas en el sitio quirúrgico o su vecindad
Las escoriaciones, abrasiones y otras lesiones cutáneas presentan mayor densidad de colonización bacteriana que la piel normal. Es conveniente, en lo posible, postergar la cirugía hasta que la piel se encuentre sana3. En pacientes con psoriasis o eczema se recomienda optimizar el estado de la piel y evitar realizar incisiones en sitios de lesiones activas3, 5. Evitar realizar la incisión quirúrgica sobre lunares, verrugas u otro tipo de lesiones cutáneas.
Artritis reumatoide
Los pacientes con artritis reumatoide sometidos a artroplastia tienen 1.6 veces mayor riesgo de ISQ62. Las altas dosis de corticoides y anti-TNF en el año previo a la artroplastia aumentan el riesgo de ISQ subsecuente, y siempre que sea posible, se recomienda su suspensión (Tabla 1). Respecto del metotrexate los datos respecto de su rol en el aumento de incidencia de ISQ en artroplastia son controvertidos. En dosis bajas no aumentaría el riesgo y no sería necesario interrumpirlo antes de la artroplastia electiva (B-II)63-66.
Tabla 1. Tiempo sugerido de cesación de tratamiento con citostáticos, antiinflamatorios e inmunosupresores previo a la cirugía
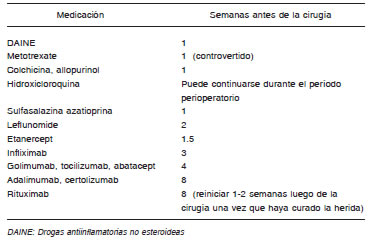
Agentes inmunosupresores
La inmunosupresión aumenta 1.9 veces el riesgo de ISQ en artroplastias electivas16. Una de las principales dificultades al momento de la evaluación preoperatoria en pacientes candidatos a artroplastia es cómo definir inmunosupresión. Ejemplos de medicamentos inmunosupresores para los cuales existen recomendaciones respecto del momento sugerido de suspensión previo a la cirugía están presentados en Tabla 1.
Parece razonable evitar los medicamentos inmunosupresores en el período preoperatorio (C-III).
Agentes biológicos. Anti-factor de necrosis tumoral (anti-TNF)
No existen recomendaciones definidas; debe valorarse la relación riesgo-beneficio para cada caso en particular. Debido a que los agentes biológicos aumentan el riesgo de infección, se sugiere suspender el tratamiento con anti-TNF previo a cirugías con colocación de implante por un tiempo equivalente a 3-5 veces la vida media de la droga y reiniciar cuando la herida esté curada y sin evidencias de infección62, 66 (Tabla 1).
Dosis adicional de esteroides en pacientes en corticoterapia crónica
Los pacientes que reciben esteroides a dosis < 7.5 mg/d o cualquier dosis por menos de 3 semanas no requieren dosis de estrés. Los pacientes con tratamientos con dosis > 7.5 mg/d por más de 3 semanas de duración requieren dosis de estrés de 50-100 mg de hidrocortisona el día de la cirugía y luego continuar con la dosificación usual (B-II). Los pacientes que reciben esteroides de reemplazo por enfermedad del eje hipotalámico requieren dosis suplementarias en el período perioperatorio67.
Otros factores de riesgo
Otros factores de riesgo son: arritmia (RR:1.30), insuficiencia cardíaca (RR:1.28), enfermedad pulmonar crónica (RR:1.22), depresión (RR:1.28), anemia preoperatoria (RR:1.36), enfermedad vascular periférica (RR:1.29), coagulopatía (RR:1.58), tumor metastásico (RR:1.59)68.
Baño prequirúrgico
Recientemente, la FDA advirtió sobre el uso doméstico de jabones antisépticos; sin embargo, esta recomendación no afecta su uso en el marco de las estrategias utilizadas para el control hospitalario de infecciones. El agente de elección es la clorhexidina, ya que provoca mayor reducción de número de microrganismos que la povidona y tiene “efecto residual”.
La clorhexidina es un antiséptico de amplio espectro, bactericida, que provoca disrupción de la membrana celular, de baja toxicidad. Se utiliza como decolonizante cutáneo al 4% en solución jabonosa o al 2% en paños (estos últimos son más eficaces en la reducción de la carga microbiana de la piel)69, con el objeto de reducir la colonización por S. aureus.
La literatura no es consistente respecto del número de baños preoperatorios recomendados. En caso de no existir colonización documentada por S. aureus, un baño previo a la cirugía parece ser efectivo2, 5,16, 69, 70. En caso de ser necesaria la decolonización, deben ser realizados 5 baños en el preoperatorio inmediato2 (AIII).
En varios estudios observacionales prospectivos se ha demostrado que el uso de paños con clorhexidina reduce la incidencia de ISQ en artroplastia, aunque no en forma estadísticamente significativa71, 72. Debe ser aplicada en todo el cuerpo salvo mucosas haciendo énfasis en pliegues y zona quirúrgica (previa realización de ducha usual incluyendo el cabello), dejar actuar 3 minutos sin enjuagar, y secar con toalla limpia.
Rasurado
Debe ser evitado ya que produce microabrasiones cutáneas que favorecen la multiplicación bacteriana, particularmente si se realiza varias horas antes de la cirugía62, 73. El rasurado se asocia a mayor incidencia de ISQ (5.6%) que la no-remoción del vello (0.6%)74. La tasa de ISQ es mayor si se realiza más de 24 horas antes del procedimiento (20%) que si se realiza inmediatamente antes del procedimiento (3.1%) o dentro de las 24 horas previas al mismo (7.1%)74. No remover el vello en la zona de la incisión a menos que el mismo interfiera con el acto quirúrgico (AII)2. En caso de ser necesaria la remoción, debe usarse cortadoras tipo clipper eléctrico (que dejan 1 a 2 milimetros de vello) con cabezal descartable el día de la cirugía en la habitación del paciente inmediatamente antes de ser trasladado al quirófano (A-II)2. No usar máquinas de depilación que arranquen el pelo desde la raíz.
Reducción de la duración de la internación preoperatoria
La internación preoperatoria deberá ser lo más corta posible (B-III)57. Se sugiere que el paciente se interne el mismo día de la cirugía3. Los pacientes derivados desde instituciones de cuidados crónicos presentan mayor riesgo de ISQ (RR 4.35)75.
Lista de verificación quirúrgica
La implementación sistemática de ¨listas de verificación¨ ha contribuido a mejorar la seguridad del paciente disminuyendo errores potencialmente evitables (AI)2, 76.
FASE INTRAOPERATORIA
Ambiente físico
Las tasas de infección en artroplastia se correlacionan con la concentración de bacterias en el aire77, lo que depende del número de personas dentro del quirófano, el movimiento del personal del quirófano, la calidad de la ropa del personal y la calidad del proceso de limpieza.
Conducta dentro de quirófano
Son recomendaciones generales para todo acto quirúrgico. Se recomienda reducir el número de profesionales y sus movimientos al mínimo indispensable2, 21, 78 (B-II). Los miembros del equipo quirúrgico deben: tener uñas cortas, no usar uñas artificiales79 (B-II), quitarse joyas de brazos y manos antes de ingresar al área quirúrgica3, 21, 80 ni ingresar con elementos personales80. Los cirujanos con lesiones cutáneas en manos y antebrazos, aunque sean mínimas, deben evitar participar del acto quirúrgico81 (B-III).
Los equipos de rayos y ecografía que ingresen a quirófano deben ser cubiertos con barreras estériles, limpiados y desinfectados entre paciente y paciente.
Los radiólogos que ingresen a quirófano deben vestir como todo el equipo quirúrgico3.
Las cajas de instrumental estéril deben ser abiertas lo más cercanamente a su uso.
Ventilación en el quirófano
La disminución del número de partículas dispersas en el aire se puede lograr por sistemas de ventilación convencionales (filtración > 90%) o sistemas de flujo laminar vertical con filtros HEPA (ultrafiltración > 99%). El sistema de flujo laminar ha sido recomendado para disminuir el riesgo de ISQ en algunos tipos de cirugías11, 83, 84. Revisiones sistemáticas recientes no encontraron diferencias significativas respecto al riesgo de ISQ entre pacientes sometidos a artroplastia realizados en quirófano con ventilación convencional o flujo laminar, si bien hay trabajos donde el agregado de un sistema portátil logró disminuir en forma significativa la carga de partículas del área quirúrgica84.
Se recomienda presión de aire positiva de modo de favorecer el flujo de aire hacia afuera del quirófano (presión diferencial mínima de 2.5 Pascales = 0.01 pulgadas de agua), renovaciones de aire/hora ≥ 15 de las cuales 3 deben ser de aire exterior (20%), calidad de filtración ≥ 90%, temperatura 20-23 °C, humedad relativa 30-60% (la humedad muy baja aumenta el potencial de polvo en el aire, mientras que la humedad muy alta favorece el crecimiento bacteriano)2, 82.
Las cirugías ortopédicas podrían ser realizadas en quirófanos con sistemas de ventilación convencionales2, 70. Hasta aclarar las controversias existentes en relación a las ventajas del flujo laminar, los centros que cuenten con dichos equipos podrían usarlos en situaciones especiales tales como cirugías de tercera revisión (o posterior) y/o en pacientes con más de un factor de riesgo (C-III).
Indumentaria quirúrgica
Todos los miembros del equipo quirúrgico deben usar ambo, gorro, barbijo que cubra nariz y boca, guantes, camisolín, calzado exclusivo o cobertores de calzado durante toda la cirugía (BI)2, 3. Se sugiere usar dos pares de guantes con el objeto de proteger al cirujano debido a que las perforaciones de los guantes son frecuentes en cirugía ortopédica62, 85. El segundo par de guantes debe ser cambiado62 si se observa perforación, a los 90 minutos del inicio, y antes de colocar el implante. La superficie externa del equipo de protección personal (camisolín) no es estéril una vez removida del paquete original, por ello una vez que los guantes tocan el camisolín deben ser cambiados86.
Anestésicos
Algunos estudios retrospectivos indican que la anestesia regional se asocia a menor tasa de ISQ en pacientes sometidos a artroplastia de miembro inferior. En lo posible, se sugiere utilizar anestesia regional (B-III).
Si bien no hay estudios sobre el uso de óxido nitroso en el régimen anestésico de pacientes sometidos a artroplastia, parece prudente evitar su uso ya que en cirugía abdominal ha mostrado provocar inmunosupresión por daño en el ADN de los neutrófilos y aumento de ISQ87, 88.
Profilaxis antibiótica
Tiene por objeto reducir la flora microbiana presente en el sitio quirúrgico al momento de la cirugía. Reduce significativamente la incidencia de ISQ en todas las categorías quirúrgicas y consecuentemente, la morbimortalidad asociada a cirugía. En particular, la profilaxis con ATB ha demostrado consistente reducción de ISQ en artroplastias completas de cadera y rodilla (A-I)2, 5, 91 . Si bien es la medida aislada más eficaz, debe ser complementada con otras medidas como la adecuada evaluación preoperatoria, la buena técnica quirúrgica, el quirófano seguro y los cuidados postoperatorios9, 90.
Se debe utilizar un ATB con espectro acotado para evitar el desarrollo de resistencia en la flora normal del paciente, y por el menor tiempo posible para reducir la posibilidad de efectos adversos. La vía de administración debe ser siempre endovenosa. Es fundamental utilizar el ATB adecuado, en la dosis apropiada y en el momento oportuno2, 5.
Antibióticos de elección en cirugía primaria
Son las cefalosporinas de primera generación (cefalotina, cefazolina) por su espectro sobre Streptococcus spp., SAMS y algunos bacilos Gram negativos, su actividad bactericida, su biodisponibilidad, su buena y rápida penetración en partes blandas y hueso, su perfil favorable tóxico-terapéutico y su bajo costo2, 3, 5.
Si bien la vancomicina es activa sobre cepas de SAMR, presenta desventajas tales como su falta de actividad sobre bacilos Gram negativos, su penetración variable en hueso por tratarse de una molécula de gran tamaño, la necesidad de infusión prolongada, su potencial toxicidad, y su menor actividad sobre cepas de SAMS respecto de las cefalosporinas. No se recomienda su uso rutinario como profilaxis ya que si bien podría reducir la incidencia de ISQ por SAMR comparada con β-lactámicos (RR: 0.43), se asocia a mayor incidencia de ISQ por SAMS cuando se utiliza como profilaxis en cirugías ortopédicas y cardiovasculares (RR: 2.8). La vancomicina debe ser diluida a 5 mg/ml en solución fisiológica estéril para evitar efectos adversos como el “síndrome de hombre rojo” y ser infundida en no menos de 60 minutos. Una vez finalizada la infusión completa, demora 30 minutos en alcanzar el pico máximo, lo que obliga a iniciar la administración antes de llevar al paciente al quirófano.
La teicoplanina es una alternativa a la vancomicina92, con sus mismas limitaciones para el caso de SAMS, pero con algunas ventajas como la posibilidad de administración en 5-10 minutos (que permite su uso durante la inducción anestésica), y su menor incidencia de efectos cardiovasculares, nefrotoxicidad y rash.
Indicaciones de uso de glicopéptidos2
Su uso debe reservarse para los siguientes casos:
1. Paciente con alergia mayor a β-lactámicos (urticaria grave, edema laríngeo y/o broncoespasmo)
2. Paciente no investigado (no se realizó hisopado) con factores de riesgo de colonización por SAMR: hemodiálisis, diabetes tipo I, institucionalizados, trabajadores de la salud, adictos a drogas intravenosas, con infección o colonización por SAMR en los 30 días previos, con enfermedades cutáneas crónicas supuradas (forunculosis) o eccematosas (psoriasis)
3. Pacientes colonizados por SAMR
4. Prevalencia institucional > 10% de ISQ por SAMR en cirugía ortopédica
5. Institución con brote por SAMR
Los glicopéptidos no deben ser empleados solos sino asociados a cefalosporinas. Si hay alergia a β-lactámicos, asociarlos a clindamicina.
Daptomicina o clindamicina+gentamicina pueden ser una alternativa en pacientes con anafilaxia a glicopéptidos (C-III).
Los pacientes con antecedentes de infección articular en el sitio quirúrgico deberían recibir profilaxis con ATB que cubra al microorganismo causante de la infección previa si su identidad ha sido documentada2, 5.
Momento de administración
Para alcanzar eficacia óptima el agente profiláctico debe alcanzar altos niveles en el sitio quirúrgico al momento de la incisión y durante todo el procedimiento. El riesgo de ISQ aumenta 4.3 veces si la profilaxis es administrada demasiado temprano (más de 2 horas antes de la cirugía) y 5.8 veces si es administrada demasiado tarde (luego de 3 horas de la cirugía)93. El momento para iniciar la infusión de los ATB es 60 minutos antes de la incisión cutánea, salvo para vancomicina y fluoroquinolonas cuya infusión debe ser iniciada 120 minutos antes, ya que requieren administración lenta2, 5 (B-II).
Si se emplea torniquete o manguito hemostático proximal para reducir el sangrado, la dosis completa de ATB profiláctico debe administrarse 10-15 minutos antes de que finalice la insuflación del mismo2, 3, 5, ya que si se administra luego de ese momento, el ATB no alcanza concentraciones tisulares en el lecho quirúrgico apropiadas para prevenir ISQ94.
Dosis recomendadas
La dosis debe ajustarse al peso del paciente según Tabla 2.
Tabla 2. Profilaxis de infección de sitio quirúrgico: dosis e indicaciones

Repetición de dosis ATB intraoperatoria
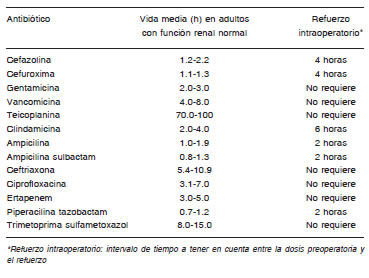
Debe asegurarse concentración tisular apropiada durante toda la cirugía. Debe repetirse una dosis intraoperatoria en cirugías que excedan dos vidas medias del ATB o si la pérdida de sangre es mayor a 1500 ml (B-III)2. El momento de administrar la nueva dosis de ATB intraoperatorio se debe medir desde la administración de la dosis prequirúrgica del mismo, no desde el inicio de la cirugía (Tabla 3).
Tabla 3. Momento de administración de dosis suplementarias intraoperatoria de antibióticos
Duración de la profilaxis
En cirugía traumatológica con implante una dosis (y si es necesario el refuerzo intraoperatorio) es suficiente como profilaxis2, 5, 95.
La profilaxis no debe extenderse más allá de 24 horas (B-III).
No está indicado prolongar la profilaxis hasta el retiro de drenajes (B-III).
Asociación de antimicrobianos
Existen evidencias de ISQ por SAMS en pacientes que reciben vancomicina como profilaxis por lo que es razonable asociar cefazolina (CIII)96.
Es recomendable asociar gentamicina a cefazolina o cefuroxima en instituciones con tasa elevada de ISQ por bacilos Gram negativos3, 96, 97.
Antibióticos de elección en cirugía de revisión
En cirugías de revisión por infección, la profilaxis debería incluir cobertura del microorganismo causante de la infección previa2, 5 (C-III). En este grupo de pacientes está indicado el uso de cemento con ATB (CCA).
Momento de administración
Si bien la profilaxis es uno de los factores más importantes para disminuir el riesgo de infección protésica, existe la recomendación de posponer su uso en cirugías traumatológicas con sospecha de infección, con el objeto de optimizar el rédito de los cultivos. Un estudio aleatorizado controlado que evaluó la tasa de recuperación de microorganismos en pacientes con sospecha de infección no mostró diferencias entre el grupo que recibió profilaxis antes de la toma de muestras y el que la recibió luego de este momento (82% vs. 81%), por lo que se concluyó que, dados los beneficios de la profilaxis con ATB, la misma no debería posponerse con el objeto de tomar cultivos98. La recomendación de posponer la profilaxis con el objeto de documentar infección debe ser definida individualmente y discutida con el especialista en infectología.
Dosis recomendadas, Refuerzo intraoperatorio, Duración de la profilaxis y Asociación de antimicrobianos
Iguales conceptos que para artroplastia primaria.
Cemento con antibióticos (CCA)
La fijación primaria es el anclaje que se produce entre la prótesis y el hueso en el momento de la cirugía y se la logra utilizando cemento de polimetilmetacrilato, o bien, mediante el anclaje intrínseco del componente protésico (componentes a presión, atornillados o autoexpandibles). La liberación de ATB desde el cemento es un proceso complejo que depende del tipo de ATB, el tipo de cemento y las condiciones en que fue realizada la mezcla. El ATB se libera desde grietas que se producen en el cemento.
Los CCA disponibles comercialmente contienen dosis bajas de ATB, útiles como profilaxis de ISQ en pacientes de riesgo, pero no para tratamiento coadyuvante en caso de artroplastia de revisión por infección protésica.
Uso profiláctico en artroplastia primaria
El CCA sirve como defensa contra la contaminación directa al momento de la cirugía y en el postoperatorio inmediato durante la cicatrización de la herida. Apoya pero no reemplaza la profilaxis con ATB sistémica.
El CCA como profilaxis se usa a baja dosis (≤ 1 g de ATB / 40 g de cemento) y no está indicado en pacientes con bajo riesgo de infección. Por lo tanto, no está indicado en pacientes sometidos a revisión primaria de rutina o colocación de primera prótesis, debido a que tiene riesgo potencial de hipersensibilidad, toxicidad y selección de resistencia en caso de ISQ.
El CCA como profilaxis debe restringirse a grupos de alto riesgo de ISQ (inmunocompromiso, obesidad mórbida, diabetes), siempre que alguno de los componentes que se utilice sea cementado.
Los ATB usualmente usados son gentamicina y tobramicina.
La evidencia actual no avala el uso rutinario de CCA como profilaxis de ISQ en artroplastia primaria99.
Uso en artroplastia de revisión
El uso de CCA para el tratamiento de infecciones osteoarticulares está bien establecido. Para obtener niveles terapéuticos se requieren en promedio 3.6 g de ATB / 40 g de cemento.
Cefazolina, gentamicina, tobramicina, vancomicina, quinolonas, daptomicina, linezolid y meropenem, entre otros, han demostrado buena elución desde el cemento, lo que permite ajustar el ATB al microorganismo documentado en aislamientos previos. Muchos requieren preparación casera ya que no se presentan en forma comercial.
Dosificación
Por cada 40 g de cemento se sugiere incorporar: gentamicina y tobramicina 4.8 g, cefalosporinas 2 g, ciprofloxacina 3 g, vancomicina 1-4 g, linezolid 1.2 g, colistin 0.24 g, meropenem 0.5-4.0 g, anfotericina B 0.2 g.
Preparación del campo quirúrgico
La realización de una adecuada limpieza del campo quirúrgico implica higiene de la piel removiendo la suciedad con esponja y jabón, para luego aplicar el antiséptico en el sitio de incisión. El enjuague se realiza con solución fisiológica o agua destilada estéril y el secado con compresas de gasas estériles.
Antiséptico para preparación del campo quirúrgico
Utilizar antisépticos de base alcohólica si no hay contraindicación específica y si están disponibles (alcohol asociado a un antiséptico que puede ser clorhexidina o iodopovidona)2, 5 (AI).
Los agentes que contienen alcohol reducen el riesgo de ISQ cuando se los compara con soluciones antisépticas en base acuosa.
Ante la ausencia de soluciones con alcohol, el gluconato de clorhexidina tiene ventajas sobre la iodopovidona, como actividad residual y actividad en presencia de sangre o suero.
Utilizar las soluciones de aplicación única (monodosis); si no es posible, utilizar envases lo más pequeños posibles y descartar una vez abierto (no rellenar).
Si se fraccionan los antisépticos, el procedimiento debe realizarse en un sitio específicamente destinado a tal fin, con estrictas condiciones de asepsia y campana de flujo laminar (preferentemente en farmacia; supervisado por responsable de esterilización).
Técnica quirúrgica
La duración de la cirugía es un factor de riesgo de infección y se puede utilizar como elemento predictor del desarrollo de ISQ.
La presencia de tejidos traumatizados o desvitalizados, hematomas y material extraño aumentan la oportunidad de ISQ.
No hay consenso respecto de la necesidad de cambiar el bisturí luego de la incisión cutánea en artroplastia electiva.
La técnica quirúrgica desprolija predispone al desarrollo de ISQ, así como el uso excesivo del electrobisturí. Se recomienda manipular suavemente los tejidos, remover tejidos desvitalizados, disminuir espacios muertos y aproximar suavemente los planos quirúrgicos (C-III).
Finalizada la cirugía ocluir la herida utilizando técnica aséptica.
No ha demostrado beneficio la aplicación tópica de ATB. No hay argumentos para recomendar su uso5.
Campos quirúrgicos adhesivos y adhesivos impregnados en antisépticos
No utilizar campos quirúrgicos adhesivos para disminuir las ISQ. No hay evidencia sobre su efectividad para este fin. Está contraindicado el uso de adhesivos impregnados con antisépticos para la zona quirúrgica para prevención de ISQ.
Sonda vesical
El riesgo de desarrollo de infecciones del tracto urinario (y posible siembra de la prótesis implantada) es proporcional a la permanencia de la cateterización. Se recomienda limitar la duración de la cateterización urinaria y colocarla con técnica aséptica (B-III)2, 57.
Manejo de suctores
Las puntas de los suctores que se utilizan para aspirar fluidos durante la cirugía ortopédica presentan tasas de contaminación de hasta el 48%. Se ha reportado ISQ provocada por la misma cepa contaminante de la punta del suctor. La contaminación de los suctores aumenta a medida que se prolonga el tiempo de la cirugía, 9% de colonización dentro de la hora de iniciada la cirugía comparado con 67% de colonización en procedimientos de más de una hora de duración. Se recomienda cambiar las puntas de los suctores cada 60 minutos4, así como cambiar el suctor antes de ingresar al canal femoral5. Retirar los suctores cuando no estén en uso.
Drenajes
Todo drenaje debe ser estéril y estar conectado a un reservorio que permita recoger y medir el volumen drenado en un circuito cerrado y aspirativo que permanezca en todo momento por debajo del nivel del paciente para evitar el retorno de fluido y la contaminación retrógrada2, 3. Debe colocarse alejado de la incisión quirúrgica, ya que los drenajes colocados contiguamente a la incisión quirúrgica aumentan el riesgo de ISQ. Los drenajes deben ser manipulados lo menos posible. Si hay desconexión se debe cambiar el reservorio; mantener el circuito el mayor tiempo posible cerrado y evitar su manipulación innecesaria.
Evitar dejar drenajes colocados por más de 48-72 horas2. No son un sustituto de la buena hemostasia y no deben permanecer demasiado tiempo. Dejar un drenaje no funcionante expone innecesariamente al paciente a mayor riesgo de infección. Los drenajes aspirativos cerrados pueden ser útiles para remover líquido de grandes espacios muertos potenciales, pero no previenen por sí solos la infección.
La conexión y manipulación del mismo debe realizarse previo lavado de manos y con guantes estériles. Los drenajes deben ser retirados lo antes posible, cuando el débito es menor de 25 ml/día. La presencia de drenajes no justifica la prolongación de la profilaxis con ATB2, 5.
Normotermia perioperatoria
La hipotermia (temperatura < 36 oC) provoca vasoconstricción generalizada, disminuye el flujo sanguíneo subcutáneo, la tensión de oxígeno, y se asocia a mayor incidencia de ISQ. Debe mantenerse la temperatura corporal por encima de 36 oC (A-I)5.
Transfusión de hemoderivados
La incidencia de ISQ aumenta 5% por cada unidad de hemoderivados transfundida durante el acto quirúrgico. Se han descripto alteraciones en la función inmune celular relacionadas a transfusión de sangre entera. Se ha descripto mayor riesgo para sangre alogénica (12%) que autóloga (1.2%) en artroplastia primaria57. Se recomienda reducir al mínimo las transfusiones intraoperatorias. Si se anticipa la necesidad de transfusión, la misma debe realizarse 48 horas antes de la cirugía para maximizar el transporte de oxígeno durante la misma3.
Oxigenoterapia
La destrucción de los microorganismos fagocitados por los neutrófilos implica procesos oxidativos. Los neutrófilos pierden rápidamente esta capacidad por presión parcial de oxígeno menor a 40 mm Hg. La incidencia de ISQ está inversamente relacionada a la tensión tisular de oxígeno. Se recomienda administrar oxígeno de modo de asegurar saturación mayor al 95%. Mantener adecuada perfusión tisular (C-III)2, 3.
FASE POSTOPERATORIA
Manejo de potenciales puertas de entrada durante la internación
Limitar la cateterización urinaria3, 57 y los accesos vasculares.
Curación de la herida
A menos que ocurra hemorragia, contaminación o sospecha de infección por Clostridium perfringens, la curación de la herida realizada en quirófano no debe ser removida durante las primeras 48 horas2, 3.
Profilaxis con ATB en procedimientos odontológicos
No existen evidencias sobre la necesidad de profilaxis con ATB en pacientes con prótesis osteoarticulares sometidos a procedimientos odontológicos. Su uso debe basarse en la complejidad del procedimiento y los factores de riesgo individuales99. Se recomienda mantener una higiene oral adecuada99.
Agradecimientos: Los autores agradecen el aporte financiero de la Sociedad Argentina de Infectología para la publicación del artículo y el apoyo institucional de la Comisión Directiva.
Conflicto de intereses: Ninguno para declarar
1. Osmon DR, Berbari EF, Berendt AR, et al. Diagnosis and management of prosthetic joint infection: clinical practice guidelines by the Infectious Diseases Society of America. Clin Infect Dis 2013; 56: e1-e25. [ Links ]
2. Documento de Consenso Interinstitucional “Actualización sobre medidas de prevención de infecciones del sitio quirurgico”. Ministerio de Salud. Administración Nacional de Laboratorios e Institutos de Salud (ANLIS). Instituto Nacional de Epidemiología (INE) - Sociedad Argentina de Infectología (SADI), Agosto 2015. En: https://www.dropbox.com/s/307pkhyfcaasjm8/CONSENSO%20INE-SADI%202015%20ISQ%20%281%29.pdf?dl=0
3. Darouiche RO. Treatment of infections associated with surgical implants. N Engl J Med 2004; 350: 1422-9. [ Links ]
4. Zimmerli W, Trampuz A, Ochsner PE. Prosthetic-joint infections. N Engl J Med 2004; 351: 1645-54. [ Links ]
5. Parvizi J, Gehrke T, Chen AF. Proceedings of the International Consensus on Periprosthetic Joint Infection. Bone Joint J 2013; 95-B: 1450-2. [ Links ]
6. Horan TC, Gaynes RP, Martone WJ, Jarvis WR, Emori TG. CDC definitions of nosocomial surgical site infections, 1992: a modification of CDC definitions of surgical wound infections. Am J Infect Control 1992; 20: 271-4. [ Links ]
7. Whitehouse JD, Friedman ND, Kirkland KB, Richardson WJ, Sexton DJ. The impact of surgical-site infections following orthopedic surgery at a community hospital and a university hospital: adverse quality of life, excess length of stay, and extra cost. Infect Control Hosp Epidemiol 2002; 23: 183-9. [ Links ]
8. Kirkland KB, Briggs JP, Trivette SL, Wilkinson WE, Sexton DJ. The impact of surgical-site infections in the 1990s: attributable mortality, excess length of hospitalization, and extra costs. Infect Control Hosp Epidemiol 1999; 20: 725-30. [ Links ]
9. Dal-Paz K, Oliveira PR, Paula AP, Emerick MC, Pecora JR, Lima AL. Economic impact of treatment for surgical site infections in cases of total knee arthroplasty in a tertiary public hospital in Brazil. Braz J Infect Dis 2010; 14: 356-9. [ Links ]
10. Baek SH. Identification and preoperative optimization of risk factors to prevent periprosthetic joint infection. World J Orthop 2014; 5: 362-7. [ Links ]
11. Adeli B, Parvizi J. Strategies for the prevention of periprosthetic joint infection. J Bone Joint Surg Br 2012; 94 Suppl A: 42-6. [ Links ]
12. Wu C, Qu X, Liu F, Li H, Mao Y, Zhu Z. Risk factors for periprosthetic joint infection after total hip arthroplasty and total knee arthroplasty in Chinese patients. PLoS One 2014; 9: e95300. [ Links ]
13. Carroll K, Dowsey M, Choong P, Peel T. Risk factors for superficial wound complications in hip and knee arthroplasty. Clin Microbiol Infect 2014; 20: 130-5. [ Links ]
14. Dowsey MM, Choong PF. Obese diabetic patients are at substantial risk for deep infection after primary TKA. Clin Orthop Relat Res 2009; 467: 1577-81. [ Links ]
15. Everhart JS, Altneu E, Calhoun JH. Medical comorbidities are independent preoperative risk factors for surgical infection after total joint arthroplasty. Clin Orthop Relat Res 2013; 471: 3112-9. [ Links ]
16. Berbari EF, Osmon DR, Lahr B, et al. The Mayo prosthetic joint infection risk score: implication for surgical site infection reporting and risk stratification. Infect Control Hosp Epidemiol 2012; 33: 774-81. [ Links ]
17. Parvizi J, Cavanaugh PK, Diaz-Ledezma C. Periprosthetic knee infection: ten strategies that work. Knee Surg Relat Res 2013; 25: 155-64. [ Links ]
18. Soohoo NF, Farng E, Lieberman JR, Chambers L, Zingmond DS. Factors that predict short-term complication rates after total hip arthroplasty. Clin Orthop Relat Res 2010; 468: 2363-71. [ Links ]
19. Peersman G, Laskin R, Davis J, Peterson M. Infection in total knee replacement: a retrospective review of 6489 total knee replacements. Clin Orthop Relat Res 2001: 15-23. [ Links ]
20. Société de Pathologie Infectieuse de Langue Française (SPILF), Collège des Universitaires de Maladies Infectieuses et Tropicales (CMIT), Groupe de Pathologie Infectieuse Pédiatrique (GPIP), et al. Recommendations for bone and joint prosthetic device infections in clinical practice (prosthesis, implants, osteosynthesis). Société de Pathologie Infectieuse de Langue Française. Med Mal Infect 2010; 40: 185-211. [ Links ]
21. Greene LR. Guide to the elimination of orthopedic surgery surgical site infections: an executive summary of the Association for Professionals in Infection Control and Epidemiology elimination guide. Am J Infect Control 2012; 40: 384-6. [ Links ]
22. Eka A, Chen AF. Patient-related medical risk factors for periprosthetic joint infection of the hip and knee. Ann Transl Med 2015; 3: 233. [ Links ]
23. Pour AE, Matar WY, Jafari SM, Purtill JJ, Austin MS, Parvizi J. Total joint arthroplasty in patients with hepatitis C. J Bone Joint Surg Am 2011; 93: 1448-54. [ Links ]
24. Issa K, Boylan MR, Naziri Q, Perfetti DC, Maheshwari AV, Mont MA. The impact of hepatitis C on short-term outcomes of total joint arthroplasty. J Bone Joint Surg Am 2015; 97: 1952-7. [ Links ]
25. Sunday JM, Guille JT, Torg JS. Complications of joint arthroplasty in patients with end-stage renal disease on hemodialysis. Clin Orthop Relat Res 2002: 350-5. [ Links ]
26. Turina M, Fry DE, Polk HC, Jr. Acute hyperglycemia and the innate immune system: clinical, cellular, and molecular aspects. Crit Care Med 2005; 33: 1624-33. [ Links ]
27. Heller S, Rezapoor M, Parvizi J. Minimising the risk of infection: a peri-operative checklist. Bone Joint J 2016; 98-B(1 Suppl A): 18-22. [ Links ]
28. Rassias AJ, Marrin CA, Arruda J, Whalen PK, Beach M, Yeager MP. Insulin infusion improves neutrophil function in diabetic cardiac surgery patients. Anesth Analg 1999; 88: 1011-6. [ Links ]
29. Richards JE, Kauffmann RM, Zuckerman SL, Obremskey WT, May AK. Relationship of hyperglycemia and surgical-site infection in orthopaedic surgery. J Bone Joint Surg Am 2012; 94: 1181-6. [ Links ]
30. Jamsen E, Nevalainen P, Kalliovalkama J, Moilanen T. Preoperative hyperglycemia predicts infected total knee replacement. Eur J Intern Med 2010; 21: 196-201. [ Links ]
31. Mraovic B, Suh D, Jacovides C, Parvizi J. Perioperative hyperglycemia and postoperative infection after lower limb arthroplasty. J Diabetes Sci Technol 2011; 5: 412-8. [ Links ]
32. Martin ET, Kaye KS, Knott C, et al. Diabetes and risk of surgical site infection: A systematic review and meta-analysis. Infect Control Hosp Epidemiol 2016; 37: 88-99. [ Links ]
33. Friedman RJ, Hess S, Berkowitz SD, Homering M. Complication rates after hip or knee arthroplasty in morbidly obese patients. Clin Orthop Relat Res 2013; 471: 3358-66. [ Links ]
34. Karunakar MA, Shah SN, Jerabek S. Body mass index as a predictor of complications after operative treatment of acetabular fractures. J Bone Joint Surg Am 2005; 87: 1498-502. [ Links ]
35. Namba RS, Paxton L, Fithian DC, Stone ML. Obesity and perioperative morbidity in total hip and total knee arthroplasty patients. J Arthroplasty 2005; 20 (7 Suppl 3): 46-50. [ Links ]
36. Lübbeke A, Moons KG, Garavaglia G, Hoffmeyer P. Outcomes of obese and nonobese patients undergoing revision total hip arthroplasty. Arthritis Rheum 2008; 59: 738-45. [ Links ]
37. Kulkarni A, Jameson SS, James P, Woodcock S, Muller S, Reed MR. Does bariatric surgery prior to lower limb joint replacement reduce complications? Surgeon 2011; 9: 18-21. [ Links ]
38. Inacio MC, Paxton EW, Fisher D, Li RA, Barber TC, Singh JA. Bariatric surgery prior to total joint arthroplasty may not provide dramatic improvements in post-arthroplasty surgical outcomes. J Arthroplasty 2014; 29: 1359-64. [ Links ]
39. Alvarez-Lerma F, Grau S. Management of antimicrobial use in the intensive care unit. Drugs 2012; 72: 447-70. [ Links ]
40. Durand F, Berthelot P, Cazorla C, Farizon F, Lucht F. Smoking is a risk factor of organ/space surgical site infection in orthopaedic surgery with implant materials. Int Orthop 2013; 37: 723-7. [ Links ]
41. Moller AM, Villebro N, Pedersen T, Tonnesen H. Effect of preoperative smoking intervention on postoperative complications: a randomised clinical trial. Lancet 2002; 359: 114-7. [ Links ]
42. Teng S, Yi C, Krettek C, Jagodzinski M. Smoking and risk of prosthesis-related complications after total hip arthroplasty: a meta-analysis of cohort studies. PLoS One 2015; 10: e0125294. [ Links ]
43. Kuehnert MJ, Kruszon-Moran D, Hill HA, et al. Prevalence of Staphylococcus aureus nasal colonization in the United States, 2001-2002 J Infect Dis 2006; 193:172-9. doi:10.1086/499632. [ Links ]
44. Septimus EJ, Schweizer ML. Decolonization in prevention of health care-associated infections. Clin Microbiol Rev 2016; 29: 201-22. [ Links ]
45. Weiser MC, Moucha CS. The current state of screening and decolonization for the prevention of Staphylococcus aureus surgical site infection after total hip and knee arthroplasty. J Bone Joint Surg Am 2015; 97: 1449-58. [ Links ]
46. Kalmeijer MD, van Nieuwland-Bollen E, Bogaers-Hofman D, de Baere GA. Nasal carriage of Staphylococcus aureus is a major risk factor for surgical-site infections in orthopedic surgery. Infect Control Hosp Epidemiol 2000; 21: 319-23. [ Links ]
47. Skramm I, Fossum Moen AE, Aroen A, Bukholm G. Surgical site infections in orthopaedic surgery demonstrate clones similar to those in orthopaedic Staphylococcus aureus nasal carriers. J Bone Joint Surg Am 2014; 96: 882-8. [ Links ]
48. Schweizer ML, Chiang HY, Septimus E, et al. Association of a bundled intervention with surgical site infections among patients undergoing cardiac, hip, or knee surgery. JAMA 2015; 313: 2162-71. [ Links ]
49. Edmiston CE, Jr., Ledeboer NA, Buchan BW, Spencer M, Seabrook GR, Leaper D. Is staphylococcal screening and suppression an effective interventional strategy for reduction of surgical site infection? Surg Infect (Larchmt) 2016; 17: 158-66. [ Links ]
50. Popovich KJ, Aroutcheva A, Hota B, Beavis KG, Hayden MK, Weinstein RA. Anatomic sites of colonization with community-associated methicillin-resistant Staphylococcus aureus. Infect Control Hosp Epidemiol 2014; 35: 1192-4. [ Links ]
51. Parvizi J, Pawasarat IM, Azzam KA, Joshi A, Hansen EN, Bozic KJ. Periprosthetic joint infection: the economic impact of methicillin-resistant infections. J Arthroplasty 2010; 25 (6 Suppl): 103-7. [ Links ]
52. Chen AF, Wessel CB, Rao N. Staphylococcus aureus screening and decolonization in orthopaedic surgery and reduction of surgical site infections. Clin Orthop Relat Res 2013; 471: 2383-99. [ Links ]
53. Bode LG, Kluytmans JA, Wertheim HF, et al. Preventing surgical-site infections in nasal carriers of Staphylococcus aureus. N Engl J Med 2010; 362: 9-17. [ Links ]
54. Immerman I, Ramos NL, Katz GM, Hutzler LH, Phillips MS, Bosco JA 3rd. The persistence of Staphylococcus aureus decolonization after mupirocin and topical chlorhexidine: implications for patients requiring multiple or delayed procedures. J Arthroplasty 2012; 27: 870-6. [ Links ]
55. Ammerlaan HS, Kluytmans JA, Berkhout H, et al. Eradication of carriage with methicillin-resistant Staphylococcus aureus: effectiveness of a national guideline. J Antimicrob Chemother 2011; 66: 2409-17. [ Links ]
56. Willis-Owen CA, Konyves A, Martin DK. Factors affecting the incidence of infection in hip and knee replacement: an analysis of 5277 cases. J Bone Joint Surg Am Br 2010; 92: 1128-33. [ Links ]
57. Pulido L, Ghanem E, Joshi A, Purtill JJ, Parvizi J. Periprosthetic joint infection: the incidence, timing, and predisposing factors. Clin Orthop Relat Res 2008; 466: 1710-5. [ Links ]
58. Cordero-Ampuero J, Gonzalez-Fernandez E, Martinez-Velez D, Esteban J. Are antibiotics necessary in hip arthroplasty with asymptomatic bacteriuria? Seeding risk with/without treatment. Clin Orthop Relat Res 2013; 471: 3822-9. [ Links ]
59. Sousa R, Munoz-Mahamud E, Quayle J, et al. Is asymptomatic bacteriuria a risk factor for prosthetic joint infection? Clin Infect Dis 2014; 59: 41-7. [ Links ]
60. Koulouvaris P, Sculco P, Finerty E, Sculco T, Sharrock NE. Relationship between perioperative urinary tract infection and deep infection after joint arthroplasty. Clin Orthop Relat Res 2009; 467: 1859-67. [ Links ]
61. Gou W, Chen J, Jia Y, Wang Y. Preoperative asymptomatic leucocyturia and early prosthetic joint infections in patients undergoing joint arthroplasty. J Arthroplasty 2014; 29: 473-6. [ Links ]
62. Johnson R, Jameson SS, Sanders RD, et al. Reducing surgical site infection in arthroplasty of the lower limb: A multi-disciplinary approach. Bone Joint Res 2013; 2: 58-65. [ Links ]
63. Kameda H, Kanbe K, Sato E, et al. Continuation of methotrexate resulted in better clinical and radiographic outcomes than discontinuation upon starting etanercept in patients with rheumatoid arthritis: 52-week results from the JESMR study. J Rheumatol 2011; 38: 1585-92. [ Links ]
64. Grennan DM, Gray J, Loudon J, Fear S. Methotrexate and early postoperative complications in patients with rheumatoid arthritis undergoing elective orthopaedic surgery. Ann Rheum Dis 2001; 60: 214-7. [ Links ]
65. Carpenter MT, West SG, Vogelgesang SA, Casey Jones DE. Postoperative joint infections in rheumatoid arthritis patients on methotrexate therapy. Orthopedics 1996; 19: 207-10. [ Links ]
66. Ding T, Ledingham J, Luqmani R, et al. BSR and BHPR rheumatoid arthritis guidelines on safety of anti-TNF therapies. Rheumatology 2010; 49: 2217-9. [ Links ]
67. Marik PE, Varon J. Requirement of perioperative stress doses of corticosteroids: a systematic review of the lite-rature. Arch Surg 2008; 143: 1222-6. [ Links ]
68. Bozic KJ, Lau E, Kurtz S, et al. Patient-related risk factors for periprosthetic joint infection and postoperative mortality following total hip arthroplasty in Medicare patients. J Bone Joint Surg Am 2012; 94: 794-800. [ Links ]
69. De Baun B. Evaluation of the antimicrobial properties of an alcohol-free 2% chlorhexidine gluconate solution. AORN J 2008; 87: 925-33. [ Links ]
70. Rezapoor M, Parvizi J. Prevention of periprosthetic joint infection. J Arthroplasty 2015; 30: 902-7. [ Links ]
71. Zywiel MG, Daley JA, Delanois RE, Naziri Q, Johnson AJ, Mont MA. Advance pre-operative chlorhexidine reduces the incidence of surgical site infections in knee arthroplasty. Int Orthop 2011; 35: 1001-6. [ Links ]
72. Karki S, Cheng AC. Impact of non-rinse skin cleansing with chlorhexidine gluconate on prevention of healthcare-associated infections and colonization with multi-resistant organisms: a systematic review. J Hosp Infect 2012; 82: 71-84. [ Links ]
73. Tanner J, Norrie P, Melen K. Preoperative hair removal to reduce surgical site infection. Cochrane Database Syst Rev 2011: CD004122. [ Links ]
74. Seropian R, Reynolds BM. Wound infections after preoperative depilatory versus razor preparation. Am J Surg 1971; 121: 251-4. [ Links ]
75. Lee J, Singletary R, Schmader K, Anderson DJ, Bolognesi M, Kaye KS. Surgical site infection in the elderly following orthopaedic surgery. Risk factors and outcomes. J Bone Joint Surg Am 2006; 88: 1705-12. [ Links ]
76. Sewell M, Adebibe M, Jayakumar P, et al. Use of the WHO surgical safety checklist in trauma and orthopaedic patients. Int Orthop 2011; 35: 897-901. [ Links ]
77. Ritter MA. Intraoperative controls for bacterial contamination during total knee replacement. Orthop Clin North Am 1989; 20: 49-53. [ Links ]
78. Olsen MA, Nepple JJ, Riew KD, et al. Risk factors for surgical site infection following orthopaedic spinal operations. J Bone Joint Surg Am 2008; 90: 62-9. [ Links ]
79. Parry MF, Grant B, Yukna M, et al. Candida osteomyelitis and diskitis after spinal surgery: an outbreak that implicates artificial nail use. Clin Infect Dis 2001; 32: 352-7. [ Links ]
80. Braswell ML, Spruce L. Implementing AORN recommended practices for surgical attire. AORN J 2012; 95: 122-37; quiz 138-140. [ Links ]
81. Pan A, Ambrosini L, Patroni A, et al. Adherence to surgical site infection guidelines in Italian cardiac surgery units. Infection 2009; 37: 148-52. [ Links ]
82. Allen G. Implementing AORN recommended practices for environmental cleaning. AORN J 2014; 99: 570-9; quiz 580-572. [ Links ]
83. Evans RP. Current concepts for clean air and total joint arthroplasty: laminar airflow and ultraviolet radiation: a systematic review. Clin Orthop Relat Res 2011; 469: 945-53. [ Links ]
84. Sossai D, Dagnino G, Sanguineti F, Franchin F. Mobile laminar air flow screen for additional operating room ventilation: reduction of intraoperative bacterial contamination during total knee arthroplasty. J Orthop Traumatol 2011; 12: 207-11. [ Links ]
85. Tanner J. Double gloving to reduce surgical cross-infection. J Perioper Pract 2006; 16: 571. [ Links ]
86. Kearns KA, Witmer D, Makda J, Parvizi J, Jungkind D. Sterility of the personal protection system in total joint arthroplasty. Clin Orthop Relat Res 2011; 469: 3065-9. [ Links ]
87. Chen Y, Liu X, Cheng CH, et al. Leukocyte DNA damage and wound infection after nitrous oxide administration: a randomized controlled trial. Anesthesiology 2013; 118: 1322-31. [ Links ]
88. Sanders RD, Weimann J, Maze M. Biologic effects of nitrous oxide: a mechanistic and toxicologic review. Anesthesiology 2008; 109: 707-22. [ Links ]
89. Merollini KM, Crawford RW, Whitehouse SL, Graves N. Surgical site infection prevention following total hip arthroplasty in Australia: a cost-effectiveness analysis. Am J Infect Control 2013; 41: 803-9. [ Links ]
90. Bratzler DW, Houck PM, Surgical Infection Prevention Guidelines Writers W, et al. Antimicrobial prophylaxis for surgery: an advisory statement from the National Surgical Infection Prevention Project. Clin Infect Dis 2004; 38: 1706-15. [ Links ]
91. Merollini KM, Crawford RW, Graves N. Surgical treatment approaches and reimbursement costs of surgical site infections post hip arthroplasty in Australia: a retrospective analysis. BMC Health Serv Res 2013; 13: 91. [ Links ]
92. Tornero E, Garcia-Ramiro S, Martinez-Pastor JC, et al. Prophylaxis with teicoplanin and cefuroxime reduces the rate of prosthetic joint infection after primary arthroplasty. Antimicrob Agents Chemother 2015; 59: 831-7. [ Links ]
93. Classen DC, Evans RS, Pestotnik SL, Horn SD, Menlove RL, Burke JP. The timing of prophylactic administration of antibiotics and the risk of surgical-wound infection. N Engl J Med 1992; 326: 281-6. [ Links ]
94. Friedman RJ, Friedrich LV, White RL, Kays MB, Brundage DM, Graham J. Antibiotic prophylaxis and tourniquet inflation in total knee arthroplasty. Clin Orthop Relat Res 1990: 17-23. [ Links ]
95. Mauerhan DR, Nelson CL, Smith DL, et al. Prophylaxis against infection in total joint arthroplasty. One day of cefuroxime compared with three days of cefazolin. J Bone Joint Surg Am 1994; 76: 39-45. [ Links ]
96. Sewick A, Makani A, Wu C, O’Donnell J, Baldwin KD, Lee GC. Does dual antibiotic prophylaxis better prevent surgical site infections in total joint arthroplasty? Clin Orthop Relat Res 2012; 470: 2702-7.
97. Dubrovskaya Y, Tejada R, Bosco J 3rd, et al. Single high dose gentamicin for perioperative prophylaxis in orthopedic surgery: Evaluation of nephrotoxicity. SAGE Open Med 2015; 3: 2050312115612803. [ Links ]
98. Tetreault MW, Wetters NG, Aggarwal V, Mont M, Parvizi J, Della Valle CJ. The Chitranjan Ranawat Award: Should prophylactic antibiotics be withheld before revision surgery to obtain appropriate cultures? Clin Orthop Relat Res 2014; 472: 52-6. [ Links ]
99. Shahi A, Parvizi J. Prevention of periprosthetic joint infection. Arch Bone Jt Surg 2015; 3: 72-81. [ Links ]














