Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) vol.78 no.2 Ciudad Autónoma de Buenos Aires abr. 2018
ARTÍCULO ESPECIAL
Desarrollo de un producto anti-toxina shiga para la prevención del síndrome urémico hemolítico
Yanina Hiriart*, Romina Pardo, Lucas Bukata, Constanza Lauché#, Luciana Muñoz, Mariana Colonna, Fernando Goldbaum*, Santiago Sanguineti, Vanesa Zylberman*
Inmunova S.A., Buenos Aires, Argentina
* Investigador del Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET),
# Becaria doctoral CONICET
Dirección postal: Vanesa Zylberman, 25 de Mayo 1021, CP1650, San Martín, provincia Buenos Aires.
e-mail: vzylberman@inmunova.com
Recibido: 7-XI-2017
Aceptado: 18-I-2018
Resumen
El síndrome urémico hemolítico (SUH) típico es una enfermedad huérfana causada por cepas de Escherichia coli productoras de toxina Shiga (Stx) y caracterizada por daño renal agudo, anemia hemolítica microangiopática y plaquetopenia. Es endémico en Argentina, el país con mayor incidencia de SUH en el mundo. Debido al rol fundamental de la Stx en su patogenia, se puede considerar que, como otras toxemias conocidas, el SUH podría ser tratado con anticuerpos. Este trabajo describe el desarrollo de un nuevo tratamiento capaz de neutralizar el efecto tóxico de distintas variantes de la Stx. El tratamiento consiste en fragmentos F(ab')2 provenientes de un antisuero equino cuya eficacia y potencia contra Stx1 y Stx2 se comprobó en diferentes modelos preclínicos. El producto mostró ser seguro en animales, presentó la farmacocinética descripta para compuestos similares y se pudo establecer una posible ventana terapéutica para su adecuada administración. En conjunto, los resultados preclínicos obtenidos validan la realización de un estudio clínico de primer uso en humanos. En dicho estudio, que se realizará en el Hospital Italiano de Buenos Aires, se analizará la seguridad y la farmacocinética del producto en voluntarios adultos sanos. Estos resultados sentarán las bases para la realización del estudio clínico fase II en pacientes pediátricos con infección por cepas de E. coli productoras de Stx.
Palabras clave: Síndrome urémico hemolítico; Escherichia coli productoras de toxina Shiga; Antisuero; Tratamiento.
Abstract
Development of a product anti-Shiga toxin for prevention of the hemolytic uremic syndrome
The typical hemolytic uremic syndrome (HUS) is an orphan disease caused by Shiga toxin(Stx) -producing Escherichia coli strains and characterized by acute kidney damage, microangiopathic hemolytic anemia and low platelet count. It is endemic in Argentina, the country with the highest incidence of HUS in the world. Stx is essential for its development and therefore, HUS is considered a toxemic non-bacteremic disorder, which could be treated with antibodies. Herein we describe the development of a new treatment capable of neutralizing the toxic effect of Stx and its variants. The treatment consists of F(ab')2 fragments from an equine antiserum whose efficacy and potency against Stx1 and Stx2 were proved in different preclinical models. The product was shown to be safe in animals. Furthermore, the anti-Stx F(ab')2 pharmacokinetic was shown to be similar to that of analogous compounds and a therapeutic window for its administration was determined. Altogether, these preclinical results warrant testing in humans. The phase I clinical trial will be performed at the Hospital Italiano in Buenos Aires to evaluate the safety and pharmacokinetics of the product in healthy adult volunteers. Based on the results of this study, a phase II clinical trial will be planned in pediatric patients diagnosed with infection by Stx-producing E. coli strains.
Key words: Hemolytic-Uremic Syndrome; Shiga-Toxigenic Escherichia coli; Antiserum; Treatment.
El síndrome urémico hemolítico (SUH) típico es una enfermedad causada por la bacteria Escherichia coli productora de toxinas Shiga (STEC) para la cual, hasta el momento, no se cuenta con tratamiento específico. Su cuadro clínico incluye anemia hemolítica microangiopática, plaquetopenia y compromiso multiorgánico. Afecta principalmente el riñón, el sistema digestivo y el nervioso; otros órganos como el páncreas y el corazón también pueden resultar afectados. Esta enfermedad tiene relevancia en nuestro país por ser endémica. Argentina presenta anualmente la incidencia más alta a nivel mundial, con alrededor de 10 casos/100 000 niños menores de 5 años1. Como consecuencia, el SUH es la principal causa pediátrica de insuficiencia renal aguda y la segunda de insuficiencia renal crónica en nuestro país, además de ser responsable del 9% de los trasplantes de riñón en niños y adolescentes. En otros países como Estados Unidos, Canadá, Reino Unido, Japón y Alemania, el SUH se presenta en brotes periódicos2-4.
El reservorio principal de las cepas de STEC es el ganado bovino, motivo por el cual la infección se asocia principalmente al consumo de carne contaminada mal cocida, aunque el contagio también puede producirse por el consumo de agua, vegetales, jugos y lácteos contaminados o no pasteurizados. La transmisión persona a persona de la bacteria también está descripta para esta enfermedad5.
Progresión de la infección y ventana terapéutica
En la Fig. 1 se muestra la evolución del proceso desde la infección hasta el desarrollo de SUH. Los primeros síntomas se presentan alrededor de tres días luego de la infección. Entre los días 1 y 3 después de haber comenzado los síntomas se presenta diarrea sanguinolenta, lo cual deriva en la hospitalización del paciente. En esta instancia, el médico indica un análisis para diagnosticar la infección por STEC. Las muestras de materia fecal o suero son derivadas a las unidades centinela del Sistema Nacional de Vigilancia Epidemiológica por Laboratorios de Argentina (SIVILA) o directamente al Laboratorio Nacional de Referencia. Una vez aislada la bacteria, es posible subtipificar la toxina que produce. La diarrea se resuelve hacia el día 7, lo que resulta en la resolución espontánea del cuadro en un 85% de los casos. Los pacientes que progresan a SUH reciben tratamiento de sostén acorde a la gravedad de su estado. El daño generado en los principales órganos afectados se debe a la toxina Shiga (Stx) producida por la bacteria. Luego de una infección, las cepas STEC pueden colonizar el intestino y dañar la barrera epitelial. Esto permite que la toxina liberada por la bacteria alcance el torrente sanguíneo y llegue a los diferentes órganos blanco. Se conocen dos tipos de toxinas, Stx1 y Stx2, con sus respectivas variantes. Las cepas productoras de Stx2a, Stx2c y Stx2d son las más frecuentemente asociadas con el desarrollo de SUH6, 7. Considerando esto, el diagnóstico temprano resulta fundamental.

Fig. 1. Progresión de la infección por Escherichia coli productora de toxinas Shiga en niños.
Actualmente no se dispone de un tratamiento efectivo de la enfermedad, y se realiza únicamente tratamiento de sostén. Ante el diagnóstico de infección por STEC, se requiere la hospitalización del paciente y la aplicación de terapia de expansión de volumen para mantener el nivel de hidratación y monitorear la progresión a SUH. La indicación de antibióticos y antiespasmódicos está contraindicada. En los casos más graves se recurre a diálisis y transfusiones. Con los cuidados adecuados, la mortalidad alcanza un 3-5%. En el 39% de los sobrevivientes la enfermedad deja secuelas como insuficiencia renal crónica, hipertensión y proteinuria8. El tiempo transcurrido entre la aparición de los síntomas y el desarrollo del síndrome sugiere la existencia de una ventana terapéutica en donde la administración de un tratamiento que neutralice la Stx detendría la toxemia, evitando la progresión a SUH y minimizando el daño generado por la misma. Esa ventana comprende los días transcurridos entre el comienzo y la resolución de la diarrea sanguinolenta (Fig. 1).
Alternativas terapéuticas desarrolladas contra la toxina Shiga
En los últimos años se han desarrollado algunas estrategias orientadas a capturar la toxina secretada durante la colonización bacteriana o liberada al torrente sanguíneo, evitando la interacción con su receptor específico, el glicoesfingolípido globotriaosilceramida (Gb3), presente en los órganos blanco.
En un estudio multicéntrico controlado, se ensayó la administración oral de análogos de Gb3 (SYNSORB-Pk) como tratamiento dirigido específicamente a la captura de la toxina a nivel intestinal. Se evaluó el efecto terapéutico en niños con diagnóstico de SUH asociado a diarrea. El estudio mostró que los pacientes que recibieron SYNSORB-Pk tuvieron similar evolución clínica de la enfermedad que aquellos que no lo recibieron. Esto sugirió que una vez que la toxina se disemina por la circulación sistémica, impedir el pasaje de más Stx a nivel de la barrera intestinal no presentaría mayores beneficios9.
Otra estrategia es la administración de anticuerpos monoclonales humanizados que neutralizan la Stx a nivel sistémico. Por ejemplo, Shigamab®, de Taro Pharmaceuticals es una mezcla de dos anticuerpos monoclonales, dirigidos contra la subunidad A de Stx2 y contra la subunidad B de Stx1. A su vez, Teijin Pharma ha diseñado un anticuerpo monoclonal dirigido contra la subunidad B de Stx2 (Urtoxazumab). Estos anticuerpos han demostrado ser seguros en estudios de Fase I realizados en adultos sanos10, 11. Sin embargo, hasta el momento no se han publicado datos concluyentes de estudios clínicos de Fase II12.
Anticuerpos policlonales como opción terapéutica
Considerando que existen distintas variantes de Stx involucradas en el desarrollo de SUH, los sueros policlonales resultan una excelente opción para una terapia de amplio espectro. Los anticuerpos policlonales reconocen una amplia gama de epitopes, usualmente desarrollan una mayor avidez por sus antígenos afines que los anticuerpos monoclonales y también son capaces de reconocer diferentes variantes de patógenos, venenos o toxinas. El uso de anticuerpos policlonales está establecido para la exposición al virus de la rabia, las mordeduras de serpientes venenosas y las picaduras de alacranes.
Un ejemplo interesante de la aplicación de sueros policlonales como terapia de amplio espectro es el tratamiento del botulismo. BabyBIG fue aprobado en 2003 para el tratamiento de botulismo infantil causado por los tipos A y B. Es un tratamiento a base de inmunoglobulinas purificadas a partir de donantes humanos, inyectados con toxoides (toxinas inactivadas) de diferentes variantes de la neurotoxina. Un estudio clínico realizado durante una década en niños afectados demostró que BabyBIG redujo significativamente los tiempos de ventilación mecánica y hospitalización. Además, el tratamiento fue administrado de modo profiláctico a pacientes con un cuadro de presunta intoxicación. La intervención temprana resultó una estrategia exitosa. Sin embargo, la restringida disponibilidad y el costo muy alto de los sueros policlonales humanos favoreció la implementación de una versión equina para este tratamiento. Así, desde 2013 la Food and Drug Administration (EE.UU.) aprobó el uso de la antitoxina botulínica heptavalente BAT (Emergent BioSolutions) para el tratamiento de botulismo. Este producto consiste en la fracción F(ab')2 purificada a partir de las inmunoglobulinas equinas. En líneas generales, este tipo de productos se está aplicando con éxito en varias situaciones clínicas de emergencia.
Nuevo tratamiento para SUH. Desarrollo de un antisuero neutralizante de toxina Shiga
Considerando las consecuencias del SUH en nuestro país y en el mundo, Inmunova –empresa de biotecnología dedicada a desarrollar productos innovadores en el área de salud– desarrolló un tratamiento capaz de neutralizar las toxinas producidas por cepas STEC. El producto consiste en la fracción F(ab')2 de las inmunoglobulinas equinas obtenidas a partir de sueros hiperinmunes.
Nuestra tecnología Immuno Multi Carrier (IMC), es una plataforma que puede ser decorada con antígenos de interés a fin de obtener una fuerte respuesta inmune contra ellos. Considerando las propiedades de IMC diseñamos una quimera en la que se logró estabilizar la estructura de StxB en la plataforma IMC. En ratones, la quimera resultante (IMC-Stx) demostró capacidad para inducir una fuerte respuesta inmune humoral en forma duradera. Los anticuerpos producidos protegieron a los animales contra la toxicidad producida por la Stx y neutralizaron sus variantes en ensayos in vitro13. Más aún, se demostró que los anticuerpos anti-StxB inducidos, al ser transmitidos en forma pasiva, protegen contra el desafío con Stx14. Estos resultados indicaron la factibilidad de utilizar la quimera IMC-Stx como inmunógeno para el desarrollo de un suero terapéutico contra Stx.
Para la manufactura del antisuero se trabajó de manera conjunta con el Instituto Biológico Argentino S.A.I.C. - BIOL. El proceso comenzó con la purificación de los inmunógenos IMC-Stx2B e IMC-Stx1B en Inmunova, bajo un procedimiento con normas BPL (Buenas prácticas de laboratorio). Las quimeras IMC-Stx1B e IMC-Stx2B purificadas se utilizaron para inmunizar caballos y obtener sueros hiperinmunes anti-Stx1 y anti-Stx2 de muy altos títulos (>1/500 000). Se estableció un plan de inmunización de los caballos y se evaluó la respuesta inmune desarrollada contra Stx1 y Stx2 por ELISA. Una vez completado el plan de inmunización, se produjo y purificó la fracción F(ab')2 de las inmunoglobulinas equinas mediante tratamiento con pepsina siguiendo un procedimiento BPM (Buenas prácticas de manufactura) realizado en Biol. Así se generó el producto INM-004 lote 3945 (Fig. 2). Para la liberación del lote se realizó un control de calidad de acuerdo a las normas vigentes que incluye análisis de carga bacteriana, nivel de endotoxinas, potencia, entre otros.
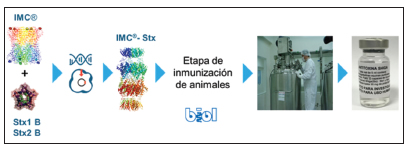
Fig. 2. Proceso productivo de INM-004.
Evaluación de la seguridad, potencia y perfil farmacocinético del producto
Se realizaron diversos ensayos destinados a evaluar el perfil farmacocinético y de seguridad del INM-004 en el Centro de Medicina Comparada del Instituto de Ciencias Veterinarias del Litoral, UNL-CONICET. Utilizando el ensayo Gold Standard de citotoxicidad en células Vero se comprobó la eficacia del producto contra Stx1a y Stx2a. A su vez, se demostró que es capaz de neutralizar distintas variantes de las toxinas relacionadas con el desarrollo de SUH, demostrando su amplio espectro de actividad.
Los estudios preclínicos realizados in vivo (ratones y conejos) permitieron evaluar la farmacología, farmacocinética, eficacia y seguridad de INM-004. Se realizaron estudios de cinética a dosis única y a dosis repetidas, en ambas especies. En los estudios de dosis única, el producto mostró una farmacocinética compatible con la correspondiente a compuestos similares, la cual se mantuvo en los estudios de dosis repetidas. La dosis máxima utilizada en ratones, 116 mg/kg, fue bien tolerada y no se observaron efectos adversos significativos. También se realizaron estudios de toxicidad a dosis única y a dosis repetida en ratones y conejos con el fin de evaluar los efectos del producto INM-004 sobre parámetros clínicos incluyendo examen de piel, mucosas, actividad motora y patrones de conducta, junto con parámetros hematológicos y bioquímicos. En estos estudios no se evidenciaron alteraciones clínicas ni subclínicas significativas asociadas al tratamiento, aún en un esquema de administración repetida de altas dosis.
Adicionalmente, se optimizó un modelo murino para emular la liberación progresiva de toxina que tiene lugar durante una infección por STEC. Se administró una dosis letal de Stx2 dividida en dosis subletales durante 4 días consecutivos. En este modelo, el producto logró rescatar a los animales del efecto tóxico, incluso cuando fue administrado 48 h después de iniciar la administración de toxina. De acuerdo con estos resultados, la administración del producto resultaría efectiva incluso luego de la exposición a la Stx, lo que sugiere la existencia de una ventana terapéutica para iniciar el tratamiento.
Para descartar cualquier tipo de interacción del producto INM-004 con tejidos humanos, se realizó un estudio de reactividad cruzada. Sobre un panel de 34 tejidos provenientes de tres donantes cadavéricos no existió unión específica del producto a cualquiera de todos los tejidos ensayados.
Perspectivas y planificación de estudios clínicos
Los resultados del conjunto de estudios preclínicos realizados respaldan la administración del producto en el contexto clínico. Se realizará un estudio clínico de primer uso (Fase I) en humanos en dos etapas, prospectivo, aleatorizado, controlado con placebo para evaluar seguridad, tolerabilidad y farmacocinética (PK) del producto INM-004. Se enrolarán 14 voluntarios adultos sanos de entre 18 y 55 años.
En la primera etapa se usará un diseño de escalamiento de dosis, comenzando con la administración de una dosis simple de 2 mg/kg, para luego aumentarla a 4 mg/kg. Posteriormente, una vez confirmada la seguridad del producto a las dosis estudiadas, se realizará un esquema de dosis repetidas administrando 3 dosis de producto de 2 o 4 mg/kg (Fig. 3).
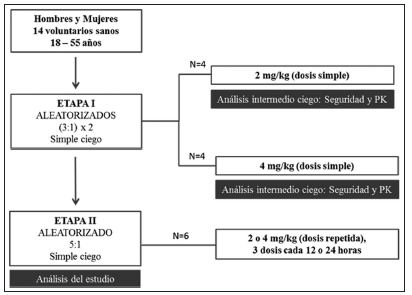
Fig. 3. Diseño del estudio clínico de Fase I (primer uso en humanos).
PK: farmacocinética
Los resultados de este estudio Fase I serán presentados ante ANMAT para su evaluación, a fin de solicitar autorización para la realización de un estudio Fase II en pacientes pediátricos. En esta Fase II, cuyo inicio está previsto en la segunda mitad de 2018, se evaluará eficacia y seguridad del producto. Cumpliendo con la planificación prevista, se espera que el producto llegue al mercado en el año 2020.
Para el diseño de este estudio consideramos fundamental la participación de todos los actores relevantes en el abordaje de esta enfermedad. Es por esto que desde el inicio del proyecto hemos establecido contacto con bioquímicos, pediatras y nefrólogos de los principales centros de atención de SUH de nuestro país. En este estudio serán incluidos pacientes pediátricos que presenten diarrea sanguinolenta y diagnóstico comprobado de infección por STEC. Se espera desarrollar un protocolo de investigación clínica cuyo objetivo, criterios de inclusión y exclusión, y definición de puntos primarios de evaluación sean consensuados con líderes de opinión de la comunidad médica, con expertos del área de diagnóstico en microbiología, y con las agencias regulatorias de Argentina, EE.UU. y Europa.
Un desafío importante será la capacidad de identificar rápidamente y con exactitud los pacientes infectados con STEC. Hay una estrecha ventana de tiempo para intervenir y prevenir las posibles secuelas relacionadas al SUH. Los pacientes generalmente buscan atención alrededor del día 4 o 5 del inicio de la diarrea. El síndrome urémico hemolítico va a comenzar 72-96 horas después. Por lo tanto, en un ensayo que implica la intervención con un fármaco que neutraliza la toxina es fundamental realizar precozmente el diagnóstico preciso y estar preparados para intervenir de inmediato. Es por esto que se está trabajando en la implementación de un test rápido de detección de Stx en materia fecal, el cual está siendo validado con el Laboratorio Nacional de Referencia del Servicio Fisiopatogenia del Instituto de Enfermedades Infecciosas, ANLIS Dr. Carlos G. Malbrán. Este método permitiría realizar una primera selección de pacientes potenciales que podrían beneficiarse de este tratamiento. Igualmente, hay que destacar que es de fundamental importancia seguir el algoritmo de tamizaje e identificación de STEC desarrollado por el Laboratorio Nacional de Referencia. Estaremos trabajando en conjunto con dicho laboratorio para identificar y validar el método adecuado de diagnóstico precoz y luego implementarlo en los distintos laboratorios de las unidades centinelas.
En conjunto con los criterios de inclusión y exclusión que se establezcan para el protocolo del estudio clínico, se definirá la población de pacientes a la cual se podrá administrar el producto. Aún hay resultados pendientes para poder definir la dosificación, pero se estima que el producto se administrará en forma de infusión en una única dosis o en tres dosis secuenciales una vez por día.
La realización de un estudio de estas características implica un enorme esfuerzo y un compromiso de todos los actores involucrados en el diagnóstico y tratamiento del SUH. Tenemos la fuerte convicción de que vale la pena, en pos de obtener una terapia para esta enfermedad de tanta relevancia en nuestro país y en el mundo.
Agradecimientos: Al Servicio Fisiopatogenia INEI-ANLIS Dr. Carlos G. Malbrán por la transferencia de variantes de Stx utilizadas en la caracterización del producto y el asesoramiento en la validación del test de screening rápido. Al Instituto Biológico Argentino S.A.I.C. – BIOL por la manufactura del INM-004. Al Centro de Medicina Comparada, Instituto de Ciencias Veterinarias del Litoral, UNL-CONICET por la realización de los ensayos preclínicos. A la Sección Farmacología Clínica, Hospital Italiano de Buenos Aires por la realización del estudio clínico Fase I. A la ANMAT por incluir el proyecto para el desarrollo del tratamiento para SUH en el “Programa para Apoyo a la Innovación en Medicamentos y Productos para la Salud”.
Conflicto de intereses: Ninguno para declarar
1. Presidencia de la Nación. Ministerio de Salud. Boletines. Encuesta: Boletín Integrado de Vigilancia. En: http://www.msal.gob.ar/index.php/home/boletin-integrado-de-vigilancia; consultado diciembre 2017. [ Links ]
2. Terajima J, Iyoda S, Ohnishi M, Watanabe H. Shiga Toxin (Verotoxin)-Producing Escherichia coli in Japan. Microbiol Spectr 2014; 2. DOI: 10.1128/microbiolspec.EHEC-0011-2013. [ Links ]
3. Luna-Gierke RE, Griffin PM, Gould LH, et al. Outbreaks of non-O157 Shiga toxin-producing Escherichia coli infection: USA. Epidemiol Infect 2014; 142: 2270-80. [ Links ]
4. Burger R. EHEC O104:H4 in Germany 2011: Large outbreak of bloody diarrhea and haemolytic uraemic syndrome by Shiga toxin-producing E. coli via contaminated food. Improving Food Safety Through a One Health Approach: Workshop. Institute of Medicine (US). Washington (DC): National Academies Press (US); 2012. En: http://www.ncbi.nlm.nih.gov/books/NBK114499/; consultado diciembre 2017. [ Links ]
5. Rivas M, Miliwebsky E, Chinen I, Deza N, Leotta GA. Epidemiologia del sindrome uremico hemolitico en Argentina. Diagnóstico del agente etiológico, reservorios y vías de transmisión. Medicina (B Aires) 2006; 66 (Supl. III): 27-32. [ Links ]
6. Boerlin P, McEwen SA, Boerlin-Petzold F, Wilson JB, Johnson RP, Gyles CL. Associations between virulence factors of Shiga toxin-producing Escherichia coli and disease in humans. J Clin Microbiol 1999; 37: 497-503. [ Links ]
7. Bielaszewska M, Friedrich AW, Aldick T, Schürk-Bulgrin R, Karch H. Shiga toxin activatable by intestinal mucus in Escherichia coli isolated from humans: predictor for a severe clinical outcome. Clin Infect Dis 2006; 43: 1160-7. [ Links ]
8. Siegler RL, Milligan MK, Burningham TH, Christofferson RD, Shien-young C, Jorde LB. Long-term outcome and prognostic indicators in the hemolytic-uremic syndrome. J Pediatr 1991; 118: 195-200. [ Links ]
9. Trachtman H, Cnaan A, Christen E, et al. Effect of an oral Shiga toxin-binding agent on diarrhea-associated hemolytic uremic syndrome in children: a randomized controlled trial. JAMA 2003; 290: 1337-44. [ Links ]
10. Dowling TC, Chavaillaz P, Young DG, et al. Phase 1 safety and pharmacokinetic study of chimeric murine-human monoclonal antibody c alpha Stx2 administered intravenously to healthy adult volunteers. Antimicrob Agents Chemother 2005; 49: 1808-12. [ Links ]
11. Bitzan M, Poole R, Mehran M, et al. Safety and pharmacokinetics of chimeric anti-shiga toxin 1 and anti-shiga toxin 2 monoclonal antibodies in healthy volunteers. Antimicrob Agents Chemother 2009; 53: 3081-7. [ Links ]
12. López EL, Contrini MM, Glatstein E, et al. Safety and pharmacokinetics of urtoxazumab, a humanized monoclonal antibody, against Shiga-like toxin 2 in healthy adults and in pediatric patients infected with Shiga-like toxin-producing Escherichia coli. Antimicrob Agents Chemother 2010; 54: 239-43. [ Links ]
13. Mejias MP, Ghersi G, Craig PO, et al. Immunization with a chimera consisting of the B subunit of Shiga toxin type 2 and brucella lumazine synthase confers total protection against Shiga toxins in mice. J Immunol 2013; 191: 2403-11. [ Links ]
14. Mejias MP, Cabrera G, Fernández-Brando RJ, et al. Protection of mice against Shiga toxin 2 (Stx2)-associated damage by maternal immunization with a brucella lumazine synthase-Stx2 B subunit chimera. Infect Immun 2014; 82: 1491-9. [ Links ]














