Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) vol.78 no.3 Ciudad Autónoma de Buenos Aires jun. 2018
ARTÍCULO ESPECIAL
Efectos cardiovasculares de los nuevos fármacos no insulínicos en diabetes
Guillermo Dieuzeide1, Félix Puchulu2, Hugo Sanabria3, Isaac Sinay3
1 Centro de Atención Integral en Diabetes, Endocrinología y Metabolismo, Servicio de Endocrinología y Diabetes, Hospital Nuestra Señora del Carmen. Chacabuco, Buenos Aires,
2 Hospital de Clínicas José de San Martín, Buenos Aires,
3 Unidad de Diabetes, Instituto Cardiovascular de Buenos Aires (ICBA), Buenos Aires, Argentina
Dirección postal: Guillermo Dieuzeide, San Lorenzo 251, 6740 Chacabuco, Pcia. Buenos Aires, Argentina
e-mail: dieuzeideg@gmail.com
Recibido: 7-II-2018
Aceptado: 20-IV-2018
Resumen
La diabetes mellitus constituye actualmente un grave problema de salud pública a nivel mundial, que incrementa el riesgo de presentar complicaciones tanto microvasculares como macrovasculares. Aunque lograr los objetivos de glucemia recomendados reduce el riesgo de complicaciones microvasculares, el efecto de los fármacos para tratar la hiperglucemia sobre las complicaciones macrovasculares y la muerte cardiovascular es motivo de preocupación. En este contexto, las agencias regulatorias han modificado la normativa para la aprobación de nuevos fármacos en diabetes, de forma que establecen la necesidad de demostrar que son capaces de disminuir la glucemia junto con una evaluación sólida de la seguridad cardiovascular. El objetivo de este trabajo es revisar los efectos cardiovasculares de las nuevas familias de fármacos no insulínicos, en especial en su efecto sobre el riesgo de eventos cardiovasculares mayores. En los últimos años, finalmente, se ha confirmado que algunos fármacos para tratar la diabetes no solo son seguros desde el punto de vista cardiovascular, sino que incluso han mostrado capacidad para reducir el riesgo de enfermedad cardiovascular en la diabetes mellitus tipo 2. La evidencia obtenida ha determinado la actualización de algunas guías terapéuticas vigentes cuando el riesgo cardiovascular debería considerarse una variable fundamental al momento de la elección terapéutica en pacientes con diabetes.
Palabras clave: Diabetes mellitus; Agonistas de los receptores para el péptido 1 similar al glucagón (AR GLP-1); Inhibidores del cotransportador 2 de sodio y glucosa (iSGLT2); Seguridad cardiovascular; Eventos cardiovasculares mayores (MACE).
Abstract
Cardiovascular effects of new non-insulinic anti-diabetes drugs
Diabetes mellitus is currently a serious public health problem worldwide, that increases the risk of presenting microvascular and macrovascular complications. Although achieving the recommended blood glucose goals reduces the risk of microvascular complications, the effect of the drugs used to treat hyperglycemia on macrovascular complications and cardiovascular death is a cause for concern. In this context, the regulatory agencies have modified the regulations for the approval of new drugs in diabetes, by adding the need to demonstrate that they are capable of lowering blood glucose levels together with a solid assessment of cardiovascular safety. The objective of this study is to review the cardiovascular effects of the new families of non-insulin drugs, with special emphasis on their effect on the risk of major cardiovascular events. In recent years, it has finally been confirmed that some of the drugs used to treat diabetes are not only safe from a cardiovascular point of view, but have even shown capacity to reduce the risk of cardiovascular disease in type 2 diabetes mellitus. The evidence obtained determined the updating of some current therapeutic guidelines when cardiovascular risk should be considered a fundamental variable at the time of therapeutic choice in patients with diabetes.
Key words: Diabetes mellitus; Glucagon-like peptide-1 receptor agonists (GLP-1 RA); Sodium-glucose transporter-2 (SGLT2) inhibitor; Cardiovascular safety; Major cardiovascular events (MACE).
Para las personas con diabetes mellitus tipo 2 (DMT2), la enfermedad cardiovascular (ECV) es la principal causa de morbilidad y mortalidad, y es responsable de la muerte de más del 60% de los pacientes. En un porcentaje aún mayor, se asocia con comorbilidad grave1-4. El riesgo de enfermedad coronaria es de 2 a 4 veces mayor y el de amputación de miembros inferiores es 25 veces más alto en presencia de DMT2. Se ha informado que la expectativa de vida se reduce de 6 a 7 años en los pacientes mayores de 40 años1, y si además esa persona tuviera un evento macrovascular, la expectativa de vida se reduce a la mitad5. Si se considera que los casos de ECV son solo una fracción visible de la población de riesgo, que el número de personas con DMT2 es creciente y que la prevalencia de ECV es 5 veces mayor en personas con diabetes vs. la población general6, resulta prioritario identificar los fármacos capaces de disminuir la mortalidad y la morbilidad por ECV2, 4, 7.
Seguridad cardiovascular y drogas hipoglucemiantes
Actualmente, se dispone de una amplia variedad de agentes terapéuticos, con diferentes mecanismos de acción, lo que ha permitido que los objetivos del tratamiento de la DMT2 se desplacen desde el alivio sintomático y el control de la glucemia hacia la prevención de las complicaciones2, 4. La evidencia disponible ha demostrado que el control intensivo de la glucemia estuvo asociado a la reducción del riesgo de complicaciones microvasculares (retinopatía y nefropatía), en tanto el impacto sobre las complicaciones macrovasculares fue modesto y no significativo8. Sin embargo, en el seguimiento a 10 años posterior al United Kingdom Prospective Diabetes Study (UKPDS), se evidenció una reducción del riesgo de infarto de miocardio (IM) y muerte por cualquier causa8, 9. Asimismo, la intervención multifactorial en el estudio STENO-2 mostró un impacto favorable sobre la enfermedad macrovascular y muerte10. Algunos autores han definido la “paradoja macrovascular” como el fracaso para reducir las complicaciones macrovasculares en igual grado que aquellas microvasculares, a pesar de una disminución similar en los valores de hemoglobina glicosilada en plasma (HbA1c)3. Observaciones epidemiológicas a largo plazo, así como algunos ensayos clínicos con insulina y fármacos orales, han revelado que el control intensivo de la glucemia, con mayor riesgo de eventos de hipoglucemia, puede resultar deletéreo para las personas con alto riesgo de ECV8, 11, como en los estudios ACCORD, ADVANCE Y VADT, los cuales observaron que el estricto control glucémico no demostró mejorar los resultados cardiovasculares (CV)8. La compleja asociación entre el tiempo de evolución de la enfermedad, la edad y la eventual fragilidad de los enfermos, el control de la glucemia y los resultados CV han tenido implicancias en el desarrollo de nuevos agentes para tratar la DMT24, 8. En 2008, debido a la falta de certidumbre acerca de la seguridad CV de algunos fármacos antidiabéticos, la Food and Drug Administration (FDA) de EE.UU. presentó una guía para la industria, en la cual estableció que para aprobar cualquier nuevo agente antidiabético es requisito demostrar que el tratamiento no causa aumentos inaceptables en el riesgo CV4, 12. Posteriormente, la European Medical Agency (EMA) y otras agencias regulatorias establecieron lineamientos similares1, 4, 12.
Para la aprobación de los nuevos agentes antidiabéticos, las guías de la FDA establecen que1, 4, 12:
- En los estudios de fase 2 y 3, la adjudicación de los eventos CV debe ser prospectiva e independiente, para permitir el metaanálisis de dichos eventos en todos los estudios controlados con placebo, de agregado (add-on) a la terapia estándar o con un comparador activo.
- Se deben evaluar los eventos adversos CV mayores (MACE) de 3 puntos, definidos como muerte de causa CV, IM y accidente cerebrovascular (ACV); pueden también incluirse otros criterios de valoración (MACE de 4 puntos o ampliado), como las internaciones debidas a angina inestable, los procedimientos de revascularización de urgencia o insuficiencia cardíaca.
- Se debe incluir una población con riesgo elevado de eventos CV (por ejemplo, con DMT2 avanzada, ancianos, con insuficiencia renal), y se evaluará la seguridad durante al menos dos años.
Es así que, utilizando los valores de riesgo de MACE, se establecen una serie de escenarios probables:
1. Si la evaluación del riesgo resulta en un cociente de riesgos (HR, hazard ratio) sin diferencia entre los grupos, pero con el brazo superior del intervalo de confianza del 95% < 1.3, o resulta en un HR de superioridad, la droga es aprobable y no requiere un estudio de evaluación cardiovascular postmarketing.
2. Si la evaluación del riesgo resulta en un HR sin diferencia entre los grupos, pero con el brazo superior del intervalo de confianza del 95% > 1.3 y < 1.8, la droga es aprobable, pero requiere un estudio de evaluación cardiovascular postmarketing.
3. Si la evaluación del riesgo resulta en un HR sin poder estadístico (pero con el brazo superior del intervalo de confianza del 95% > 1.8), o resulta inferior al comparador (es decir mayor riesgo), la droga no es aprobable (Fig. 1)13. En cumplimiento de estas pautas regulatorias, ha tenido lugar la realización de numerosos ensayos clínicos, muchos de ellos actualmente en curso, diseñados específicamente para evaluar los resultados CV en base a estos criterios de “no inferioridad” en seguridad CV, en comparación con placebo, el cual se refiere a terapia estándar o vs. un comparador activo1, 4, 12. La literatura disponible es abundante en la descripción de las características y los resultados de los estudios con fármacos antidiabéticos, tanto previos como posteriores a los requerimientos de la FDA presentados en 20081-4, 8, 11, 12, 14-20. A los fines de la publicación, y para evitar la extensión innecesaria del texto, esta revisión se centra en los resultados CV con los fármacos antidiabéticos no insulínicos más nuevos: los inhibidores de la enzima dipeptidil peptidasa-4 (iDPP-4), los agonistas de los receptores para el péptido 1 similar al glucagón (AR GLP-1) y los inhibidores del cotransportador 2 de sodio y glucosa (iSGLT2). Estos agentes, su mecanismo de acción básico y forma de administración se presentan en la Tabla 1.

Fig. 1. Criterios de la FDA para el requerimiento de estudios cardiovasculares (CV) de postmarketing13
Tabla 1. Nuevas clases de agentes antidiabéticos13

Características de los estudios centrados en la seguridad CV con los nuevos fármacos en diabetes
Los nuevos agentes antidiabéticos (iDPP-4, AR GLP-1 e iSGLT2) han sido evaluados en una cantidad importante de ensayos clínicos, varios de ellos completados recientemente y otros en curso, en los cuales el principal resultado son los eventos CV mayores, MACE de 3 puntos y MACE de 4 puntos o ampliado, tal como se describió anteriormente8.
Los hallazgos de los estudios centrados en los objetivos CV deben valorarse tomando en consideración varios aspectos propios de su diseño17:
- La población seleccionada presenta enfermedad de más tiempo de evolución; en general, han transcurrido más de 10 años desde el diagnóstico.
- El riesgo de complicaciones CV es elevado; muchos de los pacientes poseen antecedentes de eventos CV previos.
- Los estudios están diseñados para evaluar la seguridad; como se mencionó, se prioriza el riesgo de eventos CV y se requiere demostrar la “no inferioridad” (que no presenta más eventos CV) vs. placebo, si bien algunos estudios lograron mostrar superioridad (que trae aparejado un beneficio CV que no produce el placebo).
- En ambos grupos de comparación (con el agente activo o placebo), los pacientes reciben el mejor tratamiento estándar disponible según las pautas locales de la práctica clínica, y la medicación hipoglucemiante se ajusta para alcanzar un control similar de la HbA1c en todos los pacientes. Mediante este diseño, se “equipara” la glucemia en los grupos comparados, de modo tal que tanto los pacientes tratados con el placebo como con el agente activo alcanzan un descenso similar, no solo en los valores de HbA1c, sino también en los objetivos de control metabólico y tensión arterial, para que, de esta manera, cualquier efecto CV pueda ser atribuido al fármaco en estudio. Ello se logra mediante el agregado de medicación hipoglucemiante en la medida de lo necesario. Además, se permite el manejo habitual de los demás factores de riesgo CV (dislipidemia, hipertensión arterial, etc.), tratando de alcanzar los objetivos que proponen las diferentes guías de tratamiento1.
- El seguimiento de los estudios es generalmente de 2 a 3 años, siendo el más extenso hasta la fecha el del estudio LEADER con liraglutida, con una mediana de 3.8 años, conducido por número de eventos y por tiempo, mientras que el resto de los estudios fueron conducidos solamente por número de eventos1, 15, 21.
Resultados cardiovasculares de interés clínico
En conjunto, los resultados de los estudios disponibles han ratificado la seguridad CV de los nuevos fármacos en diabetes, comparados con placebo. Surgen además observaciones importantes. De manera muy sintética y acorde con los datos disponibles hasta la fecha, los resultados observados con los iDPP-4 han sido neutrales, es decir, que alcanzaron el criterio de no inferioridad vs. placebo con relación a los MACE, aunque no han mostrado superioridad. Entre los AR GLP-1, lixisenatida cumplió con el criterio de no-inferioridad con efecto neutro en relación a los eventos MACE de 4 puntos15; liraglutida y semaglutida han mostrado superioridad con respecto al placebo en la reducción del riesgo en relación a los MACE17, 21, 22; en el estudio EXSCEL, exenatida semanal mostró que el resultado no fue inferior al placebo23, mientras que en el grupo de iSGLT2, empagliflozina y canagliflozina han mostrado superioridad en comparación con placebo7, 24, 25. Las Tablas 2 y 3 describen los principales resultados de interés clínico de los estudios, incluyendo aquellos en los cuales el fármaco antidiabético mostró superioridad frente a placebo: EMPA-REG OUTCOME con empagliflozina, LEADER con liraglutida, SUSTAIN 6 con semaglutida y CANVAS/CANVAS-R con canagliflozina. Los hallazgos de estos cuatro estudios son trascendentes debido a que la diferencia en la HbA1c al final del seguimiento fue clínicamente poco relevante entre los grupos que recibieron el fármaco del estudio o el placebo. Como se mencionó previamente, los pacientes en ambos grupos recibieron el mejor tratamiento estándar, guiado por los valores de la HbA1c8. Por lo tanto, no sería posible atribuir los beneficios CV exclusivamente al descenso de la glucemia.
Tabla 2. Resumen de los estudios cardiovasculares completados y en curso 3, 8, 14, 16, 18, 19, 24

Tabla 3. Comparación de los resultados CV en los estudios que mostraron beneficio8, 18, 19, 24
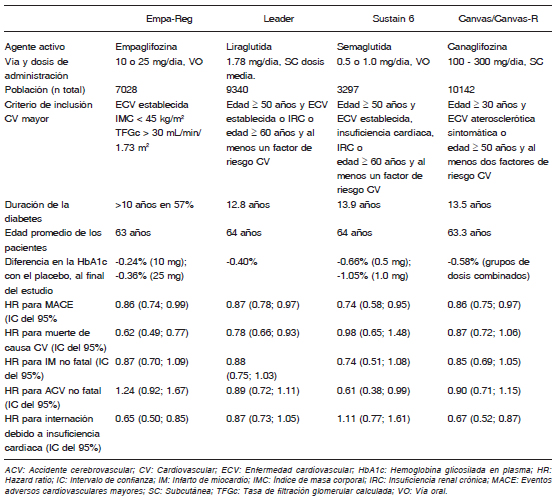
Cada clase de fármaco presenta distintos mecanismos de acción y efectos sobre los factores de riesgo CV, así como sobre otras vías que secundariamente pueden afectar la progresión de la ECV y son independientes del efecto sobre la glucemia3. Está demostrado que algunos fármacos se asocian con una mejoría de los factores de riesgo CV tradicionales (Tabla 4)13, 20; sin embargo, tampoco dichos efectos son suficientes para explicar por qué los resultados observados en los MACE no son homogéneos ni entre los iSGLT2 y los AR GLP-1, ni entre los agentes de la misma clase3, 8, 13. Un aspecto interesante a evaluar es el tiempo desde el inicio del estudio hasta donde comienzan a evidenciarse las diferencias entre los grupos con respecto al objetivo primario compuesto; con empagliflozina, el rápido descenso de la mortalidad, observado aproximadamente a partir de los tres meses en el estudio EMPA-REG OUTCOME, no podría ser explicado por efectos sobre el proceso de aterosclerosis ni por el descenso en el peso corporal, los cuales requerirían más tiempo para evidenciar su impacto a nivel CV. Se ha planteado que este beneficio podría atribuirse a la natriuresis y los cambios hemodinámicos secundarios, sumados a los efectos metabólicos (reducción de glucemia, reducción de masa grasa visceral, reducción del ácido úrico, efecto antiinflamatorio, menor estrés oxidativo y la utilización de cuerpos cetónicos como fuente de energía celular por los miocitos), además del aumento del hematocrito, el cual podría atribuirse a diuresis osmótica, mayor entrega de oxígeno, lo que explicaría el impacto sobre el beneficio CV2, 13,1 6, 26. También se ha intentado brindar explicaciones acerca de la tasa diferencial en las internaciones relacionadas con la insuficiencia cardíaca, en base a los efectos propios de clase. Tanto el uso de empagliflozina como de canagliflozina se asoció a descensos significativos en internación por insuficiencia cardíaca, y se ha planteado que la depleción del volumen intravascular mediado por el efecto natriurético podría ser responsable de este impacto5. Sin embargo, no se descarta una acción directa de estos fármacos sobre el miocardiocito. A nivel experimental, algunos investigadores han observado una modulación del intercambiador Na/H presente en las membranas de los miocardiocitos, con reducción del calcio intracitosólico, es decir, un efecto cardioprotector27, 28. La terapia con liraglutida en el estudio LEADER se asoció con descenso de la mortalidad CV en forma más progresiva a partir de los 12 meses, lo que sugiere la posible prevención del avance de la aterosclerosis y/o mejor control de los factores de riesgo18. En tal sentido, la reducción del riesgo fue concordante en todos los componentes del criterio principal de valoración (muerte de causa CV, IAM y ACV). Liraglutida y semaglutida promovieron el descenso del peso corporal y de la presión arterial, además de mostrar efectos favorables sobre el perfil lipídico12, 19, 22, 25. La presencia de receptores de GLP-1 a nivel de los miocardiocitos auriculares, pero fundamentalmente a nivel de la pared arterial, nos permite pensar que parte de los beneficios observados pueden deberse al efecto directo de estos agonistas sobre el sistema cardiovascular29. ¿Es posible extrapolar los resultados obtenidos con liraglutida y semaglutida a otras drogas de su misma clase? La diferencia de los resultados observados en los estudios ELIXA con lixisenatida y EXSCEL con exenatida plantea al menos la posibilidad de considerar que el impacto CV no es un efecto de clase entre los agonistas de GLP-1. Diferencias en la composición molecular y, por lo tanto, su homología con el GLP-1 humano pueden ser responsables de estos resultados dispares18.
Tabla 4. Efecto general de las nuevas clases de antidiabéticos sobre los factores de riesgo cardiovasculares más frecuentes16, 20

Mientras se aguardan estudios adicionales que nos permitan entender los mecanismos subyacentes sobre el impacto CV de empagliflozina, canagliflozina, liraglutida y semaglutida, las implicancias clínicas de estos resultados deben ser puestas en la perspectiva de las pautas actuales de los algoritmos terapéuticos.
La fisiopatología de las complicaciones macrovasculares en la DMT2 comprende muchos más factores que la hiperglucemia, principal mecanismo de las complicaciones microvasculares18. Intervienen el estrés oxidativo, la hiperinsulinemia, la resistencia a la insulina y también la hipoglucemia, combinados con la predisposición genética, una dieta inadecuada, la inactividad física, el tabaquismo, la dislipidemia, la hipertensión arterial y otros factores3, 18. Por lo tanto, es comprensible que el control de la glucemia per se no sea suficiente para modificar sustancialmente el riesgo de complicaciones macrovasculares en el tiempo de seguimiento de los estudios hasta la fecha. Algunos fármacos podrían controlar múltiples factores de riesgo, con la ventaja adicional de evitar los episodios de hipoglucemia. El seguimiento por más tiempo podría revelar mayores beneficios, especialmente con los agentes con menor riesgo de hipoglucemia, comparados con los fármacos hipoglucemiantes más tradicionales18. Otra posibilidad a investigar es la eventual sinergia con otros medicamentos utilizados por pacientes con diabetes para controlar los factores de riesgo CV concomitantes (antihipertensivos, hipolipemiantes, diuréticos, etc.).
Implicancia de los efectos cardiovasculares para la práctica clínica
La seguridad CV de los nuevos fármacos basados en incretinas e inhibidores de SGLT2 ha sido demostrada de manera consistente, y existe sólida evidencia de que al menos cuatro agentes antidiabéticos (empagliflozina, liraglutida, semaglutida y canagliflozina) disminuyen el riesgo de eventos CV en las personas con DMT213. En conjunto, empagliflozina y liraglutida alcanzaron una reducción de los eventos MACE de 14% y 13%, respectivamente, en pacientes con alto riesgo de eventos, es decir, que mostraron efecto cardioprotector. Estos resultados son positivos para la población con DMT2 y enfermedad CV.
Por otra parte, los estudios con las tres clases de nuevos antidiabéticos evidenciaron algunas señales específicas en el perfil de seguridad: saxagliptina se asoció con aumento de las internaciones por insuficiencia cardíaca2, 8; y en los pacientes tratados con canagliflozina hubo mayor incidencia significativa de amputaciones en miembros inferiores17. El más alto, el riesgo absoluto de amputación, ocurrió entre pacientes que tenían antecedentes de amputación o enfermedad vascular, pero el riesgo relativo de amputación con canagliflozina en comparación con el placebo fue similar en estos subgrupos24. En cuanto a semaglutida, en comparación con placebo mostró un aumento significativo del riesgo de retinopatía diabética. El incremento de retinopatía diabética con semaglutida en el estudio SUSTAIN 6 podría estar asociado a grandes reducciones tempranas de A1C, que se observaron principalmente en sujetos con antecedentes de retinopatía diabética preexistente al inicio del estudio8, 22. En SUSTAIN 1-5, no se observó desequilibrio en los eventos de retinopatía diabética para semaglutida frente a los comparadores30-34. El hallazgo relacionado con la insuficiencia cardíaca en el estudio SAVOR-TIMI 53 con saxagliptina no fue replicado en los demás estudios y no parece representar un efecto de clase15 . Las poblaciones incluidas en los estudios con iDPP-4 son heterogéneas y no está aclarada la causa del aumento de la tasa de internaciones asociadas con la insuficiencia cardíaca.
Discusión
Los fármacos antidiabéticos han sido efectivos para controlar la hiperglucemia y disminuir el riesgo de complicaciones microvasculares y, desde hace pocos años, se dispone de agentes que podrían reducir el riesgo de complicaciones CV, con distinto perfil de acción sobre los factores de riesgo CV, beneficios diferenciales y también con perfiles de seguridad diferentes. Aunque no se comprenden claramente los mecanismos a través de los cuales empagliflozina (EMPA-REG OUTCOME), liraglutida (LEADER), semaglutida (SUSTAIN 6) y canagliflozina (CANVAS) aportan beneficios sobre objetivos CV, finalmente comienza a ser posible modificar la historia natural de la enfermedad macrovascular en las personas con DMT28.
En la práctica clínica, para la elección del fármaco más apropiado para cada paciente se deberá considerar la eficacia y la seguridad, así como los efectos secundarios, las contraindicaciones, la tolerabilidad, el cumplimiento terapéutico y la adecuación para el paciente. Será recomendable individualizar la terapia sobre la base del perfil de riesgo de cada paciente; por ejemplo, la necesidad de bajar de peso y el estilo de vida, considerando que, generalmente, se requiere la combinación de al menos dos agentes antidiabéticos para alcanzar los objetivos glucémicos propuestos2, 17. Los resultados de los estudios publicados están influyendo en el manejo de la diabetes en pacientes de alto riesgo CV. Los datos de EMPA-REG OUTCOME y de LEADER actualmente tienen recomendaciones en los Estándares de atención médica en diabetes de la American Diabetes Association (ADA) de 2018 y el Manejo farmacológico canadiense de diabetes tipo 2: actualización provisional de noviembre de 201618, 19, 35. Ambas recomendaciones respaldan el uso y posicionamiento tanto de liraglutida como de empagliflozina como fármacos de preferencia luego de metformina para el control de la diabetes en pacientes de alto riesgo CV por los resultados obtenidos, además de sus múltiples beneficios clínicos, tal como la efectiva disminución de la glucemia, la presión arterial y el peso, el bajo riesgo de episodios de hipoglucemia y un adecuado perfil de seguridad18, 35.
Agradecimientos: Los autores expresan su agradecimiento al equipo de Agencia Médica, por su colaboración en la preparación y edición del manuscrito, y declaran que el apoyo editorial fue financiado por Novo Nordisk A/S.
Conflicto de intereses: Guillermo Dieuzeide ha sido investigador principal en protocolos de Astra Zeneca/BMS, Takeda, Daiicho Sanyo y Novo Nordisk. Ha participado en Advisory Boards de Novo Nordisk, Merck Sharp Dohme y GlaxoSmithKline, ha dictado conferencias para Novo Nordisk, GlaxoSmithKline y Astra Zeneca/BMS.
Félix Puchulu es disertante para Novo Nordisk, Sanofi Aventis, Astra Zeneca, Novartis y Montpellier, así como miembro de Advisory Boards de Novo Nordisk, Sanofi Aventis, Astra Zeneca.
Hugo Sanabria se desempeñó como orador para Novo Nordisk, Astra Zeneca, Boehringer Ingelheim, Janssen y Servier, fue miembro de Advisory Boards de Novo Nordisk, Astra Zeneca, Boehringer, Janssen, Servier e investigador para Novo Nordisk, Bayer, Sanofi Aventis y Astra Zeneca.
Isaac Sinay es miembro de Advisory Boards de Novo Nordisk, Eli Lilly, Sanofi Aventis, Merck Sharp & Dome, Astra Zeneca, Boehringer Ingelheim, Janssen, Novartis y Servier. Es también conferencista para todos los mencionados, investigador principal en diferentes estudios de seguimiento clínico y miembro del Comité de Operaciones del estudio TECOS (Merck Sharp & Dome) y del estudio HARMONY (GlaxoSmithKline).
1. Chudleigh RA, Bain S. Cardiovascular safety of liraglutide for the treatment of type 2 diabetes. Expert Opin Drug Saf 2017; 16: 627-35. [ Links ]
2. Naing S, Poliyedath A, Khandelwal S, Sigala T. Impact of EMPA-REG OUTCOME® on the management of type 2 diabetes mellitus: a review for primary care physicians. Postgrad Med 2016; 128: 822-7. [ Links ]
3. Avogaro A, Fadini GP, Sesti G, Bonora E, Del Prato S. Continued efforts to translate diabetes cardiovascular outcome trials into clinical practice. Cardiovasc Diabetol 2016; 15: 111. [ Links ]
4. U.S. Department of Health and Human Services. Guidance for Industry. Diabetes mellitus – Evaluating cardiovascular risk in new antidiabetic therapies to treat type 2 diabetes. Diciembre de 2008. En: https://www.fda.gov/downloads/Drugs/Guidances/ucm071627.pdf; consultado agosto 2017.
5. Emerging Risk Factors Collaboration, Di Angelantonio E, Kaptoge S, et al. Association of cardiometabolic multimorbidity with mortality. JAMA 2015; 314: 52-60. [ Links ]
6. Vallon V, Thomson SC. Targeting renal glucose reabsorption to treat hyperglycaemia: the pleiotropic effects of SGLT2 inhibition. Diabetologia 2017; 60: 215-25. [ Links ]
7. Doval HC. Cómo debemos pensar y también actuar en prevención primaria cardiovascular. Rev Argent Cardiol 2012; 80: 118-25. [ Links ]
8. Thompson PL, Davis TME. Cardiovascular effects of glucose-lowering therapies for type 2 diabetes: New drugs in perspective. Clin Ther 2017; 39: 1012-25. [ Links ]
9. Holman RR, Paul SK, Bethel MA, et al. 10-year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med 2008; 359: 1577-89. [ Links ]
10. Gæde P, Lund-Andersen H, Parving HH, Pedersen O. Effect of a multifactorial intervention on mortality in type 2 diabetes. N Engl J Med 2008; 358: 580-91. [ Links ]
11. Strain WD, Smith C. Cardiovascular outcome studies in diabetes: How do we make sense of these new data? Diabetes Ther 2016; 7: 175-85. [ Links ]
12. Hirshberg B, Katz A. Insights from cardiovascular outcome trials with novel antidiabetes agents: what have we learned? An industry perspective. Curr Diab Rep 2015; 15: 87. [ Links ]
13. Hirshberg B, Raz I. Impact of the U.S. Food and Drug Administration cardiovascular assessment requirements on the development of novel antidiabetes drugs. Diabetes Care 2011; 34 (Suppl 2): S101-6. [ Links ]
14. Lovre D, Htun W, Carrion C, Fonseca VA.. What are we learning from the FDA-mandated cardiovascular outcome studies for new pharmacological antidiabetic agents? Curr Diab Rep 2016; 16: 94. [ Links ]
15. Gupta P, White WB. Cardiovascular safety of therapies for type 2 diabetes. Expert Opin Drug Saf 2017; 16: 13-25. [ Links ]
16. Flory JH, Ukena JK, Floyd JS. Novel anti-glycemic drugs and reduction of cardiovascular risk in diabetes: Expectations realized, promises unmet. Curr Atheroscler Rep 2016; 18: 79. [ Links ]
17. Bonadonna RC, Borghi C, Consoli A, Volpe M. Novel antidiabetic drugs and cardiovascular risk: Primum non nocere. Nutr Metab Cardiovasc Dis 2016; 26: 759-66. [ Links ]
18. Trujillo JM, Wettergreen SA, Nuffer WA, Ellis SL, McDermott MT. Cardiovascular outcomes of new medications for type 2 diabetes. Diabetes Technol Ther 2016; 18: 749-58. [ Links ]
19. Anderson SL, Marrs JC. Antihyperglycemic medications and cardiovascular risk reduction. European Endocrinology 2017; 13: 86-90. [ Links ]
20. Sattar N, McLaren J, Kristensen SL, Preiss D, McMurray JJ. SGLT2 inhibition and cardiovascular events: why did EMPA-REG outcomes surprise and what were the likely mechanisms? Diabetologia 2016; 59: 1333-9. [ Links ]
21. Marso SP, Daniels GH, Brown-Frandsen K, et al. Liraglutide and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2016; 375: 311-22. [ Links ]
22. Marso SP, Bain SC, Consoli A, et al. Semaglutide and cardiovascular outcomes in patients with type 2 diabetes. N Engl J Med 2016; 375: 1834-44. [ Links ]
23. Holman RR, Bethel MA, Mentz RJ, et al. Effects of once-weekly exenatide on cardiovascular outcomes in type 2 diabetes. N Engl J Med 2017; 377: 1228-39. [ Links ]
24. Neal B, Perkovic V, Mahaffey KW, et al. Canagliflozin and cardiovascular and renal events in type 2 diabetes. N Engl J Med 2017; 377: 644-57. [ Links ]
25. Zinman B, Wanner C, Lachin JM, et al. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med 2015; 373: 2117-28. [ Links ]
26. Inzucchi S, Zinman B, Fitchett D, et al. How does empagliflozin reduce cardiovascular mortality? Insights from a mediation analysis of the EMPA-REG OUTCOME Trial Diabetes Care 2018; 41: 356-63. [ Links ]
27. Baartscheer A, Schumacher CA, Wüst RC, et al. Empagliflozin decreases myocardial cytoplasmic Na+ through inhibition of the cardiac Na+/H+ exchanger in rats and rabbits. Diabetologia 2017; 60: 568-73. [ Links ]
28. Vettor R, Inzucchi SE, Fioretto P, et al. The cardiovascular benefits of empagliflozin: SGLT2-dependent and -independent effects. Diabetologia 2017; 60: 395-8. [ Links ]
29. Nauck MA, Meier JJ, Cavender MA, Abd El Aziz M, Drucker DJ. Cardiovascular actions and clinical outcomes with glucagon-like peptide-1 receptor agonists and dipeptidyl peptidase-4 inhibitors. Circulation 2017; 136: 849-70. [ Links ]
30. Sorli C, Harashima SI, Tsoukas GM, et al. Efficacy and safety of once-weekly semaglutide monotherapy versus placebo in patients with type 2 diabetes (SUSTAIN 1): a double-blind, randomised, placebo-controlled, parallel-group, multinational, multicentre phase 3a trial. Lancet Diabetes Endocrinol 2017; 5: 251-60. [ Links ]
31. Ahrén B, Masmiquel L, Kumar H, et al. Efficacy and safety of once-weekly semaglutide versus once-daily sitagliptin as an add-on to metformin, thiazolidinediones, or both, in patients with type 2 diabetes (SUSTAIN 2): a 56-week, double-blind, phase 3a, randomised trial. Lancet Diabetes Endocrinol 2017; 5: 341-54. [ Links ]
32. Hramiak I, Ahmann A, Capethorn M, et al. Efficacy and safety of once-weekly semaglutide vs. exenatide ER after 56 weeks in subjects with type 2 diabetes (SUSTAIN 3). Can J Diabetes 2016; 40: S41. [ Links ]
33. Aroda V, Bain SC, Cariou B, et al. Efficacy and safety of once-weekly semaglutide versus once-daily insulin glargine as add-on to metformin (with or without sulfonylureas) in insulin-naive patients with type 2 diabetes (SUSTAIN 4): a randomised, open-label, parallel-group, multicentre, multinational, phase 3a trial. Lancet Diabetes Endocrinol 2017; 5: 355-66. [ Links ]
34. Rodbard H, Lingvay I, Reed J, et al. Efficacy and safety of semaglutide onceweekly vs placebo as to basal insulin alone or in combination with metformin in subjects with type 2 diabetes (SUSTAIN 5). Poster number 766. European Association for the Study of Diabetes, Munich, Germany; 12-16 September 2016. [ Links ]
35. American Diabetes Association. Pharmacologic approaches to glycemic treatment: Standards of medical cre in diabetes-2018. Diabetes Care 2018; 41(Suppl. 1): S73-S85. [ Links ]














