Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Medicina (Buenos Aires)
versión impresa ISSN 0025-7680versión On-line ISSN 1669-9106
Medicina (B. Aires) vol.79 no.1 Ciudad Autónoma de Buenos Aires feb. 2019
ARTÍCULO ORIGINAL
Supervivencia en una cohorte de pacientes con enfermedad pulmonar obstructiva crónica acorde a la clasificación GOLD 2017
Martín Sívori1, Romina Fernández1, Javier Toibaro2, Edgar Velásquez Gortaire1
1 Unidad de Neumotisiología,
2 Unidad de Clínica Médica B, Hospital Dr. J. M. Ramos Mejía, Buenos Aires, Argentina
Dirección postal: Martín Sívori, Unidad de Neumotisiología, Hospital General de Agudos Dr. J. M. Ramos Mejía, Urquiza 609, 1221 Buenos Aires, Argentina
e-mail: sivorimartin@yahoo.com
Recibido: 29-X-2018
Aceptado: 13-XII-2018
Resumen
Hasta el momento, no existe información sobre la evolución de los pacientes con enfermedad pulmonar obstructiva crónica (EPOC) de acuerdo con la nueva clasificación GOLD 2017. El objetivo de este estudio fue determinar, en una cohorte de pacientes con EPOC seguidos por veinte años, la influencia del cambio a la nueva clasificación en resultados de supervivencia por grupos y su asociación con otras variables como comorbilidades. Se evaluaron enfermos con EPOC (definición GOLD 2017) con seguimiento desde enero de 1996 a diciembre de 2016. Se usaron estadísticas convencionales y análisis de supervivencia de Log- Rank (Mantel-Cox). Se analizaron 354 pacientes: edad 66.5 ± 8.4, 66.7% hombres; ex-tabaquistas: 74.2% (56 paquetes-año); índice de Charlson 4.1 ± 1.7. A los 20 años, estaban vivos 219 (62%) y fallecidos 135 (38%), con un seguimiento de 28 meses (12-54.7). En el análisis uni y multivariado, el sexo masculino y la edad se asociaron a mayor mortalidad. Teniendo en cuenta solo la espirometría, a peor grado de obstrucción al flujo aéreo, la supervivencia es menor. Con la clasificación ABCD 2017, la peor supervivencia se encuentra en el grupo D y solo en este grupo es independiente del nivel de deterioro del VEF1 (p = 0.005). La nueva clasificación ABCD es predictora de mortalidad solo si está asociada a la función pulmonar.
Palabras clave: Enfermedad pulmonar obstructiva crónica; Clasificación GOLD.
Abstract
Survival in a cohort of patients with chronic obstructive pulmonary disease according to GOLD 2017 classification
Until now, there is no information on the evolution of patients with chronic obstructive pulmonary disease (COPD) according to the new GOLD classification. The objective of this study was to determine, in a cohort of patients with COPD followed by twenty years, the impact of the change to the new classification: survival by groups and their association with other variables such as comorbidities. COPD patients (GOLD 2017 definition) were evaluated with follow-up since January 1996 to December 2016. Conventional statistics and Log-Rank survival analysis (Mantel-Cox) were used. We analyzed 354 patients: age 66.5 ± 8.4, 66.7% men. Former smokers 74.2% (56 pack-year). Charlson index 4.1 ± 1.7. At the end of study 219 (62%) were alive and 135 (38%) died. The follow-up was 28 months (12-54.7). In the univariate and multivariate analysis, male sex and age were associated with higher mortality. Considering only the spirometry, to a worse degree of airflow obstruction, corresponded a lower survival. With the ABCD 2017 classification, the worst survival was observed in group D. Only in this group, survival is independent of the level of deterioration of FEV1 (p = 0.005). The new ABCD classification is a mortality predictor, only if it is associated to pulmonary function.
Key words: Chronic obstructive pulmonary disease; GOLD classification.
La enfermedad pulmonar obstructiva crónica (EPOC) tiene una prevalencia creciente en el mundo y la región1, 2. El estudio internacional BOLD, llevado a cabo en doce ciudades, determinó una prevalencia en adultos de 10.1%2. En Latinoamérica, el estudio PLATINO determinó en cinco ciudades de la región una prevalencia entre 7.8 y 19.5%3. En Argentina, recientemente el estudio EPOC. AR, realizado en adultos mayores de 40 años, demostró una prevalencia de 14.3% (López AM. EPOC.AR. Comunicación oral, 9° Conferencia Internacional de EPOC, Buenos Aires, 9 de abril de 2017).
La EPOC será la tercera causa de muerte en adultos en el año 20201, 4. Por las comorbilidades asociadas y el costo económico que representa la OMS la considera como la quinta causa de enfermedad crónica que generará discapacidad y consecuencias negativas en el sistema de salud1, 4. En la Argentina, es la quinta causa de internación en mayores de 60 años y se duplicó la mortalidad en los últimos 20 años, con un costo de salud considerable4.
Las guías GOLD (Global Initiative for Chronic Obstructive Lung Disease) comenzaron a publicarse en el año 2001 y basaron la clasificación de la EPOC en el criterio espirométrico, según el grado de obstrucción bronquial medido por el volumen espiratorio forzado en el primer segundo (VEF1), hasta el año 2010. A partir de 2011, se propuso una nueva evaluación multidimensional que incorpora a los síntomas, medidos a través de la escala de disnea mMRC (modified Medical Research Council), calidad de vida, a través del cuestionario COPD Assessment Test (CAT) y número de exacerbaciones, a la tradicional evaluación espirométrica5. Se establecieron así 4 grupos: A (mMRC < 2 y/o CAT <10, VEF1 > 50% y con menos de 2 exacerbaciones anuales) y B (mMRC ≥ 2 y/o CAT ≥ 10, VEF1 > 50% y con menos de 2 exacerbaciones anuales), C (mMRC < 2 y/o CAT <10, VEF1 <50% y/o 2 o más exacerbaciones anuales) y D (mMRC ≥ 2 y/o CAT ≥ 10, VEF1 < 50% y/o 2 o más exacerbaciones anuales). Se considera a los grupos A y B de bajo riesgo y a los grupos C y D de alto riesgo. En 2013 se introdujeron modificaciones, como lo es la consideración de una sola hospitalización para categorizar un paciente en el grupo C o D6.
Diferentes estudios demostraron la heterogeneidad de cada grupo en cuanto a evolución de la supervivencia, características fenotípicas y de consumo de recursos de salud7-12. A modo de ejemplo, Sillen y col. en el estudio DICES de Holanda, encontraron en 117 pacientes con EPOC GOLD D (según definición 2011), una gran heterogeneidad en parámetros de función pulmonar y muscular, intercambio gaseoso, disnea, calidad de vida, ejercicio y comorbilidades13. Diversas evidencias posteriores demostraron que no hay una progresión lineal de grupos según el orden de letra A > B > C > D y que no hay diferencia en la velocidad de declinación de la función pulmonar entre grupos.
Por estos motivos, se elevaron diferentes críticas sobre estas nuevas formas de evaluar la enfermedad14-17. La principal es que esta categorización es de base empírica, sin evidencia en estudios de soporte científico prospectivos que la fundamenten. Además, la asignación de grupo será diferente si se considera la escala CAT o la escala de disnea mMRC, más allá de la elección arbitraria de los puntos de corte que categorizan los síntomas y calidad de vida9, 12, 14.
Montes de Oca y col. recientemente han criticado en un editorial la metodología que llevó al Comité Ejecutivo de las guías GOLD a proponer esta evaluación multidimensional, sin base en evidencias científicas obtenidas de estudios prospectivos epidemiológicos15.
Por otra parte, teniendo en cuenta al tabaquismo como factor común de muchas enfermedades de alta incidencia, se ha relacionado a la EPOC con enfermedades cardiovasculares, cerebrovasculares y neoplasias, entre otras10, 18-22. Sin embargo, a pesar de su relación con la morbimortalidad, todavía no han sido tenidas en cuenta en la estratificación de la gravedad13.
Recientemente, la guía GOLD 2017 modificó la clasificación y evaluación del riesgo de exacerbación1. Al primer paso de volver a clasificar por grado de obstrucción bronquial (GOLD 1 a 4), se le agrega ahora que cada grupo debe ser evaluado para las escalas multidimensionales antes descriptas (síntomas, calidad de vida, exacerbaciones y hospitalizaciones: A, B, C y D), generándose 16 subgrupos1.
No hay, hasta al momento, información publicada que evalúe la nueva clasificación multidimensional propuesta por GOLD 2017 y la relacione a la supervivencia, así como a los diferentes factores que pudieran modificarla.
El objetivo de este estudio fue determinar, en una cohorte de pacientes con EPOC seguidos por veinte años en un servicio de Neumonología de un hospital público de la Ciudad de Buenos Aires, la relación entre la nueva clasificación GOLD 2017 y la evolución por supervivencia de los grupos y subgrupos recientemente descriptos y su asociación con otras variables.
Materiales y métodos
Se trata de una cohorte compuesta por pacientes mayores de 40 años, con diagnóstico de EPOC y con antecedentes de tabaquismo mayor a 10 paquetes-año. Se usó como criterio espirométrico de obstrucción crónica al flujo aéreo post-broncodilatador a la relación VEF1/capacidad vital forzada (CVF) menor a 0.71.
Se revisaron las historias clínicas de pacientes atendidos por uno de los autores en el consultorio externo de Neumonología del Hospital General de Agudos Dr. J. M. Ramos Mejía de la Ciudad Autónoma de Buenos Aires, desde enero de 1996 a diciembre de 2016.
Se reclasificó a todos los pacientes según la última actualización GOLD 2017: GOLD 1 si el VEF1 post broncodilatador era mayor al 80% del predicho con relación VEF1/CVF menor a 0.7; GOLD 2 si el VEF1 estaba entre 79-50%; GOLD 3 si el VEF1 estaba entre 30-49% y GOLD 4 si era menor o igual a 29%1. A su vez, cada nivel fue clasificado de acuerdo a los síntomas a través de la escala de disnea modificada del Medical Research Council (mMRC, de puntaje 0 –sin disnea a esfuerzos máximos– a 4 puntos –disnea de reposo–), calidad de vida (a través del cuestionario CAT, validado en castellano, con puntaje 0 para calidad de vida normal a 40 con mala calidad de vida) y número de exacerbaciones y hospitalizaciones en A (pocos síntomas: mMRC < 2 y/o CAT < 10, sin exacerbaciones frecuentes), B (muy sintomático: mMRC ≥ 2 y/o CAT ≥ 10, sin exacerbaciones frecuentes), C (pocos síntomas: mMRC < 2 y/o CAT < 10, 2 o más exacerbaciones en el último año, o una hospitalización por exacerbación de EPOC) y D (muy sintomático: mMRC ≥ 2 y/o CAT ≥ 10, 2 o más exacerbaciones en el último año, o una hospitalización por exacerbación de EPOC)1.
Las comorbilidades fueron evaluadas con el índice de Charlson23. Se asignó un valor determinado a cada comorbilidad y a la edad, de acuerdo con lo informado en el artículo original24. La supervivencia se calculó desde el diagnóstico de EPOC hasta diciembre de 2016 o, en caso de fallecimiento, a la fecha del óbito.
Se empleó estadística descriptiva. Se utilizó curva de Kaplan Meier para describir la mortalidad acorde a la clasificación GOLD 2013 y 2017; y método de Cox para comparar la supervivencia en la clasificación GOLD 2013 y en los subgrupos A, B y D (GOLD 2017) acorde a la función pulmonar medida por VEF1. No se consideró el análisis de mortalidad del grupo C por contener dos pacientes. Se elaboró un modelo sobre los factores asociados a mortalidad que incluyó como variables independientes: sexo, edad, bronquitis crónica, tabaquismo
actual, clasificación GOLD 2017 y la clasificación GOLD espirométrica. Se llevó a cabo el análisis univariado y multivariado sobre el tiempo hasta un evento, análisis de supervivencia Long-Rank (Mantel-Cox) con los factores propuestos en el modelo, considerándose significativo una p< 0.05.
Resultados
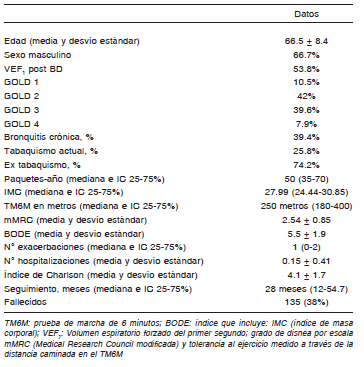
Se incluyeron en la cohorte 354 pacientes con EPOC. En la Tabla 1 se resumen los datos demográficos y generales medidos de la población. A los 20 años de seguimiento fallecieron 135 (38%) de la cohorte.
Tabla 1. Características demográficas y clínicas de la cohorte de pacientes con EPOC (n = 354)
En la Figura 1 se compara la proporción de pacientes A, B, C y D según clasificación GOLD 2013 y 2017. Se construyeron las curvas de supervivencia en función del grado de obstrucción bronquial medido por espirometría (Fig. 2) y de la nueva clasificación multidimensional GOLD 2017, sin tener en cuenta la espirometría (Fig. 3). Al evaluar la supervivencia teniendo en cuenta solo la espirometría, a peor grado de obstrucción al flujo aéreo, ésta es menor, por lo que hay una correlación entre ambas. Cuando se considera la clasificación ABCD 2017, la peor supervivencia se encuentra en el grupo D. Al combinar el grado de obstrucción al flujo aéreo con la nueva clasificación ABCD, se observa que la mortalidad del grupo D es independiente del nivel de deterioro del VEF1 (p = 0.24), a diferencia de lo que ocurre en los grupos A (p = 0.005), y B (p = 0.00), donde sería peor la mortalidad a mayor grado de obstrucción al flujo aéreo (Fig. 4).
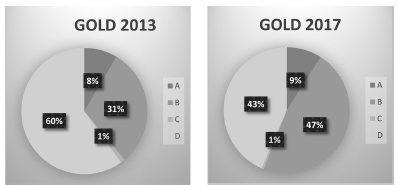
Fig. 1. Clasificación de la cohorte de pacientes con EPOC (N: 354), según GOLD 2013 y GOLD 2017
EPOC: enfermedad pulmonar obstructiva crónica
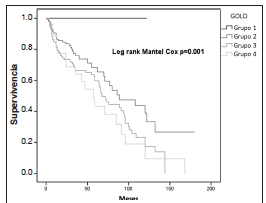
Fig. 2. Supervivencia de pacientes con EPOC según función pulmonar (GOLD 1-4)
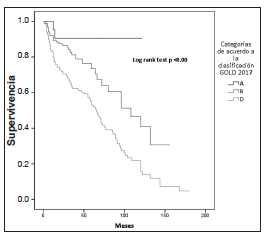
Fig. 3. Supervivencia de pacientes con EPOC por categorías GOLD 2017 (A, B, D)
Nota: No se considera la categoría GOLD C para la construcción de la curva ya que solo hay 2 pacientes
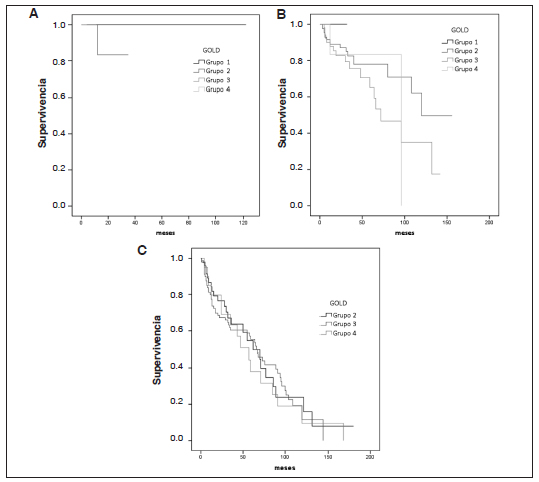
Fig. 4. Mortalidad de pacientes con EPOC categorías A, B y D, de acuerdo al grado de función pulmonar (GOLD 1-2-3-4) según GOLD 2017
Nota: La primera curva corresponde a la mortalidad del Grupo A, la segunda, al Grupo B y la tercera al Grupo D
Con respecto a las comorbilidades, la hipertensión arterial es la más frecuentemente encontrada (24%), seguida por enfermedad cardíaca (20%), diabetes (8%) y cáncer (7%). Los tipos de neoplasias encontradas fueron: diez casos de cáncer de pulmón, cuatro de próstata, tres hematológicos (dos linfomas no Hodgkin y una leucemia linfocítica crónica), tres de colon, dos de vejiga, dos ginecológicos, un caso de melanoma y una metástasis de origen desconocido.
En las Figuras 5 y 6 se observa la distribución de las comorbilidades según función pulmonar y GOLD 2017, respectivamente. El índice de Charlson fue significativamente mayor en GOLD 1 en comparación a GOLD 3 (4.72 ± 2.02 vs. 3.94 ± 1.38, p = 0.002) y en GOLD 2 en comparación al 3 (4.15 ± 1.72 vs. 3.94 ± 1.38, p = 0.009). Cualitativamente, se observó en GOLD 2 y 3 mayor frecuencia de enfermedad cardiovascular. El índice de Charlson no fue significativamente diferente entre los grupos A, B y D. Cualitativamente, la hipertensión arterial es la comorbilidad más prevalente en todos los grupos (37%, 28%, 18%, respectivamente).

Fig. 5. Distribución de las comorbilidades más frecuentes según clasificación espirométrica de EPOC
EPOC: enfermedad pulmonar obstructiva crónica; DBT: diabetes; HTA: hipertensión arterial

Fig. 6. Distribución de las comorbilidades en pacientes con EPOC, según clasificación GOLD 2017
EPOC: enfermedad pulmonar obstructiva crónica; DBT: diabetes; HTA: hipertensión arterial
Se consideraron, además del grado de obstrucción al flujo aéreo y clasificación ABCD 2017, el sexo, la edad y la presencia de bronquitis crónica como variables independientes. En el análisis univariado de estas tres variables, el sexo masculino (RR 1.54, IC95% 1.01-2.34) y la edad (RR 0.97, IC95% 0.95-0.99) se asociaron a mortalidad.
En el análisis multivariado, las variables que se asociaron en forma independiente a la supervivencia fueron edad (p = 0.031) y sexo masculino (p = 0.044).
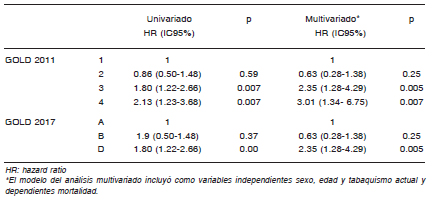
En la Tabla 2 se observa que los grupos GOLD 3 y 4 se asociaron significativamente con mortalidad en el análisis univariado (p = 0.007 en ambas categorías) y en el multivariado (p = 0.005 y p = 0.007 respectivamente). Mientras que, con clasificación GOLD 2017, solamente el grupo D tuvo asociación significativa con mortalidad en el análisis uni y multivariado (p = 0.000 y p = 0.005 respectivamente).
Tabla 2. Mortalidad de pacientes con EPOC según la clasificación espirométrica y GOLD 2017 (Análisis uni y multivariado)
Discusión
Esta investigación acerca del cambio de clasificación de EPOC en una cohorte de pacientes seguidos en un servicio de Neumonología relacionado con la mortalidad, ha demostrado que la actual clasificación GOLD 2017, que no considera el grado de obstrucción bronquial, no refleja el pronóstico de esta enfermedad. De hecho, en los grupos de bajo riesgo de exacerbaciones (A y B), sigue siendo el VEF1 un adecuado marcador pronóstico.
La nueva clasificación GOLD 2017 excluye la espirometría. En este estudio se observa que la mortalidad del grupo D es independiente del nivel de deterioro del VEF1 (Fig. 3 y 4). En cambio, en los grupos A y B es peor la mortalidad a mayor grado de obstrucción al flujo aéreo. Otro efecto de esta clasificación es el incremento de la proporción de pacientes en los grupos A y B, por la reducción de pacientes de los grupos C1 (ingresando por mMRC < 2 o CAT < 10 y VEF1 < 50%) y D1 (solo incluidos por mMRC ≥ 2 o CAT ≥ 10 y VEF1 < 50%) de la anterior clasificación (Fig. 1). La proporción de casos en las cohortes publicadas de pacientes en los grupos B y C, ha sido consistentemente baja usando las definiciones GOLD desde 2011 a 2016 inclusive6, 7, 25, 26. Recientemente, Hernández y col. evaluaron el cambio de clasificación GOLD 2007 a 2011 sobre 420 pacientes en nuestro país, y determinaron una mayor proporción de pacientes (40% aproximadamente) que cambian a una enfermedad más leve y más grave27.
El efecto de la nueva clasificación generó que los pacientes ingresados hasta el 2016, por el criterio D1, ahora pasen a ser considerados como grupo 3B o 4B. Y el grupo que hasta el 2016 era considerado C1, ahora sea considerado como 3A o 4A. Esto genera que los diferentes centros asistenciales, que tenían mucha proporción de pacientes C1 y D1, ahora disminuyan su porcentaje de C y D, y pasen a tener más pacientes A y B, respectivamente.
De manera adicional y no menos importante, la nueva clasificación 2017 excluye de la decisión terapéutica al grado de deterioro de la obstrucción bronquial, pudiendo suceder que pacientes con obstrucción grave y pocos síntomas (3A y 4A), sean tratados con broncodilatadores de acción corta. Por otra parte, ya se demostró que en las etapas iniciales de la enfermedad (EPOC con obstrucción moderada y a menudo asintomática u oligo-sintomática), la intervención farmacológica con anticolinérgicos de acción prolongada puede disminuir la velocidad de declinación del VEF1, por lo que a este subgrupo se le negaría esa oportunidad, sin dejar de señalar que las campañas de detección de EPOC justamente detectan este subgrupo de pacientes28. Ninguno de los estudios clínicos de desarrollo de las moléculas de los últimos 20 años, se realizó usando estos criterios actuales, por lo que la decisión es de base empírica, pudiendo implicar mayor costo para el sistema de salud.
Con respecto a la mortalidad, Leivseth y col. en la cohorte noruega HUNT de 1540 pacientes con EPOC seguidos entre 1995 y 2012, demostraron que la categorización por espirometría (GOLD 2007), predice mejor la mortalidad que la clasificación multidimensional GOLD 201129. En el modelo propuesto en este estudio, una peor función pulmonar se asocia a peor supervivencia (Fig. 2 y Tabla 2). Por otro lado, cuatro estudios y un análisis agrupado de cohortes compararon la mortalidad y la evaluación multidimensional GOLD 2011, no encontrando variación de cambios en mortalidad entre la clasificación espirométrica anterior del 2007 y la del 20116, 7, 25, 26. La modificación 2013 mejoró la predicción de exacerbaciones entre grupos, pero empeoró la de mortalidad y declinación de la función pulmonar12, 14, 15.
En una cohorte de 84 pacientes con EPOC D de nuestro hospital, seguida diez años, los pacientes que presentaron peor pronóstico fueron los que entraron por el criterio de exacerbación frecuente (D2), y mejor supervivencia los que entraron solo por deterioro del VEF1 (D1) de la clasificación válida hasta 2016. En el análisis multivariado, el sexo masculino, la condición de tabaquismo actual y el número de exacerbaciones fueron los principales factores asociados a la mortalidad (Sívori M, Graz A, Podestá J, et al. Definición GOLD D 2011: su heterogeneidad. En Actas del 8° Congreso ALAT, Medellín, junio 2014).
Recientemente, dos investigaciones evaluaron el efecto de cambio de clasificación GOLD 2017 sobre la mortalidad, llegando a las mismas conclusiones por nosotros arribadas30, 31. Cabrera López y col. comunicaron el seguimiento de una cohorte española de 819 pacientes a 5 años de seguimiento promedio30. Comparando la clasificación 2017 y 2015, observaron una reducción en la proporción de pacientes D y C a la mitad y el riesgo de mortalidad fue mayor en los grupos B y D, que A y C, siendo la clasificación 2015 la que mejor determinó el riesgo de mortalidad. Gedebjerg y col. comunicaron del registro danés de EPOC, información sobre 22 621 pacientes seguidos a tres años31. En comparación a las anteriores clasificaciones de 2007 y 2011, la nueva clasificación 2017 no es mejor predictora de mortalidad, pero sin embargo cuando se toma en consideración la asignación de subgrupos por función pulmonar, ésta es superior a las anteriores31.
Diferentes revisiones y estudios clínicos prospectivos determinaron la prevalencia de las diferentes comorbilidades, pero en general no difieren de la población en general: es decir, mayor en el sexo masculino la enfermedad coronaria, diabetes e hipertensión arterial; y mayor la osteoporosis y depresión en el femenino32-36. En este estudio se usó como indicador de comorbilidad el índice de Charlson23. Cada punto suma un mayor riesgo de muerte entre 46% y tres veces más23. El promedio de nuestra muestra es 4.1 que, según la publicación original, corresponde a un aumento del riesgo relativo de muerte de 4.4 (2.45-7.9)23. Divo y col. definieron el término “comorbidoma” al conjunto de enfermedades serias que afectan y se asocian a la EPOC, pero que no son efectos sistémicos de la enfermedad18. Vanfleteren y col. determinaron clusters o asociación de comorbilidades en pacientes con EPOC37. El efecto sobre la mortalidad es mayor cuantas más enfermedades serias presente y es mayor el estadio GOLD 3/437. La diabetes, hipertensión arterial y enfermedad coronaria son las que tienen mayor peso pronóstico negativo. La hipertensión es la comorbilidad más frecuente en la EPOC, más aún a mayor gravedad, y es un factor común a enfermedades cerebrovasculares, arritmias y otras enfermedades cardiovasculares y aterosclerosis38. La diabetes tipo 2 es más prevalente que en la población general (alrededor 12%) y es más frecuente en los estadios más graves. El cáncer de pulmón es una importante causa de mortalidad del paciente con EPOC, llegando en algunas series a ser causa de entre 7 y 38% de las muertes. El riesgo está directamente relacionado a la carga tabáquica y a la gravedad de la obstrucción al flujo aéreo (HR de 1.4 a 4.4, de GOLD 1 a 4 respectivamente)38. En nuestro estudio de población añosa, predominantemente masculina, con importante carga tabáquica y sobrepeso, se observó en los estadios 2 y 3 mayor porcentaje de enfermedad cardiovascular, hipertensión arterial y diabetes (Fig. 5). Las enfermedades neoplásicas se observaron más frecuentemente en los estadios 2 y 3. La hipertensión arterial predomina en todos los grupos de la nueva clasificación GOLD 2017. La diabetes y la enfermedad cardiovascular se observaron con gran frecuencia en los grupos B y D (Fig. 6). Este estudio reafirma lo que ya se ha comunicado previamente: que aún en estadios moderados de deterioro de la función pulmonar (GOLD 2), o en pacientes de bajo riesgo de exacerbaciones (grupo B), se observa mayor prevalencia de comorbilidades.
Las limitaciones de este estudio son que las conclusiones deben ser referidas a poblaciones de pacientes con EPOC atendidos en centros especializados (sesgo de inclusión). Debido a ello, el porcentaje de cada grupo es propio de este tipo de selección de muestra (alto en el grupo B y D, y no adecuadamente representado en el C), con bajo número de pacientes en alguno de los subgrupos. Además, otro resultado que deber ser interpretado con precaución es el alto índice de Charlson para el grupo A, probablemente debido al pequeño número de pacientes enrolados, y que a lo largo del período de seguimiento el tratamiento farmacológico recomendado para cada estadio fue modificado, y esto podría constituir un sesgo en la medición de la supervivencia.
El comportamiento de la supervivencia de los grupos GOLD A y B en la nueva clasificación no refleja el pronóstico de la enfermedad. Esto podría estar relacionado a factores como no haber incluido la espirometría, el bajo número de pacientes en alguno de los subgrupos de nuestra cohorte, y de comorbilidades no consideradas. No así en el grupo GOLD D que impresionaría tener una supervivencia independiente del grado de obstrucción bronquial. Se deberán seguir realizando más investigaciones para estudiar si la actual clasificación GOLD 2017, que no considera el grado de obstrucción bronquial, refleja el pronóstico de esta enfermedad.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Vogelmeier CF, Criner GJ, Martinez FJ, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive lung disease 2017 Report: GOLD Executive Summary. Am J Respir Crit Care Med 2017; 195: 557-82. [ Links ]
2. Halbert RJ, Natoli JL, Gano A, Badamgarav E, Buist AS, Mannino DM. Global burden of COPD: systematic review and meta-analysis. Eur Respir J 2006; 28:523-32. [ Links ]
3. Menezes Am, Pérez-Padilla R, Jardin JR, et al. Chronic obstructive pulmonary disease in five Latin American cities (the PLATINO study): a prevalence study. Lancet 2005; 366: 1875-81. [ Links ]
4. Figueroa Casas JC, Schiavi E, Mazzei JA, et al. Recomendaciones para la prevención, diagnóstico y tratamiento de la EPOC en la Argentina. Medicina (B Aires) 2012; 72 (Supl. I): 1-33. [ Links ]
5. Vestbo J, Hurd SS, Agustí AG, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease. GOLD executive summary. Am J Respir Crit Care Med 2013; 187: 347-65. [ Links ]
6. Johannessen A, Nilsen RM, StorebØ M, Gulsvik A, Eagan T, Bakke P. Comparison of 2011 and 2007 Global Initiative for chronic obstructive lung disease guidelines for predicting mortality and hospitalization. Am J Respir Crit Care Med 2013; 188: 51-9. [ Links ]
7. Soriano JB, Alfageme I, Almagro P, et al. Distribution and prognostic validity of the new Global Initiative for Chronic Obstructive Lung Disease grading classification. Chest 2013; 143: 694-702. [ Links ]
8. Casanova C, Marin JM, Martinez-Gonzalez C, et al. Differential effect of modified Medical Research Council dyspnea, COPD assessment test, ad clinical COPD questionnaire for symptoms evaluation within the new GOLD staging and mortality in COPD. Chest 2015; 148: 159-68. [ Links ]
9. Goossens LM, Leiner I, Metzdorf N, Becker K, Rutten-van Mölken M. Does the 2013 GOLD classification improve the ability to predict lung function decline, exacerbations and mortality? A post-hoc analysis of the 4-year UPLIFT trial. BMC Pulm Med 2014; 14: 163-71. [ Links ]
10. Dusser D, Wise RA, Dahl R, et al. Differences in outcome between GOLD groups in patients with COPD in the TIOSPIR® trial. Int J COPD 2016; 11: 133-45. [ Links ]
11. Soriano JB, Lamprecht B, Ramírez AS, et al. Mortality prediction in chronic obstructive pulmonary disease comparing the GOLD 2007 and 2011 staging systems: a pooled analysis of individual patient data. Lancet Respir Med 2015; 3: 443-50. [ Links ]
12. Franssen FME, Han MK. The ABC of GOLD A-B-C-D. Eur Respir J 2013; 42: 1166-8. [ Links ]
13. Sillen MJH, Franssen FME, Delbressine JML, et al. Heterogenicity in clinical characteristics and co-morbidities in dyspneic individuals with COPD GOLD D: findings of the DICES trial. Respir Med 2013; 107: 1186-94. [ Links ]
14. Calverley PMA. The ABCD of GOLD made clear. Eur Respir J 2013; 42: 1163-5. [ Links ]
15. Montes de Oca M, Pérez-Padilla R. Global Initiative for chronic obstructive lung disease (GOLD)-2017: la visión desde ALAT. Arch Bronconeumol 2017; 53: 87-8. [ Links ]
16. Candela JF, López-Giraldo A, Agustí A. Interrogantes y aspectos controversiales de GOLD. Rev Amer Med Respir 2014; 4: 358-61. [ Links ]
17. Jones PW, Adamek L, Nadeau G, Banik N. Comparisons of health status scores with MRC grades in COPD: implications for the GOLD 2011 classification. Eur Respir J 2013; 42: 647-54. [ Links ]
18. Divo M, Cote C, de Torres JP, et al. Comorbidities and risk of mortality in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2012; 186: 155-61. [ Links ]
19. Anthonisen NR, Connett JE, Enright PL, Manfreda J, and the Lung Health Study Research Group. Hospitalizations and mortality in the Lung Health Study. Am J Respir Crit Care Med 2002; 166: 333-9. [ Links ]
20. McGarvey LP, John M, Anderson JA, Zvarich M, Wise RA. Ascertainment of cause-specific mortality in COPD: operations of the TORCH Clinical Endpoint Committee. Thorax 2007; 62: 411-5. [ Links ]
21. McGarvey LP, Magder S, Burkhart D, et al. Cause-specific mortality adjudication in the UPLIFT® COPD trial: Findings and recommendations. Respir Med 2012; 106: 515-21. [ Links ]
22. Agustí A, Edwards LD, Celli B, et al. Characteristics, stability and outcomes of the 2011 GOLD COPD groups in the ECLIPSE cohort. Eur Respir J 2013; 42: 636-46. [ Links ]
23. Charlson M, Szatrowski TP, Peterson J, Gold J. Validation of a combined comorbidity index. J Clin Epidemiol 1994; 47: 1245-51. [ Links ]
24. Charlson ME, Pompei P, Ales KL, MacKenzie CR. A new method of classifying prognostic comorbidity in longitudinal studies: development and validation. J Chron Dis 1987; 40: 373-83. [ Links ]
25. Han MK, Muellerov H, Curran-Everett D, et al. GOLD 2011 disease severity classification in COPD Gene: a prospective cohort study. Lancet Respir Med 2013; 1: 43-50. [ Links ]
26. Lange P, Marott JL, Vestbo J, et al. Prediction of the clinical course of chronic obstructive pulmonary disease, using the new GOLD classification: a study of the general population. Am J Respir Crit Care Med 2012; 186: 975-81. [ Links ]
27. Hernandez M, Garcia F, Falco J, et al. Impact of the using the new GOLD classification on the distribution of COPD severity in clinical practice. Int J COPD 2018; 13: 351-6. [ Links ]
28. Decramer M, Celli B, Kesten S, Lystig T, Mehra S, Tashkin DP. Effect of tiotropium on outcomes in patients with moderate chronic obstructive pulmonary disease (UPLIFT): a prespecified subgroup analysis of a randomized controlled trial. Lancet 2009; 374: 1171-8. [ Links ]
29. Leivseth L, Brumpton BM, Nilsen TI, Mai XM, Johnsen R, Langhammer A. GOLD classifications and mortality in chronic obstructive pulmonary disease: the HUNT Study Norway. Thorax 2013; 68: 914-21. [ Links ]
30. Cabrera Lopez C, Casanova Macario C, Marin Trigo JM, et al. Comparison of the 2017 ad 2015 Global Initiative for Chronic Obstructive Lung Disease Reports: impact on grouping and outcomes. Am J Respir Crit Care Med 2018; 197: 463-9. [ Links ]
31. Gedebjerg A, Komjáthine Szépligeti S, Holm Wackerhausen LM, et al. Prediction of mortality in patients with chronic obstructive pulmonary disease with the new Global Initiative for Chronic Obstructive Lung Disease 2017 classification: a cohort study. Lancet Respir Med 2018; 6: 204-12. [ Links ]
32. de Miguel Díez J, Gómez García T, Puente Maestu L. Comorbilidades de la EPOC. Arch Bronconeumol 2010; 46 (Supl 11): 20-5. [ Links ]
33. Barnes PJ, Celli BR. Systemic manifestations and comorbidities of COPD. Eur Respir J 2009; 33: 1165-85. [ Links ]
34. Aryal S, Díaz-Guzman E, Mannino DM. Prevalence of COPD and comorbidity. Eur Respir Mon 2013; 58: 1-12. [ Links ]
35. Gershon AS, Mecredy GC, Guan J, Victor JC, Goldstein R, To T. Quantifying comorbidity in individuals with COPD: a population study. Eur Respir J 2015; 45: 51-9. [ Links ]
36. Laforest L, Roche N, Devouassoux G, et al. Frequency of comorbidities in chronic obstructive pulmonary disease, an impact on all-cause mortality: a population-based cohort study. Respir Med 2016; 117: 33-9. [ Links ]
37. Vanfleteren LE, Spruit MA, Groenen M, et al. Clusters of comorbidities based on validated objective measurements and systemic inflammation in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2013; 187: 728-35. [ Links ]
38. Mannino DM, Thorn D, Swensen A, Holguin F. Prevalence and outcomes of diabetes, hypertension and cardio-vascular disease in COPD. Eur Respir J 2008; 32: 962-9. [ Links ]














