El término transmogrificación significa transformación a una forma extraña1, y es la capacidad de cambiar de aspecto a cualquier forma ya sea vegetal, animal, mineral o humana. La transmogrificación placentaria del pulmón (PTL) es una lesión benigna y extremadamente infrecuente2. Si bien se asocia al enfisema bulloso gigante y por algunos autores es considerada una variante histológica del enfisema bulloso gigante unilateral, su etiología aún es desconocida3,4. Fue descripta por primera vez en 1979 por Mc Chesney5,6. Debido a la semejanza histológica que presentaba con vellosidades inmaduras de la placenta, el término “placentoide” podría ser el más adecuado para describir sus caracteres tanto histológicos como macroscópicos. La microscopía muestra de manera característica estructuras papilares revestidas por neumocitos hiperplásicos que asemejan vellosidades placentarias4,7. Radiológicamente la PTL muestra principalmente cambios bullosos y muy raramente se presenta como quistes o nódulos7. Debido a la rareza de la afección, presentamos el caso de un paciente joven, que consultó con disnea de un año de evolución, y cuyo diagnóstico postoperatorio incluía esta rara entidad.
Caso clínico
Hombre de 36 años de edad, no tabaquista y sin otros antecedentes clínicos de relevancia, quien consultó por disnea progresiva de un año de evolución. En la radiografía de tórax simple se observaba vértice pulmonar radio lúcido, base con áreas de condensación y desplazamiento del mediastino hacia el pulmón contralateral. Se realizó tomografía computarizada de tórax en la que se evidenciaron múltiples bullas en pulmón derecho con predomino en el lóbulo superior y resto del parénquima homolateral condensado, con desplazamiento mediastinal y compresión del pulmón contralateral (Fig. 1). No refirió antecedentes de infecciones respiratorias a repetición, ni trastornos en la fertilidad que hicieran suponer algún trastorno en la motilidad ciliar de carácter, al menos, autosómico recesivo. Los estudios para la evaluación de la función pulmonar incluyeron: centellograma de perfusión, test de caminata, ecocardiograma, espirometría con estudio de difusión de monóxido de carbono (DLCO) y consumo de oxígeno (VO ). En el centellograma de perfusión, el pulmón derecho aportaba el 11% de la perfusión total, en el test de marcha alcanzó los 465 metros sin desaturación, el ecocardiograma fue normal y los valores de la espirometría -VEF1 1.84 (43%), FVC 2.34 (45%), DLCO 24.3 (72%), y consumo de oxigeno (VO ) 65%, habilitan la resección quirúrgica. Se solicitó test del sudor para descartar enfermedad fibroquística (FQ) con resultado dudoso. Asumiendo que la causa de su disnea era la compresión del parénquima pulmonar izquierdo sano, y sin diagnóstico de certeza sobre la enfermedad de base, se decidió tratamiento quirúrgico. Se realizó toracotomía derecha y se halló afectación de todo el pulmón, no pudiéndose preservar parénquima. Se procedió a completar la neumonectomía derecha, sin mediar complicaciones intra o postoperatorias. Se retiró el drenaje y al sexto día fue dado de alta.
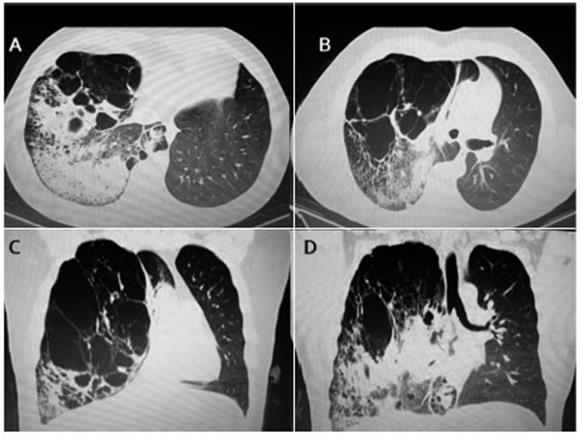
Fig. 1 Tomografía computarizada que muestra múltiples imágenes de bullas gigantes en lóbulo superior derecho y áreas de condensación en lóbulo medio e inferior. A y B: cortes axiales. C y D: cortes coronales
En el estudio anatomo-patológico, en la macroscopía, se observó pulmón derecho de aspecto globoso con pleura visceral lisa. Al corte, el tejido mostraba aspecto esponjoso, blando, friable, pardo, con áreas de degeneración quística con contenido mucoide y otras de apariencia vesicular que remedaban a la placenta (Fig. 2A). Microscópicamente, se evidenció la presencia de estructuras papilares constituidas por un revestimiento de neumocitos hiperplásicos y estroma fibrovascular con presencia de células intersticiales claras. El patrón de tinción inmunohistoquímico (IHQ) fue positivo para TTF1 (clon 8G7G3/1) en neumocitos, positivas para CD-10 y vimentina, y negativas para citoqueratina, desmina, S-100 y actina del músculo liso en las células del estroma (Figs. 2 B y C).

Fig. 2 A: imagen donde se comparan las superficies de la pieza quirúrgica y una placenta normal. Es importante notar la similitud macroscópica de ambos especímenes. B: la tinción con hematoxilina-eosina muestra estructuras papilares cubiertas por neumonocitos hiperplásicos, que asemejan vellosidades placentarias. En el estroma se observa canales vasculares, células estromales fusocelulares, linfocitos, plasmocitos, esclerosis, tejido adiposo y calcificación. C: el panel de IHQ es positivo para TTF-1 en neumonocitos, CD-10 y vimentina positivos en células estromales
El diagnóstico histopatológico definitivo fue: enfisema bulloso gigante localizado, con transmogrificación placentaria de pulmón.
A un año de la cirugía, el paciente se encuentra entrenando activamente dos horas al día para correr una regata.
Discusión
La transmogrificación placentaria del pulmón fue descripta por primera vez por Mc Chesney en 19795. Aunque no comparte las características biológicas ni las propiedades de la placenta, su denominación se debe a que morfológicamente simula las estructuras inmaduras de ese tejido, y es considerada como un subtipo histológico del enfisema bulloso8. El enfisema es definido como la dilatación de la vía aérea distal a los bronquiolos terminales, asociado a destrucción de la pared alveolar, creación de espacios aéreos y fibrosis asociada. Epidemiológicamente está relacionada con el hábito tabáquico y afecta a individuos en la 5a-6a década de la vida. Para Shapiro y col., la PTL es un tipo infrecuente de enfisema bulloso, caracterizado por la presencia de enormes bullas unilaterales, con o sin imágenes nodulares asociadas en el mismo hemitórax8. Pese a esta descripción, la transmogrificación placentaria del pulmón se distingue del enfisema típico por la tendencia a ocurrir en un grupo etario más joven (cuarta década de la vida) junto con la progresión local de la enfermedad.
Aunque ambos órganos participan en el intercambio gaseoso, la fisiopatología de esta enfermedad todavía no se conoce completamente. Se han propuesto como hipótesis de su génesis la asociación con el hamartoma fibrocondromatoso, con la lipomatosis pulmonar y la proliferación linfática y vascular sobre un parénquima pulmonar enfisematoso9. Como contrapartida, Cavazza sugiere que la PTL no necesariamente sea una variante de enfisema focalizado, sino la consecuencia de una proliferación benigna de células intersticiales claras inmaduras con cambios quísticos secundarios10. Si bien se ha propuesto también un origen congénito, no existen casos comunicados en niños.
El estudio por macroscopía evidencia la similitud con tejido placentario normal. La microscopía permite observar una condición en la cual los alvéolos desarrollan una peculiar configuración vellosa que simula, a muy poco aumento, las vellosidades placentarias11. Sus estructuras papilares están caracterizadas por la proliferación de células claras, las cuales expresan en el estudio por IHQ positividad para vimentina, CD10, D2-40 y parcial positividad para TTF-110,12. Se cree que la transformación vellosa surge del edema y la fibrosis del tejido pulmonar con enfisema grave o enfisema bulloso gigante. La lipomatosis también está implicada como causa, debido a la expresión de tejidos grasos dentro de las vellosidades, así como a una franca de lipomatosis en las vellosidades placentarias y en el intersticio del pulmón10.
Varias comunicaciones han clasificado los hallazgos radiológicos en tres patrones. La manifestación más común es el patrón de enfisema bulloso5,7,10. A continuación, la enfermedad se expresa en la radiografía con un patrón mixto de lesión y nódulo quístico de paredes delgadas8,13,14. En raras ocasiones, el hallazgo radiológico muestra un patrón de nódulo solitario7. La enfermedad en sí misma es una entidad rara, y nuestro caso tuvo hallazgos incluso más inusuales: bulla gigante, patrones de consolidación y compromiso de todo el pulmón que requirió neumonectomía.
Ma y col. publicaron las características clínico-quirúrgicas de 34 pacientes con diagnóstico de PTL. En dicho estudio la edad promedio de presentación fue 45 años (24-72), el 72% de los afectados pertenecía al género masculino, y el hábito tabáquico estuvo presente en el 48% de los casos. El 20% presentaba el antecedente médico de un hamartoma pulmonar y un 16% neumonía. Los tipos de procedimientos quirúrgicos más frecuentes fueron la lobectomía y la neumonectomía, y solo presentaron recurrencia de la enfermedad durante el tiempo de seguimiento (27 ± 29 meses) tres pacientes9. Debido al comportamiento progresivo pero lento de la enfermedad, suele manifestarse con empeoramiento de la función pulmonar o diversos eventos adversos: infecciones a repetición, compresión del parénquima adyacente, desviación del mediastino, etc. En nuestro paciente, la forma de presentación, con afectación de todo el pulmón es menos común, asociada a desviación del mediastino con compresión del pulmón sano y disnea a pequeños esfuerzos, que mejora inmediatamente realizada la cirugía. Es importante considerar como diagnósticos diferenciales: secuestro pulmonar intralobar, malformación adenomatoide quística, quiste broncogénico, enfisema bulloso, hamartoma fibrocondromatoso, linfangioleiomiomatosis y en nuestro caso, la sospecha de fibrosis quística7,8. En conclusión, aunque rara, la PTL debe considerarse en el diagnóstico diferencial de bullas gigantes que contienen tejido blando y componente graso.














