La proteinosis alveolar pulmonar (PAP) está caracte rizada por acumulación de material lipoproteináceo en los alvéolos y macrófagos alveolares, secundaria a una alteración en la homeostasis del surfactante. Se presenta más frecuentemente con disnea progresiva y tos. En las imágenes tomográficas suelen hallarse infiltrados en vidrio esmerilado con patrón de empedrado. El diagnóstico se basa en la historia clínica, los hallazgos tomográficos, el lavado broncoalveolar y, en ocasiones, biopsia de pul món. El tratamiento más utilizado consiste en el lavado pulmonar total (LPT). La evolución varía desde la resolu ción espontánea hasta la progresión a falla respiratoria. Se presenta el caso de una paciente con insuficiencia respiratoria y diagnóstico anatomopatológico de PAP a la cual se le realizó LPT con mejoría clínica. El objetivo de la presentación es la difusión de una entidad poco prevalente, que fue diagnosticada en el contexto de la pandemia por COVID-19.
Caso clínico
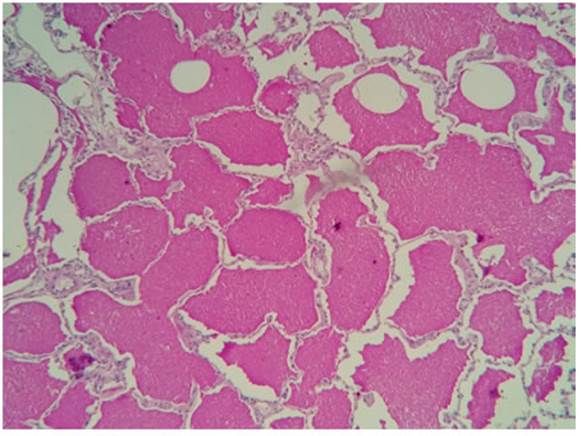
Mujer de 69 años, hipertensa, obesa, con antecedente de anemia ferropénica, ingresó por disnea progresiva de tres meses de evolución de clase funcional II a III, astenia y tos no productiva. Al ingreso presentó taquipnea y disnea CF IV con habla entrecortada. Se auscultó disminución del murmullo vesicular bibasal y crepitantes finos en campos medios bilate rales. Se obtuvieron los siguientes resultados de los análisis de laboratorio: anemia ferropénica, VSG de 46 mm/h, PCR de 14.4 mg/dl (VN < 0.5 mg/dl), LDH de 280 U/l (VN 125-220 U/l); gases en sangre arterial con pO2 68 mmHg, pCO2 42 mmHg, saturación 90% (FIO2 0.;1). El proteinograma electroforético mostró aumento policlonal de fracción gamma. FAN, anti ADN y látex para artritis reumatoidea resultaron negativos. Las serologías para HBV, HCV, HIV fueron no reactivas. Los hemocultivos y la PCR para SARS-Cov-2 fueron negativos. En la tomografía de tórax sin contraste se observó engrosamiento del intersticio intra e interlobulillar, opacidades parcheadas en vidrio esmerilado y áreas con tendencia a la consolidación a predominio del lado derecho (Fig. 1). Se realizó biopsia de lóbulos superior e inferior derecho por videotoracoscopia, obteniéndose cultivos negativos. En la anatomía patológica se observaron espacios alveolares ocupados por un material acelular, amorfo, eosinófilo que se reforzaba con tinción de PAS, macrófagos intra-alveolares con citoplasma de aspecto espumoso, hallazgos compatibles con proteinosis alveolar pulmonar (Fig. 2).
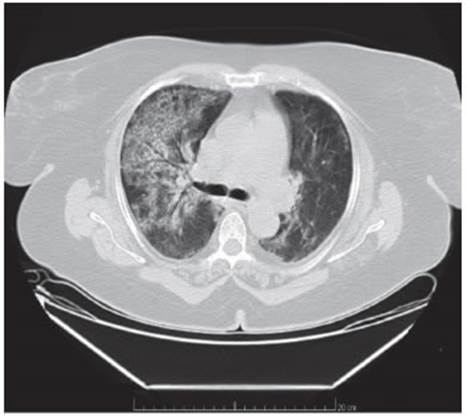
Fig. 1 Tomografía computarizada de tórax, corte axial. Áreas con engrosamiento intersticial, patrón en empedrado a predominio del lado derecho
Se indicó LPT, con aspiración de líquido lechoso, turbio. Se extubó luego de 24 horas. Evolucionó sin requerimientos de oxígeno luego de 3 días de haber realizado el tratamiento por lo que se decidió externación. Luego de 6 meses del diagnóstico, continúa en seguimiento ambulatorio.
Discusión
La PAP es una enfermedad pulmonar difusa que resulta de la acumulación de material lipoproteináceo en los alvéolos y macrófagos alveolares, secundaria a una homeostasis anormal del surfactante, producto de un desequilibrio entre la producción y la eliminación del mis mo1-9. De acuerdo al mecanismo patogénico involucrado se clasifica en: primaria, caracterizada por la alteración en la señalización de la vía del factor estimulante de colonias de granulocitos y macrófagos (GM-CSF) que altera el funcionamiento de los macrófagos y puede ser autoinmune (presencia de autoanticuerpos anti GM-CSF) o hereditaria (mutaciones que codifican subunidades del receptor GM-CSF); secundaria a una enfermedad sisté mica subyacente (síndromes mielodisplásicos, leucemia mieloide aguda, linfoma, mieloma múltiple, adenocarci noma de pulmón, melanoma, enfermedades infecciosas) o exposiciones a tóxicos inhalados; congénita, caracteri zada por mutaciones que alteran la producción o función del surfactante2,3,9.
Se ha informado que la prevalencia es de 3.7 a 40 casos por millón dependiendo del país2,4,5. El 90% de los casos corresponden a PAP autoinmune. A diferencia del caso presentado, es más usual en el sexo masculino con una relación 2:11, 2 y más frecuentemente entre la tercera y sexta década, con mediana de 51 años1,9.
Coincidente con las manifestaciones clínicas de nues tra paciente, la PAP se presenta con disnea de esfuerzo, tos seca, fatiga, y pérdida de peso, aunque alrededor de un tercio de los pacientes pueden ser asintomáticos4-6. En PAP secundaria asociada a otras enfermedades es fre cuente la presencia de fiebre3. En imágenes tomográficas suelen hallarse infiltrados bilaterales en vidrio esmerilado en regiones inferiores, de distribución peri hiliar o difusas, y patrón en empedrado2. Los hallazgos tomográficos en nuestra paciente se encuentran entre los más frecuente mente descritos en la PAP.
El diagnóstico se basa en una historia clínica compati ble, imágenes tomográficas típicas, lavado broncoalveolar con líquido de aspecto lechoso, turbio y espeso, y citología con tinción positiva de PAS1,2,6. La biopsia de pulmón (no siempre necesaria para el diagnóstico) muestra alvéolos ocupados por material acelular, amorfo, eosinófilo que se refuerza con tinción de PAS y macrófagos intra-alveolares con citoplasma de aspecto espumoso1. El diagnóstico de PAP autoinmune se realiza con el dosaje de anticuerpos anti GM-CSF en suero o en el lavado broncoalveolar7,9. En nuestro caso no contamos con la posibilidad de do saje de anticuerpos anti GM-CSF en el país, y debido a la pandemia por COVID-19 nos vimos imposibilitados de enviar la muestra al exterior para su procesamiento, por lo que, aun habiendo descartado causas secundarias, ca recemos de diagnóstico etiológico de PAP. La decisión de realizar la biopsia pulmonar como estrategia diagnóstica se debió a que la sospecha inicial era la presencia de una enfermedad pulmonar parenquimatosa difusa.
Entre los diagnósticos diferenciales figuran afecciones con manifestaciones clínicas y radiológicas similares, como son las infecciones por Pneumocystis jirovecii, mi coplasmas, y enfermedades no infecciosas, como edema pulmonar cardiogénico y no cardiogénico, neumonitis por hipersensibilidad, neumonía organizada y neumonía intersticial usual, entre otras.
El tratamiento estándar es el LPT único o periódico que consiste en intubación selectiva, instilación y reabsorción repetida de solución salina para la remoción del surfac tante acumulado1,5,9. La supervivencia a los cinco años con LPT asciende al 95%4. Las complicaciones descritas vinculadas al procedimiento son hipotermia, neumotórax, fiebre e hipoxia1,5.
El beneficio terapéutico de análogos de factor estimu lante de colonias de granulocitos y macrófagos (GM-CSF) inhalado o subcutáneo sigue siendo objeto de estudio. Se describe en algunas publicaciones una respuesta clínica favorable de entre el 50-60%1,8. Un reciente ensayo clí nico doble ciego con 64 pacientes en el que se comparó tratamiento con GM-CSF inhalado y placebo demostró mejoría modesta del intercambio gaseoso sin beneficio clínico evidente10. El uso de corticoides estaría reservado solo para los casos de PAP secundaria a procesos que lo requieran1. Se plantea el uso de rituximab para reducir los anticuerpos anti GM-CSF, si bien con resultados prome tedores aún sin estudios de eficacia y seguridad1,2,5. La historia natural del PAP autoinmune puede ser: mejoría espontánea (5-7%), síntomas persistentes sin peoría, o progresión hasta falla respiratoria6. La supervivencia a los cinco años sin tratamiento es entre 70% y 85%6. El pronóstico de la PAP secundaria es marcadamente peor, con una supervivencia del 40% a los dos años6. Nuestra paciente se encuentra en seguimiento ambulatorio, con persistencia de disnea de esfuerzo, y ausencia de disnea en reposo, sin desaturación.
Como conclusión y en contexto de la pandemia por COVID-19, destacamos la importancia de pensar en otras entidades respiratorias con cuadros clínicos y radiológicos semejantes a la infección por el nuevo coronavirus.