PUNTOS CLAVE
Conocimiento actual
• La trombolisis dirigida por catéter representa una alter nativa terapéutica para pacientes con tromboembolismo pulmonar agudo de intermedio-alto y de alto riesgo (compromiso hemodinámico).
Contribución del artículo
• El presente artículo describe la experiencia del uso de trombolisis dirigida por catéter en un Hospital General a lo largo de 5 años, donde se trataron 43 pacientes con esta técnica. Se describen las características de los pa cientes, la eficacia para disminuir la presión pulmonar y la seguridad. Se trataron pacientes con y sin compromiso hemodinámico, lográndose una disminución significativa de la presión pulmonar, y sin observarse ningún sangra do intracraneal a pesar del uso de trombolíticos.
El tromboembolismo de pulmón (TEP) agudo represen ta la tercera causa de mortalidad cardiovascular a nivel mundial1 y a pesar de los avances, ésta se encuentra en aumento2. Es una enfermedad muy heterogénea, con una fatalidad menor al 1% en pacientes con muy bajo riesgo3, mayor a 20% en pacientes con inestabilidad he modinámica4, y 95% en quienes se presentan con paro cardiorrespiratorio5. Es por ello que el tratamiento varía según la forma de presentación, siendo la anticoagulación indicada para pacientes de bajo riesgo, y los trombolíticos sistémicos para aquellos con compromiso hemodinámico3,6,7. Este tratamiento, sin embargo, se asocia a aproxima damente 2% de riesgo de hemorragia intracraneal y 10% de sangrado mayor8,9, por lo que incluso en pacientes con compromiso hemodinámico, se utiliza en menos de la mitad de los casos10,11.
A fin de mejorar su pronóstico y tratamiento, las guías clínicas internacionales dividen al TEP agudo en tres grupos de riesgo: bajo, intermedio o alto (también llama do masivo)6,7. El grupo de riesgo intermedio representa un desafío terapéutico, dado que la sola presencia de compromiso ventricular derecho (subgrupo de riesgo intermedio-alto) duplica la mortalidad a mayor a10% con anticoagulación solo con tratamiento anticoagulante, a pesar de presentarse inicialmente sin compromiso he modinámico12.
Estudios in vivo demostraron que el flujo pulmonar, y por ende los trombolíticos administrados en forma sisté mica, se dirigen preferencialmente a las zonas más per fundidas, evitando el contacto estrecho con los trombos13. La trombolisis dirigida por catéter (TDC) es un tratamiento invasivo que consiste en la administración selectiva de trombolíticos en el/los trombos/s en las arterias pulmona res, para mejorar la disolución de los mismos. Dado que el fármaco actúa a nivel local en estrecho contacto con el trombo, la dosis utilizada es menor que cuando se utiliza en forma sistémica, reduciendo significativamente la tasa de sangrado intracraneal. Este tratamiento representa una alternativa, tanto para pacientes con TEP con compromiso hemodinámico, como los de riesgo intermedio-alto que pueden evolucionar tórpidamente con anticoagulación sola7,14. Sin embargo, las guías clínicas no recomiendan su utilización sistemática en ninguna de las situaciones antes mencionadas, y reservan el uso de las terapias dirigidas por catéter (incluida la TDC) a pacientes con compromi so hemodinámico y contraindicación para trombolíticos sistémico, o luego de falta de respuesta a los mismos (indicación IIa, nivel de evidencia C)6.
A pesar de la evidencia sobre la TDC en TEP agudo, no se ha comunicado en forma sistemática el uso en nuestro medio, por lo que el objetivo del presente estudio es evaluar la eficacia y seguridad de la TDC en pacientes con TEP agudo en un centro de Argentina.
Materiales y métodos
Este es un estudio retrospectivo, observacional y analítico. Se incluyeron en forma consecutiva todos los pacientes con TEP agudo en los que se utilizó TDC en el Hospital Italiano de Buenos Aires en su sede central (Ciudad Autónoma de Bue nos Aires) o San Justo-Agustín Rocca (Provincia de Buenos Aires) desde enero de 2014 hasta julio de 2020. No se utilizó una sistemática institucional para la indicación de TDC, la cual estuvo a cargo del equipo médico tratante.
El estudio fue aprobado por el Comité de Ética de Proto colos de Investigación (CEPI) del Hospital Italiano de Buenos Aires (#5779) y se encuentra registrado en el sistema Platafor ma de Registro Informatizado de Investigaciones en Salud de Buenos Aires (PRIISA BA, #2838). Dado que se trata de un estudio retrospectivo, no se obtuvo consentimiento informado a los pacientes para el mismo, aunque éstos brindaron su consentimiento para realizar el procedimiento.
El procedimiento de TDC fue realizado en una sala de angiografía del Servicio de Hemodinamia y Cardiología In tervencionista. En resumen, se realizó una punción venosa femoral y se accedió a la arteria pulmonar para la toma de presión pulmonar sistólica, diastólica y media. Luego se reali zó una arteriografía pulmonar no selectiva (tronco de la arteria pulmonar) y selectiva en cada una de las arterias pulmonares (derecha e izquierda). Se utilizó contraste iodado de baja osmolaridad, el cual fue administrado con bomba inyectora. La cantidad de imágenes y contraste utilizado quedó a cargo del médico tratante, utilizándose la sustracción digital en apnea para mejor visualización. Una vez realizado el estudio diagnóstico de arteriografía pulmonar, se eligió el pulmón a tratar (derecho o izquierdo). Se colocó un catéter específico para liberación de trombolíticos, el cual pudo ser facilitado por ultrasonido (Ekosonic, Boston Scientiffic, EE.UU.) o con vencional (Fountain, Merit Medical, EE.UU.). No se utilizaron catéteres no destinados a la infusión de trombolíticos tipo pig-tail, y se intentó en todos los casos posicionarlo en el lugar de mayor carga trombótica. Por cuestiones técnicas (disponibilidad de catéteres y consola dedicada), no se realizó tratamiento bilateral. El trombolítico utilizado fue rtPA (“altepla sa”, Actilyse, Boehringer Ingelheim, Alemania), administrado a través del catéter de infusión para que actúe en forma local. La dosis y posología de administración quedó a cargo del médico tratante, considerando el cuadro clínico (presencia o ausencia de shock), la carga trombótica, el riesgo de sagrado y la evidencia científica disponible al momento de realizar el procedimiento. Luego de iniciada la infusión, el catéter fue fijado al introductor y el paciente trasladado a una unidad ce rrada (Terapia Intensiva o Unidad Coronaria) para monitoreo. Durante la infusión, se realizó anticoagulación con heparina: tradicionalmente se utilizó heparina sódica en infusión con tinua con un objetivo de tiempo de tromboplastina parcial activado (aPTT) de 1.5 a 2 veces el valor basal, aunque en algunos casos más recientes se utilizó heparina de bajo peso molecular (enoxaparina) a una dosis de 1 mg/kg cada 12 h en pacientes sin alteración de la función renal. Una vez finalizada la infusión, el paciente fue nuevamente trasladado a la sala de Hemodinamia, donde se constató su correcta posición, se retiró el mismo, y se realizó nuevamente medición invasiva de presiones pulmonares y angiografía de control (Fig. 1).

Fig. 1 Imágenes del procedimiento: trombolíticos dirigidos por catéter. A: Angiografía pulmonar selectiva del pulmón derecho donde se observa gran cantidad de trombos (cabeza de flecha) que ocupan la arteria princi pal distal, ocupan segmentos del lóbulo superior y ocluyen varios segmentos del lóbulo inferior donde no se observa contraste. B: Catéter de TDC (flechas), en este caso facilitado por ultrasonido. Cada una de las líneas radiopacas (negras) representa un emisor de ultrasonido. C: Angiografía pulmonar derecha luego de 20 h de infusión de trombolíticos. Nótese la diferencia en el pasaje de contraste y la desaparición del defecto de relleno de la arteria pulmonar derecha distal.
Se analizó un punto final de eficacia y de seguridad. El punto final de eficacia fue la caída de la presión pulmonar media antes y después del TDC. Además, se evaluó el efecto sobre los parámetros vitales (presión arterial, frecuencia car díaca y respiratoria) y sobre los requerimientos de oxígeno. Para este análisis (saturación, requerimiento de oxígeno y frecuencia respiratoria) se excluyeron los pacientes que se encontraban en asistencia respiratoria mecánica. El punto final de seguridad fue la presencia de sangrado grave de la escala Global Utilization of Streptokinase and Tissue Plasminogen Activator for Occluded Coronary Arteries (GUSTO)15, dentro de las 72 h de iniciados los TDC, que incluye al sangrado intracraneal y al sangrado con compromiso hemodinámico. Además, se observó la necesidad de transfusiones y la pre sencia de hematoma del sitio de punción femoral. Por último, se analizó la mortalidad total intrahospitalaria y sus causas.
Las variables cualitativas fueron expresadas mediante frecuencias y números absolutos dado que se trata de un pequeño número de pacientes, mientras que las variables continuas (signos vitales y presiones pulmonares) se expre saron como mediana y rango intercuartil. Se compararon los signos vitales y los valores de presiones pulmonares antes y después de los TDC, mediante prueba de Wilcoxon para variables apareadas (pre-post TDC). Además, se comparó la necesidad de oxígeno suplementario como variable dicotómica antes y después de la TDC, a través del test Mc Nemara. Se utilizó el software SPSS (IBM, EE.UU.) v25 y se consideró estadísticamente significativo a un valor de p < 0.05.
Resultados
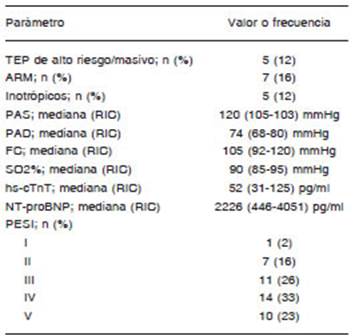
Se incluyeron 43 pacientes, en su mayoría (58%) de sexo femenino, y mediana a avanzada edad, aunque con extremos de 18 y 87 años (Tabla 1). Casi un tercio de los pacientes presentaron como factor desencadenante del TEP una internación reciente (28%) y/o una cirugía re ciente dentro de los 14 días previos al TEP (28%). El 12% presentaba antecedente de trombosis venosa profunda (TVP) conocida, y el 9% ya había tenido un TEP previa mente. Además, el 16% presentaba un cáncer activo, y el índice de masa corporal fue de 29.7 (25.6-37.4) kg/m2.
Dentro de la forma de presentación (Tabla 2), casi todos los pacientes (98%) se presentaron con disnea, siendo ésta a mínimos esfuerzos o de reposo en el 88%, y el 23% tuvo un síncope. El 12% se presentó con compro miso hemodinámico (TEP de alto riesgo/masivo), aunque la mediana de parámetros vitales se encontró dentro de límites normales con excepción de la frecuencia cardíaca que se encontraba aumentada (Tabla 2). El 16% requirió de asistencia respiratoria mecánica y el 12% con uso de inotrópicos. Casi todos los pacientes (95%) presentaron aumento de troponina cardíaca ultrasensible (hs-cTnT) al ingreso. Al analizar el Pulmonary Embolism Severity Index (PESI), se observó que el 80% presentó PESI “alto” (3 a 5)6. En el 84% se realizó una angiotomografía computada (angioTC) que confirmó el diagnóstico previo a la decisión del tratamiento. En el resto de los pacientes, el diagnóstico se confirmó en la sala de Hemodinamia a través de la arteriografía pulmonar. Combinando ambos métodos (angioTC y/o arteriografía pulmonar) se pudo observar que la mayoría (84%) presentó TEP de ramos principales, expresado como compromiso del tronco de la arteria pulmonar o ramas pulmonares (derecha o izquierda). Además, se trató de TEP bilateral en casi todos los casos (95%) con excepción de dos pacientes (5%) que presentaban un único pulmón funcionante, es decir que se comportaron como TEP bilateral. Esto se debió a neumonectomía previa por un adenocarcinoma en un caso, y TEP sobre pulmón trasplantado luego de trasplante unipulmonar en el otro. En todos se realizó ecocardiograma transtorácico, que evidenció dilatación del ventrículo derecho en casi todos (95%), con deterioro de la función contráctil en la mayoría (85%), y 7% con trombo en tránsito en cavidades cardíacas derechas.
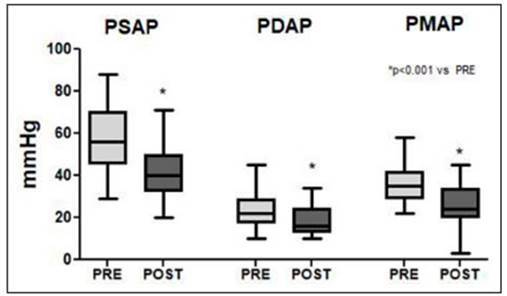
La decisión de TDC fue como terapia inicial en el 53% (n = 23), como escalamiento luego de respuesta insatisfactoria a anticoagulación sola en el 42% (n = 18), y como rescate luego de tratamiento con trombolíticos sistémicos en el 5% (n = 2). En los que se utilizó luego de otro tratamiento inicial, en la mayoría (60%) se decidió escalar a TDC dentro de las 24 h de iniciado el mismo. En relación al procedimiento y la terapéutica utilizada, en todos los casos se trató en forma local un solo pulmón por cuestiones técnicas ya descriptas en métodos, siendo el pulmón derecho el más tratado (n: 33; 77%). Se utilizó un catéter de infusión facilitada por ultrasonido en 40 casos (93%) y se decidió realizar un bolo de rtPA a través del catéter en 38 (89%). Este bolo fue de 5 mg en el 95% y de 1 mg en el 5%. El bolo de 5 mg se utilizó con más fre cuencia en los comienzos de la técnica (100% en primera mitad vs. 56% en segunda mitad, p < 0.001), mientras que en los años 2019-2020 (n = 10) no se utilizó bolo en el 50%, mostrando una tendencia hacia tratamientos menos agresivos. La dosis total de rtPA administrada (incluyendo el bolo) fue de 30 (25-35) mg, en un período de 20 h, y en el 74% de los casos se eligieron 20 h como duración total. En 4 casos (9%), una vez que se realizó la angiografía de control, se decidió recolocar el catéter dentro del mismo pulmón hacia otra área de mayor carga trombótica y con tinuar con la infusión. En estos 4 pacientes la dosis total de rtPA fue de 48 (44-51) mg durante 38 (32-39) horas. El control de presiones luego de la infusión de trombolíticos no estuvo disponible en tres pacientes (7%): uno con TEP de alto riesgo y paro cardiorrespiratorio antes del TDC que falleció a las pocas horas de iniciada la infusión; uno que presentó un hematoma del sitio de punción con compro miso hemodinámico por lo que se retiró en forma urgente sin control posterior; y otro sin intercurrencias donde no se documentaron las presiones por cuestiones técnicas. En el resto de los casos, el tratamiento con CDT resultó eficaz, asociándose a una disminución significativa no solo de la presión pulmonar media sino también de la presión pulmonar sistólica y diastólica (Fig. 2). El descenso de la presión pulmonar media fue 10 (5-13) mmHg. Si bien no se realizó medición del volumen minuto, ningún paciente presentó empeoramiento de su estado hemodinámico después del inicio de TDC, ni inicio/aumento de inotrópi cos en los que se realizaron las mediciones. Además, el tratamiento se asoció a una disminución significativa en el requerimiento de oxígeno suplementario (79% vs. 50%, pre y post-TDC, p < 0.0001). No se observaron diferencias antes e inmediatamente después de la TDC en relación a la presión arterial sistólica (119 [106-135] mmHg vs. 124 [107-137], pre y post TDC, p = 0.86), diastólica (73 [60-84] mmHg vs. 71 [62-78], pre y post TDC, p = 0.14), ni en la frecuencia respiratoria (19 [18-22] mmHg vs. 20 [17-22], pre y post TDC, p = 0.43). Se observó una ten dencia que no resultó estadísticamente significativa hacia una reducción de la frecuencia cardíaca con la TDC (96 [82-105] mmHg vs. 87 [76-99], pre y post TDC, p = 0.06).
Se realizó anticoagulación en todos los casos, antes, durante y después de la TDC. En el 58% se utilizó he parina de bajo peso molecular (HBPM) antes de la TDC, aunque en la gran mayoría (95%) se rotó a heparina sódi ca durante la infusión de TDC. Los dos casos (5%) donde se continuó con HBPM durante la TDC fueron los últimos dos pacientes tratados (año 2020), que continuaron su esquema habitual antes, durante y después de la TDC, siendo la dosis 1 mg/kg cada 12 h. En los pacientes anti coagulados con heparina sódica se realizó el monitoreo con aPTT buscando un objetivo de 1.5-2.5 veces el valor basal, siendo este monitoreo inmediatamente luego de la colocación de la TDC, a las 3 h y luego cada 6 h hasta lograr estabilidad del mismo.
Al evaluar la seguridad de la TDC, no se observó ningún caso de sangrado intracraneal. El sangrado grave (GUSTO) se observó en un solo paciente (2%) en el sitio de punción con compromiso hemodinámico, por lo que se retiró el sistema y se realizó compresión manual con resolución (mencionado previamente). La necesidad de transfusiones fue de 7% (n = 3), y el 12% (n = 5) presen tó hematoma del sitio de punción femoral. Finalmente, la mortalidad intrahospitalaria fue 12% (n = 5): un caso (mencionado anteriormente) falleció a las pocas horas de iniciados los TDC siendo el TEP la causa; un caso por hemorragia digestiva alta a los 7 días de finalizada la TDC; y 3 casos por cáncer avanzado donde se priorizó el confort: uno de ellos 70 años con adenocarcinoma de pulmóm avanzado e historia de neumonectomia, que falleció a los 18 días de la TDC, una paciente de 80 años con carcinomatosis peritoneal que falleció a los 42 días estando en cuidados paliativos, y otro de 80 años que se diagnosticó carcinoma avanzado de páncreas en la tomografía para el TEP y que ya se encontraba en ARM. Esta última presentaba neumonía asociada al respirador previo al TEP e intercurrió nuevamente con shock séptico luego de la TDC, falleciendo a los 10 días.
Discusión
La TDC representa una alternativa terapéutica para pa cientes con TEP de riesgo intermedio (sin compromiso hemodinámico) o alto (con compromiso hemodinámico). El objetivo del tratamiento con TDC consiste en gene rar similar resolución de los coágulos intrapulmonares, disminuyendo la tasa de sangrado grave e intracraneal.
En el presente estudio se describe el uso de esta téc nica en pacientes con TEP agudo en un Hospital General de Buenos Aires, Argentina. Se utilizó en su mayoría en pacientes con TEP de riesgo intermedio-alto, es decir sin compromiso hemodinámico, pero con marcadores de mal pronóstico como dilatación del VD, aumento de marcadores de injuria miocárdica y PESI “alto”. Si bien no contamos con los datos del total de pacientes con TEP de riesgo intermedio y alto que se internaron en el período de estudio, se estiman unos 50-60 pacientes por año, por lo que esta técnica se utilizaría sólo en el 11-13% de este grupo. En el subgrupo de pacientes sin compromiso hemodinámico, un ensayo clínico aleatorizado demostró que la TDC disminuye significativamente la dilatación del VD comparado con anticoagulación sola14, lo cual fue luego confirmado por registros prospectivos16 y revisio nes sistemáticas17. En nuestro estudio, observamos una reducción significativa de la presión pulmonar media, de similar magnitud a la informada en otros estudios prospectivos16,18, asociado a un a una disminución en el porcentaje de requerimiento de oxígeno suplementario, y una tendencia no significativa hacia disminución de la frecuencia cardíaca. Lamentablemente, no medimos sistemáticamente la dilatación del VD antes y después de la TDC, por lo que no podemos comparar nuestros resul tados en este sentido como lo han hecho otros estudios, lo cual representa una importante limitación.
En el presente estudio de 43 casos, un 12% se pre sentó con compromiso hemodinámico, es decir con TEP de alto riesgo o masivo. En este grupo de pacientes, las guías clínicas recomiendan la administración de trom bolíticos sistémicos6,7. Sin embargo, debido al riesgo de sangrado intracraneal, en los registros solo un 20-50% de los pacientes reciben trombolíticos sistémicos10,11. En este subgrupo, la TDC también representa una alternativa de tratamiento que resulta más segura, según se desprende de estudios prospectivos16,18. Sin embargo, dada la falta de estudios comparativos, las guías actuales sólo reco miendan la TDC en pacientes con contraindicación para tratamiento sistémico o luego de la administración de los mismos cuando no se observa mejoría clínica6.
La dosis y administración del rtPA se ha ido modifican do con el tiempo, y no existen en la actualidad consenso sobre la dosis óptima. En la mayoría de los estudios, el tratamiento se realizó mediante dos catéteres (uno en cada rama pulmonar). Sin embargo, en nuestro estudio por cuestiones técnicas solo se trató un pulmón, lo cual pudo haber modificado la dosis y velocidad de infusión. En general se considera una velocidad de infusión no mayor a 1 mg/h por cateter14,19. La dosis total utilizada en nuestro estudio fue aproximadamente 30 mg, lo cual es similar al primer informe de esta técnica (30 mg)19 y a un registro multicéntrico (28 mg)16, aunque mayor que la do sis utilizada en el único estudio aleatorizado (21 mg)14. Un estudio más reciente comparó cuatro esquemas distintos de tratamiento con menor dosis total y menor tiempo de infusión (8 mg/2 h, 8 mg/4 h, 12 mg/6 h y 24 mg/ 6 h) para mayor comodidad del paciente20. Si bien todos los esque mas (incluso con 8 mg) se asociaron a similar reducción en la dilatación del VD, se observó mayor resolución de la carga trombótica con las dosis más altas. Sin embar go, la dosis de 24 mg en sólo 6 h se asoció a sangrado intracranial, por lo que se suspendió esta rama. Dada la reciente publicación de este estudio y la falta de registros que evalúen la seguridad, en nuestra experiencia que se inició en 2014, todos los pacientes recibieron al menos 20 h de infusión y una dosis de 20 mg o más de rtPA. Los primeros estudios de TDC administraron un bolo de 5 mg por catéter19, representado en nuestra práctica inicial. Sin embargo, más recientemente sólo se utiliza bolo de 1 mg, o directamente no se administra bolo en pacientes estables. Este cambio en la literatura también se vio re flejado en nuestra práctica donde los que no recibieron bolo o recibieron sólo 1 mg fueron los últimos pacientes tratados. También se observó un cambio respecto de la anticoagulación durante la TDC. Dado un estudio reciente que demostró la seguridad de continuar con HBPM en lugar de utilizar heparina no fraccionada21, los últimos dos pacientes fueron tratados con esta técnica.
A pesar de la seguridad demostrada en los estudios clínicos con la dosis de rtPA administrada, la TDC utiliza de todas formas trombolíticos en pacientes con comorbilidades por lo que el riesgo de sangrado exis te. En nuestra serie no observamos ningún sangrado intracraneal a pesar de haber tratado también un 12% con inestabilidad hemodinámica, similar a dos registros prospectivos publicados16,18. Un solo paciente presentó sangrado grave según clasificación GUSTO, debido a un hematoma del sitio de punción, idéntico a un registro prospectivo de 150 casos18. Es por ello que técnicas de punción utilizando ecografía, u otras alternativas como la vía venosa antebraquial22 en obesos podrían disminuir las complicaciones del sitio de punción, que en nuestra serie se observaron en el 12%. Recientemente, hemos incorporado la utilización de punción guiada por ecografía para todos los pacientes sometidos a TDC.
El presente estudio presenta numerosas limitaciones. En primer lugar, se trata de un estudio retrospectivo uni céntrico con un relativo bajo número de pacientes tratados en un período mayor a 6 años. Esta baja utilización de la técnica es consecuencia de la falta de estudios aleato rizados que demuestren la eficacia sobre puntos finales duros y con mayor número de pacientes, sobre todo en aquellos con TEP de riesgo intermedio que no presentan inestabilidad hemodinámica. En segundo lugar, se trata de un estudio descriptivo sin compararse con otros pa cientes con TEP de similares características en los que se decidió otro tratamiento, sin poder afirmar el porcentaje de uso de TDC (estimado en 11-13%), ni cuales fueron las características que llevaron a la indicación de TDC. Esto último excluye la posibilidad de realizar comparaciones sobre la seguridad y efectividad de la TDC comparada con la anticoagulación aislada o la trombolisis sistémica. Además, la naturaleza retrospectiva pudo haber llevado a algún sesgo de selección. Sin embargo, solo el servicio de Hemodinamia y Cardiología Intervencionista realiza esta práctica por lo que es poco probable que se hayan tratado más pacientes no reportados en el presente. En tercer lugar, la mayoría de estudios demostró que la TDC reduce significativamente la sobrecarga del VD, con an giotomografía o ecocardiograma, pero en nuestro estudio no se realizó una medición sistemática de la misma por lo que no pudimos evaluar el efecto de la TDC en este importante parámetro. Esta limitación es de gran impor tancia dado que la reducción de la relación VD/VI fue el objetivo final primario del único estudio aleatorizado con TDC14. Sin embargo, nuestros resultados en cuanto a los cambios en las presiones pulmonares fueron similares a lo publicado. Por último, en este estudio se analizaron los resultados solamente durante la internación, sin se guimiento a largo plazo. La cohorte prospectiva ELOPE mostró que casi 50% de los pacientes que sobreviven al TEP agudo presentan limitación en su capacidad fun cional, aunque el efecto de la TDC sobre el denominado “síndrome post-TEP” es desconocido.
En conclusión, la TDC representa una alternativa de tratamiento para pacientes con TEP de riesgo alto o intermedio-alto, que se asocia a una reducción significa tiva de las presiones pulmonares. Se requieren de más estudios con mayor número de pacientes y puntos finales clínicamente relevantes a fin de extender su indicación, que actualmente queda reservada para casos muy se leccionados. En nuestra serie no observamos ningún sangrado intracraneal y un 2% de sangrado grave, similar a lo comunicado en la literatura.