La enfermedad COVID-19, causada por el SARS-CoV-2, surgió a fines de 2019 en Wuhan, China1 y desde entonces se ha extendido de forma global. Fue declarada pandemia el 12 de marzo de 2020 por la Organización Mundial de la Salud. Al 7 de diciembre de 2020 el número de casos confirmados en el mundo superó los 65.8 millo nes, de los cuales más de 1.5 millones han muerto2. La presentación clínica de la infección por SARS-CoV-2 es variable, desde formas asintomáticas a manifestaciones graves que requieren internación en unidad de cuidados intensivos y pueden causar la muerte, habitualmente por insuficiencia respiratoria3. La tasa de mortalidad es ma yor en personas mayores de 65 años y en aquellas con enfermedades crónicas, diabetes, obesidad, enfermedad cardiovascular, enfermedad pulmonar y neoplasias3.
Las inmunodeficiencias, tanto primarias como se cundarias, son consideradas factores de riesgo para las formas graves de COVID-194. Los pacientes con inmuno deficiencias suelen tener mayor susceptibilidad a distintos tipos de infecciones y mayor frecuencia de complicaciones no infecciosas, tales como trastornos inflamatorios cróni cos, linfoproliferación policlonal y neoplasias5. Las secue las de las infecciones, principalmente pulmonares, y las complicaciones no infecciosas, así como sus tratamientos, principalmente inmunosupresores, podrían aumentar el riesgo de estos pacientes de padecer formas graves de COVID-196. Las inmunodeficiencias humorales (IDH), es decir, aquellas causadas por déficit de anticuerpos, constituyen la principal causa de inmunodeficiencias primarias en adultos. Entre estas, la inmunodeficiencia común variable (IDCV) es la más frecuente; se estima que afecta una de cada 25 000 a 50 000 personas5.
Desde que comenzó la pandemia, se ha comunicado la evolución de COVID-19 en un escaso número de pacientes con IDH6-13. Presentamos una serie de casos en adultos con IDH primarias y secundarias que contra jeron infección por SARS-CoV-2 y revisamos los trabajos publicados, con el fin de contribuir a establecer el riesgo de formas graves de COVID-19 en pacientes con IDH.
Casos clínicos
Desde el comienzo de la pandemia hasta el momento, eva luamos seis pacientes con inmunodeficiencia e infección por SARS-CoV-2, tres mujeres y tres varones (edad promedio 48.5 años, rango 20-67). Todos tenían IDH y se encontraban en tratamiento de reemplazo con inmunoglobulinas al momen to del diagnóstico de COVID-19. Cuatro pacientes tenían diag nóstico de IDH primaria: tres IDCV y uno agammaglobulinemia ligada al X (XLA). Los dos restantes tenían diagnóstico de IDH secundaria, uno síndrome de Good (timoma e hipogammag lobulinemia), y el otro hipogammaglobulinemia secundaria a rituximab. En todos, el diagnóstico de COVID-19 se realizó mediante hisopado nasofaríngeo y orofaríngeo con resultado positivo para el SARS-CoV-2 por reacción en cadena de la polimerasa. Para cada paciente se registró el diagnóstico de la inmunodeficiencia, la edad al momento del comienzo de los síntomas de la inmunodeficiencia, la edad al diagnóstico de COVID-19, el último dosaje de IgG previo a la infección (entre 10 y 60 días antes), las comorbilidades, la evolución de la infección por COVID-19 y se calculó el tiempo de evolución de la inmunodeficiencia (Tabla 1).
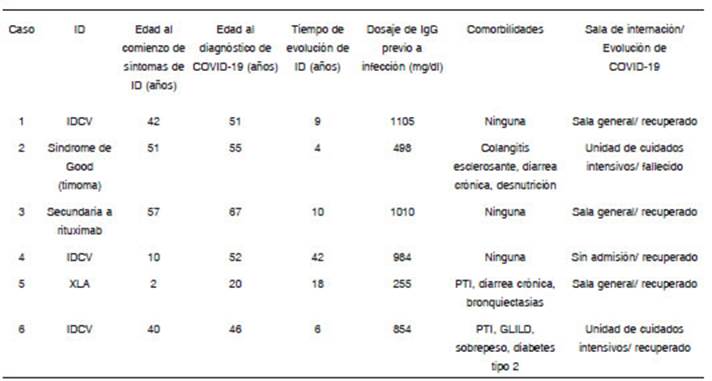
Tabla 1 Antecedentes clínicos y características de la enfermedad por COVID-19 en seis pacientes con inmunodeficiencias humorales
El paciente 1 era una mujer de 51 años con diagnósti co de IDCV en 2010 sin comorbilidades. Desde entonces recibió tratamiento de reemplazo con gammaglobulina por vía endovenosa (IVIG) de forma regular. Consultó por ageu sia, hiporexia y un único registro febril de 38 °C. Se realizó diagnóstico de COVID-19 y fue hospitalizada con resultados de laboratorio y tomografía axial computada (TAC) de tórax normales. Evolucionó con tos seca, sin cambios en el exa men físico y con saturación de oxígeno normal. Recibió IVIG al cuarto día de internación, 15 días después de su infusión habitual. A los 11 días desde el inicio de los síntomas presentó aumento de la tos y disnea, por lo que se realizó una nueva TAC de tórax que mostró opacidades en vidrio esmerilado y micronodulares en el pulmón izquierdo, algunas con tendencia a la consolidación. Se inició tratamiento con lopinavir/ritonavir, sumado a ampicilina-sulbactam y claritromicina para cubrir posible neumonía bacteriana según el protocolo de la insti tución. Al tercer día de tratamiento presentó diarrea, vómitos y aumento de la bilirrubina por lo que se suspendieron los tratamientos instaurados. Evolucionó con resolución total de los síntomas por lo que a los 14 días de internación recibió el alta hospitalaria.
El paciente 2 era un varón de 55 años con diagnóstico de síndrome de Good en 2019, en tratamiento de reemplazo con IVIG en forma irregular debido a falta ocasional de acceso a la medicación. En 2016 se diagnosticó timoma AB capsu lado que fue tratado quirúrgicamente y en 2018 colangitis esclerosante primaria, diarrea crónica y desnutrición con mal estado general e indicación de trasplante hepático. Consultó por fiebre y disnea progresiva, y se realizó diagnóstico de COVID-19 con neumonía bilateral extensa en TAC de tórax. Ingresó en unidad de cuidados intensivos por requerimiento de asistencia respiratoria mecánica y sostén hemodinámi co. Fue tratado con IVIG a los 14 días del ingreso, 32 días después de su última infusión. A los 18 días del ingreso se diagnosticó sepsis por Enterococcus resistente a vancomi cina y Klebsiella productora de carbapenemasas y tres días después falleció.
El paciente 3 era una mujer de 67 años con diagnóstico de inmunodeficiencia humoral secundaria a rituximab desde 2019 en tratamiento de reemplazo con inmunoglobulina por vía subcutánea de forma regular. En 2006 se diagnosticó linfoma no Hodgkin de células B grandes que fue tratado con múltiples esquemas quimioterápicos asociados a rituximab, que culminaron en 2010 con la remisión del linfoma. Consultó por fiebre y diarrea de tres días de evolución con saturación de oxígeno 92% a aire ambiente y antecedente de contacto estrecho con paciente COVID-19 confirmado. Se diagnosticó COVID-19 con infiltrado pulmonar bilateral en vidrio esmeri lado en la TAC de tórax y se indicó su internación. Comenzó tratamiento con dexametasona, enoxaparina y se aumentó la frecuencia de inmunoglobulina (8 gr) por vía subcutánea de intervalos de 7 días a intervalos de 5 días. Evolucionó favorablemente y a los 14 días de internación recibió el alta hospitalaria.
El paciente 4 era una mujer de 52 años, con diagnóstico de IDCV sin comorbilidades desde 2017 y en tratamiento de reemplazo con inmunoglobulina por vía subcutánea en forma regular. Consultó por fiebre, cefalea y mialgias de un día de evolución. Se realizó diagnóstico de COVID-19. Evolucionó con astenia, disnea, tos seca, estertores crepitantes bibasales en el examen físico y desaturación ante esfuerzos moderados. A los 14 días fue dada de alta por mejoría de la astenia y resolución del cuadro respiratorio.
El paciente 5 era un varón de 20 años con diagnóstico de XLA en 2008, en tratamiento de reemplazo con IVIG en forma irregular en el último año debido a problemas en el acceso a la medicación. Presentaba antecedentes de púrpura trombocitopénica autoinmune y bronquiectasias. Consultó por registros febriles, disnea clase funcional III y tos seca. Se diagnosticó COVID-19 con infiltrados pulmonares parcheados bilaterales en TAC de tórax por lo que fue internado y recibió tratamiento con antibióticos y corticoides. Al cuarto día de internación, 16 días después de su última infusión, se aplicó IVIG. Evolucionó con resolución de la disnea sin requerimiento de oxígeno, por lo que recibió el alta hospitalaria a los siete días de internación.
El paciente 6 era un varón de 46 años con IDCV en trata miento de reemplazo con IVIG de forma regular, enfermedad pulmonar intersticial linfocítica granulomatosa en la TAC de tórax, sobrepeso y diabetes mellitus tipo 2 en tratamiento con metformi na. Consultó por fiebre de cuatro días de evolución, disnea clase funcional II y tos seca. Se diagnosticó COVID-19 y se indicó su internación. La TAC de tórax mostró infiltrados pulmonares bilaterales. Evolucionó con insuficiencia respiratoria por lo que a los siete días del ingreso pasó a unidad de cuidados intensivos con requerimiento de asistencia respiratoria mecánica. El décimo día de internación, 15 días después de su última infusión recibió IVIG. Tras la mejoría clínica, a los 32 días fue trasladado a sala común, y externado al cumplir aproximadamente 90 días de internación, sin secuelas respiratorias ni neurológicas.
Discusión
El término inmunodeficiencia comprende una amplia variedad de enfermedades, que pueden ser clasificadas según el componente del sistema inmune afectado. Son consideradas factores de riesgo de mala evolución de COVID-19 debido a que ciertos defectos de la inmuni dad impedirían producir una respuesta adecuada para controlar la infección4. Llamativamente, desde el inicio de la pandemia se han realizado escasas publicaciones de asociación entre IDH y COVID-19. Las IDH primarias más frecuentemente asociadas a COVID-19 son la IDCV y la XLA6-13. Algunos autores han propuesto que la ausencia de linfocitos B podría actuar como un factor protector para formas graves en los pacientes con XLA, no así en aque llos con IDCV cuyos linfocitos B presentan alteraciones funcionales características4,10.
Se ha publicado acerca de 14 pacientes con XLA, de los cuales 7 desarrolaron neumonía, pero ninguno requirió asistencia respiratoria mecánica y todos se recuperaron6-8,10,11. En concordancia con esto, nuestro paciente con XLA y neumonía COVID-19 tuvo una rápida recuperación, pese a no haber recibido IVIG de forma regular y a presentar enfermedad pulmonar previa por bronquiectasias.
De los 43 casos de COVID-19 en pacientes con IDCV publicados a la fecha, 31 tuvieron síntomas asociados a compromiso pulmonar y 12 fallecieron6-9,13. El compromiso pulmonar preexistente parecería ser un factor pronóstico importante, y es fundamental considerarlo en estos ca sos dada su alta prevalencia: entre el 75 y el 90% de los pacientes con IDCV presentan alteraciones en la TAC de tórax; las más frecuentes son las bronquiectasias y la enfermedad pulmonar intersticial linfocítica granuloma tosa5,14. En nuestra serie, todos los pacientes con IDCV tuvieron compromiso pulmonar por SARS-CoV-2, solo uno requirió asistencia respiratoria mecánica y ninguno falleció. El paciente 6 es el único de los tres con IDCV que tenía compromiso pulmonar previo, además de otras comorbilidades; esto probablemente contribuyó a su mala evolución que requirió admisión en unidad de cuidados intensivos, al igual que observamos en otras series6,8,10,13.
Respecto al uso de inmunoglobulina como terapia de reemplazo y su rol protector frente a esta infección, es poco probable que los productos disponibles actualmente contengan anticuerpos específicos contra el SARS-CoV-2, pero sí podrían disminuir la respuesta inflamatoria como se observa en la infección grave por SARS-CoV-2, y conferir protección adicional contra la sobreinfección por bacterias que pueden ensombrecer el pronóstico de los pacientes15.
El único paciente fallecido en nuestra serie tenía síndrome de Good, no recibía IVIG de forma regular y la que recibió durante la internación no parecería haber modificado la evolución clínica. Su mala evolución proba blemente fue consecuencia del mal estado general previo y del compromiso celular asociado a su inmunodeficiencia.
La tasa de letalidad por COVID-19 entre los pacientes con IDCV publicados es 27.9%, diez veces mayor que la de la población general, calculada en 2.2%2. Al igual que en la población general, posiblemente el número de pacientes con inmunodeficiencia infectados por el SARS-CoV-2 sea mucho mayor que el notificado, especialmente entre los que no tienen comorbilidades y que pueden haber tenido un curso asintomático u oligosintomático de la infección. Por este motivo, consideramos que la tasa de mortalidad publicada carece de relevancia, ya que está calculada sobre la base del pequeño número de pacientes con IDCV disponibles en la literatura.
A pesar de que los pacientes con inmunodeficiencias pertenecen al grupo de alto riesgo de enfermedad grave por SARS-CoV-2, creemos que pueden ser clasificados en dos subgrupos, uno sin comorbilidades y con trata miento adecuado y el otro con comorbilidades y/o niveles subóptimos de inmunoglobulinas. Las inmunodeficiencias humorales sin comorbilidades en tratamiento de reem plazo con gammaglobulinas no parecieran constituir un factor de riesgo en sí mismas para una mayor gravedad en la infección por SARS-CoV-2, como se observa en los pacientes con XLA y con IDCV sin comorbilidades. El compromiso pulmonar secuela de infecciones o se cundario a enfermedades no infecciosas, el mal estado general y los tratamientos que causen inmunosupresión celular podrían ser los verdaderos factores de riesgo para la enfermedad grave por SARS-CoV-2 en pacientes con inmunodeficiencia humoral.














