PUNTOS CLAVE
• El tratamiento de elección del TCG sigue siendo quirúr gico, ya sea resección en bloque o curetaje intralesional.
• El denosumab tiene principalmente 2 indicaciones: te rapia neoadyuvante o tratamiento definitivo en tumores irresecables.
• El denosumab produce estabilización del tamaño y regresión del estadio tumoral.
• El uso de denosumab, además de presentar algunos efectos adversos, se asocia a mayores tasas de recu rrencia local.
• La transformación maligna del TCG luego de recibir de nosumab está informada y no debe ser menospreciada a la hora de indicar esta droga.
Introducción
El tumor de células gigantes (TCG) de hueso es una neoplasia ósea primaria caracterizada fundamentalmente por su agresividad local. Representa aproximadamente el 5% de los tumores óseos primarios1. Su localización más frecuente es la región epifisaria de huesos largos, especialmente el fémur distal, tibia proximal o radio distal, aunque también se puede encontrar en el esqueleto axial y dedos de las manos y pies2. A partir de 2013 ha sido clasificado por la Organización Mundial de la Salud como un tumor de agresividad intermedia, localmente agresivo y raramente metastatizante. Es considerado uno de los tumores óseos más controversiales y menos predecibles en su comportamiento. En términos de afectación local se reconocen 3 grados, según la clasificación de Cam panacci3: Grado 1: lesión intraósea con indemnidad de las corticales (latente); Grado 2: lesión ósea con erosión y afinamiento cortical, pero sin invasión de tejidos circun dantes; Grado 3: lesión ósea con destrucción cortical y extensión a partes blandas. El tratamiento para los gra dos 1 y 2 está protocolizado y consiste en resecciones intralesionales y adyuvancia local, con el fin de resecar el tumor, lograr su control y conservar la articulación ad yacente. Sin embargo, en los tumores grado 3, debido a su comportamiento agresivo y destructivo, su tratamiento continúa en discusión4. Muchos autores sugieren abor dar este subgrupo en particular como si fueran tumores malignos, planteando alternativas quirúrgicas tales como resección en bloque, amputación o artrodesis5. No obs tante, en los últimos años el tratamiento farmacológico ha ganado terreno, particularmente el denosumab. Se trata de un anticuerpo monoclonal humano que se une a un ligando expresado por las células mononucleares del TCG, llamado RANKL (del inglés Receptor activator of nu clear factor kappa-Β ligand), impidiendo su acoplamiento con el receptor RANK, presente en las células gigantes multinucleadas del tumor. La interacción entre RANK y RANKL resulta clave en el reclutamiento y actividad de estas células, que son responsables del comportamiento lítico, localmente agresivo del tumor. La inhibición de dicha interacción por el denosumab resulta en una disminución de la osteólisis y, secundariamente, osificación progresi va de las lesiones líticas6. El denosumab se ha utilizado como terapia neoadyuvante en tumores localmente muy agresivos y como tratamiento definitivo en los casos en que, por su tamaño y localización anatómica, resultan irresecables (pelvis, sacro, columna vertebral)6.
El propósito de este estudio fue evaluar un grupo de pacientes con diagnóstico de TCG óseo tratados con denosumab previo a la cirugía, identificar las indicaciones de denosumab como terapia neoadyuvante, determinar los efectos del denosumab a nivel clínico, radiológico, e histológico y reconocer sus complicaciones y efectos adversos.
Materiales y métodos
El siguiente es un estudio de cohorte retrospectivo. Se realizóuna búsqueda en nuestra base de datos oncológica entre 2010 y 2018 y se revisaron todas las historias clínicas de los pacientes con diagnóstico de TCG óseo tratados en nues tra institución. Se incluyeron para el estudio aquellos con diagnóstico de TCG confirmado por histología, tratados con denosumab y posterior cirugía, con un seguimiento mínimo de 12 meses. Se excluyeron los que recibieron solo denosumab, sin cirugía posterior.
Tomamos como punto de inicio de seguimiento el mo mento del diagnóstico y como punto final la última consulta médica. La recopilación de los datos demográficos y clínicos de cada uno fue realizada a través de la historia clínica electrónica de nuestro hospital y estuvo a cargo de uno de los investigadores.
Todos los casos fueron discutidos en ateneo multidisci plinario y la decisión terapéutica consensuada entre los es pecialistas. La dosis de tratamiento neoadyuvante, siguiendo guías y recomendaciones internacionales, fue de 120 mg de denosumab subcutáneo, mensuales, con dos dosis de ataque en el primer mes7. La duración del tratamiento previo a la cirugía fue de 3 meses.
Todos los pacientes recibieron evaluación odontológica previa al tratamiento con denosumab por el riesgo de os teonecrosis de mandíbula8 y fueron seguidos mensualmente para advertir efectos indeseados. Además, se realizaron mediciones control de calcemia y fosfatemia y se indicó su plemento con calcio y vitamina D para evitar valores riesgosos de hipocalcemia.
Se categorizaron las complicaciones como menores y mayores, considerando mayores solo a aquellas que deman daron la suspensión del tratamiento. Además, se dividieron según su tiempo de evolución en complicaciones de corto plazo, si ocurrieron intra-tratamiento con denosumab, o de largo plazo, cuando se presentaron una vez finalizado el mismo.
Las piezas de resección fueron procesadas y examinadas según protocolos y recomendaciones del Colegio Americano de Patólogos9. El análisis histológico estuvo a cargo de un patólogo especializado en tumores musculoesqueléticos. La respuesta histológica fue considerada completa cuando se evidenció una reducción mayor del 90% en el número de células gigantes multinucleadas. Cuando se observó una pérdida de entre el 10% y 90% la respuesta fue considerada parcial y, por último, si la reducción fue menor del 10%, la respuesta fue considerada ausente7.
Los pacientes fueron seguidos clínica y radiográficamente para valorar la respuesta al tratamiento, utilizando la clasifi cación de Campanacci3. El control postoperatorio se realizó a los 15, 30, 90 días y luego cada 3 meses, con radiografías de frente y perfil.
El presente trabajo fue previamente aprobado por el comité de ética del Hospital Italiano de Buenos Aires.
Resultados
Sobre un total de 80 pacientes con diagnóstico de TCG tratados en nuestra institución, 17 fueron tratados con denosumab, en 3 de los cuales se indicó como único tratamiento porque no tenían indicación quirúrgica. De los 14 incluidos finalmente para el análisis, tratados con denosumab neoadyuvante y cirugía, 8 eran de sexo feme nino y 6 masculino. El promedio de edad fue de 35 años (rango de 23 a 46). La localización más frecuente fue el radio distal (n = 4). El tiempo de seguimiento promedio fue de 51 meses (rango 12 a 120) (Tabla 1).
En 8 pacientes la lesión fue presentación inicial de TCG, mientras que en 6 se trató de una recidiva de una lesión previamente tratada con cirugía. Los 8 TCGs de presentación inicial fueron clasificados como Grado 3 de Campanacci. En 5 de ellos se realizó resección en bloque, mientras que en 3 el tratamiento quirúrgico fue curetaje intralesional. De los 6 pacientes con recidiva de TCG, 4 fueron tratados con resección en bloque y 2 con curetaje. El tratamiento preoperatorio incluyó denosumab según protocolo en todos los casos. En todos se eviden ció una mejoría clínica (manifestada por disminución del dolor), luego de haber recibido 3 meses de tratamiento preoperatorio, siguiendo las guías internacionales7, de 120 mg de denosumab. También se observaron en 13 pacientes cambios radiográficos significativos, incluyendo calcificación del tumor, estabilización del tamaño y mejor delimitación de los márgenes (Figs. 1 y 2).
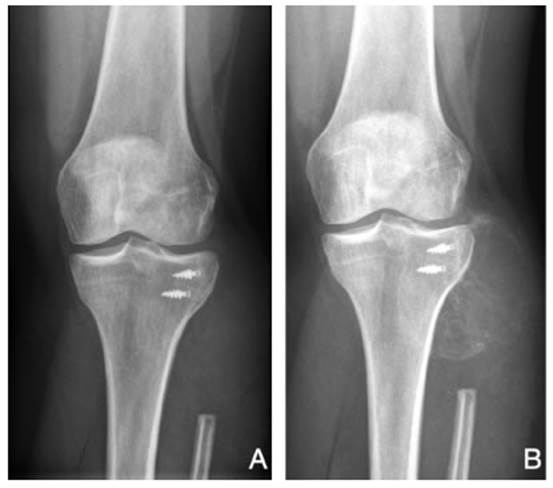
Fig. 1 Radiografía antero posterior de rodilla izquierda en un paciente operado previamente de un tumor de células gigantes del hueso (TCG) grado 3 de peroné proximal. Actualmente presenta recurrencia local. A: Imagen previa al tratamiento con denosumab. B: Osificación y delimitación de la recurrencia luego de los 3 meses de tratamiento neoadyuvante con denosumab (4 dosis de 120 mg).
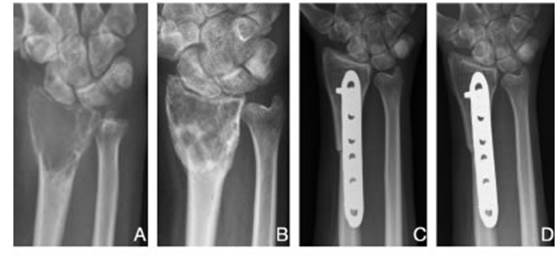
Fig. 2 A: Radiografía anteroposterior de radio distal izquierdo en la cual se evidencia una lesión lítica epifisaria correspondiente a un TCG. B: Osificación de la lesión luego de 3 meses de tratamiento neoadyuvande con denosumab. C: Radiografía postoperatoria inmediata. Reconstrucción de radio distal con trasplante osteoarticular. D: Signos de consolidación en el control anual postoperatorio
A nivel histológico, luego de la resección tumoral, 11 pacientes presentaron una respuesta completa, 2 res puesta parcial y 1 ausencia de respuesta. En la figura 3 se muestran los hallazgos histológicos del TCG antes del tratamiento con denosumab (Fig. 3 A), con respuesta par cial (Fig. 3 B), y con respuesta completa (Fig. C, D, E y F).
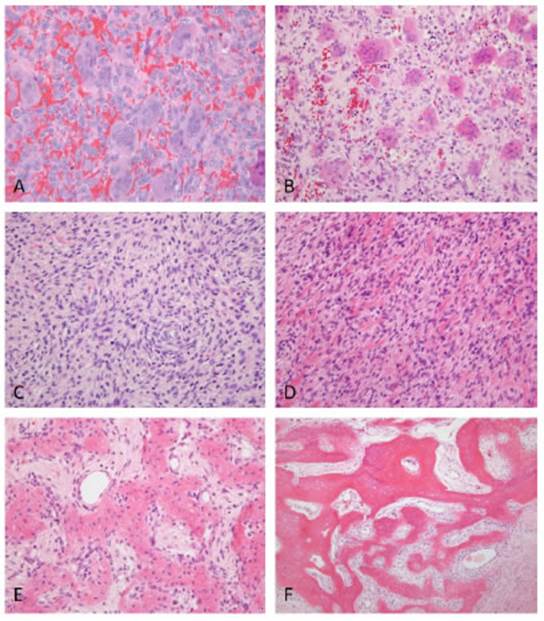
Fig. 3 Hallazgos histológicos en casos de TCG tratados con denosumab. A: TCG antes del tratamiento con denosumab. Se observan numerosas células gigantes multinucleadas y células mononucleadas con núcleos de similares características (hematoxilina-eosina, 40X). B: Respuesta parcial a denosumab. Leve disminu ción en el número de células gigantes (hematoxilina-eosina, 40X). C: Respuesta completa a denosumab. Área con pérdida total de las células gigantes multinu cleadas (hematoxilina-eosina, 40X). D, E y F: Respuesta completa a denosumab. Ausencia de células gigantes y reemplazo por tejido óseo, en diferentes estadios de maduración, desde delgadas láminas de osteoide (D, hematoxilina-eosina, 40X) hasta trabéculas menos (E, hematoxilina-eosina, 40X) y más maduras (F, hematoxilina-eosina, 10X).
En términos de recurrencia local, en 6 de los 14 pa cientes se documentó una recidiva tumoral. El tiempo promedio para la aparición de la recurrencia fue de 21.3 meses (rango 6 a 57 meses). Éstas se localizaron en hueso (n = 4) y partes blandas (n = 2). En 3 casos, 2 tratados con curetaje y 1 con resección en bloque, se trató de la primera recidiva tumoral. Los otros 3 fueron pacientes con recidivas previas, todos tratados en esta última instancia con resección en bloque.
En 7 pacientes se registraron efectos adversos o complicaciones asociadas a la utilización de denosumab. En 6 casos fueron complicaciones tempranas: fatiga y astenia (n = 2), náuseas y vómitos (n = 1), gingivitis (n = 1) y alteraciones del laboratorio (n = 2). Estas últimas se evidenciaron como descenso de la calcemia, la cual fue contrarrestada con suplementos de calcio y Vitamina D como parte del protocolo. En ninguno de los casos fue necesaria la interrupción del esquema terapéutico.
Un paciente presentó una complicación tardía (recidi va tumoral a los 12 meses), que resultó ser un sarcoma indiferenciado y se interpretó como una malignización secundaria del TCG. En este caso debió realizarse una amputación suprapatelar de su miembro inferior como tratamiento oncológico. El caso fue previamente publicado por nuestro grupo10.
Discusión
Una de las características sobresalientes del TCG óseo es su agresividad local. Esto representa un desafío para el cirujano oncológico, sobre todo en los tumores grado 3 de Campanacci que presentan un gran compromiso óseo y articular. El tratamiento de elección clásico para el TCG incluye el curetaje intralesional con adyuvancia intraope ratoria y la resección en bloque. Distintos agentes (nitró geno líquido, argón, fenol) se utilizan como tratamiento adyuvante junto con el curetaje para disminuir el riesgo de recurrencia local1. La introducción del denosumab como alternativa de tratamiento para el TCG ha cambiado el panorama de la terapéutica de esta enfermedad y se puede utilizar como terapia neoadyuvante, con el objetivo de detener el crecimiento tumoral y delimitar la lesión. También se ha descrito su utilidad como tratamiento definitivo o paliativo, enlenteciendo la progresión del ta maño tumoral y disminuyendo los síntomas asociados11. En nuestra serie de pacientes tratados con denosumab y posterior resección tumoral se evidenció, a nivel his tológico, respuesta parcial o total (definida como una reducción mayor del 10% del número de células gigantes multinucleadas, generalmente acompañada de fibrosis y osificación), en 13 de 14 pacientes. En concordancia, en estos 13 pacientes los estudios radiológicos mostraron estabilización del tamaño y calcificación del TCG. Estos hallazgos, que se hallan en línea con lo descrito en la lite ratura12,13, redundan en una mejor delimitación del tumor y, por ende, facilitan la planificación preoperatoria posi bilitando cirugías con menor morbilidad. Cabe mencionar que los cambios histológicos en estos TCGs tratados con denosumab pueden generar dificultades diagnósticas simulando, al microscopio, otras lesiones óseas primarias como displasia fibrosa, fibroma no osificante, osteoblas-toma y, en algunos casos, osteosarcoma13.
En estudios multicéntricos se evidenció buena res puesta al denosumab, con una tasa de respuesta mayor al 80%7,14; sin embargo, las recurrencias locales han planteado controversia. Luengo-Alonso y col. en su revisión bibliográfica (1095 pacientes) informaron que la recurrencia local en aquellos que recibieron denosumab neoadyuvante fue, en promedio, de un 9%6. Sin embar go, y a pesar de los resultados promisorios iniciales, los últimos trabajos proponen que el denosumab se comporta como un factor de riesgo importante para la recurrencia local15. Scoccianti y col. evidenciaron en su serie tener más riesgo de recurrencia local en pacientes tratados con denosumab, curetaje y crioterapia que en aquellos con curetaje y crioterapia solamente. Atribuyeron esta complicación a la formación de un anillo óseo periférico alrededor de la lesión, que no pudo ser resecado con el curetaje16. En 2020, una revisión sistemática con 1082 pacientes reportó que la administración de denosumab se asocia con un mayor riesgo de recurrencia debido a una variedad de razones, aunque se ha demostrado que es eficaz para aliviar el dolor17.
El tipo de cirugía utilizada luego del tratamiento con denosumab también puede ser un factor de riesgo para la recurrencia local. Agarwal y col. encontraron una mayor tasa de recurrencia local en aquellos tratados con cure taje que en los tratados con resección completa18. En un estudio más reciente, Perrin y col. mostraron una tasa de recurrencia local del 44% en pacientes que previamente recibieron cirugía de conservación articular19. De los 14 pacientes de nuestra serie, 6 presentaron recidiva local. Dentro de este último grupo, 4 habían sido resecados en bloque y 2 habían sido tratados con curetaje. El tiempo promedio de aparición de la recurrencia fue de 21.3 meses (rango 6 a 57 meses).
Como cualquier terapéutica farmacológica, el denosu mab no está exento de efectos adversos6. La osteonecro sis de mandíbula es una complicación infrecuente pero característica8. Al inhibir la función osteoclástica el deno sumab puede generar disminución de los niveles séricos de calcio, por lo que es de vital importancia el monitoreo de la calcemia20. Es importante destacar también que se han comunicado varios casos de malignización en TCGs tratados con denosumab, uno de ellos incluido en esta serie10,21. Aunque los mecanismos de esta transforma ción maligna son poco claros, una relación causa-efecto no pudo ser demostrada y se trata de un hallazgo poco frecuente, esta posibilidad debe tenerse en cuenta. Se recomienda un monitoreo estricto en aquellos pacientes con signos radiográficos de pobre mineralización o falta de respuesta al denosumab22.
Del total de nuestra serie, 6 pacientes tuvieron por lo menos un efecto adverso temprano durante el tratamiento, aunque la mayoría de ellos fueron considerados menores (fatiga, dolores musculares, astenia, náuseas, constipa ción e hipocalcemia) y no requirieron la suspensión del tratamiento.
Este trabajo presenta algunas limitaciones. Teniendo en cuenta que la introducción del denosumab al merca do para la utilización en TCG es reciente, el número de pacientes es escaso. La población tratada es además heterogénea, e incluye casos con presentación inicial de TCG y otros con una o varias recidivas previas, además de tumores en diferentes localizaciones anatómicas.
En conclusión, según nuestra experiencia el deno sumab es una herramienta útil para el tratamiento del TCG, que genera cambios evidentes a nivel histológico, radiológico y clínico que se resumen en estabilización del tamaño tumoral, calcificación y mejor delimitación. Esto permite, en casos seleccionados, realizar cirugías con menor morbilidad. Debe tenerse en cuenta que el uso de denosumab está asociado a mayor tasa de recurren cias locales7, y no está exento de efectos adversos. Su utilización debe estar monitorizada por un equipo médico multidisciplinario.















