PUNTOS CLAVE
• Existe un creciente interés por la identificación de bio marcadores que faciliten el entendimiento de la esclero sis múltiple y así lograr identificar factores diagnósticos y pronósticos que permitan un mejor tratamiento del paciente. Se ha demostrado en estudios previos que concentraciones elevadas de glutamato son responsa bles de la pérdida neuronal.
• A través de este estudio se demuestra la relación exis tente entre niveles elevados de glutamato en líquido cefalorraquídeo y el pronóstico y evolución de pacientes con esclerosis múltiple, incidiendo tanto en la evolución clínica medida por el Expanded Disability Status Scale así como en la progresión de la atrofia cortical y cambio del volumen cerebral.
Durante los últimos años se ha generado un creciente interés por la identificación de biomarcadores que faciliten el entendimiento de la progresión de la enfermedad en sujetos con esclerosis múltiple (EM)1-3. En este sentido, la determinación de algunos metabolitos en el líquido cefa lorraquídeo (LCR) proporcionó información importante en lo que respecta al proceso inmunológico y degenerativo subyacente, lo que podría presentar un elevado valor diagnóstico y pronóstico2,3. El glutamato (Glu), principal neurotransmisor excitatorio del sistema nervioso central (SNC), es una de estas moléculas4-6. Estudios previos mostraron que el incremento en las concentraciones de Glu es responsable de la pérdida neuronal tanto en eta pas agudas como crónicas de la EM4,5. En consecuencia, los niveles de Glu en LCR podrían ser utilizados desde el momento del diagnóstico de EM como un importante biomarcador de progresión de la enfermedad4.
El objetivo de este trabajo fue evaluar la asociación entre niveles de Glu en LCR al momento del diagnóstico y la progresión de la enfermedad (medida por parámetros clínicos y radiológicos) en una cohorte prospectiva de individuos con EM.
Materiales y métodos
Se realizó un estudio de cohorte prospectivo con pacientes que consultaron en el servicio de Neurología del Hospital Ita liano de Buenos Aires. Se incluyeron mayores de 18 años con diagnóstico de EM, fenotipo recaída remisión (EMRR) según los criterios validados de McDonald del año 20107. Se realizó seguimiento por cinco años. El comienzo de la enfermedad fue definido como la aparición del primer signo o síntoma su gestivo de desmielinización del SNC comprometiendo nervios ópticos, tronco cerebral, médula espinal u otras regiones, y no atribuible a otras enfermedades8. La evaluación clínica inicial fue realizada en todos los casos por un neurólogo con experiencia en el tratamiento de enfermedades desmielinizan tes, considerando aspectos demográficos, clínicos y estudios complementarios. Durante el seguimiento, los pacientes fueron evaluados clínica y radiológicamente. Se evaluó la presencia de recaídas y se midió el EDSS (Expanded Disability Status Scale) de forma trimestral. Asimismo, se realizó una resonan cia (RM) basal dentro de los primeros 30 días del ingreso al estudio y cada 12 meses durante su seguimiento con el objeto de determinar el porcentaje de cambio de volumen cerebral (PCVC), grosor cortical (GC) y volumen lesional cerebral en secuencia T2 (VLT2) mediante modelos lineales. La misma se efectuó con resonador Siemmens 1.5 Tesla con técnicas de adquisición estandarizadas de imágenes para pacientes con enfermedades desmielinizantes (densidad protónica, T2 convencional, FLAIR, T1 sin y con contraste endovenoso) y secuencia volumétrica 3D. Todas las RM fueron realizadas en periodos fuera de exacerbaciones de la enfermedad, con al menos dos meses de diferencia en aquellos que presentaron recaídas. No se realizó actualización del hardware durante el periodo del estudio.
Utilizando las secuencias T1 de la RM, se realizó la me dición del volumen cerebral (VC) global aplicando el método y el software automatizado de medición de atrofia cerebral SIENAXr9. Para realizar la medición, SIENAXr utiliza la he rramienta BET (brain extraction tool), parte del software de la librería FSL-FMRIB para extraer el cerebro y el cráneo de las imágenes de RM. Una vez extraído, un programa de segmentación tisular (FAST, otro software de la librería FSL) segmenta la imagen obtenida en GC, sustancia blanca (SB) y LCR10. Mediante ese proceso, SIENAXr, es capaz de obtener volúmenes cerebrales precisos de manera automatizada. El VC global obtenido es luego multiplicado por un factor de normalización preestablecido y ya incorporado al software que determina los volúmenes cerebrales finales normaliza dos para el paciente. Para eliminar los errores atribuibles a lesiones de SB, SIENAXr oculta y rellena con intensidades que coincidían con la SB normal circundante antes de cada análisis de segmentación por tipo de tejido.
Se estimó el PCVC entre las RM con el software SIENA (Structural Image Evaluation using Normalisation of Atrophy), incorporado dentro de la biblioteca FSL. El software realiza la extracción de las imágenes del cerebro y del cráneo de las secuencias axiales de T1 obtenidas en los dos puntos sepa rados del tiempo10. Esas imágenes son luego alineadas entre sí y posteriormente segmentadas con el objeto de diferenciar tejido cerebral de tejido no cerebral y desplazamientos perpen diculares. Luego de la segmentación y alineación, el programa compara los diferentes segmentos para detectar el porcentaje de cambio del parénquima cerebral entre las sucesivas RM. Esta técnica es utilizada actualmente como referencia para cuantificar el cambio del VC y atrofia en pacientes con EM.
Para la medición del VLT2, se utilizó el software Lesion Segmentation Tool (version 3.0.0), una caja de herramientas SPM (Statistical Parametric Mapping) que segmenta las lesio nes hiperintensas en T2 en la secuencia FLAIR11.
Para la obtención del GC en cada individuo de forma rápida y confiable, se implementó el software Computational Anatomy Toolbox (CAT12) para SPM basado en la técnica Projection-based Thickness (PBT)12.
Los niveles de Glu fueron determinados mediante fluoro metría en LCR al inicio de la enfermedad (primera recaída). Se analizaron los valores del metabolito en comparación con datos obtenidos de otro estudio en población sana (valor normal de glutamato en población sana de 3.399 + 1.63 μM/l). Se consideró como punto de corte 4.55 μM/l13.
Una vez recolectados los datos demográficos, clínicos y de RM al inicio de la enfermedad, se realizó un seguimiento prospectivo durante al menos 5 años. Los predictores prima rios de interés fueron los niveles basales de Glu en LCR, el PCVC y la progresión de la enfermedad (medida por EDSS y tasa anual de recaídas) durante el seguimiento.
Para el análisis estadístico, las características basales demográficas y clínicas de la cohorte evaluada fueron infor madas en porcentajes para los datos categóricos y en media con su desvío estándar (DE) para los datos continuos. Con el objetivo de realizar el mejor análisis de los datos obtenidos durante los cinco años de seguimiento, la asociación de nive les de Glu al inicio de enfermedad, el EDSS, VLT2 y GC al inicio y durante el seguimiento y el PCVC y recaídas durante el seguimiento, fueron evaluados mediante un modelo lineal con ecuaciones de estimación generalizadas (EEG), ajustadas mediante una estructura de correlación intercambiable por edad y sexo14. En este modelo, el PCVC y VLT2 se calcularon a partir de la RM basal y la última RM del seguimiento. Por su parte, el GC se obtuvo a partir de la RM basal y la diferencia entre la RM inicial y la última obtenida. Los resultados se expresaron como coeficientes beta (b), error estándar de la media (EE) e intervalos de confianza (IC) del 95%.
El estudio fue aprobado por el Comité de Ética de Proto colos de Investigación del Hospital Italiano de Buenos Aires. Todos los sujetos fueron informados y firmaron el consentimiento informado previo a la incorporación al estudio.
Resultados
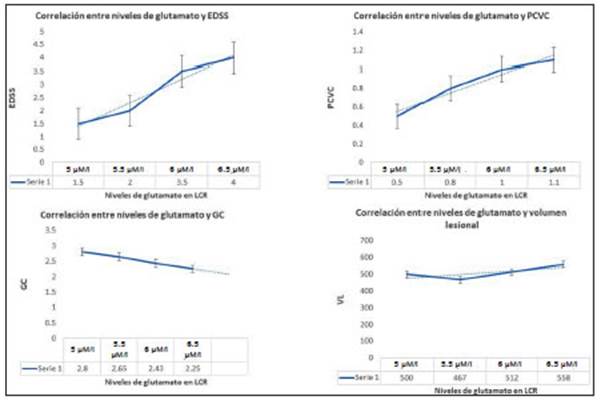
Se incluyeron un total de 26 pacientes con EM. La media de edad fue de 35 ± 3 años, 17 fueron mujeres, con una media de seguimiento de 71 ± 4 meses. El tiempo medio de evolución de la enfermedad al ingreso fue de 16 ± 4 meses y todos los casos eran pacientes con EMRR. El EDSS al momento del ingreso fue de 1.5 ± 1. La concen tración media de Glu en LCR en el inicio de la enfermedad fue de 5.3 ± 0.4 μM/L (rango de 1.1 a 9.4 μM/L) (Tabla 1). Al momento del diagnóstico y posterior a la medición de Glu en LCR, todos recibieron tratamiento modificador de la enfermedad: 13 recibieron interferón, 10 fingolimod y 3 natalizumab. Durante el seguimiento, se encontró una fuerte correlación entre la concentración elevada de Glu y la progresión en el EDSS (b = 1.06, IC 95% 0.47-1.66, p = 0.003) (Fig. 1). Respecto al volumen de estructuras cerebrales, se encontró una asociación significativa en tre niveles elevados de Glu al inicio de la enfermedad y una reducción en el volumen de SB, aumentando así el PCVC (b = -0.71, IC 95% -0.56-1.38, p = 0.002). De forma concordante, el GC se encontró reducido en aquellos pa cientes con una concentración de Glu elevada (b = -0.15, IC 95% -0.06-0.33, p = 0.01). No se encontró durante el seguimiento una relación significativa entre los niveles de Glu y la tasa anualizada de recaídas, ni el VLT2 (b = 0.08, IC 95% -0.11-0.43, p = 0.11 y b = 195, IC 95% -39-330, p = 0.22, respectivamente) (Tabla 2, Fig. 1).

Tabla 2 Estimación ecuacional generalizada de niveles de glutamato en relación a parámetros clínicos y radiológicos a los 5 años de seguimiento
Discusión
En los últimos años se han tratado de identificar distintos biomarcadores en pacientes con EM que contribuyan al diagnóstico y predicción de la progresión de la enfer medad. Entre ellos, existen algunos bien conocidos y utilizados en la práctica diaria como son las bandas oligo clonales (BOC) y secuencias específicas de RM, mientras que otros se encuentran actualmente en estudio, como los neurofilamentos y la proteína ácida fibrilar glial (GFAP)1.
En el presente estudio se analizó la relación existente entre las concentraciones biológicas de Glu en LCR al inicio de la enfermedad y el pronóstico clínico y radioló gico de pacientes con EMRR. Se observó una asociación significativa entre niveles iniciales elevados de Glu al inicio de la enfermedad y un mayor PCVC y GC, así como una mayor progresión del EDSS durante el seguimiento.
Nuestro trabajo se encuentra en línea con estudios previos que vinculan al Glu con la patogénesis de la EM. Sarchielli y col., evaluaron sus niveles en LCR de pa cientes con EMRR y EM secundaria progresiva (EMSP) en relación a controles sin enfermedad. Los autores concluyeron que los niveles del metabolito en LCR se encontraban significativamente más elevados en pacien tes con EM (p < 0.001) y aún más elevados en pacientes con recaídas clínicas frecuentes, lesiones activas o EMSP (p<0.001), sugiriendo que el Glu se encuentra implicado tanto en la actividad inflamatoria de la enfermedad como en su componente degenerativo13. En concordancia, Aze vedo y col. encontraron que concentraciones elevadas de Glu en LCR se relacionan con un descenso concomitante del N-acetilaspartato, provocando una alteración en la relación de ambas moléculas, lo que podría actuar como factor contribuyente a la progresión de la enfermedad15. Baranzini y col. encontraron unos 70 genes asociados a niveles incrementados de Glu cerebral, encontrándose que individuos con mayor número de alelos presentaron concentraciones mayores de Glu y, en consecuencia, un descenso del N-acetilaspartato y VC a un año de seguimiento16. Por último, Srinivasan y col. encontraron niveles elevados de Glu en RM tanto en lesiones activas (p = 0.02) como en sustancia blanca normal de pacientes con EM (p = 0.03) en relación al grupo control17.
Publicaciones previas sugieren que la excitotoxicidad del Glu juega también un rol importante en otras enfer medades degenerativas del SNC, como la enfermedad de Parkinson, Alzheimer, enfermedad cerebrovascular isquémica y trastornos psiquiátricos4,5,18,19. El meca nismo principal por el cual esta molécula produce daño neuronal es mediante la activación de sus receptores de membrana, induciendo un aumento del calcio intracelular y llevando a la muerte celular4,6. En el SNC, las neuronas son la mayor fuente de producción de Glu y los astrocitos juegan un rol central a la hora de regular su homeostasis, ingresándolo al compartimiento intracelular por medio de transportadores específicos en su membrana4. Una vez dentro del compartimiento intracelular, el Glu es convertido en glutamina no tóxica por la enzima astroci taria glutamina sintetasa. Posteriormente, es liberado al espacio extracelular e incorporado nuevamente dentro de neuronas para ser reutilizado y así mantener estable el pool intracelular de Glu18. Sinérgicamente, la mielina con tribuye a neutralizar los efectos tóxicos del Glu mediante algunas de sus principales moléculas constituyentes, como la glicoproteína asociada a mielina (MAG)20.
En la EM ocurren fenómenos inflamatorios que alteran la homeostasis fisiológica del Glu. En primer lugar, la microglía activada y los astrocitos producen una mayor concentración extracelular del neurotransmisor, anu lando su rol protector natural. Además, los monocitos y macrófagos intervienen en la liberación de Glu por medio de transportadores de membrana4. Por último, los axones desmielinizados producto del ataque inflamatorio constituyen una fuente adicional de Glu intracelular15-23. Esto se ha comprobado tanto para lesiones activas como crónicas de EM, donde estudios inmunohistoquímicos revelaron una actividad significativamente reducida de las enzimas encargadas de metabolizar el Glu a nivel local24. La resultante de los factores antedichos es una mayor destrucción de oligodendrocitos, células particular mente vulnerables a los efectos deletéreos del Glu25. En concordancia con estos hallazgos, estudios funcionales por RM han demostrado que las concentraciones de Glu y glutamina se encuentran significativamente aumenta das en la espectroscopía de lesiones activas y SB de apariencia normal de pacientes con EM en relación a controles17,26-27. Más aún, concentraciones elevadas de Glu en la espectroscopia se correlacionan con una mayor progresión de discapacidad, depresión y del MSSS (score de gravedad de EM)27.
El presente estudio arrojó una correlación lineal y significativa entre concentraciones biológicas basales au mentadas de Glu en LCR, la progresión de discapacidad medida por EDSS y la atrofia cerebral. Sin embargo, no se encontró relación entre los niveles de Glu en LCR y la tasa anualizada de recaídas ni el VLT2 durante el periodo de seguimiento. Una posible explicación para esto podría encontrarse en relación al hecho que los pacientes inicia ron inmediatamente tras el dosaje de Glu tratamiento con fármacos modificadores de enfermedad, disminuyendo así el riesgo de nuevas recaídas, y consecuentemente el daño de SB. Otra posible explicación podría ser que los niveles de Glu evidencian un proceso degenerativo subyacente en lugar de un proceso inflamatorio focal, motivo por el cual la concentración de Glu se asociaría a la progresión de la discapacidad en lugar de la tasa anualizada de recaídas4,17.
Nuestro trabajo presenta limitaciones. En primer lugar, fue realizado en un único centro de atención. Además, si bien fue un estudio prospectivo de al menos cinco años de seguimiento, fue observacional, con el sesgo que implica dicho diseño. Otra limitación del trabajo consistió en no contar con otros biomarcadores séricos o en LCR de la enfermedad (bandas oligoclonales o neurofilamentos) para poder comparar estos hallazgos con otros aspectos del proceso degenerativo en EM. Por último, el tamaño muestral fue pequeño, excluyendo pacientes con feno tipos primarios progresivos y secundarios progresivos de EM. Por esto, sería de importancia que otros grupos repliquen estos hallazgos.
En conclusión, este trabajo provee resultados que refuerzan nuestro conocimiento actual sobre la neuro toxicidad in vivo del Glu. Esto es de especial importancia a la hora de integrar conceptualmente aspectos fisiopa tológicos, de biomarcadores por RM y de discapacidad para facilitar un mejor estudio y comprensión de la EM.