PUNTOS CLAVE
• Las especies de Candida constituyen una causa de infección fúngica invasora en pacientes quemados en las unidades críticas.
• Numerosos factores de riesgo en el quemado originan procedimientos invasivos que llevan a infecciones por Candida spp. Una edad > 65 años, una superficie corpo ral afectada (TSBA) superior del 31% y las lesiones por inhalación se relacionaron con una mayor mortalidad.
• Los mayores valores de TSBA en edades menores se relacionaron con intentos de femicidio y alertan sobre la necesidad de programas de sostén psicológico en la comunidad.
• El diagnóstico de la candidiasis invasora mediante el Candida score o el aislamiento microbiológico a partir de muestras clínicas, y la identificación de la especie permiten un uso racional de los antifúngicos y un mejor pronóstico.
Las infecciones en los pacientes quemados son una fuente importante de morbimortalidad1. En el pasado, los patógenos predominantes fueron bacterianos, pero los avances en el cuidado de las lesiones térmicas contribu yeron a un cambio en el espectro de los microorganismos, con una mayor frecuencia de las infecciones fúngicas en las unidades de quemados2, 3. Aunque las especies de los géneros Aspergillus, Fusarium y las del orden de los mucorales causan graves infecciones fúngicas invasoras (IFI), son las especies de Candida los principales agentes causales de las IFI representando un problema grave asociado al incremento de la morbimortalidad, la duración de la estadía hospitalaria y de los costos sanitarios. La incidencia de las infecciones fúngicas está condicionada por la extensión de la superficie corporal afectada (TBSA), la profundidad de la quemadura, la presencia de lesiones por inhalación (LIH), las alteraciones en el sistema inmu ne, el uso de catéteres endovasculares y/o urinarios, la nutrición parenteral total, el uso de ventilación mecánica, el empleo de antimicrobianos tópicos y sistémicos de amplio espectro que erradican la microbiota residente y promueven la aparición de especies oportunistas. Otros factores adicionales lo constituyen la edad y diferentes comorbilidades1,4-6.
El objetivo de este trabajo fue conocer retrospectiva mente las especies fúngicas aisladas en pacientes con lesiones térmicas en un centro de atención de pacientes quemados en la Ciudad de Buenos Aires, durante los años 2011-2014, con diferentes factores de riesgo que se analizaron a partir de las historias clínicas (HC).
Materiales y métodos
Se analizaron retrospectivamente las historias clínicas (HC) de los pacientes quemados con infección fúngica documentada, internados durante el período comprendido entre enero 2011 y diciembre 2014 en el área de Terapia Intensiva (UCI) del Hospital Municipal de Quemados del Gobierno de la Ciudad Autónoma de Buenos Aires. La investigación contó con la aprobación del comité de ética de ese nosocomio.
De las HC de los pacientes se registraron los datos demo gráficos, antecedentes patológicos, la TBSA evaluada a través de la regla de los nueves4, profundidad de la quemadura representada en grados (I a IV)7.8, fuente de la quemadura y presencia de LIH4. Se completaron los registros con la pun tuación del APACHE II (Acute Physiology And Chronic Health Evaluation II), el valor de Candida score9,10, los registros de tratamientos antimicrobianos, la escisión quirúrgica de la lesión térmica y la práctica de cubrir el tejido viable con in jertos de piel. Es de mencionar, que el sistema de puntuación Candida score, con un valor superior a 2,5 permite identificar a los pacientes críticos no neutropénicos, con sospecha de candidemia, que se beneficiarían de un tratamiento antifúngico temprano10.
Los pacientes quemados incluidos fueron adultos, ma yores de 18 años de edad, de ambos sexos, con evidencia clínica de infección fúngica documentada obtenida de una muestra representativa (biopsia del tejido viable profundo y/o hemocultivos y/o urocultivos y/o cultivo de punta de catéter venoso central). La evidencia clínica de infección fue definida en base a los signos y síntomas de infección como fiebre, inadecuada perfusión periférica, alteración del estatus neurológico, disminución en el ritmo diurético, dre naje de material purulento, eritema o edema del margen de la superficie quemada, separación inesperada de la escara, necrosis localizada, lesiones vesiculares y/o falta de adhe rencia de los injertos.
Las especies de Candida que se identificaron provenían de una biopsia del tejido viable profundo, hemocultivos, urocul tivos, aspirado traqueal o cultivo de punta de catéter venoso central, que se encontraban conservados a -20 °C en el laboratorio del hospital y habían sido obtenidos de pacientes cuyas historias clínicas se analizaron.
Para identificar las especies de Candida se procedió a cultivar 50 μl de la suspensión de la colonia en el medio CHROMagar Candida (CHROMagar Candida Company, Pa ris, Francia) durante 48 horas a 37°C. Los aislamientos se identificaron de acuerdo al aspecto y color de las colonias en el medio cromogénico y al estudio micromorfológico11. A las colonias verdes en CHROMagar Candida se les estudió la producción de clamidoconidios para la eventual identificación de C. dubliniensis12,13. A las colonias púrpura en CHROMagar Candida, que no formaban seudohifas se les investigó la asimilación de trehalosa y sacarosa para identificación de C. glabrata14. Por último, se completó la identificación mediante el uso del método semiautomatizado API ID32C (BioMérieux, Francia). Las levaduras obtenidas se conservaron a -20 °C en agua destilada para los poste riores estudios moleculares.
La diferenciación de C. albicans, C. dubliniensis y C. africa na se realizó a través de la amplificación del gen hyphal wall protein 1 (HWP1)15. Para la identificación de las especies C. parapsilosis sensu stricto, C. orthopsilosis y C. metapsilosis se usaron cebadores específicos derivados de secuencias únicas dentro de la región ITS1 (internally transcribed spacer -ITS) e ITS2 de la región (ITS1-5.8 rRNA-ITS2) del rDNA16 y por último para diferenciación de las especies C. glabrata, C. bracarensis y C. nivariensis se emplearon cebadores para un gen RPL31 que codifican para una proteína de la subunidad de 60 S de rADN17.
Los resultados se volcaron en tablas del programa Excel y los datos se analizaron con el paquete estadístico SPSS 17.0 (Statistical Product and Service Solutions).
Resultados
De un total de 36 pacientes se recuperaron 52 aislamien tos de Candida spp. La incidencia de las infecciones fúngicas fue de 39.3 por cada 1000 admisiones. Los pa cientes con lesiones térmicas permanecieron internados en promedio 46.7 días, con un rango entre 9 y 218 días. Pertenecieron al sexo femenino el 63.9% (n = 23) y al masculino 36.1% (n = 13). La mediana de edad de los quemados fue de 44.5 años con un rango de edades entre 18 a 87 años. Fallecieron 14 (38.8%). Entre los mayores de 65 años la mortalidad global fue del 70% (p = 0.018).
La TSBA osciló entre 31 y 50%, en un 33.3% (p = 0.03) de los quemados mayores de 59 años. En cambio, se observaron valores de TSBA entre 71% y 100% en pa cientes de menor edad (19 años). El 75% (n = 27) de los pacientes mostró una combinación de sitios quemados (tronco, cara, miembros inferiores y superiores) y solo en el 25% (n = 9) únicamente lesiones en miembros o en tronco.
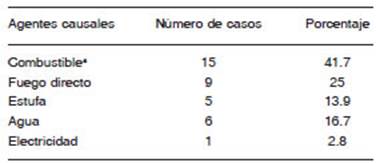
La evaluación clínica de la profundidad de las quema duras estuvo representada con el grado 4 en el 69.4% de pacientes (n = 25), marcando esto la gravedad de las lesiones. Las lesiones por inhalación se presentaron en el 50% (n = 18) y originaron una mayor mortalidad (55.6%; n = 10) (p = 0.04). Al considerar los que exhibían estas lesiones se observó que en el 88.9% (n = 16) las quema duras se localizaron en cara, y en el 83.3% (n = 15) los agentes responsables fueron el combustible y el fuego. No obstante, otros agentes estuvieron involucrados en las lesiones térmicas que se detallan en la Tabla 1.
Al relacionar en los pacientes el agente de la quema dura con el sexo, se observó que en el sexo femenino las fuentes más relevantes fueron el alcohol, el fuego y el agua caliente. En tanto que en el sexo masculino las fuentes de la quemadura lo constituyeron la estufa, la electricidad y la nafta.
Al analizar los antecedentes patológicos se observó que el 55.6% (n = 20) presentó uno o más factores de riesgo, como enfermedad obstructiva crónica, enferme dades cardiovasculares (arritmias, hipertensión arterial) y diabetes.
En la categorización de los pacientes según la puntua ción del APACHE II9 observamos que el mayor número de los quemados presentó un valor entre 31 y 40 (38.9%, n = 14) y solo 4 (11.1%) presentaron una puntuación inferior a 10. El Candida score 10 fue de 3 en el 77.7% de los casos.
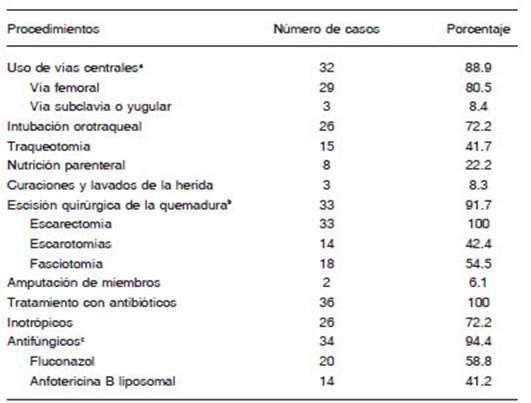
Con respecto a los procedimientos realizados se regis tró que las vías centrales (femoral, subclavia y/o yugular) se emplearon en el 88.9% (32/36) de los quemados y con un promedio de vías utilizadas en cada paciente de 5.8 (rango de 0 a 23). Otras prácticas empleadas fueron la intubación orotraqueal y la traqueotomía (Tabla 2). La nutrición parenteral la recibieron 8 quemados (22.2%).
Otros procedimientos correspondieron a la escisión quirúrgica de la quemadura como escarectomías, esca rotomías, fasciotomías y amputación de miembros que se realizó en el 91.7% (n = 33) de los pacientes. Solo 3 (8.3%) de los quemados recibieron curación con lavados, sin tratamiento quirúrgico (Tabla 2). La mortalidad fue ma yor en pacientes que recibieron la fasciotomía (p = 0.04). Luego de la cirugía y tras obtener un lecho de tejido viable, se procedía a cubrir la herida con injertos de piel. Se aplicó autoinjerto al 80.6% (n = 29) de los pacientes, que exhibió buena adherencia al tejido subyacente en un 72.4% (n = 21). En el 27.6% (n = 8) que no fue exitoso la mortalidad alcanzó el 100% (p< 0.01) y su principal causa fue el shock séptico.
Los 36 pacientes recibieron tratamiento antibiótico inicial y el 72.2% (n = 26) requirió el uso de inotrópicos. El tratamiento antifúngico se administró en el 94.4% (n = 34), inicialmente fluconazol en el 58.8% y el resto anfotericina B liposomal (41.2%) (Tabla 2). Los que iniciaron tratamien to con polienos rotaron posteriormente a fluconazol, con la excepción de un caso por una infección por C. krusei.
En el total de 36 pacientes quemados se identificaron 52 aislamientos de levaduras que se recuperaron de uroculti vo 42.3 % (n = 22), hemocultivo 26.9 % (n = 14), biopsia cutánea 9.6 % (n = 5), punta de catéter 15.4% (n = 8) y aspirado traqueal (AT), 5.8% (n = 3). Por cultivo microbio lógico convencional se identificaron a C. albicans en 53.8%, C. tropicalis 23.1%, C. parapsilosis 13.5%, C. krusei 5.8%, C. glabrata 1.9 % y C. dubliniensis 1.9 %. Los métodos moleculares permitieron confirmar a C. dubliniensis y a C. glabrata en un único aislamiento de cada una y a C. parap silosis sensu stricto en los siete cultivos de esta especie. Al relacionar las especies de Candida más prevalentes, C. albicans, C. parapsilosis sensu stricto y C. tropicalis, con diferentes cultivos se observó que C. albicans fue la especie predominante en las diferentes muestras clínicas (Tabla 3).
Discusión
La atención de las lesiones térmicas en los centros de quemados proviene de la experiencia en el soporte médi co para mantener la función hemodinámica y respiratoria en UCI, la provisión de una nutrición temprana adecuada, el tratamiento local de las quemaduras mediante el uso de técnicas quirúrgicas y el control de la colonización micro biana4. Sin embargo, las infecciones son las principales causas de muerte18 y las fúngicas son una importante causa de morbimortalidad, ya que el paciente quemado es un huésped ideal1,4,19. La incidencia de infecciones fúngicas varía entre 6.3% y 44%, dependen en general del centro hospitalario20; y constituyen un problema en las UCI quirúrgicas y de quemados2.
Las lesiones térmicas tuvieron predominio en el sexo femenino y se relacionaron con agentes como alcohol y fuego directo como causa de la quemadura, y por las lesiones de un tercero con vínculo afectivo. Estás fueron parte de las causas de femicidios, informadas en nuestro país, que se presentaron en menores de 40 años. Por otro lado, en el sexo masculino fueron prevalentes la nafta y la electricidad, en concordancia con la ocupación laboral y el manejo del combustible. En los pacientes de más de 60 años la quemadura se originó a partir de una estufa, relacionado esto a la tendencia “a calentarse el cuerpo tocando la estufa con las ropas”.
La extensión de la superficie quemada4 predominante osciló entre 31 y 50%, y la profundidad de la quemadura determinada clínicamente fue de grado 4 en un porcentaje algo inferior al 70% de los casos. Sin embargo, debemos considerar que existe para evaluar la profundidad de las quemaduras otro sistema de clasificación que las con sidera en tipos A-AB y B8 y otra metodología sensible, específica, rápida, confiable y de naturaleza no invasiva como el LDI (laser doppler imaging) que no se encuentra disponible en este centro de quemados21.
Los pacientes presentaron LIH en un 50%. Es cono cido que este tipo de lesiones causa hipoxia por falta de oxígeno, daño químico en el epitelio traqueobronquial por inhalación de las toxinas del humo y un síndrome de distrés respiratorio4,22. Las LIH deben sospecharse si el paciente sufrió la quemadura en un espacio cerrado, con compromiso facial y/o desarrolla un compromiso respiratorio. Estudios realizados por Halgas y col. señalan que la tasa de mortalidad se eleva en los pacientes con mayor TBSA y concomitantes LIH23,24. En concordancia con esto se destaca que el compromiso facial se produjo simultáneamente con otros sitios en el 88.9% de los casos con LIH. La mortalidad en los pacientes con LIH alcanzó el 55.6%.
El riesgo de candidiasis, y por lo tanto la mortalidad, se incrementa en los pacientes quemados con una TSBA superior al 30%, con quemaduras de tercer y cuarto grado de profundidad por las complicaciones inmunológicas aso ciadas, el mayor número de procedimientos quirúrgicos y una mayor duración de la hospitalización2,4,6,25. Se señala que las puntuaciones correspondientes a la evaluación del APACHE II superiores a 10 o el uso de ventilación mecánica aumenta la susceptibilidad a las infecciones fúngicas26. La mayoría de los pacientes tenían múltiples factores de riesgo como antecedentes patológicos, uso de catéteres venosos centrales, sondas urinarias, tubos endotraqueales, ventilación mecánica, nutrición parenteral total, tratamiento con corticoides sistémicos, tratamiento de soporte con aminas vasoactivas y agentes inotrópicos, y antibacterianos de amplio espectro que constituyen facto res de riesgo para la infección por especies de Candida4,5,27. Los catéteres venosos centrales son una vía de entrada para estas especies fúngicas y con un riesgo adicional de infección en los pacientes en UCI con nutrición parenteral total26. Finalmente, el Candida score identifica a los pacien tes críticamente enfermos y aquellos con una puntuación de 2.5 o superior tienen 7.7 veces más probabilidades de tener una infección probada por Candida10. Las prácticas de la escisión temprana de la escara y cobertura prematura de las heridas mediante un injerto disminuyen la incidencia de infecciones en pacientes quemados y la sepsis4,28 al mejorar la tasa de sobrevida, prácticas que fueron imple mentadas en los pacientes analizados.
En este análisis, los quemados permanecieron interna dos, en promedio, entre 4 y 5 semanas y la presencia de in fección o colonización por especies de Candida se confirmó por el aislamiento microbiológico en muestras de biopsia del tejido superficial y profundo quemado y/o hemocultivos y/o urocultivos y/o aspirado traqueal, en promedio, a los 21.4 días del ingreso en UCI. Fue coincidente con el aumento de la colonización fúngica en forma sostenida durante la estadía en el hospital, que alcanza un máximo entre la segunda y la cuarta semana4,29. La especie C. albicans se considera la más prevalente de las infecciones nosocomiales22,30. Sin embargo, se ha observado más recientemente que C. tropicalis resulta importante en los quemados22,30. En el presente estudio, C. albicans fue la más aislada, seguida por C. tropicalis y C. parapsilosis5. Se reconoce a C. albicans como la especie más común en infecciones invasoras, sin embargo, las especies de Candida no C. albicans aparecen en paulatino ascenso4,28. En coincidencia con esto se ob servó aquí que las especies prevalentes en las candidemias fueron C. albicans seguida en frecuencia por C. parapsilosis sensu stricto y C. tropicalis.
En los pacientes quemados se indica que el foco de la IFI es la lesión producida por la quemadura, aunque otros orígenes o puertas de entrada para el desarrollo de una candidemia pueden resultar de una traslocación a partir del tracto gastrointestinal, infección del tracto urinario o asociados a la invasión de dispositivos médicos y a las manos del personal de salud2,27,31. La colonización por microorganismos del catéter venoso central se produce generalmente desde la piel o partir de la conexión del mismo y se relaciona con factores como el material del catéter y la ubicación (mayor frecuencia de complicaciones infecciosas en catéteres femorales frente a subclavia y yugulares), entre otros factores4,32. La utilización de catéteres centrales estu vo presente en el 88.9% de los pacientes, y la vía femoral se usó en el 80.5%. Un estudio en pacientes quemados demostró una alta correlación entre microorganismos culti vados a partir del catéter dentro de las 48 h de inserción, y la incidencia de infección asociada al mismo. La infección del catéter en pacientes quemados comúnmente se produce por adherencia y migración de microorganismos de la biota a la punta del dispositivo4. Por ello se emplearon diferentes vías y el sitio de punción estuvo alejado de la piel lesionada.
El estudio histológico de la quemadura luego de una biopsia es el método adecuado para confirmar colonización o infección. Sin embargo, debido a la naturaleza invasiva del procedimiento y su baja sensibilidad, no se realiza de rutina6; y es materia de debate continuo la técnica de muestreo más conveniente4. Coincidente con estos hallazgos en un peque ño porcentaje de quemados se recuperaron especies de Candida mediante una biopsia cutánea de la lesión térmica.
Es conocido que existe una variabilidad geográfica en los aislamientos fúngicos en distintos centros asistencia les y el conocimiento de los microorganismos contribuye a la epidemiología de ese nosocomio, un elemento pri mordial para el efectivo tratamiento. Así, fueron opciones terapéuticas la anfotericina B liposomal y/o el fluconazol, considerando el estado del paciente y el patrón de sensi bilidad de las especies de Candida28.
Aunque con las limitaciones del presente estudio, que se realizó en un único centro de quemados y con un número pequeño de pacientes, se puede establecer que las lesiones térmicas tienen un alto riesgo de desarrollar infecciones fúngicas. Existen factores que contribuyen como la edad, TSBA y la profundidad de la quemadura, la presencia de LIH y la mayor duración de la internación en UCI, que se asocian a un número importante de pro cedimientos invasivos, entre otros factores. La candidiasis es una enfermedad infecciosa emergente, especialmente en los pacientes críticos y en grandes quemados, en los que el aumento de la supervivencia logrado en las últimas décadas llevó a una mayor incidencia de infecciones, en particular por C. albicans, aunque otras especies de Candida no C. albicans aparecen en paulatino ascenso.