La inhaloterapia consiste en la administración de medicamentos por vía inhalatoria a través de pequeñas partículas sólidas o líquidas en suspensión en un gas (aerosol) con el objeto de producir un efecto local. La ventaja de administrar medicamentos en aerosoles consiste en que la dosis necesaria para producir un efecto con una rápida respuesta es menor y actúa directamente en el sitio, lo que aumenta la eficiencia y disminuye los efectos secundarios. Sin embargo, la posibilidad de lograr un efecto adecuado dependerá especialmente de la técnica inhalatoria y del sistema de nebulización utilizado. Es fundamental realizar una educación adecuada y la revisión periódica de la técnica inhalatoria, así como de la adherencia para lograr un tratamiento adecuado1,2. La administración de fármacos por vía inhalada ha tenido un desarrollo muy grande en cuanto a innovación y cantidad de dispositivos en los últimos años, lo que ha contribuido a la mejoría de la calidad de vida de los pacientes con enfermedades respiratorias1,2.
En los últimos treinta años, los desarrollos de dispositivos han revolucionado la terapia inhalada no solo para tratar las enfermedades obstructivas crónicas más frecuentes como el asma y la enfermedad pulmonar obstructiva crónica (EPOC) (broncodilatadores primero y corticoides inhalados después), sino también para administrar antibióticos inhalados para tratar colonización e infección en fibrosis quística, bronquiectasias y neumonía por Pneumocystis jirovecii, e incluso mucolíticos1,2. Además, ha mejorado la adherencia al tratamiento crónico1,2.
Esta gran variedad de dispositivos ha generado confusión en personal de salud, pacientes y familiares, debido a los requerimientos de técnica de inhalación particulares de cada uno y la necesidad de capacitación continua3-5. En la vida real, esto ha determinado que los dispositivos no sean utilizados adecuadamente, con el consecuente impacto negativo en cuanto a adherencia y respuesta clínica3.
Diferentes recomendaciones internacionales y nacionales de las guías de tratamiento de las enfermedades citadas destacan el papel fundamental y crítico de la capacitación y el entrenamiento de personal de salud, pacientes y familiares en el uso apropiado de los dispositivos inhalatorios prescriptos5-9.
Existen pocas recomendaciones internacionales específicas actualizadas en inhaloterapias en los últimos diez años. Estas son las de la Sociedad Europea Respiratoria (ERS)/Sociedad Internacional de Aerosoles en Medicina (ISAM), Sociedad Española de Patología Torácica (SEPAR)/Asociación Latinoamericana del Tórax (ALAT) de hace más de cinco años, y las más recientes de la SEPAR y del Grupo Español del Manejo del Asma (GEMA)10-15. En nuestro país no existen publicaciones sobre actualización del conocimiento en inhaloterapia ni recomendaciones del uso correcto de los diferentes dispositivos inhalatorios disponibles.
El objetivo de este documento es actualizar el avance del conocimiento científico en inhaloterapia y establecer recomendaciones para personal de salud, pacientes y sus familias sobre el uso de los diferentes dispositivos disponibles en nuestro país.
Metodología
Se realizó una búsqueda en bases de datos como MEDLINE, EMBASE, Cochrane, SciELO, hasta diciembre de 2020, usando como palabras buscadoras en inglés “EPOC”, “Asma”, “Bronquiectasias”, “Fibrosis Quística”, “Aerosol”, “Aerocámaras”, “Polvos secos” y “Nebulización”, “Inhaloterapia” e “Inhaladores”.
Se establecieron recomendaciones adaptadas a nuestra realidad sanitaria.
Principios básicos del depósito de partículas inhaladas en la vía aérea
De la estructura de la vía aérea
Las fosas nasales (la zona de mayor resistencia de la vía aérea), la faringe, la tráquea, los bronquios y bronquiolos hasta la 15va generación bronquial constituyen la región de conducción. Las vías aéreas centrales tienen en su estructura cartílago que va desapareciendo con las sucesivas generaciones bronquiales, al igual que el músculo liso bronquial. Cada división bronquial es en ángulo recto, por lo que el área de corte transversal de las vías aéreas en cada generación bronquial se va incrementando exponencialmente. Las vías aéreas distales (bronquiolos más allá de la 16va generación, conductos y sacos alveolares donde tiene lugar el intercambio gaseoso) constituyen la denominada zona respiratoria16-18. Estas características condicionan la dinámica del flujo aéreo y, por tanto, el depósito de la partícula inhalada. La relación entre geometría y resistencia se relaciona al radio de la vía aérea. La resistencia de las vías aéreas se debe a la fricción del aire con las vías respiratorias. En el sujeto sano, las pequeñas vías aéreas suponen una mínima parte del total de la resistencia debido a que poseen un área transversal de suma muy superior a la de las vías centrales; el flujo en la periferia es dominantemente laminar, muy lento o ausente, y los gases se mueven por simple difusión. El flujo de aire en las vías aéreas mayores es complejo, variable en cada generación, debido a las ramificaciones y lleva a la inducción de turbulencias. Otros factores pueden afectar la resistencia tales como cambios de diámetro de las pequeñas vías aéreas por broncoconstricción o alteraciones en la pared bronquial16-18.
Del generador de partículas inhaladas
Se define como aerosol al conjunto de partículas sólidas del conocimiento científico en inhaloterapia y establecer o líquidas que se encuentran en suspensión en el aire10-15.
Los aerosoles pueden tener un diámetro de 100 hasta 0.01 μ. Desde el punto de vista práctico, tienen interés todas las partículas que presentan un diámetro entre 10 y 0.1 μ por su posible interacción con el aparato respiratorio10-15. Los sistemas de defensa tienen mayor eficacia en el filtrado de partículas superiores a este rango y las partículas menores, si bien pueden penetrar hasta la profundidad del sistema respiratorio, con frecuencia son exhaladas de la misma manera que se inhalaron sin dejar de permanecer en suspensión. A pesar de que la distribución de partículas de un aerosol es necesariamente dispersa, el desarrollo tecnológico ha permitido diseñar dispositivos que proporcionan un rango relativamente estrecho de partículas con el fin de conseguir el depósito óptimo de medicación en la vía aérea. Así, en los aerosoles, la interacción entre válvula dosificadora, propelentes, medicación, disolventes y sustancias tensoactivas da lugar a partículas más homogéneas, de diámetro menor (ultrafino), que además son emitidas a menor velocidad10-15.
Los inhaladores generan partículas para inhalar por la aplicación de una alta energía sobre una fase líquida o sólida. Por ejemplo, en los nebulizadores de motor y en los aerosoles, la energía procede de un gas a presión que produce la disrupción de la fase líquida con generación de un aerosol de partículas líquidas que contienen el fármaco en solución o suspensión. En los inhaladores de polvo seco (IPS), la energía es proporcionada por el mismo paciente, que debe realizar una maniobra de inhalación a través del dispositivo que liberará las partículas para su suspensión en el flujo de inhalación del paciente10-15. Otro factor a considerar es conseguir un aglomerado de partículas, casi siempre estabilizado y asociado a partículas de un carrier, generalmente grandes partículas de lactosa no inhalable, de las que se deben desprender las partículas de medicación en forma relativamente constante con diferentes rangos de flujo. Mediante unos sistemas de tamiz se desagregan liberando las partículas, incluso con flujos inspiratorios bajos. Carecen de carrier de lactosa los dispositivos de tipo Turbuhaler® en los que las partículas del fármaco se encuentran aglomeradas en el depósito del dispositivo. Es fundamental que el medicamento se mantenga completamente seco para evitar la hidratación de las partículas, la que impediría que el aerosol se desprenda. Los IPS se han modificado de forma que las partículas a inhalar son configuradas mediante la desecación de aerosoles también extrafinos. Se requiere cierta resistencia y un mínimo de flujo inspiratorio para la correcta desagregación en el aerosol. En los IPS es necesario que este flujo mínimo se genere desde el principio de la inhalación, ya que es al inicio de la inspiración cuando más fármaco es emitido por el dispositivo10-15.
La masa media aerodinámica (MMA) se define como el diámetro alrededor del cual la mitad de la masa de aerosol tiene tamaño de partícula mayor y la otra mitad menor11,14. La mayor parte de ellas son de gran tamaño (MMA > 5 μ) y se depositan en la superficie de la vía aérea por el “mecanismo de impactación”. La cantidad depositada es directamente proporcional al tamaño y la velocidad de salida del dispositivo por su componente inercial, desviándose de la corriente de aire inhalado. Este depósito se produce en las vías aéreas superiores, tráquea, bronquios principales y sus carinas o bifurcaciones (Fig. 1). Las partículas de este tamaño no tienen beneficio terapéutico, pero sí se las puede relacionar a la mayor frecuencia de eventos adversos. Las AC (o espaciadores) disminuyen muy significativamente el depósito orofaríngeo, no solo porque la impactación ocurre en ellas, sino también porque las partículas disminuyen su velocidad al atravesar la AC y, por tratarse de partículas pequeñas, pueden evaporar los disolventes y excipientes, con lo que la partícula disminuye su MMA y su inercia y así se transforma en fracción inhalable11,14,19.
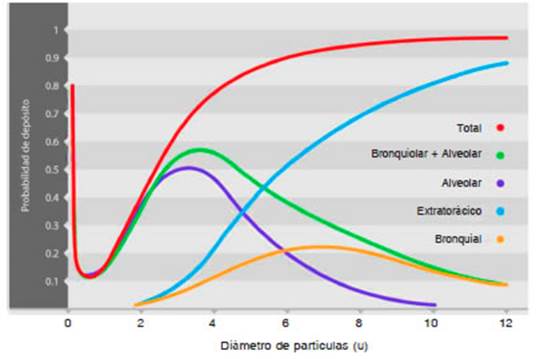
Fig 1. Depósito de partículas inhaladas en la vía aérea en relación a su tamaño (adaptado de Plaza Moral y col.12)
Las partículas de MMA medianas, menores a 5 μ, pero mayores a 1 μ, se depositan por efecto de la gravedad sobre la vía aérea inferior (bronquios distales y vía aérea pequeña) por el “mecanismo de sedimentación” (Fig. 1)10-15. La cantidad depositada es directamente proporcional al tamaño de la partícula e inversamente proporcional a la velocidad del flujo inspiratorio, por lo que la apnea en la maniobra inhalatoria favorece su depósito. Las partículas medianas son las que menor desviación presentan dentro de las columnas de flujo de aire laminar. El depósito sucede por sedimentación, sobre todo cuando el flujo se detiene, o bien por intercepción. El “mecanismo de intercepción” se refiere a que el adelgazamiento progresivo de los conductos da lugar a que las partículas viajen cada vez más próximas a sus paredes; cuando al diámetro de la partícula es similar a la luz del conducto encalla en la pared; las interacciones moleculares y, sobre todo, las fuerzas electrostáticas intervienen decisivamente en estos procesos11,14,19. Este tamaño de partículas es el terapéuticamente beneficioso y cuanta más proporción de partículas en este rango de MMA tenga un dispositivo inhalado, más beneficioso será su efecto. Por eso, un parámetro de eficiencia de un inhalador es la “fracción de partículas finas”, es decir, del total de partículas entregadas a la vía aérea, el porcentaje de partículas con MMA menor a 5.8 μ (terapéuticamente efectivas)10-15,19.
Las partículas inhaladas con una MMA menor a 1μ se mueven erráticamente en la vía aérea (“mecanismo de difusión”) y en buena parte son exhaladas (Fig. 1). Estas partículas muy pequeñas o ultrafinas llegan hasta las zonas más periféricas del aparato respiratorio suspendidas en el aire. Interaccionan con las moléculas de aire produciendo el característico movimiento browniano que hace que, por difusión, alcancen zonas muy distales de la porción respiratoria, donde incluso no existe flujo aéreo10-15,19.
La evaluación de la MMA es realizada por el Impactador de Cascada de Andersen20.
Las partículas inhaladas también sufren transformaciones debido a la interacción con otras partículas, con el medio aéreo en el que están inmersas o con las paredes del aparato respiratorio hasta que se produce el depósito. Las partículas pueden presentar evaporación de su componente líquido (excipientes o disolventes) o sufrir condensación en el interior de la vía aérea saturada de vapor de agua, con lo que aumentan de diámetro al hidratarse (partículas de polvos secos de inhalación). También las partículas pueden presentar coalescencia, es decir, unirse en agregados o disgregarse11. Por otra parte, hay que tener en cuenta que la biodisponibilidad sistémica de una droga es la consecuencia de la biodisponibilidad pulmonar y, de manera secundaria, también de la absorción intestinal consecuencia del depósito de la droga en cavidad bucal y deglutida. El depósito de la droga en boca y orofaringe, se relaciona al tipo y frecuencia de eventos adversos que variará según la molécula inhalada10-15.
Otros parámetros de la evaluación de la dinámica de nube de spray son la velocidad y la duración de la nube21
Efectividad de la inhalación
Existen varios parámetros de evaluación de la efectividad, algunos ya nombrados, como la fracción de partículas finas y el porcentaje de droga que queda alojado en el pulmón (dosis inhalada), como la dosis nominal (cantidad de fármaco que se emplea en cada activación de un inhalador) y la dosis emitida (dosis que es expulsada fuera del dispositivo en forma de aerosol)11.
Parámetros del paciente
Existen varios factores del paciente que afectan el depósito en la vía aérea, la mayoría relacionados a la técnica de inhalación particular a cada dispositivo, y otros relacionados a la enfermedad respiratoria que padece9-15.
El flujo inspiratorio del paciente se relaciona a la cantidad y el tipo de partículas depositadas en la vía aérea22,23. Un flujo inspiratorio superior a 100 l/min hace predominar el depósito por impactación. Un flujo inspiratorio inferior a 30 l/min favorece la sedimentación, pero la cantidad de droga inhalada no es adecuada. El flujo inspiratorio ideal es entre 30 y 60 l/min22,23. También el flujo inspiratorio depende del volumen inspiratorio inhalado y el tiempo en que se lo realiza. Un volumen inspiratorio bajo condiciona la correcta penetración de la droga, y en contrapartida, uno alto la mejora22,23. Irregularidades en la distribución anatómica bronquial (traqueostomía, malformaciones congénitas o adquiridas de la vía aérea, etc.) afectan el depósito de la droga inhalada10-15. Un factor muy importante en la técnica de inhalación de todos los dispositivos, es el tiempo prolongado de apnea post-inspiratoria, que favorece la sedimentación de las partículas inhaladas (idealmente 10 segundos).
Nebulizadores
Son dispositivos que permiten generar aerosoles de partículas líquidas, fáciles de usar, pero difíciles de preparar25. Disponemos de tres tipos de equipos de nebulizadores según la fuente de energía que utilicen10,25-27:
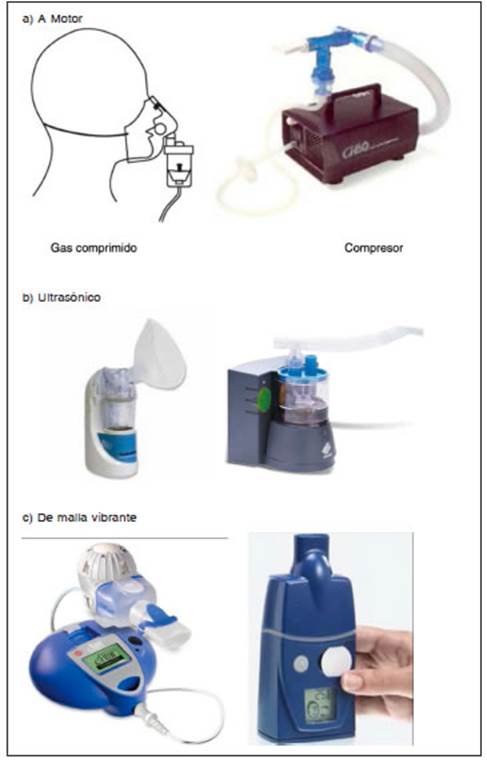
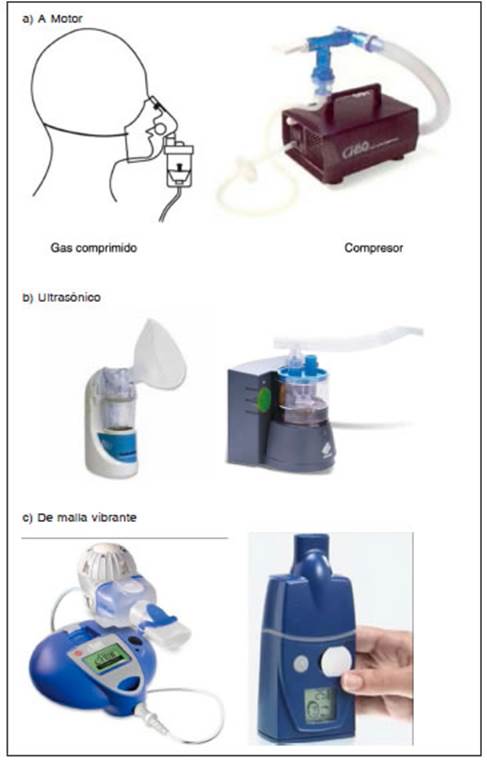
1. Nebulizadores a chorro, neumáticos, a motor o tipo jet. Son los más utilizados, como fuente de energía usan un gas comprimido (aire u oxígeno) o un compresor mecánico de aire (Fig. 2); son de alto flujo y pueden nebulizar soluciones y suspensiones. Son simples y económicos. Las partículas más grandes rebotan y las menores permanecen en suspensión. Una cantidad importante de la droga puede quedar como volumen residual y ser desperdiciada. En algunos de estos dispositivos, el flujo cesa cuando se los inclina más de 30°. El tamaño de las partículas y el tiempo de nebulización son inversamente proporcionales al flujo del gas a través del motor. La humedad y la temperatura del circuito, la viscosidad y la densidad del medicamento administrado también afectan el tamaño y la concentración de la droga en el nebulizador. Según como actúen en la fase respiratoria, las diferentes pipetas nebulizadoras pueden ser: (i) de liberación constante que generan aerosol tanto en inspiración como espiración con gran pérdida del aerosol al ambiente, (ii) con efecto Venturi que suma el flujo inspiratorio al flujo generado por el compresor, y (iii) válvulas que limitan la aerosolización ambiental o dispositivos dosimétricos que administran el aerosol solo en inspiración y evitan totalmente la aerosolización ambiental en espiración. Se recomiendan las pipetas bucales o en “pico de pato”. No se deben usar las pipetas nasales.
2. Nebulizadores ultrasónicos. La energía eléctrica se convierte en vibratoria a través de un cristal piezoeléctrico y se transmite al líquido a nebulizar produciendo su dispersión en partículas de 0.5 a 3 μ, originando una densa niebla. El tamaño de la partícula es inversamente proporcional a la frecuencia de vibración. Se han diseñado algunos de gran volumen utilizados para humidificar las secreciones y otros de pequeño volumen para administración de broncodilatadores y corticoides, pero no son apropiados para fármacos en suspensión o antibióticos por pérdida de estabilidad del fármaco por el calor generado (Fig. 3). Alrededor del 75-80% de las dosis se pierde en el ambiente durante la fase espiratoria. De la dosis restante, solo el 50% llega al pulmón. Por tanto, se estima que solo un 5-10% de la dosis nominal llega a destino a nivel pulmonar. Una desventaja es su alto costo y una ventaja es que no necesitan una reprogramación de los parámetros del ventilador ya que no agregan ningún flujo extra de gas.
3. Nebulizadores de malla vibrante o electrónicos. Son los que generan el aerosol al pasar el líquido por los orificios de una malla ya sea por acción de un compresor o material piezoeléctrico de alta frecuencia; son más eficaces que los anteriores por manejar un menor volumen residual; emplean baterías o corriente eléctrica para impulsar líquido a través de una malla con agujeros microperforados; pueden tener mecanismo activo o pasivo; producen partículas homogéneas y de tamaño óptimo (1 a 5 μ). Son más pequeños, menos ruidosos, permiten liberar el aerosol durante la fase inspiratoria y consiguen mayor depósito pulmonar del fármaco, son muy utilizados para nebulización con antibióticos (Fig. 4). Se contaminarían menos, porque el depósito de la medicación está separado del circuito del respirador.
La nebulización con broncodilatadores es ampliamente utilizada para exacerbaciones en asma y EPOC. Si bien algunos estudios evidencian que su uso domiciliario permite disminuir la morbilidad y el uso de recursos sanitarios, los ensayos son poco reproducibles en cuanto a la indicación apropiada de dosis, tiempo, flujo, volumen o dispositivos empleados, pero podríamos evaluar las circunstancias en las cuales estaría indicada la nebulización, sus ventajas y desventajas28,29.
La interfaz con el paciente puede ser una máscara facial o una pieza bucal, esta es la preferentemente indicada ya que disminuye el filtro nasal y evita el depósito del fármaco en piel y ojos30.
Ventajas
• Pueden ser indicadas a cualquier edad
• Pueden ser indicadas en exacerbaciones graves
• Permiten mezclar varios medicamentos
• No contienen propelentes que dañan el medio ambiente10
Limitaciones
• Requieren mucho tiempo de administración
• Son más grandes y menos portátiles que el inhalador presurizado de dosis medida (aerosol) o IPS
• Pueden aerosolizar partículas al medio ambiente
• Su eficacia varía mucho según el dispositivo utilizado y otras múltiples variables (flujo, volumen, característica del fármaco, tiempo de administración, etc.)10,31.
Recomendación de su indicación
• En pacientes que requieran dosis altas de broncodilatadores inhalados
• En pacientes que tengan dificultades técnicas con otros tipos de dispositivos
• Cuando se requieren fármacos que no pueden ser utilizados por otra vía (DNasa humana recombinante o antibióticos inhalados)
• En casos de exacerbación grave de asma o EPOC en los que es difícil la cooperación del paciente10
Consideraciones especiales
• No se encontraron diferencias en el grado de broncodilatación en pacientes con obstrucción aguda tratados con inhalador presurizado a dosis medida (IPDM) (con o sin AC) o nebulizaciones32,33
• En hospitalizados por crisis de asma se debe utilizar oxígeno como gas impulsor, en pacientes estables puede usarse aire comprimido10
• En exacerbaciones de EPOC siempre usar oxigenoterapia, considerar no utilizar nebulizaciones con alto flujo en pacientes hipercápnicos10
• Es importante valorar la indicación de nebulización en pacientes con bajo flujo inspiratorio, con alteración cognitiva, mala coordinación, y disminución de la fuerza física
• La nebulización requiere solo una respiración tranquila, pero el depósito pulmonar del fármaco es escaso, solo de un 10 a 20%34
• Se debe seleccionar el nebulizador adecuado según los fármacos prescriptos e indicar al paciente la limpieza del mismo según las instrucciones del fabricante para evitar la contaminación bacteriana
• No indicar nebulizaciones en quienes pueden beneficiarse de inhaladores convencionales, como polvo seco en tratamientos crónicos, y evaluar su uso mayor a 30 días.
• El proceso de nebulización finaliza al terminar de producirse la nube de aerosol, de esa manera se cumple la dosis prescripta, los nebulizadores ultrasónicos son más rápidos que los nebulizadores jet35
• No utilizar el oxígeno para nebulizar en aquellos con oxigenoterapia continua domiciliaria; mantener la cánula nasal con oxígeno mientras se nebuliza el paciente10
Técnica de administración
La solución salina es la más utilizada para nebulizar con la medicación administrada, también puede realizarse con agua destilada o ambas, el volumen a utilizar oscila entre 4 y 5 ml, excepto que sea un nebulizador diseñado para un volumen más pequeño. Debe evitarse mezclar fármacos en el nebulizador, excepto que se haya demostrado su compatibilidad y estabilidad. Los volúmenes menores pueden aumentar la viscosidad de la solución. El tiempo de nebulización dependerá del volumen y la densidad de la solución a nebulizar36.
Mantenimiento y limpieza
Se debe limpiar el nebulizador luego de su uso, según las especificaciones del fabricante; tener precaución de no utilizar temperaturas elevadas en la limpieza porque pueden dañar el equipo, y también evitar tocar la malla en los nebulizadores de malla evitando así dañar el equipo, y limpiar las pipetas de cristales y detritus residuales para mejorar el rendimiento37.
Ningún sistema de aerosolterapia es perfecto, se debe indicar el método adecuado para cada paciente después de realizar una evaluación exhaustiva del caso, incluidas las preferencias del paciente, ya que esto contribuye a mejorar la adherencia al tratamiento.
Inhalador presurizado a dosis medida o aerosol
Características
El IPDM es considerado el primer tratamiento inhalatorio portátil en lograr una adecuada entrega de medicación a la vía aérea38. Desde 1956, fecha en que se comercializó, su uso rápidamente se generalizó, y sigue siendo aún hoy el tipo de inhalador más prescripto en el mundo39. Los primeros IPDM desarrollados en Laboratorios Riker contenían microcristales de isoproterenol (MedihalerIso ®) o epinefrina (MedihalerEpi ®) suspendidos en propelente clorofluorocarbono (CFC) 12 y CFC 114, y un 35% de etanol. En diciembre de 1956, Freedman publicó la primera experiencia de uso de IPDM en asmáticos, poniendo énfasis en la necesidad de instruir al paciente acerca de su uso adecuado y la importancia de sincronizar la inspiración con la administración de la dosis40. Los IPDM tienen varios componentes que fueron sufriendo algunas variaciones en el tiempo. Estos son frasco, propelente, principio activo, válvula dosificadora y carcasa (cartucho o canister).
El frasco es capaz de tolerar altas presiones generadas por el propelente. Inicialmente se confeccionó de vidrio y luego se reemplazó por aluminio porque es más liviano, compacto, menos frágil, y evita que el principio activo se adhiera a la pared y sea degradado por la luz41.
Los propelentes son sustancias químicas que se encuentran junto con la droga en estado líquido en el frasco y al tomar contacto con la atmósfera pasan al estado gaseoso. La diferencia entre la presión del propelente y la del ambiente permite que el líquido propelente contenido en la válvula salga explosivamente al exterior arrastrando la medicación activa11. Inicialmente se utilizó CFC-12, sustancia altamente volátil, y en menor cantidad CFC-11 o CFC-114, con un punto de ebullición mayor, logrando así un equilibrio dinámico entre la fase líquida y la gaseosa, con una presión de vapor constante en el frasco tanto lleno como casi vacío (300-500kPa o 2250-3750 mmHg), permitiendo así dosis terapéuticas reproducibles. Además, agregaron surfactantes para evitar la aglutinación de la droga41. En 1987, en el Protocolo de Montreal, se decidió limitar mundialmente el uso de CFC debido a los efectos nocivos del cloro sobre la capa de ozono42. Esto condujo por un lado al diseño de nuevos inhaladores en polvo y por otro a la reformulación de los aerosoles IPDM. El propelente CFC fue reemplazado por hidrofluoroalcano (HFA). El HFA-134a y el HFA-227 alcanzan propiedades termodinámicas similares al CFC-12, pero no logran equivalentes al CFC-11 ni al CFC-114. Esto dificultó la solubilidad de las drogas en el propelente, y fue necesario cambiar dosis y formulación, y asociar nuevos surfactantes y cosolventes43. Con respecto a los IPDM con propelente CFC, el HFA libera un gas con menor fuerza de impacto (25.5 vs. 95.4 mN) y mayor temperatura (8 °C vs. -29 °C), lo que obligó a reducir el orificio de la válvula (de 0.58 a 0.2 mm), generando así un humo más lento y menos frío que facilita su inhalación con menor irritación en boca y orofaringe (efecto frío freón de los propelentes CFC) y mayor depósito pulmonar. Usando propelente CFC, solo un 10-15% aproximadamente de la medicación llega al pulmón, a diferencia del HFA con el que se logran depósitos del 40-50%44. El propelente HFA está siendo cuestionado últimamente por su contribución al calentamiento global, que a pesar de tener un efecto muy pequeño podría en un futuro restringir su uso44.
Los IPDM contienen el principio activo en forma de microcristales de droga que se pueden hallar suspendidos o disueltos en solución en el propelente líquido. En los primeros, el producto en suspensión tiende a aglomerarse y precipitar, debido a que posee una limitada estabilidad coloidal, por lo cual es necesario agitar el inhalador antes de su uso. Hay que tener en cuenta que la agitación no tendrá mayor efecto sobre la dosis inmediata que ya está en la válvula dosificadora, sino sobre la próxima dosis. Por esto se recomienda siempre utilizar dos dosis y realizar dosis al aire cuando pasa más de una semana sin uso. En los IPDM disueltos en solución, el producto es más estable, sin tendencia a aglutinar, lo que permite una fracción de partículas finas mayor y no requiere agitar el inhalador antes de su uso. El limitante de estos últimos está dado por la diferente solubilidad de las drogas, y la consiguiente dificultad para combinar múltiples medicamentos con diferentes pesos específicos44,45.
En los últimos años se ha desarrollado un sistema de co-suspensión mediante el cual los cristales de fármaco se co-suspenden con partículas porosas de fosfolípidos. Éstos, al ser componentes endógenos del surfactante pulmonar, son bien tolerados cuando se utilizan para la administración de fármacos inhalados. Las partículas porosas tienen una estructura que mejora la aerodinamia y contribuye con la aerosolización; además brindan la posibilidad de combinar múltiples drogas de diferentes pesos específicos a la co-suspensión con el propelente, y son más estables y homogéneas que las suspensiones tradicionales46,47. Las partículas porosas se disuelven cuando alcanzan las vías respiratorias, liberando el fármaco hacia la superficie de la mucosa, logrando una mejor distribución y deposición pulmonar en comparación con las formulaciones tradicionales de IPDM46,47.
Los IPDM quedan constituidos de la siguiente manera (Fig. 3): constan de un cartucho o carcasa de aluminio (canister) que almacena a presión la droga activa, en forma de microcristales, disuelta en el propelente líquido como suspensión o solución. El cartucho se rodea de una carcasa plástica en la que está inserta la válvula dosificadora. Al presionar el dispositivo, sale a través de la válvula una dosis que pasa del estado líquido al gaseoso en forma de microgotas (humo). En estas microgotas, el propelente se evapora rápidamente y los microcristales de droga activa son dispersados. Estas partículas aerosolizadas son transportadas a la vía respiratoria por la corriente de aire generada en la inspiración. La llegada de la droga activa a los bronquios distales está relacionada con el flujo generado en la inspiración, el tamaño y la aerodinamia de la partícula y la coordinación en la maniobra. Los IPDM están diseñados para emitir partículas pequeñas. La velocidad y la fuerza centrífuga generada por flujos inspiratorios elevados incrementan la impactación en boca y orofaringe. Una inhalación más lenta optimiza el depósito periférico48. Los espaciadores (EP), también llamados AC, facilitan la generación de partículas respirables al dar tiempo para que el propelente evapore y reducir la velocidad del humo disminuyendo la impactación en orofaringe. Además, facilitan la coordinación y permiten su uso en niños y añosos no colaboradores (EP con válvulas)11.
Tipos de inhaladores presurizados a dosis medida
- IPDM con propelente en suspensión (convencionales). La droga activa se encuentra en suspensión con el propelente. Generan una partícula con una MMA de 1 a 4 μ. El humo sale a gran velocidad y requieren espaciador y una buena coordinación para disminuir el impacto en orofaringe. El inhalador debe ser agitado antes de su uso. En la Argentina es el inhalador más prescripto y se comercializa con diferentes clases de broncodilatadores de corta y larga duración y corticoides.
- IPDM con propelente en solución (de partícula extrafina). La droga activa se encuentra en solución con el propelente. Generan partículas de pequeño diámetro, con una MMA de aproximadamente 1.4 μ. El humo sale más lentamente, lo que facilita la coordinación y disminuye el impacto en la orofaringe. Logran mayor depósito en vía aérea periférica. Al tratarse de una solución no requiere que el inhalador sea agitado. En la actualidad no está disponible en el mercado argentino.
- IPDM activados por la inspiración (de autodisparo). Al inhalar el paciente se libera la dosis cargada, lo que optimiza la coordinación, disminuye el impacto en orofaringe y aumenta el depósito pulmonar. El inhalador debe ser agitado antes de su uso. En la actualidad no está disponible en el mercado argentino.
- IPDM en co-suspensión (Aerosphere ®). Se incorporan micropartículas fosfolipídicas porosas de baja densidad a las que se liga la medicación activa. Esto le confiere una mayor estabilidad a la suspensión en el propelente y mejor aerodinamia lo que optimiza la distribución pulmonar. El inhalador requiere agitación previa. En la Argentina solo se comercializa una combinación de broncodilatadores de acción prolongada con el inhalador Aerosphere ®.
Inhaladores de nube de vapor suave (Soft mist inhaler ®). Es un dispositivo híbrido entre los IPDM y los nebulizadores. Debido a ello, algunos expertos lo consideran una cuarta categoría de inhaladores. En comparación con los IPDM convencionales, genera una nube de mayor duración, con partículas de menor tamaño y velocidad, lo que aumenta su depósito pulmonar. No contienen propelentes. En la Argentina prescriben diferentes clases farmacológicas de broncodilatadores con el inhalador Respimat ®.
Ventajas
Los IPDM son en general económicos, portátiles, fácil de usar, contienen múltiples dosis en un solo aparato y pueden ser acoplados a un espaciador. Pero la mayor ventaja es que, a diferencia de los inhaladores a polvo seco, no precisan de flujos elevados para su inhalación, por lo que son más eficaces en el tratamiento de pacientes añosos, con enfermedad obstructiva grave, y constituyen la herramienta fundamental de los servicios de emergencias e instituciones médicas para el manejo de la crisis de broncoespasmo49-52.
Limitaciones
Las principales limitaciones de los IPDM son la dificultad en la sincronización activación-inhalación y la alta velocidad de salida del humo que provoca un elevado depósito en orofaringe; ambos inconvenientes se reducen con la utilización de espaciador. La mayoría requiere agitación antes de su uso para mantener una dosis estable. En los IPDM sin contador de dosis es difícil determinar la cantidad remanente en el inhalador.
En el pasado, uno de sus principales problemas con los IPDM fue la ausencia de un contador de dosis que permitiera conocer el contenido efectivo disponible del fármaco. Hacer flotar el cartucho de metal en agua o escucharlo mientras se agita no son técnicas confiables para averiguar cuánto medicamento queda en el inhalador.
Recomendaciones de su indicación
• En niños mayores de 5 años y adultos que realizan una correcta técnica de uso
• En aquellos pacientes que no pueden desarrollar flujos inspiratorios enérgicos (altos) para poder usar los IPS
• Se debe revisar en cada consulta su correcto uso
Técnica correcta de uso de los inhaladores presurizados a dosis medida11,45
Cada IPDM contiene formulación y dosis de drogas específicas. Salvo en situaciones especiales, una pulsación del inhalador se asocia a una inspiración del paciente (modalidad presione y respire).
1) Sacar la tapa de la pieza bucal del inhalador
2) Agitarlo (no es necesario con algunos IPDM HFA en solución)
3) Mantener vertical el aerosol
4) Espirar todo el aire de los pulmones
5) Hay dos técnicas propuestas para usar IPDM sin espaciador: Con boca cerrada, se coloca la pieza bucal entre los labios y dientes, con la lengua abajo sin ocluir la salida del aerosol. Con boca abierta, con la pieza bucal a mitad de la abertura de la boca bien abierta separado dos dedos de la cavidad oral. Esta última técnica según algunos autores reduciría el impacto en la orofaringe53-55
Se recomienda usar los IPDM con espaciador, si es con boquilla se utiliza la técnica con boca cerrada. En niños y adultos que no coordinan, se sugiere EP con máscara facial y válvulas, manteniendo la máscara en posición durante 6 respiraciones
6) Accionar el inhalador justo cuando se inicia una inspiración lenta y profunda (de aproximadamente 5 segundos)
7) Remover el inhalador de la boca y sostener la respiración por lo menos 10 segundos
8) Espirar lentamente
9) Enjuagarse la boca con agua
10) Cuando el inhalador no fue utilizado por una semana o más, se recomienda antes de usar agitar bien y accionarlo un par de veces al aire. Algunos inhaladores requieren limpieza periódica
11) La boquilla del inhalador se debe limpiar por dentro y por fuera con un paño seco. En algunos inhaladores IPDM en co-suspensión (Aerosphere ®) la boquilla corre riesgo de bloquearse por acúmulo de medicación; se recomienda limpiarla cada 7 días, separar el cartucho de la carcasa y sumergir esta última en el chorro de agua de la canilla durante 30 segundos en ambos sentidos (a través de la boquilla y del actuador) y dejar secar durante la noche. Los nuevos inhaladores para IPDM en co-suspensión (no comercializados aún en la Argentina) poseen un orificio mayor y no requieren esta limpieza
12) En la actualidad no se recomienda sumergir el cartucho en agua ni siquiera para determinar nivel de carga
Mantenimiento y limpieza
Antes de usar el IPDM por primera vez, y cuando el inhalador no ha sido utilizado por más de 7 días, se realizarán dos o tres pulsaciones al aire. En caso de haber estado sometido a bajas temperaturas, es necesario esperar unos minutos a mayor temperatura antes de realizar la maniobra de inhalación. Por otra parte, como contiene líquido presurizado, no debe ser expuesto a temperaturas superiores a 50 °C y el cartucho metálico no debe ser perforado en ningún caso.
Es importante limpiar el inhalador al menos una vez por semana. Para realizar este proceso, es conveniente seguir estos pasos:
• Extraer el tubo metálico de la carcasa de plástico del inhalador y quitar la cubierta de la boquilla
• Lavar la caja de plástico y la cubierta de la boquilla en agua tibia. Hay que eliminar posibles restos de medicamento u otros agentes depositados en la boquilla con objetos punzantes, tipo aguja o similar. Se puede añadir un detergente suave al agua, y aclarar luego con agua corriente limpia antes de proceder al secado. Aunque resulte evidente, no debe sumergirse el tubo metálico en el agua. Algunos inhaladores modernos pueden ser limpiados simplemente con un paño húmedo
• Para secar la carcasa y la cubierta de plástico, lo más conveniente es dejarlos en un lugar seco y cálido, evitando el calor excesivo
Inhaladores presurizados a dosis medida, aerocámaras y espaciadores
Las AC y los EP constituyen elementos importantes a tener en cuenta a la hora de prescribir un IPDM. Nacen a partir de la necesidad de contar con dispositivos que permitan, a los pacientes que tienen distintos tipos de dificultades, el uso correcto de la medicación empleada por la vía inhalatoria para el tratamiento de las distintas enfermedades respiratorias. Al ser accionados, los IPDM generan partículas que se movilizan rápidamente e impactan en la orofaringe. Solo una pequeña fracción llega al pulmón. Estos aditamentos se comenzaron a desarrollar a mediados de la década del 70, cuando se planteó el problema de la coordinación “mano-pulmón” ya que los pacientes deberían presionar el aerosol y respirar simultáneamente y además servirían para reducir el impacto oral, con sus consecuencias indeseables56. La primera AC comercializada, data de 1976. Sin embargo, desde mucho antes se venía difundiendo el uso de dispositivos no valvulados caseros. Su utilidad, formas de uso, ventajas y desventajas, se describen a continuación.
Se define AC o cámaras de inhalación al dispositivo de mayor tamaño (140-800 ml) que separa la boquilla del IPDM de la boca del paciente. Posee una válvula en su parte anterior, habitualmente unidireccional, que facilita la inspiración, pero no la espiración del aire contenido dentro de ella. Consiste de: (i) un cuerpo que se fabrica de plástico, metal o de un material polímero plástico especial que repele las cargas electrostáticas, el tamaño es variable, pero debe permitir una separación de al menos 10 cm con la boca; (ii) una interfase con el paciente (máscara facial que debe ajustar perfectamente a la cara o una pieza bucal); (iii) una válvula unidireccional que permite la salida del material aerosolizado; y (iv) un puerto posterior de goma o plástico, para adaptar el aerosol. Algunas cuentan con un silbato que permite ajustar la velocidad del flujo de inhalación.
Se define EP también al dispositivo que separa la boquilla del IDPM de la boca del paciente, puede tener menor volumen con respecto a la AC, pero carece de válvula inspiratoria y/o espiratoria. Debe tener al menos 100 ml y se debe usar a una distancia entre el aerosol y la boca (10-13 cm) como para permitir la expansión del gas
generado por el IPDM y la evaporación del propelente. También se han distinguido los dispositivos de “flujo reverso” en los que el aerosol es disparado dentro de una bolsa o cámara cuyo contenido se inhala.
Existe una gran variedad de diseños y materiales empleados en la construcción de estos dispositivos. Se los puede agrupar de acuerdo al tamaño en dos categorías, de pequeño volumen (130-300 ml) y gran volumen (600-800 ml).
Efectos de los espaciadores o aerocámaras en la liberación pulmonar de la medicación
Según algunos investigadores, el depósito orofaríngeo de las drogas se reduce hasta en un 80%, cuando se lo compara con el IPDM utilizado sin aditamentos57. Esto se debe a que la medicación queda alojada inicialmente en la aerocámara y luego es inspirada. El depósito pulmonar se incrementa o, a lo sumo, no cambia. La cantidad de droga depositada dependerá también de la preparación de la misma y no necesariamente garantizará una mayor eficacia clínica.
Los estudios diseñados para investigar estos puntos han arrojado resultados contradictorios. Hay discordancia entre los datos obtenidos de estudios in vitro e in vivo y dudas acerca de las verdaderas implicancias clínicas.
Una vez activado el IPDM, las partículas impactan las paredes del dispositivo a alta velocidad y el propelente, al evaporarse, genera gotas que son “respirables”. Es decir, una fracción de la dosis quedará en las paredes y otra seguirá en suspensión para ser recibida por el paciente. Por lo tanto, permite reducir la velocidad y el tamaño de las partículas administradas. Los estudios con radiomarcadores mostraron que los EP más grandes (750 ml o más) permitieron una mayor deposición pulmonar de partículas. Esto es consistente con revisiones recientes, que sugieren que éstos confieren ventajas en términos de calidad y cantidad de aerosol que llega al pulmón. Barry y col. demostraron, ensayando con dispositivos de distintos tamaños que, con un EP de una longitud de 20 cm, equivalente a un litro de volumen, se logró alcanzar un efecto plateau que no mejoró con mayores volúmenes y que correlacionó positivamente con la fracción respirable del gas que llegó a aproximadamente un 30%60. Sin embargo, otros estudios lograron ese efecto con dispositivos más pequeños. Los EP grandes tienen ventajas en relación a la cantidad del aerosol liberado. Esto debería equilibrarse con la impracticabilidad de su uso, ya que se ha comprobado, en contraposición, una disminución significativa en la adherencia.
Se han diseñado cámaras con distintas formas, triangulares o redondeadas, que tienen algunos estudios de respaldo por sobre la forma cilíndrica tradicional, pero la evidencia disponible no es concluyente.
La longitud de la cámara de 13-20 cm es la idónea para generar una distribución óptima de partículas de tamaño entre 1-5 μ, cuya vida media dependerá del material con que se ha fabricado. Las fabricadas con material metálico y algunas de las de plástico más recientes, construidas con materiales polímeros, que tienen menor carga electrostática, mejoran el depósito pulmonar hasta en 70%. La droga permanecerá cerca de 10 segundos en forma disponible para inhalar.
La mayor parte de los estudios han utilizado b2-agonistas como droga de investigación. La eficacia de otros medicamentos a través de esta vía de administración se extrapola. Se consigue, en teoría, disminuir el depósito en la boca, la disfonía y la candidiasis orofaríngea de los corticoides inhalados. Su mayor utilidad se ha referido a aquellos pacientes que no logran coordinar las maniobras de inhalación y se los considera esenciales para los niños muy pequeños.
El agregado de una válvula unidireccional de baja resistencia que se abre ante la inspiración caracteriza a las AC. La diferencia se daría porque las partículas “capturadas” en la cámara son “liberadas” por la inhalación. Algunas tienen puerto exhalatorio para evitar la re-inhalación. Son muy importantes para personas con pobre coordinación y en aquellos que no pueden realizar inspiraciones profundas. Un estudio comparativo determinó el rendimiento de los dispositivos accesorios (incluidos algunos de fabricación casera) con respecto a los IPDM60. Se determinó que cuatro criterios son clínicamente relevantes: la cantidad de dosis de partículas finas liberadas, el depósito en la orofaringe, la eficacia ante la asincronía en la inspiración y la facilidad de uso. Todos los dispositivos, valvulados o no, permitieron un menor depósito en la orofaringe (20 a 40%), las AC valvuladas fueron más eficaces frente a la asincronía, pero no hubo diferencia significativa en la cantidad de partículas finas obtenidas ni en la facilidad del uso61. Cuando se utiliza un EP, la reducción de la dosis pulmonar es relevante (dos tercios) si el paciente retarda la inhalación solo un segundo respecto al disparo61,62. Más aún, si la acción se gatilla durante la exhalación, el depósito pulmonar cae drásticamente 80 a 90% con respecto al que se alcanzaría en forma asincrónica61,62. En cambio, si se utiliza una AC valvulada, la influencia del momento del disparo es menos significativa. Diferentes estudios en población pediátrica han demostrado que las AC son más eficientes que los EP62.
La aplicación clínica del uso de AC y EP tiene tres objetivos:
1. Hacer que los IPDM sean fáciles de usar al reducir la necesidad de coordinar la inhalación
2. Mejorar la eficacia de la medicación sobre todo con los corticoides inhalados, ya que permiten disminuir la dosis corporal total que recibirá el paciente. Se reconoce que producen disfonía y candidiasis orofaríngea como efectos adversos locales, pero parte del mismo será tragado y potencialmente aumentará sus efectos sistémicos. Sobre todo, cuando se indican en dosis altas; su utilización se encuentra recomendada por las distintas guías de práctica clínica, tales como GINA7
3. Constituir una alternativa a los nebulizadores para la administración de broncodilatadores en pacientes con ataques de asma o reagudizaciones de la EPOC63. Permitirían la administración efectiva de una menor cantidad de droga, con un menor riesgo de contaminación e infección
• Menor necesidad de coordinación entre la pulsación del IPDM y la inspiración; puede ser administrada por un cuidador
• Enlentece la nube de aerosol a medida que emerge del IPDM. Reduce la impactación/deposición orofaríngea y los efectos secundarios locales. Las partículas de mayor tamaño sedimentan en la cámara. Filtra las partículas de aerosol de mayor tamaño.
• Reduce la fracción de fármaco ingerido, la absorción gastrointestinal, la biodisponibilidad sistémica y por lo tanto los efectos extrapulmonares no deseados (agonistas b-adrenérgicos y corticoides inhalados)
• Mejora el depósito de las partículas activas en la vía aérea profunda; aumenta el depósito pulmonar del fármaco en un 20% aproximadamente
• Utilidad probada para el uso durante una exacerbación o crisis
• Permite usar respiración a volumen corriente si el espaciador tiene válvula
• No requiere altos flujos inspiratorios
• Algunos producen un “ruido”, lo que indicaría que el flujo de inhalación es muy rápido
Limitaciones 12, 58
• En algunos casos, su tamaño las hace poco portátiles
• No todas son universales. Existen incompatibilidades entre los diferentes fabricantes de cámaras y los distintos aerosoles disponibles en el mercado
• Necesitan limpieza regular con frecuencia, al menos una vez a la semana, con agua y jabón, y dejar secar al aire, sin frotar
• La carga electrostática puede reducir la fracción de aerosol respirable haciendo que menor cantidad de partículas fármaco-activas lleguen al pulmón (este efecto se reduce con las cámaras construidas de metal y algunas más modernas de polímeros plásticos elaboradas con material antiestático)
• Posibilidad de contaminación microbiana
• El costo, en general, es alto y la mayoría no tiene cobertura por parte de los prestadores de salud y el Estado Nacional
Técnica correcta de utilización de las aerocámaras y espaciadores
La inhalación del paciente no se debería demorar con respecto al disparo dentro del dispositivo. Tomar múltiples respiraciones a volumen corriente puede ser más práctico que una respiración profunda, sobre todo en niños.
Se recomienda explicar al paciente claramente, adiestrar en la técnica de utilización y revisar periódicamente su forma de uso12.
Los pasos correctos son:
1. Colocar el IPDM en posición vertical, en forma invertida en el extremo distal de la cámara, y luego agitarlo vigorosamente
2. Colocar la cámara perpendicular al cuerpo con la máscara bien adherida a la cara, abarcando boca y nariz. Sostenerla con firmeza
3. Vaciar los pulmones lentamente, hasta donde sea cómodo
4. Colocar la boquilla de la cámara entre los labios y los dientes, evitando que la lengua obstruya la salida de la boquilla, o coloque la máscara sobre la nariz y la boca y exhortar al paciente a respirar por ella. Inspeccionar visualmente el funcionamiento correcto de la válvula
5. Con respiración normal, accionar el IPDM solo una vez (1 puff) y hacer que el paciente respire inmediatamente a través del dispositivo lentamente hasta llenar los pulmones de tres a siete veces (tres respiraciones para los adultos)*,**
6. Retener la respiración 10 segundos (como mínimo 5 segundos). Como alternativa, si no se puede mantener la respiración, considerar la posibilidad de efectuar múltiples respiraciones seguidas en la misma maniobra
7. Retirar la cámara de la cara
8. En caso de requerir un segundo disparo, dejar pasar por lo menos un minuto y repetir la maniobra descripta
Mantenimiento y limpieza
• Limpiar el dispositivo por lo menos una vez por semana
• Utilizar agua tibia y unas gotas de detergente suave (esto reduce la carga electrostática) cada 10 a 12 días
• Dejar secar al aire, sin frotar, en el escurridor de platos
• No hervirlas, no colocarlas en el lavaplatos, microondas ni secarla con paños o papeles generando fricción
• Verificar la unión “aerosol-intermediario” para evitar fugas con pérdida de la medicación
• Respetar uso individual para evitar contagios
• Guardar el aerosol con tapa colocada y la aerocámara en lugar limpio y fresco, lejos del alcance de los niños. No es un juguete
• Llevar la aerocámara a todas las consultas
• Si se usa una aerocámara con válvulas, controlar periódicamente que éstas funcionen bien
• Suelen tener una vida media de aproximadamente un año
Recomendaciones de la indicación de los inhaladores presurizados a dosis medida y aerocámaras en adultos58
• Adultos con mala coordinación de la técnica de uso de IPDM
• En pacientes que por el uso de corticoides inhalados (sobre todo si la dosis indicada es alta) presentan eventos adversos o se quiere reducir su incidencia (orofaríngeos, laríngeos y de impacto sistémico)
• En la atención de una crisis de asma bronquial o exacerbación de EPOC, para administrar broncodilatadores en reemplazo de la medicación nebulizada, por ser más simple y sencillo de usar. En el tratamiento de la crisis asmática (excepto las de riesgo vital), el efecto de un broncodilatador b2 agonista administrado con AC es equivalente al de un nebulizador
Errores en el uso de las aerocámaras y espaciadores en adultos58
• Incapacidad de mantener apnea (o mantenerla durante al menos 3 segundos)
• Cuando se ha indicado administrar dos dosis, comenzar la segunda antes de los 2 segundos de la primera
• Presentar tos durante la inhalación
• Un EP o AC defectuosa en la válvula o con grietas en el plástico
• Secar la cámara con un paño en lugar de al aire
• No quitar la tapa del IPDM
• No quitar la tapa de la pieza bucal
• No agitar el inhalador
Aerocámaras y espaciadores en pediatría
En los últimos 50 años, se ha jerarquizado la terapia inhalatoria en pediatría y, en la actualidad, se la considera una herramienta terapéutica de primera línea para múltiples afecciones59,60. Permitió que niños de todas las edades pudiesen acceder a tratamientos locales o tópicos, de gran eficacia, rápido inicio de acción, gran practicidad administrando fármacos de dosis cuantificables, minimizando efectos sistémicos53,59,60,63,64.
En el apartado de aerosoles y el de EP y AC en adultos se han descripto detalladamente las características de los mismos.
En pediatría nunca se debe indicar la administración directa en la boca del IPDM, es mandatorio el uso de los mencionados dispositivos65. Los niños pequeños son incapaces de realizar la maniobra de inhalación y posterior apnea y los de edad escolar y adolescentes tienen muchas dificultades para coordinar la inhalación con el momento del disparo del IPDM, por lo que se desperdicia medicación, se incrementa el depósito orofaríngeo, disminuye la eficiencia terapéutica y se generan mayores efectos secundarios.
En pediatría, el desafío radica en la correcta elección del dispositivo considerando la edad del niño, evaluando sus capacidades y habilidades para lograr que realice correctamente la técnica. Sabemos que los niños poseen vías aéreas más cortas, de menor calibre y mayor resistencia. A menor edad, la frecuencia respiratoria es mayor, los ciclos respiratorios son más cortos y de menor amplitud, el volumen inspiratorio es menor y, si a estas características fisiológicas le sumamos un cuadro clínico de dificultad respiratoria asociado o no a un síndrome febril, la frecuencia respiratoria incrementa notablemente. En los niños pequeños predomina la respiración nasal, por lo cual es imprescindible el uso de máscara facial que se adhiera a la cara abarcando nariz y boca.
Ventajas
Al disparar el IPDM en una aerocámara o espaciador se logra reducir la velocidad de las partículas de la nube del aerosol, las que se expanden y favorecen la evaporación del propelente. Las partículas grandes impactan y se depositan en las paredes de la cámara. Las medianas y las pequeñas se mantienen en suspensión y son inhaladas en cada ciclo respiratorio realizado por el niño.
El correcto uso y adecuado estado de conservación de estos dispositivos permite optimizar el tratamiento inhalatorio, eslabón fundamental para el éxito terapéutico. Disminuyen la tos y el broncoespasmo reflejo, reducen efectos colaterales locales (ej.: candidiasis) y sistémicos gracias al menor depósito orofaríngeo y a la menor absorción oral y gastrointestinal.
Limitaciones
• Algunas son frágiles, se pueden romper
• A veces el extremo distal de la aerocámara no es de material moldeable, lo que dificulta la hermética adherencia de las boquillas de los IPDM
• En algunos niños se han constatado reacciones alérgicas en la cara por contacto
• El costo suele ser elevado, no están subvencionadas. Deben ser renovadas y cambiadas periódicamente
• La aplicación en el hogar siempre debe ser supervisada por un adulto responsable
• Requieren frecuente supervisión médica de la técnica y estado de conservación de las aerocámaras
Requerimientos técnicos del uso de aerocámaras en pediatría66
Las aerocámaras de uso pediátrico varían en su forma de presentación, solo algunas de las manufacturadas y mencionadas en la literatura están disponibles en nuestro medio y no disponemos de aerocámaras de gran tamaño56.
La calidad, la sensibilidad y el buen funcionamiento de las válvulas, tanto inspiratoria como espiratoria, son puntos fundamentales, dado que lactantes y niños generan bajos flujos. La válvula inspiratoria unidireccional permite que, respirando a volumen corriente, en cada inhalación el aire de la aerocámara sea aspirado e ingrese en la vía aérea. Al espirar, la válvula inspiratoria se cierra y el aire exhalado sale por la válvula espiratoria mezclándose con el aire ambiental. El cierre hermético de la válvula inspiratoria evitará que se pierda la medicación retenida en la cámara en caso de que el niño mueva la cabeza y la separe de la aerocámara.
La calidad y grado de adherencia de la máscara facial a la cara del niño harán que la maniobra sea confortable, evitarán la pérdida de medicación y potenciarán la eficacia de la misma en la maniobra inspiratoria.
Los EP simples no poseen válvulas; el paciente inhala y exhala en el reservorio y, en caso de que se aparte la cara del dispositivo la mediación retenida en el mismo se perderá mezclándose con el aire ambiental. En caso de no poder acceder a una AC manufacturada, existe la posibilidad de confeccionar EP caseros teniendo muy en cuenta optimizar el sellado de la entrada del aerosol y el de la máscara facial evitando fugas de la medicación prescrita67.
El volumen recomendado de las AC y EP no debe ser inferior a 140 ml, ni superior a 800 ml y su longitud entre 13 y 20 cm.
Algunas AC han sido diseñadas con materiales antiestáticos que reducen la adherencia de las partículas del aerosol a las paredes del reservorio.
Técnica para el uso de aerocámara con pieza bucal en niños (Fig.4a)
• Mantener el niño sentado, nunca acostado. Si opone resistencia colocarlo con la espalda y cabeza apoyadas en el pecho del adulto, sujetar firme y suavemente piernas y brazos. También puede estar de pie
• Sacudir el IPDM y colocarlo en forma invertida en el extremo distal de la cámara
• Solicitarle que realice una maniobra espiratoria máxima y la mantenga
• Colocar en la boca la pieza bucal con los labios bien sellados y la cámara perpendicular al cuerpo
• Realizar un disparo del IPDM
• Solicitarle que realice una inhalación lenta y profunda y retenga el aire mediante apnea de diez segundos. Algunas AC poseen un visualizador de movimiento de la misma (flow-vu) que permite controlar la inspiración y un sonido que advierte si la inhalación haya sido excesivamente brusca o rápida
• Retirar la pieza bucal de la boca
• En caso de requerir un secundo disparo, dejar pasar por lo menos un minuto y repetir la maniobra descripta
Técnica para el uso de aerocámara con máscara en niños (Fig. 4b)
En la práctica clínica, se asume que a los niños menores de 5 años hemos de indicar siempre AC con máscara siguiendo las instrucciones que se detallan a continuación. Para indicar una AC con pieza bucal debemos cerciorarnos que el niño sea capaz de colaborar y asimilar las consignas correspondientes, que pueda realizar una inhalación lenta y profunda que genere un flujo inspiratorio suficiente y que pueda lograr mantener una apnea de 10 segundos de duración luego de la inhalación
• Mantener el niño sentado, nunca acostado. Si opone resistencia colocarlo con la espalda y cabeza apoyadas en el pecho del adulto, sujetar firme y suavemente piernas y brazos
• Sacudir el IPDM y colocarlo en forma invertida en el extremo distal de la cámara
• Colocar la cámara perpendicular al cuerpo con la máscara bien adherida a la cara, abarcando boca y nariz. Sostenerla con firmeza
• Realizar un disparo del IPDM
• Contar diez inhalaciones controlando los movimientos respiratorios del niño, la apertura de la válvula inhalatoria. Algunas AC poseen un visualizador de movimiento de la misma (flow-vu)
• Retirar la cámara de la cara
• En caso de requerir un segundo disparo, dejar pasar por lo menos un minuto y repetir la maniobra descripta
Errores frecuentes en pediatría 4,68
• No sacar la tapa del IPDM
• No colocar el aerosol en posición de L invertida
• Soplar dentro del dispositivo en vez de inhalar
• A veces cuentan, hablan o cantan y no realizan los diez ciclos respiratorios solicitados
• Evitar en la medida de lo posible que el niño llore69
• Buscar el ideal para cada niño, evaluando si es conveniente respiración a volumen corriente o si, en función de su desarrollo físico y psíquico, puede realizar maniobra de inhalación profunda y apnea posterior
Recomendaciones de la indicación de los inhaladores presurizados a dosis medida y aerocámaras en pediatría
Se debe indicar siempre la administración directa en la boca del IPDM con AC en todos los niños menores de 5 años.
En los niños mayores de 5-6 años de edad capaces de colaborar, lo ideal es indicar AERC con pieza bucal con la finalidad de optimizar el acceso a la medicación realizando maniobra inspiratoria lenta y profunda seguida de una apnea de diez segundos.
Utilización de dispositivos en Unidades Críticas
El desarrollo en la administración de medicamentos por vía inhalatoria ha tenido un gran progreso en los últimos años gracias al avance en los conocimientos físicos, farmacológicos y técnicos, que han permitido el empleo cada vez más frecuente de los aerosoles y lograr aprovechar sus claras ventajas sobre otras vías de administración esto es, requerir menor cantidad de droga, tener menos efectos sistémicos y mayor rapidez de acción70-72.
La aplicación en cuidados críticos adquiere connotaciones complejas debido a la gran cantidad de factores involucrados. La terapia con IPDM con adaptadores y el uso de nebulizadores han mejorado notablemente en los últimos años a la par del conocimiento de la fisiopatología del movimiento de las partículas aerosolizadas.
Como conceptos claves se mencionan la tasa de salida (masa de aerosol generada por unidad de tiempo), el tamaño de la partícula generada y el depósito en la vía aérea natural y artificial73,74. Además, hay que considerar los factores que afectan el aporte de los aerosoles en los pacientes con una vía aérea artificial, sobre todo el tubo endotraqueal, que aumenta la resistencia dependiendo de su tamaño, del material (carga electrostática) y del espacio muerto extra-torácico. Se considera que esto constituye el mayor impedimento para la llegada del aerosol al tracto respiratorio inferior. Actúa como el sitio primario de impacto de las partículas, reteniendo una gran parte de las mismas, en función de la longitud y los ángulos del circuito. En esta misma consideración, se incluyen también la pieza en Y, el codo del conector y los tubos corrugados. Para sobrepasar el tubo endotraqueal y llegar a la vía aérea distal, las gotas o esferas deberían tener de 1 a 3 μ, vencer el impacto inercial (tamaño, flujo alto y flujo turbulento), la sedimentación gravitacional en cuanto cesa el flujo de aire y la difusión. Hay varios métodos y estrategias que se emplean en la aerosolterapia en cuidados críticos (Tabla 2):75-77
1. IPDM con adaptador y AC
2. IPDM en línea o directo sobre el circuito y/o por el tubo endotraqueal
3. Nebulizadores tipo jet
4. Nebulizadores a malla vibrante
5. Nebulizadores ultrasónicos
1. Inhaladores de dosis medida con adaptador y aerocámara75
Son eficaces, económicos y fáciles de utilizar. Se deben aplicar con un dispositivo adaptador diseñado para añadir al circuito del respirador. Este puede ser, unidireccional, bidireccional o simplemente una cámara espaciadora, de 50 a 150 ml de volumen. Los bidireccionales son más eficaces y los EP hasta 8 veces mejores. Esto se debe a que la velocidad del aerosol se enlentece y se evapora el propelente disminuyendo el tamaño de las partículas. Los más grandes y los elaborados utilizando materiales electrostáticos son mejores. Uno de sus inconvenientes potenciales es la gran variabilidad de la dosis que logra llegar al pulmón (de 0.3% a 97.5%)67. Se sugiere colocarlos a 15 cm del tubo endotraqueal. Los factores que afectan la eficiencia del IPDM serían la separación de la droga y el propelente, la temperatura, el volumen, la posición del EP o AC, la ubicación en el circuito y el tiempo de disparo, entre otros.
2. Inhalador presurizado a dosis medida en línea o directo sobre el circuito y/o por el tubo endotraqueal75
Cuando el IPDM se conecta directamente al tubo orotraqueal, el 90% de la droga se deposita en él o en el adaptador que se utiliza. Esta cantidad se reduce al mínimo cuando se coloca un EP a una importante distancia de la Y. Por otro lado, una alta proporción del aerosol se pierde en el tubo cuando se aplica en un circuito de ventilador con humidificador. Se puede reducir al mínimo en circuito seco41.
3. Nebulizadores neumáticos o tipo jet73,75,77
3a. Nebulizadores a jet de pequeño volumen. El gas externo es aportado por un compresor o una fuente de gas comprimido. Funcionan en forma continua, usando aire a presión u oxígeno. Se supone que aumentan entre 6 y 8 l/ minuto el volumen corriente insuflado por el respirador. Se contaminan fácilmente. Constan de un reservorio pequeño (5 a 20 ml), una entrada para el gas, un amplificador y un sistema capilar o Venturi que crea el aerosol al combinar el flujo de gas y la solución a un punto de alta velocidad. Ya que flujos bajos o altos limitan la nebulización, se recomienda utilizar entre 8 y 10 l/min. Existen sistemas con nebulizador de flujo continuo con reservorio simple y otros con bolsa reservorio. Los diseñados con una bolsa reservorio que se ubica sobre la rama espiratoria mejoran la eficiencia entre 30 y 50%73.
3b. Nebulizadores a jet de gran volumen. Son útiles para pacientes con broncoespasmo. Tienen un reservorio de 200 ml y generan partículas de 2.2 a 3.5 μ. Permiten realizar terapia broncodilatadora continua.
4. Nebulizadores de membrana vibrante
Se los puede utilizar adaptados en ventilación invasiva y no invasiva preferentemente próximos al ventilador. Son de elección para administrar los antibióticos nebulizados. Su costo es alto.
5. Nebulizadores ultrasónicos
En ventilación mecánica se emplean con mayor frecuencia los IPDM con adaptador y/o EP y los nebulizadores de pequeño volumen. Estos dos métodos han sido validados ampliamente en la literatura14.
La mayoría de estudios sobre efectos de aerosolterapia en ventilación mecánica se han realizado en pacientes intubados por vía orotraqueal. Existe mucha menos experiencia con traqueostomías.
Estudios en vivo muestran que el depósito de aerosol con nebulizadores es, en general, menor del 5%, aunque un estudio informó hasta 30%. Por otro lado, con IPDM hay resultados mejores, que varían de 6 a 11%73.
Inhaladores de polvo seco
Características
Los inhaladores de polvo seco (IPS) son dispositivos que liberan un principio activo al aparato respiratorio cuando se inhala a través de ellos. Las indicaciones más frecuentes son las enfermedades obstructivas (asma, EPOC); pero existen antibióticos como la tobramicina a través del Podhaler ® (ver más adelante), insulina, vacunas respiratorias, antipsicóticos y otras formulaciones que utilizan los dispositivos IPS para alcanzar niveles terapéuticos con dosis mucho más bajas que la administrada por vía sistémica.
Básicamente, un IPS bien diseñado consta de una formulación en polvo adecuada para el fármaco (principio activo), un compartimento precargado de dosis única o un recipiente multidosis con un mecanismo de medición para la formulación en polvo, un principio de dispersión de polvo y una carcasa para todas las piezas. Las características secundarias pueden incluir varias formas de señalar al paciente el uso correcto con respecto a la activación y a la inhalación de la dosis y el número de dosis que quedan en el inhalador. También pueden tener medidas de protección contra la absorción de humedad por la formulación en dispositivos multidosis o contra la exhalación a través del inhalador78,79.
Clasificación según la disposición de las dosis
En la Figura 5 se muestra la clasificación de los IPS según la disposición de la dosis.
Otra forma de clasificar a los IPS es según la resistencia ofrecida. Básicamente, los IPS se pueden diferenciar según su régimen resistivo intrínseco, como una constante que depende del diseño original de cada dispositivo, y que se evalúa midiendo la magnitud de la caída de presión en el propio dispositivo:
• Baja resistencia (< 5 Mbar 1/2 l/min). Requieren flujos inspiratorios >90 l/min. Disponibles en Argentina: Aerolizer ® y Breezhaler ®
• Media resistencia (5-10 Mbar 1/2 l/min). Requieren flujos inspiratorios entre 60 y 90 l/min. Disponibles en Argentina: Turbuhaler ®, Diskus ® y Ellipta ® ; no disponibles en Argentina: Novolizer® y Genuair®
• Alta resistencia (> 10 Mbar 1/2 l/min). Requieren flujos inspiratorios < 50 l/min. Disponible en Argentina: HandiHaler ®; no disponibles: Easyhaler ® y Twisthaler ®
Eficiencia en la entrega
Administrar el medicamento de la manera más eficiente posible adonde debe ir en las vías respiratorias, sigue siendo el objetivo número uno. Los desarrolladores continuarán apuntando a mejorar la eficiencia de la administración de medicamentos al pulmón mediante la reducción de pérdidas en el dispositivo y las vías respiratorias superiores, ya que esto mejora el tratamiento del paciente. Los desarrollos recientes de inhaladores han alcanzado dosis pulmonares entre el 40% y el 50% como porcentaje de la declaración de la etiqueta utilizando una serie de formulaciones basadas en vehículos tradicionales basados en transportadores con agentes de control de fuerza de cohesión y basado en fórmulas sin transportadores79.
Entrega de fármacos en dosis altas
Nuevas moléculas grandes entran en la línea de desarrollo respiratorio de las grandes empresas farmacéuticas y biotecnológicas tales como proteínas, oligonucleótidos, anticuerpos y nanopartículas. Como resultado, es posible que se requieran nuevos IPS para administrar dosis más altas utilizando formulaciones ricas en fármacos en grandes volúmenes de polvo y sin portadores, posiblemente requiriendo múltiples inhalaciones por parte del paciente.
Por el contrario, cuando se utiliza un IPS de baja resistencia, la única fuerza impulsora para la desagregación y la microdispersión del fármaco a inhalar es la tasa de flujo de aire de inhalación del paciente (el papel de la turbulencia inducida por la resistencia es insignificante en estos casos), que solo depende de la gravedad de su enfermedad. Como consecuencia, el requerido régimen de turbulencia solo se puede lograr aumentando el flujo de aire de inhalación, que, sin embargo, con frecuencia representa la principal limitación crítica para pacientes con enfermedades pulmonares obstructivas. En estas circunstancias, la variabilidad en la dosis es mayor y la dosis inhalada efectiva puede estar lejos de la declaración original, debido también al mayor impacto orofaríngeo de la droga en polvo. En realidad, estamos ante un “malentendido conceptual” que es crucial para decidir qué IPS es más conveniente para el paciente en la vida real. En otras palabras, los IPS de “baja resistencia” no son “los IPS más eficaces” porque los pacientes necesitan un nivel de flujos inspiratorios más altos. Con frecuencia aquellos con EPOC no pueden lograr altos flujos inspiratorios. Desafortunadamente, estos conceptos no fueron lo suficientemente aclarados en la práctica general, y fueron progresivamente descuidados y prácticamente dejados a la interpretación simplista incorrecta del término “baja resistencia”, que recuerda espontáneamente per se el principio de “facilidad de uso”, particularmente en médicos inexpertos. También la renuencia de la industria a explicar mejor o caracterizar su dispositivo jugó, un papel crucial en la negligencia de estos aspectos. Puede que el escenario de la vida real se vuelva cada vez más confuso en el futuro cercano porque, más allá de los numerosos IPS ya disponibles con fines terapéuticos, dispositivos novedosos están entrando en el mercado y debería consignarse la gama de regímenes de resistencia intrínseca de cada nuevo IPS, porque el desempeño de los distintos IPS varía aún más en términos de terapéutica y eficacia, sustancialmente por el régimen de resistencia intrínseca. Vale aclarar que el flujo inspiratorio óptimo no debe ser excesivo porque aumenta la pérdida de dosis por impacto orofaríngeo y a su vez, si el flujo es insuficiente, el principio activo queda en el reservorio. En un estudio de pacientes con EPOC, los flujos inspiratorios máximos (PIFR) contra IPS de resistencia media-alta (54%), media (77%), y baja (57%) fueron, en su mayoría, óptimos. Sorprendió que un 42% de los PIFR contra IPS de baja resistencia fueran excesivos (más dosis se queda en orofaringe), independientemente de la edad, índice de masa corporal, puntuación de gravedad de la disnea y gravedad de la EPOC. Los PIFR insuficientes fueron poco frecuentes, pero los PIFR subóptimos/insuficientes fueron más prevalentes en mayores de 75 años contra resistencia media-alta80.
Inhaladores de polvo seco unidosis
En los IPS de dosis únicas, la cápsula se coloca en el reservorio destinado a tal efecto, luego presionando sobre unas agujas laterales se perfora la cápsula dura. El flujo inspiratorio hace girar por turbulencia la cápsula que va liberando el fármaco contenido en su interior a través de las dos perforaciones. Una rejilla separa el reservorio del tracto de salida. Esta rejilla favorece la desagregación del agente activo separándolo del vehículo o transportador como por ejemplo la lactosa que quedará en la orofaringe. El Spinhaler de Fisons para el cromoglicato de sodio, lanzado en la década del 70, fue el primer IPS. El protocolo de Montreal para frenar el efecto invernadero en 1987 promovió alternativas a los aerosoles de CFC, tales como los IPS. La batalla global contra el cambio climático que surge de las emisiones de gases de efecto invernadero llevó a los entes reguladores a someter la tecnología IPDM a restricciones de emisiones de carbono. Sin grandes avances tecnológicos en la búsqueda de alternativas que no sean gases de efecto invernadero, las empresas farmacéuticas se inclinaron hacia el uso de tecnologías alternativas de inhaladores81. En este sentido, una alternativa disponible es el IPS sin propelente y accionado por inspiración. En términos de emisiones totales de gases nocivos durante el ciclo de vida, los IPS no solo producen diez veces menos emisiones de gases de efecto invernadero que los IPDM, sino que también pueden lograr eficiencia en la administración pulmonar y la carga de fármacos que está más allá del alcance de la tecnología IPDM. Mundialmente, la aparición de IPS se produjo en la década de 1960 y la adopción del mercado por parte de las empresas farmacéuticas ha crecido de manera constante como resultado de estas ventajas. Actualmente, se comercializan un total de 114 productos inhalados, que llegan a los pacientes bajo la forma de aproximadamente 49 millones de dispositivos de polvo seco producidos por año82.
En general, el rendimiento de los dispositivos depende de dos factores principales: 1) el flujo inspiratorio generado por el paciente y 2) las turbulencias dentro del dispositivo capaces de desagregar las moléculas activas, producir microdispersión y la fracción de partículas finas. Tradicionalmente, el polvo seco consiste en partículas micronizadas del fármaco (1-5 μ) mezcladas con un excipiente inactivo de mayor tamaño (40 μ) que funciona como transportador. Ejemplos son lactosa, manitol, sucrosa, sorbitol y estearato de magnesio, entre otros. Una combinación no óptima de ambas partes se expone a las fuerzas cohesivas entre partículas (fuerzas de van der Waals) que producen la agregación y aglomerado de las partículas con una deficiente dispersión. El tamaño apropiado del excipiente transportador reduce las fuerzas cohesivas y permite lograr una dosis más uniforme a mejores flujos83.
Inhaladores de polvo seco multidosis
Después de los primeros IPS basados en cápsulas rígidas, aparecieron los sistemas multidosis. Estos inhaladores de dosis múltiples, se introdujeron en la década de 1990 con las mismas formulaciones de un vehículo para el medicamento. Fueron diseñados con varios principios de medición de dosis, incluidos portaobjetos (por ejemplo, Novolizer ®, Meda Pharma), cilindros (por ejemplo, Easyhaler ®, OrionPharma) y discos (por ejemplo, Pulvinal ®, ChiesiFarmaceutici) con reservorios de dosis, o huecos ejes (por ejemplo, Taifun ®, LeirasOy), operados por el paciente. Otros IPS multidosis similares desarrollados en el mismo período son el Twisthaler ® (Merck, Sharp & Dohme Ltd.), el Clickhaler ® (Vectura), y el SkyeHaler ® (SkyePharma) comercializado como Certihaler ® por Novartis, y Airmax ® (Norton Healthcare), este último conocido actualmente como Spiromax® (TEVA). También se aplicaron vehículos inactivos en los primeros inhaladores blíster de dosis unitarias múltiples de la década de 1990, el Diskhaler ® y Diskus ® de Glaxo Smith Kline. La única excepción a la regla es el Turbuhaler ®, introducido por AstraZeneca a finales de los 80. Los medicamentos micronizados como terbutalina y budesonide que se administran con este inhalador Turbuhaler ® de depósito multidosis se transforman mediante esferonización en agregados blandos (originalmente sin lactosa micronizada) para obtener una formulación sin vehículos ni transportadores79. La versión Turbuhaler ® M3 para budesonide/formoterol sí contiene lactosa como vehículo; aunque ninguno de los IPS con lactosa pueden generar inconvenientes en personas con intolerancia.
La principal ventaja de los IPS en comparación con los IPDM es la menor necesidad de coordinación al momento de inhalar la dosis; pero este beneficio se transforma a la vez en el principal obstáculo porque la dosis inhalada depende de los altos flujos inspiratorios que desagregan las moléculas a los tamaños respirables (< 5 μ) y la despegan de las moléculas transportadoras como la lactosa que quedarán en la orofaringe. De aquí que no se recomiendan los IPS en menores de 5 años y en pacientes con pobre flujo inspiratorio84. La segunda ventaja de los IPS vs. IPDM es la magnitud de disponibilidad respiratoria de la dosis. Para los IPDM suele ser de 20% de la dosis etiquetada contra 40% para IPS (Fig. 6)85. La ausencia de propelentes en los IPS hace que no se observe la rara broncoconstricción por ácido oleico que pueden ocasionar los IPDM86.

Fig. 6 Porcentaje promedio de la dosis depositada en los pulmones desde 14 diferentes inhaladores de polvo seco, obtenido mediante estudios centellográficos (adaptado de Islam y col.85)
Aunque los IPS activos parecen más fáciles de usar que los pasivos, ninguno de estos dispositivos avanzados, se han comercializado todavía por dificultades intrínsecas, fallas técnicas y costos. Algunos ejemplos de IPS disponibles en Argentina se muestran en la Figura 7.
En la Tabla 3 se compara el depósito en las diferentes estructuras anatómicas de los diferentes tipos de inhaladores.
Ventajas
• Simplicidad de uso en varios dispositivos pequeños y manejables
• No necesitan coordinación en comparación con los IPDM
• Biodisponibilidad pulmonar aumentada con dosis uniformes
• Superioridad ecológica por no usar propelentes
• Posibilidad de administración pulmonar de principios activos con acción sistémica
• Posibilidad de administración de proteínas
• Posibilidad de administrar altas dosis inhalatorias
• Se pueden usar en sujetos traqueostomizados
Limitaciones
• Exposición a la humedad puede alterar sus partículas activas en algunos IPS
• Imposibilidad de uso de los IPS multidosis en pacientes ventilados
• Existencia de numerosos fármacos inhalatorios sin presentaciones en IPS
• Pobre percepción de la inhalación de la dosis en comparación a IPDM en algunos dispositivos IPS multidosis
• Desaconsejado en menores de 5 años
• Dificultad para alcanzar los flujos inspiratorios óptimos en mayores de 75 años
• La espiración inicial sobre la boquilla puede hacer perder la dosis
• Necesidad de mantenimiento y limpieza con algunos dispositivos
• Costo mayor
La relación resistencia intrínseca/flujos inspiratorios es determinante para la eficiencia. No intercambiar los diferentes dispositivos unidosis de drogas diferentes entre sí. Cada una de ellas se debe inhalar con su dispositivo particular.
Recomendación de su indicación
• Se debe recomendar su uso en pacientes que pueden realizar flujos inspiratorios enérgicos
• Se debe revisar periódicamente su correcta técnica inhalatoria
Mantenimiento y limpieza
Para su correcto mantenimiento, es importante guardar el inhalador en un lugar seco para preservarlo de la humedad. La limpieza del dispositivo nunca debe realizarse con agua sino con un paño (sin pelusa) o con un papel seco alrededor de la boquilla después de su utilización. Posteriormente, se debe cerrar el inhalador y guardar12,15.
Los sistemas unidosis poseen una rejilla que retiene potenciales restos de cápsulas de gelatina dura que deben ser eliminados luego de cada uso.
Inhaloterapia en fibrosis quística
La enfermedad respiratoria es la causa de morbilidad y mortalidad más frecuente, que ocurre en más del 90% de los pacientes con fibrosis quística (FQ) y varía en la edad de presentación, ya que la alteración de la proteína reguladora de la conductancia transmembrana determina alteraciones en el intercambio de cloro y agua en el epitelio respiratorio, con deshidratación de la superficie bronquial8,9,87-98. Desde hace más de 50 años se ha utilizado la terapia inhalatoria para intentar controlar la infección crónica de las secreciones bronquiales en niños con FQ. Se utilizaban antibióticos intravenosos diluidos en solución fisiológica en forma empírica, sin contemplar los aditivos ni la osmolaridad de los mismos (tobramicina, gentamicina, colistina, amicacina, etc.). En las últimas décadas se ha progresado sustancialmente tanto en el desarrollo de nuevas drogas específicamente diseñadas para ser administradas por vía inhalatoria, antibióticos y mucolíticos en especial, tanto por medio de nebulizadores como de polvos secos inhalados8,9,87-98.
Es fundamental el tipo de dispositivo utilizado para la eficiencia de la emisión y el depósito de las diferentes drogas, especialmente adaptado a la edad y el patrón respiratorio de los pacientes.
Nebulizadores para fibrosis quística
Los nebulizadores a motor siguen siendo una opción adecuada, pero su funcionamiento debe ser controlado periódicamente y deben ser reemplazados cuando disminuye el flujo emitido. Suelen ser utilizados con diferentes interfaces. En los niños pequeños las máscaras faciales disminuyen la eficiencia por el patrón respiratorio especialmente nasal y depósito de aerosol en la cara, fosas nasales y ojos con la posible producción de efectos colaterales. La utilización de pipetas bucales es de elección. Pueden ser de liberación constante, que generan el aerosol de manera continua tanto en inspiración como en espiración y presentan el inconveniente de perder hacia el ambiente casi un 70% del volumen de líquido a nebulizar durante la fase espiratoria. Por otro lado, están las que, mediante efecto Venturi activo en la fase inspiratoria, logran sumar el flujo inspiratorio al flujo generado por el compresor.
Cada vez es más frecuente la utilización de los llamados “nebulizadores inteligentes”. Se trata de dispositivos más pequeños, que utilizan una malla con múltiples micro-orificios sobre una columna o cristal piezoeléctrico que vibra a una frecuencia determinada (∼116 kHz). Este sistema se llama VTM (Vibrating Mesh Technology) y además incorpora la tecnología AAD (Adaptative Aerosol Delivery), que es la capacidad de entregar la sustancia a nebulizar solo en la fase inspiratoria adaptándose al patrón respiratorio del paciente, monitoreando los cambios de presión en la pieza bucal mientras este respira. La mayor ventaja es favorecer la eficiencia y la adherencia, al disminuir los tiempos de los sistemas a pistón a menos de la mitad. Los modelos más representativos en la actualidad son el Eflow ® (Pari Medical, West Byfleet, UK) y el Ineb ® (Profile Pharma, Zambon SpA, Chichester, UK).
Drogas para terapia inhalatoria en fibrosis quística
La enfermedad respiratoria es la que suele marcar el pronóstico de los pacientes con FQ. La misma se relaciona directamente con la infección crónica por gérmenes oportunistas, de los que la Pseudomonas aeruginosa es una de las que se asocia con deterioro de la función pulmonar y aumento de la mortalidad8,9,87,88.
El tratamiento antibiótico agresivo por vía oral, intravenoso o inhalatorio -de acuerdo al grado de compromiso del paciente- junto con el advenimiento de drogas mucolíticas inhaladas, son los que han marcado en el tiempo el aumento de la supervivencia media de los pacientes con FQ (Fig. 8) 8,9,87-91.

Fig. 8 Supervivencia e introducción de nuevas terapias en fibrosis quística a lo largo del tiempo (adaptado de Clancy y col.91)
Los antibióticos inhalados más utilizados en el país son la tobramicina y la colistina92-95. Ambos se pueden utilizar como terapia de ataque cuando se obtiene un cultivo de secreciones bronquiales de rutina positivo para P. aeruginosa, generalmente asociado a 20 días de ciprofloxacina por vía oral y durante un período que puede variar entre 1 y 3 meses8,9,87-89,91-95. Por otra parte, cuando se produce colonización o infección crónica, se los utiliza en forma crónica, generalmente en periodos de 28 días on/28 días off, para disminuir la carga bacteriana8,9,87-89,91-95.
Aunque no existe suficiente evidencia que lo avale, muchos especialistas intercalan 28 días de tobramicina con 28 de colistina para mantener tratamiento antibiótico inhalado constante. La tobramicina es un aminoglicósido que se utiliza en dosis de 300 mg cada 12 horas y la colistina, derivado de la polimixina, se usa en forma de colimestato sódico en dosis de 1 millón de UI en menores de 1 año de edad y 2 millones de UI en niños mayores de 1 año cada 12 horas8,9,87, 88,91-94.
Otros antibióticos inhalados que se pueden utilizar, aunque no se encuentran en nuestro país son el b-lactámico aztreonam lysine (Cayston; Gilead Sciences, Foster City, CA, USA) que también ha demostrado actividad contra P. aeruginosa, especialmente cuando no se obtiene buena respuesta con los anteriores8,9,87,88,91,96,97. Si bien tiene la desventaja de requerir tres dosis por día, el volumen a administrar es muy pequeño (1 ml) y mediante un nebulizador de malla la administración demora aproximadamente 1 minuto8,9,87,88,91,96,97.
Polvos secos
Durante la última década se desarrollaron los antibióticos inhalados en forma de polvo seco, tanto tobramicina (TOBI Podhaler; Novartis Pharmaceuticals, East Hanover, NJ, USA) como colistina (Colobreathe; Forest Laboratories, Dartford, UK) 8,9,87,88,91. Este progreso ha ofrecido una forma más rápida y cómoda de administración de antibióticos inhalados, con una eficacia similar a los nebulizados. Además, los sistemas de polvo seco tienen la ventaja de requerir mucho menor tiempo de limpieza comparado con los sistemas de nebulización, lo cual también favorece la adherencia de pacientes con varios tratamientos inhalatorios diarios.
Tratamientos en fase de experimentación
Se encuentra en desarrollo, todavía en fase experimental, la producción de nuevos antibióticos inhalados como ciprofloxacina en polvo seco, y de levofloxacina y amikacina nebulizados99,100.
Otros tratamientos inhalatorios de uso frecuente en FQ son los tratamientos mucolíticos y mucoactivos. La primera que se desarrolló fue la alfa dornasa, una desoxiribonucleasa recombinante humana que hidroliza el ADN extracelular en pacientes con FQ y reduce la viscoelasticidad del esputo8,9,87,88,91,101. Los ensayos clínicos han mostrado mejoría del grado de obstrucción al flujo aéreo y disminución del número de exacerbaciones con respecto al placebo. Otros agentes como la solución salina hipertónica (ClNa 7%) y el manitol inhalado (Bronchitol; Pharmaxis Pharmaceuticals, Burnham, UK) actúan también permitiendo el aumento de la capa de agua líquida de la superficie bronquial y aumentando el aclaramiento mucociliar8,9,87,88,91.
Técnica y secuencia de administración de la terapia inhalada en fibrosis quística
En los pacientes que requieren más de un fármaco por vía inhalatoria, la administración debe ser cada 12 h y en el siguiente orden:
• 1° Agonista b2 adrenérgico de acción corta
• 2° DNasa o solución hipertónica 7%
• 3° Kinesioterapia respiratoria
• 4° Antibiótico nebulizado o polvo
Métodos de limpieza y desinfección de dispositivos de terapia respiratoria
Se recomienda lavar las ampollas de nebulización con agua con detergente después de cada utilización y luego desinfectarlas con:
• Agua hirviendo durante 5 minutos
• Alcohol etílico al 70% durante 5 minutos
• Lavavajilla con agua a temperatura igual o superior a 70 °C
• Horno microondas en recipiente con agua durante 5 minutos a 2.45 GHz
Luego secar bien con toalla de papel o al aire antes de guardarlo.
En el caso de los nebulizadores por malla, es necesario seguir las instrucciones para su limpieza y desinfección para evitar que se obstruyan los microorificios con diminución de la eficiencia.
Errores de la inhaloterapia
Pacientes
La prevalencia de errores de los pacientes en las técnicas de inhalación es cercana al 90%4,102-106. Los errores en la técnica de inhalación “críticos” o esenciales son los que afectan el depósito de la droga en la vía aérea “blanco” y los “no críticos” son los que disminuyen la cantidad de droga depositada102-106. En una revisión sobre errores en las maniobras de inhalación, Usmani y col. describieron casi 300 errores críticos en la literatura asociados a edad, educación, instrucción médica previa de la maniobra inhalatoria, dos o más comorbilidades (obesidad, deterioro cognitivo y enfermedad cardiovascular) y bajo nivel socioeconómico4. Estos autores observaron que una mayor frecuencia de errores en las maniobras se asociaba con una mayor cantidad de exacerbaciones y el consiguiente impacto en el consumo de recursos de salud4. Solo a manera de ejemplo, en España, Reino Unido y Suecia, en 2015, los errores en técnicas de inhalación se vinculaban a costos indirectos y directos en recursos de salud por más de 750 millones de euros107. Se observó peor control del asma y la EPOC y deterioro de la calidad de vida, tanto en estudios clínicos como en estudios de vida real107-117.
En la Tabla 4 se detallan los errores más frecuentes para cada tipo de inhalador. Se ha demostrado que los errores en el uso del inhalador afectan los resultados; pero en comparaciones directas entre tipos o dispositivos de inhaladores no se ha demostrado diferencia en forma concluyente17.
Equipo de salud
Varios estudios demostraron que la frecuencia de errores en el conocimiento acerca de las correctas técnicas de inhalación, es desmedidamente alta en los miembros del equipo de salud que participan en la atención de estos pacientes (médicos, enfermeros, farmacéuticos, kinesiólogos, etc.). Hanania y col. determinaron que solo tenían adecuado conocimiento de las técnicas inhalatorias 67% de los neumonólogos, 48% de los internistas y 39% de los enfermeros118. En un estudio similar realizado en farmacéuticos, no se observaron niveles superiores de conocimiento119. En un estudio español sobre 1640 personas entre pacientes, personal de enfermería y médicos, se observó que solamente el 9% de los pacientes, el 15% del personal de enfermería y el 28% de los médicos fue capaz de realizar correctamente las maniobras de inhalación120.
Sin embargo, en encuestas a neumonólogos en nuestro país, es alto el porcentaje de ellos que dicen evaluar y educar en la consulta diaria las técnicas de inhalación en pacientes con asma y EPOC, probablemente sobreestimando la real situación121,122.
Las diferentes guías y recomendaciones internacionales enfatizan la importancia de evaluar la corrección de la maniobra de inhalación en cada consulta antes de escalar el tratamiento farmacológico en sujetos con asma, EPOC y FQ5-15. Incluso antes de identificar a un individuo como asmático grave, se debe evaluar la corrección de las maniobras de inhalación7,8.
Organización sanitaria
Debido al uso intensivo y masivo de los medicamentos administrados a través de los diferentes inhaladores, es lógico concluir que su uso incorrecto y/o no sistematizado ocasione pérdidas económicas y su normatización genere ahorro de costos para el sistema de salud12.
Adherencia
La Organización Mundial de la Salud define la adherencia al tratamiento como “el grado en que el uso de la medicación por parte del paciente se corresponde con el régimen prescrito” y hace hincapié en la “diversidad y complejidad del comportamiento de adhesión al tratamiento”123.
La adherencia adecuada al tratamiento farmacológico en pacientes con asma y EPOC no supera el 50%114,115. La no adherencia provoca un aumento en la morbimortalidad y en la utilización de los recursos de salud116,124-126. La adherencia a los medicamentos inhalados y los factores relacionados es muy compleja (Tabla 5)127,128, pero la adherencia es esencial para optimizar y alcanzar los beneficios del tratamiento. Por eso debe ser evaluada asiduamente en la práctica clínica. Generalmente es realizada por la anamnesis directa, pero el paciente invariablemente la subestima. Si bien existen cuestionarios para estudiarla (como el cuestionario específico TAI), en la vida real no se utilizan126,127,129-131.
Impacto de la educación
Existe evidencia de que el entrenamiento permite mejorar la técnica, por lo que la primera medida debería ser la instrucción de los profesionales de la salud. En la Tabla 6 se recomiendan las pautas educativas en técnicas de inhalación132.
Con educación periódica se logra reformar la técnica de inhalación en asma y EPOC. La educación es un componente fundamental en el tratamiento de las enfermedades respiratorias crónicas y debe incluir necesariamente este tópico. Usmani y col. revisaron 26 estudios clínicos que observaron mejoría significativa de la técnica de inhalación por parte de los pacientes luego de la educación adecuada4. Tanto las guías GINA como las GOLD recomiendan incluir en los programas educativos la evaluación y educación de la técnica propia a cada paciente en forma periódica6,7.
Elección del inhalador
La elección del inhalador debe estar guiada por los factores detallados en la Tabla 7 6,7,12,50,133-135. En la Tabla 8 se comparan las principales características de cada sistema11,12,15.
Uso de dispositivos inhalatorios en pandemia
Desde fines de 2019, la infección por el coronavirus SARS-CoV-2 se ha diseminado por todo el mundo, provocando una preocupante tasa de hospitalizaciones y mortalidad secundaria principalmente a neumonía. Es por ello que se han hecho recomendaciones en cuanto al uso de dispositivos inhalatorios en el contexto de esta pandemia. Diferentes guías han incorporado normativas de uso que se resumen a continuación6,7,136,137.
• Los pacientes deben seguir tomando la medicación inhalatoria prescripta, especialmente corticoides inhalados si están indicados
• Está prohibido el uso de nebulizadores por el riesgo aumentado de aerosolización de partículas virales
• Es mandatorio indicar los IPDM con AC o IPS
• En ventilación mecánica, si es necesario el uso de nebulización, se debe usar uno de circuito cerrado tipo “en malla”
• Si en el domicilio del paciente es imprescindible usar nebulizaciones, debe realizarse al lado de una ventana abierta, en habitación aparte, y en ausencia de otra persona
• Respetar estrictamente las normas de bioseguridad e higiene
Conclusiones
Las recomendaciones de las principales guías internacionales en asma, EPOC y FQ recomiendan fuertemente evaluar y corregir la técnica de inhalación antes de escalar el tratamiento farmacológico, ya sea aumentando la dosis como agregando otros grupos farmacológicos.
La frecuencia de errores de técnica de inhalación es muy alta entre los pacientes, y requiere revisiones periódicas. Estos errores afectan el control de las enfermedades y la calidad de vida y aumentan el consumo de recursos de salud. El personal de salud debe conocer la técnica correcta del inhalador prescripto.
Se debe reconocer que una buena técnica de inhalación es tan importante como la droga prescripta.
Durante la pandemia por SARS-CoV2 está prohibido el uso de nebulizadores. La elección del inhalador debe estar guiada por varios factores: situación clínica del paciente, edad, disponibilidad de la droga en la forma farmacéutica, costo y el correcto uso de la técnica del inhalador elegido.