PUNTOS CLAVE
Conocimiento actual
• El trasplante renal ABO incompatible permite disminuir los tiempos en lista de espera para pacientes que no cuenten con un donante compatible. El advenimiento de nuevas técnicas de desensibilización e inmunosupresión ha mejorado los resultados de este tipo de trasplante en los últimos años en el mundo.
Contribución del artículo al conocimiento actual
• En nuestro estudio los resultados durante el primer año post-trasplante fueron comparables entre los pacientes que recibieron un trasplante ABO incompatible y aquellos trasplantados con similares características, pero con donantes ABO compatibles.
• El trasplante renal ABO incompatible es una adecuada opción, factible en nuestro medio, para pacientes que no cuentan con donantes compatibles.
El trasplante renal es el tratamiento de elección para la enfermedad renal crónica terminal1. Un trasplante renal exitoso mejora la calidad de vida y reduce el riesgo de mortalidad para la mayoría de los pacientes en compara ción con la diálisis de mantenimiento2,3. La extensión de las indicaciones para trasplante renal, la creciente inciden cia de enfermedad renal crónica terminal y la escasez de órganos incrementan el tiempo de permanencia en lista de espera4. Dentro de las estrategias implementadas para disminuir el problema de la escasez de órganos se ha intentado aumentar el grupo de donantes vivos, entre ellas el trasplante renal ABO incompatible (ABOi)5. Durante mucho tiempo la incompatibilidad en el grupo sanguíneo se consideró una contraindicación para el trasplante de bido al mayor riesgo de rechazo humoral y pérdida del injerto6. Sin embargo, las nuevas estrategias de desensibilización previas al procedimiento, como la eliminación de aglutininas por plasmaféresis o inmunoadsorción y el agotamiento de las células productoras de anticuerpos con rituximab han permitido llevar cabo el trasplante re nal ABOi de forma exitosa7,8. Gran parte de los datos se basan en la experiencia de los centros japoneses donde esta práctica ha sido más ampliamente adoptada9,10. En EE.UU. un análisis que incluyó 738 trasplantes de riñón ABOi mostró una supervivencia comparable del paciente, pero redujo la supervivencia del injerto censurado por muerte en comparación con los trasplantes con ABO compatible (ABOc)11.
El objetivo general de este estudio fue describir los re sultados durante el primer año de aquellos que recibieron un trasplante ABOi en nuestra institución. Los objetivos específicos fueron: analizar la supervivencia del injerto y del paciente, evaluar la tasa de complicaciones durante el primer año (rechazo agudo, internaciones, sangrado mayor e infecciones) de los trasplantados ABOi y com pararlos con un grupo control, e identificar los factores de riesgo de rechazo agudo en ambos grupos.
Materiales y métodos
Se realizó un estudio de cohorte retrospectivo, observacional y analítico, en el que se incluyeron consecutivamente todos los pacientes que recibieron un trasplante renal de donante vivo ABOi en el Hospital Privado Universitario de Córdoba desde julio del 2014 hasta abril del 2019 (grupo de estudio). Además, por cada paciente del grupo de estudio, se eligió un sujeto que durante el mismo periodo haya recibido un trasplante renal donante vivo ABOc y que cumplía con las siguientes características: mismo sexo, similar edad (± 5 años), similar fecha del trasplante (± 1 año), similar grado de sensibilización previa según los anticuerpos reactivos contra panel (PRA, ± 10%), similar grado de compatibilidad HLA y coincidencia en la presencia o no de anticuerpos donante especifico (ADE) pretrasplante (grupo control seleccionado, pareado, relación 1/1). A los pacientes de ambos grupos se les realizó un seguimiento de un año posterior al trasplante. Se excluyeron los sujetos: menores de 18 años, embarazadas, que recibieron un trasplante renal múltiple simultáneo o un trasplante de origen fallecido.
Todos los pacientes trasplantados recibieron tratamiento inmunosupresor y profilaxis infecciosa según el protocolo del servicio de nefrología. Aquellos con alto riesgo inmuno lógico recibieron como inducción suero antitimocítico (1.5 mg/kg/día por 5 días), o basiliximab (2 dosis de 20 mg) y gammaglobulina humana (2 dosis de 2 g/kg) como esquema alternativo en los sujetos de mayor riesgo de infecciones graves y cáncer. Los pacientes de alto riesgo de retraso de la función del injerto y bajo riesgo inmunológico recibieron basiliximab (misma dosis). Todos recibieron además pulsos de metilprednisolona por 3 días (250 mg cada 12 horas, 4 dosis y 125 mg cada 12 horas, 2 dosis). Como mantenimien to utilizaron inhibidores de la calcineurina (preferentemente tacrolimus 0.15 mg/kg/día), un anti-proliferativo (preferen temente micofenolato, en su formulación sódica a dosis de 720 mg cada 12 horas, o en su formulación mofetil a dosis de 1000 mg cada 12 horas) y prednisona (5 mg/día), salvo algunas excepciones en situaciones especiales. Todos re cibieron profilaxis antibiótica de infección de sitio quirúrgico en el postoperatorio inmediato, trimetoprima-sulfametoxazol durante 1 año, valganciclovir durante 3 meses (en los sujetos que recibieron suero antitimocítico o los que presentaban IgG negativa para citomegalovirus -CMV- previa al trasplante) o aciclovir indefinidamente (en todos los demás) y nistatina en la primera etapa del trasplante. A partir del primer mes a todos se les realizó pesquisa para CMV, poliomavirus BK (VBK) y enfermedad de Chagas (donante o receptor con serología positiva para Chagas) con determinación mensual de PCR hasta los 6 meses. Posteriormente al trasplante los pacientes realizaron controles periódicos frecuentes, permitiendo su seguimiento y registros de incidencias de significancia en sus historias clínicas.
Los candidatos al trasplante ABOi un mes antes de la ci rugía programada realizaron la desensibilización, que implica la combinación de rituximab (1000 mg EV), plasmaféresis y gammaglobulina humana (2 g/kg). La plasmaféresis se realiza con separador celular Fresenius. Se recambian 1.5-3 litros de plasma por tratamiento con un reemplazo del 100% del volumen, utilizando 500 ml de solución fisiológica y albúmi na o plasma fresco congelado. Se realizan las pruebas de compatibilidad previas a infusión de rituximab. Todos reciben como inducción previa al trasplante: suero antitimocítico, gammaglobulina humana y pulsos de metilprednisolona por 3 días (todos a igual dosis que en ABOc). En casos especiales de bajo riesgo inmunológico recibieron basiliximab en lugar de timoglobulina. Como mantenimiento utilizan el triple esquema (tacrolimus, micofenolato y prednisona, en la misma dosis que en los trasplantes ABOc).
Los candidatos a trasplante ABOi cumplieron con los cri terios generales de selección: tener un título de isoaglutininas ABO inicial ≤ 1:128 y un título ≤ 1:8 previo a la realización del trasplante. Monitorizamos los títulos de isoaglutinina diaria mente mientras el paciente esté internado y semanalmente durante el primer mes posterior al trasplante.
La titulación de las isoaglutininas se realizó de acuerdo con las técnicas estándares del servicio de hemoterapia y criobiología (técnica de titulación semicuantitativa). Como muestra se utilizó suero del receptor con los anticuerpos a titular, y como reactivos glóbulos rojos del donante, en sus pensión al 3% en solución salina. La técnica de dilución para los estudios de titulación consistió en estudiar anticuerpos IgG e IgM. Para cada anticuerpo se rotuló 10 tubos de ensayo de kahn con diluciones consecutivas al 1/2. Se colocó 100 μl de solución salina en todos los tubos, salvo en el primero (no diluido) y se agregó un volumen igual de suero a los dos primeros tubos, se mezcló el contenido de la dilución y se transfierió 100 μl al tubo siguiente y se repite el procedimiento para todas las diluciones hasta completar los 10 tubos. Lue go se agregó 100 μl de la suspensión de glóbulos rojos al 3%, se incubó a 37°C para IgG y a 22 °C IgM y centrifugó a 2000 rpm por 1 minuto (centrifugación de lectura). Para la interpretación de los resultados se observa la mayor dilución con una aglutinación macroscópica de 1+ y se informa como la inversa de la dilución.
Para distinguir la clase de inmunoglobulina presente (IgM o IgG) se utilizó 2-mercapto etanol, que anula los puentes disulfuros de la IgM, desnaturalizándola. Se utilizó como muestra 100 μl de suero, y 100 μl de solución de 2-mercapto Etanol, se incubó 15 minutos a 37 °C (el suero tratado con 2ME significa inexistencia de anticuerpos IgM, mientras que en el suero no tratado significa una mezcla de IgG e IgM) para su interpretación.
Los tubos donde se dosaron IgG, luego de la incuba ción, se realizaron lavados con solución fisiológica por triplicado y se centrifugó a 3000 rpm durante 3 minutos, se desechó el excedente de solución fisiológica y agregó 50 μl de suero de Coombs (anticuerpos anti-IgG y anti-c3b) a cada tubo, se centrifugó a velocidad de lectura y se observó si hay aglutinación.
El tratamiento del rechazo agudo depende de la gra vedad del mismo y de la presencia o no de componente humoral. En el caso de rechazo agudo celular tipo IA y IB se trataron con pulsos esteroides. En los rechazos tipo IIA en pacientes con mínima endotelitis (aislados linfocitos en endotelio) y no hipersensibilizados se administró es teroides o bien gammaglobulina endovenosa asociados a esteroides en individuos hipersensibilizados o arteritis mayor. En rechazos tipo IIB y III se utilizó esteroides asociados a gammaglobulina. En los rechazos agudos humorales el tratamiento siempre incluyó esteroides EV asociado a: IVIG en el tipo IIA, y plasmaféresis (5 sesio nes 60 ml/kg) y gammaglobulina en el tipo II B y III. En los rechazos humorales resistentes al tratamiento o en presencia de ADE con títulos mayores a 5000 de media de intensidad de fluorescencia se agrega rituximab. En casos refractarios se considera el uso de bortezomib o eculizumab.
Las variables categóricas se expresaron como valores absolutos (n) y las continuas como mediana (M) y rango inter-cuartilo (RIC). Para comparar las variables categó ricas se utilizó test exacto de Fisher y para las continuas el test de Mann Whitney. Para comparar las curvas de supervivencia del injerto y del paciente se utilizó Kaplan Meier y el test de Log-rank. Todos los test fueron a dos colas y se consideró estadísticamente significativo un valor de p menor a 0.05. Los análisis estadísticos se reali zaron con STATA 15 (StataCorp. LP. College Station, TX) y GraphPad Prism version 8.0.0 para Windows (GraphPad Software, San Diego, California USA).
Todos los pacientes firmaron el consentimiento in formado y el acta de información sanitaria al momento del trasplante. El estudio fue aprobado por el Comité de Docencia e Investigación del Hospital Privado Universi tario de Córdoba.
Resultados
Entre julio de 2014 y abril de 2019 se realizaron 121 trasplantes donante vivo en el Hospital Privado Uni versitario de Córdoba, de ellos 13 (10.7%) fueron ABO incompatible.
Las características basales de los pacientes que reci bieron un trasplante ABO incompatible y su grupo control (trasplante ABO compatible) se muestran en la Tabla 1. Con respecto a los antecedentes personales patológicos, etiología de la enfermedad renal crónica, terapia de reem plazo renal previa, análisis previos al trasplante y riesgo inmunológico no se encontraron diferencias significativas entre los grupos. En relación a las características de do nante, la tasa de filtrado glomerular (TFG) basal medida por iotalamato era menor en los donantes del grupo ABOi comparado con los del grupo ABOc (p = 0.01). A todos los pacientes se les colocó durante el procedimiento un catéter urinario doble J. Como era de esperarse, exis tieron diferencias significativas en la inmunosupresión de inducción entre los grupos. Los pacientes del grupo ABOi requirieron en un mayor porcentaje plasmaféresis (p = 0.01), gammaglobulina (p = 0.01), y existió una ten dencia al mayor requerimiento de timoglobulina y menor requerimiento de basiliximab. Ambos grupos mostraron un alto porcentaje de pacientes con eventos previos sensibilizantes y riesgo inmunológico elevado. Todos los pacientes recibieron tacrolimus, micofenolato y esteroi des como inmunosupresión de mantenimiento. No hubo diferencias significativas en los dosajes de tacrolimus post trasplante, salvo a los 3 meses; (ABOi = 10.5, RIC: 9.6-11.8 ng/ml vs ABOc: 12.5, RIC: 10.6-13.6; p = 0.043).
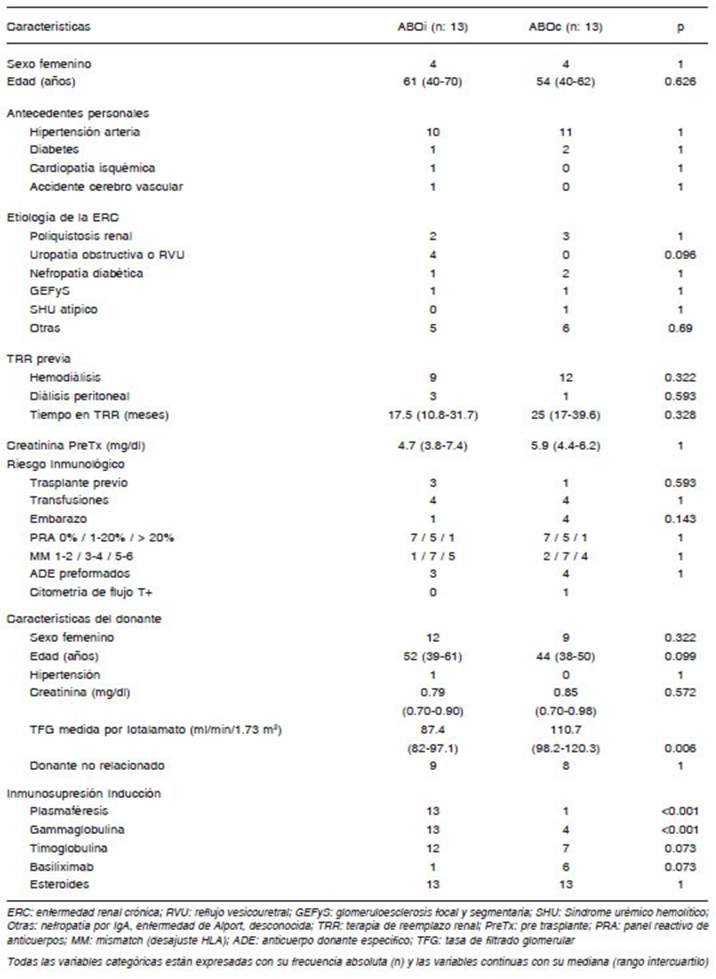
Tabla 1 Características basales de los pacientes que recibieron un trasplante renal donante vivo ABO incompatible (ABOi) y su grupo control de trasplantados con donantes vivos ABO compatibles (ABOc)
Durante el seguimiento posterior al trasplante, un solo paciente en el grupo control presentó retardo en la función del injerto en el grupo ABOc. No se registraron episodios de sangrado mayor en ningún paciente. En los pacientes ABOi existió una menor tendencia de presentar infección por CMV comparado con los ABOc y una mayor tendencia de presentar episodios de urosepsis, pero sin diferencias significativas (Tabla 2).

Tabla 2 Eventos durante 1 año de seguimiento de los pacientes que recibieron un trasplante renal donante vivo ABO incompatible (ABOi) y su grupo control de trasplantados con donantes vivos ABO compatibles (ABOc)
Cinco pacientes ABOi presentaron rechazo agudo (4 humorales y 1 celular) comparado con 4 de los pa cientes del grupo control (2 celulares y 2 mixtos), estas diferencias no fueron estadísticamente significativas. El tiempo hasta el desarrollo del primer episodio de rechazo fue de 1.31 (RIC: 0.7-6) meses en el grupo de estudio y de 2.7 (RIC 2.5-3.8) en el grupo control (p = 0.327). Se registró una sola pérdida de injerto en el grupo ABOi y ninguna en el grupo control durante el seguimiento. No hubo muertes en ninguno de los grupos. No se hallaron diferencias significativas en las curvas de supervivencia libres de rechazo, de supervi vencia del injerto y del paciente entre los grupos ABOi y ABOc (Fig. 1).

Fig. 1 Comparación entre las curvas de supervivencia: A: del injerto (eje izquierdo), B: libre de rechazo (eje izquierdo) y C: global del paciente (eje derecho), entre los grupos que recibieron un trasplante ABO incompatible (ABO i) y compatible (ABO c)
Existió una tendencia de presentar valores más ele vados de creatinina sérica y proteinuria en los pacientes del grupo ABOi comparado con sus respectivos controles a partir de los 3 meses de seguimiento, sin hallarse dife rencias estadísticamente significativas (Fig. 2).
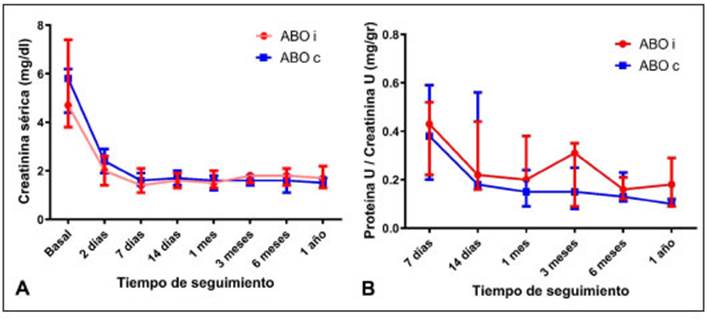
Fig. 2 Evolución durante el seguimiento de: A: creatinina sérica y B: relación proteína urinaria / creatinina urinaria, en los pacientes trasplantados renales ABO incompatibles (ABO i) y compatibles (ABO c)
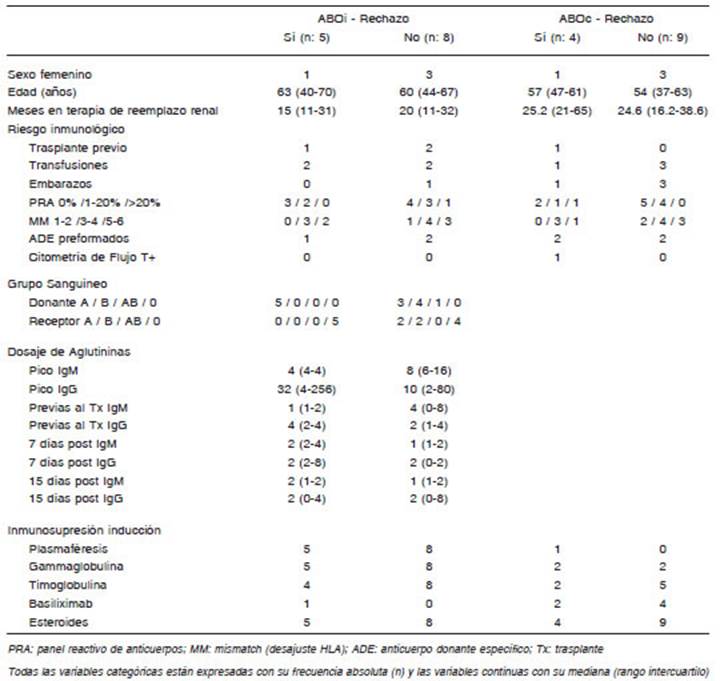
No se hallaron factores predictores de rechazo es tadísticamente significativos en ningún grupo. En ABOi todos los que presentaron rechazo (n = 5) pertenecían al grupo 0 y su receptor al grupo A. Existió una tendencia de presentar aglutininas IgM a los 7 días post-trasplante más elevadas en aquellos con rechazo (p = 0.076) (Tabla 3).
Discusión
El uso de nuevas técnicas de desensibilización, han per mitido llevar a cabo el trasplante renal ABO incompatible de forma exitosa en distintas partes del mundo. En estos últimos años diversos estudios han evaluado la evolu ción y los riesgos asociados a este tipo de trasplante. Futagawa y col. demostraron una supervivencia inferior del injerto durante el primer año de los trasplantes ABOi, pero los injertos que sobrevivieron a partir de entonces tuvieron resultados comparables a los de los pacientes que eran ABOc12. En una cohorte descripta por Mont gomery y col., los receptores de ABOi presentaron una mayor pérdida del injerto a los 10 años de seguimiento (27.1 vs. 23.9%, p=0.001), sin embargo, gran parte de las pérdidas se dieron durante los primeros 14 días y luego fueron equivalentes entre ambos grupos. La supervivencia de los pacientes fue similar entre los grupos11. Un registro japonés reveló una supervivencia general y del injerto inferior a un año de seguimiento, pero sin diferencias significativas9. Ambas cohortes japonesas y estadounidenses incluían pacientes tratados con esplenectomía. En un estudio más reciente que incluyó 1420 trasplantes ABOi que recibieron como inducción rituximab, se observó una diferencia mínima, pero estadísticamente significativa, en la supervivencia entre los receptores de injertos ABOi fren te a los receptores ABOc (97% ± 0.5% vs 98.6% ± 0.3 % p = 0.006) durante el primer año de seguimiento, asociado también a una mayor tasa de muerte temprana por infección13. En nuestro trabajo la supervivencia del paciente al año fue del 100% en ambos grupos y la del injerto fue de 92.3% y 100% en ABOi y ABOc respectivamente, sin hallarse diferencias estadísticamente significativas. Solo se registró una pérdida del injerto en el grupo de estudio por rechazo refractario en un paciente hipersensibilizado. Al año los receptores ABOi presentaron una tendencia de valores de creatinina sérica más elevadas que el grupo control, que puede estar en relación con el hecho de que los donantes en este grupo presentaban una TFG más baja que los donantes del grupo ABOc.
Con respecto a las complicaciones infecciosas Opeltz y col. informaron una incidencia de hospitalizaciones por infección durante el primer año del 17.1% en el grupo ABO incompatible y del 19.5% en los controles ABO compatibles (p = 0.46)13. En un estudio de Lentine y col., el trasplante ABOi se asoció con más del doble de riesgo de neumonía y un 55% más de riesgo de ITU/pielonefritis en el periodo comprendido entre 0-90 días14. Un estudio de un solo centro que comparó 21 trasplantados ABOi con 47 ABOc, reveló que las infecciones virales (CMV, virus herpes simple, varicela zoster y VBK) y bacterianas que conducen a la hospitalización como urosepsis y neumonía fueron significativamente más frecuentes en el grupo ABOi que en los ABOc (50% vs. 21%; p = 0.038)15. En un estudio efectuado en el instituto Johns Hopkins se demostró un aumento 3 veces mayor de la frecuencia de nefropatía por VBK entre pacientes con incompatibilidad ABO comparado con incompatibles con HLA (17.7% vs. 5.9%)16. En nuestro estudio observamos una tendencia a presentar mayor número de urosepsis en los receptores ABOi, lo que puede estar asociado a la mayor inmunosu presión a la que se someten estos pacientes.
Otra de las complicaciones asociadas al trasplante con incompatibilidad sanguínea son las hemorragias. Weerd y col. demostraron en una cohorte de 65 pacientes ABOi que tuvieron mayor pérdida sanguínea intra-operatoria y recibieron el doble de transfusiones que sus controles en las primeras 48 horas post-operatorias, independiente mente de la técnica de plasmaféresis utilizada, pero sí en relación al número de procedimientos de plasmaféresis17. En nuestro grupo de estudio no se registraron episodios de sangrado mayor.
Con respecto a los episodios de rechazo, la incidencia varía ampliamente según distintos informes. Takahashi y col. comunicaron una incidencia de rechazo agudo del 58% en los pacientes que reciben un trasplante ABOi9.
Un reciente estudio informó una incidencia de rechazo agudo del 19.4% en el primer año para los pacientes de ABOi vs 10.5% para ABOc. Los receptores de ABOi tenían un riesgo 1.76 veces mayor de rechazo agudo durante el primer año del trasplante. Otros factores significativos que se asociaron con un mayor riesgo de rechazo fueron PRA alto (RR: 1.51; IC del 95%: 1.40-1.64) y desajuste de HLA (RR: 1.60; IC del 95%: 1.53-1.68)18. En un meta nálisis la incidencia de rechazos agudos fue del 32.9%, la mayoría de los cuales fueron mediados por anticuerpos y ocurren principalmente en el post-trasplante temprano, generalmente en las primeras 2 semanas19. Gloor y col. informaron una tasa de rechazo del 28% y demostraron que los aumentos rápidos en los títulos de aglutininas en el período posoperatorio inmediato aumentan el riesgo de lesión del aloinjerto y pérdida del injerto mediada por anticuerpos20. Mientras, en otro trabajo publicado por Tobian y col., la incidencia de rechazo agudo humoral fue del 15.2%. Si bien la mayoría de los individuos tenían un título de aglutininas elevado antes del rechazo, este aumento tenía un valor predictivo positivo deficiente para rechazo agudo21. Dorje y col. informaron los hallazgos de biopsias de vigilancia en el primer año post-trasplante en receptores de injerto renal ABOi comparados con ABOc (en ausencia de ADE pre-trasplante), con tasa similares de rechazo entre ambos grupos. Solo un paciente del grupo ABOi se asoció a un aumento marginal del número de aglutininas, uno del grupo ABOi y cuatro del control desarrollaron rechazo subclínico, asociados al desarro llo de ADE de novo en el primer año22. Toki y col. en un estudio de ABOi que incluyó pacientes con PRA > 10% y presencia de ADE pre trasplantes, demostraron una aso ciación significativa entre ADE y el desarrollo de rechazo agudo humoral23. La incidencia de rechazo varía entre un 10-60% según los diferentes reportes. En nuestro estudio no hubo diferencias significativas en la tasa de rechazo entre los grupos y en los pacientes del grupo ABOi, el rechazo no estuvo asociado a elevaciones significativas en los títulos de aglutininas post trasplante.
En un estudio publicado recientemente los pacientes que reciben un trasplante ABOi demostraron tener mejor pronóstico de sobrevida global comparado con los pa cientes que continúan en lista de espera y luego reciben un trasplante de donante cadavérico ABOc24. Si bien en nuestro trabajo no se realizó esta comparación, ninguno de los pacientes incluidos en el grupo ABOi tenía posibi lidades de recibir un trasplante de donante vivo ABOc y las únicas opciones posibles que tenían eran continuar en lista de espera o recibir el trasplante ABOi. Por lo tanto, el trasplante ABOi en estos pacientes evitó que continúen en lista de espera.
Las limitaciones de nuestro estudio son: la inclusión de un número pequeño de pacientes, de un solo centro, que dificulta la generalización los resultados. Existen tendencias en los resultados que probablemente no adquieran significancia estadística debido al bajo poder estadístico de la muestra. El seguimiento a un año, no permite determinar la evolución a largo plazo de la supervivencia del paciente y del injerto y el desarrollo de otras complicaciones como neoplasias. La fortaleza es la homogeneización de los grupos (pacientes pareados según edad, año de trasplante, grado de compatibilidad y estado de hipersensibilización previa), con una pauta de inmunosupresión homogénea de acuerdo al protocolo de nuestro centro. Según nuestro conocimiento, este es el primer reporte de trasplantes ABOi en nuestro medio demostrando que es una opción factible de realizar en beneficio de los pacientes.
En conclusión, la tasa de rechazo no muestra relación con la incompatibilidad sanguínea. No existieron diferen cias en relación a las complicaciones post-trasplante. Los resultados de sobrevida global y del injerto fueron simila res en ambos grupos durante el seguimiento. El trasplante renal con incompatibilidad ABO es una adecuada opción factible en nuestro medio para pacientes que no cuentan con donantes compatibles.