PUNTOS CLAVE
• La BCG, una cepa atenuada de M. bovis, lleva 100 años de uso en la vacunación contra la tuberculosis y ha sido aplicada a más de 4 mil millones de niños en más de 180 países. Se administran anualmente más de 120 millones de dosis, lo que la hacía -hasta 2021- la vacuna más empleada en el mundo.
• BCG protege contra la enfermedad que sigue a la infec ción primaria de tuberculosis; también se asocia con una protección inespecífica en varias otras enfermedades infecciosas y en el tratamiento del cáncer.
• La pandemia de COVID-19 confirmó que la vacunación es un instrumento fundamental para el control de las enfermedades infecciosas.
• Aunque existen más de 20 vacunas candidatas contra la tuberculosis, BCG seguirá figurando en el Calendario de Vacunación Nacional, para ser aplicada al recién nacido hasta que haya disponible una más eficaz.
La BCG cumple 100 años, y es la única vacuna an tituberculosa en uso. El 18 de julio de 1921, en París, el pediatra Dr. Benjamin Weill-Hallé y el Dr. Raymond Turpin, en la guardería de la maternidad del Hôpital de la Charité, administraron a un recién nacido cuya madre, tuberculosa, había muerto después del parto y que iba a quedar a cargo de su abuela, también tuberculosa y en un medio contaminado, 6 mg de BCG, por boca, en tres dosis. Días antes, el 1 de julio, Weill-Hallé había consultado con Calmette (Fig. 1) el caso y la posibilidad de vacunar al recién nacido con BCG. Y, conscientes de sus “escrúpulos de experimentadores”, decidieron que era “su deber hacer la prueba”1,2.

Fig. 1 Le Docteur Albert Calmette. Chanteclaire, 1906. B. Moloch (Alphonse H. Colomb, 1849-1909). Welcome Co llection. En: https://wellcomecollection.org/works/zt2ka9gx; 11/9/2021
Albert Calmette (1863-1933) y Camille Guérin (1872- 1961) habían comprobado que su bacilo era “inofensivo” para los bovinos y animales de laboratorio y aun para el hombre. En un artículo de un año antes dicen: “Por otras experiencias que no caen dentro del alcance de este tra bajo, adquirimos la certeza de que nuestro bacilo bovino vivo es inofensivo para el hombre, incluso por inoculación endovenosa a la dosis de, al menos, 44 000 bacilos3. ¿Quién habrá sido el inoculado? No se menciona más en sus publicaciones.
A los seis meses el primer vacunado estaba bien, con desarrollo normal y por ello decidieron, Calmette, Guérin, Weill-Hallé, Turpin y Miss Coloni (mencionada solo en referencia 2) aplicar la BCG a otros niños. Esta vez a “([…] los niños pequeños cuyos padres han tenido la amabilidad de autorizarnos”). Lo hicieron desde 1922 hasta 1924. Los resultados los presentaron Calmette, Guérin, Weill-Hallé y sus colaboradores, en la sesión de la Académie Nationale de Médicine del 24 de junio de 19241.
Calmette y Guérin, después de 20 años de estudios, exponen allí los fundamentos y resultados de atenuar la tuberculogénesis del Mycobacterium bovis. Cultivaron el bacilo, en un medio con bilis de buey, para modificar here ditariamente la constitución físico-química del bacilo. Con siguieron atenuarla tras una serie ininterrumpida de 230 pasajes que les llevó 13 años. Estos bacilos atenuados, los Bacilos de Calmette Guérin, devinieron inofensivos pero capaces de inmunizar contra las formas virulentas de M. bovis y M. tuberculosis, en todas las especies que estudiaron, cobayos, conejos, bovinos y simios.
Relatan luego los resultados, entre 1921 y 1924, de inocular por vía oral, en tres dosis, a 217 recién nacidos de madres tuberculosas, pierden el seguimiento de 39. Son de familias de los arrabales, sin domicilio fijo. De los 178 restantes 9 murieron en los 18 meses siguientes a la inoculación, solo en tres establecieron la causa de la muerte, dos bronconeumonías y uno por trastornos diges tivos. Controlaron con la reacción tuberculínica cutánea tres meses después de la inoculación a 53; negativa en 47, cinco en contacto con enfermos bacilíferos; positiva en seis, tres en contacto con bacilíferos. Para comparar resultados los autores anuncian una segunda serie de inoculaciones limitadas a un distrito central y elegante de París (VIe).
Dicen que no pretenden que su BCG, bacilo modifica do, avirulento y no tuberculógeno, aunque “aún tóxico y productor de tuberculina”, resuelva el problema, sino que creen que solamente mostraron las pruebas experimen tales y que su utilización racional puede reducir la morta lidad y morbilidad de los infantes y de los sujetos nunca expuestos, en una vieja civilización que convive por siglos con el bacilo. Están convencidos que la inmensa mayoría de las tuberculosis de adolescentes son manifestaciones tardías de una infección adquirida en la cuna. Añadimos, la BCG es una primoinfección controlada.
En 1931 en la Royal Society of Medicine, Calmette presenta una revisión histórica y técnica del tema, llega al centro de las controversias: la posibilidad de que la BCG pierda su fijeza, mute su virulencia, y sea patógeno. Calmette sostiene lo contrario con la experiencia propia y ajena, y rebate en un análisis puntilloso, cada una de las objeciones. Con Guérin siempre supieron y tuvieron en cuenta ese riesgo que ocurrió con otras vacunas. Se menciona el llamado “desastre de Lübeck” y la posibili dad de mutación de la BCG: “¿Esto nos da el derecho a concluir que ningún artificio de laboratorio nunca tendrá éxito en conseguir la transformación del BCG en un bacilo virulento, de la misma manera que Guérin y yo conseguimos transformar un bacilo virulento en el BCG ¡Sería el último en sostenerlo!”. No había ocurrido hasta entonces. Termina diciendo: “¿Qué médico, qué autoridad sanitaria que conozca estos hechos y con toda la información ahora disponible rechazaría deliberadamente aplicar este método simple contra la más virulenta de las enferme dades humanas?”2. Veremos más adelante que el BCG evoluciona y cambia su genética, pero no se convierte en tuberculógeno y mantiene su capacidad inmunógena.
El desastre de Lübeck ocurrió en los años 1929-33, 251 recién nacidos inoculados por vía oral, 173 enfermaron de tuberculosis, 72 de ellos murieron. Causa: contaminación de la BCG con una cepa de M. tuberculosis; contamina ción: un error humano; consecuencia: una desconfianza que persistió por muchos años4. Pese a la desconfianza la BCG se usó en casi todos los países de Europa y ciudades de EE.UU., Canadá y el resto de América5.
La BCG llegó a la Argentina en 1925. La trajo el Dr. Andrés R. Arena (1887-1971), Director del Laboratorio antirrábico del Instituto Bacteriológico de La Plata, a quien el gobierno provincial, en 1924, le otorgó un accidentado subsidio para viajar a Barcelona y estudiar una vacuna producida por el Dr. J. Ferrán. Arena, después de unos meses de infructuosos ensayos con esa vacuna, se tras ladó al Instituto Pasteur de París, donde apenas estuvo ocho días antes de embarcarse de vuelta al país. El mismo Calmette le entregó cultivos de BCG con la condición “que la vacuna debía otorgarse gratuitamente y los cultivos debían facilitarse para quienes los solicitaran para realizar experiencias o investigaciones”. Arena colocó los cultivos en la sala de máquinas del barco para mantenerlos a la temperatura adecuada. Y en 1925, el Instituto Bacterio lógico de La Plata preparó la BCG y entregó las primeras dosis al doctor Antonio Igartua, quien inoculó a treinta niños en la Maternidad de la Escuela de Parteras de la Plata. No nos detendremos en las vicisitudes burocráticas y políticas por las que pasó Arena en su carrera5. No nos sorprenden. Ahora la BCG figura entre las vacunas del Calendario de Vacunación Nacional, puede leerse en los envases de leche.
El análisis genético de la vacuna BCG y su capacidad inmunizante
Desde 1924 hasta los años 60, el Instituto Pasteur entre gó cultivos de BCG a más de 50 laboratorios de todo el mundo6-8. Hay evidencias de que durante ese período la cepa original (desaparecida) sufrió múltiples cambios ge néticos que dieron origen a varias subcepas. El desarrollo en medio con glicerol (DG+) sumado a la resistencia a cicloserina (RC+) y pirazinamida (RPZ+) son caracteres fenotípicos comunes a todas las subcepas de BCG y permiten una sencilla diferenciación con M. tuberculosis (DG+, RC-, RPZ-) y M. bovis (DG-, RC-, RPZ+). Además, BCG es siempre sensible a fluoroquinolonas, claritromi cina, doxiciclina y gentamicina.
Las variaciones genómicas que se observaron en ciertas subcepas de BCG consisten en supresiones (deleciones), duplicaciones y mutaciones puntuales. Se han detectado variaciones de posición en las secuencias de ADN, polimorfismos de un solo nucleótido (SNP, por single nucleotide polymorphism) y también duplicaciones y deleciones ocurridas antes de 1960, en que se intro dujo la liofilización y se estandarizó la producción de la vacuna. La disponibilidad de las secuencias completas de los genomas de M. tuberculosis H37Rv, M. bovis y BCG ha permitido su análisis comparativo9. Se identificó una serie de deleciones cromosómicas comunes a es pecies virulentas y avirulentas, pero un solo locus, RD1 (Región Cromosómica de Diferencia 1), está suprimido en todas las subcepas de BCG. Este evento genético sin duda contribuyó a su atenuación y explicaría por qué se ha mantenido esa condición. Tras la reintroducción experimental de RD1 en el cromosoma de BCG se ob servaron cambios en la morfología de las colonias que las asemejaron al bacilo virulento y un aumento, aunque parcial, en la virulencia para el ratón. Esto indicaría que la atenuación de la virulencia en el BCG es un proceso poli-mutacional10.
BCG-Moreau (Brasil), BCG-Rusia y BCG-Japón, ob tenidas del Instituto Pasteur antes de 1926, tienen dos copias de la región de inserción IS6110, mientras que las obtenidas después de 1931, como BCG-Denmark, BCG-Tice y BCG-Glaxo, tienen una sola copia de IS6110 y también han perdido la región RD2. Además, solo las cepas “tempranas” poseen ácidos metoximicólicos en la pared celular, considerados factores de virulencia, pero no está claro que su pérdida reduzca la eficacia protectora de las cepas “tardías” de BCG11.
En definitiva, la BCG no es una sola vacuna, hay diferen tes subcepas, con diferentes propiedades, y aun distintos genotipos dentro de cada subcepa, que podrían ser en parte responsables de variaciones en la inmunogenicidad y en la virulencia residual12. Se han publicado metaanálisis sobre la protección conferida por BCG en diversos países y regiones, así como ensayos clínicos comparativos entre distintas subcepas13-16. Sin embargo, estas diferencias no se han podido relacionar fehacientemente con la capacidad protectora. Si bien los expertos de la OMS recomiendan realizar nuevos estudios de efectividad comparativa de las diferentes subcepas, afirman que, entre los productos BCG validados, no existe uno preferido para su uso, en ninguna edad o grupo de riesgo13. La demanda global de BCG se estima en ~350 millones de dosis. De las 19 instituciones productoras de BCG en el mundo, solo 4 tenían en 2017, suficiente capacidad de producción y contaban con los controles de calidad internacional (con calificación de OMS) requeridos para proveer a más de 169 países, a través de UNICEF y OMS. Las cepas BCG más empleadas actual mente son BCG-Denmark, BCG-Japan y BCG-Bulgaria (genéticamente idéntica a BCG-Russia)13,14.
Mecanismo de acción y predictores de inmunidad
En BCG, como en muchas otras vacunas, la eficacia se demostró sin que se comprendiera el mecanismo de acción. Más tarde se observó la relación entre conversión tuberculínica post-vacunal y protección. Y por lo tanto se dedujo el rol protagónico de la inmunidad mediada por células en la protección conferida.
Tanto la clásica prueba tuberculínica intradérmica con PPD como las más modernas pruebas de liberación de interferón-gamma en sangre, son una medida indirecta de infección porque detectan la respuesta de células T de memoria a antígenos de M. tuberculosis. Estas pruebas no distinguen entre infección latente y TB activa. Además, pier den capacidad diagnóstica en sujetos con baja población de células T CD4+. Aunque de modo imperfecto, la prueba tuberculínica puede servir como medida de la respuesta a la vacunación, porque el PPD contiene antígenos comunes a los miembros del Complejo M. tuberculosis. Ha sido y es extensamente empleada para medir no solo los índices de infección en una población sino también la cobertura de va cunación BCG. Las pruebas de interferón-gamma de última generación usan antígenos purificados presentes en RD1 (ESAT-6 y CFP-10) y no son útiles para medir respuesta a la vacunación porque BCG carece de esos antígenos17.
En la mayoría de las enfermedades infecciosas, la detección de anticuerpos en sangre es un buen monitor de respuesta a las vacunas, pero en la TB los anticuerpos no han demostrado proveer información válida de protección. Falta aún un indicador validado de la protección contra TB conferida por BCG.
La eficacia de la vacunación BCG en la Argentina
En un estudio retrospectivo de casos y controles en me nores de 6 años (n: 1050), realizado en tres hospitales del conurbano bonaerense entre 1978 y 1985, se mostró que la vacuna BCG ejerce efectiva prevención de las formas primarias y diseminadas en niños [73% (62-82%)]18. La protección comprobada fue 100% para meningitis y otras localizaciones extrapulmonares, 88% para TB miliar y 65% para TB pulmonar. Pero cuando el análisis se limitó a casos con confirmación bacteriológica, es decir con certeza diagnóstica, el porcentaje de protección ascendía a 96%. En estudios realizados en Bahia y Sao Paulo (Bra sil) con BCG allí producida (cepa Moreau), se comprobó una protección del orden de 98 y 92%, respectivamente, contra la meningitis TB15,16. En esos años, la cobertura de vacunación al nacer era, en la Argentina, aproximadamente 77%, y se empleaba BCG liofilizado de diferentes orígenes y subcepas (Paris 1978, Glaxo 1979-81, Japón 1984, y Laboratorio Central de Salud Pública de La Plata, cepa Paris 1984-88). La cobertura de vacunación BCG en menores de 4 años continuó aumentando, y alcanzó 97% en 201719-21.
La Figura 2 compara la cobertura de vacunación BCG y la notificación de TB (total, casos pulmonares y meningitis en menores de 4 años) entre 1980 y 2000. La disminución de la meningitis en niños fue marcadamente mayor que la de TB total. En la Tabla 1 se compara la disminución de incidencia de casos de TB entre 2004 y 2019, que fue 19%, con la de meningitis TB en menores de 4 años, que alcanzó 65%. En conjunto, estos datos coinciden en mostrar que la vacunación en los primeros años de vida ejerce un efecto independiente de otras medidas de control de la TB (detección de casos y tratamiento).
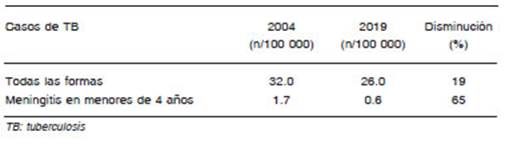
Tabla 1 Incidencia total de casos de TB por 100 000 habitantes y de meningitis TB en niños menores de 4 años, República Argentina, 2004 vs. 2019, y porcentaje de disminución de ambas tasas en ese período19,21
BCG, infección, enfermedad y tratamiento anti-TB
El valor fundamental de la vacunación BCG consiste en impedir la diseminación hematógena una vez establecida la infección por M. tuberculosis. Eso fundamenta la reco mendación de aplicarla al recién nacido, que es seguida en 141 de los 194 países que la emplean13.
La vacuna BCG no previene la TB pulmonar del adulto, que puede ser debida a reinfección (en zonas de alta en demicidad), a reactivación y, muy raramente, a infección primaria, pero sí es capaz de prevenir tanto la TB sensible como la resistente o multirresistente a los fármacos anti-TB.
¿La vacuna BCG protegería también contra la infección por M. tuberculosis?
La escasez de elementos para responder a esta pregunta se debe a que la prueba tuberculínica cutánea no distin gue si una respuesta positiva se debe a infección por M. tuberculosis, a vacunación con BCG o a infección por micobacterias no tuberculosas, aunque las reacciones por vacunación o sensibilización a otras micobacterias son, en general, más pequeñas que las debidas a infec ción TB reciente y progresiva. Si la vacunación BCG fue recibida 15 o más años antes, puede ser ignorada como causa de respuesta positiva al PPD, especialmente ante induraciones de 15 mm o más22.
En cambio, las pruebas de liberación de interferón gamma, basadas en células T (IGRA) sí podrían diferen ciar la infección tuberculosa (IGRA+) de la vacunación previa con BCG y de la mayoría de las infecciones por micobacterias no tuberculosas (IGRA-)17,22. Esto permite investigar si la BCG protege no solo contra la enferme dad sino también contra la infección tuberculosa. En un metaanálisis publicado en 2014, con información sobre la progresión a TB activa en niños contactos de casos TB, en que se incluyeron 14 estudios realizados en 9 países, se pudo establecer, en 6 de ellos, la relación entre niños vacunados IGRA+ o IGRA-, y casos de TB. Se asoció así la vacunación BCG con la reducción de la infección latente por M. tuberculosis, en un 27% (RR 0.73), y con la enfermedad TB, en un 71% (RR 0.29)23. Los autores señalaban algunas limitaciones del estudio, entre ellas: que no se pudo determinar el grado de exposición al caso índice TB, y que el uso de IGRA como indicador específico de infección TB todavía estaría sujeto a debate.
Inmunidad inespecífica o heteróloga. Otros empleos de la vacuna BCG
El sistema inmune innato tiene capacidad para desarro llar memoria inmune y proporcionar protección duradera contra invasores extraños. Se ha asociado la vacunación BCG con protección contra lepra, úlcera de Buruli, varias parasitosis, y menor mortalidad por cualquier causa en la infancia24,25. La inmunoterapia con BCG concentrado in situ es eficaz en el cáncer de vejiga. También se la emplea en otros tipos de cáncer, esclerosis múltiple y diabetes tipo 1, entre otras26. La vacuna BCG podría reforzar la inmunidad natural frente al SARS-CoV-2 y otros patógenos27. En particular, se asocia a protección contra infecciones respiratorias y sepsis28. Estos efectos heterólogos del BCG serían debidos a su capacidad para alterar los puntos de ajuste inmune a través de las células T, así como a cambios epigenéticos en las células de la inmunidad innata, un proceso conocido como “inmunidad entrenada”.
La pandemia de COVID-19 y la vacunación BCG
La pandemia de COVID-19 ha afectado drásticamente la atención de la salud. Se modificaron las prioridades, bajó tanto la demanda como la oferta de la consulta médica, y también se afectó, por razones operativas, la cobertura de vacunación infantil, incluida la de BCG, que bajó, en las Américas, de 97% en 2017, a 85% en 202019-21. Pero, por otra parte, la pandemia de COVID-19 ha contribuido a valorizar la vacunación como estrategia básica de control de infecciones. Entre 2020 y 2021 se han desarrollado, probado y aplicado más vacunas que nunca antes en la historia. Y esto también tiene un efecto positivo sobre el desarrollo de nuevas vacunas contra la TB y otras enfer medades endémicas.
¿Nuevas vacunas anti-TB?
El objetivo general de cualquier vacunación no es prevenir la infección sino lograr una protección duradera contra ella, y también reducir la morbilidad y mortalidad asociada al desarrollo de la enfermedad. La vacuna BCG protege especialmente de la enfermedad que sigue a la infección tuberculosa primaria. La duración media de esa protec ción se estima en 10 a 15 años. Además, es una de las vacunas más seguras que existen, en cuanto a accidentes post-vacunales o efectos secundarios13.
¿Qué se espera entonces de una nueva vacuna anti-TB? Hay varias demandas, entre ellas: que pueda prevenir la TB por reinfección, y por ello ser empleada en adolescentes y adultos jóvenes, que son las fuentes más frecuentes de transmisión de la TB; que pueda reemplazar a la BCG en la vacunación del recién nacido, y/o ser admi nistrada como booster; que actúe como adyuvante en el tratamiento de la TB multirresistente y en la prevención de recurrencia después de finalizado el tratamiento anti-TB, y como vacuna post-exposición en contactos de casos29.
En 2012 se establecieron algunos criterios básicos para el desarrollo de vacunas anti-TB y en 2021 se com pletaron con una guía, que comprende desde ensayos clínicos tempranos de seguridad e inmunogenicidad, has ta implementación y ensayos de eficacia13,29,30. A inicios de 2020 ya se establecieron varias tecnologías para el futuro desarrollo de vacunas anti-TB: vacunas celulares inactivadas y atenuadas, de subunidades proteicas, de ácidos nucleicos, con vector adenovirus, y con virus in fluenza recombinante como vector30-32.
Actualmente hay más de 20 vacunas anti-TB propues tas. Dos de ellas, VPM1002, y MTBVAC, en desarrollo avanzado, son vacunas celulares. Existen varios ejemplos de vacunas celulares, inactivadas o atenuadas, contra enfermedades virales: MMR (measles, mumps, rubella, sarampión, paperas y rubéola, atenuadas), IPV (vacuna antipolio inactivada), y las anti-COVID-19 Sinopharm y Sinovac (inactivadas), pero hay menos entre las destina das a prevención de patógenos bacterianos (Bordetella pertussis, en DPT).
VPM1002 es un BCG recombinante vivo atenuado, originado en Max Planck Institute for Infection Biology. Los resultados de ensayos pre-clínicos confirmaron que es por lo menos tan seguro e inmunogénico como BCG. MTBVAC, desarrollada por la Universidad de Zarago za, el Instituto Pasteur y Biofabri, es una cepa de M. tuberculosis viva atenuada. Los ensayos de seguridad e inmunogenicidad en infantes y en recién nacidos han sido exitosos.
MIP es otra vacuna celular basada en el potencial inmunoterapéutico del M. indicus pranii inactivado, que se propone como adyuvante del tratamiento. Por otro lado, ChAdOx1.PPE15 es una vacuna recombinante en un adenovirus de replicación deficiente, que expresa la proteína micobacteriana PPE15. Es parte del Programa UOXF TB (Universidad de Oxford) para una vacunación booster de BCG en adolescentes. Se ensaya la vía inha latoria de aplicación.
Las vacunas recombinantes expresan antígenos y no pueden replicarse, por lo que se las considera totalmente seguras. Las vacunas de ácido nucleico utilizan material genético (ADN o ARN) para inducir la fabricación de proteínas específicas antigénicas. En nuestras células el código de ADN se traduce en ARN mensajero (ARNm) que se utiliza como plantilla para fabricar proteínas an tigénicas específicas. Las vacunas de ARNm pueden producirse con rapidez en grandes volúmenes. En el caso de COVID-19, este tipo de vacunas se ha desarrollado, ha pasado ya pruebas de fase III, y se ha aplicado a millones de personas en todo el mundo. También constituyen un campo promisorio de aplicación contra variadas enferme dades endémicas, incluida la TB. Las vacunas de ADN ya se emplean en veterinaria, son de sencilla producción y más estables que las de ARNm, pero deben penetrar en el núcleo celular, inconveniente que se resuelve con el empleo de adyuvantes apropiados. En cambio, las de ARNm solo necesitan llegar al citoplasma31-33.
Una de las barreras principales para el desarrollo de vacunas contra la TB es la complejidad de la respuesta inmune a la infección, y la consiguiente falta de pruebas que correlacionen con la protección alcanzada.
A partir de modelos animales, existe evidencia de que la aplicación directa de una vacuna en la mucosa respiratoria, donde existen diferentes subtipos de células T, podría mejorar la respuesta inmune protectora13,34,35.
Se ha mostrado que las micobacterias liberan vesícu las extracelulares, que contienen lipoglicanos y lipopro teínas de importante rol en la inmunidad anti-TB, y que podrían ser aplicadas en la tecnología de producción de vacunas y métodos diagnósticos36,37. También se ha hallado que los exosomas de macrófagos infectados por M. tuberculosis contienen proteínas, tales como antígeno 85-C y ESAT-6, de importancia en la activación de células T contra la infección TB38-40.
Conclusiones
La BCG, una cepa atenuada de M. bovis, lleva 100 años de uso en la vacunación anti-TB y ha sido aplicada a más de 4 mil millones de niños en más de 180 países. Se administran anualmente más de 120 millones de dosis, lo que la hacía −hasta 2021− la vacuna más empleada en el mundo.
También este año en que la BCG cumple 100, la TB matará más de un millón de personas que, además, es lo que hace todos los años. Sin embargo, la historia nos enseña, y los avances logrados frente al COVID lo con firman, que la vacunación es el instrumento fundamental para el control y la erradicación de las enfermedades infecciosas, incluida una que lleva más de 3 millones de años entre nosotros, la TB.
Hasta que haya otra vacuna más eficaz, ampliamente disponible y económica, la BCG debe seguir figurando en el Calendario de Vacunación Nacional, para ser aplicada al recién nacido, como figura en el Calendario, antes del egreso de la maternidad41.















