PUNTOS CLAVE
• En COVID-19 existen estados de hiperinflamación, donde la inmunosupresión y el bloqueo de receptores de IL-6 podría ser beneficiosa. Se ha desarrollado una guía de práctica clínica, utilizando el método GRADE acerca del uso de tocilizumab en COVID-19. Se sugiere utilizar tocilizumab en pacientes hospitalizados con COVID-19 grave y crítica, conjuntamente con corticoides sistémicos.
La enfermedad por el Coronavirus 2019 (COVID-19 - Coronavirus Disease 2019) es una patología respiratoria de humanos producida por la infección por un nuevo coronavirus identificado con la sigla SARS-CoV-2.1 El 11 de marzo de 2020 la Organización Mundial de la Salud (OMS) declaró al COVID-19 como una pandemia, y desde ese momento hasta el 13 mayo del 2021 se ha informado aproximadamente para Argentina más de 3 000 000 casos confirmados y 68 807 muertes1,2.
La evidencia actual muestra que la infección por el SARS-CoV-2 progresa en diferentes etapas. Los síndro mes de dificultad respiratoria aguda (SDRA) se observan después de la segunda semana, y no se relacionan solo con la replicación viral no controlada, sino con la respuesta del huésped3. Estos síntomas en general, no incluyen la disnea, pero sí una progresiva declinación de la función respiratoria observable a través de la gasometría y las imágenes pulmonares.
Tocilizumab es un anticuerpo monoclonal recombi nante humanizado, que actúa a través de la inhibición de la citocina interleucina 6 (IL-6), involucrada en procesos inflamatorios sistémicos. La Agencia Europea de Medi camentos (EMA) y en nuestro país, ANMAT, autorizó su uso para el manejo de diversas enfermedades entre las que se incluye la artritis reumatoide (artritis reumatoide, artritis idiopática juvenil sistémica, de células gigantes y artritis idiopática juvenil múltiples articulaciones)4,5.
Aunque los inmunomodulares no deben usarse en for ma rutinaria en pacientes con COVID-19, existen estados de hiperinflamación en personas grave o críticamente enfermas, donde la inmunosupresión y el bloqueo de este tipo de receptores de IL-6 podrían ser beneficio sos6. En junio de 2021 la FDA emitió una autorización de uso de emergencia para tocilizumab para el tratamiento de pacientes adultos y pediátricos con COVID-19 que reciben corticosteroides sistémicos y requieren oxígeno suplementario, ventilación mecánica no invasiva o invasi va u oxigenación por membrana extracorpórea (ECMO), https://www.fda.gov/media/150321/download
Las guías informadas por la evidencia constituyen una de las herramientas más útIles para mejorar la salud pública y la práctica clínica, ofrecer intervenciones con sólidas pruebas de eficacia, evitar riesgos innecesarios, utilizar razonablemente los recursos, disminuir la variabi lidad en la práctica clínica y, en esencia, mejorar la salud y garantizar una atención de calidad, razón de ser de los sistemas y servicios de salud.
Esta guía ha sido elaborada a partir de la metodología propuesta por el Grupo de Trabajo GRADE (Grading of Recommendations Assessment, Development and Eva luation)7, con el objetivo de proveer a los profesionales de la salud y los generadores de políticas en salud, un instrumento para orientar el uso de tocilizumab en pa cientes con enfermedad grave y crítica por coronavirus. En la primera parte (I), se presenta la guía, detallando el alcance y usuarios, el marco teórico y justificación, así como el objetivo y población diana. En la segunda parte (II), se expone la metodología utilizada para el desarrollo de la guía. La tercera parte (III) contiene la recomenda ción formulada, con un resumen de los juicios emitidos por el panel como justificación. En la cuarta parte (IV), se presentan estrategias relacionadas con la implementación de la recomendación.
En el anexo Material Suplementario se presenta in formación adicional relacionada con el proceso de cons trucción de la recomendación (detalle de la composición -Tabla S1 y S2- y declaración de conflictos de interés del grupo elaborador -Tabla S3-, descripción detallada de las preguntas en formato PICO -Tabla S4-, búsqueda bibliográfica, gráficos de tipo forest plot para los desenla ces de interés -Figuras 1 a 5-, perfil de evidencia según la metodología GRADE -Figura 6- y los gráficos con el detalle de la valoración de riesgo de sesgo de los estudios aleatorizados -Tablas S5 y S6-)
Con apoyo del grupo metodológico, expertos clínicos y en gestión en salud de la provincia y el resto del país se ha desarrollado una guía de práctica clínica que oriente al personal de salud y a los generadores de políticas públicas del Ministerio de Salud de Rio Negro acerca del uso de tocilizumab para pacientes con enfermedad grave y crítica por coronavirus. El presente documento brinda información científica actualizada y confiable y se ha elaborado en base a la metodología GRADE (Grading of Recommendations Assessment, Development and Evaluation)7, con la finalidad de evitar la progresión a formas más graves de la enfermedad y eventos fatales.
Metodología
Esta sección está adaptada de la plantilla de reporte de guías informadas en la evidencia que se encuentra en la directriz para el fortalecimiento de los programas nacio nales de guías informadas por la evidencia de la OPS7.
Alcance y usuarios
La presente guía provee recomendaciones informadas en la evidencia para pacientes adultos con sospecha o con diagnóstico confirmado de coronavirus. Las reco mendaciones están dirigidas a profesionales de la salud, incluidos médicos especialistas en medicina interna, terapia intensiva y médicos residentes, quienes están de una u otra forma están involucrados en la atención de pacientes con enfermedad grave y crítica por coronavirus en la provincia de Río Negro. La guía también está dirigida a orientar a los generadores de políticas en salud de la provincia quienes tienen la responsabilidad de definir la implementación de esta y otras guías. En forma secundaria este documento puede ser de utilidad para médicos y generadores de po líticas en salud en otras provincias o países.
Objetivos y población diana
Esta guía se desarrolló con el objetivo de orientar el uso de tocilizumab para el manejo de los pacientes con en fermedad grave y crítica por coronavirus. La enfermedad grave se define como SpO2 ≤ 92% con aire ambiente y/o pacientes que reciben oxígeno suplementario (incluyendo cánula nasal de alto flujo y ventilación no invasiva); la en fermedad crítica se define como pacientes que requieren ventilación mecánica invasiva.
Cómo usar esta guía
La pregunta clínica presenta una recomendación que brinda indicaciones para el uso de tocilizumab en el ma nejo de los pacientes con enfermedad grave y crítica por coronavirus. Dicha recomendación presenta la calidad de la evidencia siguiendo el sistema GRADE (Tabla 1). Además, se indica la fuerza de la recomendación con arreglo al sistema GRADE (Tabla 2).
Composición del grupo desarrollador
El grupo desarrollador contó con la participación de expertos temáticos en el tratamiento de pacientes con enfermedad grave y crítica por coronavirus y expertos en metodología para el desarrollo de guías de práctica clínica con la metodología GRADE. En el anexo material suplementario -Tabla S1 y S2- se presenta la composi ción íntegra del grupo desarrollador.
En la elaboración de la guía participaron tres gru pos. En primer lugar, el grupo coordinador cumplió las funciones de organización, dirección y coordinación. En segundo lugar, el grupo de expertos fue seleccionado entre profesionales con experiencia en el diagnóstico, manejo y tratamiento de la enfermedad por coronavirus y sus funciones consistieron en: 1) formular las recomen daciones en respuesta a las preguntas planteadas por el grupo coordinador; 2) identificar estrategias para optimizar la implementación de las recomendaciones y 3) participar en el proceso de redacción del documento definitivo. Por último, las funciones del grupo de metodólogos consistie ron en: 1) realizar la revisión sistemática de la literatura con el objetivo de recopilar la evidencia necesaria para contestar la pregunta planteada; 2) resumir la evidencia; 3) proveer soporte metodológico al grupo de expertos para la formulación de las recomendaciones; y 4) participar del proceso de redacción del documento definitivo.
Declaración de conflicto de intereses
Todos los miembros del grupo desarrollador y del panel de expertos, así como las personas que participaron en la revisión externa, firmaron una declaración de conflicto de intereses. Los coordinadores generales de la guía revisaron todas las declaraciones con el fin de detectar algún conflicto que pudiera afectar los juicios de valor y las recomendaciones. Todos los involucrados declararon no tener conflictos de interés frente a la formulación de las recomendaciones, no estar involucrados como inves tigadores en ensayos clínicos en curso sobre la temática ni haber recibido donaciones o prestaciones por parte de los grupos de interés. De forma general, no se constató ningún conflicto con potencial para introducir sesgo a las recomendaciones de la guía.
Declaración de independencia editorial
El Ministerio de Salud de la Provincia de Rio Negro, brin dó los recursos económicos para el trabajo del equipo metodológico. El grupo desarrollador de la guía se en cargó, de manera independiente, del trabajo científico de investigación y de la elaboración de las recomendaciones.
Definición de los alcances y objetivos de la guía de práctica clínica
El grupo coordinador definió los alcances y objetivos de esta guía con el propósito de servir de apoyo a los profesionales de la salud, para permitirles brindar una atención médica homogénea, con calidad, equidad y eficiencia. Revisada la literatura pertinente, el grupo desarrollador redactó un documento con los objetivos, los antecedentes y la justificación para confeccionar esta guía de práctica clínica. También se definió la población objeto de la guía y los aspectos clínicos centrales.
El objetivo de esta guía es generar las recomenda ciones sobre el uso de tocilizumab en pacientes con enfermedad grave y crítica por coronavirus. La misma fue impulsada por el Ministerio de Salud de Rio Negro, buscando favorecer la interacción técnica y científica sobre este asunto entre los profesionales de la región y del resto del país
Esta guía pone a disposición del resto de las provin cias de nuestro país y de los Estados vecinos, la mejor evidencia disponible para la toma de decisiones, con el fin de reducir la morbimortalidad por coronavirus, además de contribuir al control de esta enfermedad como problema de salud pública.
Decisión sobre desarrollo de novo o adaptación
Se realizó un análisis de la calidad y la pertinencia clínica de guías existentes y no se encontraron guías suscep tibles a ser adaptadas8-10. Al momento de desarrollo de esta guía, las recomendaciones no incluían la evidencia actualizada, ni todos los desenlaces de interés del panel y desarrolladores del documento ni una evaluación apro piada de diversos factores que pudieran ser adaptados a la perspectiva de la provincia de Río Negro. Se procedió entonces a desarrollar una guía de novo.
Formulación de preguntas clínicas
El grupo coordinador revisó los aspectos clínicos relevantes que debían ser abordados y formuló la pregunta específica mediante su estructuración en formato PICO (población, intervención, comparación y desenlaces).
El grupo coordinador y el equipo metodológico reali zaron un ejercicio de priorización de desenlaces con el ánimo de señalar los que resultaron claves y debieran ser incluidos en base a calificaciones realizadas en el contexto de las guías terapéuticas de la organización mundial de la salud11. Cada desenlace fue clasificado como “crítico”, “importante no crítico” y “no importante” para los pacientes, con arreglo a una escala de nueve unidades propuesta por el grupo GRADE y consensuado con el panel de expertos12.
Revisión sistemática
El equipo metodológico realizó la búsqueda utilizando la plataforma L·OVE de Epistemonikos para identificar estudios aleatorizados. Se registraron todas las citas y se valoró la inclusión de todos los estudios primarios poten cialmente relevantes según el título. Los mismos fueron analizados por dos metodólogos en paralelo, para definir su inclusión. Las discrepancias se resolvieron mediante deliberación.
Evaluación del riesgo de sesgo de los estudios individuales
Se utilizó la herramienta Cochrane RoB 2.013
Generación de las estimaciones de efecto y evaluación de la certeza
El grupo de metodólogos extractó y analizó la informa ción contenida en las mencionadas publicaciones de la siguiente manera: 1) Para los desenlaces seleccionados se meta-analizaron los riesgos relativos con el paquete metafor del software “R”14, utilizando el método estadístico de Mantel-Haenszel. En el anexo material suplementario -Figuras 1 a 5- se encuentran disponibles los gráficos de tipo “forest plot” para los desenlaces de interés; 2) Para resumir los riesgos basales utilizamos los riesgos basales o las tasas de eventos observados en las ramas control de los estudios aleatorizados; 3) El grupo de metodólogos evaluó la evidencia a través de los estudios separando la información por desenlace evaluado.
En el anexo material suplementario -Figura 6- está disponible el perfil de evidencia según la metodología GRADE7,15.
Traspaso de evidencias a recomendaciones
El proceso de construcción de recomendaciones se rea lizó en una reunión virtual realizada el día 30 de abril de 2021. De dicha reunión participaron los coordinadores, los expertos temáticos y los expertos en metodología. Para fa cilitar todo el proceso realizado durante la reunión, que se describe a continuación, se utilizó software GRADEpro16.
Para el traspaso de evidencias a recomendaciones, el grupo de metodólogos preparó planillas con el objetivo de facilitar el proceso (evidence-to-decision frameworks o marcos de referencia) según las recomendaciones del grupo GRADE17. En dichas planillas incluyeron: 1) la pregunta desarrollada en formato PICO; 2) el cuadro de resumen de resultados construido con la evidencia en contrada; 3) información sobre valores y preferencias de los pacientes; 4) información sobre utilización de recursos y costos; y 5) información relacionada con la factibilidad de aplicación y la equidad.
El grupo de metodólogos realizó una búsqueda biblio gráfica rápida con el objetivo de identificar información adicional relevante en relación con cada uno de estos aspectos. El panel de expertos valoró la evidencia recopi lada en el momento de debatir y definir los componentes que terminaron influyendo en la recomendación. Para el dominio relacionado al uso de recursos se desarrolló un modelo de impacto presupuestario
El grupo de expertos emitió un juicio para cada uno de los aspectos relevantes a la recomendación en res puesta a cada una de las preguntas. Dicho juicio fue consensuado por el grupo y, en los casos en los que no fue posible alcanzar el consenso, se votó a mano alzada. Se registraron los resultados de cada votación. Sin embargo, la mayoría de las decisiones fueron alcan zadas por consenso sin necesidad de recurrir al recurso de la votación.
El panel de expertos definió la recomendación con siderando los juicios alcanzados sobre cada uno de los aspectos relevantes. Para ello, decidieron tanto sobre la dirección (a favor o en contra de la intervención) como la fuerza (fuerte o débil), siguiendo los lineamientos del grupo GRADE7. Al igual que con los componentes indivi duales, la fuerza y la dirección de la recomendación, se votó a mano alzada, ya que no fue posible lograr un con senso y se registraron los resultados de la votación. Para definir una recomendación como fuerte, era necesario un acuerdo mínimo del 80% de los integrantes del panel; de no alcanzarse ese grado de acuerdo, la recomendación se definió como condicional.
La metodología GRADE ofrece dos grados de fuerza de recomendación: “fuerte” y “débil” o “condicional”. Una vez que se contempló el equilibrio entre riesgo y beneficio, la calidad de la evidencia, los valores y preferencias y el contexto de la provincia de Río Negro
El proceso de definición de la fuerza de recomendación comprendió una discusión extensa, por parte del panel de expertos, en torno fundamentalmente con la magnitud del beneficio esperado, el potencial impacto presupuestario para el subsistema público de salud de la Provincia de Rio Negro y las potenciales barreras en el acceso frente a un aumento exponencial y sostenido en la demanda por parte del único productor. Por último, se verificó que el panel de expertos estuviera de acuerdo con la recomendación definitiva y las consideraciones de implementación, incor porando la perspectiva de los participantes.
Incorporación de aspectos relacionados con costos, preferencias de los pacientes, equidad e implementación
El equipo metodológico desarrollo un modelo de impacto presupuestario desde la perspectiva del subsistema pú blico de salud de la Provincia de Río Negro. Se estimó el impacto presupuestario del uso de tocilizumab en pa cientes críticos y graves con COVID-19 de la provincia de Río Negro. La estimación de costos se realizó desde la perspectiva del financiador, Salud Pública de Río Negro, con un horizonte temporal de 6 meses.
Para estimar la población elegible para recibir tocili zumab, se trabajó con la información epidemiológica del número de casos incidentes de pacientes con COVID-19 positivo por semana epidemiológica que brinda la Sala de Situación de Salud del Ministerio de Salud de Río Negro18. Según esta información se calcula un promedio de 1000 casos incidentes por semana epidemiológica y se estima que el 10% de dichos casos se hospitalizan19, asumiendo que corresponde a pacientes con enfermedad grave o crítica (pacientes que requieren alguna forma de oxigenoterapia). A partir de la información de la Encuesta Nacional de Factores de Riesgo 201820, se estima que en Río Negro el 26.9% tiene cobertura exclusiva de salud pública. De esta forma se estimó una población blanco mensual de 108 pacientes elegibles para recibir tocilizu mab. Para calcular los costos de la intervención se tomó el valor de tocilizumab de ampollas de 400 mg según valor de referencia Kairos21 menos el 30%, para incorporar los descuentos por compra institucional. Se calculó una dosis única promedio de 800 mg por paciente (dosis de 8 mg por kilo) en base a la revisión de los estudios primarios incluidos en este informe. A partir de las estimaciones de efecto de esta guía, se tomó un promedio de 13.6 días de estadía en UCI en pacientes tratados con Tocilizumab y 20 días en pacientes del grupo control, mientras que el requerimiento de ventilación mecánica invasiva (VMI) fue establecido en un 12.8% en pacientes tratados con tocilizu mab y de 16% en el grupo control. Para calcular los costos de la internación en UCI se utilizaron los valores seguridad social de Río Negro, la Obra social Universitaria y PAMI en base a la consulta de los nomencladores de valores de IPROSS, SOSUNC y PAMI respectivamente. Se supuso en base a las estimaciones del equipo metodológico, una tasa de difusión de la tecnología del 10% por mes, iniciando en el 50% el mes 1 y llegando al 100% en el mes 6.
Cuestiones específicas de equidad, aceptabilidad y factibilidad se sustentaron en la experiencia y las per cepciones de los integrantes del panel de expertos que desarrollan tareas afines en la provincia de Rio Negro y el juicio de dicha información por parte de todo el panel de expertos. La información referida a valores y preferencias, se obtuvo de la guía de práctica clínica para tratamientos covid-1912 y el juicio de todo el panel de expertos. Esta información se resumió de forma narrativa y se incluyó en los marcos de evidencia a la decisión.
Recomendación
Pregunta
En pacientes con enfermedad grave y crítica por corona virus ¿Debe utilizarse tocilizumab junto con el tratamiento estándar en comparación con el uso del tratamiento estándar sin tocilizumab?
Se sugiere utilizar tocilizumab en pacientes hospita lizados con COVID-19 grave o crítica (recomendación CONDICIONAL sustentada en MODERADA CERTEZA en la evidencia).
Justificación
La dirección de la recomendación se sustenta en los probables beneficios en reducción de la mortalidad e ingreso a ventilación mecánica invasiva. El carácter condicional se sustenta en: 1) El impacto en el uso de los recursos: los costos de adquisición de tocilizumab son elevados (entre $128 626 y $ 153 274 por paciente tratado); siendo incierto el impacto sobre el presupuesto en salud surgido de su incorporación al esquema de tra tamiento (fundamentalmente por el riesgo de sesgo en la estimación de reducción de los tiempos de internación en UCI y la incertidumbre en los costos de internación en dicha unidad); 2) Las potenciales barreras surgidas de una posible incapacidad del productor de proveer la droga frente a un aumento sustancial en la demanda si se implementa el uso de tocilizumab en pacientes con enfermedad grave y critica por COVID-19
Consideraciones de implementación
Dosis: 8 mg/kg de peso real, única dosis, por vía en dovenosa, en infusión lenta (durante una hora), dosis máxima 800 mg
Administrar dexametasona 8 mg (o equivalente) por 10 días conjuntamente con tocilizumab.
La recomendación aplica a: 1. Pacientes con enfer medad grave definida como SpO2 ≤ 92% con aire am biente y/o pacientes que reciben oxígeno suplementario (incluyendo cánula nasal de alto flujo y ventilación no invasiva); 2. Pacientes con enfermedad crítica: pacientes que requieren VMI.
En base a la incertidumbre en el acceso a la droga el panel consideró que puede no ser factible disponer de las reservas necesarias para indicar tocilizumab al universo completo de pacientes con enfermedad grave y crítica definidos en el punto anterior.
Por lo tanto, se sugieren los siguientes puntos para apoyar el mejor juicio clínico del equipo médico tratante para seleccionar los pacientes que recibirán tocilizumab priorizando aquellos grupos de pacientes con mayor probabilidad de beneficio 1. Pacientes que reciben VMI en las primeras 72 horas de iniciada la misma. Luego de las primeras 72 horas el efecto del tocilizumab es incierto; 2. Dentro del universo de pacientes graves debe consi derarse: el nivel y respuesta al flujo de oxígeno y soporte ventilatorio no invasivo instaurados (a mayor nivel y peor respuesta, mayor riesgo de requerir VMI y de muerte) y los factores de riesgo sociodemográficos, clínicos y de laboratorio asociados a mala evolución23.
Frente a un potencial aumento en la inmunosu presión debe instaurarse una vigilancia activa para la detección y tratamiento temprano de infecciones bacterianas y fúngicas según protocolos institucionales vigentes.
Se sugiere emprender la gestión necesaria que per mita la articulación de los 3 subsistemas de salud para asegurar el acceso equitativo a tocilizumab a los pacien tes, independientemente de la cobertura de salud de los habitantes de la Provincia.
Los comités hospitalarios pueden considerarse para sustentar y dar apoyo al equipo de salud para el uso de tocilizumab por fuera de la indicación actual aprobada por ANMAT.
Resumen de la evidencia y los juicios emitidos por el panel
Resumen de los hallazgos
Los resultados de 8 ECA23-30, con 4116 pacientes inclui dos, evaluaron tocilizumab en pacientes con COVID-19 (Tabla 3).

Tabla 3 Características de los pacientes, tiempo desde el inicio de los síntomas hasta la infusión de tocilizumab y dosis en los estudios incluidos
La mayoría incluyó a pacientes con enfermedad grave o crítica, como lo demuestran las tasas de mortalidad en los grupos de control, que oscilaron entre el 12 y el 39%. La media de edad de los pacientes fue de 60 años. La media del tiempo del inicio de los síntomas a la infusión de tocilizumab fue de 10 días. Tanto RECOVERY como REMAP-CAP (los dos ensayos de tocilizumab que ma yor información aportan a las estimaciones de efecto de este informe) iniciaron el tratamiento en forma temprana (mediana de 48 horas de hospitalización al momento de la aleatorización en RECOVERY; menos de 24 horas en la UCI para REMAP-CAP). La dosis utilizada más frecuentemente fue de 8 mg/kg de peso con un máximo de 800 mg.
Para los desenlaces mortalidad e ingreso a ventilación mecánica invasiva el riesgo de sesgo fue valorado como “bajo” en 6 estudios23,24,26,28,29,30 y como “algunas preocupaciones” en 2 estudios25,27 por problemas en el reporte del ocultamiento de la asignación de la secuencia de aleatorización. Para el resto de los desenlaces el riesgo de sesgo fue valorado como “bajo” en 3 estudios24,26,28 y como “alto” en 5 estudios23,25,27,29,30 por problemas derivados de la ausencia de ciegos sobre el tratamiento de los pacientes y la medición de dichos desenlaces y los problemas ya mencionados en el proceso de alea torización25,27.
En el anexo material suplementario se encuentras disponibles los gráficos de valoración de riesgo de sego (Tablas S5 y S6)
Beneficios y daños
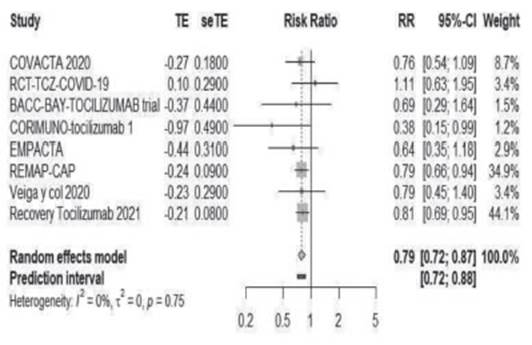
Tocilizumab probablemente reduce la mortalidad, RR 0.83 (IC del 95%: 0.75 a 0.93); en pacientes con enfer medad grave la diferencia de riesgo (DR) es de 2.2% menos (IC del 95%: de 3.2% menos a 0.9% menos); en pacientes críticos, la DR es de 6.6% (IC95% de 2.7% menos a 9.8% menos); reduce el ingreso a ventilación mecánica invasiva, RR 0.79 (IC del 95%: 0.72 a 0.87); DR 3.5% menos (IC del 95%: de 2% menos hasta 5% menos) y probablemente no aumenta significativamente los eventos adversos graves, RR 0.89 (IC del 95%: 0.74 a 1.07); DR 1.2% menos (IC del 95%: 2.9% menos a 0.8% más). Además, tocilizumab probablemente provoque una disminución de la duración de estadía en unidad de cuidados intensivos y críticos; diferencia de medias 6 días menos (IC del 95%: de 6 días menos a 7 días menos) y podría reducir el requerimiento de terapia de sustitución renal, RR 0.75 (IC 95% 0.59 a 0.96); DR 1.7% menos (IC95% de 2.8 menos a 0.3 menos). La certeza global en el cuerpo de la evidencia fue juzgada como MODERADA por imprecisión (Tabla 4).
Uso de recursos
Desde la perspectiva del Ministerio de Salud de Rio Negro, el costo del tratamiento con 2 ampollas de tocilizumab por paciente oscila entre $128 626 y $ 153 274: mientras que el costo diario de internación en UCI oscila entre $ 23 590 y $47 538: mediana $ 38 879. La estimación del costo del tratamiento de un paciente con tocilizumab se estima entre $474 098 y $750 784 y el valor del costo del tratamiento de un paciente sin tocilizumab se estima entre $471 800 y $878 594. El principal inductor de cos tos está definido por el costo de los días de internación. Tocilizumab podría asociarse a ahorros moderados por paciente tratado (mediana -$71 042; rango -$127 811 a $2 298); la certeza en la evidencia es BAJA conside rando el riesgo de sesgo en la estimación del efecto de tocilizumab sobre los tiempos de internación en UCI y el margen de error en la estimación de ahorro (surgido fundamentalmente de la variabilidad en los costos estimados de internación en UCI). Teniendo en cuenta los costos de internación de los diferentes financiadores, el análisis de impacto presupuestario, considerando una tasa de difusión progresiva de la tecnología de 50%, a 100%, con un incremento mensual de 10% para los meses 1 a 6, es la que se presenta en la Tabla 5.

Tabla 5 Análisis de impacto presupuestario teniendo en cuenta 3 financiadores de la provincia de Río Negro
Existe incertidumbre en el impacto presupuestario surgido de la incorporación de tocilizumab (mediana mes 2 - $4 600 000, rango - $8 251 000 a $148 000; mediana mes 4 -$6 100 000, rango -$11 000 000 a $198 000). La certeza en la evidencia es MUY BAJA considerando: 1. la incertidumbre en la estimación de la población elegi ble (considerando el potencial impacto de la vacunación con 1 dosis en la incidencia y la tasa de difusión de la tecnología en un escenario de potenciales problemas de acceso); 2. el riesgo de sesgo en la reducción en los tiempos de UCI y 3. margen de error en la estimación de ahorro (surgido fundamentalmente de la variabilidad en los costos estimados de internación en UCI).
Impacto sobre la equidad, aceptabilidad y factibilidad
No hubo consenso en el panel respecto del impacto de la incorporación de tocilizumab sobre la equidad. Es factible que poblaciones desfavorecidas con mayor riesgo de mala evolución, considerando los conocidos factores de riesgo sociodemográficos22, presenten mayores beneficios en términos absolutos. Esto es posible considerando la igualdad en la atención de pacientes que permite la concentración de los mismos en hospitales de alta complejidad de la Provincia, in dependientemente de su vulnerabilidad. Sin embargo, los pacientes que por su condición económica o de empleo sean atendidos fuera del subsistema público (sistema de obras sociales o medicina prepaga) pue den no tener o ver demorado el acceso a tocilizumab si los financiadores de dicho sistema deciden no dar cobertura al mismo.
Se consideró en forma mayoritaria que es probable que los financiadores del subsistema público acepten la implementación de una recomendación a favor de tocilizumab y su compra centralizada para abastecer al subsistema, a la luz del beneficio estimado en salud y la mejor estimación de efecto sobre el impacto en el uso de recursos. Se consideró que la falta de aprobación por ANMAT para esta indicación específica posiblemente no impacte en la aceptabilidad considerando que los comi tés hospitalarios asignados pueden dar sustento para su uso sin la aprobación nacional. En caso que la compra de tocilizumab no sea centralizada en el subsistema público, los administradores de los hospitales pueden no considerar aceptable los costos de adquisición de la droga frente a la incertidumbre de los potenciales ahorros considerando el presupuesto hospitalario y el costo de oportunidad. En caso que los subsistemas de obras sociales y medicina prepaga consideren no dar cobertura a tocilizumab, la judicialización en torno a la demanda de cobertura por el subsistema público podría disminuir la aceptabilidad por parte del mismo. Considerando la situación epidemiológica actual de la Provincia de Rio Negro se consideró que probablemente existan barreras mayores para el usar tocilizumab en la totalidad de pacientes con enfermedad grave y critica, fundamentalmente por la incertidumbre en la capacidad del productor de proveer tocilizumab frente a un aumento sustancial en la demanda. Por el mencionado problema de acceso es posible también que la infusión de la dro ga se haga por fuera de los tiempos establecidos como criterios de inclusión en los estudios que dan sustento a los beneficios que avalan el uso de la droga. Luego de completar la formulación de la recomendación, el equipo metodológico y el panel de expertos tuvieron acceso a un documento diseminado por el productor donde el mismo destaca que ha “trabajado de manera urgente para incre mentar la capacidad de fabricación y el suministro a nivel global, aumentando nuestra propia red de producción y colaborando activamente con socios externos para maxi mizar la producción de Actemra® (tocilizumab) y satisfacer la demanda global proyectada. En la Argentina, se registra una demanda inesperada a nivel local, que supera el sumi nistro proyectado. Por este motivo, desde Roche Argentina estamos haciendo todos los esfuerzos para regularizar el abastecimiento y la entrega de producto de acuerdo a la demanda local durante el mes de junio 2021”31.
Balance entre beneficios y aspectos negativos
El panel otorgó en forma mayoritaria mayor peso a una reducción pequeña en la mortalidad y el requerimiento de VMI y menor peso a los problemas de acceso, para definir la dirección a favor de tocilizumab. El carácter condicional de la recomendación se sustenta en la incertidumbre en el impacto presupuestario y los potenciales problemas de acceso.
En la Tabla 6 se detallan los juicios emitidos por el panel de expertos en el cuadro GRADE de evidencia a la recomendación.
Plan de implementación
Acciones necesarias para la implementación de la recomendación
1. Difusión, distribución y reconocimiento de una versión abreviada en formato digital e impreso para los Hospitales de tercer nivel de la provincia de Rio Negro.
2. Difusión, distribución y reconocimiento de la versión completa en formato digital para los Hospitales de tercer nivel de la provincia de Rio Negro.
Barreras de implementación
1. Falta de adherencia por parte de los profesionales de salud a la recomendación.
2. Reducción en la provisión de la droga por parte del productor.
3. Falta de presupuesto hospitalario para hacer frente a la compra de tocilizumab.
Estrategias de implementación
1. Difusión, distribución y reconocimiento de la versión abreviada y completa en formato digital para los Hospita les de tercer nivel de la provincia de Rio Negro.
2. Presentación del proceso de la construcción de la recomendación en reuniones virtuales con representantes de los servicios de clínica médica y terapia intensiva de los hospitales de tercer nivel de la provincia de Rio Negro.
3. Compra centralizada por parte del Ministerio de Salud.
4. Generación de comités hospitalarios para dar sus tento a la elección de pacientes de mayor probabilidad de beneficio frente a la incertidumbre en el acceso para el universo completo de pacientes con enfermedad grave y crítica y la falta de aprobación por ANMAT.
Indicadores de proceso
1. número de pacientes hospitalizados con COVID grave y crítica que reciben tocilizumab / total de pacientes hospitalizados con COVID grave y crítica,
2. número de médicos capacitados que indican tocili zumab para pacientes hospitalizados con COVID grave y crítica/ número total de médicos capacitados.