PUNTOS CLAVE
Conocimiento actual
• La gran mayoría de los individuos generan anticuerpos luego de la infección por SARS-CoV-2 que permanecen detectables por un período de tiempo aún no bien esta blecido.
Contribución del artículo
• Comprobamos que todos los pacientes estudiados se roconvirtieron IgM e IgG; la IgG permaneció detectable hasta los 6 meses (período de seguimiento). Estrati ficamos los patrones de seroconversión; el sincrónico mayoritario le restaría utilidad a la IgM aislada como indicador de respuesta aguda. La metodología utilizada reflejó adecuadamente la cinética de anticuerpos.
En diciembre de 2019 se diagnosticaron los primeros casos en Wuhan, China, de una neumonía de caracterís ticas semejantes al síndrome respiratorio agudo severo (SARS) causado por el SARS-CoV en 2003. A principios de enero de 2020 se aisló por primera vez el nuevo coro navirus SARS-CoV-2 (Severe Acute Respiratory Syndro me Coronavirus type 2), la enfermedad causada por él se denominó COVID-19 (Coronavirus disease 2019). El virus se diseminó hacia países de los diferentes continentes y el 11 de marzo de 2020 la OMS declaró la pandemia. El primer caso de COVID-19 y aislamiento del SARS-CoV-2 en Argentina fue el 3 de marzo del 2020 y el 7 de marzo el Ministerio de Salud confirmó la primera muerte en el país y de América Latina: un hombre de 64 años con enfermedades preexistentes (diabetes, hipertensión e insuficiencia renal).
Los coronavirus circulan con frecuencia y en general producen enfermedades respiratorias leves. Hasta la aparición de la enfermedad COVID-19, las infecciones graves fueron producidas por dos β-coronavirus: el ya mencionado SARS-CoV y el MERS-CoV causante del Sín drome Respiratorio del Oriente Medio (MERS) en 20121-4.
La enfermedad COVID-19 es un desorden multisistémi co con marcadas alteraciones bioquímicas de inflamación, hipercoagulabilidad y daño orgánico. La historia natural se desarrolla básicamente en tres fases clínicas: el inicio de la enfermedad se caracteriza por la presencia de síntomas gripales (odinofagia, tos seca, dificultad respiratoria, entre otros); algunos pacientes progresan a la siguiente fase, caracterizada por neumonía, con radio-opacidades pulmonares bilaterales con el típico aspecto de “vidrio esmerilado” en los estudios de imágenes. Aquellos pa cientes que progresan a una tercera fase presentan un estado hiperinflamatorio con infiltración de macrófagos y neutrófilos, liberación de citoquinas y elevación de los marcadores de inflamación, pudiendo desarrollar un síndrome de distress respiratorio5.
La gran mayoría de los afectados producen anticuer pos específicos contra el SARS-CoV-2. Sin embargo, aún continúa siendo objeto de estudio su declinación y su desaparición, si la presencia de dichos anticuerpos confiere inmunidad contra las re-infecciones y cuál debería ser el umbral de protección. Por otra parte, la re-infección por SARS-CoV-2 ya ha sido comunicada y, en nuestro país, está definida por consenso, cuando en un individuo nuevamente sintomático, la segunda rt-qPCR (Reverse Transcriptase Quantitative Polimerase Chain Reaction) es detectable después de un período libre de síntomas mayor o igual a 45 días posteriores a la primera PCR positiva6,7.
En relación a los coronavirus, se sabe que los anticuer pos contra el SARS-CoV y el MERS-CoV decaen con el tiempo, y hay informes de re-infecciones con coronavirus homólogos dentro de los 80 días luego de un episodio previo8. El perfil de anticuerpos contra el SARS-CoV tiene un patrón típico de producción de IgM e IgG; la IgM desaparece al final de la semana 12 y la IgG persiste más tiempo, indicando que puede desempeñar un papel protector2,9,10. Por su parte, el SARS-CoV-2 ingresa al organismo y se une a la enzima convertidora de angioten sina 2 presente en las células diana mediante la proteína S (Spike). El dominio RBD (receptor-binding domain) de la proteína S es altamente divergente de otros Coronavirus, y constituye el blanco primario de los anticuerpos “neutra lizantes”, fundamentales para frenar la propagación del virus al bloquear su unión al receptor celular.
Desde el comienzo de la pandemia se han publica do numerosos trabajos estudiando el comportamiento y la duración de los anticuerpos específicos contra el SARS-CoV-211-14. Conocer su presencia, el momento de la seroconversión y la persistencia en el tiempo de los mismos, podría representar una herramienta que permita su empleo en la vigilancia epidemiológica de la infección, la evaluación de la duración de la inmunidad protectora contra una posible reinfección y el riesgo de padecer un nuevo episodio de COVID-19. En la prác tica clínica, permitirá elegir la prueba adecuada en el momento oportuno y hacer una correcta interpretación de su resultado en cada paciente. Hasta el momento, los estudios serológicos han cumplido un rol importante en el diagnóstico en aquellos casos con una evolución mayor a 7 días, con PCRs negativas y persistiendo la alta sospecha de COVID-19.
En el presente trabajo estudiamos el patrón de la respuesta humoral de anticuerpos específicos anti SARS-CoV-2, IgM e IgG, su cinética de aparición, magnitud de la respuesta y posible negativización, en pacientes hospitalizados por COVID-19 en el Hospital de Rehabi litación Respiratoria María Ferrer (HRRMF) de la ciudad de Buenos Aires (Argentina) y relacionamos ese patrón de respuesta con diferentes parámetros demográficos y clínicos de la población estudiada.
Materiales y métodos
Estudio de cohorte, prospectivo (tiempo de seguimiento máxi mo de 6 meses). Se incluyeron pacientes con enfermedad COVID-19 hospitalizados entre el 18 de agosto de 2020 y el 6 de febrero de 2021. El HRRMF es un hospital público, monovalente, especializado en enfermedades respiratorias que, desde el comienzo de la pandemia, fue afectado a la atención de pacientes con COVID-19. Los criterios de inter nación y gravedad se tomaron según las recomendaciones de la autoridad sanitaria local15.
Se dispusieron muestras seriadas de suero o plasma (he parina de litio) de los pacientes (desde el ingreso al hospital, durante su internación y luego de su alta institucional) para el análisis de los anticuerpos específicos IgM e IgG según los siguientes intervalos de tiempo desde el inicio de los sín tomas: 1) 1-7 días; 2) 8-14 días; 3) 15-21 días; 4) al mes; 5) 2 meses; 6) 3 meses; 7) 4 meses; 8) 6 meses. Las muestras fueron separadas en alícuotas y guardadas a -20 °C hasta su procesamiento en un equipo miniVidas (Biomerieux) en uso en nuestro laboratorio. Para la detección tanto de IgM como IgG específicas para SARS-CoV-2 se utilizó el ensayo cualitativo, automatizado, VIDAS® SARS-CoV-2 IgM y VIDAS® SARS-CoV-2 IgG (Biomerieux) basado en un inmunoensayo enzimá tico de dos pasos combinado con un ensayo de fluorescencia ligado a enzima (ELFA), que utiliza el antígeno recombinante RBD de la proteína viral S, subunidad S1. Se obtiene un valor índice (VT), relación entre el RFV (relative fluorescent value) de la muestra y el RFV del estándar. Es negativo cuando VT < 1 y positivo si ≥ 1. El equipo cumple con los procedimien tos habituales de mantenimiento, controles y calibraciones establecidos según nuestra política de calidad, siguiendo las buenas prácticas de laboratorio y en conformidad con las recomendaciones del fabricante. Además, participamos de un Programa local de Control Interlaboratorios de serología SARS-CoV-2 provisto por el Hospital de Pediatría Juan P. Garrahan (al momento de la elaboración del manuscrito, en desarrollo del segundo ciclo). El desempeño del laboratorio ha sido 100% de muestras correctamente clasificadas tanto para IgM como para IgG.
Se compararon los valores del VT de cada muestra tanto para IgM como IgG en función de los intervalos de tiempo establecidos en el protocolo. Se calculó la mediana y rango intercuartílico de dichos VT. El criterio diagnóstico de CO VID-19 fue por detección del genoma viral SARS-CoV-2 por rt-qPCR en tiempo real. Se registraron: fecha del inicio de síntomas, parámetros clínicos y bioquímicos al ingreso (pro tocolizados en la institución), comorbilidades, intercurrencias clínicas, diferentes esquemas de medicación implementados y evolución hospitalaria.
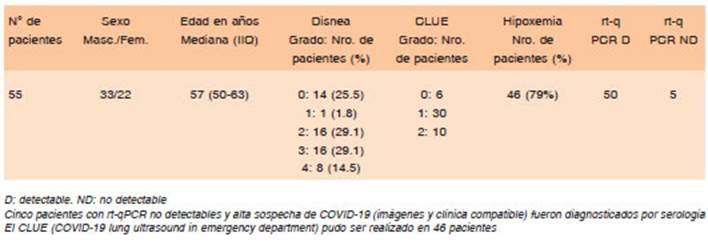
En cuanto al cuadro clínico, para la evaluación del grado de disnea al ingreso se utilizó la escala de disnea modificada del Medical Research Council (mMRC) (0 a 4). Frente a la no disponibilidad de tomografía computarizada (TC) en el hos pital, para valorar la gravedad de la neumonía al ingreso de los pacientes se utilizó la ecografía pulmonar basándose en el protocolo CLUE (COVID-19 lung ultrasound in emergency department)16, siendo la puntuación de 0 a 3 (normal, leve, moderado y grave respectivamente). Se evaluó la hipoxemia al ingreso definida como pO2 < 80 mmHg, considerando ajuste por edad según la fórmula pO2 = 104 - (0.27 × años)17.
Análisis estadístico: Para el análisis descriptivo, las variables cuantitativas se reportaron como media y desviación estándar o mediana e intervalo intercuartílico (IIQ) (percentil 25 y 75) según su distribución. Para evaluar la distribución de los datos se utilizaron histogramas y el test de Shapiro-Wilk. Para la evaluación de las variaciones en la concentración de anticuerpos a lo largo del tiempo se utilizó un modelo generalizado de efectos fijos; el tiempo se modeló como variable categórica. Para evaluar si alguna variable independiente se asociaba a una modificación en la concentración de anticuerpos a lo largo del tiempo se generaron términos de interacción utilizando el tiempo como variable categórica. Se consideró un valor de p < 0.05 como estadísticamente significativo. Todos los cálculos estadísticos se realizaron utilizando un software estadístico comercial (STATA 13.0, Stata Corporation, College Station, TX).
El estudio fue realizado en concordancia con las normati vas éticas de la Declaración de Helsinki de 1975 y aprobado por los Comités de Ética en Investigación de la institución y del Ministerio de Salud de la Ciudad de Buenos Aires. El consentimiento informado fue verbal durante el periodo de aislamiento epidemiológico y luego escrito y firmado en la primera visita al laboratorio.
Resultados
Se enrolaron 98 pacientes internados por COVID-19; 43 de ellos fueron desestimados tempranamente por falle cimiento en las primeras dos semanas, alta temprana sin posibilidad de seguimiento, o abandono del protocolo. Quedaron en seguimiento 55 pacientes. Las caracte rísticas demográficas, clínicas al ingreso y moleculares de la población estudiada se describen en la Tabla 1.
Cuarenta y cuatro pacientes (80%) presentaban una o más comorbilidades y/o factores de riesgo asociados a COVID-19 (Fig. 1). Al momento de la internación, los pacientes presentaban una evolución desde el inicio de los síntomas de 6 días (IIQ: 4-8). La mediana de tiempo de hospitalización fue de 11 días (IIQ: 7-18). Catorce pacientes (25%) requirieron internación en Unidad de Cuidados Intensivos (UCI). Ocho pacientes (15%) falle cieron. La Figura 2 describe el requerimiento de oxígeno suplementario y tipo de soporte ventilatorio máximo necesario en los pacientes estudiados.

Fig. 2 Requerimiento de oxígeno suplementario y tipo de soporte ventilatorio en los 55 pacientes estudiados
Se procesaron en total 692 determinaciones entre IgM e IgG. La Figura 3 muestra la cinética de los anticuerpos específicos IgM e IgG y su estratificación en función de los intervalos de tiempo adoptados.
El 100% de los pacientes estudiados seroconvirtieron ambas inmunoglobulinas en algún momento del segui miento. El 98% antes del día 20 desde el inicio de los síntomas y, en un paciente con cáncer de pulmón, la IgM apareció entre los días 21 y 49, posteriormente a la IgG que se positivizó el día 20.
En 40 pacientes (73%) se pudo evaluar el tiempo de aparición de las inmunoglobulinas. La mediana de tiempo a la seroconversión fue de 10 días para IgM (IIQ: 7-13) y de 10.5 días para IgG (IIQ: 7-13). En el 80% de los pacientes el patrón de seroconversión fue sincrónico, es decir, ambas inmunoglobulinas aparecieron en el mismo intervalo de medición; en el 10% apareció primero la IgG y en el 10% restante la IgM antecedió a la IgG. Un total de 28 pacientes (51%) fueron seguidos hasta los 6 meses y en ninguno de los casos se observó desaparición del anticuerpo IgG. En 43 pacientes (73%) se pudo evaluar la mediana de tiempo hasta la desaparición de la IgM siendo de 91 días (IIQ: 61-131). En 5 pacientes (12%) la IgM continuaba positiva hasta el sexto mes, uno de ellos sin factor de riesgo ni comorbilidades conocidos.
La sensibilidad clínica de los anticuerpos IgM e IgG en conjunto fue: durante la 1ra semana posterior al inicio de los síntomas 30% (IC95% 21.4-40.7); entre la 2da y 3ra semana 72% (IC95% 63.5-79.5); 4ta semana 91% (IC95% 87.0-94.4) y 96% (IC95% 90.6-98.3) a las 8 semanas.
Posteriormente se compararon las medianas y ran gos intercuartílicos frente a diferentes variables: sexo, edad, factores de riesgo definidos para COVID y otras comorbilidades (enfermedad renal crónica, obesidad, diabetes, hipertensión arterial, enfermedad cardiovascu lar, enfermedades respiratorias crónicas - enfermedad pulmonar obstructiva crónica (EPOC), enfermedad pul monar intersticial difusa (EPID), asma-miastenia gravis, antecedentes de tabaquismo e inmunocompromiso). Se encontraron diferencias significativas en las curvas de anticuerpos para algunas de las variables analizadas, en algunos casos en ambas inmunoglobulinas y en otros solo en una de ellas.
En el modelo generalizado de efectos fijos se encon traron diferencias estadísticamente significativas en las curvas de anticuerpos IgM según sexo, edad, EPOC e inmunocompromiso (Fig. 4).

Fig. 4 Evolución de los anticuerpos IgM en los intervalos de tiempo establecidos según sexo, edad, presencia de EPOC e inmunocompromiso.
Se encontró diferencia significativa en las curvas de anticuerpos según el sexo, siendo mayor la respuesta de IgM en los hombres que en las mujeres. Tomando en cuenta la mediana de la edad de los pacientes estudiados (56 años) se observó mayor respuesta, en ambas inmu noglobulinas, en el grupo de mayor edad (> 56). En los pacientes con EPOC se observó una mayor respuesta de IgM, mientras que en los pacientes con inmunocompro miso la respuesta de IgM fue menor.
Adicionalmente, se observaron diferencias estadís ticamente significativas en las curvas de anticuerpos IgG en pacientes con EPID y en aquellos que recibieron corticoides como parte de su terapia (8mg. dexametasona por 10 días) (Fig. 5). En el caso de los pacientes con EPID se observó una respuesta disminuida de IgG respecto de los que no la tenían. En los que recibieron durante su internación corticoides como parte de su terapia, se observó una respuesta aumentada de IgG.
Discusión
La totalidad (n = 55) de los pacientes estudiados serocon virtieron tanto la IgM como la IgG. Si bien se encuentran en la bibliografía diferentes porcentajes de pacientes que no desarrollan anticuerpos, en general los estudios incluyen pacientes leves o asintomáticos, mientras que nuestro trabajo se los excluye, siendo una cohorte más homogénea, en la que fueron incluidos solamente aque llos que tuvieron una forma de la COVID-19 que requirió internación.
El tiempo de aparición de las inmunoglobulinas es coincidente con otros informes18,19. Es importante aclarar que, si bien el estudio se realizó en un total de 55 pacientes, para establecer el momento de aparición de cada inmunoglobulina se tuvieron en cuenta solamente aquellos pacientes en los que se pudo observar seroconversión entre 2 muestras en intervalos consecutivos, definida como la variación de VT < 1 a VT ≥ 1. Además, para este análisis, se descartaron aquellos en los que no fue posible obtener una muestra basal con VT < 1. El mismo criterio se aplicó para establecer el tiempo de desaparición de la IgM, siendo en este caso la variación en intervalos consecutivos de VT ≥ 1 a VT < 1. Si bien la existencia de los tres patrones de seroconversión hallados ya ha sido comunicada por otros autores, dichos trabajos no muestran las proporciones de cada patrón20,21. Dado que solo el 10% de las IgM antecedió a las IgG y que la gran mayoría tuvo un patrón sincrónico (80%) no pareciera ser de utilidad la determinación de IgM ais lada como indicador de respuesta aguda.
Solo en 28 pacientes se pudo completar el seguimiento previsto, ya que los restantes no completaron el protocolo por fallecimiento, abandono del mismo o para evitar su exposición debido a la alta circulación del virus desde abril de 2021. De cualquier manera, es destacable que en todos ellos la IgG permaneció detectable hasta los 6 meses. Si bien se requerirían cohortes mayores para fortalecer estos resultados, actualmente la vacunación ha cambiado el estatus inmunológico de la población, siendo más difícil incluir pacientes que no tengan al menos una dosis del esquema vacunal. Un resultado llamativo fue la persistencia de la IgM a lo largo de los 6 meses en 5 pacientes; esto podría deberse a una persistencia de antígenos virales en algunos sitios del organismo que actúan como reservorio, estimulando al sistema inmune, al igual de lo descripto en otros virus14,22. Se necesitan estudios complementarios y específicos sobre la inmu nidad en este grupo de pacientes para comprender este comportamiento.
Si bien se considera de riesgo a los mayores de 65 años, en nuestra cohorte la mediana de edad fue 56 años, comparable a la informada en el estudio multi céntrico realizado en pacientes de terapia intensiva en Argentina (SATICOVID)23-25. Por ello, para la compara ción en el modelo lineal fijo, la edad se dicotomizó en función de dicha mediana. En los pacientes > 56 años observamos un nivel mayor de IgM, del mismo modo que entre hombres y mujeres, siendo mayor en los hombres. En un estudio (en prensa) de la Universidad de Tel Aviv sobre 26 000 personas, el grupo de Noam Shomron halló diferencias en la cantidad de anticuerpos con la edad y el sexo26. Ellos observaron que la tasa de anticuerpos comienza a aumentar a partir de los 51 años; a su vez, entre los hombres, encontraron mayores niveles de anticuerpos a una edad más temprana. La patogenia sesgada por el sexo en la enfermedad COVID-19, no se comprende correctamente, pero podría ser multifac torial27-29. En nuestra serie, como describe el gráfico 4, la IgM fue más alta en los hombres.
Respecto al comportamiento de los anticuerpos en relación a las comorbilidades y factores de riesgo, en los pacientes con EPOC la respuesta de IgM estuvo aumentada mientras que en los inmunocomprometidos la IgM fue menor como mencionan otros autores13. Las pruebas serológicas para cualquier patógeno en individuos inmunocomprometidos siempre generan problemas de interpretación. La respuesta serológica contra el SARS-CoV-2 en las personas infectadas por el virus de la inmunodeficiencia humana (HIV) no se ha descrito bien. Contrario a lo comunicado en un caso de la literatura30, en el que la respuesta de anticuerpos fue tardía, en el único paciente HIV positivo de nuestra serie, cuya PCR fue negativa, el diagnóstico se confirmó por la detección de IgM e IgG específicas a los 4 días del inicio de los síntomas. En pacientes con cáncer, Liu y col. hallaron una prevalencia inferior de anticuerpos IgM e IgG específicos al día 21 desde el inicio de los síntomas, comparado con otros pacientes hospitalizados por COVID-1931. En nuestro paciente con cáncer observamos un comportamiento similar al día 21, pero al haber hecho un seguimiento longitudinal observamos, además, una aparición tardía de ambas inmunoglobulinas. El hallazgo de una disminución de la IgG específica en aquellos con EPID, podría deberse al compromiso inmunológico asociado a algunas de las enfermedades autoinmunes de dichos pacientes (artritis reumatoidea y enfermedad mixta del tejido conectivo).
En los enfermos que recibieron durante su internación corticoides, como parte de su terapia, se observó una respuesta aumentada de IgG, un efecto opuesto al obser vado por otros autores, que hablan del efecto supresor del sistema inmune de los corticoides, planteando que provocan una disminución de la IgG32.
Existen estudios que relacionan la enfermedad grave con la presencia de un mayor título de anticuerpos en la fase aguda12,20,33-35. Analizando nuestra cohorte, aque llos pacientes que requirieron cuidados críticos, ARM y los que fallecieron vs. los que tuvieron un curso menos grave, no observamos mayores niveles de anticuerpos en los críticos ni en aquellos que fallecieron. Como ya fue mencionado, no se realizó la comparación con casos leves. Por lo observado en nuestro trabajo coincidimos con Lou y col. en que son muchos los factores que afec tan la respuesta inmune al SARS-CoV-2, incluyendo el tratamiento farmacológico previo y el instaurado para la COVID-19 entre otros19.
Como limitaciones de nuestro estudio, la primera que debemos mencionar, es el tamaño de la muestra. Sin embargo, no todas las experiencias publicadas de cohortes mayores emplean una única metodología y son muy variables los tiempos elegidos para la medición de los anticuerpos. Frente a la gran heterogeneidad de las publicaciones encontradas, respecto al análisis de las características demográficas y clínicas, algunos de nuestros hallazgos coinciden con las experiencias de ciertos autores, mientras que otros no. Otro aspecto es que no podemos afirmar que los anticuerpos estudiados impliquen inmunidad, ya que no realizamos la determi nación de anticuerpos neutralizantes por el grado de complejidad de la misma, poco accesible en nuestra práctica clínica diaria. Pero cabe destacar que existen trabajos publicados en los que se ha visto una muy buena correlación entre los anticuerpos neutralizantes y los anticuerpos dirigidos contra el dominio RBD de la proteína S y, particularmente, con el método utilizado (VIDAS® SARS-CoV-2)36-41. Por otra parte, en nuestra experiencia, la metodología utilizada refleja adecuada mente la cinética de anticuerpos, mostrando la aparición, pico y descenso de los mismos de acuerdo a la evolución clínica de los pacientes. Como es de notar, existe una dispersión de valores de VT por fuera del rango intercuar tílico, sobre todo en el intervalo 1. Suponemos que esto podría deberse a una subestimación de los síntomas de inicio de algunos pacientes, en particular aquellos con patología respiratoria crónica, por lo que la fecha de inicio de los síntomas registrada podría ser posterior a la real. Por otro lado, la persistencia de anticuerpos IgG hallada también es heterogénea en sus valores índices (entre 1.48 y 35.7). Gaebler y col. correlacionaron nive les mayores de anticuerpos anti-RBD IgG hasta los 6 meses con la persistencia de síntomas post-agudos en los individuos estudiados14. Esta variable no fue incluida en nuestro diseño, por lo que no pudimos comprobarlo. Faltan aún estudios que interpreten clínicamente estas diferencias observadas.
Un punto importante en el que todavía falta avanzar en estas pruebas diagnósticas, es la necesidad de contar con ensayos serológicos comerciales que puedan compararse entre sí. La OMS desarrolló un Estándar Internacional para armonizar la expresión de los resultados entre los diferentes ensayos comerciales disponibles42,43. Estudios realizados a posteriori de este protocolo han evaluado la sensibilidad analítica del test utilizado con un intervalo de diluciones del primer estándar internacional de la OMS para anticuerpos anti-SARS-CoV-2 (NIBSC, código 20/136). El valor de corte de VIDAS® SARS-COV-2 IgG II (índice=1.00) se calculó como equivalente a 20.33 BAU/ml (unidad de unión de anticuerpos/ml - binding antibody units). La correlación con las unidades BAU da robustez a la metodología empleada para la cuantificación de la IgG. Todavía existe incertidumbre en la interpretación de los niveles de anticuerpos necesarios para asegurar una inmunidad protectora, y se requiere continuar trabajando al respecto13. Del mismo modo, la sensibilidad clínica obtenida en nuestra cohorte, podría no ser reproducible en una población con enfermedad leve o asintomática.
Al momento de realizar este trabajo, no se encontraba disponible la vacuna en nuestro país, por lo que la pobla ción estudiada no estaba inmunizada contra SAR-CoV-2. Con el desarrollo de las diferentes vacunas y sus dife rentes epítopes, nos encontramos en un nuevo escenario respecto a los ensayos de anticuerpos específicos, donde seguramente deberán redefinirse la utilidad clínica, diag nóstica, epidemiológica y de evaluación de la protección adquirida. En este momento, en la población ya vacunada, las pruebas serológicas no serían recomendables con fines de diagnóstico para la infección por SARS-CoV-2, pero podrían ser de utilidad para guiar posibles refuerzos futuros de las vacunas o políticas de revacunación, como ocurre con otras enfermedades inmunoprevenibles. Final mente, continúa siendo de utilidad evaluar la presencia de anticuerpos en niños y adolescentes (a la fecha de la redacción de este manuscrito aún no incorporados al plan de vacunación), con sospecha de síndrome inflamatorio multisistémico asociado a COVID-19 (SIM-C) que se presenta alrededor de los 45 días posteriores al síntoma inicial leve.
Es oportuno destacar que, además de la respuesta de anticuerpos, sabemos hoy que las vacunas y la infección natural generan inmunidad celular contra el SARS-CoV-28.
Podemos concluir, en base a nuestro estudio y frente a la gran cantidad de trabajos publicados, que deberían continuar los esfuerzos hacia el desarrollo de un algoritmo de evaluación global de la protección inmunológica contra SARS-CoV-2, en cada individuo y según el escenario clínico.