La leucemia linfoblástica aguda (LLA), al igual que el resto de las neoplasias hematológicas, incrementa el riesgo de padecer un segundo cáncer primario. En el caso de la LLA, lo más frecuente es que se asocie a linfoma de Hodgkin, cáncer de piel in situ e invasor, tumores endocrinos y de riñón1. Presentamos el caso de una mujer de 40 años con esta enfermedad que desarrolló un cáncer de cuello uterino, del que no hemos hallado reportes como segundo cáncer primario asociado a LLA, que además se manifestó como un síndrome del psoas maligno y signos radiológicos que simulaban un absceso del músculo psoas izquierdo.
Caso clínico
Una mujer de 40 años con diagnóstico de LLA B común de alto riesgo se internó de forma programada para recibir el quinto ciclo de quimioterapia, correspondiente a la consolidación.
Su diagnóstico se había hecho 10 meses antes en otra ciudad del interior del país a raíz de la aparición de petequias y hematomas espontáneos en los miembros inferiores, junto con metrorragia. En ese momento, le habían realizado solo una ecografía ginecológica transvaginal informada como normal y todas las manifestaciones habían sido atribuidas a la trombocitopenia (21 000/mm3). Fue derivada a nuestro hospital para iniciar el tratamiento.
Había respondido favorablemente a los ciclos anteriores, no había tenido complicaciones relacionadas a la quimiote rapia, y su enfermedad mínima residual al momento de la internación en cuestión era negativa. En el tiempo transcurrido desde el diagnóstico, las metrorragias prácticamente habían desaparecido.
Tenía antecedentes de ex-tabaquismo, infección por SARS-CoV-2 leve dos meses previos a la última internación. Había tenido 6 embarazos, 5 partos y 1 aborto.
Al ingreso refirió dolor inguinal izquierdo con irradiación al muslo, de 3 meses de evolución, con impotencia funcio nal, que cedía parcialmente con analgésicos no esteroides y tramadol. Además, manifestó tener diarrea de 4 días de evolución, sin moco, pus ni sangre, y dolor sordo en fosa iliaca derecha, sin fiebre o equivalentes. En el examen físico estaba hemodinámicamente estable y afebril. Se destacaba el dolor a la palpación profunda en fosa iliaca derecha, con defensa, sin reacción peritoneal, y signo del psoas positivo a la izquierda. En el laboratorio de ingreso presentó 11 000 leucocitos/mm3 (83% de neutrófilos). La prueba de HIV y de embarazo fueron negativas.
Una tomografía de abdomen y pelvis con contraste endo venoso evidenció una imagen con refuerzo marginal que com prometía el músculo psoas ilíaco izquierdo, interpretada como un absceso, y generaba uronefrosis homolateral, además de signos de tiflitis (Fig. 1). Evolucionó sin fiebre ni diarrea, completó 7 días de tratamiento antibiótico con piperacilina-tazobactam y vancomicina. Los hemocultivos resultaron nega tivos y en el cultivo de la materia fecal desarrollaron gérmenes habituales de la flora intestinal. La detección de antígeno para C. difficile fue negativa.

Fig. 1 Tomografía computarizada de abdomen y pelvis con contraste endovenoso, corte coronal (A) y axial (B). En ambos se observan engrosamiento circunferencial del ciego (cruces) e imagen heterogénea comprometiendo el psoas izquierdo (asteriscos), gene rando uronefrosis homolateral (círculo rojo en A)
Se le practicó una punción biopsia del psoas izquierdo guiada por tomografía con obtención de escaso material de consistencia semisólida sin desarrollo microbiológico, inclu yendo el cultivo para bacilos ácido-alcohol resistentes. La citometría de flujo no detectó linfocitos atípicos. El análisis histopatológico informó tejido fibroso infiltrado por nidos y cordones correspondientes a carcinoma escamoso queratini zante moderadamente diferenciado acompañado de músculo estriado esquelético (Fig. 2).
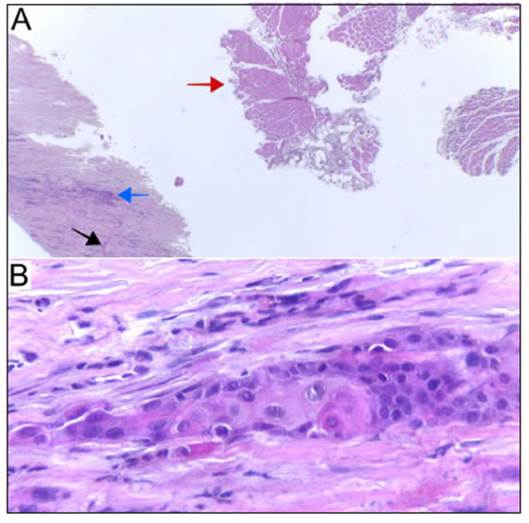
Fig. 2 Biopsia por punción del músculo psoas izquierdo. A: Tejido fibroso infiltrado por nidos (flecha azul) y cordones (flecha negra) correspondientes a carcinoma escamoso moderadamente diferenciado (H&E, 40X). La flecha roja señala músculo estriado esque lético. B: Nido de infiltración a mayor aumento (H&E 400X)
El examen ginecológico dirigido evidenció un cuello uterino retraído hacia la pared lateral izquierda, duro pétreo y friable. La colposcopía demostró una lesión exofítica sangrante. Se tomaron muestras para su análisis histopatológico, que resul taron: 1) En hora 12, carcinoma escamoso moderadamente diferenciado con presencia de embolias linfovasculares (grado histológico 2), y 2) En hora 2, SIL (lesión intraepitelial escamo sa, por su acrónimo en inglés) de alto grado/CIN (neoplasia intraepitelial cervical)3.
El equipo interdisciplinario tratante decidió priorizar el tratamiento del cáncer de cuello uterino, y luego reiniciar el mantenimiento.
Por razones personales, la paciente decidió regresar a su localidad de residencia a más de 1500 km de nuestro hospital. Si bien no pudimos hacer un seguimiento clínico, sabemos que recibió radioterapia local sin mejoría de los síntomas.
Discusión
La LLA tiene una incidencia global del 1-4.8 por 100 000 habitantes. Dentro de los factores de riesgo para pade cerla se encuentran los hereditarios, defectos genéticos y exposición a radiación y/o químicos. Si bien en el adulto representa solo el 12% de los casos de leucemia, en los niños es responsable del 80%2.
El desarrollo de un cáncer en alguien que ha tenido otro en el pasado se denomina segundo cáncer primario y puede aparecer entre meses y años desde el diagnós tico original3. Un estudio informó que el riesgo relativo (RR) global de un segundo cáncer primario era de 2.13 luego del diagnóstico de LLA1. Dentro de los 14 tipos de cáncer registrados, los más frecuentes fueron linfoma de Hodgkin (RR = 14.65), cáncer escamoso de piel, in situ (7.81) e invasivo (5.2), tumores endocrinos (5.61), cáncer renal (5.02), linfoma no-Hodgkin (4.92) y -en el límite de la significancia estadística- cáncer de mama (1.07), entre otros, sin mención del de cuello uterino. Entre las enfermedades hematológicas malignas, la LLA fue la que registró la menor tasa de segundo cáncer primario, coincidente con su menor supervivencia.
La prevalencia de las metástasis musculares origina das en tumores sólidos varía entre 0.03-5.6 % en autop sias y 1.2-1.8% en series radiológicas4. Esta llamativa baja frecuencia contrasta con lo esperable por la rica vascula rización del músculo estriado esquelético y con el hecho de que éste representa el 50% del peso corporal total. Se ha propuesto que la contracción constante de las fibras musculares, la producción local de ácido láctico, la inhi bición de la invasión celular por inhibidores de proteasas en la membrana basal, la presencia de factores peptídicos musculares, y la actividad antitumoral de los linfocitos y/o células NK (asesinas naturales, por su acrónimo en in glés) dentro del músculo serían condicionantes negativos para el implante y crecimiento de las células tumorales5. Los tumores que más frecuentemente metastatizan en el psoas son el de pulmón, riñón, tiroides y melanoma6. Según su apariencia tomográfica, las metástasis mus culares pueden presentarse como masas nodulares con realce homogéneo con contraste (tipo I, el más frecuente - 46.5%), lesiones intramusculares similares a abscesos y realce en anillo (tipo II), infiltración difusa del músculo con engrosamiento y realce heterogéneo (III), calcifica ciones intramusculares múltiples (IV) y por último como hemorragia intramuscular (tipo V, con una frecuencia del 1.2 % de las metástasis musculares)4.
El síndrome del psoas maligno es una complicación sistémica del cáncer caracterizada por la infiltración de dicho músculo. Se manifiesta con una plexopatía lumbo sacra proximal, flexión dolorosa de la cadera y dolor con la extensión del psoas7.
La Agencia Internacional de Investigación en Cáncer dependiente de la Organización Mundial de la Salud esti mó una incidencia de cáncer de cuello uterino del 16.7 por 100 000 habitantes en 2020 en Argentina8. El cáncer es camoso de cuello uterino frecuentemente infiltra órganos pélvicos de forma directa y se disemina al retroperitoneo precavo9. El compromiso muscular es muy infrecuente y se documenta en estadios muy avanzados o en pacientes inmunosuprimidos, como en aquellos con SIDA5. Existen otras comunicaciones de metástasis musculares en el psoas simulando un absceso del músculo y hasta simu lando también una espondilodiscitis10-12.
La combinación temporal de diarrea, dolor abdominal en fosa ilíaca derecha, una imagen compatible con en grosamiento del ciego y una colección comprometiendo el psoas izquierdo nos orientaron al diagnóstico de un absceso del psoas secundario a una tiflitis, que creemos resultó un confundidor, ya que no se relacionó más que temporalmente con el diagnóstico principal. Es sabido que los abscesos del psoas pueden ser primarios cuando responden a la diseminación hematógena o linfática de un microorganismo, o secundarios cuando se generan por expansión directa por contigüidad, por ejemplo, de afec ciones intestinales y urinarias, y osteomielitis vertebral, entre otras13,14. Los elementos en contra de un proceso infeccioso eran la evolución crónica y la ausencia de fiebre y sus equivalentes, además de una leucocitosis limítrofe. El estudio histológico mediante biopsia por punción guiada por tomografía fue el elemento que definió y reorientó el diagnóstico.
No hemos encontrado en la literatura casos de cáncer de cuello uterino como segundo cáncer primario luego del diagnóstico de LLA. Otras hipótesis nos llevaron a cuestionarnos si la coincidencia temporal de ambas neo plasias habrá sido fortuita, o si tal vez existirá la pérdida de función de algún gen supresor de tumores involucrado, como algunos autores han postulado15.
Como conclusiones, si bien ha habido informes de me tástasis de cuello uterino en el músculo psoas simulando un absceso, esto es muy infrecuente especialmente cuan do no se asocia a SIDA. El caso nos recordó que, ante la ausencia de síntomas sistémicos sugestivos de infección, y ante la presentación crónica, debe considerarse el sín drome del psoas maligno como causa de cualquiera de las formas de presentación de las metástasis en el psoas. Por último, reportamos la asociación de LLA y cáncer de cuello uterino como segundo cáncer primario.














