Introducción al tratamiento anticoagulante con agentes orales directos
El tratamiento anticoagulante sigue siendo la mejor herra mienta para prevenir y controlar un evento trombótico en diferentes enfermedades del territorio venoso y arterial. Su uso ha crecido en las últimas décadas y se calcula que el 5% de la población mundial recibirá alguna droga anticoagulante en su vida|1. Existen diferentes agentes anticoagulantes, algunos de administración oral y otros parenterales (Tabla 1). Entre las drogas de administración oral, es cada vez más frecuente que los pacientes reciban los agentes anticoagulantes orales directos (ACOD o su sigla internacional en inglés DOACs), también denomi nados anticoagulantes NO anti-vitamina K (NOACs). Son medicamentos inhibidores específicos de factores de coagulación activados, que no requieren el ajuste de dosis con una determinación de laboratorio ya que tienen un efecto anticoagulante más predecible1-4. Con ellos se ha generado un nuevo escenario en la práctica de la anticoagulación5.
Todas las guías americanas y européas6-9 y las reco mendaciones de consensos nacionales e internaciona les10-12 hoy sugieren usar los DOACs como primera línea de tratamiento, antes que los clásicos antagonistas de la vitamina K (AVK) para pacientes con enfermedad trom boembólica (ETV)y fibrilación auricular (FA). Tanto las guías americanas como las europeas coinciden en que las ventajas de menor sangrado mayor y menor sangra do cerebral, sumado a la posibilidad de evitar controles hospitalarios y facilidades en la toma de una dosis fija sin interferencias con la dieta, permiten posicionar mejor a estos nuevos agentes sobre los dicumarínicos5-12.
En este trabajo se ha revisado la bibliografía más importante sobre los anticoagulantes directos y se han dado sugerencias de distintos referentes en el tema, para obtener un manuscrito actualizado, pero al mismo tiempo realista, sobre el mejor manejo de estos nuevos agentes en los diversos escenarios clínicos. Se trata de un documento de posición de un grupo de expertos en el manejo de DOACs que pretende dar lineamientos generales para el uso correcto de los anticoagulantes directos con una visión práctica, local y actualizada. La sistemática se basó en elaborar un manuscrito generado por los cuatro editores responsables y revisado por un equipo de referentes en el tema compuesto por seis he matólogos (doctores Casais, Korin, Fondevila, Giumelli, Aris Cancela y Rossi) cuatro cardiólogos (doctores Botto, Zaidel, Fitz Maurice y Bahit), dos bioquímicos (doctoras Scazziota y Martinuzzo) y un médico clínico (Dr Vazquez). Posteriormente, este texto fue reevaluado por los restan tes autores del manuscrito para dar su conformidad final sobrelas diversas aristas en el uso de los DOACs que se consideraron en el texto.
Estas recomendaciones para el manejo de los anticoa gulantes orales directos han sido concebidas como una herramienta de uso dinámico y sencillo para el apoyo de la actividad diaria de diferentes especialidades que utilizan a los DOACs en su práctica habitual. Las sugerencias que figuran en este texto posiblemente contribuyan a esclare cer las dudas que surgen con respecto a un grupo de me dicamentos que cada vez se utilizará en mayor frecuencia. Entender la herramienta y manejarla correctamente per mitirá ayudar a un mayor número de pacientes. En este consenso participan cardiólogos, clínicos, bioquímicos y hematólogos porque todas estas áreas se relacionan íntimamente con el uso de los DOACs. Las clínicas de anticoagulación son el lugar natural de contacto en caso de dudas o complicaciones con drogas antitrombóticas, por lo cual fomentamos el acceso de todos los enfermos anticoagulados a estas unidades, diseñadas para el ma nejo de un grupo singular de pacientes con alto riesgo de eventos trombóticos y hemorrágicos13.
El uso de los DOACs se ha incrementado en los últimos años, de manera tal que en algunos países de Europa y en los EE. UU. entre el 60 y 70% de los pacientes anticoa gulados de novo empiezan su tratamiento con alguno de estos agentes14. En Latinoamérica, y concretamente en Argentina, posiblemente el porcentaje de anticoagulados con los DOACs sea cercano al 20 o 30%. Sin embargo, este número crece constantemente y es muy probable que en el futuro lleguen a ser los medicamentos más usados como antitrombóticos orales. Es muy importante entender que a pesar de que los DOACs son un grupo muy distinto de drogas comparado con los antagonistas de la vitamina K (Tabla 2), los pacientes que los reciben están anticoagulados y por ende tienen mayor riesgo de sangrado. Debemos considerar que las medidas de ma nejo e instrucciones sobre cuidados son fundamentales, sin importar de qué anticoagulante oral estemos hablando.
Las personas que están en tratamiento con DOACs deben ser instruidos siempre por el médico que prescribe estos medicamentos15.
Por ejemplo, los pacientes deben estar en conocimien to de que no pueden recibir inyecciones intramusculares ni hacer una punción profunda de tejidos (pleurocente sis, punción lumbar, infiltración intraarticular) sin previa suspensión del agente, pero pueden vacunarse y recibir inyecciones subcutáneas. Tampoco pueden hacer acti vidades deportivas con alto riesgo de traumatismo como artes marciales, esquí, boxeo o lucha, etc. Siempre deben suspender el DOAC previo a una cirugía o extracción dentaria. Deben consultar al médico de inmediato en caso de hemorragias, aunque sean superficiales. El tratamiento anticoagulante, en la dosis correcta, rara vez es causa de sangrados espontáneos, por lo que, si estos ocurren, se debe descartar siempre una afección subyacente. En el caso de un traumatismo de cráneo siempre deben consultar a emergencias especialmente si hubo pérdida de conocimiento o es un traumatismo significativo porque se debe hacer una tomografía de cerebro de control. Los pacientes deben tener un teléfono de contacto con su médico o institución para cualquier emergencia. Como ya se ha mencionado, siempre puede ayudar el hecho de establecer un vínculo con la clínica de anticoagulación para educar al paciente. Un familiar debe ser instruido sobre el tratamiento anticoagulante y la importancia de no abandonarlo. Si es posible, entregarle al enfermo una car tilla o tarjeta donde se especifique la droga anticoagulante que recibe, la dosis y el motivo por el que se encuentra con este tratamiento. De esta forma se puede fomentar la adherencia del paciente al tratamiento13.
El sangrado sigue siendo la complicación más impor tante del uso de los agentes directos. La tasa informada de sangrado mayor con DOACs es de 4% en promedio16. Existe un grupo de pacientes que va a tener mayor riesgo de sangrado con el uso de las drogas anticoagulantes, especialmente en ciertas enfermedades del tubo digesti voy en ancianos considerados frágiles17.
Entre los marcadores de riesgo de hemorragia pode mos mencionar a la hipertensión arterial mal controlada, insuficiencia renal moderada o grave, la mala adherencia al tratamiento anticoagulante, el antecedente de un san grado clínicamente significativo con otro anticoagulante, tratamiento crónico con antiinflamatorios no esteroides o con antiagregantes como aspirina y al abuso de alcohol o hepatopatía. Estos pacientes que tienen alto riesgo he morrágico deberían ser supervisados en forma especial, posiblemente con una mayor contención familiar, medidas de gastro-protección, consultas más regulares/frecuentes con el médico y eventualmente, un ajuste de la dosis del medicamento anticoagulante14.
El objetivo de esta publicación es revisar las indicacio nes y contraindicaciones de los anticoagulantes directos y dar pautas para el manejo práctico de estos nuevos anticoagulantes en pacientes con diferentes escenarios clínicos. Dado que en este momento algunas de las pro puestas solo son sugerencias de manejo y expresan la opinión de los autores basadas en consensos de expertos nacionales e internacionales, la decisión de la conducta a seguir dependerá fundamentalmente del mejor criterio médico frente a cada paciente individual.
Los DOACs son agentes anticoagulantes orales que actúan inhibiendo en forma específica a los dos princi pales factores de la coagulación que intervienen en la formación de un trombo. Poseen una serie de ventajas, pero también algunas limitaciones, comparado con los clásicos anticoagulantes antagonistas de la vitamina K
Todos los médicos deben familiarizarse con sus pro piedades, indicaciones y manejo, ya que su uso se ha incrementado significativamente en los últimos años.
Características de los anticoagulantes orales directos, mecanismo de acción, catabolismo, farmacocinética y forma de administración
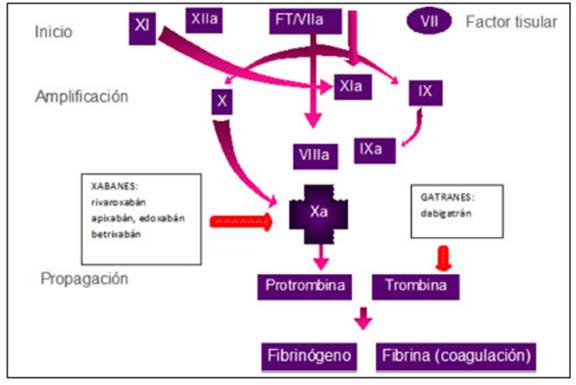
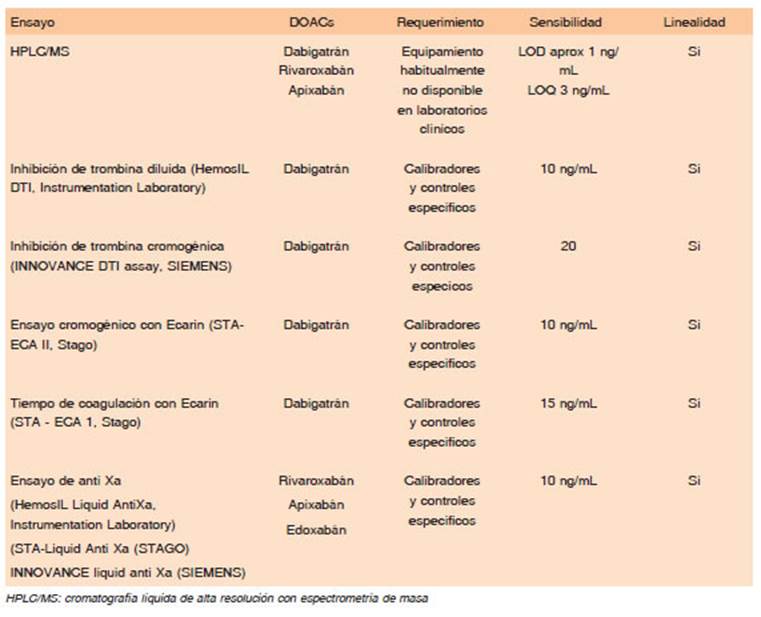
Los DOACs son medicamentos con un mecanismo de acción muy diferente a los anticoagulantes orales clásicos AVK, ya que inhiben en forma directa un solo factor en la hemostasia, ya sea a la trombina (factor IIa) o al factor Xa (Fig. 1). No necesitan control de laboratorio para evaluar la calidad del tratamiento y de hecho no existe por el momento una forma de monitoreo de su acción en sangre en la práctica diaria, que se correlacione con efectividad clínica o seguridad para evitar eventos hemorrágicos4-9. La dosis sugerida de cada uno de ellos es una dosis fija, sin ajustar al peso, pero se deben tomar ciertas precau ciones en pacientes que pesan menos de 50 kg o más de 120 kg. Una ventaja de estos medicamentos es que los alimentos no interfieren con su acción. Además, poseen una amplia ventana terapéutica y menor interferencia medicamentosa. Todo esto hace que los DOACs tengan un efecto anticoagulante más estable y predecible que los AVK1-4. Otra de las ventajas de este grupo de drogas, es que todos ellos presentaron menor sangrado cerebral cuando se los comparó con los AVK17. Sin embargo, tienen algunas limitaciones como el riesgo potencial de mala adherencia al tratamiento, especialmente en ancia nos que requieran uso prolongado del medicamento, al prescindir del monitoreo mensual de anticoagulación. Otro problema para considerar es que no todos los pacientes tendrán un antídoto disponible en forma inmediata, ya que únicamente contamos con agente reversor para el anti trombínico dabigatrán y solo se puede acceder al mismo en centros de alta complejidad. Tampoco se podrán usar los DOACs en todas las indicaciones clínicas en las que ya conocemos que los AVK son efectivos: en algunos casos la escasa experiencia o la falta de evidencia hará más prudente el uso de otro tratamiento anticoagulante, en otros los nuevos anticoagulantes no han funcionado y no pueden utilizarse4-9,14. Un escenario diferente se presenta en el laboratorio de hemostasia, por que no tenemos la necesidad del monitoreo del RIN y solo contamos con pruebas más complejas para medir la concentración de DOACs en sangre. Esto genera un nuevo paradigma en el uso de las pruebas de coagulación. Tener un estudio preoperatorio normal dejará de ser de utilidad de manera universal en el paciente anticoagulado con DOACs. Por otro lado, conocer la concentración en sangre de los DOACs no parece tener sentido en la mayoría de los pacientes con lo que debemos acostumbrarnos a no medir los niveles plasmáticos de estos agentes salvo en situaciones excepcionales18-20. La dosis es un tema que requiere mucha atención, los DOACs tienen dosis diferentes para cada indicación (FA, tratamiento de ETV, profilaxis de ETV) y en algunos casos, dosis diferentes dentro de la misma indicación (primeros días del evento de ETV vs. subsiguientes; primeros meses de ETV vs. Tratamiento alejado; FA en > 75-80 años vs. más jóve nes). Algunos se dan 2 veces al día y otros en 1 sola toma4,10,20,21. Todo lo anterior hace necesario que los DOACs sean manejados por médicos entrenados en el uso de estas drogas. Posiblemente una de las mayores limitaciones para el uso de DOACs sea el costo de la medicación para el paciente, comparado con el costo de los AVK.
Inhibidores orales de la trombina o “gatranes”: etexilato de dabigatrán
Actúan inhibiendo directamente a la trombina (en la vía final común de la formación del trombo) y la agregación plaquetaria inducida por trombina (Fig. 1) (Tabla 3).
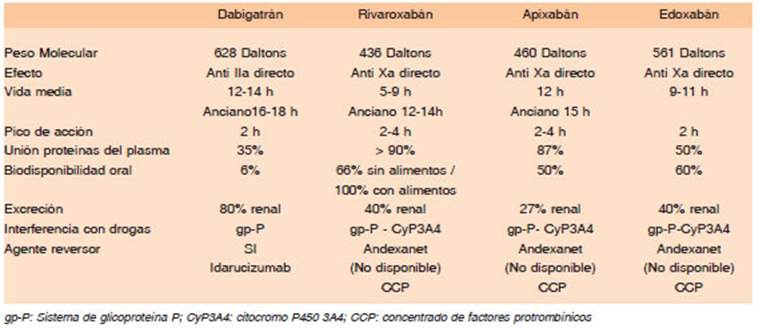
El etexilato de dabigatrán es una prodroga oral que rápidamente se transforma en la droga activa dabigatrán, mediante la acción de múltiples esterasas del tubo digesti vo, plasma e hígado4,21-27. Tiene una escasa biodisponibili dad oral de 6% y requiere de un medio ácido para mejorar su absorción. Su forma de presentación es en cápsulas compuestas por pequeños pellets con una concentración de 75, 110 y 150 mg de dabigatrán y de ácido tartárico. Su efecto máximo como anticoagulante es muy rápido, entre las 2 y 3 horas de la ingesta. Solo el 35% de la droga se une a las proteínas del plasma, por lo que es el único anticoa gulante directo potencialmente hemodializable. Tiene una vida media entre 12 y 17 horas, dependiendo de la función renal. La dosis no se ajusta por peso, pero varía según la indicación, edad y función renal del paciente. El dabigatrán atraviesa la barrera placentaria y no se puede usar durante el embarazo. Dado que se elimina principalmente por vía renal (80%), siempre debe calcularse el aclaramiento renal de creatinina mediante la fórmula de Cockcroft-Gault antes de iniciar un tratamiento con dabigatrán.
Aclaramiento de creatinina:
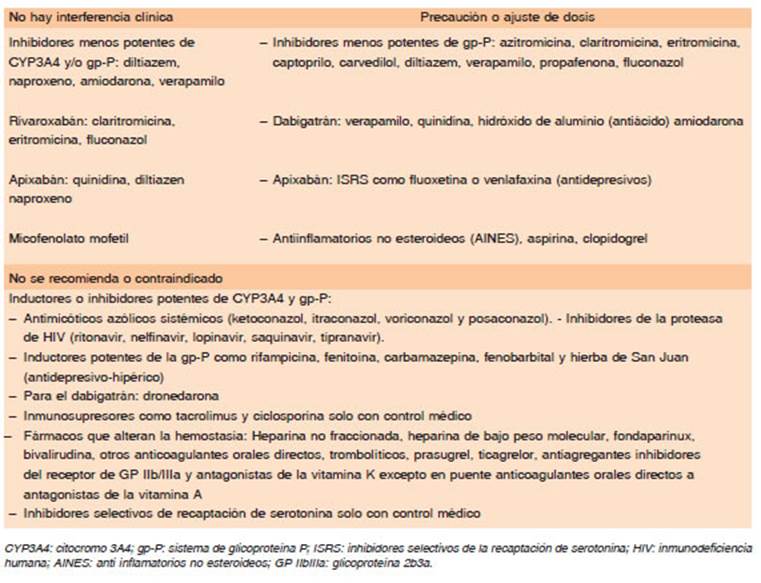
El dabigatrán es el DOAC que menor catabolismo he pático presenta y no tiene interferencia con medicamentos que afectan al citocromo P450. La interacción farmaco lógica es con los medicamentos que afectan el sistema de transporte de eflujos de la glicoproteína P (gp-P) (vía de eliminación intestinal). Para su seguimiento se debe controlar la función renal mediante el cálculo del aclara miento de creatinina, al menos dos o tres veces por año en ancianos y así definir si se mantiene la misma dosis de dabigatrán. Este control también debe realizarse en toda circunstancia clínica que potencialmente pueda alterar la función renal, como cuadros febriles, deshidratación o ante medicamentos nefrotóxicos, especialmente en los adultos mayores. Las cápsulas de dabigatrán están envasadas en blisters para protegerlas de la humedad y la luz y no se deben sacar del envase original hasta su uso, para evitar la desnaturalización de la droga. Tampoco se puede masticar, romper o abrir la cápsula, por lo que no se debe utilizar en pacientes con problemas de deglución o si se requiere de una sonda nasogástrica para administrar el medicamento. El dabigatrán puede producir malestar gástrico o dispepsia, hasta en el 10% de los pacientes, la recomendación en estos casos es ingerir la cápsula con abundante agua o con alimentos y evitar el decúbito luego de administrar el medicamento. Si los síntomas digestivos persisten, a pesar de estas medidas, se debe considerar cambiar a otro DOAC. Pacientes con cirugía bariátrica, bypass gástrico o con gastrectomía no deben utilizar dabigatrán porque su absorción puede estar com prometida, así como en caso de ostomías de alimentación (gastrostomía o yeyunostomía) ya que dependiendo de la ubicación del ostoma la absorción estará comprometida. Una dosis perdida de dabigatrán puede tomarse hasta 6 horas posteriores al horario programado, transcurrido ese tiempo, se omite la dosis y se continúa con la siguiente dosis programada. No se deben tomar “dosis dobles” para compensar. Es el único anticoagulante directo que cuenta con un agente reversor específico en nuestro medio, el anticuerpo monoclonal idarucizumab28,29. En Argentina, el dabigatrán cuenta con agentes genéricos de la droga.
Inhibidores orales del factor Xa o “xabanes”: apixabán, rivaroxabán y edoxabán
Son inhibidores directos, reversibles y selectivos que bloquean al factor Xa (FXa). Actúan en una etapa más temprana de la hemostasia al inhibir al complejo pro trombinasa. A diferencia de las heparinas son capaces de inhibir al FXa en forma independiente de la presencia de antitrombina. Se calcula que al inhibir una molécula del FXa se evita la formación de aproximadamente 1000 moléculas de trombina (inhibe la generación de trombina) (Fig. 1)4-10.
Es un inhibidor específico del FXa capaz de unirse tanto al FXa circulante como al que se encuentra formando parte del complejo protrombinasa. Se presenta en comprimidos de 2.5 y 5 mg que contienen lactosa como excipiente, por lo que no debe indicarse si existe intolerancia o alergia a la misma. Tiene buena biodisponibilidad por vía oral (50%) y su absorción no se altera con los alimentos. Se puede triturar el comprimido para su administración por sonda nasogástrica. Su efecto máximo se produce luego de 2 a 3 horas de la ingesta y su vida media es de 12 horas. Se une en un 87% a la albúmina por lo que no es posible hemodializarlo ni ultrafiltrarlo. Es uno de los DOACs con menor eliminación renal (27%) por lo que debe ser preferido en caso de falla renal moderada. Si bien existen algunos estudios en los que se lo utilizó en pacientes con insuficiencia renal grave (aclaramiento de creatinina < 30 ml/min), o en hemodiálisis, aún el nivel de evidencia es pobre y solo algunas guías de tratamiento recomiendan su empleo en pacientes con falla renal grave. Presenta interferencia medicamentosa con drogas que alteran al citocromo CYP3A4 hepático y es substrato del sistema de la gp-P. Se emplea en dosis fija en función de la enfermedad, pero se ajusta a cada persona, cuando la edad, peso y función renal son extremas. La presencia de dos de los siguientes tres factores, obliga a ajustar al apixabán a una dosis menor: pacientes mayores de 80 años, con peso menor a 60 kg o con un valor de creatini na > 1.5 mg/%. Una dosis perdida de apixabán, porque no se tomó cuando correspondía, puede tomarse hasta 6 horas posteriores al horario programado, transcurrido ese tiempo, se omite la dosis y continúa con la siguiente. No se deben tomar “dosis dobles” para compensar. Los pacientes con pesos extremos, ya sea menor a 50 o mayor a 120 kilos, aumentan o reducen, respectivamente, un 30% la concentración de apixabán en sangre, cuando se ingiere en la dosis habitual. Se desconoce si esto tiene alguna consecuencia clínica. En Argentina no hay agentes genéricos de esta droga por el momento.
Es un inhibidor específico del FXa. Su forma de presen tación es en comprimidos de 2.5; 10; 15 y 20 mg. Tiene una biodisponibilidad oral de 100% pero siempre debe administrarse con alimentos para favorecer su absorción con la dosis de 15 y 20 mg. Cuando no se administra con alimentos, la biodisponibilidad se reduce al 66% y esto puede generar una falla terapéutica del medicamento. Por lo tanto, el rivaroxabán se toma siempre con el almuerzo o la cena. En el caso de una sobredosis, el rivaroxabán no se absorbe en el tubo digestivo más allá de 50 mg (efecto techo por absorción limitada). Tiene un rápido comienzo de acción de 2 horas y una vida media de 9 a11 horas.
Se administra en una dosis diaria única y esto le per mitiría una mejor adherencia al tratamiento. El comprimido puede triturarse para su administración por sonda naso gástrica, pero su absorción se afecta si se administra en una posición distal al estómago, como ocurre con la sonda naso-yeyunal. Contiene lactosa como excipiente, por lo que no debe indicarse si existe intolerancia o alergia a la misma. Se une en gran medida a las proteínas del plasma (> 90%) y se elimina el 40% de la droga por vía renal, lo que obliga a ajustar la dosis según el aclaramiento de creatinina, que siempre debe calcularse mediante la fór mula de Cockcroft-Gault antes de iniciar el tratamiento. Su perfil farmacocinético se afecta en la insuficiencia hepática moderada o grave (Child-Pugh B y C) y no se recomienda su uso en estos pacientes. Como todos los anti FXa, tiene interferencia con medicamentos que afectan al citocromo CYP3A4 hepático y es substrato del sistema de la gp-P, por lo que se debe corroborar que el paciente no reciba simultáneamente medicación que altere su concentración en sangre. En caso de que el paciente se olvide de tomar el rivaroxabán en el horario correspondiente, lo puede ha cer hasta 12 horas pasado del horario habitual. Luego de las 12 horas se debe esperar al día siguiente, sin duplicar la dosis, excepto en el tratamiento inicial de la trombosis venosa, en el que pueden tomarse 2 comprimidos juntos de 15 mg. En Argentina se cuenta con gran cantidad de agentes genéricos de rivaroxabán
Edoxabán4
En Europa, EE. UU. y Japón está aprobado su uso en FA y tratamiento de ETV. Se presenta en comprimidos de 30 y 60 mg. Tiene una biodisponibilidad de 60% y rá pido comienzo de acción, entre 1 y 2 horas. Se une 50% a las proteínas del plasma. Tiene eliminación renal del 40% por lo que debe ajustarse la dosis en pacientes con falla renal. También se cataboliza en el hígado. Posee la ventaja de poder administrarse en una sola toma diaria. La interferencia medicamentosa es con el sistema de la gp-P y el citocromo P450 CYP3A4 hepático. Aún no está disponible en Argentina.
En Argentina contamos con un agente antitrombínico directo denominado dabigatrán y con dos agentes anti-factor X activado, el rivaroxabán y el apixabán. Todos ellos tienen una farmacocinética y farmacodinamia característica y para poder utilizarlos adecuadamente debemos primero familiarizarnos con las propiedades de cada una de las diferentes drogas.
Indicaciones de los anticoagulantes orales directosen distintos escenarios clínicos
Los DOACs están aprobados para la prevención de un accidente cerebro vascular (ACV) o embolia sistémica en la fibrilación auricular que no tiene origen valvular (FANV), para el tratamiento de la enfermedad tromboembólica venosa (trombosis venosa profunda y embolia pulmonar), para profilaxis de la flebotrombosis en la artroplastia de cadera o rodilla y profilaxis alejada en enfermedad coro naria (solo para rivaroxabán).
Fibrilación auricular
Definición, clasificación, factores de riesgo de trombosis y de sangrado en fibrilación auricular
La fibrilación auricular (FA) es una taquiarritmia supra ventricular caracterizada por una activación auricular no coordinada, muy irregular, que puede latir a 600-800 veces por minuto. Solo un pequeño número de estos impulsos eléctricos llega a los ventrículos, que pueden alcanzar una frecuencia de 180 latidos por minuto o ma yor. La respuesta ventricular depende de las propiedades electrofisiológicas del nodo auriculoventricular y de otros tejidos de conducción, del tono vagal y simpático, de la presencia o ausencia de vías accesorias, y de la acción de fármacos. En el ECG se observan oscilaciones rápidas u ondas fibrilatorias (ondas f), que varían en amplitud, forma e intervalo y sustituyen a las ondas P. Genera una contracción auricular inefectiva, que predispone al desarrollo de coágulos y eventuales embolias, así como disminuye la eficiencia en el llenado ventricular, lo que sumado a la frecuencia elevada puede inducir insuficiencia cardíaca o incluso síncope. La prevalencia global de la FA en la población general se encuentra en torno al 1.5-6.2. Por grupos etario es, aproximadamente, del 0.2-0.3% en 25- 35 años, 3-4% en 55-60 años y 5-9% en mayores de 65 años, llegando al 10% en la década de los 80. Por sexos está en torno al 2.8% en mujeres y 5.9% en varones entre 65-69 años, llegando a 6.7% en mujeres y 8.0% en varones de 80 o más años. Se asocia a un aumento de 5 veces de riesgo de un accidente cerebro vascular32,33.
Clasificación de la fibrilación auricular
Se han propuesto varias clasificaciones y en forma gene ral se distinguen cinco patrones basados en la presenta ción, duración y la forma de terminación de los episodios de FA (Tabla 4).
Valoración del riesgo de accidente cerebrovascular embólico: los factores de riesgo de embolias se resumen en el puntaje CHA2DS2-VASc34, acrónimo por sus iniciales en inglés: Congestive heart failure (Insuficiencia cardíaca congestiva), Hypertension (HTA) (hipertensión arterial), Age ≥ 75 (edad ≥ 75 años), Diabetes, Previous Stroke (ACV), Vascular disease (enfermedad vascular), Age 65- 74 (edad entre 65 y 74 años), Sex category female (sexo femenino). Este puntaje delinea categorías de riesgo tromboembólico (Tabla 5) y es el preferido por las guías actuales para recomendar tratamiento: Cuando el puntaje es 0 = bajo riesgo no se indica anticoagulación oral, cuan do es 1 = bajo moderado puede o no indicarse tratamiento (dependerá de la preferencia o eventuales hallazgos no incluidos en el puntaje, como por ejemplo dilatación de la aurícula izquierda), y ≥ 2 = moderado alto en todos los casos se sugiere anticoagulación oral. (Tabla 5). Como la mayoría de los puntajes basados en factores de riesgo clínico, CHA2DS2-VASc funciona modestamente para predecir pacientes de alto riesgo que presentarán eventos tromboembólicos, pero aquellos identificados como bajo riesgo CHA2DS2-VASc 0 (hombres), o 1 (mujeres) tienen consistentemente bajo riesgo de ACV o muerte (< 1%/ año) y no requieren anticoagulación. El sexo femenino es un factor edad-dependiente de ACV más que un factor de riesgo por sí mismo. En estudios observacionales las mujeres sin otros factores de riesgo (CHA2DS2-VASc de 1) tuvieron bajo riesgo de ACV, similar al de los hombres con puntaje CHA2DS2-VASc de 0.
Estimación de riesgo de sangrado: Los pacientes tratados con anticoagulación incrementan el riesgo de sangrado, lo que ha llevado a intentar predecir ese ries go con la elaboración de puntajes. Se han desarrollado diferentes propuestas dentro de las cuales la más popu lar y utilizada es el HAS-BLED35 (Tabla 6). Este puntaje incluye la hipertensión arterial, la enfermedad renal, la enfermedad hepática, historia de ACV, sangrado previo o diátesis hemorrágica, RIN lábil, edad mayor a 65 años, medicamentos concomitantes que predisponen al sangra do y uso de alcohol. Este puntaje puede ser utilizado en pacientes tratados con anticoagulantes orales directos y en ese caso la variable de RIN lábil se omite del cálculo. De acuerdo con el score HAS-BLED, los pacientes se dividen en tres categorías: 0 es bajo riesgo; 1-2 puntos es riesgo moderado y 3 o más puntos es alto riesgo de sangrado. Un alto riesgo de sangrado no debería impedir la indicación/uso de los anticoagulantes orales, debido a que el beneficio clínico neto es mayor en estos pacientes. Actualmente las guías recomiendan que la valoración formal del riesgo de sangrado contribuya al manejo de pacientes que toman anticoagulantes, poniendo atención en factores de riesgo modificables que deberían ser reva lorados en cada visita. Los pacientes con alto riesgo de sangrado con factores de riesgo no modificables deberían ser controlados con mayor frecuencia. Esto es de parti cular importancia en los sujetos que tienen indicación de tratamiento antitrombótico como aquellos pacientes con FA sometidos a intervenciones coronarias percutáneas
El paciente con fibrilación auricular debe ser evaluado siempre sobre los factores de riesgo trombóticos y de sangrado antes de iniciar un tratamiento anticoagu lante.
Manejo general de la anticoagulación en fibrilación auricular: A quién indicar un anticoagulante oral directo y a quién un antagonista de la vitamina K
Los anticoagulantes orales sirven para disminuir el riesgo embólico de la FA. Los antagonistas de la vitamina K ejercen un beneficio notable en la reducción de embo lias sistémicas y cerebrales. En el metaanálisis de los 6 ensayos clínicos clásicos36 que compararon warfarina contra placebo, la reducción de embolias fue de 62 % (IC 95% de 48 a 72%) en 2900 pacientes y la mortalidad se redujo en 1.5 muertes cada 100 tratados respecto del placebo. La warfarina, y por extensión el acenocumarol, constituye una indicación indudable cuando el puntaje CHA2DS2-VASc es ≥ 2. Los DOACs han sido evaluados en ensayos controlados contra warfarina en estudios de grandes dimensiones en la FA como el RELY (dabigatrán), ROCKET (rivaroxabán) y ARISTOTELES (apixabán)37-39. Los tres agentes con que contamos en Argentina han demostrado eficacia y seguridad adecuadas en esta indicación y se los ha recomendado en todas las guías internacionales por encima del uso de los AVK en el tratamiento inicial de la FA. Cada agente tiene sus parti cularidades y el metaanálisis de los tres estudios detecta heterogeneidad e inconsistencia sobre algunos eventos. En conjunto se observa una modesta reducción de la incidencia de eventos combinados embólicos del 10% (IC 4 a 16%), de la mortalidad del 10% (IC 6 al 13%), en valores absolutos 0.4 por cada 100 tratados, reducción de los sangrados mayores del 24% (IC 95% 20 a 27%) y marcada disminución de las hemorragias intracere brales del 54% (IC 47 al 61%)40. La dosis sugerida y las características diferentes de los estudios no permiten recomendar alguno de los anticoagulantes directos por encima de los otros, especialmente porque no se han hecho trabajos prospectivos comparativos entre ellos (Tabla 7). La indicación de un DOAC en esta enfermedad ha sido evaluada en la Fibrilación Auricular “No Valvular” (FANV.). En los estudios, la única enfermedad valvular excluida fue la estenosis mitral moderada a grave, de tal manera que no se excluyen para el uso de DOACs a pacientes con FA y otras valvulopatías más frecuentes como la insuficiencia mitral no reumática, la estenosis o la insuficiencia valvular aórtica.
¿Cuándo están indicados los antagonistas de vi tamina K?: Si bien la recomendación de todas las guías es utilizar a los anticoagulantes directos sobre los AVK, no todos los pacientes pueden realizar este tratamiento con los anticoagulantes directos9. Se recomienda utilizar AVK por sobre DOACs en el caso de:
a) Los pacientes que tengan una contraindicación para los DOACs como interferencia de medicamentos, embarazo o pacientes pediátricos.
b) En caso de sospecha de mala adherencia al trata miento anticoagulante o de dificultades socioeconómicas donde el médico juzgue improbable que el paciente pueda asumir el mayor costo del tratamiento con los DOACs.
c) Los tratados con un AVK que ya se encuentran estables con los dicumarínicos, con un tiempo en rango terapéutico > 65% y que no deseen cambiar el tratamiento.
d) Pacientes frágiles con función renal o hepática deteriorada o peso < 50 kg donde se requiera un estre cho monitoreo de coagulación que se puede lograr con la medición del RIN frecuente. Aquellos con riesgo de sangrado gastrointestinal (angiodisplasia colónica no re suelta, úlcera péptica activa o antecedente de hemorragia digestiva reciente).
e) En presencia de estenosis mitral reumática o válvula protésica mecánica.
¿Cuándo están indicados los anticoagulantes orales directos?: En general las guías recomiendan con preferencia el uso de DOACs en fibrilación auricular res pecto de los AVK, lo que se ve limitado por sus mayores costos. Las indicaciones habituales son:
a) Pacientes tratados con AVK, adherentes al trata miento, con un inadecuado control de anticoagulación (tiempo en rango terapéutico inferior al 65%) con dicu marínicos.
b) Para el inicio de tratamiento anticoagulante en pacientes sin comorbilidades o en plan de cardioversión eléctrica a corto plazo.
c) En situaciones donde no se puede controlar ade cuadamente la anticoagulación por falta de laboratorio de hemostasia, o por dificultades para la extracción de sangre por venopuntura.
d) Cuando el paciente elige no realizar controles de coagulación.
En las próximas secciones se desarrollarán algunos contextos específicos y sus recomendaciones.
Manejo la de cardioversión eléctrica
En la fibrilación auricular aguda la cardioversión es el tratamiento habitual si tiene menos de 48 horas (ideal mente, menos de 24 horas) y se puede realizar sin la administración de anticoagulantes. Es recomendable realizar un eco trans-esofágico previo para descartar la presencia de trombos. En la FA de más de 48 horas de evolución, cuando se desconoce el tiempo de aparición o en FA persistente, la cardioversión, tanto eléctrica como farmacológica, se asocia a un aumento del riesgo de eventos cardioembólicos entre 5% y 7%. Con tratamiento anticoagulante adecuado (RIN entre 2 y 3 en el caso de AVK por al menos 4 semanas) este riesgo se reduce a 0.8%41. La recomendación clásica es anticoagulación durante 3 semanas previas y al menos 4 semanas poste riores a la cardioversión. En el caso de que no se pudiera esperar por mala tolerancia a la arritmia, una alternativa es una anticoagulación rápida y efectuar un ecocardiograma trans-esofágico que descarte la presencia de coágulos auriculares previo al intento de cardioversión. Los DOACs han sido comparados en ambos contextos a través del sub-análisis de los ensayos controlados iniciales y en tres estudios prospectivos frente a la cardioversión, con resultados similares a los antagonistas de la vitamina K42. Pueden ser una alternativa a los AVK en este contexto para evitar el inconveniente de los frecuentes chequeos del RIN previos, la necesidad de drogas puente como la heparina de bajo peso molecular (HBPM) o eventualmente la cancelación de la cardioversión porque el paciente tiene un RIN sub-terapéutico al momento del procedimiento. Para la cardioversión planificada se administran anticoa gulantes por tres a cuatro semanas. Los DOACs están aprobados también para la indicación de cardioversión no demorada en pacientes previamente no anticoagulados, si en un control previo al procedimiento con ecocardio grama trans-esofágico no se observan trombos. En este caso el tratamiento debe iniciarse cuatro horas antes del procedimiento y mantenerse al menos por 4 semanas.
Manejo de la ablación con anticoagulantes orales directos
La ablación es una indicación cada vez más frecuente en diferentes contextos clínicos de la FA. El procedimiento invasivo de una ablación aumenta el riesgo de complica ciones tromboembólicas y es por eso que los consensos internacionales recientes recomiendan realizar este tipo de procedimientos bajo tratamiento anticoagulante inin terrumpido con antagonistas de la vitamina K intentando mantener un RIN entre 2.0 a 2.5, porque reduce los even tos trombóticos cuando se compara con la suspensión transitoria de warfarina y puenteo con HBPM. Sin em bargo, en procedimientos de ablación complejos con alto riesgo de sangrado está indicada la suspensión transitoria del anticoagulante. Los DOACs en forma ininterrumpida son una alternativa para pacientes a quienes se les va a realizar una ablación de FA y su seguridad y eficacia ha sido explorada en varios ensayos comparativos con warfarina en todos los agentes (apixabán, dabigatrán, edoxabán, y rivaroxabán)43. Un metaanálisis de 29 estu dios observacionales y aleatorizados que abarcó más de 12 000 pacientes, confirmó un número inferior de eventos hemorrágicos con DOACs vs. AVK con una tasa baja y similar de complicaciones, por lo que puede considerarse a los DOACs el modo preferido de anticoagulación para aquellos derivados a este procedimiento44.
Anticoagulación en angioplastia coronaria y luego de síndrome coronario agudo
Luego de un episodio coronario agudo es frecuente que se utilice la asociación de aspirina y un inhibidor PY212 (clopidogrel, ticagrelor o prasugrel) durante uno a 12 me ses. Esta asociación es rutinaria luego de una angioplastia programada o de urgencia, con una duración variable de acuerdo con el tipo de stent utilizado. En los pacientes con fibrilación auricular y puntajes CHAD2VAS2C de 2 o más es necesario agregar un anticoagulante oral, por lo que se incrementa el riesgo hemorrágico.
Se han publicado tres ensayos controlados que evalua ron diferentes esquemas de asociación entre fármacos y duraciones, dos de ellos luego de una angioplastia progra mada o urgente. El estudio PIONEER AF-PCI45 comparó rivaroxabán en diferentes dosis en doble esquema con clopidogrel contra un esquema triple con warfarina, aspi rina y clopidogrel en 2124 pacientes. El estudio REDUAL-PCI46 comparó dos dosis de dabigatrán en un doble esquema con clopidogrel o ticagrelor contra un esquema triple con warfarina, aspirina y clopidogrel o ticagrelor en 2725 pacientes. Estos dos estudios demostraron una reducción de la incidencia de sangrados mayores con el doble esquema respecto del triple, sin diferencias en eventos graves como infarto, ACV o muerte. En el grupo dabigatrán en dosis 110 mg cada 12 h se observó un incremento de la incidencia de infarto en los primeros meses que en un análisis ulterior sugirió que requeriría adicionar aspirina. El tercer estudio AUGUSTUS47 incluyó pacientes luego de un síndrome coronario agudo (SCA) o una angioplastia y comparó en forma factorial warfarina vs. apixabán en dosis habituales, y en la otra rama factorial aspirina vs. placebo, en 4614 pacientes que recibían un inhibidor PY212 (92% clopidogrel). El apixabán se asoció a menor sangrado mayor que la warfarina, y menor inci dencia de hospitalización y mortalidad, sin diferencia en eventos isquémicos. La otra rama de aspirina se asoció a mayor incidencia de sangrado respecto del placebo sin diferencias en eventos isquémicos, hospitalización ni mortalidad. Los tres estudios tienen limitaciones porque no abarcan todo el espectro del problema. Los primeros dos porque no compararon un doble esquema con war farina y clopidogrel, que había sido validado en el estudio WOEST48, lo que pudo haber incrementado la incidencia de sangrado atribuible al triple esquema y no al agente anticoagulante. Una segunda limitación es que se observó una tendencia no significativa a mayor infarto y trombosis del stent en los pacientes sin aspirina, de modo que el tamaño de la muestra podría ser insuficiente para evaluar eficacia terapéutica.
Recomendaciones en SCA: Los estudios efectuados no son suficientes para definir con precisión la conducta por carecer de un tamaño muestral adecuado para eva luar eventos mayores clínicamente relevantes. Su mayor aporte es en la reducción de sangrado, con los reparos metodológicos que comentamos. Con esta información se han desarrollado dos guías internacionales con un enfoque algo diferente. Ambas han intentado manejar en forma balanceada los tres componentes del riesgo: el ACV cardioembólico, la recurrencia isquémica y el san grado. De tal manera que reelaboraron la información con propuestas de conductas diferenciadas de acuerdo con el riesgo de trombosis del stent que está incrementado en los cuadros agudos, en lesiones muy proximales y de tronco, al riesgo embolígeno evaluado con el CHA2DS2VASc y los riesgos de sangrado evaluado con puntajes como el HAS-BLED. Ambas guías prefieren el uso de DOAC res pecto de la warfarina por la menor incidencia de sangrado y similitud o beneficio en eventos clínicos. Dentro de los inhibidores P2Y12 se prefiere el clopidogrel, y solo se indicaría ticagrelor en pacientes con alto riesgo isquémico y bajo riesgo de sangrado. La información sobre ticagrelor es escasa para usar con DOACs. Se excluye en este contexto al prasugrel por su mayor riesgo de sangrado.
En forma general, en aquellos pacientes de bajo riesgo de eventos trombóticos (angioplastia electiva sin hallaz gos clínicos y angiográficos de alto riesgo) o alto riesgo de sangrado, la indicación será un anticoagulante directo asociado a clopidogrel sin aspirina. En pacientes con FA de bajo riesgo embólico, edad < 65 años, CHA2DS2VASc score de 0-1, se optará por una doble antiagregación con ácido acetil salicílico (AAS) más clopidogrel o ticagrelor. En el otro extremo, en pacientes de alto riesgo clínico (diabetes, insuficiencia renal crónica, trombosis previa del stent, tabaquista) con lesiones anatómicas complejas (> de 2 stent, longitud del stent > 60 mm, bifurcaciones, oclusiones crónicas, lesión de tronco, enfermedad multi vasos, angioplastia o síndrome coronario agudo de alto riesgo), la aspirina no se suspenderá tempranamente dependiendo también del riesgo de sangrado. Esta forma de dividir a los pacientes no fue evaluada prospectiva mente en ningún ensayo, y no existe un criterio absoluto para aplicar estos resultados a todos los pacientes. En la tabla 8 resumimos la comparación entre la propuesta de los dos consensos más recientes sobre el tema, el norteamericano y el europeo. En el caso del consenso norteamericano49,50 (primera parte de la Tabla 8), la dosis de dabigatrán se ajustará al riesgo isquémico: en el caso de usar dabigatrán 110 mg cada 12 horas es conveniente durante el primer mes asociar aspirina. El consenso europeo51 (segunda parte de la Tabla 8) se su giere dosis bajas de dabigatrán si se usa triple esquema y dosis altas, 150 mg, con esquema doble. La dosis de apixabán se recomendaba en forma clásica, 5 mg c/12 horas. Un detalle relevante para la toma de decisión es que, en los metaanálisis de los tres ensayos, incluyen do solo los pacientes con angioplastia, se observó un incremento de la incidencia de trombosis de los stents en los grupos con terapia doble52,53.
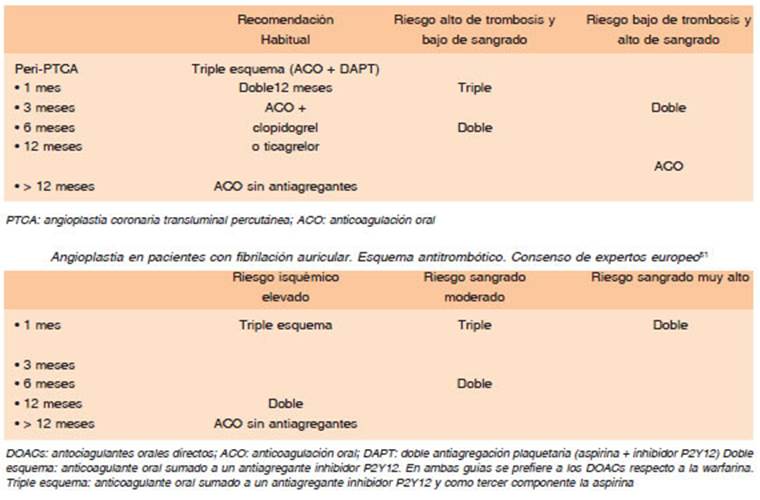
Tabla 8 Angioplastia en pacientes con fibrilación auricular. Esquema antitrombótico. Consenso de expertos norteamericanos50
Intentaremos hacer algunas puntualizaciones para disminuir el riesgo de sangrados por anticoagulación en FA y angioplastía o SCA como el uso de via radial anti coagulado por FA se debe enfatizar una serie de medidas como el uso de vía radial para cateterismo, utilizar vainas más chicas, uso rutinario y prolongado de inhibidores de la bomba de protones como gastro protector, evitar el uso simultáneo de otros agentes antitrombóticos, en lo posible evitar los inhibidores IIb IIIa, y el puente con HBPM. Hoy las guías recomiendan no suspender el AVK en pacientes con AVK por FA que van a realizar cateterismo con colocación de stents en lugar de hacer puente con HBPM, por el mayor riesgo de sangrado que este procedimiento conlleva. Esto está fuertemente avalado por el estudio BRIDGE54. Queda por debatir si el bolo de heparina normalmente utilizado en el procedimiento debe evitarse o no.
Enfermedad coronaria estable en pacientes con fibrilación auricular
Los pacientes con fibrilación auricular y enfermedad coronaria estable que no han sido revascularizados, y aquellos luego de transcurridos 12 meses post angio plastía, período durante el cual recibieron doble o triple terapia antitrombótica, clásicamente debieran continuar en forma crónica solo con anticoagulación vía oral. En casos que la estimación del riesgo hemorrágico esté aumentada, existe evidencia indirecta surgida de los estudios pivotales de DOACs37-39, de metaanálisis55,56 y de un ensayo aleatorizado, que avala la suspensión de la AAS, continuando solo con monoterapia con el agente anticoagulante oral, preferentemente un DOAC frente a los AVK57. Esta conducta ha demostrado una tasa de eventos isquémicos/embólicos semejante a la terapia doble, pero con reducción significativa de la hemorragia mayor. A pesar de una calidad metodológica modesta, con algunas limitaciones, el ensayo aleatorizado japo nés AFIRE, que comparó monoterapia con rivaroxabán versus rivaroxabán + AAS, demostró no-inferioridad en relación con el punto final compuesto cardiovascular (ACV, embolismo sistémico, IAM, angina inestable que requiere revascularización y muerte total) y disminución significativa de la hemorragia mayor56. Por lo tanto, las guías clínicas avalan suspender la AAS y dejar solo el DOAC, excepto en aquellos casos en los que se considere un riesgo isquémico muy elevado, en general manifestado por eventos isquémicos recurrentes58,59.
Debemos evaluar a cada caso en forma individual y compartir con el paciente las ventajas y desventajas de cada una de las drogas anticoagulantes para elegir el mejor tratamiento posible.
En caso de cardioversión eléctrica, ablación o que la arritmia se acompañe de un síndrome coronario agudo hay circunstancias particulares que considerar con los DOACs.
Los DOACs son una alternativa válida de anticoagulación en la FA. Todas las guías de manejo actual recomien dan su uso antes que los antagonistas de la vitamina K por su practicidad, facilidad de manejo y mejor perfil de seguridad, aunque existen situaciones en donde los dicumarínicos son una mejor opción en esta enfermedad.
Otros escenarios cardiovasculares sin fibrilación auricular conocida
Uso de anticoagulantes orales directos en enfermedad arterial periférica
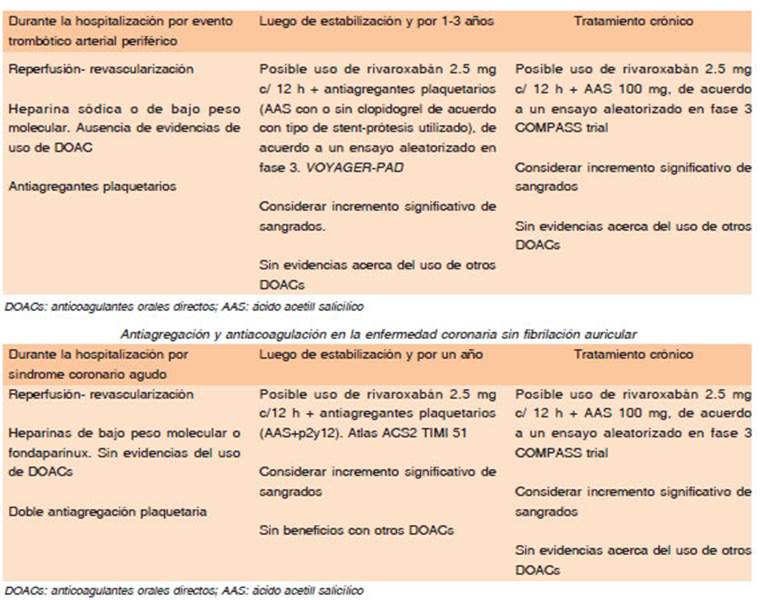
En un estudio aleatorizado en fase III se evaluó el uso de un DOAC a dosis bajas (rivaroxabán 2.5 mg dos veces al día) agregado al tratamiento estándar (aspirina con o sin clopidogrel) en sujetos con enfermedad arterial periférica sometidos a revascularización (bypass o angioplastia). Se observó una reducción significativa del 15% a tres años del criterio de valoración principal (isquemia aguda, amputación, infarto, ACV o muerte). Sin embargo, se incrementaron los sangrados: Incremento de sangrado mayor del 43% por puntaje TIMI, p = 0.07, y del 42% por puntaje ISTH p = 0.007)60. El uso de otros DOACs en este contexto no fue evaluado. Por ello, consideramos que la anticoagulación crónica de la enfermedad arterial perifé rica no debe ser una práctica generalizada, y que el uso de DOAC en este escenario, sin fibrilación auricular, sería sólo con rivaroxabán 2.5 mg cada 12 horas en sujetos con elevado riesgo trombótico y bajo riesgo de sangrado.
Uso de DOACs luego de un síndrome coronario agudo
En pacientes en ritmo sinusal luego de un evento co ronario agudo existe un riesgo residual importante de complicaciones trombóticas alejadas con una inciden cia de eventos combinados del 10-12 %, de infarto de miocardio del 6 a 8% y de muerte de 4.5 a 6%61. En un estudio aleatorizado en fase III se evaluó el uso de un DOAC a dosis bajas (rivaroxabán 2.5 mg cada 12 horas) agregado al tratamiento estándar (aspirina con o sin clopidogrel) en sujetos con un síndrome coronario agudo, 60% de ellos sometidos a revascularización. Se observó una reducción significativa del 16% del criterio de valoración principal (infarto, ACV, o muerte cardio vascular) en el seguimiento promedio de 13 meses. Sin embargo, se incrementaron muy significativamente los sangrados mayores un 246%62. Dado el incremento marcado en los sangrados y la pérdida de sujetos en el seguimiento, esta terapia no fue aprobada por FDA. El uso de otros DOACs no demostró beneficios (estudios REDEEM y APPRAISE)63,64. Por ello, consideramos que la anticoagulación oral luego de un síndrome coronario agudo en pacientes con ritmo sinusal no debe ser una práctica generalizada, y que el uso de DOACs en estos casos se limita al rivaroxabán 2.5 mg cada 12 horas en sujetos seleccionados con elevado riesgo trombótico y bajo riesgo de sangrado. Probablemente sea reservado sólo para sujetos con eventos trombóticos coronarios recurrentes a pesar del uso de antiagregantes (Tabla 9).
Uso de anticoagulantes orales directos como prevención secundaria de enfermedad cardiovascular
En un estudio aleatorizado en fase III se evaluó el uso de un DOAC a dosis bajas (rivaroxabán 2.5 mg cada 12 h) agregado al tratamiento estándar (aspirina) en sujetos con enfermedad cardiovascular de alto riesgo (enfermedad vascular periférica o enfermedad coro naria con 2 lechos vasculares o 2 factores de riesgo adicionales). Se excluyó a sujetos que requerían doble antiagregación, o anticoagulados por otros motivos (FA, ETV), así como a los considerados de alto riesgo de sangrado. Se observó una reducción del riesgo relati vo de eventos del 24% lo que llevó a una interrupción precoz del estudio por sus beneficios. Sin embargo, se incrementaron 70% los sangrados mayores. Tanto los pacientes con enfermedad coronaria crónica como aquellos con enfermedad vascular periférica tuvieron beneficios significativos65,66. El uso de otros DOACs como dabigatrán y apixabán en esta indicación no fue evaluado. Por ello, consideramos que la anticoagula ción crónica como estrategia de prevención secundaria en sujetos con enfermedad coronaria o arterial periféri ca establecida no debe ser una práctica generalizada, y que el uso de DOACs en este contexto, sin fibrilación auricular, sería sólo con rivaroxabán 2.5 mg cada 12 h en sujetos con elevado riesgo trombótico y bajo riesgo de sangrado (Tabla 9).
Trombo intracardíaco o miocardiopatía no compactada
La presencia de un trombo en el ventrículo izquierdo hoy se ha reducido notablemente (de 21-46% a 4-15%), lo que está relacionado con la mejor y más rápida reper fusión en el infarto de miocardio. Paradójicamente, el incremento en la supervivencia de pacientes con mio cardiopatías de otras etiologías (cardiopatía congénita corregida, Takotsubo, miocardiopatía dilatada y otras como la cardiopatía de la enfermedad de Chagas en nuestro medio) podría estar relacionado con el hallazgo de trombos en el ventrículo izquierdo. El riesgo de una embolia sistémica es motivo de preocupación y cuando se detecta un trombo en el VI se indica tratamiento anticoagulante por al menos 3-6 meses. El uso de los anticoagulantes directos en este contexto se ha conside rado como una alternativa con frecuencia, aún sin contar con estudios clínicos adecuados. Hemos hallado seis revisiones sistemáticas y metaanálisis publicados hasta el año 202167-72 donde se evaluaron pequeñas cohortes y estudios observacionales o caso-control con todos los nuevos anticoagulantes. En ellos, la tasa de resolución de trombos y eventos embólicos fue similar entre los asignados a DOACs o a warfarina. En la mayoría de los estudios se observó una menor incidencia de sangrados en sujetos que recibían los DOACs. Recientemente se conoció el resultado de un pequeño ensayo clínico pros pectivo aleatorizado, abierto73, donde se pudo determinar la no inferioridad de apixabán (5 mg cada 12 horas) en comparación con warfarina en la tasa de resolución volumétrica del trombo a tres meses en sujetos con un infarto agudo de miocardio. En conclusión, consideramos que es aconsejable el uso de anticoagulantes ante el hallazgo de un trombo en el VI, pero la evidencia para el uso de DOAC en reemplazo de los antagonistas de la vitamina K aún es débil y debe considerarse en cada caso en particular. En el caso del miocardio no compacto se pueden inferir las mismas recomendaciones que para el trombo intracardíaco.
Anticoagulantes orales directos en prótesis valvulares cardíacas
Válvulas mecánicas: no pueden indicarse los DOACs. En los pacientes con reemplazo valvular mitral o aórtico con prótesis mecánica se exploró en un ensayo dabiga trán en comparación con warfarina, con incremento de embolias y sangrado en el grupo dabigatrán74. No se han explorado los otros agentes en este contexto, por lo que no pueden utilizarse DOACs en prótesis mecánicas, sólo antagonistas de la vitamina K.
Válvula biológica en ritmo sinusal: no hay evidencias para DOAC. No existe adecuada experiencia para re comendar DOACs en los primeros 3 meses de anticoa gulación luego de un reemplazo valvular biológico en pacientes con ritmo sinusal. La incidencia de embolias con válvulas biológicas es muy baja, del 1% en el primer año y en los estudios comparativos con warfarina no se ha demostrado una reducción clara, dado que para eva luarlo se requerirían ensayos de dimensiones inmensas75.
Válvula biológica con fibrilación auricular: ¿pueden indicarse anticoagulantes orales directos? Si la válvula reemplazada es biológica y requiere anticoagulación por fibrilación auricular existen dudas sobre la indicación de DOACs. La única información disponible es el subanálisis de los estudios controlados con muy pocos pacientes en esta condición que impide sacar conclusiones76,77. Es una opción aún no evaluada en ensayos clínicos y con alguna aceptación en la comunidad de cardiólogos78.
Reemplazo valvular aórtico percutáneo (TAVI): Como prevención de la trombosis de las valvas en ritmo si nusal: no puede indicarse DOACs como alternativa a la antiagregación. En los ecocardiogramas posteriores al implante valvular aórtico percutáneo (Transcatheter Aor tic Valve Implantation) se observa en cerca del 10% de los casos trombosis no obstructiva de las valvas, lo que llevó a intentar comparar la antiagregación habitual con los DOACs. La posible indicación de un DOAC luego de TAVI, se exploró en el estudio GALILEO79 que comparó rivaroxabán con la indicación rutinaria de antiagregantes plaquetarios, aspirina sumada a clopidogrel. El estudio fue detenido precozmente por resultados negativos, con incremento incluso de la mortalidad. Otro ensayo similar, el ATLANTIS80 comparó apixabán con antiagregantes plaquetarios en pacientes en ritmo sinusal sin indicación de anticoagulación (n = 1049) y tuvo otra rama que com paró apixabán con warfarina en pacientes con indicación de anticoagulación por fibrilación auricular (n = 451) que comentaremos en el párrafo siguiente. En la compara ción de apixabán con antiagregantes se observó una reducción del diagnóstico de hallazgos trombóticos en las valvas, que no tuvo implicancias clínicas: no se redujeron los eventos mayores, no bajó la tasa de sangrado y se incrementó la mortalidad no cardiovascular en forma sig nificativa. El resultado de estos dos ensayos contraindica los DOACs como alternativa a la antiagregación luego del TAVI. Como alternativa a la warfarina en pacientes con TAVI y fibrilación auricular: Indicación dudosa de DOAC. En la rama del estudio ATLANTIS con fibrilación auricular, apixabán no fue superior a los AVK en eventos mayores ni en sangrado. Si bien apixabán resulta una alternativa, no mostró ventajas. Otro estudio de mayores dimensiones con edoxabán, el ENVISAGE TAVI AF81 en 1426 pacien tes confirmó no inferioridad para el edoxabán respecto de los antagonistas de la vitamina K en el punto final primario (combinado de mortalidad por cualquier causa, infarto de miocardio, ACV isquémico, eventos tromboembóli cos graves, trombosis de la válvula o sangrado mayor), pero tuvo un 40% mayor riesgo de sangrados mayores en forma significativa. En forma general, el apixabán no ofreció ventajas y el edoxabán no estaría indicado por su mayor sangrado, lo que limita la indicación de DOACs en este contexto.
Los DOACs pueden utilizarse como anticoagulantes en pacientes con enfermedad cardíaca que no sea FA, pero el nivel de evidencia en ciertos casos es menor y los resultados de diferentes estudios en este campo no han resultado adecuados.
Debemos ser cautos al momento de usar estos agentes en algunas circunstancias como la afección arterial pe riférica o enfermedad coronaria estable, seleccionando los pacientes que no responden a antiagregantes o que tienen mayor riesgo trombótico. No todos los DOACs tienen evidencia de uso en enfermedad arterial crónica.
Tratamiento de la enfermedad tromboembólica venosa con anticoagulantes orales directos
Tratamiento de la trombosis venosa profunda
Los nuevos anticoagulantes directos tienen algunas ventajas para el tratamiento inicial de la trombosis veno sa profunda (TVP) si lo comparamos con el tratamiento tradicional de HBPM y AVK. Por ejemplo, en algunos casos se puede evitar el uso inicial de heparinas, no se requiere el monitoreo diario de coagulación para llegar a un rango adecuado de dosis, no genera trombocitopenia inmune, tienen un rápido comienzo de acción y un me nor riesgo de sangrados. Al no tener la interferencia con alimentos como los AVK, el control y las instrucciones para el paciente resultan más sencillos. De esta forma, con un perfil más amigable, los nuevos anticoagulantes orales permitirían, en muchos casos, el manejo desde el domicilio del enfermo, siempre que las condiciones de seguridad para pacientes ambulatorios con ETV estén presentes (Fig. 2A). Todo esto ha llevado a sugerir el uso de DOACs como primera línea de tratamiento comparado a los AVK en las guías internacionales de tratamiento de la enfermedad tromboembólica venosa (ETV)82-84. Sin embargo, antes de indicar un DOAC en ETV, debe mos estar seguros de que el paciente se puede tratar adecuadamente en forma ambulatoria y que reúne los requisitos para el uso de estos agentes como adherencia al tratamiento anticoagulante y capacidad para adquirir el medicamento. Para el uso de DOACs la función renal y hepática deben ser normales y también debemos descartar a aquellos con síndrome antifosfolípido (SAFL) o tumores con alto riesgo de sangrado. En el caso de la trombocitopenia inmune por heparina o de trombosis y trombocitopenia por la vacuna del COVID-19, si bien hay escasa evidencia para el uso de DOACs, al no contar con otras alternativas en nuestro medio como el heparinoides o bivalirudina podrían eventualmente usarse los nuevos agentes como tratamiento anticoagulante85.
En definitiva, en algunas circunstancias habrá que elegir entre un DOACo el tratamiento clásico de HBPM/ AVK según sea adecuado para cada paciente individual por disponibilidad y posología del anticoagulante. En otras será preferible la internación en el hospital, si no cumple con criterios para tratamiento ambulatorio; y en otras se podría optar por una internación domiciliaria con una HBPM, supervisada por un profesional en el domicilio del paciente (de esta forma se resuelve el problema de acce so al tratamiento y permite un seguimiento más estrecho del cuadro). Otro escenario para el uso de DOACs en la ETV son los pacientes con mal control de anticoagulación con los AVK (TRT < 60%) y con buena adherencia y per sistencia con el tratamiento9-11. También pueden utilizar un agente oral directo los sujetos que luego de 6 meses de anticoagulación requieran tratamiento a largo plazo de una ETV por no tener un factor desencadenante claro (ETV idiopática) y que prefieran no hacer los controles periódicos de anticoagulación86.
La dosis y forma de administración de cada uno de los anticoagulantes directos en la ETV es diferente y debe usarse según lo recomendado para cada droga83 (Tabla 10). En el caso del rivaroxabán y apixabán pueden indi carse sin necesidad de heparina previa pero el dabigatrán debe recibir un curso de 5 días mínimo con HBPM o HNF. Para el rivaroxabán en el tratamiento la dosis inicial es de 15 mg cada 12 horas durante tres semanas y luego pasar a 20 mg/día hasta terminar el tratamiento. Si el paciente olvida una dosis debe recibir lo antes posible una nueva toma para completar los 30 mg del día y al día siguiente retoma el esquema habitual de 15 mg cada 12 horas. Para el anticoagulante directo apixabán, la dosis inicial es de 10 mg cada 12 horas en la primera semana y luego 5 mg cada 12 horas. Si el paciente NO tiene buena adherencia al tratamiento las virtudes de los DOACs desaparecen. Al ser un tratamiento oral que no requiere controles de coagulación se corre el riesgo, por parte del paciente, de banalizar la terapéutica y por lo tanto tener complicaciones trombóticas o hemorrágicas mayores a las de los estudios clínicos. Por eso fidelizar la adherencia es fundamental85.
Tratamiento del tromboembolismo pulmonar
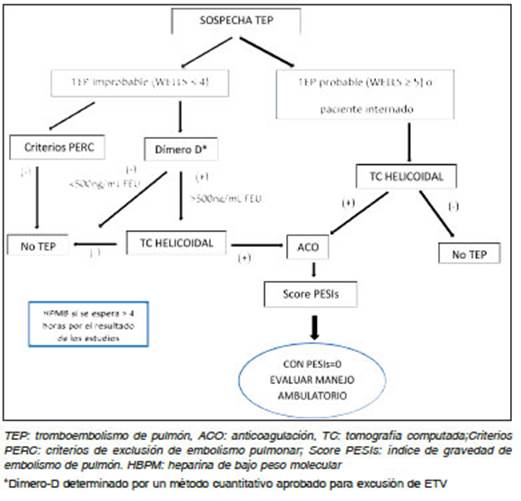
Los anticoagulantes directos posiblemente no sean la droga de elección en el paciente internado con un tromboembolismo pulmoner (TEP) submasivo o masivo con riesgo de compromiso hemodinámico. Pero para la mayoría de los pacientes con riesgo intermedio/bajo y bajo son una excelente alternativa al inicio de anticoa gulación en lugar de la heparina y AVK, con la ventaja del alta temprana al ser una droga oral (Fig. 2B). Para el subgrupo de pacientes considerado como de “muy bajo riesgo”, podrían directamente manejarse en el domicilio y recibir un DOAC siempre que cumplan con los criterios HESTIA. Estos pacientes tienen una puntuación del score PESI simplificado de “cero” (no deben tener ninguno de los siguientes: edad mayor a 80 años, cáncer, enfermedad cardiorrespiratoria crónica (EPOC), frecuencia cardíaca > 110 por minuto, tensión arterial < 100 mm Hg y satura ción de oxígeno < 90 %)83,87.
Criterios para evaluar internación o manejo ambulatorio con anticoagulantes directos en enfermedad tromboembólica venosa aguda.
Un gran número depacientes pueden beneficiarse con el manejo ambulatorio de la trombosis venosa profunda y así evitar la hospitalización88. Si bien la realidad en Latinoa mérica podría ser diferente89 la primera recomendación de las guías 2021 de la Sociedad Americana de Hematología (ASH) es ofrecer el tratamiento anticoagulante en el do micilio a los pacientes con bajo riesgo de complicaciones, en lugar de internación6. Según algunos reportes hasta el 70% de los casos de TVP y hasta 20% de los pacientes con TEP podrían tratarse directamente en el domicilio90-92. La conveniencia para el sistema de salud del tratamiento ambulatorio de la ETV abarca desde ventajas psicológicas para el paciente y la posibilidad de una reinserción laboral temprana hasta un ahorro económico en la institución y la posibilidad de descongestionar la ocupación de camas, liberando este recurso para otras enfermedades93.
En ETV deberíamos considerar internar al paciente si presenta ciertas condiciones de riesgo para el manejo en el domicilio que son reconocidos como criterios HESTIA90. En este grupo de enfermos es preferible una supervisión más estrecha hasta que la condición clínica mejore y el paciente pueda ser controlado ambulatoriamente. Estas son sugerencias prácticas de manejo para indicar la internación en una ETV:
1) Riesgo alto de sangrado (diátesis hemorrágica, pla quetopenia < 100 000/mm³, antecedente de hemorragia digestiva o de sangrado en el SNC, trauma reciente) o que tenga un sangrado activo.
2) TEP sintomático con marcadores de riesgo modera do/alto o con score PESI simplificado ≥ 1 (cualquiera de los siguientes: edad > 80 años, EPOC, insuficiencia cardíaca, cáncer, frecuencia cardíaca > 110 × minuto, tensión arterial < 100 mmHg, Saturación de oxígeno < 90% al aire).
3) TVP extensa con compromiso circulatorio y riesgo de flegmasia dolens. TVP ileo-femoral en paciente joven, con bajo riesgo de sangrado, donde se esté considerando el uso de fibrinolíticos y/o trombectomía.
4) Trombosis venosa que requiera analgesia endove nosa para calmar el dolor.
5) Mal estado general o alguna comorbilidad que requiera internación como: alto riesgo de caídas, anemia (hb < 10 g/ dl), edad > 75 años en paciente frágil o menor de 18 años, falla renal (aclaramiento de creatinina < 30 ml/min), alco holismo, cáncer activo, infección que requiera internación, hepatopatía grave, hipertensión arterial grave no controlada.
6) Sospecha clínica de cáncer que requiera internación para confirmar el diagnóstico.
7) Embarazo
8) Pesos extremos (peso > 140 kg o < 50 kg)
9) Trombofilia de alto riesgo como SAFL de triple positividad.
10) ETV en postoperatorio de cirugía mayor reciente (< de 1 semana).
11) Paciente con difícil acceso al centro de salud por distancia o que no tiene contención o compliance con el tratamiento anticoagulante. Pacientes con dificultades socio-económicas en donde no tengamos garantizada la adherencia al tratamiento.
12) Trombosis venosa recurrente.
Uso de anticoagulantes orales directos en el paciente con trombosis y cáncer
El uso de DOACs ha sido recientemente aceptada por algunas guías de manejo para pacientes con trombosis y cáncer y que tengan bajo riesgo de sangrado. Si bien la terapéutica con HBPM posiblemente siga siendo el trata miento patrón en los pacientes con trombosis y cáncer, las nuevas guías americanas de hematología recomiendan usar a los DOACs antes que la HBPM y los AVK como primera alternativa anticoagulante en pacientes con ETV en el contexto de un tumor94. Los estudios de pacientes con cáncer avanzado y trombosis con rivaroxabán y edoxabán han demostrado una eficacia superior a la HBPM, pero a costa de mayor sangrado95,96. Los tra bajos prospectivos con apixabán han demostrado igual eficacia y seguridad que la HBPM97,98. La posibilidad del uso de un DOAC en trombosis y cáncer ha permitido una enorme ventaja por costo y confort para el paciente que no debe recibir inyecciones todos los días. Sin embargo, en algunos de los estudios de pacientes oncológicos, el sangrado mayor fue significativamente más alto que la HBPM, y ciertas subpoblaciones fueron excluidas de los ensayos clínicos, por lo que debemos ser cuidadosos al momento de elegir el paciente adecuado para los DOACs. En definitiva, la elección del mejor anticoagulante debe ser siempre personalizada, caso por caso. Existen cuatro variables que se deben tener en cuenta para definir el tratamiento anticoagulante en aquellos enfermos con un tumor maligno (Consentimiento del paciente, Labilidad, Origen del tumor y Tamaño del trombo, representados por la palabra C.L.O.T)99-101:
a) CONSENTIMIENTO y posibilidades del paciente. Este debe ser el primer punto para considerar. Debemos evaluar con el paciente las alternativas de uso con HBPM o DOACs, su costo y cobertura médica, disponibilidad de tratamiento y tolerancia individualizada. Hay que conside rar la situación en pacientes en etapa de cuidados paliati vos. En algunos casos donde la adherencia al tratamiento es difícil podría ser preferible el uso de anticoagulantes parenterales o de internación domiciliaria.
b) LABILIDAD del paciente. Representa el riesgo de sangrados de cada paciente individual determinado por factores particulares como:
- Insuficiencia renal grave (preferir HBPM 50% dosis y control con anti Xa)
- Plaquetopenia < 50000/mm³ preferir HBPM según recomendaciones ISTH 2018102
- Insuficiencia hepática o aumento de enzimas hepáticas
- Peso extremo (< 50 kg o caquexia o > 120 kg) preferir HBPM
- Mal estado general (ECOG III o IV clasificación de la OMS)
- Mucositis con alto riesgo de sangrados (gastritis, esofagitis o rectitis actínica)
- Medicación concomitante que afecte la concentración en sangre de DOACs al alterar su farmacocinética por interferir con el citocromo 3A4 o con el sistema de la gp- P. Drogas antitumorales que interfieran con los DOACs, antiangiogénicos o necesidad de doble tratamiento an tiplaquetario
c) ORIGEN del tumor. Ciertos tumores no deben iniciar anticoagulación con DOACs por su alto riesgo de com plicaciones hemorrágicas como en un tumor primario del SNC o en pacientes con metástasis cerebrales, leucemia aguda, tumor activo en estómago o esófago y cáncer de urotelio67 Si bien el apixabán ha demostrado en los estu dios un menor sangrado que los otros DOACs en tumores del tubo digestivo y genitourinario, fueron incluidos muy pocos pacientes con cáncer activo de la unión esófago-gástrica y por el momento no parece seguro usarlo en es tos pacientes que tienen muy alto riesgo de sangrado. De igual modo, si bien han aparecido informes de tratamiento de ETV con DOACs en pacientes con tumores del SNC con menor sangrado que las HBPM, la evidencia aún es pobre y debemos hacer consideraciones caso por caso84.
d) TAMAÑO del trombo. En pacientes que tienen una gran carga trombótica como un TEP masivo/submasivo o con una TVP bilateral y con compromiso circulatorio no debemos usar inicialmente un DOAC sino heparina no fraccionada, por su efecto anticoagulante inmediato, capacidad antiinflamatoria y por la posibilidad eventual de tener que usar fibrinolíticos.
¿Cuáles son los pacientes con enfermedad tromboembólica venosa en los que NO se debería considerar una anticoagulación inicial con anticoagulantes orales directos?
En los estudios clínicos que evaluaron el uso de DOACs en ETV un grupo de pacientes fueron excluidos y por consiguiente no contamos con evidencia adecuada para su uso en forma eficaz y segura82-85. Entre los criterios para uso de anticoagulación inicial con heparina (con o sin AVK posterior) debemos considerar a:
- Pacientes con TEP que estén inestables hemodiná micamente o con flegmasía dolens donde eventualmente se requiera el uso de fibrinolíticos. También un TEP submasivo que requiera monitoreo en terapia intensiva o considerado como de alto o moderado riesgo y portador de enfermedad pulmonar grave crónica que no puedan tolerar un nuevo evento embólico.
- Pacientes con insuficiencia renal grave o terminal (indicación de heparina no fraccionada endovenosa o sub cutánea) o aquellos con insuficiencia hepática moderada o grave (hepatitis aguda o crónica, cirrosis o enzimas he páticas aumentadas tres veces el valor máximo normal).
- Pacientes portadores de una TVP muy sintomática o extensa que requiera internación para control del dolor. En este caso la heparina es más efectiva para controlar y reducir el dolor por su efecto antiinflamatorio indepen diente del efecto antitrombótico.
- Pacientes con necesidad de procedimientos invasivos de urgencia como aquellos con sospecha de cáncer.
- Pacientes portadores de una trombofilia considerada de alto riesgo como SAFL y posiblemente déficit de anti trombina, defectos combinados y para algunos expertos, también el déficit de proteína C o S. En este caso es preferible el tratamiento con AVK.
- Pacientes donde se sospecha pobre adherencia al tratamiento anticoagulante o con limitaciones socio-económicas para poder adquirir los DOACs.
- Pacientes con pesos extremos ya sea mayor a 120 kg (BMI > 40 kg/m²) o menores a 50 kg de peso debido a la escasa experiencia con los anticoagulantes directos en estos grupos77.
- Pacientes con cáncer activo o bajo quimioterapia considerados por su localización o por medicación con comitante como de alto riesgo de sangrado. En este caso es preferible la HBPM.
- Pacientes con TVP/TEP recurrente estando en rango adecuado con los AVK.
- Pacientes que estén medicados con drogas formalmen te contraindicadas con los DOACs por ejemplo portadores de HIV con antirretrovirales, trasplantados que utilicen drogas inmunosupresoras como tacrolimus y ciclosporina, infecciones que requieran antibióticos o antimicóticos que interfieren con los anticoagulantes directos como tuberculo sis o infección de prótesis que ingieran rifampicina.
- Pacientes con cirugía bariátrica, cirugía abdominal reciente, síndrome de intestino corto o cualquier condición que pueda afectar la absorción de los DOACs.
Uso de bajas dosis de anticoagulantes orales directos como profilaxis extendida
Dos estudios han evaluado el uso de una dosis 50% menor de rivaroxabán (EINSTEIN CHOICE) y apixabán (AMPLIFY EXTENSION) comparado con placebo o aspiri na, luego de 6 meses de anticoagulación convencional en un total de 5800 pacientes que requerían anticoagulación prolongada103,104. El dabigatrán no se ha evaluado en ETV para profilaxis extendida con una dosis menor. Los tra bajos con DOACs en la población con una ETV sin factor de riesgo claro muestran una no significativa reducción en sangrados comparado con aspirina o placebo con una eficacia muy superior al comparador y equivalente a la rama que permaneció anticoagulada con la dosis habitual del DOAC (1.5% de nuevos eventos trombóticos en la rama de dosis baja del anticoagulante contra 6.3% de la rama placebo).Esto los posiciona como una alternativa interesante con un riesgo de sangrado equivalente a as pirina, pero con una protección antitrombótica semejante a un anticoagulante en dosis plena86 especialmente en sujetos sin factor desencadenante claro (ETV idiopática o primaria) o que tienen tan solo un factor de riesgo menor86. Sin embargo, en los dos estudios de profilaxis extendida se excluyeron a aquellos pacientes con muy alto riesgo trombótico como los que padecen trombosis recurrente, trombofilia de alto riesgo, con cáncer activo, o con un peso mayor a 120 kg105,106. En estos pacientes no debemos utilizar la dosis reducida. La dosis aprobada para uso a largo plazo de apixabán es 2.5 mg cada 12 horas y 10 mg una vez por día para el rivaroxabán.
Anticoagulantes orales directos en enfermedad tromboembólica venosa: estudios del “mundo real”
Si bien los ensayos clínicos aleatorizados son el están dar para demostrar la eficacia y seguridad de una nueva droga o tratamiento, los estrictos criterios de inclusión y exclusión pueden poner en duda la generalización de sus resultados a la población no seleccionada. Se estima que alrededor del 20% de los pacientes con ETV tienen alguno de los criterios de exclusión de los utilizados en los estudios clínicos y habitualmente también presentan mayor riesgo de TEP y de sangrado107. Los llamados Estudios del Mundo Real (EMR) comprenden estudios observacionales no aleatorizados, estudios de fase IV, registros prospectivos de pacientes, análisis retrospec tivos de bases de datos de asistencia sanitaria o bases de datos de reclamos. Los EMR buscan confirmar las observaciones de los ensayos aleatorizados en cohortes que reflejen la práctica diaria (pacientes añosos, pesos extremos, con comorbilidades) y con un seguimiento habitualmente más prolongado que el de los ensayos clínicos14,108,109. En ETV los EMR nos aportan evidencia sobre eficacia y seguridad de los DOACs en general, en la población de pacientes frágiles y sobre la incidencia de síndrome post trombótico (SPT) en pacientes tratados únicamente con DOACs. Además, ofrecen evidencia sobre la persistencia en el tratamiento anticoagulante en pacientes tratados con DOACs.
a) Eficacia y seguridad: Son numerosos los registros o estudios de cohorte sobre el uso de DOACs en pa cientes con ETV; la mayoría muestran concordancia con los hallazgos de los estudios randomizados en cuanto a incidencia de retrombosis y hemorragia mayor108-114. El Registro Global de Anticoagulantes en el Campo en Tromboembolismo Venoso (GARFIELD-VTE) es un estudio prospectivo, de no intervención, diseñado para evaluar las estrategias terapéuticas en pacientes con ETV tratados según las prácticas locales habituales109. El registro comparó los efectos de los DOACs y los antagonistas de la vitamina K a los 12 meses después del diagnóstico de ETV. Incluyó 7987 pacientes, 60% recibían DOACs (80% rivaroxabán, 13% apixabán, 5% dabigatrán y 2% edoxabán). No hubo diferencias significativas en edad y sexo en ambos grupos de tratamiento. La recurrencia de ETV fue similar en ambos grupos al igual que el riesgo de hemorragia mayor. Los sitios de sangrado más frecuentes en pacientes con DOACs fueron uterino (16.2% vs. 15.3% en pacientes con AVK) y el tracto gastrointestinal superior (13.5% vs. 8.3% en pacientes con AVK) o inferior (16.2% vs. 19.4% en pacientes con AVK). Sin embargo, la mor talidad por todas las causas a 12 meses de tratamiento fue menor en los tratados con DOACs. Además, los que recibían DOACs tenían menos probabilidades de sufrir una hemorragia fatal que aquellos con AVK (1.4% vs. 4.3%). En el registro Dresden113,114 en los tratados con rivaroxabán (N = 418, media de seguimiento: 862 días) la tasa de ETV recurrente y de sangrado mayor fue de 1.9% y 3.8% respectivamente. En tratados con apixabán (N = 352, mediana de seguimiento 22 meses) la tasa de ETV recurrente y sangrado mayor fue 1.3/100 pacientes-año y 1.5/100 pacientes-año, respectivamente.
b) Pacientes frágiles: El Registro Informatizado de Enfermedad Trombo Embólica (RIETE) investigó el uso de DOACs versus anticoagulación estándar en pacientes frágiles con ETV115. El registro definió como frágil a los de 75 años o más, y/o con aclaramiento de creatinina < 50 mL/minuto y/o con peso < 50 kg. El punto final para eva luar fue la combinación de ETV recurrente o hemorragia mayor durante el tratamiento inicial (DOACs vs. HBPM) y durante la terapia a largo plazo (DOACs vs. AVK). Entre enero 2013 y abril 2018 se incluyeron 10054 pacientes (terapia inicial: N = 9049 y largo plazo: N = 6636). En el tratamiento inicial los que recibían DOACs eran más jóvenes, tenían menos probabilidades de presentar TEP (en comparación con TVP) y era menos probable que tuvieran cáncer, anemia o insuficiencia renal que los tratados con HBPM, pero tenían más ETV no provoca da, ETV previa e insuficiencia cardíaca crónica. Los que recibieron DOACs tuvieron una tasa significativamente menor del resultado combinado y de mortalidad que los que recibieron HBPM. No hubo ETV recurrente en los tratados inicialmente con DOACs. El riesgo de hemorragia mayor también fue menor en el grupo tratado con DOACs que en los que recibieron HBPM. Ninguno que recibiera inicialmente DOACs murió de TEP o hemorragia. Cuando se evaluó la terapia a largo plazo, los que recibían DOACs tenían menos probabilidades de tener insuficiencia renal y más probabilidades de tener ETV previa, insuficiencia cardíaca crónica o una hemorragia mayor reciente que los que recibían AVK a largo plazo. La mediana de la duración del tratamiento con DOACs fue la mitad que la de los AVK (96 vs. 172 días, respectivamente). La pro porción de los que recibieron la dosis recomendada de DOACs fue para rivaroxabán 65%, para apixabán 68%, para dabigatrán 55% y para edoxabán 61%; muchos de estos pacientes tenían antecedentes de hemorragia grave reciente, insuficiencia renal grave, insuficiencia hepática o trombocitopenia.
c) Síndrome postrombótico: Se define como SPT a los signos y síntomas de insuficiencia venosa crónica de distinta gravedad que suceden entre los 3-6 meses hasta 2 años luego de una TVP aguda y que pueden afectar la calidad de vida, producir discapacidad y representar una carga para el paciente y el sistema de salud. La incidencia de SPT a los 2 años luego de una TVP aguda es de 20- 50% cuando se utiliza el score de Villalta111. En pacientes con anticoagulación sub terapéutica, el riesgo de SPT es 2-3 veces mayor que en aquellos con anticoagulación en rango. El registro nacional danés de pacientes116 evaluó a casi 20 000 pacientes con un primer episodio de ETV (45% con TEP), tratados con warfarina (N = 11.390, 57%) o con rivaroxabán (N = 8.567, 43%). La incidencia de SPT a 3 años fue 0.55/100 pacientes-año y 0.53/100 pacientes-año en tratados con warfarina y rivaroxabán, respectiva mente. El estudio US MarketScan117, que incluye datos de bases de datos comercial y de Medicare, evaluó 10463 pacientes con TVP tratados con rivaroxabán y 26494 trata dos con AVK, entre enero 2012 y junio 2015. Rivaroxabán se asoció con una reducción de 23% (IC 95%16-30) de STP comparado con warfarina (3.69 vs 4.73 eventos por 100 pacientes-año, respectivamente). El beneficio del uso de rivaroxabán versus warfarina se mantuvo en forma significativa aun cuando se evaluó únicamente SPT con úlcera venosa (1.11 vs. 1.38 eventos por 100 personas-año, respectivamente. Prandoni y col.118 evaluaron una cohorte prospectiva de 309 pacientes ambulatorios con TVP proximal, tratados con DOACs (84% rivaroxabán, 12% apixabán, 4% dabigatrán) seguidos durante 3 años. Compararon la incidencia de trombosis residual y de SPT en la cohorte prospectiva y en una cohorte histórica de 1036 pacientes tratados con AVK entre 2003 y 2009. La presencia de SPT fue 40% menor en el grupo de DOACs vs.AVK. Dos metaanálisis recientes que incluyeron, ade más de RCT, estudios de cohorte prospectivos, estudios de corte transversal y retrospectivos, observaron menor incidencia de SPT con DOACs versus AVK119,120. En el metaanálisis de Li y col.119 la incidencia de STP en los diferentes estudios fue muy variable tanto en los pacientes tratados con rivaroxabán (14%-50%) como en los tratados con AVK (5%-67%). En total, el STP se produjo en 28% en el grupo de rivaroxabán y en 42%en el grupo de los AVK. En el análisis global, independientemente del diseño de los estudios, el rivaroxabán se asoció con una significativa menor incidencia de STP. Este beneficio se mantuvo al considerar los diferentes grados de severidad del SPT. Karathanos y col.120 observaron similares resultados (SPT en pacientes tratados con rivaroxabán vs. warfarina).
d) Persistencia en el tratamiento: El Registro Dres den113,114 ofrece evidencia sobre la persistencia de pacientes en el tratamiento con rivaroxabán y apixabán. A los 6 meses, 58% y 68% de aquellos en tratamiento con rivaroxabán y apixabán, respectivamente, continuaban en tratamiento.
Los DOACs son una alternativa correcta para el trata miento inicial de la ETV, especialmente para el paciente que se manejará ambulatoriamente, que tiene cáncer sin factores de riesgo de sangrado o que hará un tra tamiento anticoagulante corto y no desea concurrir al monitoreo de la anticoagulación. También en el que no logra un adecuado TRT a pesar de la correcta adheren cia o que requiere tratamiento anticoagulante a largo plazo con una dosis menor del agente antitrombótico.
Estos pacientes no necesitan un control de coagulación para ajustar la dosis del medicamento, pero deben concurrir a la consulta del profesional para tener un seguimiento cercano de su enfermedad, especialmente en la etapa aguda de la misma.
Habitualmente los pacientes elegidos para manejo ambulatorio tienen escasas comorbilidades y en la práctica cotidiana del consultorio tienen bajo riesgo de sangrado, buena adherencia al tratamiento y pueden hacerse responsables del mayor compromiso que significa iniciar un tratamiento anticoagulante en el domicilio.
Profilaxis antitrombótica en enfermedad tromboembólica venosa con anticoagulantes directos
Artroplastía de cadera y rodilla. Profilaxis alejada con anticoagulantes orales directos.
Si bien todas las guías internacionales (ACCP 2012, NICE 2019, AAOS 2013, Europa 2018)121-124 de profilaxis antitrombótica incluyen hoy a la aspirina (AAS) como una alternativa válida para la tromboprofilaxis en la cirugía de reemplazo de cadera y de rodilla, NO todos los pacientes pueden manejarse solo con antiagregantes plaqueta rios125. Es claro que el escenario de la tromboprofilaxis y el riesgo tromboembólico ha cambiado en los últimos 20 años y esto ha favorecido la posibilidad de uso de AAS. Por un lado los puntos finales de los trabajos de investiga ción han cambiado, hoy solo se consideran como válidos los estudios que describen eventos clínicos sintomáticos de ETV y no la trombosis detectada en flebografías. En estos trabajos la aspirina ha tenido un buen desempeño en pacientes sin riesgo elevado de trombosis. Por otro lado, diversos factores han impactado favorablemente a la cirugía ortopédica mayor, reduciendo el riesgo elevado de trombosis. La cirugía utiliza hoy técnicas diferentes, menos cruentas, el uso rutinario de ácido tranexámico ha reducido significativamente el sangrado y el requerimiento de transfusiones y especialmente, se ha desarrollado un nuevo concepto forzando una “deambulación precoz”,que es uno de los pilares para la menor incidencia de ETV Existe un grupo de pacientes que son en promedio más jóvenes (menores de 75 años y sin comorbilidades) que han recibido una cirugía denominada fast track, que ya caminan antes de las primeras 48-72 horas del procedi miento quirúrgico y que con frecuencia son egresados de la institución en forma temprana entre el segundo y cuarto día pos-operatorio126. Estos pacientes, que son de muy bajo riesgo tromboembólico, deben recibir una HBPM en la internación y podrían recibir tromboprofilaxis a partir del quinto día con aspirina únicamente, como recomiendan las últimas guías internacionales127. Para los pacientes de alto riesgo trombótico se sugiere, en cambio, una profilaxis más intensiva. Los DOACs son una alternativa conveniente a las drogas parenterales para la prevención del tromboembolismo venoso postoperatorio en la artroplastia de cadera y rodilla con muy alto riesgo tromboembólico. En estos pacientes no basta solo con aspirina para la profilaxis a largo plazo. Los DOACs han demostrado eficacia y seguridad equivalente a las HBPM en profilaxis de ETV en artroplastia de cadera y rodilla. En los estudios prospectivos evaluados mediante una venografía, comparado con HBPM el rivaroxabán demostró mayor eficacia, pero a costa de mayor sangrado, el dabi gatrán resultados semejantes y apixabán menor sangrado con igual trombosis128-131. Las siguientes características elevan el riesgo de ETV en el postoperatorio y por ende se sugiere utilizar profilaxis antitrombótica con HBPM o DOACs en lugar de aspirina:
- Paciente mayor de 75 años y con dificultades en la deambulación
- Procedimiento de revisión de cadera
- Diagnóstico concomitante de cáncer activo o en tratamiento con quimioterapia
- Antecedente de ETV previa
- Antecedentes de trombofilia
- Inmovilidad prolongada posoperatoria o que no deambula al alta
- Antecedente de otra cirugía mayor reciente
La duración de la tromboprofilaxis debiera ser de 30 a 40 días en artroplastia de cadera y 15 a 30 días en personas sometidas a artroplastia de rodilla dependiendo de la existencia de estos criterios de alto riesgo trom bótico121. Entre las ventajas de los DOACs, comparado con las HBPM, se destacan la simplicidad de la vía oral, que los costos de los DOACs son menores y que no requieren personal de enfermería para la aplicación del medicamento122,124.
La dosis y comienzo de administración de los DOACs depende del agente utilizado (Tabla 11). En ninguna circunstancia se deben utilizar DOACs como trombopro filaxis previo a la cirugía, su uso siempre es posterior a la misma. En el caso de dabigatrán la dosis inicial en artro plastia de cadera y rodilla es a las cuatro horas del cierre quirúrgico y ajustada al 50%, es decir dos cápsulas de 75 mg (en total 150 mg) en una toma. Luego se administra una dosis de 220 mg una vez al día (dos cápsulas de 110 mg). Esta dosis se ajusta en mayores de 75 años o que estén en tratamiento con ciertos medicamentos como amiodarona o verapamilo o que tengan un aclaramiento de creatinina entre 30 y 50 ml por minuto. En estos casos la dosis de inicio se ajusta y será de una sola cápsula de 75 mg de dabigatrán y luego una cápsula de 150 mg por día hasta completar el tratamiento131. Para el rivaroxabán la primera dosis es a las ocho horas de la cirugía y se da en forma fija 10 mg por día sin ajuste por peso u otros factores129,130. Para el apixabán la dosis de inicio es al día siguiente de la cirugía (entre 12 y 24 horas del cierre quirúrgico) y se da en forma fija 2.5 mg cada 12 horas128. Si se utiliza HBPM durante la internación y luego, al mo mento del alta, se decide rotar a un DOAC (uso fuera de prospecto) se debe iniciar el anticoagulante directo 24 horas luego de la última dosis de la HBPM.
Fractura de cadera: La evidencia actual es insuficiente para indicar un DOAC en cirugía por fractura de cadera, aunque se ha planteado su uso (fuera de prospecto) luego del alta para la profilaxis extendida durante 30 días como está sugerido en el reciente consenso argentino inter societario de fractura de cadera132. No deben utilizarse DOACs durante la internación en el período previo a la cirugía en pacientes con fractura de cadera, en este caso se debe usar siempre una HBPM.
Otros escenarios para tromboprofilaxis con anticoagulantes orales directos en cirugía
En enfermedad quirúrgica de miembros inferiores infrapa telar la utilización de DOACs es una alternativa creciente por su facilidad y comodidad de uso, a pesar de que aún no hay estudios clínicos que validen esta indicación. La dosis propuesta es la misma que para el RTC y RTR. El estudio PRONOMOS demostró buen desempeño del rivaroxabán 10 mg en cirugía ortopédica NO mayor de miembros inferiores comparado con la HBPM133.
Por el contrario, en la cirugía abdominal de alto riesgo tromboembólico no se recomienda el uso de los DOACs como profilaxis antitrombótica122. Los nuevos agentes tienen una alta concentración de la droga activa en el tubo digestivo (por la excreción del sistema de la gp-P o en el caso del dabigatrán por la baja biodisponibilidad de la droga) y es probable que esto incremente el riesgo de sangrado local en el lecho quirúrgico, por lo que no se han hecho estudios en este tipo de cirugía4. Sin embargo, en un estudio piloto de 400 pacientes con tumores gine cológicos que no incluye cirugía del tubo digestivo, se ha utilizado apixabán 2.5 mg cada 12 horas comparado con enoxaparina por un mes en profilaxis alejada en cirugía de cáncer de útero y de ovario con resultados semejantes de seguridad y de eficacia a las HBPM134.
Manejo de la anestesia neuraxial (anestesia raquídea o epidural/espinal) con anticoagulantes orales directos
Ciertas circunstancias con el uso de drogas anticoagulan tes en este tipo de anestesia pueden aumentar el riesgo de producir un hematoma espinal o epidural y paraparesia o paraplejía asociada al procedimiento. Esto ocurre en el caso de una cirugía espinal previa, punción lumbar trau mática o reiterada, el uso de catéter epidural continuo y el uso concomitante de antiagregantes o anticoagulantes (Tabla 12). El uso de DOACs en este escenario no ha sido correctamente evaluado en estudios clínicos, pero debemos considerar las medidas sugeridas con otros anticoagulantes. En caso de catéter de analgesia retirar el catéter al menos 5 horas antes de la dosis inicial del DOAC15
Profilaxis con anticoagulantes orales directos en pacientes clínicos internados
Ninguno de los anticoagulantes directos que tenemos en nuestro medio han demostrado utilidad por sobre las HBPM en profilaxis primaria en pacientes clínicos inter nados y por lo tanto no deben utilizarse en ese contexto. Solo el betrixabán y rivaroxabán han sido aprobados por la FDA para la profilaxis extendida en pacientes inicialmente hospitalizados por motivos clínicos. Betrixabán 160 mg (dosis de carga) seguido por 80 mg por día, durante 35 a 42 días (tromboprofilaxis extendida) redujo el riesgo de eventos de ETV en comparación con enoxaparina 40 mg por día, durante 10 a 14 días y sin incrementar la incidencia de sangrado mayor135. Rivaroxabán 10 mg por día ha sido aprobado en pacientes clínicos de riesgo136. Se ha propuesto para quienes tienen factores de riesgo persistentes o de alto riesgo al momento del alta como edad mayor a 75 años, antecedente de cáncer activo o de ETV previa o la presencia de valores de dímero-d elevado (valor superior normal × 2) o la suma de dos de los siguientes: antecedente de tromboflebitis superficial, obesidad, várices o insuficiencia venosa crónica, tera pia hormonal, paresia de MMII, uso de eritropoyetina o trombofilia86. En la actualidad también se ha sugerido el uso de bajas dosis de rivaroxabán de 10 mg por día para pacientes con COVID-19 con marcadores de alto riesgo de ETV para el uso luego del alta por un mes137,138.
Los DOACs se han utilizado también en la tromboprofi laxis de pacientes que realizan vuelos prolongados debido a la facilidad de su uso, sin embargo, no hay estudios clínicos respaldando a los anticoagulantes directos en este escenario clínico y no han sido aprobados para esta indicación específica. Como se puede ver en algunas guías cuando se utilizan los DOACs como tromboprofilaxis en vuelos se administran a la dosis habitual de profilaxis antitrombótica, y solo en pacientes considerados de muy alto riesgo trombótico como los portadores de trombofilias de alto grado, los que tienen un antecedente de ETV y los pacientes oncológicos139,140.
Profilaxis con anticoagulantes orales directos en cáncer para pacientes ambulatorios con quimioterapia
Si bien la recomendación actual en las guías interna cionales es solo hacer profilaxis primaria en pacientes oncológicos con mieloma múltiple y en algunas subpo blaciones con tumores de alto riesgo trombótico y bajo riesgo de sangrado, hoy un mayor número de casos podrían beneficiarse de la prevención antitrombótica, especialmente con los DOACS, por su facilidad de manejo y costo. Estos deben ser sujetos con alguna forma de evaluación que determine alto riesgo de ETV y sin riesgo de sangrado semejantes a los pacientes de tratamiento de trombosis y cáncer con DOACs95,100,141,142. En dos estudios con apixabán (estudio AVERT)143 y con rivaroxabán (estudio CASSINI)144 se utilizó como marcador de riesgo trombótico al score de Khorana ≥ 2. En estos pacientes con tumores muy trombogéni cos como cáncer gástrico, de páncreas o pulmón, con enfermedad oncológica localmente avanzada o con metástasis y quimioterapia con platino o gemcitabina se puede considerar el uso de anticoagulantes directos por seis meses en lugar de HBPM. Los pacientes reclutados en los estudios mencionados eran pacientes con riesgo bajo de sangrado por no tener plaquetopenia, contar con una adecuada función renal, no tener tumores lo calizados en tubo digestivo o en SNC y tampoco tener interferencia de la quimioterapia con los DOACs. En estos casos, con bajo riesgo de sangrado, el uso de profilaxis primaria con DOACs redujo significativamente los eventos trombóticos sin aumentar el sangrado. El riesgo de sangrado en ambos estudios fue bajo (< 2%) y el sitio de sangrado fue predominantemente digestivo. La dosis de tromboprofilaxis solo fue evaluada para apixabán, 2.5 mg cada 12 horas y para rivaroxabán, 10 mg una vez por día.
La indicación de tromboprofilaxis con DOACs ha cam biado en los últimos años en cirugía ortopédica mayor de miembros inferiores con la cirugía fast track en pacientes con bajo riesgo trombótico. Hoy los DOACs se pueden indicar en aquellos con muy alto riesgo de ETV y su practicidad permite extender la prevención en una forma mas amigable comparado con las HBPM. Debemos comprender que los DOACs tienen limitacio nes y es necesario conocer las ventajas y desventajas de cada uno de ellos.
En algunas circunstancias se ha planteado el uso de DOACs como prevención primaria de trombosis, como en pacientes con cáncer donde el nivel de evidencia aún es escaso pero alentador. El uso fuera de pros pecto de DOACs no debe hacerse como una conducta rutinaria, ya que no se pueden homologar los resulta dos de otros anticoagulantes a todas las indicaciones de tromboprofilaxis.
Tratamiento de trombosis en sitios inusuales con anticoagulantes orales directos
Trombosis de senos venosos cerebrales
El único DOAC evaluado en un estudio clínico aleatoriza do en esta enfermedad es el dabigatrán y los resultados fueron semejantes al tratamiento anticoagulante tradicio nal con heparina y AVK con lo que podríamos usarlo en la dosis de 150 mg cada 12 horas luego de cinco días de heparina. Como consideraciones especiales debemos excluir del uso de DOACs a pacientes con transformación hemorrágica de la trombosis cerebral, que estén en coma, que requieran anticonvulsivantes, ya que la mayoría de ellos interfieren con los DOACs o que la trombosis de senos venosos cerebrales sea secundaria a un tumor, traumatismo o infección local145,146.
Trombosis esplácnica
No hay adecuada evidencia para justificar el uso de DOACs, especialmente porque la mayoría de ellos tienen un importante catabolismo hepático y muchos de estos pacientes tienen compromiso de la función hepática y alto riesgo de sangrado digestivo por hipertensión portal, plaquetopenia asociada a hiperesplenismo o por una mayor concentración del DOAC asociado al deterioro del citocromo 3A4147. El rivaroxabán, por ejemplo, está contraindicado en sujetos con falla hepática moderada y grave (Child Pugh B y C). También los pacientes que tienen una trombosis mesentérica pueden tener una ab sorción errática de los DOACs por congestión intestinal y esto podría afectar su efectividad. En aquellos casos con trombosis esplácnica y antecedente de hemorragia digestiva por várices esofágicas no controladas, trombosis asociada a cáncer o que tengan cirrosis avanzada no se debería considerar a los DOACs como una alternativa válida, porque no conocemos su eficacia y riesgo de complicaciones en este contexto. Recientemente se ha planteado el uso de DOACs en pacientes sin cirrosis y con trombosis portal incidental o sintomática147,148. En este caso el dabigatrán es, de los anticoagulantes directos, el que se elimina en menos del 10% por el hígado y no re quiere del citocromo 3A4 hepático para su catabolismo24, además de tener un agente reversor disponible. Pero de todas formas su uso será fuera de prospecto, ya que no hay estudios adecuados usando este agente, solo aisla dos informes de casos con cirrosis leve Child-Pugh A147.
El uso de DOACs en trombosis de sitios inusuales como la de senos venosos cerebrales o trombosis esplácnica solo cuenta con escasa evidencia y en todos los casos se deben considerar primero otras alternativas terapéuticas y las limitaciones de cada uno de ellos en estas enfermedades. Su indicación debe ser consensuado con el paciente, entendiendo que hoy no está aprobado su uso por las autoridades regulatorias en Argentina.
Rol del laboratorio de hemostasia en el tratamiento con anticoagulantes orales directos
El rol del laboratorio en los anticoagulados con DOACs va a depender del objetivo del estudio, si es solo detectar la presencia de la droga anticoagulante o medir su concen tración en forma cuantitativa. Si bien no es necesario el monitoreo de laboratorio de los DOACs para ajustar su dosis, hay que recordar que tanto las pruebas basales como los ensayos especiales realizados en el laboratorio de hemostasia, podrían verse afectados por la presencia de los anticoagulantes directos en el plasma. El grado de afectación dependerá de la concentración del DOAC en sangre al momento de la extracción de la muestra, lo cual a su vez dependerá de la dosis que recibe el paciente y del tiempo transcurrido desde la ingesta de la droga: si es en el valle (24 o 12 horas desde la última toma, según si requiere 1 o 2 tomas diarias) o en el pico (2-4 horas de la toma), así como también de la variabilidad interindividual. La Tabla 13 muestra las concentraciones esperadas en el pico y en el valle de los DOACs comunicadas en los ensayos clínicos.
Las pruebas básicas de hemostasia no son útiles para predecir complicaciones hemorrágicas o trombóticas en anticoagulados con DOACs. Aunque se mencionó que no es necesario medir el efecto anticoagulante de estos nuevos agentes, existen situaciones clínicas en las que puede ser útil contar con la determinación cuantitativa de estas drogas149,150 con distintos objetivos:
- Frente a un procedimiento o cirugía no programada, o previo a la anestesia peridural/ neuroaxial, o a la reali zación de procedimientos invasivos de emergencia como punción lumbar.
- Para facilitar la toma de decisiones en caso de complicaciones hemorrágicas, especialmente sangrado mayor, o trombóticas, por ejemplo, si hubiera necesidad de administrar trombolíticos de urgencia frente a un evento isquémico cerebral.
- Para determinar si existe bioacumulación del me dicamento por interacciones medicamentosas o por un deterioro inesperado de la función hepática o renal, especialmente en añosos con aclaramiento de creatinina en el límite de lo normal.
- En el caso de una intervención quirúrgica programada con alto riesgo de sangrado, en la que se necesite certifi car la ausencia de cualquier anticoagulante.
- Para comprobar la adherencia del paciente al trata miento anticoagulante, o si toma una dosis mayor a la recomendada.
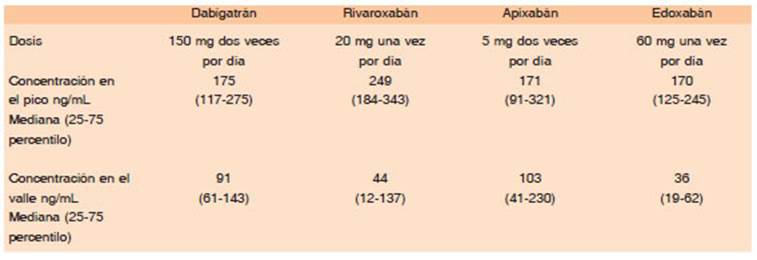
Tabla 13 Concentración de anticoagulantes directos esperada en el pico y en el valle en pacientes anticoagulados149
Detección cualitativa de los anticoagulantes orales directos a través de las pruebas básicas de coagulación
Los DOACs, debido a su efecto anti-IIa o anti-Xa pueden interferir en los ensayos de punto final coagulométrico. Estudios realizados con plasmas normales adicionados in vitro con droga o plasmas de pacientes anticoagulados con ellas, han demostrado que el efecto depende tanto del tipo de droga, como del par “reactivo/sistema de detección del coágulo” utilizado, sumado a una gran variabilidad intra e interindividual149-154 Cada profesional debería conocer el comportamiento del sistema que utiliza tanto para el tiempo de protrombina (TP) como para el tiempo de trom boplastina parcial activado (APTT) y cómo son afectados por la presencia de los DOACs en su propio laboratorio.
Tiempo de protrombina: Para una dada concentración, el dabigatrán prolonga el tiempo de protrombina (TP) en forma concentración dependiente con una amplia varia bilidad entre los distintos reactivos. Para 200 ng/mL de dabigatrán en sangre, la relación TP paciente/TP normal varía entre 1.33 y 1.88 dependiendo del reactivo utilizado. Para el rivaroxabán, el TP también se prolonga de forma diferente de acuerdo con el origen de la tromboplastina y al tipo de detección del coágulo que se utilice. Para 120 ng/mL de rivaroxabán en sangre, la relación TP paciente/ TP normal varía de 1.15 y 1.56, dependiendo del par “reactivo/sistema de detección”. Un TP normal, usando reactivos sensibles, sugiere que el nivel de rivaroxabán no es alto, pero no se puede excluir totalmente su pre sencia149-154. Para el apixabán, el TP solo se prolonga a concentraciones más elevadas que para el rivaroxabán e incluso puede ser normal hasta concentraciones de apixabán de 200 ng/mL cuando se utilizan algunos re activos que demostraron ser muy poco sensibles. Por lo tanto, un TP normal en un paciente anticoagulado con apixabán, no excluye la presencia de la droga a con centraciones terapéuticas. El motivo de la diferencia de comportamiento de las distintas tromboplastinas a la presencia de rivaroxabán o apixabán en plasma no ha sido esclarecido aún. La prolongación del TP tiende a una meseta a concentraciones muy elevadas de la dro ga por lo que no se alcanzan valores de TP superiores al rango de medición, a diferencia de lo que ocurre con los anticoagulantes orales AVK. En anticoagulados con DOACs no se recomienda informar el TP como RIN.
Tiempo de tromboplastina parcial activado (APTT): Está prolongado de manera no lineal con la concentra ción de dabigatrán. Los distintos reactivos comerciales difieren en su sensibilidad. La relación APTT paciente/ APTT normal ha sido informada entre 1.43 y 1.71 para diferentes reactivos y una concentración de dabigatrán de 100 ng/mL. Un APTT normal no excluye la presencia de dabigatrán en sangre149-154. El Tiempo de Coagulación Activado (ACT) medido en segundos, se prolonga por la presencia de dabigatrán y esto complica la interpretación de esta prueba en pacientes que están recibiendo hepari na por un evento coronario. Para el rivaroxabán el APTT se prolonga, también en forma no lineal, pero en mucho menor medida que para dabigatrán. Este efecto es similar, pero aún mucho menor para el apixabán.
Tiempo de trombina (TT): El TT es demasiado sensible a la presencia de dabigatrán en sangre (>150 segundos para un normal de 15-17 s), aún a concentraciones correspondientes al valle, y no es útil para evaluar la concentración de droga. Un TT normal descarta la pre sencia de dabigatrán, pero si el TT está prolongado no indica necesariamente alta concentración de la droga. Si bien hay autores que sugieren que valores de TT menores a tres veces el límite superior normal del en sayo aseguran concentraciones de dabigatrán <50 ng/ mL (que podrían considerarse seguras para abordar una cirugía) los diferentes sistemas de detección de los coagulómetros y la distinta concentración de la trombina empleada como reactivo en el ensayo impiden generalizar un valor de corte de TT para una concentración segura de dabigatrán149,150,155. Por este motivo se sugiere que cada laboratorio establezca su valor de TT expresado en segundos que asegure una concentración de dabiga trán menor de 50 ng/mL. El TT no se ve alterado por la presencia de los DOACs anti Xa149-153,155.
Los dispositivos al pie de la cama (POC) para la deter minación de TP, APTT y el ACT presentaron una pobre correlación y baja sensibilidad a la presencia de DOACs. En estudios comparativos se ha observado que los resul tados están dentro de los valores de referencia, aunque las muestras contengan DOACs a concentraciones tera péuticas, por lo que no está recomendado su uso149,150.
Interferencia de los anticoagulantes orales directos en las pruebas de hemostasia
La interferencia de los distintos DOACs, aún a bajas con centraciones, sobre las distintas pruebas de hemostasia ha sido ampliamente demostrada. El conocimiento del efecto de la presencia de los DOACs sobre el ensayo que se está realizando es de vital importancia para evitar errores diagnósticos en el momento de la validación de los resultados. La Tabla 14 resume los efectos de los diferentes anticoagulantes directos sobre los distintos ensayos de coagulación. Como regla general se podría decir que en mayor o menor medida se ven afectados to dos los ensayos de punto final coagulometrico149,150,156-158.
Para una dada concentración de dabigatrán, la mayor o menor influencia sobre la determinación de fibrinógeno (método de Clauss) está relacionada con la concentración de trombina presente en el reactivo. Aquellos reactivos con concentración de trombina menor a 100 NHI/mL ge neran resultados falsamente disminuidos. El fibrinógeno “derivado del tiempo de protrombina” produce valores falsamente aumentados en los anticoagulados con riva roxabán y en menor medida con apixabán, dependiendo de la tromboplastina utilizada en el ensayo, siendo más marcado con tromboplastinas de cerebro de conejo157. Un punto para remarcar es que la presencia de cualquiera de los DOACs en plasma genera resultados falsos positivos de anticoagulante lúpico, razón por la cual deben excluirse su presencia en plasma antes de realizar el diagnóstico156,158. Si bien algunos autores sugieren que la suspensión de los DOACs durante 3 días antes de realizar los estudios, dependiendo de la función renal, sería suficiente para evitar la interferencia, otros mencionan que el tiempo de suspensión debería ser mayor, debido a que el tiempo de veneno de víbora de Russell diluido se ve influido por concentraciones muy bajas de apixabán o rivaroxabán158. Lo aconsejable ante la duda, es excluir la presencia de dabigatrán realizando el TT y la de rivaroxabán o apixabán realizando un ensayo de actividad anti-Xa. Otra opción es remover el DOAC del plasma en estudio, antes de realizar las pruebas. Para ello existen diversos métodos aún no disponibles en Argentina como por ejemplo:
a) DOAC - Stop (agente adsorbente, Haematex Re search, Hornsby NSW, Australia)
b) DOAC Remove (carbón activado, 5 Diagnostics, Suiza).
c) DP-Filter (filtros, 5-Diagnóstica)
d) DOAC filter (filtros, Diagnóstica Stago, Francia)
Estos métodos no son intercambiables y deben utili zarse con precaución en el caso de realizar pruebas de anticoagulante lúpico.
Determinación cuantitativa de anticoagulantes orales directos
El método de referencia para la determinación cuanti tativa de los DOACs es la cromatografía líquida de alta resolución acoplada a espectometría de masa (HPLC/ MS) pero no está disponible en los laboratorios clínicos. Actualmente existen pruebas específicas para medir la concentración en sangre de los DOACs cuyos resultados se expresan en concentración plasmática de la droga (ng/ mL, expresados como dabigatranemia, rivaroxabanemia y apixabanemia). Sin embargo, los reactivos disponibles para estas determinaciones cuantitativas no han sido investigados aún en relación con eventos clínicos y no deben utilizarse para ajustar o modificar la dosis del medi camento en pacientes bajo tratamiento con estos anticoa gulantes. El límite de detección de estas pruebas para los DOACs es de 25-50 ng/ml y muestran buena correlación con las determinaciones realizadas por HPLC / MS hasta una concentración de 500 ng/ml. Las concentraciones determinadas deben ser interpretadas en el contexto de la historia clínica del paciente, el tipo de DOAC, el tiem po desde la última dosis hasta el momento de toma de la muestra y el potencial impacto en la decisión clínica sobre el paciente. (Tabla 14) (ej. previo a procedimientos invasivos y cirugías, estrategias de reversión, etc)149,150,154.
Determinación de dabigatrán: Los métodos adecuados para la cuantificación de dabigatrán incluyen el tiempo de coagulación con ecarina (TCE), el ensayo de ecarina cromogénico (ECE), la inhibición del tiempo de trombina diluido (ITT o DTI) y la determinación de la actividad anti-FIIa cromogénico. Son todas pruebas automatiza bles con coeficiente de variación (CV) inter ensayo de menos de 15%. Utilizando calibradores de dabigatrán con matriz plasmática, estos métodos han demostrado ser comparables entre ellos y con HPLC/MS149,151 (Tabla 15) (Anexo 2).Utilidad de la determinación de dabigatrán en pacientes tratados con idarucizumab: dado que podría existir un efecto rebote debido a la disociación idarucizu mab-dabigatrán entre las 12-24 horas posteriores a su administración, la determinación de dabigatrán plasmático podría ser de utilidad para decidir si es necesario infundir una segunda dosis del antídoto159.
Determinación de apixabán o rivaroxabán: Los niveles de apixabán y rivaroxabán en sangre se determinan por el método cromogénico de actividad anti Xa (anti- Xa), sin agregado de antitrombina. Se deben emplear calibradores y controles específicos, ya sea para apixabán o rivaroxa bán y no pueden intercambiarse entre ellos, ni usar otros controles de anti-Xa, como el de las HBPM. Numerosos estudios han demostrado que los ensayos que determinan la actividad anti-Xa por método cromogénico son muy sensibles a la presencia de la droga anticoagulante en cuestión y correlacionan muy bien con HPLC/MS. Si no se dispone de los calibradores específicos, se puede realizar el ensayo de actividad anti- Xa calibrado con HBPM, sólo para excluir la presencia de la droga, pero no para cuan tificarla. Para una dada concentración de rivaroxabán y apixabán los valores de actividad anti -Xa con la metódica de HBPM son diferentes con cada dupla coagulómetro/ reactivo (Tabla 15)151,154,160,161. Utilidad de la determinación de rivaroxabán o de apixabán en pacientes tratados con andexanet alfa: Las guías internacionales (FDA; EMEA) no recomiendan evaluar los niveles de rivaroxabán o apixabán post infusión de andexanet. No obstante, se podría medir el nivel de anticoagulante para evaluar si se utilizará un régimen de baja o alta dosis de andexanet. Por otro lado, los métodos de anti Xa han demostrado tener limitaciones en medir correctamente la concentración de droga en presencia del agente reversor. Uno de los pro blemas es que la dilución del plasma con que se realizan los ensayos podría causar la disociación del inhibidor del complejo andexanet-rivaroxabán o andexanet-apixabán) elevando falsamente los niveles de droga anticoagulante medida. La determinación de los niveles de anti Xa no debería demorar el inicio del tratamiento con el reversor, sobre todo en pacientes con sangrado intracraneal150.
Requerimientos de calidad en la determinación cuantitativa de anticoagulantes orales directos
Las muestras de sangre para la determinación cuanti tativa de DOACs deben extraerse en tubos con citrato de sodio 3.2% cumpliendo las recomendaciones de una muestra adecuada para estudios de coagulación162,163. Las muestras deben procesarse antes de las 8 horas de extraídas para la determinación cuantitativa de dabigatrán, rivaroxabán o apixabán; también pueden conservarse a -20 °C tres meses o a -80°C durante un año149,150. Los ensayos deben ser validados/verificados por los laboratorios según corresponda, antes de utili zarlos para informar los resultados de pacientes. Para la verificación se deben realizar estudios de precisión, veracidad y linealidad. Se recomienda utilizar metodologías cuyos CV sean menores de 15% (máximo 20% en los valores cercanos al LOQ). Los laboratorios deben utilizar controles internos de la calidad y participar en programas externos de evaluación de la calidad para la determinación cuantitativa de DOACs (Programas de ac ceso en Argentina: CAP College American Pathologists; ECAT European action for thrombosis). En caso de no acceder a estos últimos, al menos deben hacerse com paraciones de muestras de pacientes con laboratorios pares especializados.
Si bien no existen valores comunicables establecidos en el pico de actividad de los DOAcs debido a la alta variabilidad intra e interindividual en la concentración de droga, en el valle una concentración de DOAC mayor a 200 ng/mL se considera un valor comunicable.
El laboratorio de hemostasia con los DOACs puede resultar de utilidad en casos específicos.
Pacientes con una misma concentración de DOAC presentan diferentes resultados de TP y APTT de acuerdo con el reactivo utilizado y el momento de la toma de la muestra.
Un TP normal en un paciente con rivaroxabán o apixa bán no excluye niveles clínicamente relevantes de la droga en plasma. El cálculo del RIN no es de utilidad con los DOACs.
Un APTT normal no excluye la presencia de dabigatrán a niveles clínicamente relevantes.
Un TT normal asegura la ausencia de dabigatrán en plasma, pero no es de utilidad para los agentes anti Xa.
Existe una marcada interferencia en algunas pruebas de coagulación con los DOACs, con lo que siempre debemos estar atentos a suspenderlos antes de reali zar estos estudios, como por ejemplo para el dosaje de factores de coagulación o para estudios de trombofilia, especialmente de anticoagulante lúpico.
Las pruebas específicas para medir la concentración de DOACs en sangre pueden ser de utilidad en algu nas circunstancias, como ante una cirugía de urgencia o ante un sangrado, pero no se necesita hacer un monitoreo de coagulación rutinario con los DOACs y los resultados de estas mediciones no se han correla cionado hasta el momento con eventos clínicamente relevantes de trombosis o de sangrado.
Uso correcto de los anticoagulantes orales directos
La facilidad de uso de los DOACs, sin la necesidad de monitoreo de coagulación para el ajuste de dosis por un es pecialista en hematología, ha generado un nuevo escenario para el manejo de la anticoagulación en estos pacientes. Ahora tenemos la posibilidad de que todos los profesionales médicos puedan iniciar y mantener un tratamiento anticoa gulante con los agentes directos. Como es de esperar, este preconcepto “facilista” de que es muy sencillo anticoagular a un paciente puede generar errores en la indicación, forma de uso y dosis de una droga potencialmente peligrosa jus tamente por su acción anticoagulante5-12. Es por esto por lo que todos los facultativos que indiquen un tratamiento con los DOACs deben conocer algunas normas de manejo del paciente anticoagulado.
Educación del paciente anticoagulado 5-10
El paciente con DOACs necesita un mayor cuidado al recibir las instrucciones sobre el tratamiento anticoagu lante al comienzo de éste, simplemente porque luego no requiere de citas mensuales de monitoreo y se corre el riesgo de que cometa errores en el manejo. El hecho de que no tengan interferencia con los alimentos y que sean muy pocos los medicamentos que los afectan, junto con la posibilidad de usar una dosis fija, hace que frecuentemente se dejen de lado las instrucciones sobre lo que significa estar anticoagulado. Uno de los problemas más frecuentes con estos nuevos agentes es la falta de adherencia al tratamiento. En el caso de los AVK, si un paciente no toma el medicamento con la frecuencia que le indica su médico, ya sea por olvido o por desidia, es muy posible que lo detectemos en sus controles de RIN. Mediante la educación permanente, los controles de RIN más frecuentes y un contacto estrecho con la familia, este problema se puede solucionar. Esto no pasará con los DOACs ya que no se necesitan controles de monitoreo. Por lo tanto, las instrucciones iniciales deberán ser una prioridad para cualquier profesional que comience un tratamiento con estos nuevos agentes.
Educación del médico
El médico que indique un DOAC deberá asegurarse de que la enfermedad a tratar cuente con datos provenientes de estudios clínicos adecuados que demuestren beneficio y seguridad del agente anticoagulante y además debe verificar que el paciente a tratar sea similar a los que participaron de los estudios clínicos. Por ejemplo, los estudios en FA excluyeron pacientes con aclaramiento de creatinina < 30 ml/min, ACV reciente (menor a 7 días para apixabán y 14 días para dabigatrán o rivaroxabán), con recuentos de plaquetas < 100 000/mm³, con una cirugía en los últimos 30 días, con antecedente de sangrado grave (cerebral, ocular, retroperitoneal, espinal, gastrointestinal o articular), en el caso de embarazo o lactancia o si tenían antiplaquetarios aparte de aspirina 100 mg por día37-39. Todos estos criterios de exclusión de los estudios aleato rizados han demostrado que aumentan significativamente el riesgo de un evento hemorrágico si no son considerados a la hora de definir la anticoagulación.
También deberá asegurarse de elegir la dosis adecua da para la afección y las condiciones comórbidas de cada caso individual. Un error frecuente es la sub-dosificación, generalmente justificada en una sobrevaloración del riesgo de sangrado. Hasta la mitad de los pacientes que reciben dosis reducidas de DOACs no tienen criterio para dicha reducción. El resultado de esta dosificación incorrecta es un aumento de la mortalidad de hasta el 25%164. En pa cientes con historia de sangrado, el uso de dosis reducidas de DOACs no mostró beneficios, ya que entre el 18 y 24% presentó un nuevo evento hemorrágico165. Un estudio de la vida real en 55000 pacientes con FA mostró que el uso de dosis reducidas de DOACs se acompañó de similar o más eventos trombóticos sin reducción del sangrado respecto de la warfarina166. La información deberá ser analizada críticamente considerando el beneficio/riesgo individual de cada DOAC y/o cada dosis en cada enfermedad.
Finalmente, el médico deberá limitar la indicación de los DOACs a aquellas dolencias donde su eficacia ya ha sido demostrada mediante estudios clínicos de diseño adecuado. Extrapolar indicaciones asumiendo que deberían funcionar de la misma forma por tratarse todos de “agentes anticoagulantes” es incorrecto y puede exponer al paciente a fallos peligrosos como ya sabemos que ocurre en reemplazos valvulares mecánicos, SAFL triple positivo, miocardiopatía dilatada sin FA, luego de reemplazo valvular trans-catéter (TAVI) o en un ACV de origen incierto y sin fuente cardioembólica evidente (ESUS)85 donde los DOACs no están indicados.
Inicio de anticoagulación con anticoagulantes orales directos 4-12
A diferencia de los AVK, el efecto anticoagulante de los DOACs será inmediato y completo. Siempre se debe contar con un laboratorio basal antes de iniciar el trata miento anticoagulante con estos agentes, que debe incluir un hemograma con recuento de plaquetas, creatinina, hepatograma (TGO/TGP, bilirrubina total), TP y aPTT. En el caso de cualquier trastorno basal de la hemostasia como recuento de plaquetas < 100 000/mm³, TP o aPTT alterados se debe replantear la conducta respecto a la indicación de un DOAC y consultar con el hematólogo. Previo al uso de los anticoagulantes directos es necesario interrogar al paciente acerca de antecedentes de sangra do digestivo alto y bajo, especialmente si se piensa indicar dabigatrán o rivaroxabán, ya que en los ensayos clínicos se los ha asociado a mayor hemorragia gastrointestinal que la warfarina. Los sujetos con hepatopatía moderada o grave tampoco pueden recibir un DOAC como primera alternativa de anticoagulación. Siempre se debe calcular el aclaramiento de creatinina, ya que la dosis tanto de dabigatrán como de rivaroxabán, se ajusta con un acla ramiento < 50 ml/minuto. Si el valor del aclaramiento de creatinina es menor a 30 ml/ minuto no se recomienda el uso rutinario de los nuevos anticoagulantes por el riesgo de bioacumulación. Tal vez la única excepción es el apixabán, que ha sido evaluado en pacientes con falla renal grave en algunos estudios comparado con warfarina167. Cada uno de los DOACs requiere una dosis y forma de administración diferente, por lo que conviene familiarizarse con al menos una de estas drogas para el manejo habitual. Por ejemplo, el dabigatrán solo se puede retirar del blister inmediatamente antes de su ingesta y no se puede guardar en un pastillero. El rivaroxabán siempre debe ingerirse con el almuerzo o la cena para mejorar su absorción con los alimentos. El apixabán y dabigatrán siempre se administran cada 12 horas en el tratamiento anticoagulante.
Valoración del riesgo de sangrado, concepto de paciente frágil168-171
El sangrado es el principal efecto secundario de cual quier anticoagulante, principal motivo de consulta a los servicios de emergencias y la causa más frecuente de abandono del tratamiento anticoagulante170. En trabajos prospectivos, el sangrado grave comunicado con los AVK fluctúa entre 1 y 3% por año, pero en series de casos con pacientes más frágiles por edad o comorbilidades, puede alcanzar entre 2 y 15% por año, con una mortali dad asociada al sangrado que oscila entre 10 y 30%6-8. El sangrado digestivo es el más frecuente y totaliza las dos terceras partes de los episodios de sangrado mayor, con una mortalidad relativamente baja, entre 15 y 18%. Una hemorragia cerebral, en el paciente anticoagulado con AVK, tiene una mortalidad entre 40 y 50% y totaliza cerca del 90% de todas las muertes asociadas con anticoagulación169. Pero todos estos parámetros epidemiológicos han cambiado con los anticoagulantes directos. El riesgo de sangrado cerebral es 70% menor con DOACs y los porcentajes de mortalidad y secuelas por sangrado son significativamente inferiores. Por el contrario, el sangrado digestivo es 40% más frecuente con los DOACs compara do con la warfarina, especialmente con la dosis mayor de dabigatrán de 150 mg cada 12 horas, rivaroxabán 20 mg o edoxabán 80 mg, por lo que en pacientes con antecedente de hemorragia en el tracto gastrointestinal se recomienda utilizar un AVK o eventualmente apixabán171,172. La ingesta de aspirina o AINEs con los DOACs duplica el riesgo de sangrado mayor y clínicamente relevante en los estudios de FA y ETV por lo que su uso debe ser restringido. El tratamiento gastro-protector puede ayudar, pero debemos enfatizar la prioridad de limitar el uso de estos agentes173. Otro grupo de pacientes con mayor riesgo de sangrado por DOACs son las mujeres fértiles donde se ha descripto que el rivaroxabán puede aumentar el sangrado menstrual en el 20-25%174.
Si bien existen diferentes evaluadores de riesgo de sangrado como el score ATRIA, es el score predictor HAS-BLED el que tiene un valor predictivo en 7 trabajos de 0.65 (rango 0.60-0.69) y que resultó el mejor evaluador de riesgo de sangrado para DOACs. El riesgo bajo (0 pun tos) corresponde a 1/3 de los pacientes. Se recomienda con un puntaje de HAS-BLED ≥ 3, tener precaución con el tratamiento anticoagulante, eventualmente ajustar la dosis del medicamento a una menor y tener una revisión del paciente en forma frecuente. El score HAS-BLED es el utilizado en las guías de la Sociedad Europea de Cardiología, la Sociedad Cardiovascular Canadiense, las guías NICE 2014 y guías de la Sociedad Americana de Cardiología AHA/ACC/HRS 2014. En el predictor HAS-BLED el punto de “RIN lábil” no se puede aplicar a los DOACs. Se ha sugerido que pacientes con una puntuación ≥ 3 de HAS-BLED deben intentar corregir los factores de riesgo de sangrado modificables, pero no deben dejar de estar anticoagulados porque el riesgo trombótico generalmente es mayor35.
Los pacientes con un peso menor a 50 kg y con deterioro renal podrían tener mayor riesgo de sangrado con los DOACs, ya que la farmacocinética y farmacodi namia del anticoagulante podrían verse afectadas; pero el impacto clínico de la bioacumulación de droga no fue aún correctamente evaluado. Es posible que en estos pacientes frágiles sea mejor considerar el uso de los AVK con un estricto monitoreo de la anticoagulación, pero la decisión final debe tomarse en conjunto con el paciente y caso por caso175.
Ajuste de dosis de los anticoagulantes orales directos de acuerdo con el riesgo de sangrado
Es frecuente ver que en ETV se administra una dosis me nor a la recomendada para el tratamiento anticoagulante inicial con los DOACs. Sin embargo, la dosis ajustada, ha sido evaluada en estudios clínicos prospectivos solo en pacientes con FA o en profilaxis en cirugía ortopédica mayor y no se ha testeado en el tratamiento de aquellos con ETV. Las razones que justifican ajustar la dosis de los DOACs son: falla renal moderada y grave, edad mayor a 80 años, pesos extremos, interferencia con medicamentos que afecten al citocromo 3A4 hepático o al sistema de la gp-P o pacientes con alto riesgo de sangrado17,22,165. Si bien el uso de una dosis menor y ajustada es una medida acertada en ciertos pacientes, los informes de uso de DOACs que surgen de grandes bases de datos, refieren un uso mucho mayor de la dosis baja. Por ejemplo, la dosis ajustada de apixabán de 2.5 mg cada 12 horas fue testeada en la FA en un acotado número de pacientes, pero con buenos resultados39. En el caso del dabigatrán, una dosis de 75 mg por día fue aprobada por la FDA para los que padecen falla renal grave, pero solo en base a su comportamiento farmacocinético y sin evidencia clínica adecuada176. Para el rivaroxabán, una dosis de 2.5 mg cada 12 horas (la denominada baby dose) ha sido apro bada para el síndrome coronario estable, pero su uso en pacientes con FA y ETV no debe recomendarse62. A favor del uso de dosis ajustada, en un registro reciente denominado STAR 2 para mayores de 85 años, la mayor incidencia de sangrado mayor, comparado con la war farina, se asoció a la dosis plena de los DOACs por no tener en cuenta la edad y otras comorbilidades170. Para pacientes con sobrepeso hasta 120 kg o un índice de peso corporal menor a 40 mg/m² no se requiere un ajuste de dosis de DOACs. Personas con un peso mayor posible mente podrían recibir apixabán o rivaroxabán en la dosis habitual, pero con una evidencia pobre177,178.
Interacciones con otros medicamentos, alimentos o hierbas medicinales
Una de las ventajas de los DOACs sobre los AVK es su bajo potencial de interacción con los alimentos y con otros medicamentos, si bien algunas drogas o hierbas medi cinales deben ser tenidas en cuenta ante la posibilidad de interferencia como esta especificado en el prospecto de cada uno de ellos176,179,180. Por el momento, sin em bargo, la mayoría de la evidencia proviene de estudios farmacocinéticos en voluntarios sanos y muy pocas pu blicaciones han evaluado eventos clínicos de trombosis o de sangrado, especialmente en pacientes añosos o con falla renal asociado a interferencia medicamentosa181,182. Todos los DOACs son sustrato del sistema de transporte de la gp-P, una bomba de transporte que los elimina hacia la luz de la pared intestinal. Inhibidores potentes de la gp-P provocarán que se acumule el anticoagulante en el torrente sanguíneo4-10. Pertenecen a este grupo la dronedarona, quinidina, tacrolimus, ciclosporina, antirre trovirales inhibidores de la proteasa (ritonavir, saquinavir, trepanavir) y antimicóticos azólicos como el ketoconazol, fluconazol, itraconazol, voriconazol o posaconazol. Estas drogas aumentan significativamente la concentración de los DOACs y está contraindicado su uso conjunto con los anticoagulantes directos15. Por ejemplo, el ritonavir aumenta 160% la concentración del rivaroxabán y el ketoconazol aumenta entre 150 y 200% los niveles en sangre de los tres agentes anticoagulantes directos. Los inhibidores menos potentes de la gp-P como amiodaro na, eritromicina, claritromicina, diltiazem o verapamilo, no aumentaron la tasa de sangrado de los DOACs en los estudios clínicos, pero pueden afectar la cantidad de droga disponible en sangre cuando se combinan con otros factores en pacientes frágiles y así aumentar el riesgo de hemorragias. El diltiazem aumenta 30-40% la concen tración del apixabán, y la amiodarona y quinidina entre 12 y 58% al dabigatrán, mientras que la claritromicina aumenta entre 49 y 54% al dabigatrán y al rivaroxabán. Se sugiere que la toma de dabigatrán sea por lo menos 2 horas posteriores a la ingesta de verapamilo, ya que aumenta su concentración entre 23 y 54%, y ajustar la dosis de 220 a 150 mg/día en la profilaxis de artroplastia de cadera y rodilla. Los inductores potentes de la gp-P como rifampicina están contraindicados también, ya que producen una reducción importante en la concentración de los DOACs en el plasma entre 5 y 66% para el dabi gatrán y rivaroxabán y 50% para el apixabán181,182. Otros inductores menos potentes como la carbamazepina, fenobarbital y fenitoína no son recomendados en con junto con el uso de DOACs. También hay interferencia con medicamentos que afectan al citocromo CYP 3A4 hepático, específicamente con los agentes anti Xa, ya que esta enzima metaboliza 33% del rivaroxabán y 25% del apixabán. Así, los inhibidores potentes de esta enzima hepática como ketoconazol y otros antimicóticos azólicos, y antiretrovirales para tratamiento de HIV como ritonavir no pueden usarse junto con anticoagulantes anti Xa directos. Por otro lado, los inductores potentes del citocromo 3A4 provocan acumulación del anticoagulante y tampoco pueden usarse. Entre ellos se encuentra la rifampicina, fenitoina, carbamazepina, fenobarbital y hierba de San Juan (Tabla 16).
Otros medicamentos que debemos considerar porque pueden alterar a los DOACs son los que modifican el pH gástrico. Antiácidos con base en hidróxido de aluminio, magnesio o bicarbonato sólo pueden ser administrados dos horas posteriores a la ingesta del dabigatrán, pero no interfieren con los otros anticoagulantes directos. En cambio, los inhibidores de la bomba de protones (panto prazol, omeprazol, etc.) no afectan a los DOACs181.
Aunque en teoría los alimentos o las hierbas medici nales inhibidoras/inductoras del CYP3A4 o gp-P podrían interferir con la farmacocinética de los DOACs no hay evidencia directa de que esta interacción ocurra182.
Uso simultáneo de otros anticoagulantes: Como norma general no se recomienda el uso conjunto de un agente anticoagulante directo y otras drogas que alteren la he mostasia, como la HNF, HBPM, bivalirudina, fondapari nux, trombolíticos, prasugrel, ticagrelor y antiagregantes potentes inhibidores del receptor de la GP IIb/IIIa. Solo ha sido evaluado el uso simultáneo de los AVK cuando se hace el puente de un nuevo anticoagulante a un dicu marínico, por el lento comienzo de acción de los AVK y la necesidad de superponer las dos drogas para mantener el efecto anticoagulante. También se ha usado simultánea mente un DOAC con bajas dosis de heparina intravenosa para el mantenimiento de un catéter arterial (hasta 10000 U/día HNF)183. La administración concomitante de un DOAC y clopidogrel o aspirina aumentó 60% el sangrado mayor en pacientes con FA, similar a lo que ocurre con los dicumarínicos y solo en casos muy específicos debe mos superponer ambas drogas. Estos pacientes podrían beneficiarse de inhibidores de la bomba de protones15. En el SCA la evidencia muestra mayor riesgo de sangrado con estos nuevos agentes en pacientes con triple terapia anti-trombótica (aspirina más clopidogrel o ticagrelor o prasugrel, asociado a un DOAC) y no debería utilizarse en este contexto184. La recomendación en este caso es utilizar un agente directo solo con clopidogrel.
Contraindicaciones de los anticoagulantes orales directos4-10,22,32,82
Se consideran contraindicaciones para los anticoagulan tes orales directos a las siguientes:
1) Falla renal grave/hemodiálisis (es una contraindica ción relativa para algunos DOACs con menor aclaramiento renal como el apixabán).
2) Hepatopatía grave asociada a trastornos en las pruebas de coagulación (Child Pugh B o C). Pacientes con hepatograma alterado previo al inicio del tratamiento fueron excluidos de los estudios clínicos (TGO x 2 el valor límite superior normal y bilirrubina > 1.5 veces el normal) y se recomienda precaución en su uso.
3) Paciente que podría necesitar el uso de fibrinolíticos (inestable hemodinámicamente en un TEP o con flegma sía dolens) o ante un ACV isquémico agudo en ventana para fibrinolíticos.
4) Reemplazo valvular cardíaco mecánico o FA con enfermedad valvular reumática.
5) Embarazo/lactancia. Potencial de embarazo sin uso apropiado de métodos anticonceptivos (doble barrera).
6) Paciente menor a 18 años (están en marcha estu dios para la población pediátrica).
7) Necesidad de medicamentos con interacción sig nificativa con los DOACs como ritonavir, antimicóticos azólicos (ketoconazol, fluconazol, itraconazol, voricona zol, posaconazol), rifampicina, tacrolimus, ciclosporina. Doble tratamiento antiagregante.
8) Mala adherencia al tratamiento anticoagulante o falta de supervisión si el paciente no comprende los riesgos de éste.
9) Hemorragia activa clínicamente significativa, coagu lopatía clínicamente relevante, plaquetopenia (< 50000/ mm³) o paciente considerado con muy alto riesgo de sangrado por su médico tratante*.
10) Alergia a la droga o sus excipientes.
* Entidades descriptas con alto riesgo de sangrado (al gunas de estas circunstancias pueden no ser contraindi caciones absolutas de anticoagulación y deben valorarse individualmente los riesgos y beneficios del tratamiento): Úlcera gastrointestinal activa, neoplasias con alto riesgo de sangrado (metástasis en el SNC, tumores de urotelio o de la región esófago-gástrica), lesión o trauma espinal o cerebral reciente, politraumatismo grave, antecedente de sangrado clínicamente relevante reciente, antecedente de hemorragia cerebral espontánea o con angiopatía amiloide, presencia de várices esofágicas, bronquiecta sias sangrantes o antecedente de hemorragia pulmonar, malformación arterio-venosa o aneurisma vascular con riesgo de sangrado, cirugía espinal en SNC, cirugía ocu lar en el último mes, derrame pericárdico, endocarditis infecciosa, hipertensión arterial no controlada, anestesia neuroaxial programada.
Seguimiento, adherencia y persistencia en el tratamiento con anticoagulantes orales directos
La posibilidad de evitar el monitoreo mensual de anti coagulación con los DOACs es una ventaja tentadora, especialmente en pacientes con dificultades para acce der a una clínica de anticoagulación como en el caso de trastornos en la deambulación, agenda laboral o escolar estricta, malos accesos venosos y distanciamiento al centro de referencia. Esto se ha potenciado en el último año con la pandemia del COVID-19, donde trasladarse a un centro de monitoreo implicaba un riesgo. Los nuevos agentes evitan la necesidad del chequeo mensual de coagulación, pero igualmente los pacientes bajo trata miento con DOACs deben concurrir al médico con cierta regularidad15,185. Se sugiere que la primera consulta programada sea al mes de iniciado el tratamiento con uno de los nuevos anticoagulantes para evaluar su adherencia y tolerancia. Las posteriores consultas deben realizarse cada 3-6 meses dependiendo de la función renal y de las características del paciente; y cada vez que surja un sangrado, un procedimiento que requiera la interrupción de la anticoagulación o alguna duda sobre el tratamiento con DOACs10. Una vez estabilizado el paciente, y si se mantiene sin complicaciones, se debe programar el control una vez por año con estudios de laboratorio, que deben incluir un hemograma con recuento de plaquetas, hepatograma y creatinina en sangre85.
Debido a que estos pacientes no harán el monitoreo mensual de coagulación es posible esperar una menor adherencia y persistencia con el tratamiento, con alrededor de 30% de pobre adherencia y persistencia con DOACs y esto se ha asociado a una mayor incidencia de complica ciones trombóticas y de muerte106,184. La mala adherencia o el abandono del tratamiento anticoagulante es un problema tanto para los AVK como para los DOACs. En tratamientos crónicos de cualquier medicamento se calcula que entre 25% y 35% de los pacientes abandonará en el curso de un año dicho tratamiento108. La ausencia del contacto mensual con el médico y el costo más elevado son dos dificultades adicionales que presentan los nuevos agentes directos.184 Sin embargo, en diferentes estudios en los que se evaluó el nivel de abandono al tratamiento anticoagulante, los pacientes fueron más adherentes a los DOACs que a los AVK185. En el caso de aquellos pacientes poco adherentes al tratamiento, que olvidan con frecuencia la toma del anti coagulante, es preferible rotar el medicamento a warfarina, cuya vida media prolongada de 40 horas permite mantener en forma más estable el efecto anticoagulante en el tiempo. Otras recomendaciones sugeridas para optimizar la adhe rencia es educar correctamente sobre la importancia del tratamiento anticoagulante y alertar sobre las consecuencias del abandono de éste. Se le pueden entregar instrucciones o recomendaciones por escrito, una tarjeta de identificación de paciente anticoagulado y acceso a sistemas de alerta telefónico186. También hay que instruir a la familia sobre la importancia de la anticoagulación y eventualmente, se puede recomendar el seguimiento con consultas regulares en una clínica especializada en hemostasia.
Cambio de otro anticoagulante a anticoagulantes orales directos y viceversa9,15
El período de transición entre dos anticoagulantes suele ser poco considerado en las indicaciones para los pa cientes y sin embargo tiene cuatro veces más riesgo de trombosis o de sangrado, por lo que su trascendencia es clave cuando instruimos a los enfermos anticoagulados.
- Para pasar de una HBPM como la enoxaparina a un DOAC, debemos administrar la primera dosis del anticoa gulante directo en el horario en que hubiera sido adminis trada la dosis subsiguiente de la HBPM. Por ejemplo, si le correspondiera la dosis de HBPM a las 9 de la mañana, debe recibir el DOAC a las 9 de la mañana. Si, por el contrario, se quiere rotar de un DOAC a una HBPM, se debe esperar 12 horas desde la última dosis terapéutica, en el caso de estar usando dabigatrán o apixabán o 24 horas desde la última ingesta si se trata de rivaroxabán, para dar la dosis de enoxaparina. Si la función renal es inadecuada, como el DOAC se bioacumula, el tiempo de espera puede extenderse más de 24 horas9
- Para HNF intravenosa por infusión continua, se debe dar la primera dosis de DOAC dos horas antes de suspender la perfusión de heparina. En el otro sentido, para pasar de un DOAC a heparina endovenosa, al igual que con la HBPM, debemos esperar 12 horas desde la última dosis de dabigatrán o apixabán y 24 horas desde la de rivaroxabán.
- Más complejo es para el caso de los AVK por su lento comienzo de acción. Para pasar de acenocumarol o warfarina a un DOAC comenzar con el anticoagulante directo cuando el RIN es menor a 2.5. Esto generalmente ocurre luego de 48-72 horas de suspendida la warfarina y 24-48 horas luego de suspender el acenocumarol, si estaba en rango adecuado (RIN 2-3). En los pacientes que rotemos de un DOAC a AVK, se requiere la administración simultánea de ambas drogas (cabalgamiento de ambos medicamentos) hasta alcanzar un RIN mayor a 2, esto es al menos por 3 a 5 días. Se ha reportado un mayor número de eventos isquémicos cerebrales cuando la transición del DOAC es inadecuada por lo que deben extremarse los cuidados en este caso. Para pacientes con función renal normal se puede suspender el agente directo luego de 3 a 5 días del uso simultáneo de AVK con RIN >2. Si el aclaramiento de creatinina es entre 30 y 50 ml/minuto se debe suspender el DOAC antes, 2-3 días luego del inicio de AVK. Sólo monitorear el RIN para medir los AVK en el valle del efecto del anticoagulante directo (antes de la siguiente dosis) y luego de suspendido el DOAC, ya que estos interfieren con el valor del TP (especialmente el rivaroxabán) y podrían dar un RIN falsamente elevado9.
Manejo perioperatorio de los anticoagulantes orales directos
Estos pacientes al estar anticoagulados deben suspender el tratamiento transitoriamente frente a una cirugía. El tiempo que un enfermo permanecerá sin DOACs depende del balance entre el riesgo trombótico basal y el riesgo de sangrado por el procedimiento y debe calcularse en forma previa en cada caso particular. Los anticoagulantes directos NO necesitan HBPM como reemplazo al suspen derlos, como ocurre con los dicumarínicos, porque se ha visto que el puente con HBPM aumenta el sangrado con DOACs15,54. El tiempo de suspensión dependerá de tres factores, el funcionamiento del riñón, el riesgo de sangra do del procedimiento y el riesgo de tromboembolismo por suspender la anticoagulación187,188:
1) Función renal: Siempre calcular la depuración o aclaramiento de creatinina antes de una cirugía espe cialmente con los DOACs que tienen mayor excreción renal como dabigatrán y rivaroxabán. En pacientes con deterioro renal el DOAC debe suspenderse más tiempo.
2) Riesgo de sangrado del procedimiento (Tabla 17): Existen procedimientos que tienen alto riesgo de sangra do y que, por lo tanto, deben regresar a una hemostasia normal y suspender el anticoagulante unos días antes de la cirugía. Estos procedimientos pueden ser sencillos técnicamente, pero implican un mayor riesgo de com plicaciones hemorrágicas, solo por el hecho de estar anticoagulado. Son intervenciones, por ejemplo, en las que no es sencillo detectarun sangrado clínicamente relevante (biopsias/punciones sin posibilidad de control de hemostasia) o donde el riesgo de sangrado es inacep table por el sitio donde ocurre. También se debe consi derar como parte de este grupo al paciente con mayor riesgo de sangrado por sus comorbilidades (enfermedad cardíaca, hepática, respiratoria o renal) o pacientes con medicación antiplaquetaria concomitante. Ciertas cirugías requieren una hemostasia “completamente normal” como la neurocirugía y el tiempo de suspensión en este caso siempre es mayor.
En procedimientos de alto riesgo hemorrágico se debe suspender cinco vidas medias del DOAC previo a la cirugía para eliminar más del 95% de la concentración terapéutica de la droga. El dabigatrán debe tener una ventana de 2-3 días de suspensión si el aclaramiento de creatinina es > 50 ml/minuto, 4 días si es de 30-50 ml/minuto y mayor a 5 días en pacientes con falla renal grave. Para el apixabán y el rivaroxabán la suspensión es de 48 horas con una función renal normal y con aclaramiento de creatinina 30-50 ml/minuto la última dosis 2-3 días previo al procedimiento.
Anestesia neuroaxial (epidural o espinal): Se la debe considerar como un procedimiento con alto riesgo de sangrado con un mínimo de 24-48 horas sin medicación cuando la función renal es normal. Se recomienda contar con un TP y APTT normal. En caso de catéter de analge sia retirar el catéter al menos 5 horas antes de la dosis inicial del DOAC15
Para procedimientos de bajo riesgo de sangrado la conducta con los DOACs es sencilla y basta solo con suspender al menos una dosis previa (ventana de 12-24 horas sin anticoagulante) o eventualmente, se puede directamente no suspender la anticoagulación en pacien tes con alto riesgo tromboembólico. En procedimientos con riesgo moderado de sangrado se debe suspender el DOAC entre 2 y 3 vidas medias antes de la cirugía (24-48 horas). Si el aclaramiento de creatinina es 30-50 ml/minuto hay que suspender 48-72 horas previo al procedimiento mínimo187,188.
3) Riesgo muy alto de trombosis por la enfermedad de base: El riesgo de trombosis y sus consecuencias es mayor en la enfermedad arterial que en la venosa. Se considera como de alto riesgo trombótico a un evento tromboembólico venoso o arterial agudo que ocurrió en los últimos tres meses, al reemplazo valvular mecánico mitral o con historia de embolia y a la FANV con alto riesgo embólico (puntuación de CHA2DS2VASc ≥ 6). En estos casos donde es imperioso reiniciar la anticoagulación tempranamente se recomienda usar en forma inicial una HBPM y solo recomenzar con los DOACs a 48-72 horas de la cirugía187,188.
En caso de una cirugía de urgencia, como todos los DOACs tienen una vida media de al menos 12 horas, se debe intentar posponer la cirugía todo lo posible para que se elimine la mayor cantidad del anticoagulante15. Es muy importante, en estos casos, tratar de determinar con cierta certeza el tiempo transcurrido desde la última toma del medicamento. En la eventualidad de que solo hayan pasado 2 a 4 horas de la ingesta del anticoagulante direc to, se debe administrar al paciente carbón activado para adsorber a la droga antes de que ingrese al organismo. Ante una urgencia, una alternativa solo para el dabigatrán es el uso del agente reversor idarucizumab que eliminará por completo a la droga en minutos y nos permitirá realizar la cirugía en forma segura29. En caso de no contar con el antídoto específico, para el dabigatrán si la cirugía es imperiosa se podría efectuar una hemodiálisis previa al procedimiento, aunque esto rara vez se puede hacer en un paciente crítico28. Para los otros agentes directos anti Xa al no contar con un agente reversor en nuestro medio y no ser pasibles de hemodiálisis, eventualmente la única alternativa es hacer la cirugía con una hemostasia prolija y solo en caso de sangrado usar concentrados de agentes prohemostáticos, si este lo amerita8-12.
El estudio de coagulación pre-quirúrgico clásico (TP, APTT y hemograma) no es necesario con los pacientes anticoagulados con DOACs puesto que resultará normal aún en pacientes con niveles terapéuticos de DOACs10,155. Solo en algunos casos aislados las pruebas básicas de coagulación pueden ayudarnos con estos agentes a tomar una decisión por la información que nos brindan sobre el nivel del anticoagulante en sangre. El valor consi derado como seguro para un procedimiento de alto riesgo de sangrado es una concentración menor a 30 ng/ml del anticoagulante ya que en el estudio PAUSE valores por encima de 30 ng/ml en estos pacientes se asociaron a 5% de sangrado con apixabán y 14% con rivaroxabán189. Para procedimientos sin tanto riesgo hemorrágico basta con valores menores a 50 ng/ml para una cirugía segura (Tabla 18).
El reinicio de la anticoagulación dependerá del estado hemostático (sangrado por drenajes, etc.), del riesgo hemorrágico de la cirugía y de la urgencia para reiniciar la tromboprofilaxis. Hay que considerar que los DOACs tienen un efecto inmediato como anticoagulantes por lo que en pacientes de mayor riesgo hemorrágico jamás se debe retomar el medicamento antes de 24-48 horas de pasada la cirugía y con una hemostasia ya normalizada. En procedimientos con bajo riesgo de sangrado se puede reiniciar el tratamiento luego de 12 horas posteriores a la cirugía189. En cirugía mayor o con alto riesgo de sangrado reiniciar el anticoagulante directo solo 48-72 horas luego de la cirugía con la dosis habitual. En cirugía urológica reiniciar el DOAC cuando desaparece la hematuria. En cirugías con alto riesgo de sangrado o que persisten con sangrado por los drenajes o de la herida quirúrgica comenzar primero con heparina o HBPM en dosis de profilaxis o intermedia (de acuerdo con el riesgo trombó tico y hemorrágico) y solo reincorporar el DOAC luego de algunos días de la cirugía, cuando el riesgo de hemorragia sea menor10.
Insuficiencia renal y anticoagulantes orales directos
Los pacientes con falla renal moderada y grave son un grupo complejo para el tratamiento anticoagulante, ya que tienen mayor riesgo de FA, de tromboembolismo venoso, de sangrados y mayor mortalidad, independien temente del agente anticoagulante que utilicemos190-193. Aún si usamos un AVK o heparina no fraccionada, que no tienen aclaramiento renal, el riesgo de complicacio nes trombóticas y, especialmente hemorrágicas, es más alto que en los pacientes con función renal normal y se recomienda, en el caso de la warfarina, reducir la dosis 20% y mantener un TRT mayor a 70% con controles de RIN más frecuentes191.
Con los DOACs el problema es más complejo porque tienen diferente aclaramiento renal15. La concentración plasmática de dabigatrán en falla renal grave aumentará hasta 6 veces, con el rivaroxabán aumentará 64% y con el apixabán 44%190. Sin embargo, a pesar de que no hay estudios clínicos adecuados en pacientes con aclaramien to de creatinina entre 15 y 30 ml/minuto la alternativa de usar una dosis ajustada de DOACs está aprobada por la FDA para falla renal grave192. A este respecto, la decisión de cuál de los DOACs utilizar debe ser individualizada, dada la falta de estudios prospectivos en quienes tienen daño renal extremo. Por ejemplo, la FDA ha aprobado el uso de 75 mg de dabigatrán cada 12 horas (basado en la farmacocinética de la droga) para pacientes con aclara miento de creatinina menor a 30 ml por minuto, pero esta dosis no está aprobada por la ANMAT y no parece una buena alternativa hasta que tengamos evidencia clínica de la seguridad de su uso. El apixabán es el DOAC con menor aclaramiento renal y en algunos estudios como el RENAL-AF una dosis de 5 o 2.5 mg cada 12 h ha demostrado menor sangrado que los AVK191. El estudio AXADIA evalúa la eficacia y seguridad de apixabán en pacientes con falla renal grave, también con resultados muy alentadores, pero por el momento la evidencia es escasa y al no ser estudios con una muestra adecuada las guías no recomiendan el uso generalizado de apixabán en esta circunstancia194.
Se ha sugerido, como forma de monitoreo en estos casos de falla renal, evaluar la función renal cada 3 a 6 meses en pacientes con insuficiencia renal moderada y cada 1 a 3 meses en la insuficiencia renal grave, y también en cada oportunidad donde se sospeche que la función renal pueda disminuir o deteriorarse.
Evento isquémico o hemorrágico cerebral en pacientes tratados con DOACs8,9,15
Esta es una complicación grave que tiene alta morbimor talidad y debe ser tratada en forma urgente en una unidad especializada donde instaurar las medidas generales de cuidado de pacientes con ACV de acuerdo con las guías internacionales de manejo. Primero se debe descartar con una imagen un sangrado en el SNC. En un paciente con FA ante un nuevo evento isquémico hay que considerar para definir la conducta el riesgo de sangrado, gravedad del ACV, mejoría o no del cuadro desde su instauración, uso de medicación concomitante y comorbilidades. Es muy importante conocer la adherencia al tratamiento y la intensidad de la anticoagulación. También deberá consi derarse la posibilidad de isquemia cerebral no cardioem bólica (ACV de origen vascular, por ejemplo, obstrucción carotídea) y descartar la presencia de trombos intracavi tarios o en la orejuela por fallo en la anticoagulación. Los pacientes con ACV no hemorrágico y síntomas leves o moderados que presenten mejoría desde su llegada a la emergencia solo requieren control. Debemos hacer un estudio de coagulación y asegurarnos de la adherencia al tratamiento con los DOACs.
Los pacientes con eventos isquémicos más graves bajo un anticoagulante directo podrían, en algunos casos especiales, ser considerados para el uso de trombolíti cos, si se encuentran en el período de ventana de hasta 5 horas del inicio de los síntomas del ACV.Además, no deben tener deterioro de la función renal (aclaramiento de creatinina > 50 ml/minuto) no deben haber recibido el anticoagulante en las últimas 48 horas (al menos 4 vidas medias) y tener pruebas basales de coagulación normales o dosaje de DOACs menor a 30 ng/mL. En el caso de dabigatrán se han publicado pacientes que recibieron idarucizumab como reversor seguidos de trombólisis195-198.
Reinicio de anticoagulación con anticoagulantes orales directos luego de un evento trombótico o hemorrágico cerebral
El reinicio de la anticoagulación luego de un sangrado cerebral podría considerarse luego de un cuidadoso análisis de riesgo/beneficio. En especial si la causa fue no traumática, si el sangrado fue profundo y las neuroimágenes no muestran micro sangrados y no son sugestivas de angiopatía amiloide. En estos casos, con los anticoagulantes directos se sugieren pautas similares a los AVK. Aguardar para el reinicio al menos dos y hasta cuatro a ocho semanas del sangrado y utilizar la menor dosis eficaz del DOAC198.
El reinicio de la anticoagulación con un DOAC, luego de un evento trombótico cerebral dependerá de la gravedad del ictus, riesgo de recidiva y presencia de transformación hemorrágica. Considerar un período sin anticoagulación según el tipo de ACV utilizando la regla del 1-3-6-12 que significa esperar para el reinicio del DOAC un día en el caso de un AIT (evento isquémico transitorio), 3 días en un ACV menor sin secuelas, 6 días en un ACV moderado con secuelas motoras y al menos 12-14 días en caso de un evento mayor con secuelas graves. En todos los casos controlar que no haya una transformación hemorrágica. Se deben descartar primero otras afecciones no cardio embólicas que pueden provocar isquemia, como un infarto cerebral profundo por hipertensión o una obstrucción carotídea por placas ateromatosas8,9. El fallo terapéu tico en pacientes adherentes, en especial si el riesgo cardioembólico es elevado, fue descripto en pacientes con bajas concentraciones de DOAC. En estos casos se sugiere modificar otros factores de riesgo vascular, agregar estatinas y rotar a dabigatrán 150 mg o AVK que permiten un monitoreo cercano. En casos recurrentes se podrá considerar el cierre de la orejuela.
Los DOACs son anticoagulantes que permiten una mayor libertad en el manejo de los pacientes anticoa gulados, pero justamente por eso debemos instruir adecuadamente a los enfermos tratados con estos agentes. La educación del paciente y de su familia pasa a ser especialmente relevante y para ello los profesio nales de la salud que indiquen DOACs deben poder manejarlos apropiadamente, evitando situaciones de riesgo para el paciente.
Es prioritario asegurarnos de la adherencia y persisten cia con el tratamiento, de que la dosis y la indicación del medicamento sea la correcta, de que los pacientes tengan una función renal adecuada para el DOAC que prescribimos y que cuenten con asesoramiento disponible ante una intervención quirúrgica o ante un sangrado o un nuevo evento trombótico.
Debemos conocer las contraindicaciones de los DOACs y que, a pesar de tener menos interferencia con otros medicamentos, de todas formas, algunos de ellos interfieren en el catabolismo y la concentración de DOACs en sangre.
Manejo de sangrado en pacientes tratados con anticoagulantes orales directos
Medidas generales para el paciente con sangrado y anticoagulantes orales directos
La hemorragia es el principal efecto adverso de los anti coagulantes y se asocia a un aumento en la mortalidad. Los eventos de sangrado con DOACs, en comparación con AVK, son menos graves, requieren menor cantidad de transfusiones, menor cantidad de días de internación, y tienen mejor pronóstico199,200. Una de las características más relevantes de los DOACs es la franca disminución (cercana a 70%) en la incidencia de sangrado intracraneal en comparación con los AVK, así como menor volumen, expansión y mortalidad del hematoma intracreneal201. Aún a pesar de estas ventajas en términos de seguridad, frecuentemente tendremos que enfrentarnos con pacien tes que tengan algún episodio de sangrado mayor bajo tratamiento anticoagulante con DOACs202,203. Este tipo de complicaciones deben ser siempre tratadas como una urgencia (Fig. 3). La gravedad del sangrado y la presenta ción clínica es determinante del comportamiento médico frente a estas situaciones.
Generalmente los sangrados menores son transitorios y no requieren ajuste de dosis del DOAC. Se sugiere solo suspender transitoriamente una dosis del anticoagulante o simplemente el retraso en el horario de la próxima toma. Se debe verificar que la dosis sea la correcta para el paciente, que la función renal sea adecuada para esa dosis, revisar la medicación concomitante u otros cambios o modificaciones en la rutina del paciente. En caso de epistaxis anterior se debe evaluar la cauterización local de la mucosa nasal. Ante una hematuria descartar una infección urinaria o un factor local como un pólipo. La hipermenorrea asociada a rivaroxabán podría requerir un cambio en el anticoagulante.
Por el contrario, ante un sangrado clínicamente significa tivo o grave la conducta no es diferente a un sangrado por otra droga anticoagulante. Cada centro debería desarrollar protocolos propios de manejo de sangrado que incluyan medidas generales de soporte y el uso, eventualmente, de agentes reversores o de factores prohemostáticos, además de recomendaciones de control hemodinámico, manejo de fluidos y monitoreo de la coagulación acorde con la gravedad de la hemorragia. Se debe suspender inmediatamente el anticoagulante oral directo y cualquier otro agente antitrom bótico concomitante que el paciente pudiera estar recibiendo, como AAS. Se deberá hacer el mayor esfuerzo para registrar la dosis y hora de la última toma del DOAC, y si pasaron < 2-4 horas de la toma es razonable la administración de carbón activado 1 g/kg (30-60 gramos de charcoal activado diluido) que reduce cerca de 50% la absorción del anticoagulante directo en las primeras horas. Si pasaron más de 6 horas desde la ingesta la efectividad del adsorbente se reduce a menos del 30%203,204.
La presencia de compromiso hemodinámico es siempre un signo de sangrado mayor que compromete potencialmente la vida y su manejo debiera ser similar al del sangrado crítico. En este punto es importante consi derar transfundir plaquetas si el paciente se encuentra recibiendo concomitantemente antiagregantes plaqueta rios (ticagrelor requiere mayor cantidad de concentrados por ser un inhibidor reversible de las plaquetas). Se debe obtener urgente un laboratorio con hemograma y recuento de plaquetas, TP, APTT, TT (para determinar la presencia de dabigatrán), creatinina y hepatograma. La complejidad en la toma de decisiones sobre el uso de hemoderivados hace recomendable que en forma temprana se consulte con especialistas en hematología para acompañar el caso15 Se deben implementar de in mediato medidas para controlar el sitio de sangrado (por ejemplo, de ser posible compresión directa del lugar de sangrado). En una hemorragia digestiva considerar hacer estudios endoscópicos (video-endoscopia digestiva alta y video-colonoscopia) para poder implementar medidas hemostáticas locales. Este aspecto es, frecuentemente, una situación de discordia entre los equipos de atención en emergencia y el servicio de gastroenterología. Es recomendable buscar el momento apropiado para realizar los estudios endoscópicos de urgencia en este contexto y corregir los factores que podrían modificarlo. Esta con ducta debe ser discutida con antelación a la presentación de una emergencia, mediante el desarrollo de protocolos institucionales. En algunos casos puede ser necesario el equipo de radiología intervencionista15,203-206.
En ciertas situaciones de mayor gravedad se deberá considerar la opción de revertir el efecto de la droga anticoagulante con medicación específica. Estas situa ciones comprenden: todo sangrado que amenace la vida del enfermo, sangrado mayor persistente, a la caída de hemoglobina > 5 g/dl, necesidad de transfusión > 4 uni dades de glóbulos rojos (UGRD), sangrado que produce descompensación hemodinámica y que no responde lue go de al menos 1 hora de reanimación con fluidos (o con requerimiento de inotrópicos para sostener la presión), o pacientes que requieren procedimientos quirúrgicos en el contexto de un sangrado mayor. También es importante tener en cuenta los sangrados que comprometen “espacios pequeños no compresibles” o que comprometan la funcionalidad de órganos como cualquier hemorragia en el sistema nervioso central, intraocular, pericárdio, retroperitoneal, vía aérea (esto incluye epistaxis posterior), hemotórax o intraarticular/muscular. Estas situaciones requieren fuertemente la consideración de revertir el efecto del DOAC203,204. Debemos tener en considera ción que utilizar alguno de los antídotos para un agente anticoagulante no es equivalente a revertir la causa del sangrado y siempre se deberá realizar el mayor esfuerzo en hallar el origen del sangrado y eventualmente tratar o realizar acciones para mitigar la pérdida de sangre con las medidas apropiadas para cada caso. Todo sangrado en un paciente anticoagulado requiere de una estrategia que permita determinar si existe una lesión que causó el evento, independientemente de las acciones necesarias para cohibir y manejar la hemorragia desde la hemosta sia206. Es en estas situaciones en las que se considerará la reversión del efecto de la droga anticoagulante.
Deberemos tener en cuenta que existen métodos de reversión específicos (agentes reversores específicos para la droga que está recibiendo el paciente) e inespe cíficos (productos prohemostáticos que podrían favorecer la trombosis)203-205.
Agentes prohemostáticos o reversores inespecíficos
El uso de plasma fresco congelado, concentrado de fibrinógeno o crioprecipitados no deben usarse para ma nejo de sangrado en quienes están bajo tratamiento con DOACs, ya que no posen efecto alguno para controlar el sangrado provocado por estos anticoagulantes. Tan solo se deben considerar en el contexto de un sangrado ma sivo que requiera reposición de factores de hemostasia. Tampoco será de utilidad el sulfato de protamina (agente reversor de la heparina no fraccionada y en menor medida de heparina de bajo peso molecular) o la vitamina K (droga que puede revertir el efecto de los AVK en el mediano plazo). En situaciones críticas, y ante la imposibilidad de contar con agentes reversores específicos, se debenutilizar concentrados de factores protrombínicos (CFP) para intentar revertir el efecto de los DOACs. La dosis propuesta es 25-50 U/kg y puede repetirse según la res puesta clínica para todos los DOACs207,208. Si es posible, se debe preferir CFP que contengan 4 factores (factores VII-II-IX y X) sobre los concentrados de 3 factores (con centrado con factores II-IX-X). El CFP activado es también una alternativa si no contamos con un agente reversor específico (aCFP en dosis 50-80 U/kg hasta un máximo de dosis de 200 U/kg/ día), especialmente en el caso de dabigatrán; sin embargo, no hay datos clínicos adecuados sobre su eficacia y seguridad. El Factor VII activado re combinante (dosis 90 μg/kg) ha sido menos consistente en los estudios en voluntarios sanos y se recomienda como última alternativa en pacientes con sangrado crítico por un DOAC sin respuesta a otras medidas como los CFP207. Otros agentes que pueden usarse como adyuvantes son el ácido tranexámico (dosis de 15-30 mg/kg endovenoso o 1000 mg en infusión de 10 minutos); especialmente en sangrados mucosos o asociados a trauma grave. Otra medida adicional, en el caso del dabigatrán, es forzar la diuresis, ya que se elimina predominantemente por vía renal. Y debido a su escasa unión a proteínas plasmáticas (35%) el dabigatrán es el único DOAC potencialmente hemodializable. Una hemodiálisis de 2 a 4 horas reduce 50-60% la concentración de dabigatrán, pero en un pa ciente con un sangrado crítico generalmente hacer este procedimiento no es posible15,203-206.
Agentes reversores específicos
Sin lugar a duda estos son los agentes de elección ante las situaciones de emergencia descriptas. En la actualidad existen dos drogas que poseen esta funcionalidad: 1) idarucizumab: una fracción de un anticuerpo monoclonal humanizado que revierte en forma específica el efecto del dabigatrán, y único agente reversor disponible en Argentina; y 2) andexanet-alfa: un factor Xa recombi nante modificado que no posee actividad enzimática y que posee capacidad de revertir el efectos de todos los inhibidores directos (xabanes: rivaroxabán, apixabán, edoxabán y betrixabán) e indirectos (heparinas de bajo peso molecular, fondaparinux) del FXa. Sin embargo, el andexanet-alfa, se encuentra comercialmente disponible solo en EE.UU. y Europa. Una particularidad del uso de estos agentes reversores es que ambas drogas fueron evaluadas en ensayos clínicos no controlados en los que la decisión de reversión se basó en elementos clínicos independientemente del resultado de pruebas o estatus de coagulación del paciente. Por lo que la recomenda ción sobre el uso en emergencias de estos reversores se basa en la valoración clínica de la situación sin requerir el resultado de cualquier prueba de coagulación. Esto es así, no solo porque su uso está únicamente indicado en situaciones críticas (de amenaza de vida) donde no po demos esperar los resultados de estudios de hemostasia, sino también por la falta de disponibilidad y complejidad de las pruebas específicas de coagulación para valorar el efecto de los DOACs y por la poca utilidad clínica de las pruebas de coagulación basales.
El idarucizumab es el agente reversor del dabigatrán, y se encuentra aprobado para su uso desde 2015 en Ar gentina y en más de 60 países del mundo. Se trata de la fracción variable de un anticuerpo monoclonal específico que demostró efectividad en estudios hechos en pacientes con sangrado crítico o con requerimiento de cirugía de urgencia (requerimiento quirúrgico dentro de las 6 horas de presentación en la emergencia)209-211. La dosis para utilizar en todos los casos en que se considere la reversión de dabigatrán es de 5 gramos intravenosos: 2 frascos de 2.5 g cada uno administrados por vía intravenosa en bolo lento o infusión rápida, con un tiempo entre frasco no mayor a 10 a 15 minutos. Su dosis de 5 g es fija, independientemente de la edad, función renal o dosis de dabigatrán que estuviera tomando el paciente206-211. Los frascos ya poseen la droga preparada para la administración sin requerimiento de reconstitución o preparación específica. El idarucizumab revierte en minutos el efecto del dabigatrán en forma completa, sostenida e inmediata normalizando las pruebas de coagulación. No se han registrado complicaciones protrombóticas asociadas a su uso, si bien no hay estudios aleatorizados controlados que lo hayan comparado con estrategias de reversión inespecíficas212. Tampoco se ha observado generación de autoanticuerpos con significado clínico en los estudios clínicos213. Como el efecto del anticuerpo es de apenas unas horas, se puede reiniciar el tratamiento con dabiga trán a las 24 horas del uso del antídoto ya que no tiene efecto residual, si bien en un paciente con sangrado ma yor no se recomienda el uso de dabigatrán tan cercano al evento clínico. Al no poseer efecto sobre otras drogas antitrombóticas, es posible iniciar estrategias de trombo-profilaxis (HBPM, por ejemplo) dentro de las 24 horas de haberlo administrado. Refrigerado a temperatura entre 2° a 8 °C su vida útil es cercana a 30 meses209.
El andexanet es un agente reversor de inhibidores del FXa que no está disponible en nuestro medio. La dosis del andexanet es diferente según el tiempo transcurrido desde la última ingesta del anticoagulante, y también debe ajustarse acorde al DOAC anti-Xa que se quiera revertir202. Por ejemplo, para apixabán se utiliza una dosis menor que la dosis recomendada para rivaroxabán, y a su vez esta se debe ajustar acorde a si pasaron más de ocho horas de la última toma del DOAC.Su administración es en forma de bolo endovenoso asociado a una infusión continua de entre 2 a 4 horas posterior al bolo, por lo que, si bien su efecto es inmediato, para lograrlo se debe completar la administración completa demorando todo el proceso entre 3 a 4 horas mínimo. El agente viene en viales como polvo liofilizado que debe ser reconstituido para su administra ción. Todas estas circunstancias dificultan su manejo en emergencias. El estudio clínico que promovió su aprobación contempló la reversión en situaciones clínicas de sangrado que amenaza la vida, por lo cual no se encuentra aprobado en la actualidad para reversión en contexto de requerimiento de procedimientos quirúrgicos de emergencias214. Si bien posee una corta vida media, su efecto reversor de los inhi bidores del FXa hace que potencialmente sea difícil iniciar en forma temprana estrategias de trombo-profilaxis con HBPM. A diferencia del idarucizumab, el uso de andexanet se ha asociado a una elevación de factores pro-trombóticos posteriores a su infusión y eventualmente a un aumento del riesgo de trombosis, por lo que su uso debe preservarse específicamente a situaciones que amenazan la vida en donde la relación riesgo/beneficio avale su utilización214. El costo de este agente reversor es significativamente más caro que el del reversor del dabigatrán. Pero tiene la ventaja de inhibir a cualquiera de los agentes anti Xa incluidas las HBPM y pentasacáridos.
Protocolo sugerido de manejo de sangrado severo con anticoagulantes orales directos15,203-206
1) Se debe suspender inmediatamente el anticoagu lante directo y cualquier otro agente antitrombótico como antiagregantes.
2) Registrar la dosis y hora de la última toma del DOAC con la familia.
3) Si pasaron menos de 2-4 horas de la toma adminis trar carbón activado 1 g/kg (30-60 g de charcoal activado diluido) que reduce 50% la absorción del anticoagulante en las primeras horas. No usarlo si pasaron más de 6 hrs de la ingesta del DOAC.
4) Hacer el sostén hemodinámico de acuerdo con la pérdida de sangre (manejo de sangrado crítico).
5) Considerar transfusión de plaquetas si toma antia gregantes (ticagrelor requiere mayor cantidad de concen trados por ser un inhibidor reversible de las plaquetas).
6) Se debe obtener urgente un laboratorio con hemo grama y recuento de plaquetas, TP, APTT, TT (para el dabigatrán), creatinina y hepatograma.
7) Siempre se debe notificar al hematólogo para que participe en la toma de decisiones.
8) Se deben implementar de inmediato medidas para controlar el sitio de sangrado (compresión directa del lugar de sangrado).
9) En una hemorragia digestiva considerar hacer una video endoscopía alta y baja de urgencia para poder imple mentar medidas hemostáticas locales. En algunos casos puede ser necesario el equipo de radiología intervencionista.
10) El uso de plasma fresco congelado o crioprecipi tados no corregirá el sangrado producido por los DOACs y no debe usarse. Tampoco el sulfato de protamina o vitamina K.
11) En el caso del dabigatrán se recomienda forzar la diuresis y debido a su escasa unión a proteínas plasmáti cas (35%) es el único potencialmente hemodializable si no contamos con el antídoto. Una hemodiálisis de 2-4 horas reduce 50-60% la concentración de dabigatrán, pero en un paciente con un sangrado crítico generalmente esto no es posible.
12) Ante un sangrado con riesgo de vida considerar el uso de agentes prohemostáticos como CFP y CFP activados o de agentes reversores específicos como idarucizumab y andexanet
El manejo del sangrado con DOACs debe estar siem pre protocolizado en la institución donde se atiende el paciente y debe ser multidiciplinario y apropiado a las características del evento.
De acuerdo con la gravedad de la hemorrágia y al tipo de anticoagulante directo debemos considerar el uso de agentes prohemostáticos, de agentes reversores específicos y de agentes coadyuvantes para detener el sangrado.
Los DOACs son anticoagulantes y como tales provo carán un mayor riesgo de hemorragias, especialmente en pacientes frágiles con comorbilidades, que ingieran simultáneamente antiagregantes o que deterioren su función renal.
Rol de las clínicas de anticoagulación para el uso de los anticoagulantes orales directos
Las clínicas de anticoagulación originalmente fueron diseñadas para dar a los pacientes cuidado efectivo y seguro sobre el uso de los AVK. Sin la necesidad del mo nitoreo del RIN y ajuste personalizado de dosis, con estos nuevos agentes se ha cuestionado el rol de las unidades de control de pacientes anticoagulados, especialmente cuando se promociona la independencia que nos brindan los DOACs, que permite evitar la consulta mensual con el análisis de sangre. Pero con la diversidad de drogas anticoagulantes con que contamos y la posibilidad de indicación por parte de médicos generales, posiblemente las clínicas de anticoagulación deban redimensionarse, con nuevos roles en el manejo de pacientes en tratamiento con anticoagulantes orales.
La clínica de anticoagulación puede ser una herra mienta útil para reforzar la eficacia y seguridad de los DOACs215,216. Basta con considerar algunas de las carac terísticas de una clínica de anticoagulados para entender el rol que pueden desempeñar:1) Tienen disponibilidad para la consulta con un especialista en anticoagulación y para un rápido control ambulatorio luego de ser evaluados en la emergencia con el tratamiento inicial. 2) Tienen la posibilidad de una educación sistemática del paciente que comienza un tratamiento con estos agentes, sin necesidad de concurrir todos los meses al monitoreo de sangre. En este sentido la clínica es fundamental para el asesoramiento de médicos y pacientes al momento de seleccionar el anticoagulante ideal, la dosis y duración del tratamiento para cada caso. El médico a cargo debe considerar el tiempo en rango terapéutico, si estaba medicado con un AVK, la adherencia al tratamiento, in dicaciones y contraindicaciones de cada medicamento, los costos y disposición del paciente. 3) Las clínicas de anticoagulación pueden reforzar y estimular la adherencia y persistencia con el tratamiento anticoagulante. Se sabe que, con el tiempo, como en todo tratamiento crónico, se pierde la compliance con la ingesta de la medicación, especialmente si el paciente no percibe un beneficio clínico con el uso del anticoagulante. 4) También deben ayudar a minimizar los riesgos de sangrado adaptando la consulta para resolver dudas en cada paciente individual; y ante la eventualidad de una hemorragia es el lugar na tural de consulta sobre uso de drogas prohemostáticas y eventualmente, de agentes reversores específicos. 5) En la clínica de anticoagulación se debe expandir el conocimiento sobre el uso correcto de los DOACs, que se modifica permanentemente y así evitar errores comu nes que hemos visto en profesionales no habituados a manejar estos medicamentos13,215.
El paciente anticoagulado debe tener un lugar de contacto para resolver una complicación relacionada con el tratamiento anticoagulante, ya sea trombótica o hemo rrágica. También podrá consultar en todo momento sobre como suspender el tratamiento en forma segura ante una cirugía o un procedimiento odontológico y especialmente sobre cuándo reiniciarlo sin riesgo de sangrado. Aún en el caso de un sangrado menor, como una epistaxis auto limitada o la presencia de hematomas, se generará una situación de angustia en el paciente y la tendencia será suspender toda la medicación antitrombótica. Esto tiene una trascendencia clínica relevante ya que, dependiendo del paciente, puede quedar expuesto a una complicación trombótica innecesaria. Contar con un consultor para estas circunstancias en una clínica de anticoagulación ayudara a resolver las dudas y mejorar la compliance con el tratamiento. El paciente anticoagulado debe poder ac ceder a la receta del medicamento con tiempo, debe tener la posibilidad de un contacto para la emergencia y, sobre todo, debe conocer todas las ventajas y desventajas de los DOACs. El ámbito de la clínica de anticoagulación es el lugar adecuado para definir con el hematólogo cuánto tiempo debe permanecer anticoagulado y con que dosis, si se requieren o no estudios complementarios como un seguimiento con ecografía, si hay que medir marcadores como el dímero-d o incluso si se debe solicitar un estudio de trombofilia85,215. Es el lugar donde el paciente puede ser instruido sobre la trascendencia de no suspender el tratamiento antes de tiempo, donde el contacto con el grupo familiar puede ayudar a aceptar y comprender
la importancia de la anticoagulación. Es donde el he matólogo podrá considerar desescalar la dosis de un tratamiento según el riesgo de cada caso individual. La clínica de anticoagulación debe priorizar la educación del paciente, y si es posible, entregarle material escrito incluido una cartilla con información sobre el tratamiento anticoagulante y que cosas tiene permitido o no hacer (ver anexo 2). También es el lugar donde, como todo paciente anticoagulado, pueda eventualmente firmar el consentimiento informado sobre lo que significa estar anticoagulado, en el que figuren los riegos y eventuales complicaciones de este tratamiento.
Las clínicas de anticoagulación son el lugar natural para la consulta y educación de los pacientes anticoa gulados. Los DOACs son medicamentos nuevos y no siempre los médicos que los prescriben pueden resol ver todos los escenarios de estos complejos pacientes.
Contar con un centro de consulta disponible las 24 horas para el asesoramiento de médicos y pacientes sin duda ayudará a optimizar el tratamiento con los anticoagulantes orales directos.
Conclusiones
Desde hace unos años el manejo de los pacientes an ticoagulados ha cambiado y lo que parecía que nunca llegaría se ha instalado en nuestra actividad cotidiana con nuevos medicamentos que tienen un perfil farmaco dinámico más favorable y que provocan menos sangra dos y no requieren del control mensual de coagulación ni de frecuentes cambios de dosis. Múltiples estudios prospectivos simultáneos, con más de 50 mil pacientes aleatorizados para recibir un DOAC o el tratamiento convencional con heparina y AVK han permitido sumar una cantidad de evidencia que avala su uso, como nun ca había pasado con otro agente anticoagulante. Y la experiencia con estudios de la vida real ha corroborado los resultados de los trabajos aleatorizados con DOACs, pero en una población mucho más numerosa y heterogé nea, sin los estrictos criterios de exclusión de los estudios clínicos prospectivos que se hicieron inicialmente para validar estos medicamentos. En algún aspecto estas publicaciones de fase IV simulan mejor la forma en que usamos en el consultorio cotidiano a los DOACs y pareciera que son igualmente seguros y efectivos. Sin embargo, su uso debe ser correctamente valorado por el profesional de salud, que muchas veces, por no estar acostumbrado al manejo de pacientes anticoagulados, comete errores y hasta puede generar un daño. No de bemos dejar de considerar que la educación de nuestros colegas es prioritaria con una clase diferente de drogas que resultan mucho más sencillas de utilizar, pero que al mismo tiempo pueden provocar complicaciones de sangrado o de trombosis tan frecuentemente como las que ocurren con los clásicos AVK.
Si el paciente NO tiene buena adherencia al tratamien to las virtudes de los DOACs desaparecen. Al tratarse de un medicamento oral que no requiere controles de coagulación se corre el riesgo, por parte del paciente, de banalizar al tratamiento anticoagulante y por lo tanto de tener complicaciones trombóticas y de sangrado que no se vieron en los estudios clínicos. Por eso fidelizar la adherencia es fundamental. El ajuste de dosis para cada paciente individual y la decisión de cuál de todos los DOACs disponibles utilizar es otro problema que debe enfrentar el médico que inicia un tratamiento anticoagulan te. Y no siempre se toma la mejor alternativa, adecuada a la posibilidad de sangrado y de trombosis de cada caso, con el riesgo de provocar complicaciones, solo por elegir mal el agente anticoagulante.
Es posible que aprovechar la experiencia de las clíni cas de anticoagulación sea, en este sentido, una ventaja. De esta forma es claro que no podemos cerrar las puertas de este recurso que ya tenemos disponible, y que puede solucionar las frecuentes eventualidades y consultas que surgen en el complejo mundo del paciente anticoagulado.
Debemos aprender a usara los anticoagulantes orales directos sabiamente, considerando no solo los mejores resultados de los estudios clínicos, sino también las di ferentes realidades de cada paciente, de tal manera que las ventajas de estas drogas nuevas se vean reflejadas en un cambio que beneficie a todos.
Estas recomendaciones para el manejo de DOACs buscan orientar al médico sobre problemas cotidianos al momento de usar alguno de los nuevos agentes anticoa gulantes. Los DOACs son mejores medicamentos y si los sabemos utilizar en forma correcta estaremos brindando un beneficio al sistema de salud, pero especialmente a nuestros pacientes del consultorio, que en definitiva es lo único que importa.