PUNTOS CLAVE
• La evaluación de la fertilidad constituye uno de los temas que el médico debe abordar, sobre todo resguardando su buen accionar ante efectos poco conocidos del tra tamiento hormonal de reafirmación.
• Según la literatura internacional aproximadamente un 50% de la población trans mantiene el deseo de pater nidad. Sin embargo, en nuestro medio no observamos estas características. Probablemente como consecuen cia del costo y de la accesibilidad de las técnicas de reproducción asistida.
• La hormona antimülleriana constituye una herramienta útil para evaluar la capacidad reproductiva. No encon tramos variaciones en las concentraciones de hormona antimülleriana posterior al tratamiento hormonal de re afirmación a corto plazo.
Varón trans (VT) es aquella persona de sexo biológico femenino con identidad de género masculina que puede optar por recibir un tratamiento hormonal de reafirmación (THR) con testosterona. Por lo contrario, el término cisgé nero (CIS), hace referencia a las personas cuya identidad y expresión de género coincide con el sexo biológico.
Hasta el momento los efectos de este tratamiento sobre la reproducción en VT son poco claros1. Por tal motivo, las sociedades científicas recomiendan discutir las opciones de fertilidad previo al tratamiento hormonal o quirúrgico2.
Con el tiempo, las edades de consulta de aquellos indi viduos que desean tratamiento hormonal de reafirmación de género se ve adelantada, por lo tanto, la reproducción, así como su planificación tiende a ser retrasada e irre levante durante esta transición3,4. Sumado a esto, las técnicas de preservación de fertilidad son costosas y poco accesibles para la población en general lo que constituye una barrera para su alcance4,5.
En edades tempranas (Tanner 2) se recomienda utili zar análogos de la hormona liberadora de gonadotrofinas (GNRH) para suprimir el desarrollo de caracteres sexuales no deseados6. Esto permite aliviar la disconformidad que suele generarse, además de dar el tiempo necesario para experimentar la sexualidad. Durante la utilización de este tratamiento de supresión, ciertos estudios infor maron disminución del volumen testicular y reducción en el tamaño uterino7,8. Aunque estas investigaciones son a corto plazo, se vio que el tamaño uterino retorna al rango de normalidad luego de un año de la suspensión de análogos de GNRH8.
Las opciones de fertilidad en esta etapa de la vida son recomendadas, acorde a la edad y contexto de cada persona (criopreservación de tejido y/o gametas)9.
En mujeres trans adultas (persona de sexo biológico masculino con identidad de género femenina) el impacto del tratamiento hormonal feminizante sobre la morfología testicular es discordante en la literatura. Algunos estudios, encontraron daños graves sobre los componentes testicu lares (células de Sertoli y Leydig) asociados a depósito de tejido fibroso, mientras que otros describieron indemnidad en la espermatogénesis10,11. Estas discrepancias o heterogenei dad en los hallazgos, pueden ser influenciadas por el tiempo y tipo de exposición hormonal, aunque se tratasolamente de una hipótesis. Estos resultados siguen respaldando que la preservación de la fertilidad debe ser discutida con el paciente, de igual manera que la anticoncepción12.
Así mismo, el impacto del THR sobre la fertilidad en VT es poco conocido.
El tratamiento con testosterona en VT es efectivo para iniciar y mantener la amenorrea, que en el 90 % de los casos se alcanza durante los primeros 6 meses de THR13.
La amenorrea producida por el tratamiento con tes tosterona es reversible mientras que, a nivel ovárico, los cambios histológicos que fueron informados son contradictorios. Al parecer, podría existir una hiperplasia del estroma con incremento en el depósito de coláge no en la túnica albugínea14,15. A nivel folicular, se han observado cambios morfológicos, principalmente en los folículos maduros, aquellos que son rodeados por células de la teca andrógeno-dependientes. Estos cambios men cionados simulan a los encontrados en el síndrome de ovario poliquístico (SOP)16-18. Otros autores discrepan con estos hallazgos sin encontrar diferencias con la población control18. Se han reportado embarazos en individuos VT bajo tratamiento hormonal con testosterona, por lo tanto, no se puede mencionar la anovulación como causa de amenorrea.
La hormona antimülleriana (HAM) constituye un mar cador bioquímico importante de la capacidad reproductiva en las mujeres CIS19,20. Es una glicoproteína producida exclusivamente por las células de la granulosa de folícu los no seleccionados: preantrales y antrales pequeños; no se halla regulada por la hormona folículo estimulante (FSH) y juega un rol importante al inhibir el reclutamiento folicular19,20. A diferencia de otros biomarcadores, tales como la FSH, inhibina B, el recuento de folículos antrales por ecografía transvaginal, etc., los niveles de HAM no varían significativamente durante los ciclos menstruales normales. Por estas características la convierte en un parámetro medible y representativo del pool folicular20-22. Es utilizado como indicador de la reserva ovárica por cen tros de fertilidad ya que correlaciona positivamente con el número de folículos que se obtienen tras la estimulación ovárica, además de los ovocitos recuperados23.
Algunos investigadores han evaluado los niveles de HAM en VT con THR, aunque los resultados no son con cluyentes. Caanen y col. encontraron una disminución de este marcador luego de 16 semanas de tratamiento con testosterona, sin embargo, estos individuos habían recibido previamente análogos de GNRH e inhibidores de aromatasa17. En otro estudio retrospectivo no hallaron variaciones en los niveles de HAM24.
En el Hospital Durand funciona, hace más de 15 años, el Grupo de Atención a Personas Transgénero (GAPET), considerado un centro de referencia y derivación de indi viduos con diversidad de género ya que brinda atención integral en diferentes especialidades. En nuestra expe riencia, aproximadamente el 70% de los VT no desean vitrificar ovocitos previos al inicio del THR, por lo que se decidió investigar si el mismo afecta su reserva ovárica.
El objetivo de este trabajo es evaluar los niveles de HAM en VT durante el THR con testosterona a corto plazo.
Materiales y métodos
Se realizó un estudio de diseño prospectivo en la División Endocrinología del Hospital Durand, durante los meses de febrero de 2016 a septiembre de 2019, para evaluar el impacto del THR con testosterona sobre los niveles de HAM.
Se incluyeron consultantes VT entre 18 y 30 añospara el análisis, con ciclos menstruales regulares (eumenorrea) y que deseaban una masculinización completa, la cual desde el punto de vista del objetivo bioquímico implica alcanzar valores de testosterona dentro del rango de referencia poblacional masculino. Previo al inicio del THR y para verificar su estado de salud genital todos debían ser evaluados por el servicio de ginecología. De los 82 VT atendidos en el consultorio de endocrinología del Hospital Durand, se excluyeron aquellos consultantes con diagnóstico de SOP o con signos clínicos y/o bioquímicos de hiperandrogenismo, los que estuviesen bajo tratamiento actual o previo con esteroides sexuales, así como también aquellos que no regresaron al control semestral o anual del tratamiento hormonal de reafirmación, quedando de esta manera incluidos en este estudio un total de 16 VT. Esta decisión de exclusión se realizó con el fin de evitar que cualquier modificación en los valores de HAM sea consecuen cia del uso concomitante de otros preparados, así como de enfermedades que causen oligo-anovulación.
El estudio fue aprobado por el Comité de Ética del Hospital y se obtuvo el consentimiento informado por escrito de cada participante.
Se tomó una muestra de sangre por venopunción antes del inicio del tratamiento (basal) y a los 6 y/o 12 meses de iniciado el mismo (control). Estos controles fueron realizados siguiendo nuestro protocolo de rutina, para determinar los niveles hormonales de testosterona recomendados, acordes al sexo biológico masculino. El preparado de testosterona elegido para iniciar el THR se consensuó con cada consul tante teniendo en cuenta además la disponibilidad del mismo.
Los 16 VT incluidos en el estudio fueron tratados con un decanoato de testosterona 1000 mg intramuscular, dosis útiles para lograr masculinización clínica y bioquímica. Tal como se menciona en la literatura mundial, y como recomienda el fabricante: iniciamos una dosis IM basal con un refuerzo a los 45 días. A partir de este refuerzo se continúa cada 12 semanas ± 2 semanas de acuerdo a los controles bioquímicos.
Al momento del control hormonal, 9 consultantes habían recibido 3 (basal, refuerzo y 1 dosis) aplicaciones de testos terona mientras que 7 habían recibido 4.
Se midieron los niveles de hormona luteinizante (LH), FSH, estradiol, testosterona y HAM en fase folicular temprana (basal) mediante un método quimioluminiscente, y luego de los 6 a 12 meses del THR se determinaron los niveles de testosterona y HAM.
La HAM se determinó mediante un inmunoensayo quimio luminiscente tipo sándwich, con un límite inferior de detección de 0.02 ng/ml. Para la determinación de testosterona se utilizó un inmunoensayo quimioluminiscente de tipo competitivo, con un límite inferior de detección de 0.1 ng/ml.
El análisis estadístico para muestras pareadas se llevó a cabo mediante el test Wilcoxon Signed Rank para aquellas variables que no tenían distribución normal. La significancia estadística se consideró con una p < 0.05. Los análisis es tadísticos fueron realizados con el programa Statistix 7.0.
Resultados
La Tabla 1 muestra las características basales de los 16 VT que cumplieron los criterios de inclusión del estudio. Son presentadas como mediana y rango intercuartil.
Tabla 1. Características basalesde los 16 varones trans (VT) incluidos en el estudio
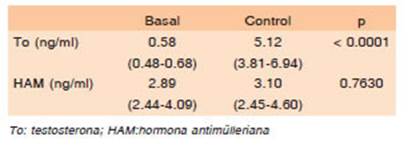
La Tabla 2 describe la mediana de los niveles basales de testosterona y HAM y los valores obtenidos luego de 6 a 12 meses de iniciado el THR, a lo que llamamos “control”.
Tabla 2. Medianas de testosterona y hormona antimülerriana basales vs. control (6-12 meses)
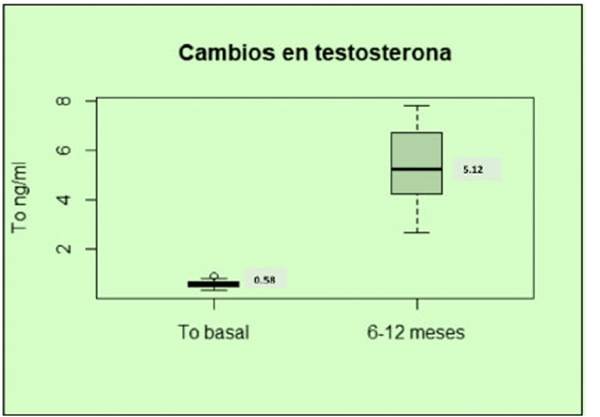
Todos los individuos, al momento del control semes tral o anual del THR, lograron un aumento de los niveles de testosterona que se encontraron dentro del rango de referencia poblacional masculino (3-9 ng/ml) (Fig. 1). Sin embargo, no se observaron diferencias significativas (p 0.7630) en los niveles de HAM basales y luego de 6 a 12 meses de iniciado el tratamiento con testosterona.
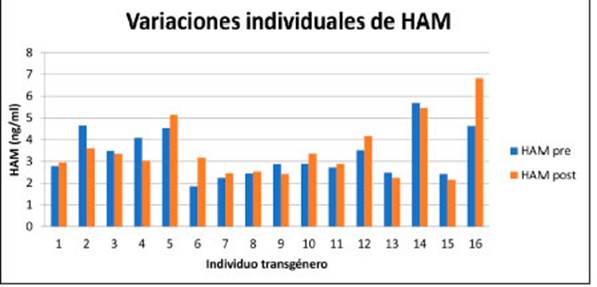
Las concentraciones individuales de HAM basales y control se representan en Figura 2.
Discusión
En nuestro país, de acuerdo con la ley 26.743 de identidad de género, se establece "el derecho a acceder a inter venciones quirúrgicas totales y parciales y/o tratamientos integrales hormonales para adecuar su cuerpo, incluida su genitalidad, a su identidad de género autopercibida", a fin de garantizar el goce de su salud integral. La evaluación de la fertilidad constituye uno de los temas que el médico debe abordar, sobre todo resguardando su buen accionar ante efectos poco conocidos del THR.
El deseo de fertilidad en personas trans debe ser considerado antes del inicio de cualquier tratamiento, médico o quirúrgico. Recientes estudios informaron que aproximadamente el 50% de las personas trans mantie nen el deseo ser padres25-27.
El personal de salud dedicado a la atención de perso nas trans debe, por un lado, cumplir con las necesidades y requerimientos del individuo como la ley lo demanda y, por otro lado, debe tenerse en cuenta las opciones de preservación de fertilidad previo a la decisión de iniciar el proceso de asignación del género autopercibido. Dado que, en nuestra población, un alto porcentaje de VT no desea preservar gametas antes de iniciar tratamiento, la medición de HAM constituye una herramienta promisoria en VT ya que conforma una técnica no invasiva y demos tró alta correlación positiva con el número de complejos cúmulo-ovocito24,28.
Actualmente se debate si la exposición a andrógenos altera la reserva ovárica. Los estudios publicados hasta el momento son contradictorios. A diferencia de lo publicado por Caanen y col., los cuales observaron una disminución en la concentración de HAM luego del THR, nuestros resultados indican que no habría diferencias significativas en los niveles de HAM en VT con THR, similar a lo que comunican Tack y col.17,25. Esto es importante conside rarlo ya que las técnicas de preservación de fertilidad son costosas y poco accesibles para la población general, lo que constituye una barrera para su alcance4,5. Hasta donde sabemos, este es el primer estudio realizado en nuestro país que evalúa los niveles de HAM en VT durante el tratamiento hormonal.
A pesar de ciertas limitaciones potenciales, nuestros resultados son prometedores y servirán para direccionar futuras investigaciones en nuestro país. Dado que el tratamiento hormonal es parcialmente reversible, frente al deseo futuro de fertilidad podría llegar a ser posible recuperar la función ovárica en estos individuos. Sin embargo, aun teniendo en cuenta que la HAM disminuye con la edad, se necesitan más estudios clínicos e histo patológicos a mediano y largo plazo para determinar el impacto de los andrógenos en los niveles de HAM, la reserva folicular y la morfología ovárica en VT.




![[18F]Fluorothymidine preclinical study in non-human primate. Dosimetry and biodistribution](/img/en/prev.gif)