PUNTOS CLAVE
• El diagnóstico de infección de prótesis articulares constituye un desafío para el equipo médico que debe abordarlas. Las limitaciones de algunas de las pruebas existentes y falta de disponibilidad de otras hacen dificultoso el diagnóstico correcto y oportuno.
• Estas recomendaciones están realizadas con el objeto de proveer una herramienta que permita seguir un curso de acción razonable, basada en el conocimiento actual y los recursos disponibles, sin reemplazar al juicio clínico.
Las infecciones de prótesis articulares (IP) afectan al 0.5-1% de los implantes primarios y 3-5% de los implantes de revisión. Si bien su incidencia promedio se ha reducido progresivamente, se estima que el número de IP aumentará en las próximas décadas, debido, entre otras razones, a la mayor expectativa de vida, con el consecuente incremento en la demanda de estos procedimientos que devuelven la capacidad funcional a millones de pacientes1,2. El riesgo es mayor para rodilla (1-2%) que cadera (0.3-1.3%) y puede llegar al 9% en otras localizaciones como el codo.
En Argentina, un estudio estimó el exceso de casos de infección de sitio quirúrgico (ISQ) asociada a prótesis de cadera y de rodilla como Razón Estandarizada de Infección (REI). Este indicador resulta de dividir los casos observados sobre los casos esperados, en base a una tasa de referencia. La REI calculada para el Proyecto “Índice de Riesgo de Infección Quirúrgica” (IRIQ, 2003), el Proyecto VALIDAR (2004) y el Programa Nacional de Vigilancia de Infecciones Hospitalarias (VIHDA, 2005-2013) fue de 1.95 (IC95% 1.69-2.22) y 2.98 (IC95% 2.31-3.65), para ISQ de prótesis de cadera y de rodilla, respectivamente. Esto representa un exceso de alrededor del doble de casos de ISQ peri-protésicas en nuestro país en comparación con los EE.UU. (Quirós RE. ¿Existe un exceso de infecciones de sitio quirúrgico en la República Argentina?. XV Congreso de la Sociedad Argentina de Infectología. 28-30 mayo 2015. Buenos Aires-Argentina). Más recientemente, el informe anual VIHDA (enero-diciembre 2019 - sobre 54 instituciones), informó que las tasas de infección de prótesis articulares varían entre 2.7-5.4% en cadera, 1.6-2.4% en rodilla3. Un estudio caso control realizado en nuestro país, en el año 2009, demostró un incremento en los costos atribuibles para IP de cadera de USD 15 252 cuando se realizó cirugía en dos tiempos (Salazar E y cols. Exceso de costos asociados a infección de prótesis de cadera. IX Congreso Argentino de Epidemiología, Control de Infecciones y Seguridad del paciente. 23-24 septiembre 2009. Buenos Aires-Argentina).
El diagnóstico de las IP es un gran desafío por su presentación poco evidente y solapada, exigiendo una alta sospecha clínica. Es fundamental realizar el diagnóstico en forma oportuna y expeditiva. Para las presentes recomendaciones se realizó una revisión narrativa de la literatura publicada hasta abril de 20214-11. Aunque el presente documento está enfocado en IP de rodilla y cadera, representa una revisión actualizada de las recomendaciones existentes, aportando evidencia clasificada acorde a CTFPHC (Canadian Task Force on Preventive Health Care)12. Este grupo considera que en muchos casos la opinión de expertos (calidad III de evidencia) tiene el peso necesario para sostener un grado de recomendación A, hasta tanto se cuente con mayor información13.
El objeto de estas guías es proveer una herramienta que permita seguir un curso de acción razonable basada en el conocimiento actual y los recursos disponibles, sin reemplazar al juicio médico.
Definición de infecciones de prótesis articulares
Se han utilizado varias definiciones para el diagnóstico de IP. Hasta el año 2010 el diagnóstico fue subjetivo y a discreción del centro o profesional tratante, con lo cual los estudios clínicos son de difícil interpretación.
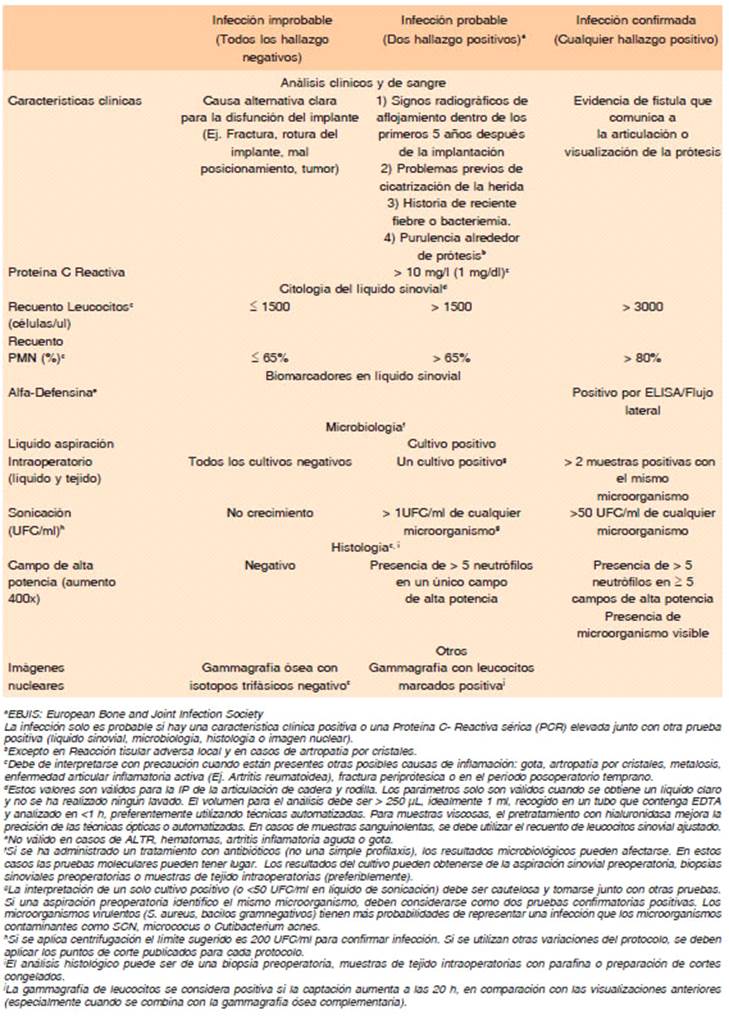
En 2011 la MSIS propuso una serie de criterios diagnósticos, posteriormente revisados y modificados por el ICM y las guías IDSA que estandariza el diagnóstico de IP, facilitando la investigación colaborativa y la interpretación de los estudios clínicos, pero en base a la opinión de expertos (Tabla 1).
En 2018, se realizó un estudio multicéntrico que culminó en un sistema de puntuación para establecer el diagnóstico de IP crónica, generando por primera vez una definición basada en evidencia que posteriormente fue sometida a validación externa, y que permite validar los puntos de corte propuestos en ICM 2013 para cada test y atribuir un peso diagnóstico relativo14. Los pacientes con IP aguda temprana o hematógena (síntomas < 6 semanas) y megaprótesis fueron excluidos (Tabla 2). La validación mostró que 95.5% de las IP crónicas y 97.5% de las asépticas fueron correctamente diagnosticadas. La población analizada incluía pacientes con neoplasia, diabetes y artritis reumatoidea (AR), por lo tanto, los puntos de corte y puntaje sugeridos y validados son aplicables en estas poblaciones. Esta nueva definición ofrece una elevada sensibilidad (97.7% vs. el 79.3% de sensibilidad de los criterios MSIS-2011) y elevada especificidad (99.5%) en el caso que el puntaje señale infección o no infección, quedando un grupo de pacientes con puntaje intermedio (no concluyente)8, que requerirá profundizar o repetir estudios hasta quedar incluido en alguno de los otros 2 grupos. Esta definición no incluye la técnica de sonicación ni técnicas moleculares en sus criterios, permitiendo su aplicación en cualquier ámbito, dejando la posibilidad de avanzar sobre estas técnicas para los casos no concluyentes. El sistema de puntaje está diseñado para interpretar los estudios solicitados, no siendo un algoritmo. Por otra parte, debido a que hasta el 41% de las IP tienen cultivos negativos, es importante contar con criterios que permitan establecer el diagnóstico en forma confiable.
Los criterios diagnósticos no son de utilidad en pacientes con artropatía por cristales, artropatías inflamatorias, infecciones por microorganismos de lento crecimiento (Cutibacterium acnes y algunas especies de Staphylococcus coagulasa negativos (SCN), con la probable excepción de S. lugdunensis).
Por lo dicho en este apartado, una de las principales dificultades para interpretar los resultados de los test, subyace en los diferentes criterios usados para clasificar las IP15,16-19.
Clasificación
Aunque uno de los elementos clave es la duración de los síntomas, no existe evidencia que avale el intervalo de tiempo óptimo para dividir las IP en agudas y crónicas. La historia natural de las IP es un continuo desde el inicio hasta la cronicidad, a lo largo de lo cual se establece el biofilm. Si bien el biofilm microbiano puede desarrollarse en las primeras horas o días, no está claro el momento preciso en que se establece la madurez del mismo, dado que su proceso de formación varía notablemente entre las diferentes especies bacterianas20. La mayoría de los estudios sugieren que el biofilm maduro se establece entre las 2-6 semanas, dependiendo de la especie microbiana, inóculo y huésped8. El término “aguda” no está claramente definido y diferentes guías y autores no han logrado unificar criterios, considerando entre menos de 4 semanas y hasta 3 meses6,7,14,16,17,21,23-26. Como no existe una clasificación universalmente aceptada de las IP, este grupo de trabajo propone utilizar una combinación de clasificaciones que, junto al criterio clínico del equipo tratante, permita implementar el manejo más apropiado y según cada paciente.
Duración de los síntomas y período de presentación: permite interpretar estudios complementarios de laboratorio e imágenes, predecir etiología y guiar estrategia antimicrobiana8,27.
Aguda
• Postoperatoria: síntomas <4 semanas28-30. Inicio usualmente abrupto, dolor que aumenta rápidamente y flogosis. Los microorganismos predominantes son: S. aureus, Enterobacteriaceae, Pseudomonas aeruginosa, Enterococcus spp e infecciones polimicrobianas; alta prevalencia de microorganismos multiresistentes27, en particular en la situación epidemiológica actual en Argentina.
• Hematógena: síntomas < 3 semanas luego de un período asintomático variable10,28,29. Puede ocurrir en cualquier período postoperatorio luego de una etapa libre de síntomas, como resultado de una bacteremia17. Los microorganismos más frecuentes son Staphylococcus aureus y Streptococcus spp27. Su incidencia es 0.07% por prótesis por año30.
Crónica: síntomas >4 semanas30
• Temprana (1-3 meses del postoperatorio)8,16. Suelen ser agudas que evolucionan a la cronicidad. Los agentes etiológicos son similares a las IP agudas postoperatorias.
• Demorada (3 meses a 2 años); predomina notablemente SCN.
• Tardía (>2 años). Predominan SCN y C. acnes27.
Métodos diagnósticos
Toda artroplastia dolorosa debe ser considerada una IP posible hasta que se demuestre lo contrario22. La historia clínica detallada permitirá guiar los pasos a seguir con el objeto de lograr el diagnóstico, que se basa en la combinación de hallazgos clínicos, parámetros químicos sanguíneos y del líquido sinovial, cultivos e histología (Tablas 2, 3 y 4) que se suman al criterio del equipo tratante.
Diagnóstico preoperatorio
Es esencial que la IP sea diagnosticada o excluida antes de una cirugía de revisión. Los datos pre, intra y postoperatorios así como el examen físico, permitirán establecer la probabilidad pre-test de IP, y planear los pasos diagnósticos a seguir (C-III)5.
Antecedentes y manifestaciones clínicas
Factores de riesgo de IP: ASA score - American Society of Anesthesiologists ≥ 3, AR o trauma como causa de reemplazo31, cirugía prolongada (> 2.5 horas), obesidad31, malnutrición32, diabetes, alcoholismo, inmunosupresión32, infección previa en articulación31, aflojamiento temprano, insuficiencia renal crónica, hepatopatía crónica (especialmente hepatitis C), infección del sitio quirúrgico (ISQ) superficial, bacteriemia por S. aureus33, dehiscencia de la herida, neoplasia, linfedema34, colonización por S. aureus.
Manifestaciones clínicas (C-III)
a. Síntomas de infección aguda: Fiebre (40% de los pacientes)35. Dentro de los 5 días postoperatorios puede deberse a causa no infecciosa, en respuesta al trauma quirúrgico. Frecuente en IP aguda hematógena. Flogosis periarticular: frecuente en IP aguda postoperatoria y hematógena. Eritema (42%)35, difícil de jerarquizar en los primeros días del posoperatorio. Secreción prolongada por la herida quirúrgica28. Dehiscencia de la herida quirúrgica28. Dolor: es el síntoma más frecuente.
b. Síntomas de infección crónica: suelen ser sutiles. Disfunción articular, dolor, sensibilidad (S) 60-97%; especificidad (E) 28%35. Disminución del rango de movilidad (S 84%; E 44%)35. Impotencia funcional y dolor pueden ser las únicas manifestaciones de las formas crónicas. Fístula (S 20-30%; E 100%)35 es considerada criterio mayor para el diagnóstico de IP. Líquido articular (S 79%; E 67%). Otras manifestaciones: eritema (S 43%; E 95%) y fiebre (S 13- 41%; E 96%) han demostrado ser altamente específicas.
Pruebas de laboratorio
El uso de antimicrobianos altera la eficacia diagnóstica de los test (cultivos, marcadores serológicos y sinoviales) por lo que se sugiere fuertemente evitar la administración de antibióticos en pacientes con sospecha de IP, salvo que el paciente presente inestabilidad sistémica por sepsis (A III)8 escenario, por otra parte, muy infrecuente y que, en general, se observa en infecciones tempranas o hematógenas.
Hemograma
No se recomienda en general realizar recuento de leucocitos ni porcentaje diferencial de neutrófilos como test diagnóstico para IP debido a que es poco sensible y específico8,54.
Marcadores séricos
No existe un marcador perfecto. Su uso combinado utilizando puntos de corte validados, es esencial para el diagnóstico de IP, en particular aquellas con cultivos negativos.
Si bien los marcadores en líquido articular tienen mayor exactitud y son superiores, los test séricos siguen siendo la primera línea diagnóstica por ser menos invasivos y fácilmente accesibles38.
Velocidad de sedimentación globular (VSG) y proteína C reactiva cuantitativa (PCR)
Son los marcadores serológicos de primera línea y deben realizarse en todo paciente con sospecha de IP (A-III)7. Existen variaciones de estos marcadores entre distintos laboratorios por lo cual se recomienda realizar el testeo siempre en el mismo laboratorio (CIII). El aumento del fibrinógeno y otras proteínas plasmáticas, así como la presencia de anemia y proteínas anormales circulantes pueden aumentar la VSG38. La VSG debe medirse por método semiautomatizado39.
La VSG y PCR son marcadores de respuesta sistémica a la inflamación, por lo tanto, no pueden utilizarse como únicos test para diferenciar IP vs. no IP. Además, los valores normales no descartan la presencia de infección. Las IP provocadas por microorganismos de baja virulencia pueden cursar con marcadores de respuesta inflamatoria sistémica normales28. En ausencia de artropatía inflamatoria o infección, sus niveles se normalizan, en promedio, en la tercera semana. VSG puede permanecer elevada hasta 6 semanas luego de la cirugía, mientras que PCR lo hace hasta 2 semanas.
La PCR es un reactante de fase aguda, producida por el hígado en respuesta al aumento de interleukina-6, alcanzando el pico máximo a las 24-35 horas del inicio del estímulo. Se une a las bacterias favoreciendo y estimulando su fagocitosis por parte de los leucocitos. No es específico de inflamación de origen infeccioso, y puede elevarse en enfermedades sistémicas autoinmunes, trauma o luego de lesión tisular quirúrgica. Además, la PCR aumenta luego de la cirugía como consecuencia de la inflamación postoperatoria; siendo de mayor utilidad la medición seriada para una interpretación apropiada28. Su concentración disminuye con el uso de corticoides sistémicos38. No son útiles las determinaciones cualitativas expresadas en “cruces” ni tampoco las semicuantitativas (ej.: 1/8).
Ambos marcadores pueden tener falsos positivos (enfermedades inflamatorias sistémicas y en el período postoperatorio temprano7) y negativos (en aproximadamente 23% de pacientes con IP; uso de antibióticos sistémicos e infecciones por microorganismos de baja virulencia40-42.
La determinación de VSG y PCR en forma conjunta tiene mayor sensibilidad que cada determinación por separado (A-III). Son útiles en la evaluación inicial y para el seguimiento.
Para el diagnóstico de IP, la sensibilidad para VSG es de 42-94%, y la especificidad de 33-87%38; mientras que para PCR la sensibilidad varía de 74 a 94% y la especificidad de 20 a 100%. Esta gran variabilidad obedece a los distintos puntos de corte utilizados en los estudios clínicos. En ocasiones los valores de VSG principalmente y también de la PCR, pueden tener intermitencias durante el seguimiento, con aumentos y descensos, a veces de difícil interpretación, y que pueden no estar en relación con la evolución clínica y radiológica; deben analizarse con prudencia, observar la tendencia en determinaciones sucesivas en intervalos razonables y no tomar decisiones únicamente basados en estos parámetros.
Los puntos de corte de VSG y PCR cuantitativa sugeridos para el diagnóstico de IP crónica son valores >30 mm/h y 10 mg/l respectivamente8,43. Con estos puntos de corte la VSG muestra una S de 86% y E de 72%; mientras que la PCR muestra S de 87-88% y E de 73-79%43,44.
Para el caso de las IP agudas tempranas (<4 semanas del postoperatorio) se sugiere utilizar puntos de corte de PCR más elevados (>100 mg/l) para evitar falsos positivos provocados por postquirúrgico inmediato8.
Los puntos de corte mencionados se ven alterados en pacientes con enfermedad infecciosa de otra etiología, neoplasia, insuficiencia renal crónica, insuficiencia hepática, o enfermedades autoinmunes. Estos grupos de pacientes fueron excluidos en los estudios para el diagnóstico39.
Un estudio retrospectivo sugiere puntos de corte dentro de las 4 semanas postoperatorias de 55 para VSG y 23 para PCR. En este estudio los valores de VSG y PCR fueron mayores para IP tardía de rodilla que cadera. En las IP tempranas no hubo diferencias entre rodilla y cadera39. Con puntos de VSG > 50 y PCR > 20 la S es 80% y 95% y la E de 93% y 94% respectivamente.
Resumiendo: debe realizarse PCR cuantitativa y VSG en todo paciente con sospecha de IP. Entre 4 y 11% de las IP pueden tener ambos marcadores negativos47,48. Los valores normales o debajo del punto de corte se observan en IP provocadas por microorganismos poco virulentos (Cutibacterium, Corynebacterium y especies de SCN) o en pacientes que han recibido tratamiento antibiótico47,49. Su valor normal o debajo de los puntos de corte no descarta IP (A-I)11. Una baja probabilidad pre-test y un resultado negativo de ambas son en general suficientes para descartar infección antes de la cirugía de revisión43. En caso de que ambos sean negativos pero la sospecha clínica sea elevada, deben indicarse otras herramientas diagnósticas.
Consideramos que es de buena práctica tomar muestras para cultivo cada vez que se realice una revisión de una artroplastia por razones aparentemente no infectológicas y con baja probabilidad pre-test, dadas las implicancias que puede tener para el paciente además de las ventajas de implementar tratamientos precoces y apropiados.
Interleuquina 6 (IL-6)
Es una citoquina inflamatoria producida por monocitos y macrófagos en respuesta a infección o inflamación. Se encuentra elevada significativamente en IP comparado con el aflojamiento aséptico. El nivel sérico normal es de 1 pg/ml. Aumenta en el postoperatorio de una artroplastia (hasta 30-430 pg/ml) retornando su nivel basal a las 48 hs. No se eleva en aflojamiento protésico aséptico; transformándolo en un biomarcador sérico potencialmente útil, especialmente en el postoperatorio (IP agudas tempranas). Su S y E son de 72-97% y 89- 91% respectivamente (comparables a VSG y PCR); por lo que al momento no hay recomendaciones definitivas para su uso en el diagnóstico de IP8,50. Falsos positivos: inserto de polietileno (los monocitos responden a las partículas de polietileno secretando IL-6)50 y pacientes obesos (pueden tener niveles elevados afectado por el tejido adiposo)8.
Procalcitonina
Aumenta en presencia de infecciones bacterianas dentro de las 6-24 hs de ocurridas. Tiene alta precisión para el diagnóstico de infecciones sistémicas. Sin embargo, su baja S (33 a 58%) para el diagnóstico de IP, limita su utilidad y no se recomienda su uso8,50.
Dímero-D
Producto de degradación de la fibrina usado para el screening de trombosis venosa profunda. Las infecciones sistémicas o locales aumentan los niveles de dímero-D por la actividad fibrinolítica. La S de su determinación es de 80-89% y la E de 79-93%, por lo que se considera útil para asistir en el diagnóstico de IP (A-II). Su valor se normaliza al segundo día postoperatorio, permitiendo su uso en la evaluación de IP aguda51. Su utilidad principal sería asistir en la determinación del momento óptimo de reimplante.
Su S y E dependen del punto de corte elegido. El consenso ICM 2018 lo estableció en 850 ng/ml a partir de una cohorte en un estudio de una sola institución52. Utilizando un punto de corte mayor (1170 ng/ml) su S es de 93% y E de 75%. La combinación de dímero-D y PCR tiene una S de 98% en el diagnóstico de IP crónica53. Puede asistir al diagnóstico de IP crónica aportando información adicional a PCR y VSG (A-II).
Artrocentesis diagnóstica. Marcadores sinoviales
Se recomienda realizar artrocentesis en todo paciente con sospecha de IP, salvo que el diagnóstico sea evidente, esté planeada la cirugía y pueda diferirse el inicio antibiótico. Es la herramienta diagnóstica más útil y debe realizarse en toda articulación protésica dolorosa antes de su revisión28. También se recomienda en pacientes con prótesis y PCR o VSG inexplicablemente elevadas (A-III) o con sospecha clínica de IP7.
El análisis de líquido sinovial debe incluir:
- Recuento glóbulos blancos (GB) y % polimorfonucleares (PMN) (A-III)
- Leucocito esterasa (LE)
- Proteína C reactiva (PCR)
- Cultivo en aero y anaerobiosis (A-III)
- Búsqueda de cristales
En pacientes clínicamente estables, se recomienda suspender antibióticos al menos 2 semanas antes para optimizar la recuperación microbiológica (B III)7.
a. Recuento de glóbulos blancos
Debe realizarse dentro de las 24 horas de la aspiración. Su punto de corte sigue siendo materia de debate. Para IP crónica se han propuesto valores >170017 (S 94% y E 88%) y en pacientes sin enfermedad reumatológica7,17,46. El ICM 2018 toma como criterio menor un punto de corte de 3000/μl (S 86% y E 83%)14. Para IP aguda los valores propuestos son de 10 000 a > 27 8007. Puede tener un gran valor predictivo negativo. No es útil en condiciones que provocan inflamación aséptica (artropatía por cristales, enfermedades reumatológicas, periodo postoperatorio temprano, luxación o fracturas periprotésicas)28.
b. Porcentaje de polimorfonucleares
También continúa en debate el punto de corte7,9,17. El ICM 2018 toma como punto de corte 70% para IP crónica y 90% para IP aguda (< 6 semanas postoperatorias)14.
c. Leucocito-esterasa
Puede detectarse fácilmente usando tiras colorimétricas como las usadas para el análisis de orina. La presencia de sangre puede interferir con los cambios colorimétricos. Es una prueba sencilla, rápida, económica, con alta S (92-100%) y E (77-88%).
Considerando el resultado de “++” como IP, la S, E, VPP y VPN y la precisión diagnóstica fueron 84, 100, 100, 79 y 90%, respectivamente en una población de 67 individuos sometidos a artroplastia de cadera o rodilla en forma prospectiva. La interpretación visual estuvo de acuerdo con el lector colorimétrico automatizado en el 90% de los casos (alfa de Cron Bach = 0.894). El grado de la prueba estuvo fuertemente correlacionado con el recuento de glóbulos blancos en el líquido sinovial (ρ = 0.695) y el porcentaje de PMN (ρ = 0.638), y se correlaciona moderadamente con la PCR y la VSG54,55.
d. Alfa-defensina
Es un péptido antimicrobiano liberado por los neutrófilos en respuesta a diferentes patógenos envueltos en citoquinas proinflamatorias. Se activa en forma innata y funcionan localmente independientemente de la respuesta sistémica. Puede ser útil en donde se ha administrado previamente antibióticos, en microorganismos de baja virulencia y no se afecta por la contaminación con sangre del líquido sinovial. Existen dos métodos para medirlo: cuantitativo (ELISA) y cualitativo (Synovasure lateral flow, SLF), este último con menor sensibilidad59. Falsos positivos: metalosis, gota, artropatías inflamatorias. La detección cualitativa (SLF) en líquido sinovial puede hacerse en quirófano o inmediatamente luego de la aspiración en 10 minutos28,59. Estudios iniciales reportaron una S de 67-100%56-58. Utilizando los criterios de definición de ICM, muestra una baja S (54%)28, manteniendo alta E (99%)2, por lo cual no es apto para screening, sino como test confirmatorio. No está disponible en Argentina.
e. Cultivo
El cultivo del líquido sinovial tiene una S de 45-75%, con una E de 95%28. Se sugiere inocular una alícuota en botella de hemocultivo automatizada,8 e incubar durante 14 días con el objeto de detectar patógenos como C. acnes28.
La punción peri protésica puede ser de gran valor cuando la realizan manos expertas; la obtención de muestras sugestivas (en especial con artrocentesis que son negativas o cuando no hay evidencias de compromiso articular), apoyados con radioscopia, pueden aportar el diagnostico microbiológico si se realizan con precisión.
Siempre es importante el intercambio de información con el área de microbiología y evaluar cultivos en medios especiales, si son necesarios, o la incubación prolongada. La mirada clínica del experto del laboratorio es un aspecto esencial.
Factores que modifican los marcadores séricos y sinoviales
Uso de antibióticos dentro de las 2 semanas previas(BIII)42, tipo de microorganismo (ej.: C. acnes y Staphylococcus coagulasa negativos, excepto S. lugdunensis, Corynebacterium spp., Candida y micobacterias) pueden demostrar niveles menores de marcadores inflamatorios8,59.
Hemocultivos
Deben realizarse hemocultivos en botellas aerobias y anaerobias si el paciente presenta fiebre, los síntomas son de inicio agudo o hay sospecha de infección hematógena y/o por S. aureus (B-III)7.
Cultivo superficial de fístula
No está recomendado por la alta probabilidad de contaminación (AII). Algunos expertos opinan que, en lugares con poco acceso a métodos diagnósticos adecuados, y siempre que se apliquen las condiciones de asepsia necesaria, la muestra sea profunda y el resultado sea monomicrobiano, podría tenerse en cuenta esa información hasta poder contar con una muestra más adecuada.
Imágenes
Radiografía simple
Siempre es la primera imagen a realizar en pacientes con sospecha de IP, tanto para el diagnóstico como para el seguimiento (A-I)7,9,60. De bajo costo, accesible, permite evaluar la estructura ósea, pero no tanto las partes blandas (aunque las radiografías con técnica digital pueden aportar algún indicio). La evaluación seriada puede ser útil para detectar aflojamiento28. Deben estar correctamente tomadas, con la técnica adecuada e incluir el par radiológico.
Signos radiográficos de IP: aflojamiento de componentes previamente bien fijados y osteolisis o reabsorción ósea alrededor de los componentes protésicos (particularmente dentro de los 5 años postoperatorios), orientación o ubicación anómala de los componentes, elevación subperióstica y trayecto fistuloso transcortical. El desarrollo rápido de una línea continua de radiolucidez (> 2 mm) o de osteolisis focal dentro de los 3 años postoperatorios es sugestiva de IP, pero no es sensible ni específica para distinguirla de un aflojamiento aséptico28. La radiografía permite también descartar otros cuadros que pueden justificar (o contribuir a) la presencia de dolor (fracturas, metalosis, calcificaciones heterópicas, entre otras).
Otros estudios por imágenes: no deben ser usados rutinariamente (B-III)7.
Fistulografías y artrografías con material hidrosoluble
Son procedimientos sencillos, económicos, y de fácil acceso. Útiles para establecer la presencia de comunicación con la prótesis o con la denominada “interfase” hueso-cemento (AII). Dado que los trayectos fistulosos pueden tener un recorrido caprichoso o inusual, pueden servir además para planear el abordaje quirúrgico. Es conveniente realizarlas luego de obtener las muestras para cultivo, ya que el procedimiento puede contaminar la muestra posterior.
Ecografía
Permite detectar complicaciones alrededor de la prótesis y ante la presencia de colecciones pueden localizar el sitio a punzar61. Suelen ser de utilidad en las infecciones tempranas; la presencia de signos compatibles con colecciones y/o hematomas, debe motivar la obtención de una muestra por punción, a veces guiada con el mismo ecógrafo.
Tomografía axial computarizada con contraste endovenoso
Es útil para evaluar la presencia de secuestros óseos, abscesos, fístulas y permite hacer la reconstrucción de diferentes planos. Los implantes metálicos generan artefactos que deterioran la imagen, que se pueden minimizar con técnicas de sustracción digital61.
Puede contribuir a detectar defectos acetabulares.
Resonancia magnética nuclear
Útil para evaluar compromiso de partes blandas, permitiendo ver abscesos y fístulas. Tiene como desventaja que las imágenes pueden verse alteradas por artefactos metálicos debido al implante, a menos que los mismos sean de titanio o tantalio. La resonancia magnética nuclear (RMN) con secuencia de reducción de artefactos metálicos (MARS) es útil para el diagnóstico diferencial con metalosis28,61.
La TAC y la RMN ofrecen imágenes de difícil interpretación en las IP tempranas, debido a los cambios ocasionados por la propia cirugía.
Estudios radioisotópicos
Su utilidad ha sido cuestionada con frecuencia. Es importante tener en cuenta que puede existir hipercaptación durante períodos prolongados (6-12 meses luego de la artroplastia; y extenderse a >2 años en prótesis no cementadas). Su importancia reside en su posible valor predictivo negativo; aunque tampoco es definitivo (A-II) ya que zonas “frías” (que en ocasiones suelen ignorarse) pueden ofrecer información de utilidad.
La gammagrafía ósea tiene una S y E de 33% y 86%, respectivamente. Dada su E, puede alcanzar un VPN relativamente alto, por lo que puede ser útil en la evaluación inicial de pacientes con dolor en el sitio de una artroplastia cuando la etiología no es clara23. El empleo de 99mTc difosfonato de metileno (MDP) tiene excelente S, pero baja E28. No valorable durante el primer año postoperatorio ya que persiste la captación en fase tardía debido a que detecta el aumento de remodelación ósea alrededor de la prótesis. No permite diferenciar entre IP y aflojamiento aséptico. Por su parte, los leucocitos marcados con Indio-111 (S: 80%, E: 80%) debido a que no se acumulan normalmente en las zonas periprotésicas, podrían utilizarse en el período temprano28. En prótesis no cementadas la captación de la médula ósea desplazada ocasiona falsos positivos.
La especificidad de estudios por imágenes de médula ósea con azufre coloidal marcado con tecnecio-99m combinados con estudios de leucocitos marcados con indio-111 puede ser mejor que las pruebas por separado. Debe iniciarse con la gammagrafía con tecnecio para mostrar las zonas de alta actividad metabólica y luego el 111In, que se acumulará en regiones de inflamación. La combinación de estos dos estudios ayuda a diferenciar una infección verdadera de zonas no inflamadas, con alta actividad metabólica, como fracturas o regiones de remodelado. Finalmente, el Galio-67 tienen una baja sensibilidad para diagnosticar infección ya que se fija a tejidos en función de la vascularización, la inflamación y otros factores.
Tomografía por emisión de positrones con 18-fluorodesoxiglucosa
Es un estudio de alta calidad para la detección de IP (S 82% y E 87%)28 pues refleja la utilización de glucosa y puede indicar zonas de inflamación. Su empleo es aún controvertido y se necesitan más estudios para definir su utilidad, ya que es un método caro y no está accesible en todos los centros.
En general, la mayoría de los pacientes con sospecha de IP no suelen necesitar de los estudios de medicina nuclear mencionados para confirmar el diagnóstico, en especial en los primeros 2 años desde la artroplastia. De hecho, las guías de IDSA, recomiendan no realizar estos estudios de rutina (B- III). Pueden ser de utilidad en pacientes seleccionados, donde los estudios presentan resultados no concluyentes.
Postergar la obtención de muestras para cultivo para realizar un estudio radioisotópico, cuando otras imágenes han aportado datos de interés, puede ser perjudicial para el paciente afectado y el futuro de la artroplastia comprometida, en particular cuando se pretende una estrategia conservadora del implante afectado.
Diagnóstico intraoperatorio
Examen histológico de tejido periprotésico
Es un método altamente confiable, y debe considerarse un procedimiento estándar en el diagnóstico de IP28. La detección de polimorfonucleares puede realizarse por técnicas de inmunohistoquímica y validarse usando una puntuación. Se debe realizar recuento de neutrófilos por campo con magnificación de 400x. El infiltrado inflamatorio puede no estar distribuido uniformemente en la articulación, es necesario tomar al menos tres muestras profundas: membrana interfase implante-hueso, pseudocapsula/sinovial u otros tejidos. Deben evaluarse de 5 a 10 campos de alta potencia (magnificación 400x).
El criterio para confirmar infección es la presencia de 5 o más neutrófilos en cada uno de los 5 campos de alta potencia. La histología tiene menor S que E (especialmente para SCN y C. acnes).
Cultivos
Deben tomarse al menos 3-5 muestras de tejido periprotésico intraoperatorio para cultivo (B-II). Para limitar el riesgo de contaminación, cada muestra debe tomarse con elementos estériles separados e identificar cada una correctamente. Algunos expertos opinan que las muestras obtenidas del canal medular pueden ofrecer mayor rédito microbiológico. Las muestras deben incubarse en aéreo y anaerobiosis, no realizando cultivos para hongos o micobacterias en forma rutinaria6. La sensibilidad de los cultivos procesados en forma estándar es de 54%.
Se sugiere fuertemente abstenerse del uso de antibióticos (con objetivos terapéuticos) si no hay diagnóstico etiológico preoperatorio, salvo que el paciente presente compromiso sistémico (sepsis). Si el paciente se encuentra bajo tratamiento antibiótico se sugiere suspender los mismos al menos 2 semanas antes de la toma de muestras para optimizar el rendimiento de los cultivos (A-II). Los antibióticos profilácticos no tienen efecto negativo sobre el rendimiento de los cultivos intraoperatorios8,62,63.
Sonicación del implante removido
Esta técnica utiliza ultrasonido con ondas de baja frecuencia a través del líquido que rodea la prótesis, desprendiendo los microorganismos que se encuentran formando biofilm en la superficie62,63. El fluido sonicado se remite para cultivo y su inoculación en botellas de hemocultivo mejora la sensibilidad y reduce el tiempo de cultivo a 5 días. El punto de corte de 50 UFC/ml del fluido de sonicación tiene S de 79% y E de 99%. Es especialmente útil en IP crónicas y en pacientes con tratamiento antibiótico previo. La metodología de obtención de la muestra en el quirófano es precisa: la prótesis explantada debe ser colocada inmediatamente en un contenedor estéril hermético rígido de plástico. No deben usarse bolsas plásticas ya que tienen alta tasa de contaminación. Deben ser remitidas a la brevedad al laboratorio de microbiología.
En las IP agudas tempranas, la sonicación de las partes del implante cementadas con antibiótico provoca aumento de la liberación y elusión del antibiótico, inhibiendo el crecimiento microbiano y provocando resultados falsos negativos28.
Reacción en cadena de la Polimerasa (PCR)
Este método de biología molecular tiene una S de 84% y E de 89% en el fluido sinovial, y de 81 y 96% en fluido de sonicación. Es útil en pacientes que han recibido antibióticos. Su limitación es el costo y los falsos positivos por contaminación28.
Conclusiones
El desarrollo tecnológico y mayor expectativa de vida han incrementado el uso de cirugía de artroplastia. Su complicación infecciosa constituye un problema creciente de salud pública. El diagnóstico de IP se encuentra en permanente evolución y constituye un desafío. Las diferentes definiciones, la evolución de nuevas metodologías diagnósticas, y las limitaciones de los métodos diagnósticos clásicamente utilizados constituyen una dificultad para realizar el diagnóstico correcto y oportuno.
La sospecha clínica, el manejo multidisciplinario y el abordaje sistemático utilizando las herramientas diagnósticas disponibles constituyen los pilares del diagnóstico.