PUNTOS CLAVE
Conocimiento actual
• La amiloidosis plantea un desafío en el manejo clínico y en el desarrollo de guías de práctica, dada la natu raleza poco frecuente de la enfermedad, la escasez de tratamientos disponibles y aprobados por los entes reguladores
• El manejo de los pacientes con polineuropatía amiloidó tica familiar requiere un abordaje multidisciplinario
Contribución del artículo
• En los últimos años se desarrollaron nuevas drogas para el tratamiento de los pacientes con polineuropatía amiloidótica familiar
• La evidencia científica disponible es limitada y de mo derada-baja calidad
• Existe una necesidad urgente de generar información científica de calidad para guiar la práctica clínica y la toma de decisiones
La amiloidosis hereditaria es una enfermedad poco frecuente, que se caracteriza por el depósito extracelu lar de la proteína amiloide transtiretina con compromiso multisistémico por afección de diferentes órganos y teji dos; entre ellos los del sistema nervioso, ojos, corazón y riñón1. Se produce por la presencia de mutaciones en el gen que codifica a la transtiretina, proteína sintetizada en mayor parte por el hígado que circula normalmente en su forma homotetramérica. Hoy se conocen al menos 120 mutaciones, la gran mayoría relacionadas con la reducción de la estabilidad de la forma tetramérica de la proteína y en última instancia con el desarrollo de ATTRv. La mutación más frecuente a nivel mundial es la p.Val50Met2. Si bien en sus inicios ha sido asociada a regiones endémicas como Suecia, Japón y Portugal, la incidencia en regiones no endémicas está aumentando debido al mayor conocimiento de la enfermedad y la disponibilidad de la prueba genética.
La ATTRv representa un desafío diagnóstico debido a la variabilidad del cuadro clínico y edad de presentación, al compromiso multisistémico, casos esporádicos y la penetrancia variable de las diferentes mutaciones. Se requiere de la sospecha frente a un cuadro clínico com patible y su confirmación por depósito amiloide en biopsia y/o por la detección de una mutación amiloidogénica por secuenciación del gen3.
Existen diferentes tratamientos disponibles para los pacientes con ATTRv y otros aún en etapas de investi gación4,5. El manejo de los pacientes con ATTRv requiere un abordaje multidisciplinario, incluyendo el tratamiento sintomático, el trasplante cardíaco o renal en caso de enfermedad avanzada, y la terapia específica para inhibir la producción de la transtiretina o evitar su depósito en los tejidos5.
El trasplante hepático ha sido la primera estrategia utilizada para disminuir la producción de la proteína precursora transtiretina1. Debido a las limitaciones aso ciadas al procedimiento, es que en los últimos años se han desarrollado nuevas drogas para el tratamiento de los pacientes con polineuropatía amiloidótica familiar (po lineuropatía por ATTRv), especialmente para pacientes en estadios tempranos de la enfermedad (estadio I y II) aumentando su sobrevida.
Con el objetivo de suprimir la producción hepática de transtiretina se utilizan actualmente los ARN de interfe rencia y los oligonucleótidos antisentido6. Europa y EE.UU aprobaron dentro de este grupo el uso de patisirán e ino tersen como inhibidores de la síntesis de la transtiretina en el hígado en pacientes adultos con polineuropatía estadios I y II asociada a ATTRv7. Otras drogas inhibidoras de la síntesis de la transtiretina, como AKCEA-TTR-LRx y vutrisirán están en estudio.
La disociación del tetrámero de transtiretina en subu nidades monoméricas es un proceso clave en la forma ción de la fibra amiloide4,8. Con el objetivo de estabilizar dicho precursor tetramérico circulante, Europa y algunos países de Asia y Sudamérica aprobaron el uso de tafa midis en pacientes adultos con polineuropatía estadio I9. Otras drogas estabilizadoras como el diflunisal, AG10 y epigalocatequina-3-galato presente en el té verde están en estudio10.
Por último, se evalúan tratamientos que podrían fa vorecer la remoción de los depósitos amiloides de los tejidos. Dentro de este grupo se encuentran el complejo doxiciclina-ácido tauroursodeoxicólico, y los anticuerpos monoclonales específicamente dirigidos contra la proteína amiloide depositada en los tejidos11.
El objetivo de esta guía es elaborar recomendaciones basadas en la evidencia, mediante un proceso de elabora ción validado, que permitan realizar un adecuado manejo de pacientes con polineuropatía amiloidótica familiar en la atención especializada. Los beneficios esperados son: sistematizar el tratamiento de la enfermedad en la atención especializada en el marco del grupo de estudio de amiloidosis, unificar el manejo de los pacientes con polineuropatía amiloidótica familiar entre los diferentes profesionales de la salud y mejorar los resultados en la atención. La población de estudio son pacientes con diagnóstico de polineuropatía amiloidótica familiar. Los usuarios principales previstos de la guía son profesionales de salud generalistas, clínicos, hematólogos, neurólogos y bioquímicos, en el ámbito de centros de atención es pecializada o tercer nivel de atención de Latinoamérica.
El equipo elaborador fue conformado por un grupo interdisciplinario de profesionales del Hospital Italiano de Buenos Aires, con experiencia disciplinar y metodológica. El Panel de Expertos se conformó con médicos clínicos, hematólogos, neurólogos, y bioquímicos de diversas insti tuciones. Se utilizaron como herramientas metodológicas para el desarrollo de esta guía, el Manual Metodológico GRADE 201712 y el manual actualizado “Elaboración de guías de práctica clínica en el sistema nacional de salud”13.
Métodos
Esta guía de práctica clínica de tratamiento de amiloidosis se basa en la mejor evidencia disponible de efectividad clínica y representa una ayuda a los profesionales de la salud para tomar decisiones informadas sobre la atención médica adecuada. La guía fue confeccionada basándose en estándares de calidad metodológica, dada la ausen cia de guías locales de tratamiento de la polineuropatía amiloidótica familiar. Está organizada en un apartado metodológico que narra cómo se realizaron las preguntas y un apartado con las recomendaciones pertinentes.
El proceso de cada etapa junto con su desarrollo com pleto y anexos se encuentra disponible en el repositorio institucional Trovare14. La redacción de la guía para su publicación sigue los lineamientos de reporte para las guías de práctica en el cuidado de la salud (RIGHT) de Equator (https://www.equator-network.org/)15.
Elaboración de preguntas
Las preguntas estuvieron centradas en la efectividad y seguridad del tratamiento para la amiloidosis sistémica. El equipo elaborador generó un listado de 56 preguntas que fueron priorizadas con el método Hanlon, aportándole a cada una un puntaje, contemplando 4 componentes: mag nitud, severidad, eficiencia y factibilidad16. Las preguntas se refinaron mediante la estrategia PICO12 y se seleccio naron en base a los desenlaces utilizando la metodología GRADE, que permite categorizar a los desenlaces según un puntaje numérico en escala del 1 al 9 (7 a 9: crítico; 4 a 6: importante; 1 a 3 de importancia limitada)12 (Tabla 1).
Revisión de evidencia
Se realizó un protocolo de búsqueda bibliográfica siguien do las recomendaciones de las guías NICE17, utilizando el repositorio de citas PubMed (https://pubmed.ncbi.nlm.nih.gov/), Cochrane (https://www.cochranelibrary.com/) y Epistemonikos (https://www.epistemonikos.org/es). La búsqueda se realizó durante julio-agosto del 2020, en inglés y español, con selección de los artículos desde el período 2000 hasta 2020. En un segundo paso, se realizó la inclusión de artículos por título/resumen por 2 evaluadores independientes, mediante la plataforma Ra yyan (https://rayyan.ai/). Como tercer paso, un evaluador revisó la evidencia utilizando las guías de reporte para cada diseño, utilizando la última versión publicada en Equator (https://www.equator-network.org/). Se incluyeron los artículos que cumplían con los criterios de redacción para cada guía de reporte (Tabla 2). Finalmente, los ar tículos incluidos se evaluaron con distintas herramientas de evaluación de confianza, según el diseño:
Los estudios con una sola rama de intervención se evaluaron con las herramientas de evaluación de calidad del Instituto Nacional de Salud (NIH)18. Los estudios de cohorte con dos ramas de intervención se evaluaron con la herramienta “Riesgo de sesgo en estudios no aleatorios de intervenciones” (ROBINS-I)19; los ensayos clínicos aleatorizados se evaluaron con la herramienta “Riesgo de sesgo” (RoB)20.

Tabla 2 Conceptos de búsqueda para cada pregunta. Proceso de selección de artículos utilizando distintas herramientas y número de artículos seleccionados en cada etapa
Tres evaluadores realizaron el resumen de la evidencia de cada artículo para que el panel de expertos cuente con el cuerpo de la evidencia resumido antes de la actividad “del marco de la evidencia a la decisión” propuesto por la metodología GRADE para la elaboración de una reco mendación/guía21.
Certeza de la evidencia
La calidad de la evidencia se graduó mediante la he rramienta GRADEpro (https://gradepro.org/). El sistema GRADE permite valorar la evidencia de manera estan darizada y transparente. Utiliza los siguientes dominios para valorar la calidad de la evidencia: riesgo de sesgo, evidencia indirecta, imprecisión, inconsistencia, sesgo de publicación. Estos 5 dominios pueden disminuir la calidad de evidencia de un artículo. Asimismo, para los estudios observacionales, el sistema GRADE incorpora tres do minios que pueden aumentar la calidad de la evidencia: gradiente dosis-respuesta, gran magnitud del efecto, efecto de los potenciales factores de confusión residual. Una vez valorada la evidencia mediante los dominios, ésta se clasificará como alta, moderada, baja o muy baja. Un nivel de evidencia alta significa que estamos muy seguros de que el efecto real se aproxima al de la estimación del efecto; moderada: tenemos una confianza moderada en la estimación del efecto, es probable que el efecto real esté cerca de la estimación del efecto, pero existe la posibili dad de que sea sustancialmente diferente; baja: nuestra confianza en la estimación del efecto es limitada, el efecto real puede ser sustancialmente diferente de la estimación del efecto; muy baja: tenemos muy poca confianza en la estimación del efecto, es probable que el efecto real sea sustancialmente diferente de la estimación del efecto12.
Elaboración de recomendaciones
Para la toma de decisión se contemplaron todos los domi nios del marco de evidencia propuesto por GRADE para preguntas terapéuticas (Tabla 3). Las recomendaciones se redactaron a partir del perfil de la evidencia (Tabla 4), conforme a un marco de traspaso de la evidencia a la decisión. Las consideraciones para cada práctica son opinión de expertos.
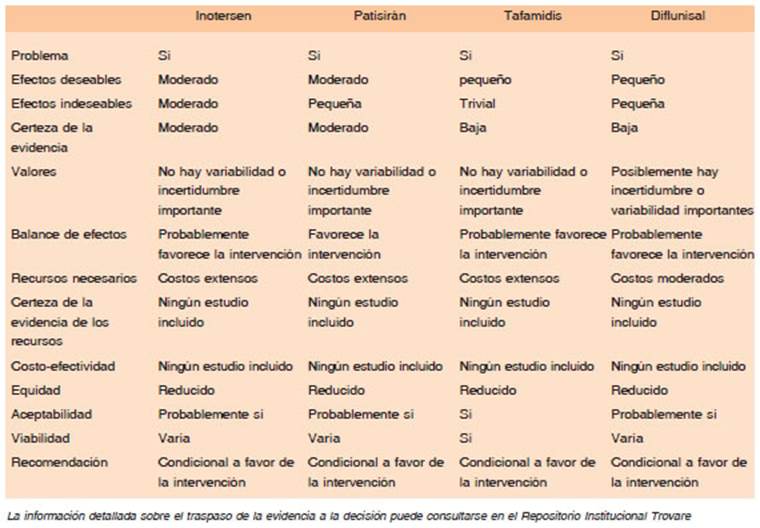
Tabla 3 Dominios contemplados en el traspaso de la evidencia a la decisión. Valoración de los dominios para cada una de las drogas evaluadas en las recomendaciones
Las recomendaciones se graduaron según su direc ción: a favor o en contra; y según fuerza: fuertes y débiles o condicionales21. Las recomendaciones finales fueron evaluadas con la herramienta “Evaluación de implemen tabilidad de la guía” (GLIA) para barreras y facilitadores de la implementación22,23. Posteriormente, fueron seleccio nadas las recomendaciones claves. Las recomendaciones claves servirán de seguimiento de la implementación a través de indicadores que están en proceso.
Cuestiones generales necesarias para el uso, la correcta interpretación e implementación de las recomendaciones
Esta guía cubre los aspectos priorizados en el tratamiento de adultos (18 años o más), referidos a la atención espe cializada, con diagnóstico de polineuropatía amiloidótica familiar. Esta guía es relevante para todos los profesio nales de la salud y para los involucrados en las políticas sanitarias, para asegurar que existan los acuerdos nece sarios para brindar la atención adecuada.
Esta guía no aborda el tratamiento sintomático ni de cada órgano involucrado, ni el trasplante hepático. Esta guía no reemplaza los conocimientos y habilidades del médico tratante.
Esta guía asume:
- Que la experiencia clínica del panel deriva de la in teracción con los pacientes y confía que el balance entre la magnitud de los efectos deseables y los indeseables es a favor/en contra de la intervención.
- Que el médico tratante tiene experiencia en el trata miento de la polineuropatía amiloidótica familiar.
- Que se evalúan los riesgos y beneficios de cada tratamiento disponible.
- Que los tratamientos se realizan según el mejor es tándar de cuidado y con el espíritu de que eventualmente se desarrollen localmente, para mejorar el tratamiento de las personas con polineuropatía amiloidótica familiar.
El escenario de la amiloidosis plantea un desafío en términos de enfermedad poco frecuente, drogas en es tudio, ausencia de aprobación por entes reguladores de drogas, sumado a la necesidad de generar información científica de calidad para guiar la práctica clínica y la toma de decisiones. El tratamiento debe ser indicado y perma necer bajo supervisión de un médico con experiencia en el manejo de pacientes con polineuropatía amiloidótica familiar y/o con posibilidades de consulta a médicos con experiencia en el seguimiento de esta enfermedad.
Los autores de la guía limitan su responsabilidad, siendo la guía una orientación al tratamiento sin sustituir el juicio médico actuante en cada caso. Las recomenda ciones están sujetas a actualización según la realidad local y la evidencia científica disponible.
Limitaciones
Hay pocos estudios aleatorizados controlados que inves tiguen el tratamiento más apropiado para la amiloidosis en diferentes contextos. El diseño de la estrategia de tratamiento se basa en opiniones de expertos, principal mente basadas en ensayos retrospectivos. Actualmente, el único tratamiento aprobado para la polineuropatía amiloidótica familiar es el tafamidis, el resto no están aprobadas y deben ser usadas off-label o en el contexto de un ensayo clínico.
Las recomendaciones están sujetas a actualización según la realidad local y la evidencia científica disponible.
Recomendaciones
Durante el proceso de elaboración de la guía de práctica clínica de tratamiento de amiloidosis, se generaron 4 re comendaciones para el tratamiento de la polineuropatía amiloidótica familiar. Las recomendaciones se presentan con su dirección y su fuerza: fuerte “Se recomienda”; débil o condicional “Se sugiere” y, con la calidad de evidencia que la sustenta: muy baja, baja, moderada o alta y con la justificación de la recomendación. Las consideraciones de implementación se detallan en el Anexo 1.
Para la formulación de cada recomendación se tuvo en cuenta la opinión del panel en cuanto a las creencias de los valores y las preferencias de las personas con amiloidosis.
Se tuvo en cuenta la opinión del panel en cuanto a las implicaciones de costos y recursos en la formulación de recomendaciones.
Se obtuvo el consenso de expertos mayor al 75% en cuanto a las implicancias de costos, recursos, creencias y preferencias de las personas con amiloidosis. Por falta de evidencia, el equipo de investigación se abstuvo de realizar recomendaciones para el desenlace mortalidad.
Recomendación 1
En pacientes con amiloidosis ATTRv y neuropatía estadio I y II, se sugiere el tratamiento con inotersen 300 mg sub cutáneo semanal dado que, probablemente, estabilice o enlentezca el avance de la neuropatía medida con la Pun tuación de deterioro de neuropatía modificada +7 (mNIS +7) y el empeoramiento de la calidad de vida medida con el cuestionario de calidad de vida de Norfolk-neuropatía diabética (QOL-DN).
Calidad de la evidencia: Moderada.
Fuerza de la recomendación: Condicional a favor.
Justificación
- La calidad de la evidencia disponible es moderada, limitada a un estudio de fase III, aleatorizado, doble ciego, controlado por placebo (NEURO-TTR)25 y a un análisis interino del estudio de extensión del ensayo clinico NEURO-TTR.
El estudio NEURO-TTR, incluyó 172 pacientes (112 en el grupo inotersen y 60 en el grupo placebo) con ATTRv, con polineuropatía estadio I o II (Puntuación de deterioro de neuropatía (NIS) <10). Evaluó el cambio a los 15 meses con respecto al basal de la progresión de la neuropatía con la escala mNIS +7 y la calidad de vida con la escala QOL-DN.
- Los efectos deseables e indeseables son moderados, siendo, por lo tanto, el balance entre efectos iguales.
Respecto a los efectos deseables, en el estudio NEU RO-TTR, la diferencia de medias de mínimos cuadrados desde el inicio hasta la semana 66 entre los dos grupos (inotersen menos placebo) fue de -19.7 puntos (IC 95% -26.4 a -13.0; p < 0.001) para la escala mNIS +7 y −11.7 puntos (IC95% −18.3 a −5.1; p < 0.001) para la escala QOL-DN. En el análisis interino del estudio de extensión del NEURO-TTR, se analizaron 93 pacientes (69% de los 135 incluidos). La mediana de exposición combinada de inotersén más prolongada durante NEURO-TTR más el estudio de extensión fue de 5.2 años. Los pacientes que continuaron el tratamiento con inotersen demostraron un beneficio sostenido en mNIS +7 y QOL-DN. Los pacientes que cambiaron de placebo a inotersen mostraron una mejoría o estabilización en mNIS +7 y QOL-DN.
Respecto a los efectos indeseables, en el estudio NEURO-TTR, se reportó un episodio de hemorragia intracraneal fatal, que se le atribuyó a la trombocitopenia generada por el inotersen.
- No se identificaron estudios que consideren los valores y preferencias de los pacientes. El panel de ex pertos consideró que no hay variabilidad o incertidumbre importante. Dada la escasa disponibilidad de otras drogas, se valora la intervención, pese al balance entre efectos deseables e indeseables y sus altos costos.
- Con respecto a los recursos necesarios, el inotersen es un medicamento con un costo elevado, que requiere controles de laboratorio periódicos y debe ser indicado y supervisado por un médico con conocimiento en el manejo de estos pacientes.
Si bien no hay evidencia de costo-efectividad a nivel local, el panel de expertos consensuó que “probablemente se favorece la intervención”. Si bien el costo es elevado, también es beneficioso respecto a los resultados clínicos. Se necesitan estudios a largo plazo, dada la naturaleza del tratamiento prolongado.
- La aplicabilidad del tratamiento con inotersen es variable. Probablemente sea factible de utilizar desde el punto de vista médico-paciente, pero, probablemente no lo sea desde el punto de vista del sistema de salud-financiador.
Recomendación 2
En pacientes con amiloidosis ATTRv y neuropatía estadio I y II, se sugiere el tratamiento con patisirán 0.3 mg/kg endovenoso una vez cada 3 semanas dado que, proba blemente, estabilice o enlentezca el avance la neuropatía medida con mNIS +7 y el empeoramiento de la calidad de vida medida con QOL-DN.
Calidad de la evidencia: Moderada.
Fuerza de la recomendación: Condicional a favor.
Justificación
- La calidad de la evidencia es moderada, limitada a un estudio de fase III, aleatorizado, doble ciego, controlado por placebo (APOLLO)26 y un estudio observacional de comparación indirecta entre patisirán y tafamidis27 que brinda robustez a los resultados del estudio APOLLO26.
El estudio APOLLO incluyó 225 sujetos con polineu ropatía IIIb o menor (NIS 5-130) (148 grupo patisiran y 77 grupo placebo). Evaluó el cambio a los 18 meses con respecto al basal de la progresión de la neuropatía con la escala mNIS +7 y la calidad de vida con la escala QOL-DN.
- Los efectos deseables son moderados, con efectos indeseables pequeños, siendo el balance entre efectos deseables e indeseables a favor de los primeros.
Respecto a los efectos deseables, en el estudio APO LLO, la diferencia de medias de mínimos cuadrados desde el inicio hasta el mes 18 entre los dos grupos (patisirán menos placebo) fue de -34±3 puntos (IC 95% -29.12 a -39.88) para la escala mNIS +7 y de -21.1±3.1 puntos (IC95% -15.02 a -27.17) para la escala QOL-DN.
Respecto a los efectos indeseables, en el estudio APO LLO, el edema periférico y las reacciones relacionadas a la infusión fueron las más frecuentes. No se notificaron reacciones graves relacionadas con la perfusión, y la frecuencia de las reacciones disminuyó con el tiempo. No se reportaron cambios en los recuentos de plaquetas o función renal.
- No se identificaron estudios que consideren los valores y preferencias de los pacientes. El panel de ex pertos consideró que no hay variabilidad o incertidumbre importante. Dada la escasa disponibilidad de otras drogas, se valora la intervención, pese a sus efectos deseables moderados y sus altos costos.
- Con respecto a los recursos necesarios, el patisirán presenta altos costos. Si bien no hay evidencia de costo-efectividad a nivel local, el panel de expertos consensuó que “probablemente se favorece la intervención”. Si bien el costo es elevado, también es beneficioso respecto a los resultados clínicos. Se necesitan estudios a largo plazo, dada la naturaleza del tratamiento prolongado.
- La aplicabilidad del tratamiento con patisirán es varia ble. Probablemente sea factible de utilizar desde el punto de vista médico-paciente, pero, probablemente no lo sea desde el punto de vista del sistema de salud-financiador.
Recomendación 3 (recomendación clave)
En pacientes con amiloidosis ATTRv y neuropatía estadio I, se sugiere el tratamiento con tafamidis 20 mg vía oral, una vez por día, ya que podría enlentecer el avance de la neuropatía, evaluado mediante la puntuación de dete rioro de neuropatía en los miembros inferiores (NIS LL) y el empeoramiento en la calidad de vida medido con QOL-DN y IMCm
Calidad de la evidencia: Baja.
Fuerza de la recomendación: Condicional a favor.
Justificación
- La calidad de la evidencia global es baja, basada principalmente en un ensayo clínico de fase III, aleatori zado, doble ciego, controlado por placebo multicéntrico, internacional (Fx-005). El estudio de extensión en el que se evaluaron los resultados a largo plazo del uso de tafa midis, reforzó los resultados del ensayo clínico.
El estudio Fx-005, incluyó 128 enfermos (65 grupo tafamidis 20 mg/día y 63 grupo placebo) con mutación Val 50Met y puntuación de NIS-LL ≤ 10. Evaluó la proporción de pacientes de cada grupo que tuvieron un incremento < 2 en la escala NIS-LL a los 18 meses respecto al basal y con el cambio respecto al basal del QOL-DN. Hubo una alta tasa de deserción, lo que se juzgó como riesgo de sesgo serio. Los intervalos de confianza mostraron imprecisión en el análisis por intención a tratar. La calidad global de la evidencia se clasificó como baja.
- Los efectos deseables son pequeños con efectos indeseables triviales, siendo el balance entre efectos deseables e indeseables a favor de los primeros.
Con respecto a los efectos deseables, en el estudio Fx-005, en el análisis por intención a tratar no se en contraron diferencias en la escala de NIS-LL y QOL-DN entre grupos. En el análisis por protocolo (n = 87, las bajas fueron en su mayoría por trasplante hepático) sig nificativamente más sujetos tratados con tafamidis que con placebo respondieron a NIS-LL (60% versus 38%; p 0.041), y tuvieron QOL-DN mejor conservado (0.1 versus 8.9; p 0.045) con un reducción en el deterioro neu rológico periférico28. En el estudio de extensión (Fx-006) del Fx-005, se incluyeron 71 individuos que se siguieron por 12 meses. Los que recibían tafamidis 20 mg/día en el estudio Fx-005 continuaron el mismo esquema, y los que recibían placebo, comenzaron con tafamidis 20mg/ día. El efecto de tafamidis en la desaceleración de la progresión neurológica y la preservación de la calidad de vida se mantuvo durante los 30 meses del período total de estudio (Fx-0005 + Fx-006). Tafamidis también redujo el deterioro neurológico en pacientes que habían recibido placebo anteriormente29.
Con respecto a los efectos indeseables, en el estudio Fx-005 la incidencia de eventos adversos graves fue similar en el grupo de tafamidis (9%) que en el grupo de placebo (8%). Los eventos adversos más frecuentes del tafamidis fueron las infecciones urinarias y vaginales.
- No se identificaron estudios que consideren los valores y preferencias de los pacientes. El panel de ex pertos consideró que no hay variabilidad o incertidumbre importante. Dada la escasa disponibilidad de otras drogas, se valora la intervención, pese a sus efectos deseables moderados y sus altos costos.
- Con respecto a los recursos necesarios, el tafamidis presenta altos costos. Si bien no hay evidencia de costo-efectividad a nivel local, el panel de expertos consensuó que “probablemente se favorece la intervención”. Si bien el costo es elevado, presenta resultados clínicos poten cialmente beneficiosos. Se necesitan estudios a largo plazo, dada la naturaleza del tratamiento prolongado.
- El tratamiento con tafamidis es aceptable, dada la vía de administración oral. El tafamidis, a diferencia del resto de las terapéuticas, está aprobado en Argentina para el uso en la polineuropatía por ATTRv.
Recomendación 4
En pacientes con amiloidosis ATTRv y neuropatía sinto mática y en ausencia de otros tratamientos con eficacia aprobada, se sugiere el tratamiento con diflunisal 250 mg dos veces al día, vía oral, ya que podría evitar la progresión de la neuropatía medida con la puntuación de deterioro de neuropatía más 7 (NIS +7).
Calidad de la evidencia: Baja.
Fuerza de la recomendación: Condicional a favor.
Justificación
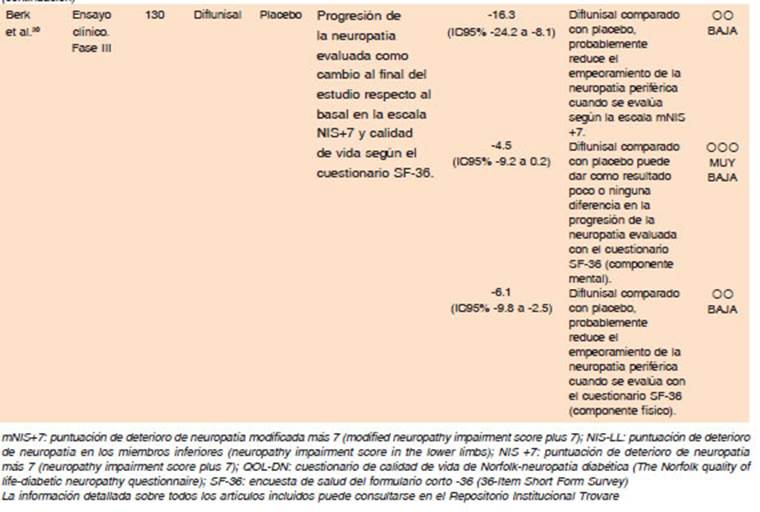
- La calidad de la evidencia global es baja, limitada a un ensayo clínico, internacional, multicéntrico, iniciado por investigadores, aleatorizado, doble ciego, controlado con placebo; un ensayo clínico, de una sola rama de interven ción, abierto y un estudio observacional. El ensayo incluyó 130 individuos (64 grupo diflunidal y 66 grupo placebo) con signos de neuropatía periférica o autonómica clínica mente detectables por un neurólogo capacitado. Evaluó el cambio con respecto al basal a los 2 años en la escala NIS +7 y la calidad de vida con el cuestionario SF-36. Hubo una alta tasa de deserción (mayor para el grupo placebo), lo que se juzgó como riesgo de sesgo serio30.
- Los efectos deseables e indeseables son moderados, siendo, por lo tanto, el balance entre efectos igual.
Con respectos a los efectos deseables, en el ensayo clínico aleatorizado, la puntuación de la escala NIS +7 aumentó 8.7 puntos (IC95% 3-14) en el grupo de diflu nisal y 25 puntos (IC95% 18-32) en el grupo placebo con una diferencia de -16.3 puntos (IC95%, -8.1 - -24.5). Con respecto a la calidad de vida a los 2 años, no se encontraron diferencias en el componente mental, siendo la diferencia de medias entre los grupos de tratamiento de -4.5 puntos (IC95%, -9.2-0.2, p 0.062), pero si en el componente físico, con una diferencia de medias de −6.1 (IC95% −9.8- −2.5, p 0.001).
Con respecto a los efectos indeseables, en el ensayo clínico, 4 sujetos descontinuaron el tratamiento (hemo rragia gastrointestinal, insuficiencia cardíaca congestiva, glaucoma, náuseas). Entre los eventos adversos más frecuentes se reportaron: intolerancia gástrica, altera ción de la función renal, trombocitopenia, sobrecarga de volumen31-33.
- No se identificaron estudios que consideren los valores y preferencias de los pacientes. El panel de ex pertos consideró que posiblemente hay incertidumbre o variabilidad importantes, justificada en el balance entre efectos deseables e indeseables.
- Con respecto a los recursos necesarios, el diflunisal tiene menor costo comparado con el resto de las terapias.
- El tratamiento con diflunisal es “probablemente” aceptable, justificada en el balance entre efectos desesa bles e indeseables.
- El tratamiento con diflunisal varía respecto a su viabi lidad. Si bien es menos costoso que otras terapias, la falta de disponibilidad en Argentina dificulta su implementación.
Conclusiones
Esta revisión provee una guía rigurosa y actualizada de la evidencia disponible para el tratamiento farmacológi co específico de la polineuropatía amiloidótica familiar. Existen pocos tratamientos con eficacia comprobada para el tratamiento de la ATTRv. Se encuentran en curso ensayos clínicos que pretenden evaluar nuevas opciones farmacológicas, generando una perspectiva alentadora sobre el tratamiento y el pronóstico de los pacientes que padecen polineuropatía amiloidótica familiar. No obstante, el acceso a la medicación continúa siendo un desafío en la región.