PUNTOS CLAVE
• La evidencia respecto al tratamiento de la amiloido sis por transtiretina proveniente de ensayos clínicos aleatorizados es escasa. Resulta necesario establecer recomendaciones terapéuticas consensuadas basadas en la evidencia, mediante un proceso de elaboración válido.
• Referentes disciplinares de la Argentina elaboraron la primer Guía de Práctica Clínica en América Latina con el objetivo de sistematizar la terapéutica, consi derando la evidencia disponible, la regulación local de medicamentos y los costos, entre otros. Se emitieron 11 recomendaciones basadas en el sistema Grade para pacientes con cardiomiopatía por amiloidosis variante y senil, considerando los siguientes fármacos: tafamidis, diflunisal, inotersen, patisirán y doxiciclina más ácido ursodesoxicólico.
La amiloidosis es una enfermedad crónica poco fre cuente, subdiagnosticada, definida por el depósito de proteínas mal plegadas que forman fibrillas de amiloide y se acumulan en el espacio extracelular de diversos tejidos1. De acuerdo con los registros locales e inter nacionales, más del 90% de la afectación cardiaca por amiloidosis se explica por depósitos de cadenas livianas (amiloidosis AL) y depósitos de la proteína transtiretina (amiloidosis ATTR), ya sea del tipo mutada (ATTRv) o de tipo salvaje (ATTRwt)2.
La ATTRwt ha cobrado una mayor relevancia en el último tiempo gracias a la incorporación de métodos diagnósticos no invasivos como la cámara gamma con difosfonatos y/o pirofosfato. La adecuada performance diagnóstica del método y su amplia disponibilidad ha posibilitado la incorporación de la técnica incluso en estrategias de screening frente a subgrupos de interés, como por ejemplo pacientes con insuficiencia cardiaca, fracción de eyección preservada, el estudio de la hiper trofia ventricular, así como también ante la evidencia de estenosis aórtica grave con bajo flujo-bajo gradiente, entre otras3-6. La prevalencia e incidencia informada varía según las series, en estudios de autopsia en pacientes adultos mayores de 80 años se encontraron depósitos de sustan cia amiloide por TTR en el 25% de los corazones y este porcentaje asciende al 32% si los pacientes presentaban insuficiencia cardiaca con fracción de eyección preserva da y edad mayor a 75 años7-10. En los pacientes internados por insuficiencia cardiaca y fracción de eyección preserva da, se ha demostrado la presencia de depósitos cardiacos de TTR en el 13% de los estudios, (IC 95%, 7.2%-19.5%).
A su vez, se diagnosticó amiloidosis ATTRwt en el 16% de los sujetos que se sometieron a un reemplazo valvular aórtico percutáneo (TAVR) por estenosis aórtica grave, y en el 5% de aquellos con sospecha de miocardiopatía hipertrófica7,8,11. La incidencia de amiloidosis en Argentina ajustada a la población de la Ciudad de Buenos Aires es de 6.46 personas/millón de habitantes para la amiloidosis ATTRwt, mientras que la prevalencia es aún desconoci da3. Con respecto a la ATTRv, resulta difícil establecer con exactitud la prevalencia a escala global, aunque se estima en aproximadamente un caso por cada 100 000 habitantes4. Las variantes más frecuentemente relacionadas con el compromiso cardíaco son Val122Ile, Leu111Met, Ile68Leu. En el registro THAOS, el cual recopila informa ción de los pacientes con amiloidosis mutada y senil, la información obtenida sugiere que si bien el pronóstico es heterogéneo, la supervivencia se encuentra fuertemente relacionada con la función cardiaca5,6.
El tratamiento farmacológico de la cardiopatía por ATTR está orientado al tratamiento de soporte de la insu ficiencia cardiaca y al específico para ATTR, este último es el abordado por esta guía. El tratamiento farmacológico específico (disponible o en desarrollo) está orientado a:
- bloquear la síntesis de proteínas: patisiran e inotersen
- estabilizar el tetrámero TTR: diflunisal, tafamidis, molécula AG10
- remover las fibrillas: doxiciclina, ácido ursodesoxicó lico, molécula PRXC004
Actualmente, contamos con pocos estudios aleato rizados controlados que investiguen el tratamiento más apropiado para la amiloidosis ATTR y ninguna Guía de Práctica Clínica que aborde cuál es la estrategia terapéu tica más adecuada considerando el contexto actual en América Latina. Es por ello que el objetivo de esta guía fue elaborar recomendaciones basadas en la evidencia, mediante un proceso de elaboración validado, que per mitan realizar un adecuado manejo de pacientes con cardiopatía por ATTR en el ámbito de centros de atención especializada o tercer nivel de atención de Latinoamérica. Los beneficios esperados son: sistematizar el tratamiento de la enfermedad en la atención especializada en el marco del “Grupo de Estudio de Amiloidosis”, unificar el manejo de los pacientes con cardiopatía por ATTR entre los dife rentes profesionales de la salud y mejorar los resultados en la atención. La población de estudio son los individuos con diagnóstico de cardiopatía por ATTR y los usuarios principales previstos son profesionales de salud genera listas y especialistas: clínicos, cardiólogos, hematólogos y bioquímicos. Se deja constancia que la presente guía no tiene por objetivo realizar recomendaciones respecto a aquellos pacientes con polineuropatía por ATTR que coexistan con afectación cardiaca y que ya se encuentren bajo tratamiento específico de esta enfermedad.
El equipo elaborador de esta guía fue conformado por un grupo interdisciplinario de profesionales del Hospital Italiano de Buenos Aires con experiencia disciplinar y me todológica. El Panel de Expertos se conformó con espe cialistas en cardiología, representantes de los principales centros de la Argentina referentes en el tratamiento de los pacientes con cardiomiopatía amiloidótica por ATTR.
Métodos
Esta guía de práctica clínica sobre el tratamiento de la amiloidosis, se basa en la mejor evidencia disponible de efectividad clínica y representa una ayuda a los profe sionales de la salud para tomar decisiones informadas sobre la atención médica adecuada. Se utilizaron como herramientas metodológicas para el desarrollo de esta guía, el Manual Metodológico GRADE 2017 y el manual actualizado “Elaboración de Guías de Práctica Clínica en el Sistema Nacional de Salud”12,13-35. Está organizada en un apartado metodológico que narra cómo se realizaron las preguntas y un apartado con las recomendaciones pertinentes. El detalle de los métodos y los anexos está disponible en http://trovare.hospitalitaliano.org.ar/greens tone/cgi-bin/library.cgi?c=revistas&a=d&d=D1179.
La redacción de la guía para su publicación sigue los lineamientos de la guía de reporte RIGHT de Equator14.
Elaboración de preguntas
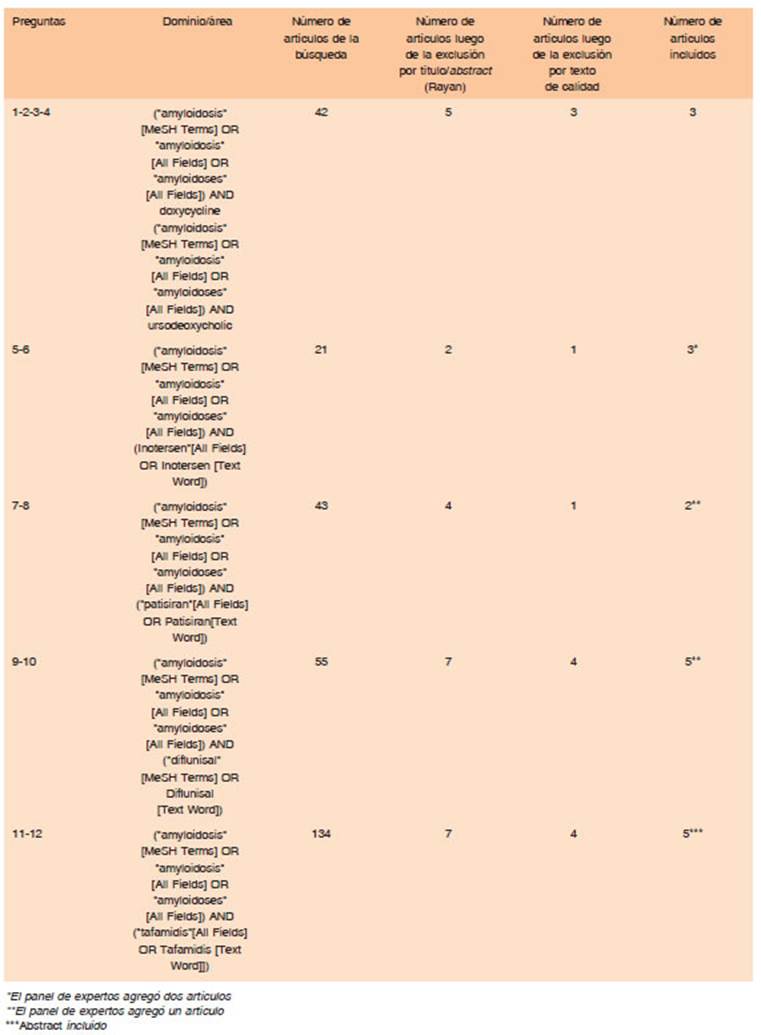
Las preguntas estuvieron centradas en la efectividad y seguridad del tratamiento para la cardiopatía por ATTR. El equipo elaborador generó un listado de 56 preguntas que fueron priorizadas con el método Hanlon, apor tándole a cada una un puntaje según 4 componentes: magnitud, gravedad, eficiencia y factibilidad15 (Tabla 1). Las preguntas se confeccionaron en formato PICO12 y se categorizaron en base a los desenlaces. Se utilizó la metodología GRADE para categorizar dichos desenlaces según un puntaje numérico en escala del 1 al 9 (7 a 9: crítico; 4 a 6: importante; 1 a 3 de importancia limitada)12.
Revisión de evidencia
- Se realizó un protocolo de búsqueda bibliográfica siguiendo las recomendaciones de las guías NICE16, utilizando el repositorio de citas PubMed (https://pubmed.ncbi.nlm.nih.gov/), Cochrane (https://www.cochraneli brary.com/) y Epistemokus (https://www.epistemonikos.org/). La búsqueda se realizó durante julio-agosto del 2020, con selección de los artículos desde el período 2000 hasta 2020, en inglés y español (Tabla 2). Se realizó la inclusión de artículos por título/resumen por dos evalua dores independientes, mediante la plataforma Rayyan (https://rayyan-prod.qcri.org/welcome.)17.
- Para la revisión de la evidencia se utilizaron las guías de reporte acorde al diseño encontrado utilizando la última versión publicada en Equator (www.equator.org) y las herramientas de evaluación de nivel de confianza para estudios individuales recomendadas por Cochrane18,19. Los estudios con una sola rama de intervención (serie de casos/cohortes) se evaluaron con las herramientas de evaluación de calidad del NIH20, los de cohorte con dos ramas se evaluaron con la herramienta ROBINS-I19 y los ensayos clínicos aleatorizados se evaluaron con la herramienta RoB18. Por último, las revisiones sistemáticas se evaluaron con la herramienta AMSTAR-221.
- Tres evaluadores realizaron el resumen de la evi dencia de cada artículo para que el panel de expertos cuente con el cuerpo de la evidencia resumido antes de la actividad “del marco de la evidencia a la decisión” propuesto por la metodología GRADE para la elaboración de una recomendación/guía22. La evidencia se clasificó en alta, moderada, baja, muy baja12 (Anexo 1. Resumen de evidencia).
Certeza de la evidencia
La calidad de la evidencia se graduó mediante la herra mienta GRADEpro23. El sistema GRADE permite valorar la evidencia de manera estandarizada y transparente, utilizando los siguientes dominios para valorar la calidad de la evidencia: riesgo de sesgo, evidencia indirecta, imprecisión, inconsistencia y sesgo de publicación. Estos 5 dominios pueden disminuir la calidad de evidencia de un artículo. Asimismo, para los estudios observacionales, el sistema GRADE incorpora tres dominios que pueden aumentar la calidad de la evidencia: gradiente dosis-respuesta, gran magnitud del efecto y efecto de los poten ciales factores de confusión residual. Una vez valorada la evidencia mediante los dominios, ésta se clasifica como alta, moderada, baja o muy baja12.
Elaboración de recomendaciones
Para la toma de decisión se contemplaron todos los dominios del marco de evidencia propuesto por GRADE para preguntas terapéuticas. Las recomendaciones se redactaron a partir del perfil de la evidencia y las tablas SoF conforme a un marco de traspaso de la Evidencia a la Decisión (Anexo 1. Resumen de evidencia - Ver al final del artículo). De la evidencia a la decisión, disponibles en http://trovare.hospitalitaliano.org.ar/greenstone/cgiin/library.cgi?c=revistas&a=d&d=D1179).
Las consideraciones para cada práctica son opinión de expertos.
Las recomendaciones se graduaron según su direc ción (a favor o en contra) y según su fuerza (fuertes y débiles o condicionales)22. Las recomendaciones finales fueron evaluadas con la herramienta GLIA para barreras y facilitadores de la implementación24,25. Posteriormente, fueron seleccionadas las recomendaciones claves por consenso formal y se señalaron junto a la numeración subrayada.
Cuestiones generales necesarias para el uso, la correcta interpretación e implementación de las recomendaciones
Esta guía cubre los aspectos priorizados en el tratamiento de adultos (18 años o más) referidos a la atención espe cializada, con diagnóstico de cardiopatía por ATTR.
Esta guía es relevante para todos los profesionales de la salud y para los involucrados en las políticas sanitarias ya que aborda los acuerdos necesarios para brindar una atención adecuada.
Para la correcta implementación de las recomenda ciones se asume lo siguiente:
- La experiencia clínica del panel deriva de la interac ción con los pacientes y confía que el balance entre la magnitud de los efectos deseables y los indeseables es a favor/en contra/o condicional de la intervención.
- Que el médico tratante tiene experiencia en el trata miento de la cardiopatía por ATTR.
- Que se evalúan los riesgos y beneficios de cada tratamiento disponible.
- Que se evalúa el estado basal del paciente como aproximación para establecer la expectativa de vida pre vio a la indicación de drogas de alto costo y con efectos deseables valorables en mediano-largo plazo.
- Que los tratamientos se realizan según el mejor estándar de cuidado, para mejorar el tratamiento de las personas con cardiopatía por ATTR.
- Que el tratamiento debe ser indicado y supervisado por un médico con experiencia disciplinar en la cardiopatía por ATTR.
- Esta guía no reemplaza los conocimientos y habili dades del médico tratante.
En nuestro país, la amiloidosis ATTR de tipo salvaje y ATTRv se encuentran enmarcadas dentro de la ley 26.689 de enfermedades poco frecuentes26-28. Dicha ley cuenta con la adhesión de 16 de las 23 provincias y de la Ciudad Autónoma de Buenos Aires. Sin embargo, el manejo respecto al diagnóstico y tratamiento continúan siendo un desafío clínico, justificado por la ausencia de aprobación de medicamentos por los entes reguladores, los altos costos de las drogas con precios no regulables y por la baja calidad en la evidencia científica disponible en este ámbito.
Los autores de la guía limitan su responsabilidad, siendo la guía una orientación al tratamiento sin sustituir el juicio médico actuante en cada caso.
Recomendaciones
Durante el proceso de elaboración de esta guía, se ge neraron 11 recomendaciones para el tratamiento de la cardiopatía por ATTR. Las recomendaciones se presentan con su dirección y su fuerza: fuerte (se recomienda); débil o condicional (se sugiere) y con la calidad de evidencia que la sustenta: muy baja, baja, moderada o alta. De las mismas se desprende el algoritmo terapéutico de la Figura 1 (Algoritmo de tratamiento para la miocardiopa tía amiloidótica por transtiretina). La justificación de la recomendación se desarrolla a continuación de cada recomendación.
Para la formulación de cada recomendación se tuvo en cuenta la opinión del panel en cuanto a las creencias de los valores y las preferencias de las personas con amiloidosis cardiaca por ATTR, la certeza en la eviden cia disponible, el costo de cada una de las tecnologías y los requerimientos organizacionales necesarios para su administración, así como también la viabilidad de la indicación considerando la disponibilidad del fármaco en el ámbito local. (Tabla 3).
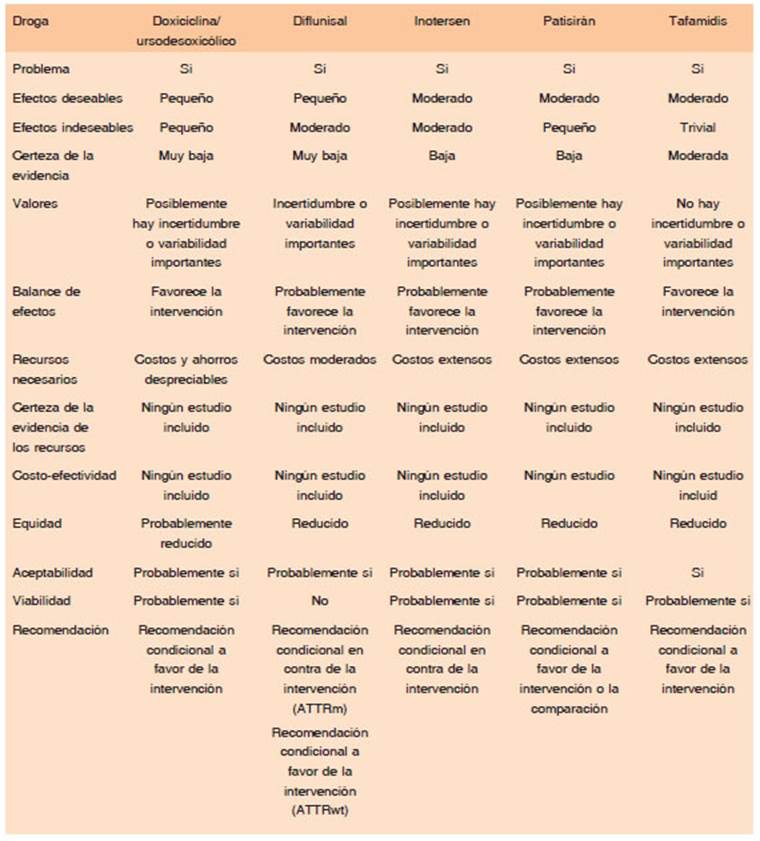
Tabla 3 Resumen de juicios con los resultados finales de la votación con el panel de expertos y la revisión por pares especialistas en cardiología
A continuación, se describe la recomendación para cada fármaco abordado con su respectiva justificación.
Recomendación 1
Calidad de la evidencia: MUY BAJA
Fuerza: DÉBIL A FAVOR
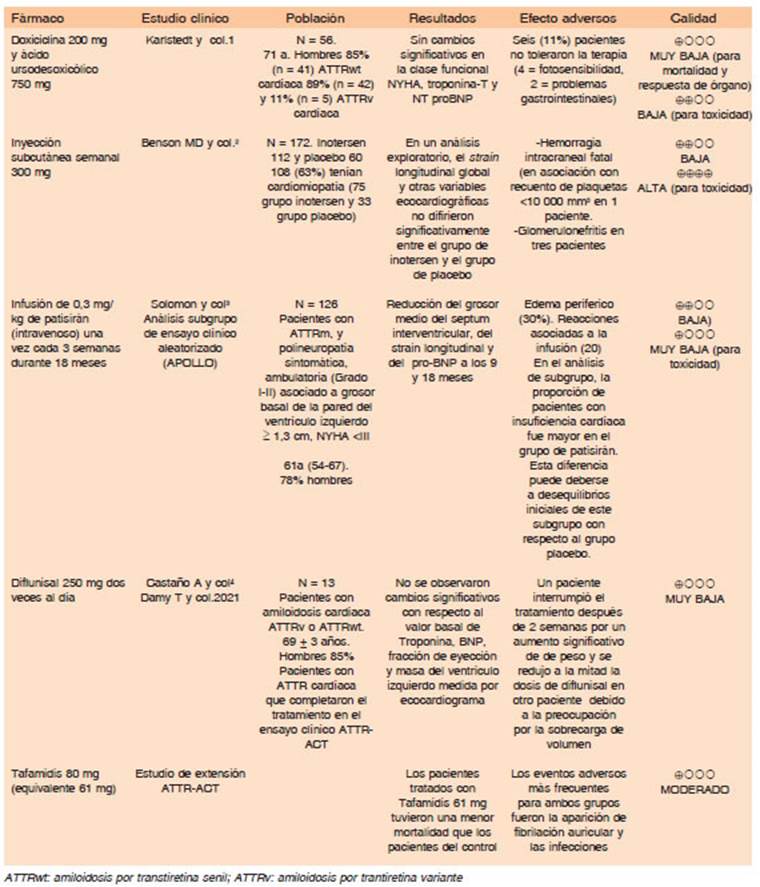
En pacientes con cardiopatía por ATTRwt y en ausencia de disponibilidad de otra droga de eficacia aprobada, se sugiere el tratamiento con doxiciclina 100 mg/12 h y ácido ursodeoxicólico 250 mg/8 h vía oral ya que podría reducir la progresión de la cardiopatía, pero la evidencia es muy incierta.
Recomendación 2
Calidad de la evidencia: MUY BAJA
Fuerza: DÉBIL A FAVOR
En pacientes con cardiopatía por ATTRwt y en ausencia de disponibilidad de otra droga de eficacia aprobada, se sugiere el tratamiento con doxiciclina 100 mg/12 h y ácido ursodeoxicólico 250 mg/8 h vía oral ya que podría reducir la progresión de la cardiopatía, pero la evidencia es muy incierta.
Justificación:
- La calidad de la evidencia disponible es muy baja y se limita a estudios de fase II de una sola rama de intervención y a estudios observacionales con escaso número de pacientes y considerables pérdidas en el seguimiento.
- Los efectos deseables son pequeños, con efectos indeseables también pequeños (considerando principal mente los adjudicables a la doxiciclina), lo que resulta en un balance entre efectos deseables e indeseables cercanos. En un estudio de fase II, de una sola rama de intervención se incluyeron 17 pacientes con cardiopatía por ATTR clase funcional ≤a 3 (NYHA). Solo 7 de 17 pacientes completaron el período de seguimiento de 12 meses. De éstos, 4 mantuvieron estables los niveles de NT-proBNP y no hubo progresión clínica en ninguno. Los parámetros ecocardiográficos se mantuvieron estables en 5 pacientes y mejoraron en 2. En un estudio retrospectivo, que incluyó 56 pacientes con amiloidosis cardíaca por un seguimiento de 22 meses, no se observaron cambios significativos en la clase funcional -evaluada a través de score NYHA-, en variables bioquímicas como la troponina-T y el NT-proBNP), así como tampoco en las va riables ecocardiográficas (deformación longitudinal global) respecto a los valores basales. En este mismo estudio, 6 pacientes abandonaron el tratamiento por los eventos adversos (fotosensibilidad e intolerancia gastrointestinal).
- No se identificaron estudios que consideren los va lores y preferencias de los pacientes con respecto a esta estrategia. El panel de expertos consideró que podría ha ber heterogeneidad en la aceptación del tratamiento dado su mecanismo de acción y su lenta velocidad de efecto, generando variabilidad en los pacientes con respecto a la mejoría que aporta el tratamiento.
- El costo del esquema doxiciclina/ácido ursodesoxi cólico en comparación con otras terapéuticas utilizadas para la cardiopatía por ATTR, es considerablemente menor.
- El esquema terapéutico está disponible en Argentina y es de fácil acceso.
Recomendación 3:
Calidad de la evidencia: BAJA
Fuerza: DÉBIL EN CONTRA
En pacientes con ATTRv con cardiopatía clase funcional ≤ 3 (NYHA) y en presencia de otras drogas con eficacia aprobadas, no se sugiere el tratamiento con inotersén 300 mg subcutáneo semanal, pero la evidencia es incierta.
Recomendación 4:
Calidad de la evidencia BAJA
Fuerza: DÉBIL EN CONTRA
En pacientes con ATTRwt con cardiopatía clase funcional ≤ 3 (NYHA) y en presencia de otras drogas con eficacia aprobadas, no se sugiere el tratamiento con inotersén 300 mg subcutáneo semanal, pero la evidencia es incierta.
Justificación:
- La calidad de la evidencia disponible es baja, limi tada a un estudio de fase III, abierto, de una sola rama de intervención, que incluyó 22 pacientes con ATTRv o ATTRwt y cardiopatía moderada a grave, de los cuales 15 cumplieron 12 meses de tratamiento (tiempo de se guimiento corto considerando que es una enfermedad crónica). Un estudio prospectivo, abierto, de una sola rama de intervención, incluyó 33 pacientes, con ATTRv y ATTRwt, con cardiopatía clase funcional I-III (NYHA), con un tiempo de seguimiento mayor, pero con pocos pacientes y pérdidas en el seguimiento (aportado por el panel de expertos).
- Los efectos deseables e indeseables resultan mode rados. Se informó un episodio de hemorragia intracraneal fatal, que se le atribuyó a la trombocitopenia generada por el inotersén.
- No se identificaron estudios que consideren los valo res y preferencias de los pacientes. El panel de expertos consideró que podría existir variabilidad en la aceptación del tratamiento, dado los eventos adversos moderados previamente descritos.
- Con respecto a los recursos necesarios, el inotersén es un medicamento con un costo elevado, que requiere controles de laboratorio periódicos y debe ser indicado y supervisado por un médico con conocimiento en manejo de pacientes con amiloidosis.
- En cuanto a la aplicabilidad de la indicación, el inoter sen no está aprobado por ANMAT (Argentina) para su libre comercialización y su uso actual se encuentra restringido a los pacientes incorporados a un ensayo clínico.
Recomendación 5:
Calidad de la evidencia BAJA
DÉBIL NI EN CONTRA NI A FAVOR
En pacientes con ATTRv con cardiopatía clase funcional ≤ 2 (NYHA), el tratamiento con patisirán 0.3 mg/kg endovenoso una vez cada 3 semanas podría estabilizar el avance de la enfermedad o generar una mejoría de respuesta de órgano, en ausencia de otros esquemas disponibles con eficacia aprobada pero la evidencia es incierta.
Justificación:
- La calidad de la evidencia es baja, limitada a un estudio de subgrupo preespecificado que incluyó 126 pacientes con cardiopatía por ATTRv en clase funcional I-II (NYHA), con evaluación de desenlaces exploratorios y con un seguimiento de 18 meses (tiempo de seguimiento corto considerando que es una enfermedad crónica).
- Los efectos deseables son moderados, con efectos indeseables pequeños, siendo el balance entre efectos deseables e indeseables a favor de los primeros. El pati sirán disminuyó la media de grosor parietal del ventrículo izquierdo y mejoró la deformación longitudinal global, disminuyó la media de concentración de NT-proBNP y la proporción de resultados cardíacos adversos en com paración con placebo a los 18 meses de seguimiento, lo que sugiere que el patisirán podría detener la progresión de las manifestaciones cardíacas de la ATTRv. Entre sus principales eventos adversos se informaron los relacio nados a la infusión (eritema, dolor abdominal, náuseas y edema periférico).
- No se identificaron estudios que consideren los valores y preferencias de los pacientes. El panel de expertos consideró que posiblemente haya variabilidad en la aceptación del tratamiento, al ser un medicamento costoso con una vía de administración invasiva.
- Con respecto a los recursos necesarios, el patisirán es un medicamento con un costo elevado, que requiere ser aplicado en un ámbito hospitalario por personal espe cializado, con un equipo de infusión específico.
- En cuanto a la aplicabilidad de la indicación, el patisi rán no está aprobado por ANMAT (Argentina) para su libre comercialización, y su uso actual se encuentra restringido a los pacientes incorporados a un ensayo clínico.
Recomendación 6:
Calidad de la evidencia: MUY BAJA
Fuerza: DÉBIL EN CONTRA
En pacientes con ATTRv con cardiopatía clase funcional ≤ 3 (NYHA) y en presencia de otras drogas con eficacia aprobadas, no se sugiere el tratamiento con diflunisal 250 mg dos veces al día, vía oral, para evitar la progresión de la cardiopatía, pero la evidencia es muy incierta.
Recomendación 7:
Calidad de la evidencia: MUY BAJA
Fuerza: DÉBIL A FAVOR
En pacientes con ATTRwt con cardiopatía clase funcional ≤ 3 (NYHA) y en presencia de otros tratamientos con eficacia aprobada, no se sugiere el tratamiento con diflunisal 250 mg dos veces al día, vía oral, para evitar la progresión de la cardiopatía, pero la evidencia es muy incierta.
Justificación:
- La calidad de la evidencia disponible es muy baja, limitada a ensayos clínicos de una sola rama de interven ción y estudios observacionales, con escaso número de pacientes y pérdidas en el seguimiento.
- Los efectos deseables son pequeños, con efectos indeseables moderados, siendo el balance entre efectos deseables e indeseables a favor de los segundos. En un ensayo clínico de una sola rama de intervención, abierto, en el que se incluyeron 13 pacientes con ATTRv y AT TRwt, el 69% tenía clase funcional I o II (NYHA) y 31% clase III o IV. La media de seguimiento fue de 0.9±0.3 años. La media de la masa ventricular izquierda y la frac ción de eyección se mantuvieron estables mientras que los biomarcadores (Troponina I y BNP) mostraron una tendencia al aumento. En otro ensayo clínico de una sola rama de intervención, abierto, que incluyó 40 pacientes con ATTRv, con una media de seguimiento de 38 meses, el 55% tenía clase funcional I-II (NYHA). A los 24 meses, fueron evaluables 21 pacientes. Los parámetros ecocar diográficos (grosor del tabique interventricular y fracción de eyección) se mantuvieron estables a los dos años de iniciado el tratamiento. Sus potenciales efectos secunda rios a nivel gastrointestinal, alteración de la función renal, retención hídrica, sangrados e hipertensión hacen que su perfil sea poco adecuado para pacientes con cardiopatía.
- No se identificaron estudios que consideren los valo res y preferencias de los pacientes. El panel de expertos consideró que hay variabilidad en la aceptación por parte de los pacientes, justificada por el balance entre efectos deseables e indeseables a favor de los segundos.
- Con respecto a los recursos necesarios, el diflunisal se administra por vía oral y tiene menor costo comparado con el resto de las terapéuticas potencialmente utilizables en la cardiopatía por ATTR. Sin embargo, al momento de realizada la guía, no se encuentra disponible en Argentina.
Recomendación 8:
Calidad de la evidencia: MODERADA
Fuerza: DÉBIL A FAVOR
En pacientes con ATTRv con cardiopatía clase funcional ≤ 3 (NYHA), se sugiere el tratamiento con tafamidis 80 mg (tafamidismeglumina 80 mg/tafamidis ácido libre 61 mg) vía oral, una vez por día, dado que es probable que reduzca la mortalidad global, mortalidad cardiovascular e internaciones cardiovasculares y la progresión de la cardiopatía.
Recomendación 9:
Calidad de la evidencia: MODERADA
Fuerza: DÉBIL A FAVOR
En pacientes con ATTRwt con cardiopatía clase funcional ≤ 3 (NYHA), se sugiere el tratamiento con tafamidis 80 mg (tafamidismeglumina 80 mg/tafamidis ácido libre 61 mg) vía oral, una vez por día, dado que es probable que reduzca la mortalidad global, mortalidad cardiovascular e internaciones cardiovasculares y la progresión de la cardiopatía.
Justificación:
- La calidad de la evidencia global es moderada, basada principalmente en un ensayo clínico de fase III, aleatorizado, doble ciego, controlado por placebo (ATTR-ACT). El estudio de extensión en el que se evaluaron los resultados a largo plazo del uso de tafamidis, reforzó la evidencia del ensayo clínico.
- Los efectos deseables son moderados y los efectos indeseables triviales, siendo el balance entre efectos deseables e indeseables muy a favor de los primeros. En el ensayo clínico ATTR-CT, se incluyeron 441 pacientes con ATTRv o ATTRwt con cardiopatía clase funcional I-III (NYHA). El seguimiento fue de 30 meses. Tafami dis se asoció con una menor mortalidad por todas las causas, menor tasa de hospitalizaciones relacionadas con causas cardiovasculares (calidad de evidencia mo derada). NT-proBNP tuvo un aumento menor entre los que recibieron tafamidis versus placebo en el mes 30. No hubo cambios significativos al mes 30 con respecto al basal en el grosor del tabique interventricular, la fracción de eyección y ladeformación longitudinal global (calidad de evidencia baja).
- No se identificaron estudios que consideren los valo res y preferencias de los pacientes. El panel de expertos consideró que no hay variabilidad en la aceptación del tratamiento, debido al balance entre efectos deseables e indeseables y su vía de administración oral.
- Con respecto a los recursos necesarios, el tafamidis se administra por vía oral y no requiere de monitorización. El costo es elevado, con la calidad de evidencia global moderada, lo que podría dificultar el financiamiento por parte de los prestadores.
Recomendación 10:
Calidad de la evidencia: BAJA
Fuerza DÉBIL A FAVOR
En pacientes con ATTRv con cardiopatía clase funcional ≤ 3 (NYHA), se sugiere el tratamiento con tafamidis 20 mg, vía oral, una vez por día, ya que podría reducir la mortalidad global, mortalidad cardiovascular e internaciones cardiovasculares y la progresión de la cardiopatía, pero la evidencia es incierta.
Recomendación 11:
Calidad de la evidencia: BAJA
Fuerza DÉBIL A FAVOR
En pacientes con ATTRwt con cardiopatía clase funcional ≤ 3 (NYHA), se sugiere el tratamiento con tafamidis 20 mg, vía oral, una vez por día, ya que podría reducir la mortalidad global, mortalidad cardiovascular e internaciones cardiovasculares y la progresión de la cardiopatía, pero la evidencia es incierta
Justificación:
- La calidad de la evidencia global es baja, basada principalmente en un ensayo clínico de fase III, aleatori zado, doble ciego, controlado por placebo (ATTR-ACT) y el estudio de extensión a largo plazo29 (aportado por el panel de expertos).
- El balance entre efectos deseables e indeseables es a favor de los primeros. En el ensayo clínico ATTR-CT, se incluyeron 441 pacientes con ATTRv o ATTRwt con cardiopatía clase funcional I-III (NYHA). El seguimiento fue de 30 meses. Si bien el tafamidis (pool de 80 mg y 20 mg) se asoció con una menor mortalidad por todas las causas (HR: 0.70; IC 95%, 0.51-0.96) y menor tasa de hospitalizaciones relacionadas con causas cardio vasculares (RR: 0.68; 0.56-0.81), en el análisis según dosis de tafamidis (80 mg vs. 20 mg), la dosificación de 20 mg mostró un hazard ratio para supervivencia global de 0.715 (IC 95% 0.450-1.137), con un intervalo de confianza de 95% que cruza la línea del no efecto. A su vez, en el análisis de extensión que comparó la dosis de 80 mg (o su bioequivalente de 61 mg) vs. la de 20 mg, con una mediana de seguimiento de 51 meses, la rama con tafamidis de 80 mg (61mg) demostró reducción de la mortalidad por todas las causas con un HR crudo de 0.700 (0.501-0.979) y ajustado de 0.571 (0.395-0.827).
- No se identificaron estudios que consideren los valo res y preferencias de los pacientes. El panel de expertos consideró que no hay variabilidad en la aceptación del tratamiento, debido al balance entre efectos deseables e indeseables y su vía de administración oral.
- Con respecto a los recursos necesarios (costos), se administra por vía oral y no requiere de monitorización. El costo es elevado, con la calidad de evidencia global baja, lo que podría dificultar el financiamiento por parte de los prestadores.
Terapias farmacológicas en desarrollo
En la actualidad, distintas líneas de investigación se en cuentran en curso. Basados en comunicaciones anterio res, nuevos agentes farmacológicos como el acoramidis (conocido como AG10), podrían resultar alternativas terapéuticas eficaces para el tratamiento de los pacientes con amiloidosis por TTR30. A su vez, drogas silenciadoras como el vutrisiran y moléculas como elION-682884 están siendo evaluadas en estudios en fase III, lo que repre sentaría estrategias terapéuticas emergentes eventual mente eficaces para el tratamiento de la cardiomiopatía amiloidótica por transtiretina31,32. Conforme se encuentre disponible nueva evidencia, el contenido de esta guía y las recomendaciones emitidas por el panel de expertos podría necesitar adecuarse a la nueva evidencia en un futuro.
Buenas prácticas
A continuación, se enumeran 4 conductas de buenas prácticas clínicas desarrolladas en el proceso de elabo ración de la guía.
- Buena práctica 1: La terapéutica del paciente con cardiopatía por ATTR debe estar orientada al tratamiento de soporte, principalmente al manejo de las arritmias e insuficiencia cardiaca y al tratamiento específico de la ATTR.
- Buena práctica 2: En el tratamiento de soporte no usar IECA, ARA-II, betabloqueantes, bloqueantes de los canales de calcio.
- Buena práctica 3: En el tratamiento de soporte usar anticoagulación precoz, diuréticos, monitorear las altera ciones de la conducción y considerar el trasplante de co razón en pacientes con insuficiencia cardiaca avanzada.
- Buena práctica 4: Evaluar la efectividad del trata miento: objetivo estabilidad/mejoría clínica, bioquímica o ecocardiográfica de la enfermedad.
Revisión
La revisión externa fue contemplada en el proceso de elaboración de la guía con especialistas en cardiología de distintas instituciones.
El proceso de escritura del desarrollo completo de la guía sigue las guías AGREE33 y para la publicación en esta revista se adecuó el manuscrito para la guía RIGHT14.
Limitaciones
Hay muy pocos estudios aleatorizados controlados que investiguen el tratamiento más apropiado para la ami loidosis en diferentes contextos clínicos y bajo distintos aspectos regulatorios y económicos. El diseño de la es trategia de tratamiento se basa en opiniones de expertos, principalmente sustentado por ensayos retrospectivos. Actualmente, el único tratamiento para la cardiopatía por ATTR aprobado por ANMAT es el tafamidis, el resto no están aprobadas y son utilizadas fuera de la indicación para la cual fueron aprobadas (off label) o en el contexto de un ensayo clínico (Tabla 4). Es por eso que se resalta la escasa evidencia científica aún disponible y, por ende, la necesidad de adaptar las futuras recomendaciones sobre el tratamiento a actualizaciones según la realidad local y la evidencia científica disponible.
Conclusiones
Esta revisión intenta proveer una guía rigurosa y actualizada de la evidencia disponible para el tratamiento farmacológi co específico de la ATTR. En la actualidad existen pocos tratamientos con eficacia comprobada para el tratamiento de ATTR, aunque se encuentran en cursos numerosos ensayos clínicos que pretenden evaluar nuevas opciones farmacológicas silenciadoras o quelantes de la fibrilla amiloi de. Estos avances generan nuevos cuestionamientos sobre las estrategias terapéuticas óptimas, inicio oportuno de las mismas en relación al estadio de la enfermedad y la eficacia potencial de la combinación de las terapias estabilizadoras, silenciadoras y quelantes de los depósitos amiloides. Así mismo, los sistemas de salud tienen la alentadora expecta tiva de contar con numerosas terapéuticas potencialmente eficaces y el desafío de incorporarlas de manera sustentable. Los avances en cursos generan una perspectiva futura alen tadora sobre el tratamiento y el pronóstico de los pacientes que padecen amiloidosis cardiaca.
Acceso a la Guía de Práctica Clínica
El proceso de cada etapa, junto con su desarrollo completo y anexos se encuentra disponible en http://trovare.hospitalitaliano.org.ar/greenstone/cgi-bin/library.cgi?c=revistas&a=d&d=D1179