Uno de los autores que esto escriben recordaba que un colega del Hospital Muñiz, hace medio siglo, tenía la costumbre de vacunarse con todas las vacunas a su alcance “para mantener activa la inmuni dad”. Ahora vemos que su idea no era tan extravagante ni el colega tan excéntrico.
El recuerdo surgió de la lectura del artículo Beyond the Booster Shot, publicado en The New Yorker por Mathew Hutson, periodista especializado en ciencia1. Y el artículo nos llevó a redactar esta nota sobre efecto inespecífico de las vacunas, heterólogo, “fuera del blanco”.
Calmette advirtió el efecto inespecífico de la vacunación BCG (que se aplicaba por vía oral). En su comunicación a la Royal Society of Medicine del 9 de junio de 1931 dice: The general mortality of 8075 vaccinated children exposed to tuberculous infection, aged from one month to one year, controlled by 114 dispensaries, has been 4.6%, whereas in non-vaccinated children of the same age, living under similar conditions, it is at least 16%, and often exceeds 25%. Y Calmette se pregunta: How can this diffe rence between general mortality in vaccinated and in non-vaccinated groups be explained? […] Can it be that tuberculous infection plays a more important part in infant mortality than we have supposed? […] Or does the harbouring of BCG, followed by its digestion and elimination, confer on the organism a special aptitude to resist those other infections which are so frequent in young children? […]2.
El siguiente hito son los trabajos del matrimonio de Marina K. Voroshilova y Mikhail P. Chumakov y col. En el análisis de los resultados de una campaña de vacunación masiva contra la poliomielitis, en la Unión Soviética, en 1959 (77 478 872 vacunados), en la sección titulada Interference dicen: In oral immunization with live poliovirus vaccine the phenomena of interference between non-poliomyelitis enteroviruses (…) and live vaccine strains and of interference between individual types of live vaccine acquire special importance.[…] The data obtained enable us to draw the preliminary conclusion that most instances of oral immunization failure are due to the influence of interference upon the vaccination process. The interference may probably be overcome by particularly massive vaccinations (involving no less than 50% of the susceptible population) and by repeated vaccinations over at least three years3.
Por estas observaciones Voroshilova decidió probar vacunas con enterovirus no patógenos para proteger a los vacunados de los patógenos. Se basa en esta idea: The results of our observations and investigations proved the existence of a novel phenomenon, namely, nonspecific inhibition of pathogenic viruses by nonpathogenic enteroviruses. The mechanism of the interfering effect of LEV [Live Ente rovirus Vaccines) against pathogenic enteroviruses and respiratory viruses in man is not yet clear. In addition to competition for habitat and interfering effect, there appears to be a nonspecific stimulation of several protective systems of the body4.
En 1992 publicaron “The results of the 3-year controlled trials of a new method of nonspecific urgent prophylaxis of influenza and acute respiratory diseases (ARD) by immunization of healthy adults with standard live enterovirus oral vaccines […]”. En el resumen accesible no hay detalles sobre las vacunas utilizadas5.
Vorosholiva y Chumakov probaban las vacunas en sus tres hijos que, en su infancia, cada otoño recibían la vacuna Sabin para protegerlos de la gripe. Y dos de los tres hermanos, Konstantin y Peter, diseñaron vacunas que probaron en sí mismos6.
El siguiente paso en esta historia es la publicación de Peter Aaby y col., para algunos una piedra angular en la historia de las vacunas. Del resumen tomamos este párrafo: Recent community studies indicate, however, that malnutrition is not the cause of high measles mortality. In an urban community in Guinea-Bissau, child mortality has been registered for a period of 3 years; I year before and 2 years after the introduction of a general measles vaccination program. In the years following the introduction of measles vaccination, mortality for children aged 6 to 35 months has significantly diminished. Though this is not a controlled study of vaccinated and unvaccinated children, much of the reduced mortality can apparently be attributed to the protective effect of measles vaccination7.
Al trabajo inicial de Aaby y col. siguieron muchos otros, observacionales, que se extendieron de Guinea-Bissau a otros países igualmente pobres y sumaron nuevos interesados en el efecto no especí fico de las vacunas. La masa de publicaciones es enorme, por ello solo incluimos una revisión reciente8.
No faltaron las críticas y la OMS, a través del Strategic Advisory Group of Experts on Immunization (SAGE), comisionó dos revisiones sistemáticas para aclarar la situación.
Una de las revisiones concluía así: Evidence suggests that receipt of BCG and measles containing vaccines (MCV) reduce overall mortality by more than would be expected through their effects on the diseases they prevent, and receipt of diphtheria-tetanus-pertussis (DTP) may be associated with an increase in all cause mortality9.
La otra así: The quality of the evidence, however, does not provide confidence in the nature, magni tude, or timing of non-specific immunological effects after vaccination with BCG, diphtheria, pertussis, tetanus, or measles containing vaccines nor the clinical importance of the findings10.
Las investigaciones siguieron su camino. La pandemia de COVID trajo consigo un rápido desarrollo del conocimiento sobre los distintos tipos de inmunidad y su papel frente a las infecciones virales, en especial frente al SARS-CoV-2. Y a ello nos referiremos ahora.
Fundamentos biológicos del efecto no específico de las vacunas y las estrategias de nuestro sistema inmunitario
La más antigua estrategia evolutiva de defensa es la inmunidad innata, no específica, cuyas fun ciones principales son: reclutar células y mediadores químicos (citoquinas) en los sitios de infección, activar el sistema del complemento (inmunidad humoral), y remover antígenos extraños por medio de los leucocitos. La inflamación y la fiebre, en la que intervienen las citoquinas, son herramientas de la inmunidad innata.
Por encuentros previos con patógenos, sus productos, o por vacunas capaces de protegernos con tra diversos antígenos, se desarrolla la inmunidad innata entrenada. En este tipo de inmunidad no específica participan células mieloides, linfoides, NK, receptores celulares y linfoquinas, producidas por linfocitos T.
Además, la presentación del antígeno activa la inmunidad adaptativa o adquirida, altamente espe cífica, que sigue una reprogramación epigenética (sin alteraciones en la secuencia del ADN), y que conduce a una mayor y mejor respuesta en los encuentros futuros con ese antígeno. Por ejemplo, quien se recupera del sarampión queda protegido contra él de por vida, o, como ocurre con la varicela, por un tiempo prolongado. El proceso de inmunidad adaptativa es la base de la vacunación.
Tanto la inmunidad innata como la adquirida incluyen componentes humorales, los anticuerpos cir culantes, activos frente a patógenos extracelulares, y componentes celulares, que actúan frente a pató genos intracelulares y en la respuesta antitumoral.
Las vacunas “vivas” y la inmunidad entrenada
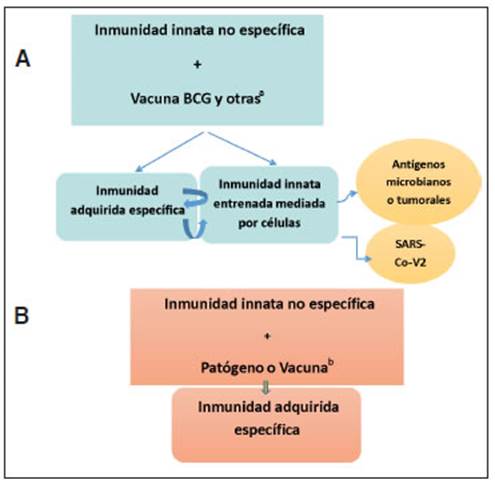
La vacuna BCG, una suspensión de bacilos vivos atenuados, además de su efecto específico de protección contra la tuberculosis, estimula la inmunidad innata entrenada (Fig. 1 A).
Según los datos disponibles sobre la vacunación BCG y los casos notificados de COVID-19, a inicios de 2020 (antes de la aparición de vacunas anti-SARS-CoV-2), algunos estudios mostraban que países como Holanda, España, EE.UU., entre otros, donde no se aplicaba la vacuna BCG, resultaban más afectados por el COVID-19, con mayor mortalidad y letalidad, que los países con políticas de vacuna ción BCG de larga data, lo que estaría en consonancia con la idea de que la BCG protege a la población adulta vacunada en su infancia. Pero dos cuestiones quedaron sin respuesta: ¿El efecto protector de BCG dado en la infancia sería aún válido en adultos y en adultos mayores? ¿El refuerzo del sistema inmunitario innato puede ser poderoso más allá de la niñez?
Estos estudios eran observacionales, basados en análisis de datos posteriores a los hechos (after-the-fact data analysis), y eso los hacía poco confiables. Más tarde, con el desarrollo de la pandemia y la introducción de la vacunación anti-COVID, esas observaciones no pudieron confirmarse11,12.
La inmunidad entrenada adjudicada a la vacuna BCG, también podría obtenerse con otras vacunas. Además de la BCG varias vacunas de amplio uso en el mundo, están compuestas por bacterias o virus vivos atenuados, entre ellas SRP (sarampión, rubeola, parotiditis, o MMR), la vacuna nasal para pre venir la influenza, dos tipos de vacunas compuestas por virus vivo atenuado de varicela zoster (para prevención del herpes zoster y de varicela), y dos vacunas orales a enterovirus (EOV): la del rotavirus y la OPV (anti-polio oral)13. (Fig.1 A).
Otras vacunas están compuestas por gérmenes inactivados, como la de Bordetella pertussis celular (Pw), la de hepatitis A, y la anti-polio inyectable (IPV), o son acelulares, como la PCV (anti-neumococos), las de influenza estacional, y la de hepatitis B. Estas vacunas previenen la enfermedad por estímulo de la inmunidad específica, pero no intervendrían en el desarrollo de la inmunidad entrenada. (Fig.1 B).
En casos muy raros, el virus debilitado que se usa en la OPV puede mutar a una forma más peli grosa: cVDPV2 (circulating vaccine-derived poliovirus type 2). Por esa razón se recomendó el empleo de la vacuna inyectable acelular (IPV), en lugar de la OPV, en los países y regiones donde la polio natural ha sido eliminada. No obstante, en noviembre 2020, la OMS incluyó en la lista de uso de emergencia una nueva vacuna oral compuesta por polio virus tipo 2 vivo atenuado (nOPV2)14.
Motivos no específicos para reforzar los programas de vacunación infantil
Varias de estas vacunas están incluidas en los programas de va cunación infantil, recomendados por OPS y OMS, que se siguen en nuestro país15,16. Su cumplimiento, con altas coberturas, además del efecto específico para controlar y hasta erradicar graves enfermeda des, es probable que contribuya al control de otras. Ello aporta una razón adicional para reforzar esos programas, que han sufrido mermas en su cobertura en los últimos años, en que el mayor esfuerzo fue puesto en controlar la pandemia de COVID-19, y han sido también cuestionados por los movimientos anti-vacunas, como sucedió con la del sarampión17.
Vacunas “vivas” y SARS-CoV-2
Además de la BCG, dos vacunas de virus vivos atenuados, OPV y anti-sarampión, se han asociado con una reducción de la mortalidad infantil mayor que la esperada por su efecto específico sobre las enfermedades que previenen. K. Chumakov y coautores, en 2021 recuerdan los completos estudios sobre el rol protector no específico de OPV, realizados en las décadas de 1960 y 703-6. Y se preguntan si la acción de estas vacunas “vivas”, inducida por su replicación celular, que estimula una respuesta inmune ampliada, podría también prevenir la enfermedad por SARS-CoV-218,19.
La respuesta inmune celular contra nuevas variantes e híbridos de SARS-CoV-2, y la vacunación
Establecida la infección, actúa la respuesta inmunitaria adaptativa específica para la eliminación viral. Los anticuerpos juegan un papel básico en la neutralización del virus, pero éste puede propagarse por contacto de célula a célula, y esa diseminación es resistente a la neutralización por anticuerpos, de lo que se puede deducir que la inmunidad de las células T resulta esencial para la eliminación del SARS-CoV-220-22.
Además, el virus SARS-CoV-2 muta, y sus distintas variantes y sub variantes acumulan nuevas mu taciones, que escapan de los anticuerpos neutralizantes. Importa mucho entonces conocer si las nuevas variantes escapan la acción de las células T.
Las mutaciones del SARS-CoV-2 en la proteína viral S (spike) no afectarían el reconocimiento por las células T, ya que este no se enfoca solo en epitopes del RBD (receptor binding domain) de la proteína S del virus. El SARS-CoV-2 tiene un genoma de ARN mensajero (ARNm) muy grande, de 30 kb, y puede codificar muchos epitopes de células T. Recordemos que los epitopes son péptidos derivados de antí genos proteicos que, unidos a una determinada glicoproteína del complejo mayor de histocompatibilidad (MHC), son reconocidos por las células T21.
Las respuestas de las células T son multiantigénicas. Se han identificado en SARS-CoV-2 más de 1400 epitopes de células T CD4 y CD8, en 10 antígenos inmunodominantes (reconocidos con mayor fuerza), lo que hace poco probable que la mutación viral, que solo afecta a la proteína S, sea suficiente para evadirse del reconocimiento por las células T21,22.
De acuerdo a esto, la respuesta inmune celular se mantendría frente a nuevas variantes, sub-varian tes, recombinaciones e híbridos del virus, altamente transmisibles e infectantes23,24. Esa respuesta de las células T CD4+ y T CD8+, dirigida contra ellas, puede contribuir a la menor gravedad de los casos.
Después de la vacunación, la respuesta de las células T de inmunidad celular es más duradera que la mediada por anticuerpos, y parece mostrar fuerte protección cruzada contra las diferentes variantes del SARS-CoV-2.
La magnitud de la inducción de células T específicas para la proteína spike varía según el subtipo de vacuna, y las plataformas basadas en adenovirus generan, de acuerdo con algunos estudios, respues tas T más fuertes, mientras que las plataformas de vacunas ARNm desarrollan títulos de anticuerpos más altos. Esto puede ser un fundamento para el uso complementario de vacunas heterólogas (por ejemplo: BNT162b2mRNA y ChAdOx1nCoV-19)25.
Para terminar este relato: los Chumakov (hijos), Robert C. Gallo y directivos de la Global Virus Net work (GVN), antes de que estuvieran disponibles las vacunas contra COVID-19, se vacunaron con MMR, por si acaso1. Y el colega que recordamos al comienzo, no era tan extravagante ni excéntrico, entrenaba la inmunidad, y tiene ahora ilustre compañía.