PUNTOS CLAVE
Conocimiento actual
• El testeo, rastreo y aislamiento de contactos estrechos, constituyen un pilar del manejo de la pandemia por SARS-CoV-2. Sin embargo, la baja disponibilidad y demoras de los test moleculares constituyen un cuello de botella en la estrategia. Los test rápidos de detección de antígeno surgen como una opción atractiva.
Contribución del artículo al conocimiento actual
• La implementación de una estrategia de vigilancia basa da en el uso de test rápidos de detección de antígeno tuvo una aceptabilidad y cobertura elevada y aceleró el diagnóstico e identificación de los individuos que tuvieron mayor contagiosidad.
El testeo, la identificación de contactos y su aislamiento constituye una de las estrategias de salud pública esencia les para contener el avance del SARS-CoV-2. Respecto al testeo, la RT-qPCR es considerada “la prueba de oro” para el diagnóstico de la enfermedad1-3. Sin embargo, su disponibilidad no es universal, dado que su empleo requiere laboratorios con equipamiento especializado, re activos costosos y personal experimentado y el resultado puede demorar horas o incluso días1-4. Las estrategias de vigilancia con test rápidos de detección de antígeno (TR-Ag) surgen como una potencial alternativa al reducir la demora, tener menor costo, ser más accesibles y poseer un adecuado rendimiento diagnóstico, en comparación con la RT-qPCR4-9.
Si bien este tipo de estrategias constituye una opción muy atractiva, en particular en contextos de ausencia y/o restricción de recursos o en ámbitos rurales o remotos, se desconoce la medida en la que contribuyen a controlar la transmisibilidad del virus. Distintos estudios mostraron que el riesgo de infección por SARS-CoV-2 se modifica según la edad, sintomatología y tipo de contacto con el caso primario, pero se desconoce cómo varía según el método empleado para el diagnóstico de la enfermedad (TR-Ag vs. molecular)10-14. Dada su menor sensibilidad en relación a la RT-qPCR, los TR-Ag pueden no detectar algunos casos de pacientes con COVID-19. Sin embar go, teniendo en cuenta que su sensibilidad aumenta en pacientes con cargas virales altas, estos test permitirían identificar rápidamente a los pacientes con mayor con tagiosidad8,9,15,16.
En diciembre del 2020, el Hospital Municipal de Coronel Suárez, único efector público de un municipio localizado en el centro de la Provincia de Buenos Aires, Argentina, implementó esta estrategia, teniendo en cuenta el rendimiento diagnóstico, facilidad de aplicación y menor costo de los TR-Ag. El objetivo del estudio fue, por un lado, describir los resultados de la estrategia en los primeros cuatro meses, con foco en su capacidad para detectar y realizar el seguimiento de los casos primarios, su red de contactos estrechos (CE) y los casos secundarios; y, por otra parte, estimar indicadores de transmisibilidad del virus en la población de estudio, así como su asociación con el resultado del test diagnóstico confirmatorio.
Materiales y métodos
Este es un estudio de cohorte retrospectivo que incluyó a pacientes que consultaron en el Servicio de Emergencias (SE) del Hospital de Coronel Suárez entre el 1 de diciembre de 2020 y el 31 de marzo de 2021, presentaron síntomas com patibles con COVID-19 y fueron incluidos en la estrategia de testeo, identificación de casos y rastreo, y aislamiento de CE.
Los criterios de inclusión fueron: 1) cumplir criterios de caso sospechoso de COVID-19 definidos por el Ministerio de Salud de la Nación17; y, 2) haber sido testeados con un TR-Ag de SARS-CoV-2 como parte de la evaluación inicial. Se excluyeron aquellos que: 1) fueron testeados con TR-Ag en laboratorios privados de la ciudad; 2) fueron testeados solo por test moleculares (TM); 3) fueron testeados con TR-Ag por otra causa diferente a la presencia de síntomas compatibles de COVID-19.
A los pacientes incluidos se les realizó un hisopado nasofa ríngeo y un TR-Ag (Abbott PanBioTM) que, en caso de resultar positivo, se interpretó como confirmatorio de COVID-19 (TR+). Frente a un resultado negativo, el mismo operador recolectó en ese momento un segundo hisopado con la misma técnica. Debido a que al momento del estudio Coronel Suárez no disponía de equipamiento para realizar métodos moleculares, las segundas muestras obtenidas fueron remitidas hacia otras localidades para su evaluación con Rt-PCR, iAMPR o NeokitR. Un TM positivo confirmó el diagnóstico y fue considerado como un resultado falso negativo del TR-Ag (TR- TM+).
Todos los casos confirmados de COVID-19 fueron inclui dos en el seguimiento a través del equipo de telemedicina, responsable de realizar el interrogatorio para identificar, con tactar y aislar a aquellas personas que reunían los criterios de CE según la definición del Ministerio de Salud de la Nación17. Cada CE fue seguido telefónicamente durante 14 días para monitoreo e identificación de síntomas compatibles con la enfermedad. Se descartaron del análisis aquellos CE que no cumplieron los 14 días de seguimiento y los que debieron realizar cuarentena por pertenecer a una burbuja escolar.
La muestra de casos confirmados fue clasificada en pri marios y secundarios. Los casos primarios fueron aquellos diagnosticados por un método de laboratorio en el SE y que no tuvieron un infector conocido. Los casos secundarios fueron aquellos determinados como positivos a SARS-CoV-2 donde se pudo identificar al infector. Para ambos grupos se registró la cantidad de CE convivientes y no convivientes y los casos positivos resultantes durante el período de seguimiento. Parte de esos casos positivos fueron diagnosticados por el propio SE y forman parte de la base analizada, mientras que otros fueron confirmados por centros privados o por criterios clínico-epidemiológicos de COVID-1917. Se debe destacar que el rastreo permitió identificar los contagios posteriores de un caso secundario. De acuerdo al grado de certeza de la exposición entre infector e infectado, los casos secundarios se clasificaron como “seguros” (cuando correspondía a un CE de solo un caso índice) y “probables” (cuando era CE de dos o más casos índice). En los CE asintomáticos, no se realizaron estudios de laboratorio confirmatorios.
Para describir la implementación de la estrategia se anali zaron el alcance, la aceptabilidad, la cobertura y el porcentaje de positividad del test diagnóstico. El alcance de la estrategia se estimó a través de la frecuencia absoluta de casos con firmados, CE y casos secundarios; la aceptabilidad como la proporción de casos incluidos en la estrategia sobre el total de pacientes que consultó en el SE; la cobertura del seguimiento como la proporción de CE que tuvieron seguimiento completo y el porcentaje de positividad como la cantidad de casos confirmados sobre el total de pacientes incluidos.
Los indicadores de transmisibilidad viral valorados fueron probabilidad de generar transmisión posterior al contagio, cantidad de contagios secundarios generados, tasa de ata que secundaria (TAS) e índice de sobredispersión. La TAS se estimó como la proporción de casos secundarios del total de CE de los infectores que tuvieron seguimiento completo. Como en parte de los casos secundarios no se pudo identificar unívocamente al infector, se obtuvieron dos estimaciones de la TAS, una global que consideró el total de casos secundarios generados (seguros o probables) por un caso índice, y otra que solo incluyó los casos secundarios con infector seguro. El parámetro indicador de sobredispersión, α, fue estimado con una negativa binomial no condicionada y condicionada. Para cada uno de los indicadores mencionados, se estimó la asociación con el test diagnóstico confirmatorio.
Las variables primarias fueron los indicadores de trans misibilidad y, como variables secundarias, además del re sultado del test diagnóstico confirmatorio, se consideraron la edad, género, personal de salud, síntomas al momento de la evaluación, fecha de inicio de los síntomas y variables de exposición (tamaño del grupo conviviente, número de CE no convivientes). Se realizó un análisis univariado de las variables primarias y secundarias. Las variables nominales se expresaron como frecuencias absolutas y relativas. Las variables cuantitativas con media y desviación estándar cuan do la distribución fue simétrica y como mediana con rango intercuartil, cuando ésta fue asimétrica.
Las diferencias de transmisión entre TR+ y TR-TM+ fue ron evaluadas con pruebas de ratio de verosimilitud (LR) y de Mann-Whitney. La robustez de los hallazgos fue valo rada con un análisis multivariado basado en regresiones. Se consideraron tres indicadores de transmisibilidad viral (variables dependientes): si el caso confirmado generó o no transmisión secundaria sintomática, la cantidad de CE confirmados por cada caso y la TAS. La primera de estas variables fue analizada con modelos de regresión logística (logit). Los resultados de las estimaciones basadas en el logit se expresaron en ratios de chances (odds ratios, OR). Por su parte, los factores asociados a la cantidad de casos secundarios generados por cada infector fueron analizados mediante una regresión negativa binomial. Los resultados de este análisis se expresan en la ratio de tasa de incidencia (IRR, por sus siglas en inglés). Finalmente se analizaron distintos factores asociados a la TAS (y distintas variantes, con y sin certidumbre, dentro y fuera del hogar) mediante el modelo tobit para variable dependiente censurada. Los resultados de estas regresiones se expresan como efectos marginales sobre la dependiente censurada. La asociación entre el resultado del TR y las tres variables dependientes mencionadas fue controlada por factores sociodemográficos (género, edad, si es personal de salud), síntomas reportados, tipo de caso (primario, secundario) y origen del caso primario (aglomerado o individual) según el rastreo de contactos. En el caso del logit y de la negativa binomial, el tamaño del hogar y la cantidad de CE fuera del hogar fueron incluidos como co-factores en las estimaciones, al representar indicadores de exposición. En el tobit, no se incluyeron esas dos variables de exposición en tanto forman parte del denominador en la definición de la propia dependiente. El análisis se llevó a cabo con el software Stata v.16.
El protocolo fue aprobado por el Comité de Ética del Hospital de Coronel Suárez. El estudio utilizó como fuente de información la base de datos confeccionada por el equipo de telemedicina. Si bien no se obtuvo consentimiento informado para la inclusión de pacientes, para el estudio se elaboró una nueva base de datos a partir de la fuente original de información, en la que se omitieron los datos vinculados a la identidad del paciente. El estudio fue financiado con recursos propios, sin recibir financiamiento específico.
Resultados
Entre el 1 de diciembre de 2020 y el 31 de marzo de 2021, ingresaron en la guardia externa del Hospital de Coronel Suárez 1952 pacientes con criterios de caso sospechoso de COVID-19, de los cuales 1706 (87%) fueron evaluados por medio de un TR-Ag (Fig. 1). Se excluyeron 246 casos por ser evaluados únicamente por TM: 121 se registraron en el primer mes de implementación de la estrategia y los restantes correspondieron, en su mayoría, a casos pediátricos. De este grupo de excluidos, 59 (24%) fueron positivos.
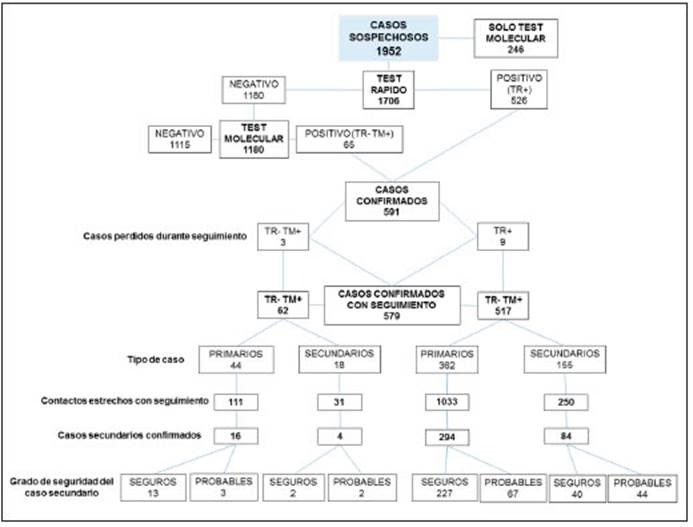
Fig. 1 Flujograma de la población de estudio: casos confirmados, contactos estrechos y casos secundarios
De los 1706 pacientes chequeados con TR-Ag, 526 resultaron positivos y 1180 negativos. Estos últimos fueron evaluados por TM, confirmándose el diagnóstico en 65 pacientes (50 por RT-qPCR, 8 por iAMPR y 7 por NeokitR) y descartándose la enfermedad en los restantes 1115 pa cientes. En total, se identificaron 591 casos de COVID-19, representando un porcentaje de positividad de 34.7%. De los 591 pacientes con diagnóstico de COVID-19, 12 no pudieron ser contactados y/o aportar información sobre contactos (9 en el grupo de TR+ y 3 en el grupo de TR-TM+). Los 579 casos restantes que conformaron la muestra total de observaciones correspondieron a 407 casos primarios y 172 secundarios.
A partir de la información aportada en el seguimiento telefónico, se registraron 1669 CE, de los cuales, 1425 (85%) tuvieron seguimiento completo. En conjunto, 398 CE resultaron posteriormente positivos. A la vez, los casos secundarios generados fueron clasificados en “seguros” y “probables” en tanto en varios casos se detectaron diferentes posibles infectores (especialmente dentro del hogar) de acuerdo a la fecha de exposición para un mis mo caso secundario. En total, se detectaron 282 casos secundarios seguros y 116 probables.
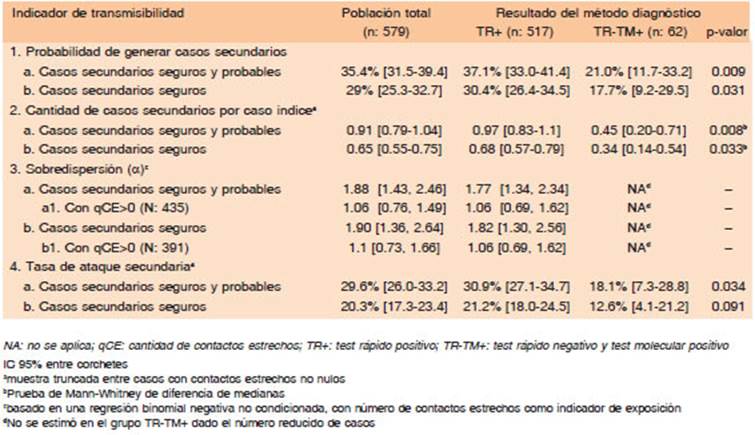
En la Tabla 1 se describen las características sociode mográficas, síntomas y método diagnóstico confirmatorio de los casos.
En 35% (205/579) de los casos confirmados se infor maron contagios sintomáticos posteriores. Esta propor ción fue mayor en los casos con TR+ (37.1%, 192/517, LR test p-valor = 0.009) que en aquellos con TR-TM+ (21%; 13/62). Cuando se consideraron únicamente los casos secundarios seguros (y se excluyeron los probables), la probabilidad de contagio sintomático se redujo a 29%. Sin embargo, también en este caso se observó una mayor probabilidad en confirmados por TR+ (30.4%, 157/517, LR test p-valor = 0.031) que en aquellos con TR-TM+ (17.7%; 11/62) (Tabla 2).
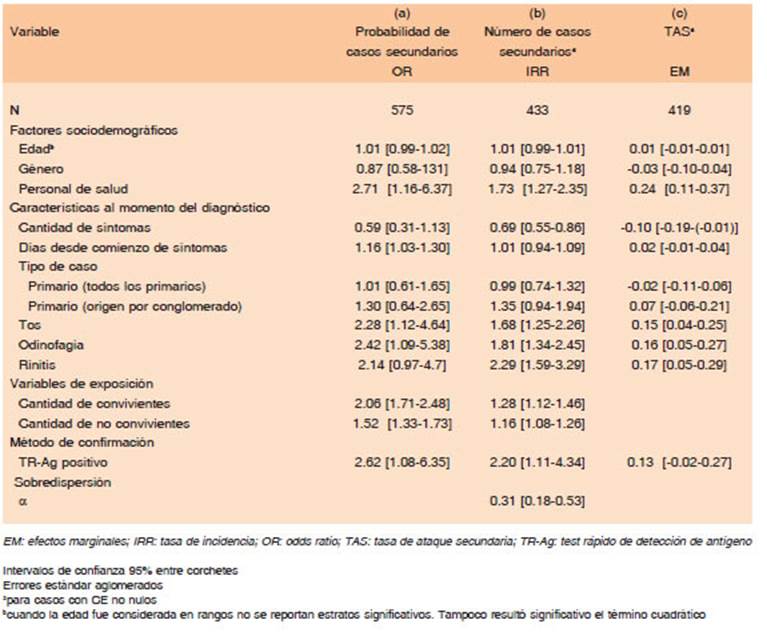
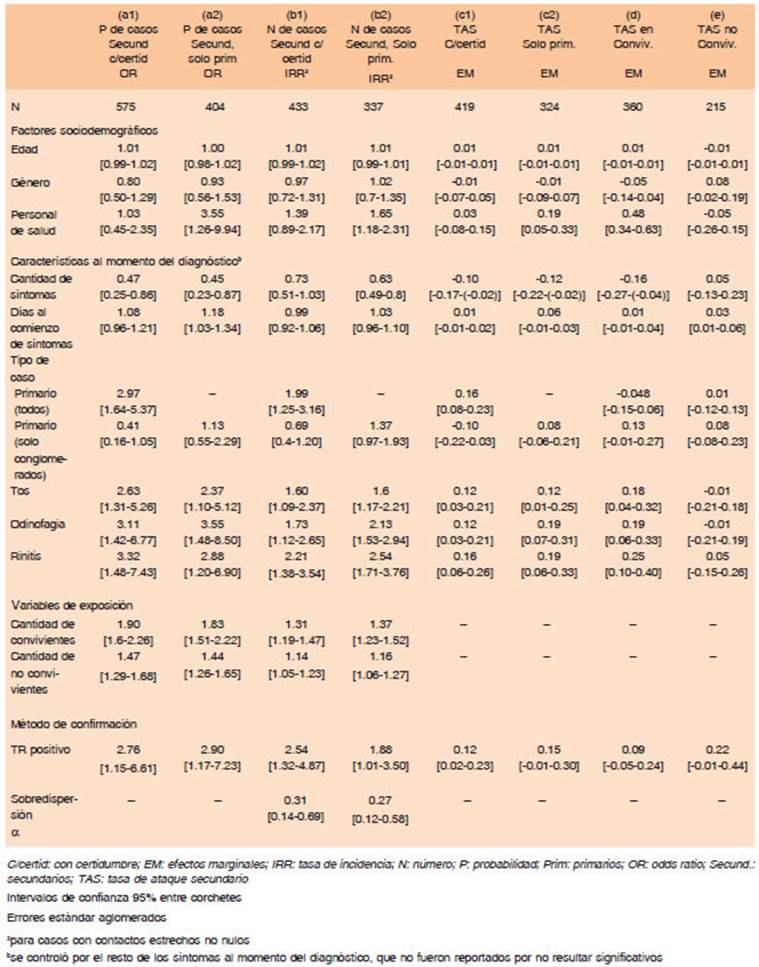
La asociación entre la presencia de un TR+ y una ma yor probabilidad de contagio sintomático se mantuvo en el análisis multivariado (Tabla 3, columna a). Las chances de que un caso confirmado por TR genere transmisión sintomática secundaria aumentaron 2.6 (IC 95% 1.08, 6.35) veces en promedio respecto de un falso negativo obteniendo un OR superior cuando se tomaron solamente los casos secundarios seguros (columna c1 de (Tabla 1 en material suplementario).
Cada caso confirmado generó 0.91 casos secundarios con posterioridad (0.65 cuando se toman en cuenta sola mente los casos secundarios seguros). Según el resultado del TR, los positivos tuvieron mayor cantidad de casos secundarios que los falsos negativos (0.97 vs. 0.45; p-valor = < 0.01 en prueba de Mann-Whitney de diferencia de me dianas) (Tabla 2). De los casos confirmados, la mayoría no registró un caso secundario posterior (63% con TR+ vs. 79% con TR-TM+). Entre los que sí originaron casos, el porcentaje fue mayor en los TR+ vs. TR-TM+ en todos los grupos analizados considerando la cantidad de casos secundarios por caso primario (Fig. 2).

Fig. 2 Distribución de casos secundarios generados por cada caso índice según su método de confirmación (TR+ N: 517, TR-TM+ N: 62). Porcentajes
Las estimaciones de la regresión negativa binomial no condicionadas mostraron sobredispersión en la trans misión en tanto α resultó mayor a 0 en todos los grupos analizados (Tabla 2). Debido a que alrededor de 25% de la muestra reportó no haber tenido CE y ello podría significar cierto subreporte, se obtuvo una estimación alternativa de α considerando solo los casos que declararon un número de CE mayor de 0. La sobredispersión se redujo notable mente cuando se excluyó la porción de casos sin CE (α = 1.06, IC 95% 0.76-1.49), lo que sugiere que el posible subreporte pudo sobreestimar la sobredispersión. Si bien la estimación puntual de α fue discretamente menor en la submuestra de TR+, los IC no difirieron sustancialmente (IC 95% 1.34-2.34). No se estimó en el grupo TR-TM+ dado el número reducido de casos.
La regresión binomial negativa condicionada mostró que los TR+ generaron, en promedio, el doble de casos secundarios que los falsos negativos (Tabla 3, columna b). Si bien en el análisis multivariado el parámetro de sobredispersión disminuyó respecto a las estimaciones no condicionadas, continuó siendo estadísticamente distinto de 0, lo que mostró sobredispersión incluso luego de controlar por factores condicionantes.
La TAS para toda la población de estudio, incluyendo casos secundarios seguros y probables fue de 27.9% (398/1425). Al considerar solo los seguros, descendió a 19.7% (282/1425). De acuerdo al tipo de CE, la TAS fue 33.5% (258/771) en convivientes y 19.7% (129/654) en no convivientes.
Cuando se analizó la TAS según el método de confir mación, los casos con TR+ tuvieron una TAS de 30.9%, mientras que con TR-TM+ de 18.1% (Tabla 2). En el análisis multivariado, los TR+ presentaron, nuevamente, mayor TAS que el resto (Tabla 3, columna c). Un resul tado positivo por TR incrementó la TAS en 12.5% en promedio, aunque este resultado quedó en el límite de la significación estadística (IC 95% -1.9%-26.9%). Este efecto fue similar tomando en cuenta solamente los casos secundarios seguros (columna c1 de (Tabla 1 en material suplementario).
El análisis multivariado evidenció otros factores que se asociaron en forma independiente con los indicadores de transmisibilidad considerados. Entre los síntomas se encontraron la secreción nasal, odinofagia y tos (Tabla 2). Para cada uno de ellos, las chances de generar casos secundarios se duplicaron cuando estuvieron presentes. Además, la secreción nasal duplicó el número de casos secundarios promedio generados, la odinofagia incremen tó este número en un factor de 1.8 y la tos en un factor de 1.7. La TAS aumentó entre 17 y 15 puntos porcentuales, con independencia del efecto de otros condicionantes.
En presencia de una mayor cantidad de síntomas in formados, se observó una disminución de la probabilidad de generar casos secundarios. En el análisis global, el personal de salud presentó mayores indicadores de trans misibilidad, aunque el resultado no se mantuvo cuando se tuvieron en cuenta solo los casos secundarios seguros (columnas a1 y a2 de Tabla 1 en material suplementario).
Discusión
La estrategia de testeo, rastreo y aislamiento mediante la utilización de un TR-Ag para la evaluación de los casos sospechosos de COVID-19 implementada en el SE del hospital de Coronel Suárez presentó una elevada acep tabilidad y cobertura de seguimiento. Adicionalmente, permitió constatar que la transmisibilidad viral fue mayor en aquellos individuos con COVID-19 que presentaron inicialmente un TR-Ag positivo que en aquellos que fueron confirmados con un TM, luego de presentar un TR-Ag negativo. Este resultado fue robusto en los varios subgrupos considerados.
En nuestro conocimiento, no hay experiencias simi lares publicadas en Argentina. La estrategia mediante el uso de TR-Ag tuvo una alta aceptabilidad por parte del grupo médico. La cobertura, a través del equipo de seguimiento de telemedicina, sumado al hecho de contar con el resultado del test en un lapso más corto, contribuyó al aislamiento de un número importante de CE: prácticamente, nueve de cada diez pudieron ser seguidos e indicarse el aislamiento de manera precoz. Previo al estudio, la demora en la obtención del diagnóstico era muy alta, dada la falta de disponibilidad en la ciudad de laboratorios con capacidad instalada para la realización de los TM. El aislamiento precoz (dentro de las 24 horas) de todo CE constituye un indicador de la efectividad de las estrategias de vigilancia, lo que enfatiza aún más la importancia de disponer de TR-Ag18-20. Además, tal como evidenciaron los resultados del presente estudio, los TR-Ag permitirían identificar a los individuos que podrían tener mayor contagiosidad, con un porcentaje reducido de resultados falsos negativos.
Esta estrategia se alinea con la resolución del Ministe rio de Salud de la provincia de Buenos Aires de abril del 2021, que, ante la eventual reducción de la disponibilidad de test diagnósticos frente a nuevas olas de la pandemia, permite descartar un caso sospechoso de COVID-19 mediante la utilización de un TR-Ag aislado21. Desde la perspectiva sanitaria, los resultados de este estudio son de gran relevancia y, en particular, en aquellos municipios y centros alejados de los grandes centros urbanos que carecen de capacidades y disponibilidad de TM.
La TAS global fue elevada y se mantuvo sin variaciones significativas durante el período evaluado. No hubo cam bios en las restricciones impuestas por los organismos gubernamentales ni modificaciones climáticas importantes durante el período de estudio que pudieran afectar dicha tasa. La TAS del 33.5% en convivientes y 19.7% en no convivientes, fue superior a las reportadas en la mayor parte de la literatura internacional10-14,22-26. Es posible que el contexto de alta circulación viral, así como las prácticas sociales y culturales locales y estrategias de aislamiento menos eficaces en comparación a las empleadas en otros países podrían explicar, al menos en parte, las diferencias encontradas.
En la literatura sobre transmisión de enfermedades in fecciosas, R0 (conocido como R-nought) suele ser un pa rametro epidemiológico relevante en tanto permite evaluar las perspectivas de controlar una epidemia. R0 representa la cantidad de casos secundarios desencadenada a partir de un caso primario. En nuestro caso, proveemos una estimación ubicada en torno a 0.91. Este valor, al ubicarse por debajo la unidad augura un buen pronóstico sobre la marcha de la pandemia. Con todo, no se debe omitir que ese valor es una estimación puntual, mientras que su IC muestra que podria ser levemente superior a 1, indicando la posibilidad de continuar con transmisiones problemá ticas. Una limitación respecto de esta estimación es que se trata de casos secundarios que fueron testeados y seguidos en instalaciones del Hospital local, pero los casos primarios podrían haber dado lugar a contagios testeados por otros dispositivos, fuera del registro de este estudio. Por este motivo, la estimación provista debería entenderse mejor quiza como un valor mínimo, más que un promedio. De todas maneras, el examen detenido de la evolución de los casos que cada semana fueron diag nosticados en todo el partido de Coronel Suarez muestra que entre enero y marzo 2021, la curva fue descendente, elemento que favorece la estimación propia.
Los resultados del análisis multivariado mostraron, consistentemente, la asociación independiente entre los resultados de un TR-Ag positivo y los distintos indicadores de transmisibilidad viral. Esta asociación se mantuvo, aun considerando únicamente los casos secundarios seguros (escenario más conservador). La mayor transmisibilidad viral de individuos con TR-Ag positivo podría ser explicada por una mayor carga viral. Distintos estudios han mostrado que los TR-Ag tienen mejor correlación con los métodos moleculares cuando la carga viral es elevada8,15,16. A su vez, estudios epidemiológicos han demostrado que la carga viral es un predictor independiente del riesgo de contagio12,22. Si bien los TR-Ag han demostrado en estudios in vitro mejor predicción de crecimiento viral en cultivos celulares que la RT-qPCR, no existen, en nues tro conocimiento, trabajos que hayan evaluado el riesgo de contagio en pacientes con COVID-19 que presenten TR+ en comparación con TR-Ag falso negativo15,27. Otros factores como secreción nasal, odinofagia y tos también se asociaron a una mayor probabilidad de contagio sintomático. Particularmente, la secreción nasal, que, al momento del estudio no era considerada como criterio de caso sospechoso de COVID-19, al ser subestimada pudo incrementar el riesgo de transmisión secundaria. Este hallazgo apoya la decisión del Ministerio de Salud del país, que introdujo a la congestión nasal como criterio de caso sospechoso en mayo de 202128.
Desde el comienzo de la pandemia se ha observado que una minoría de los pacientes explica la mayoría de los contagios mediante eventos de supercontagio29-32. En este estudio se presentan estimaciones del parámetro de dispersión, central para detectar fenómenos de super contagio, lo cual constituye un hallazgo novedoso, dado que trata de las primeras estimaciones para estudios de poblaciones en países de bajos y medianos ingresos. A pesar de encontrar sobredispersión en el caso analizado, fue inferior respecto de la evidencia internacional (valo res equivalentes de α que varían entre 1.6 y 10 frente a valores estimados aquí en torno a la unidad cuando se controló por posible subreporte)33,34. Esta diferencia po dría deberse a que las estimaciones de sobredispersión difundidas para otros países se realizaron al inicio de la pandemia, cuando se desconocía la magnitud del efecto de los eventos facilitadores de supercontagios. Desde entonces las restricciones impuestas a la circulación y, en general, las campañas de concientización sobre las formas de transmisión han impactado sobre las oportunidades de generar supercontagios, lo cual podría anticipar una caída del parámetro. La magnitud del fenómeno de sobredisper sión puede tener implicancias sobre el tipo de medidas de contención. Simulaciones realizadas para distintos valores del parámetro de dispersión muestran que, cuando la heterogeneidad es reducida y la sobredispersión es baja, la limitación de contactos debería enfocarse en los contactos frecuentes, más que los esporádicos, lo cual representa un desafío de salud pública en tanto implica intervenir sobre hábitos, más que sobre eventos puntuales35.
El estudio presenta limitaciones, algunas de ellas inhe rentes a la implementación de la estrategia. La descripción de la cadena de transmisión se realiza a partir del relato de los pacientes, por lo que es posible el subreporte de CE. Se asumió que el contagio no proviene de otras fuentes diferentes a la población incluida en la cohorte. Esta im precisión podría afectar la precisión de los indicadores, en particular cuando se incluyen los casos probables. No fue posible verificar el riesgo de transmisión de acuerdo a la edad de los contactos, ni testear a los CE asintomáticos.
En conclusión, los resultados de este estudio dan cuenta de las fortalezas de implementar una estrategia basada en el uso de TR-Ag, la que tuvo una aceptabilidad y cobertura elevada y aceleró el diagnóstico e identifica ción de los individuos que tuvieron mayor contagiosidad. Estos resultados son alentadores, particularmente en contextos alejados, con baja disponibilidad y capacidades para la realización de TM.