PUNTOS CLAVE
• Hay escasa evidencia sobre la satisfacción de los pa cientes respecto de su participación en un ensayo clí nico y en particular, con el procedimiento de toma de consentimiento informado.
• Este artículo resume el aporte de más de 3000 pacientes de Argentina a través de un estudio observacional sobre los temas mencionados.
La herramienta que utiliza la farmacología clínica para la determinación de la relación eficacia/seguridad de los medicamentos es el ensayo clínico.
La importancia que tienen los ensayos clínicos para la salud pública ha quedado en clara evidencia durante la actual pandemia de COVID-19, evidenciándose la necesidad de realizar ensayos clínicos aleatorizados siguiendo todas las normas éticas y de buena práctica clínica en todos los casos1.
Toda investigación con seres humanos debe llevarse a cabo con el debido respeto y preocupación por los derechos y el bienestar de los participantes y las comu nidades donde se realiza la investigación. Este respeto y preocupación se manifiestan en los requerimientos para obtener un consentimiento informado y para asegurar que los riesgos se minimicen y sean razonables en relación con la importancia de la investigación2-4.
En la Conferencia Internacional de Armonización de requerimientos técnicos para el registro de fármacos para uso en humanos (International Conference on Har monisation of Technical Requirements for Registration of Pharmaceuticals for Human Use), conocida por sus siglas en ingles ICH, en su guía de eficacia, específicamente la E6 R2 y en la Disposición 6677/2010 de la Administra ción Nacional de Medicamentos Alimentos y Tecnología Médica (ANMAT) de Argentina, se hace referencia al consentimiento informado como un proceso, mediante el cual un sujeto confirma voluntariamente su deseo de par ticipar en un estudio en particular, después de haber sido informado sobre todos sus aspectos relevantes para que tome la decisión de participar. El consentimiento informa do se documenta de forma escrita, firmada y fechada5,6.
Los consentimientos informados han aumentado pro gresivamente su extensión y complejidad, impulsados principalmente por los requerimientos de los patrocina dores, las regulaciones, disposiciones y consideraciones legales, limitando la comprensión por parte de los partici pantes de los ensayos clínicos6-8.
Varios estudios internacionales han analizado la mo tivación y la satisfacción de los participantes en el marco de la investigación clínica9-11.
Sin embargo, ante la pregunta, sobre si los partici pantes de los ensayos clínicos están satisfechos con la información recibida y con su participación en los ensa yos clínicos o no, encontramos escasa evidencia en la bibliografía12,13.
En el año 2009 diseñamos una encuesta de satisfac ción, que el investigador tenía la obligación de entregar luego de la firma del consentimiento informado, a todos los participantes de ensayos clínicos aprobados por el Comité Independiente de Ética para Ensayos en Farma cología Clínica, Fundación de Estudios Farmacológicos y de Medicamentos (FEFyM) Prof. Luis M. Zieher, para su envío voluntario y sin costo alguno a través del Correo Argentino. Con las primeras 1000 encuestas recibidas se realizó un análisis preliminar de tipo descriptivo a fines del 201114.
Con el objetivo de analizar el grado de satisfacción de los sujetos con el proceso de consentimiento informado y con la participación en un ensayo clínico, se diseñó este estudio observacional no intervencional sobre las encuestas de satisfacción, entregadas por personas que participaron en estudios clínicos experimentales en centros de investigación, entre los años 2009 y 2014.
Materiales y métodos
Se diseñó un estudio observacional, no intervencional (de corte transversal), realizado sobre la base de datos creada en función de las encuestas voluntarias y anónimas de satisfacción, realizadas en forma prospectiva y entregadas a los sujetos que participaron en estudios clínicos experimentales en centros de investigación de la Argentina, que han subrogado la evaluación y seguimiento ético del estudio en el Comité Independiente de Ética para Ensayos en Farmacología Clínica de la Fundación de Estudios Farmacológicos y de Medicamentos Prof. Luis M. Zieher (FEFyM). Se incluyeron todas las encuestas de las personas que firmaron un consentimiento informado conteniendo la sección correspondiente a la encuesta anónima. Se excluyeron del análisis las encuestas relacionadas con protocolos observacionales, pediátricos, es tudios de bioequivalencia o de fase 1 con voluntarios sanos y las encuestas con datos faltantes considerados críticos como edad, nivel educativo, respuesta a las dos preguntas de satis facción del consentimiento y a las dos preguntas dicotómicas sobre la participación, a modo de resumen de la experiencia de la persona en el estudio.
El objetivo primario del estudio fue describir el grado de satisfacción de los sujetos con el proceso de consentimiento informado y con la participación en un ensayo clínico. Los objetivos secundarios fueron analizar si el grado de satis facción con el proceso de consentimiento informado difiere según grupo etario y nivel de educación, analizar si la utilidad del testigo difiere según grupo etario y nivel de educación, y analizar si existe asociación entre el deseo de participar en un nuevo ensayo clínico (o de recomendarlo a un tercero) y grupo etario, nivel educativo o grado de satisfacción, durante la participación en el estudio.
Las encuestas de satisfacción tenían dos partes, una relacionada con el consentimiento informado y otra con la participación del sujeto en el estudio. Las encuestas anónimas fueron entregadas a las personas y completadas en forma prospectiva. En la medida que fueron recibidas se cargaron en una base de datos en FEFYM, entre los años 2009 y 2014. Este estudio se realiza en forma retrospectiva sobre los datos que figuran en la base de datos antes mencionada.
Ambas encuestas contenían datos del protocolo, investiga dor, datos demográficos (edad y sexo) y nivel de educación (primario, secundario o terciario/universitario). La primera par te de la encuesta tenía preguntas relacionadas con el proceso de consentimiento informado y preguntas de satisfacción con el consentimiento. Las dos preguntas de satisfacción estaban referidas a la información recibida y la clarificación de las dudas. La segunda parte de la encuesta, relacionada con la participación de la persona en el estudio, tenía preguntas de satisfacción en cuanto a la continuidad de atención por el médico que tomó el consentimiento, la clarificación de dudas, el cumplimiento con los procedimientos del estudio, la percepción de utilidad del producto en investigación y la resolución de eventos adversos. Las respuestas a cada una de ellas, se categorizó en bajo, intermedio o alto grado de satisfacción, en función de una escala tipo Likert de 3 puntos. La segunda parte tenía dos preguntas dicotómicas, con el objeto de inferir la satisfacción global de la persona participante, en función de una respuesta positiva o negativa a su voluntad de par ticipar en estudios futuros y a la de recomendar a otros una participación en estudios clínicos.
El estudio fue aprobado por el Comité Independiente de Ética para Ensayos en Farmacología Clínica Fundación de Estudios Farmacológicos y de Medicamentos Prof. Luis M. Zieher (FEFyM) y registrado en la plataforma PRIISA BA (Cod. 4013).
En la planificación de este protocolo se estimó que serían necesarios 1068 encuestas (de cada una de las partes, apro ximadamente 2200 en total) para obtener un nivel de precisión de 3% en cualquiera de las respuestas. El análisis del grado de satisfacción con el consentimiento y con la participación en el estudio fue descriptivo en función de las respuestas a las preguntas de satisfacción. Los intervalos de confianza del 95% (IC95%) se calcularon por método exacto de Clopper-Pearson basado en la distribución binomial. Se realizó una regresión logística binaria para estudiar la asociación entre el deseo de participar en un nuevo ensayo clínico (o de recomendarlo a un tercero), ambas consideradas como variables dependientes, y grupo etario, nivel educativo o grado de satisfacción durante la participación en el estudio (variables independientes). El grado de satisfacción del estudio se estimó en función de un puntaje de 1 a 3 (a mayor puntaje mayor satisfacción) calculado sobre la respuesta media de las 5 preguntas de satisfacción de la encuesta de participación en el estudio. Se usó el programa: Cran R versión 3.5.0. Se estableció un valor de 5% como nivel de significancia.
Resultados
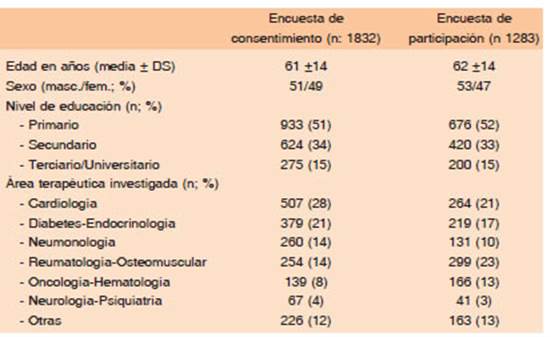
Entre 2009 y 2014 se recibieron 3404 encuestas. De estas encuestas se excluyeron 289 (8.5%) dado que no reunían los criterios del estudio. La población de análisis fue de 3115 encuestas (1832 sobre consentimiento y 1283 sobre la participación en el estudio) de 362 protocolos (y similar cantidad de investigadores) realizados en diversas provincias de la Argentina (Figura 1).
La edad promedio de los participantes (61 ± 14 años y 62 ± 14 años) fue similar en ambas encuestas (de consentimiento y de participación), respectivamente. El nivel de educación más frecuente fue el primario (51% y 52%) en ambas encuestas respectivamente. Las especia lidades más frecuentemente investigadas en los centros participantes fueron cardiología, diabetes/endocrinología y reumatología/osteomuscular que en su conjunto repre sentaron el 63% y el 62% de los protocolos de ambas encuestas respectivamente (Tabla 1).
Satisfacción con consentimiento informado: El proce dimiento más frecuentemente utilizado para la toma del consentimiento fue la lectura y explicación del mismo en el día de la firma (79.8%). La mayoría de las personas consultó previamente a firmar el consentimiento (79.2%) y les resultó útil la presencia de un testigo (68.1%) (Tabla 2). El nivel de satisfacción con el consentimiento informado evaluado a través de las dos preguntas relacionadas con la información recibida y la aclaración de las dudas fue elevado. El 91.3% (IC 95%: 89.9-92.5) de las personas clasificó la información recibida como muy buena o ex celente y el 95.1% (IC 95%: 92-96) contestó que todas sus dudas fueron aclaradas (Tabla 2).
Al analizar las respuestas de acuerdo a categorías de edad (≤ 65 años y > 65 años) no encontramos dife rencias en la satisfacción de la información recibida, que fue calificada como muy buena o excelente en el 91.4% y 91.2% de ambos grupos etarios respectivamente (p: 0.37). Encontramos una muy pequeña diferencia en el porcentaje de personas que contestó que todas sus dudas fueron aclaradas, 94.9% y 95.4% en ambos grupos etarios respectivamente (p < 0.01).
Al analizar las respuestas de acuerdo al nivel educativo (primario, secundario y terciario/universitario) encontra mos que a medida que aumentaba el nivel educativo crecía la proporción de aquellos que calificaba la infor mación recibida como muy buena o excelente. En los tres niveles educativos los porcentajes observados fueron de 89.1, 92.6%, y 96% respectivamente (p < 0.01). En estos subgrupos según nivel educativo no encontramos diferencias en el porcentaje de personas que contestó que todas sus dudas fueron aclaradas. En los tres niveles los porcentajes observados fueron de 94.3%, 95.7%, y 96.7% respectivamente (p: 0.11).
En forma adicional analizamos en los grupos categori zados por edad y nivel educativo la utilidad de la presencia de un testigo. El testigo fue de utilidad en una menor proporción, 64.8% versus 72.4%, para las personas de menor edad (≤ 65años) en comparación con los de mayor edad (> 65 años), (p < 0.01).
A menos nivel educativo, mayor proporción de utilidad del testigo. En los tres niveles educativos (primario, secun dario y terciario/universitario) la proporción de personas que encontró útil al testigo fue de 75.1%, 62.6%, y 56.4% respectivamente (p > 0.001).
Satisfacción con participación en el estudio: El grado de satisfacción con la participación en el estudio se evaluó a través de cinco preguntas categorizadas en satisfacción alta, intermedia y baja. A la pregunta sobre la continuidad de la atención por el médico que tomó el consentimiento informado, se observó un grado de satis facción alto del 88.3% (IC 95%: 86.3-90). Respecto de la clarificación de dudas fue del 97.7% (IC 95%: 96.7-98.4); en cumplimiento con los procedimientos del estudio del 98.3% (IC 95%: 97.4-98.9); en percepción de utilidad del producto en investigación del 95% (IC 95%: 93.6-96.1) y en la resolución de eventos adversos del 75.1% (IC 95%: 72.3-77.7) (Tabla 3).
La encuesta sobre con la participación del sujeto en el estudio tenía además dos preguntas que resumían su experiencia con el estudio. El 97.3% (IC 95%: 96.3-98.1) expresó su voluntad de volver a participar en estudios futuros y el 98.4% (IC 95%: 97.6-99) recomendaría a otras personas participar en ensayos clínicos.
Analizamos por regresión logística la asociación entre el deseo de participar en un nuevo ensayo clínico (o de recomendarlo a un tercero) como variables dependientes y grupo etario (≤ 65 años y >65 años), nivel de educación (primario, secundario, terciario/universitario) y el puntaje de satisfacción con la participación (calculado a través del promedio de las respuestas a las cinco preguntas de satisfacción del cuestionario de participación) como variables independientes.
De las variables independientes analizadas solo el puntaje de satisfacción se asoció en forma independiente con el deseo de volver a participar en un ensayo clínico (OR 13.6: IC95%: 4.7-39.1, p <0.001) y con la recomen dación a un tercero para que también participe (OR 16.7: IC95%: 4.4-63.4, p < 0.001).
Discusión
Las encuestas a participantes de ensayos clínicos se han utilizado en diversos países para determinar la motivación y satisfacción general de los sujetos incluidos en proto colos de investigación; sin embargo, se han realizado pocas encuestas para determinar la satisfacción de los participantes en los ensayos de investigación clínica en nuestro país9-14.
Nuestro estudio fue diseñado con el objetivo de ana lizar el grado de satisfacción con el proceso de consen timiento informado y con la participación en un ensayo clínico.
En lo que respecta a la descripción del grado de sa tisfacción con el consentimiento informado evaluado a través de dos preguntas relacionadas con la información recibida y la aclaración de las dudas, ha sido elevado el grado de satisfacción. El 91% clasificó la información recibida como muy buena o excelente y el 95% contestó que todas sus dudas fueron aclaradas. Esto condice con los resultados del cuestionario escrito de participantes de un estudio realizado en pacientes con Sida en Argentina, Brasil y Tailandia y de 14 ensayos clínicos realizados en una universidad de Canadá, que indicaron que la mayoría de los encuestados estaban satisfechos con el proceso de consentimiento informado12-15.
Ahora bien, cabe destacar que, al analizar las respues tas de acuerdo al nivel educativo encontramos que a me dida que aumentaba el nivel educativo crecía la proporción de personas que calificaba la información recibida como muy buena o excelente, entonces, teniendo en cuenta que el nivel de educación más frecuente fue el primario (51% y 52%) en ambas encuestas respectivamente, es importante destacar la importancia de que el investigador se asegure sobre la adecuada comprensión del consenti miento en todos los pacientes, y especialmente en el caso de menor nivel educativo. Los resultados de una encuesta realizada en 291 participantes de estudios clínicos en Co rea del Sur16 (país con un alto nivel de educación), mostró que los investigadores clínicos deben hacer un esfuerzo adicional para confirmar el nivel de comprensión de sus pacientes con respecto al ensayo clínico dado que más del 50% de los participantes en los ensayos clínicos no comprendió adecuadamente el consentimiento
Los resultados de un estudio realizado en Canadá indican que aquellos con educación superior tenían más probabilidades de comprender el motivo del uso de place bo, aunque no tenían más probabilidades de comprender el doble ciego15. Un estudio de vacuna antigripal realizado en Sudáfrica en sujetos con un nivel medio de educación primaria observó que solo el 21% pudo recordar que fueron asignados al azar a las diferentes ramas de trata miento, y solo el 19% había interpretado el concepto de placebo como un medicamento inactivo17.
La mayoría de las personas consultó a terceros antes de la firma del consentimiento (79.2%) y les resultó útil la presencia de un testigo. Esta utilidad fue menor en las personas ≤ 65 años respecto de las mayores de 65 años (64.8% versus 72.4% respectivamente). Estos resultados son consistentes con la publicación de un estudio reali zado en la provincia de Córdoba, en el cual observaron que la edad se asoció negativamente con un mayor nivel de conocimiento relacionado con el estudio clínico, y que el nivel de satisfacción con el estudio clínico fue independiente del nivel de comprensión y entendimiento del estudio18. A su vez, el testigo resultó más útil en los participantes con menor nivel de educación (68.1%), lo que avalaría el requisito en nuestro país de la participa ción de un testigo independiente según la vulnerabilidad educativa del participante, más allá de la vulnerabilidad social, cultural y económica4,6.
Es pertinente cuestionarse si un consentimiento infor mado extenso y complejo es el correcto para que nuestra población pueda comprenderlo y así tomar una decisión libre y voluntaria. También es relevante preguntarse, sobre todo en estudios de larga duración, si un solo con sentimiento al inicio del estudio es suficiente19.
Estudios aleatorizados han demostrado que consen timientos informados menos extensos y más simples de leer no obstaculizaron ni mejoraron la comprensión de la información, tampoco tuvieron impacto en la satisfacción con el proceso de consentimiento informado, lo que res palda los esfuerzos continuos para mejorar el proceso de consentimiento informado20,21.
En lo relativo al grado de satisfacción con la participa ción en el estudio, este fue alto en los diferentes aspectos evaluados. No obstante, la encuesta mostró que casi 1 de cada 4 pacientes tenía un grado bajo de satisfacción con la atención y resolución de eventos adversos duran te el estudio. Este resultado merece ser investigado en mayor detalle y destaca la relevancia que tiene durante el transcurso del estudio asegurarse que los pacientes no tengan preguntas o dudas que no se hayan abordado adecuadamente, en especial en lo referido a los eventos adversos.
En forma adicional el 97% de los sujetos expresó su voluntad de volver a participar en estudios futuros, y el 98% recomendaría a otras personas participar en ensayos clínicos. Estos resultados coinciden con la encuesta reali zada en EE.UU. a 278 participantes (55% afroamericanos y 29% blancos no hispanos) que indicaron que la mayoría de los participantes calificaron su satisfacción como muy alta9, y con otros estudios realizados en la Argentina que encontraron resultados similares12,18.
En nuestro estudio el puntaje de satisfacción con la participación se asoció, en forma independiente de la edad y el nivel socioeconómico, con el deseo de volver a participar en un ensayo clínico (OR 13.6: IC95%: 4.7-39.1, p < 0.001) y con la recomendación a un tercero para que también participe (OR 16.7: IC95%: 4.4-63.4, p < 0.001).
Los hallazgos están alineados con otros estudios si milares internacionales que señalan que las expectativas previas y las actitudes generales hacia la atención médica y la investigación, junto con el grado de satisfacción con el personal de investigación y con el ensayo específico en sí, son determinantes importantes para querer participar en ensayos futuros9,10,22.
Normalmente, las encuestas voluntarias de opinión suelen ser contestadas cuando no se cumplieron las expectativas generadas. Este no fue el caso. La can tidad de encuestas recibidas muestra que los partici pantes se involucran y expresan voluntariamente sus opiniones, las cuales deben ser tenidas en cuenta por investigadores, agencias regulatorias, comités de ética y patrocinadores, los que, a su vez, deberían trabajar mancomunadamente para responder eficazmente a las expectativas y demandas de los participantes en ensayos clínicos.
Nuestro estudio tiene varias limitaciones que deben ser señaladas. La limitación principal está relacionada con el diseño observacional y voluntario. La posibilidad de que exista un sesgo de selección en base a las carac terísticas de las personas que voluntariamente completan y envían la encuesta es la principal limitante de nuestro estudio. Sin embargo, la elevada cantidad de encuestas recibidas, disminuye la posibilidad de este sesgo. En forma adicional, en algunas preguntas de la encuesta las respuestas no están adecuadamente balanceadas y tienden a predominar las respuestas positivas sobre las negativas, lo que puede introducir un sesgo adicional de diseño. El error en las respuestas es otro tipo de sesgo posible dado que las encuestas son totalmente volunta rias, anónimas y realizadas sin ningún tipo de control de calidad o posibilidad de clarificación de datos. Se han simplificado las preguntas de la encuesta para minimizar este sesgo. Los estudios de observación tienen un mayor riesgo de datos faltantes. A pesar que se han excluido las encuestas con datos faltantes críticos el porcentaje no evaluable fue bajo (8.5%).