PUNTOS CLAVE
Conocimiento actual
• La amiloidosis plantea un desafío en el manejo clínico y en el desarrollo de guías de práctica, dada la natu raleza poco frecuente de la enfermedad, la escasez de tratamientos disponibles y aprobados por los entes reguladores.
• El manejo de los pacientes con amiloidosis AL requiere un abordaje multidisciplinario.
Contribución del artículo
• En los últimos años se desarrollaron nuevas drogas para el tratamiento de los pacientes con amiloidosis AL.
• La evidencia científica disponible es limitada y de mo derada-baja calidad. Existe una necesidad urgente de generar información científica de calidad para guiar la práctica clínica y la toma de decisiones
La amiloidosis por cadenas livianas de inmunoglobu linas (AL) es una enfermedad crónica, poco frecuente, subdiagnosticada, causada por el depósito de proteínas mal plegadas en diversos tejidos1,2. Sus manifestacio nes clínicas dependen del órgano donde se deposite la proteína, pudiendo generar proteinuria, insuficiencia renal, insuficiencia cardiaca, hepatomegalia, neuropatía sensitiva, motora y/o autonómica, entre otros3.
La incidencia de amiloidosis AL en EE.UU. es de 5-12 personas por millón por año4. En Argentina se estima en 11 personas por millón por año5, sin embargo, la inci dencia podría ser mayor en Latinoamérica donde existen escasos datos6-9.
El objetivo del tratamiento en la amiloidosis AL es erradicar el clon de células plasmáticas responsables de la producción de la cadena liviana responsable del daño o, de no ser posible, lograr la mayor profundidad de respuesta hematológica y de órganos para retrasar la recaída de la enfermedad3,10. El tratamiento de primera línea se basa en esquemas con bortezomib seguido de trasplante de células progenitoras hematopoyéticas (TCPH). Sin embargo, solo el 20% de los pacientes son elegibles para el mismo. En los pacientes no candidatos a TCPH, los regímenes terapéuticos se basan en la combi nación de dexametasona, agentes alquilantes, inhibidores de proteasomas, inmunomoduladores o daratumumab, guiándose en la estratificación de riesgo, las comorbili dades y la funcionalidad del paciente11.
América Latina cuenta con una realidad distinta res pecto a los países del norte y Europa. La disponibilidad de recursos, así como la información sobre el tratamiento de la amiloidosis en países en desarrollo es limitada. En Argentina, la amiloidosis AL se encuentra enmarcada dentro de la ley 26.689 de enfermedades poco frecuen tes12-14. Sin embargo, su manejo respecto al diagnóstico y tratamiento implica un desafío clínico y en el desarrollo de guías de práctica, justificado por la evidencia científi ca de moderada-baja calidad, la falta de aprobación de medicamentos específicos por los entes reguladores y los altos costos con precios no regulables de los diferentes tratamientos.
Nuestro objetivo fue elaborar recomendaciones basa das en la evidencia, mediante un proceso de elaboración validado, en conjunto con la experiencia del panel de expertos. Queremos destacar que nuestras recomen daciones se adaptan a los recursos disponibles y las limitaciones económicas propias de los países Latinoa mericanos, para permitir realizar un adecuado manejo de pacientes con amiloidosis AL en la atención especializada local. Los beneficios esperados son: sistematizar el tra tamiento en la atención especializada, unificar el manejo entre los diferentes profesionales de la salud y mejorar los resultados en la atención. La población de estudio son pacientes con diagnóstico de amiloidosis AL. Los usuarios principales previstos de las recomendaciones son los profesionales generalistas de salud, clínicos, cardiólogos, hematólogos, inmunólogos clínicos, nefró logos y bioquímicos, en el ámbito de centros de atención especializada de Latinoamérica.
Métodos
Las recomendaciones fueron confeccionadas basándose en estándares de calidad metodológica, dada la ausencia de guías locales de tratamiento de la amiloidosis AL. El equipo elaborador se conformó por un grupo interdisciplinario de profesionales del Hospital Italiano de Buenos Aires, con ex periencia disciplinar y metodológica.
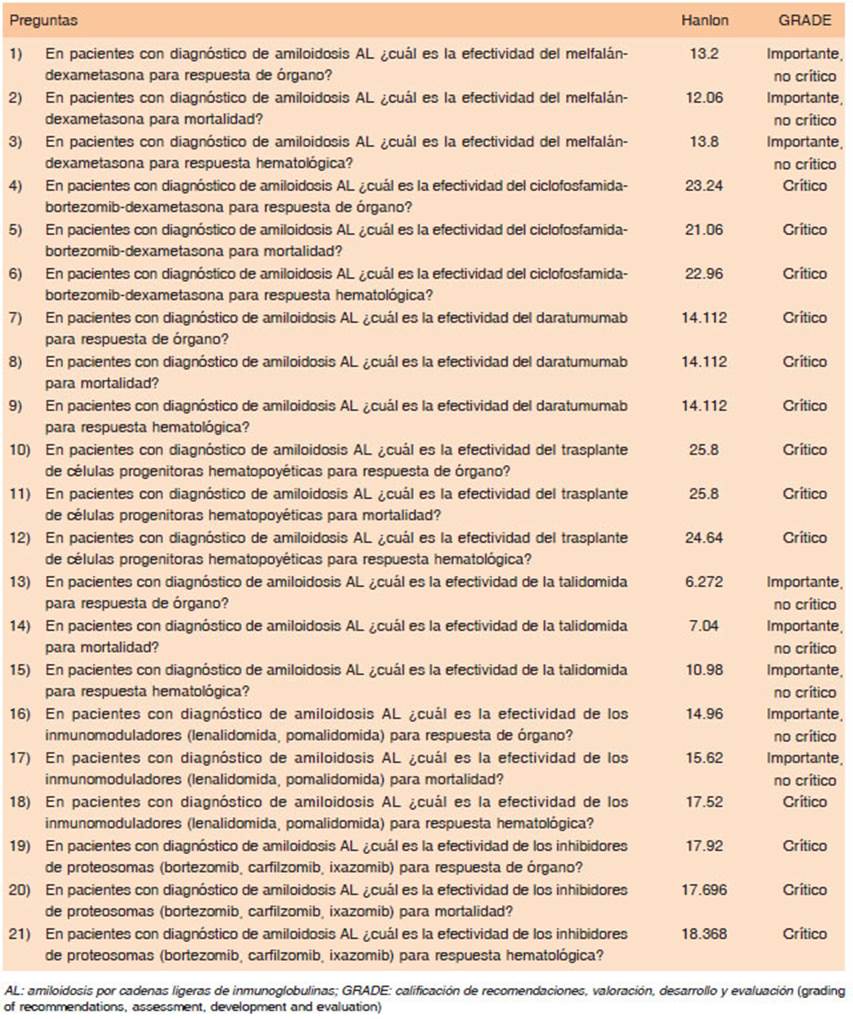
Se generó un listado de preguntas con formato PICO15 centradas en la efectividad y seguridad del tratamiento para la amiloidosis AL. Las preguntas se priorizaron utilizando el método Hanlon16 y se clasificaron los desenlaces según su importancia con la metodología propuesta por GRADE: 7 a 9: crítico; 4 a 6: importante; 1 a 3 de importancia limitada15 (Anexo 1).
Los criterios de elegibilidad, la estrategia de búsqueda y la extracción de datos fueron definidos previamente por el equipo elaborador.
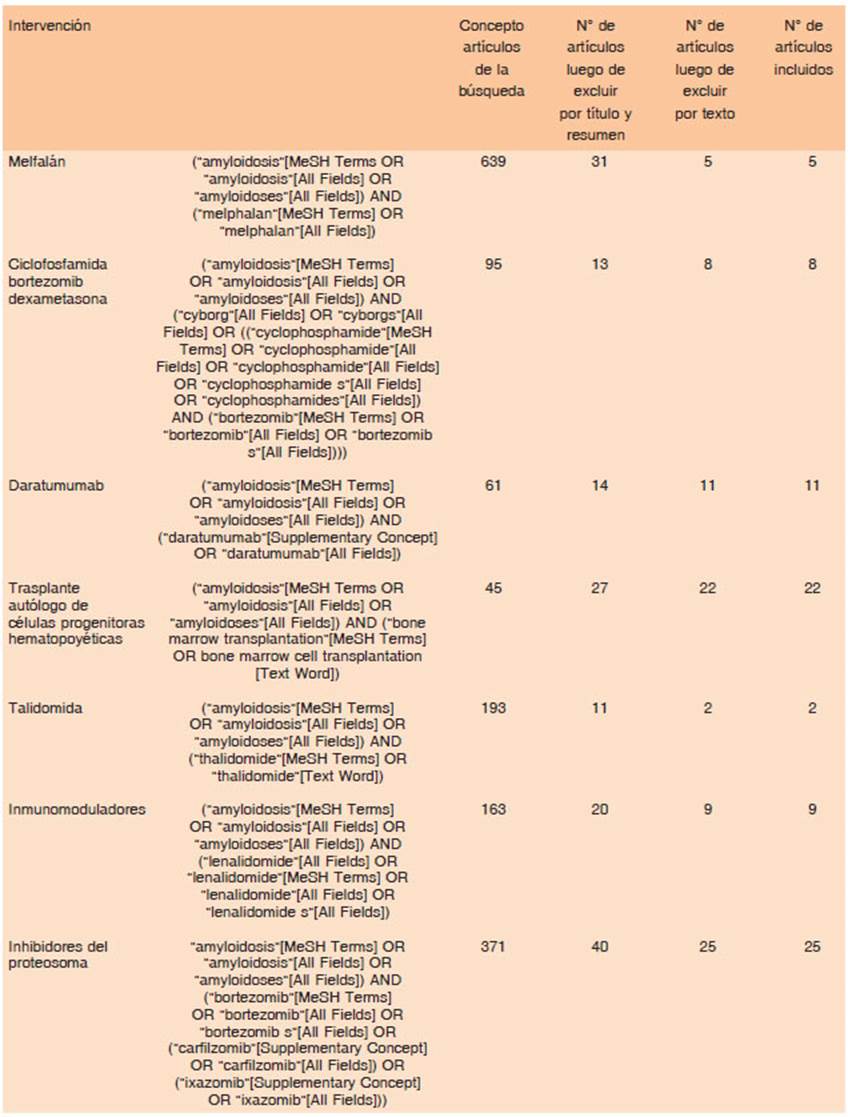
Se realizó un protocolo de búsqueda bibliográfica siguiendo las recomendaciones de las guías NICE17 utilizando el repo sitorio de citas PubMed (https://pubmed.ncbi.nlm.nih.gov/), Cochrane (https://www.cochranelibrary.com/) y Epistemonikos (https://www.epistemonikos.org/es), durante julio-agosto del 2020, en inglés y español, con inclusión de los artículos hasta 2020. Se seleccionaron los artículos que involucraron seres humanos adultos, con diagnóstico de amiloidosis AL, que recibieron tratamiento con los fármacos contenidos en las preguntas PICO. Se incluyeron revisiones sistemáticas, estudios experimentales u observacionales tipo cohorte, trans versal, casos y controles, prospectivos o retrospectivos. Se excluyeron estudios en animales, de investigación básica y cartas al editor.
Dos evaluadores independientes realizaron la inclusión de artículos, seleccionando según título y resumen, mediante la plataforma Rayyan (https://rayyan.ai/). Luego, un evaluador revisó la evidencia utilizando las guías de reporte para cada diseño publicadas en Equator (https://www.equator-network.org/) e incluyó los artículos que cumplían con los criterios de redacción para cada guía de reporte (Anexo 2). Se realizó el resumen de la evidencia y se evaluó la calidad de cada artículo utilizando las siguientes herramientas: los estudios de cohorte con dos ramas de intervención se evaluaron con la herramienta “Riesgo de sesgo en estudios no aleatorios de intervenciones” (ROBINS-I)18; los ensayos clínicos alea torizados se evaluaron con la herramienta “Riesgo de sesgo” (RoB)19, las revisiones sistemáticas se evaluaron con la he rramienta de medición para evaluar revisiones sistemáticas (AMSTAR-2)20.
La evidencia se clasificó en alta, moderada, baja, muy baja calidad, según lo propuesto por la metodología GRADE21. Se elaboró un perfil de evidencia, contemplando el resumen y la calidad de la misma. En la elaboración de las recomen daciones se contemplaron todos los dominios del marco de traspaso de la evidencia a la decisión propuesto por GRADE para preguntas terapéuticas (Anexo 3). Las recomendaciones se redactaron a partir del perfil de la evidencia, la opinión del panel de expertos y situada en el contexto de países en desarrollo.
Cada etapa de elaboración de las recomendaciones, su de sarrollo completo y el resumen de la evidencia se encuentran disponibles en el repositorio institucional Trovare22.
Cuestiones generales necesarias para el uso, la interpretación e implementación de las recomendaciones
Las recomendaciones cubren los aspectos priorizados en el tratamiento de adultos (18 años o más), referidos a la aten ción especializada, con diagnóstico de amiloidosis AL. Estas recomendaciones son relevantes para todos los profesionales de la salud y los involucrados en las políticas sanitarias, para asegurar que existan los acuerdos necesarios para brindar la atención adecuada.
En estas recomendaciones no se aborda el tratamiento de soporte.
Estas recomendaciones no reemplazan los conocimientos y habilidades del médico tratante. Los autores limitan su responsabilidad, siendo las recomendaciones una orientación al tratamiento sin sustituir el juicio médico actuante en cada caso.
Esta guía asume que:
- La experiencia clínica del panel deriva de la interacción con los pacientes.
- El médico tratante tiene experiencia en el tratamiento de pacientes con amiloidosis AL.
- Se evalúan los riesgos y beneficios de cada tratamiento.
- El tratamiento es indicado y permanece bajo supervisión de un médico con experiencia en el manejo de pacientes con amiloidosis AL.
- Los tratamientos se realizan según el mejor estándar de cuidado.
- Se evalúa la respuesta y toxicidad periódicamente para guiar dosis o cambio de terapéutica.
- Las recomendaciones están sujetas a actualización según la realidad local y la evidencia científica disponible.
Revisión
El proceso de escritura del desarrollo completo de la guía sigue los lineamientos de “Valoración de las directrices para la investigación y la evaluación” (AGREE)23 y para la publicación en esta revista se adecuó el manuscrito para la guía RIGHT24.
Limitaciones
Hay pocos estudios aleatorizados controlados que investiguen el tratamiento más apropiado para la amiloidosis en diferentes contextos. El diseño de la estrategia de tratamiento se basa en opiniones de expertos, principalmente basadas en ensa yos observacionales. Actualmente, los diferentes fármacos utilizados en la amiloidosis AL deben ser usados off-label o en el contexto de un ensayo clínico.
Las recomendaciones están sujetas a actualización según la realidad local y la evidencia científica disponible.
Resultados
Recomendaciones
Durante el proceso de elaboración, se generaron 11 recomendaciones.
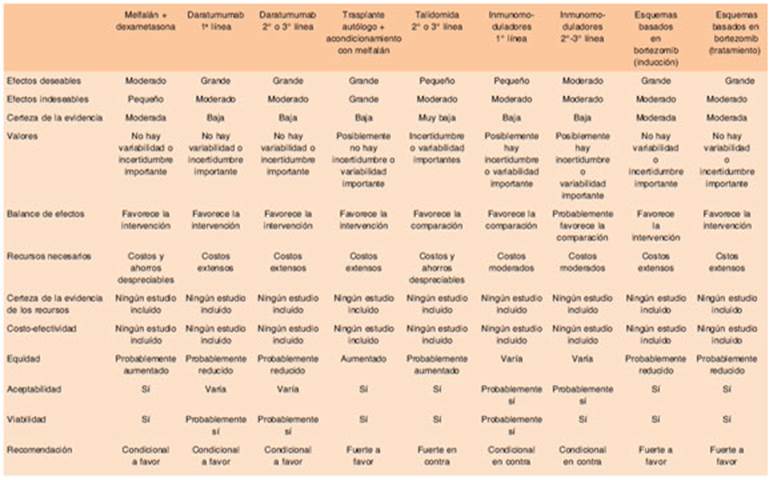
Las recomendaciones se presentan con su dirección: a favor o en contra de la intervención; con su fuerza: fuerte “Se recomienda”, débil o condicional “Se sugiere”; y con la calidad de evidencia que la sustenta: muy baja, baja, moderada o alta21. De las mismas se desprende el algoritmo terapéutico (Figs. 1 y 2.).
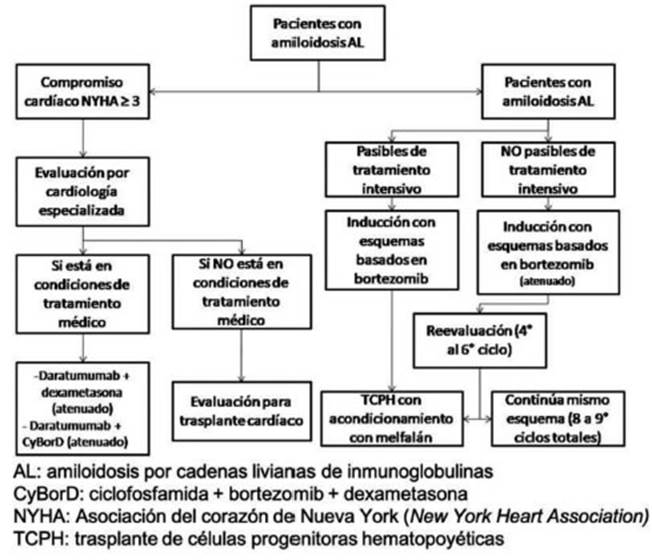
Fig. 1 Algoritmo de tratamiento de primera línea para la amiloidosis por depósito de cadenas livianas de inmunoglobulinas (AL)
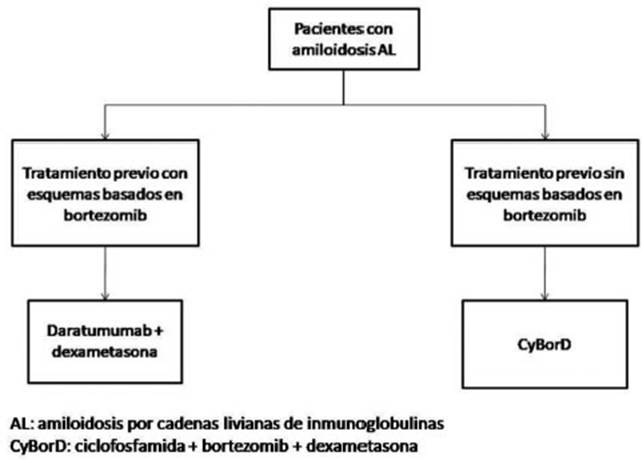
Fig. 2 Algoritmo de tratamiento de segunda o tercera línea para la amiloidosis por depósito de cadenas livianas de inmunoglobulinas (AL)
Las recomendaciones claves se indican entre paréntesis.
Para la formulación de cada recomendación se tuvo en cuenta la opinión del panel en cuanto a las creencias de los valores y las preferencias de las personas con amiloidosis.
Se tuvo en cuenta la opinión del panel en cuanto a las implicaciones de costos y recursos en la formulación de recomendaciones.
Se obtuvo el consenso de expertos mayor al 75% en cuanto a las implicancias de costos, recursos, creencias y preferencias de las personas con amiloidosis.
Se presentan 4 buenas prácticas, las cuales represen tan consideraciones del panel de expertos.
Buena práctica 1
Al momento de elegir el tratamiento en pacientes con diagnóstico de amiloidosis AL se debe tener en cuenta el/ los órgano/s comprometido/s y considerar las toxicidades y eventos adversos asociados a éste.
Buena práctica 2
Los pacientes con diagnóstico de amiloidosis AL, jóvenes, sin comorbilidades y buen estado basal, pueden recibir esquemas intensivos seguido de TCPH. Los pacientes frágiles (edad avanzada o comorbilidades) o con daño de órgano limitante, deben realizar esquemas ajustados, para lograr un balance entre efectividad y toxicidad10.
Buena práctica 3
En pacientes con diagnóstico de amiloidosis AL, se debe evaluar la elegibilidad para el TCPH versus la terapia es tándar intensiva o baja intensidad, basándose en el daño de órgano, las comorbilidades y la experiencia del centro.
Buena práctica 4
En pacientes con diagnóstico de amiloidosis AL se debe evaluar la efectividad del tratamiento, siendo el objetivo lograr al menos una muy buena respuesta parcial10. En los pacientes que tienen baja diferencia entre la cadena liviana libre involucrada y no involucrada (dFLC: 20 mg/L- 50 mg/L) la respuesta debe ser una dFLC menor a 10 mg/L. La serum m spike, cuando está presente, ayuda a evaluar la respuesta en los pacientes que tienen bajos niveles de cadenas livianas circulando. En los pacientes con insuficiencia renal la respuesta es desafiante y re quiere a veces biopsia de médula ósea.
Recomendación 1 (recomendación clave)
En pacientes con amiloidosis AL seleccionados, se re comienda el trasplante autólogo de células progenitoras hematopoyéticas posterior a una inducción con esquemas basados en bortezomib, dado que probablemente profun dice la respuesta hematológica y de órgano, la durabilidad de las mismas y mejore la sobrevida.
Calidad de la evidencia: moderada
Fuerza: fuerte a favor
Justificación
- La calidad global de la evidencia disponible es mo derada, basada en un ensayo clínico unicéntrico, abierto, y estudios observacionales. Los esquemas basados en bortezomib son variables respecto a la dosis, frecuencia, vía de administración, números de ciclos, combinación con otras drogas y el estado basal de los pacientes lo que introduce heterogeneidad entre los estudios, afectando la validez externa.
- El balance entre efectos deseables e indeseables es a favor de los primeros.
Respecto a los efectos deseables, en un estudio de cohorte en el que se comparó la inducción con esquemas basados en bortezomib versus no inducción, el HR ajus tado para sobrevida global fue de 0.17 (IC95% 0.04-0.76) a favor de la inducción25. En un ensayo clínico de fase III, abierto, la tasa de respuesta hematológica a los 12 meses fue del 86% para el grupo que recibió inducción con bor tezomib versus 54% para los que no recibieron inducción, RR: 1.60 (IC95% 1.10-2.33) y la tasa de sobrevida a los 24 meses posteriores al inicio del tratamiento fue del 95% en el grupo de inducción versus el 69% en el grupo de no inducción (p 0.03)26. No se encontraron diferencias en los distintos estudios con respecto a la respuesta del órgano.
Respecto a los efectos indeseables, el evento adverso más frecuentemente informado asociado al bortezomib fue la neuropatía sensorial periférica con o sin dolor neu ropático, exacerbación de hipotensión ortostática, edema periférico y estreñimiento o diarrea27.
- No se identificaron estudios que consideren los valo res y preferencias de los pacientes. El panel de expertos consideró que no hay variabilidad en la aceptación del tratamiento, justificado en los efectos deseables grandes, con calidad de evidencia moderada.
- Con respecto a los recursos necesarios, los esque mas basados en bortezomib deben ser administrados en centros especializados, que manejen adecuadamente las infusiones o aplicaciones de la droga. El costo total, si bien dependerá de la combinación seleccionada, es elevado, pudiendo dificultar el acceso en determinados ámbitos. El TCPH debe realizarse en un centro con experiencia.
- Respecto a la aplicabilidad del tratamiento en Argenti na, existen centros especializados en trasplante autólogo tanto en el ámbito público como privado.
Recomendación 2 (recomendación clave)
En pacientes con amiloidosis AL seleccionados en centros especializados, se recomienda el trasplante autólogo de células progenitoras hematopoyéticas con acondi cionamiento con melfalán, ya que podría profundizar la respuesta hematológica y de órgano, la durabilidad de las mismas y mejorar la sobrevida.
Calidad de la evidencia: baja
Fuerza: fuerte a favor
Justificación
La calidad de la evidencia disponible es baja, basada en un ensayo clínico aleatorizado, multicéntrico, abierto, dos ensayos clínicos de una sola rama de intervención y estudios observacionales, en su mayoría retrospectivos, de una sola rama de intervención. El acondicionamiento con melfalán es variable respecto a la dosis. Asimismo, en algunos de los estudios, el trasplante autólogo de células progenitoras hematopoyéticas se acompañó por inducción. Ambos escenarios afectan la validez externa de los resultados.
- Los efectos deseables e indeseables son grandes. Sin embargo, el panel de expertos consideró que se fa vorece la intervención, justificado porque los efectos inde seables son manejables cuando el trasplante se realiza en centros especializados y acreditados. Un ensayo clínico de fase III, aleatorizado, abierto, comunicó resultados desfavorables para el trasplante autólogo comparado con la quimioterapia convencional. Sin embargo, la tasa de mortalidad relacionada al trasplante fue elevada, lo que podría justificar los resultados respecto a la sobre vida global28. En un estudio observacional que comparó quimioterapia sola versus TCPH más melfalán en altas dosis, el HR para sobrevida global fue de 5.69 (IC95% 1.71-18.98) a favor del trasplante autólogo más melfalán en altas dosis. La tasa de respuesta hematológica fue de 72% para TCPH y 55% para quimioterapia sola (RR 0.76; IC95% 0.53-1.10), la tasa de respuesta completa fue de 28% para TCPH y 16% para quimioterapias sola (RR 0.58; IC95% 0.23-1.47)29.
Con respecto a los efectos indeseables, los más frecuentes fueron las citopenias, mucositis, náuseas y vómitos30. Se informaron efectos indeseables a nivel car díaco, siendo las arritmias lo más frecuente, en población con compromiso cardíaco basal31. La tasa de mortalidad relacionada al trasplante dependerá de los criterios de elegibilidad para el trasplante y la experiencia del centro en trasplante.
- No se identificaron estudios que consideren los valores y preferencias de los pacientes. El panel de ex pertos consideró que posiblemente no hay variabilidad en la aceptación del tratamiento. Los pacientes, por lo general, aceptan en todos los casos (o la gran mayoría), trasplantarse.
- Con respecto a los recursos necesarios, el TCPH con acondicionamiento con melfalán debe ser realizado en centros especializados, con experiencia en trasplante y adecuado manejo del postoperatorio. Los costos son extensos.
- Respecto a la aplicabilidad del tratamiento en Argenti na, existen centros especializados en trasplante autólogo tanto en el ámbito público como privado.
Recomendación 3 (recomendación clave)
En pacientes con amiloidosis AL no elegibles para tras plante autólogo de células progenitoras hematopoyéticas, se recomienda el tratamiento de primera línea con regíme nes basados en bortezomib: bortezomib + dexametasona; CyBorD (ciclofosfamida + bortezomib + dexametasona), bortezomib + melfalan + dexametasona, dado que pro bablemente logre mayor tasa de respuesta hematológica, respuesta de órgano y aumente la sobrevida.
Calidad de la evidencia: moderada
Fuerza: fuerte a favor
Justificación
- La calidad de la evidencia disponible es moderada, basada principalmente en un ensayo clínico de fase III, aleatorizado, multicéntrico, abierto. Existen revisiones sistemáticas con calidad de evidencia baja. Los estudios observacionales son, en su mayoría, de una sola rama de intervención. Los esquemas basados en bortezomib son variables respecto a la dosis, frecuencia, vía de administración, números de ciclos, combinación con otras drogas y el estado basal de los pacientes lo que introduce heterogeneidad entre los estudios, afectando la validez externa.
- El balance entre efectos deseables e indeseables es a favor de los primeros.
- Respecto a los efectos deseables, en un ensayo clí nico, el esquema bortezomib + melfalán + dexametasona logró una tasa de respuesta hematológica a los 3 meses de 79% versus 52% para el grupo control, con tasas más altas de muy buena respuesta parcial o respuesta completa (64% versus 39%; HR 2.47; IC95% 1.30-4.71) y una mejora en la sobrevida global (HR 0.50; IC95% 0.27-0.90)32.
Respecto a los efectos indeseables, los eventos ad versos de grado 3 y 4 más comunes fueron citopenia, neuropatía periférica e insuficiencia cardíaca y ocurrie ron en el 20% en el grupo de bortezomib + melfalán + dexametasona frente al 10% de los ciclos realizados en el grupo control32.
- No se identificaron estudios que consideren los valo res y preferencias de los pacientes. El panel de expertos consideró que no hay variabilidad en la aceptación del tratamiento, justificado por sus efectos deseables mode rados, con calidad de evidencia moderada.
- Con respecto a los recursos necesarios, los esque mas basados en bortezomib deben ser administrados en centros especializados, que manejen adecuadamente las infusiones o aplicaciones de la droga. El costo del bortezomib es elevado, pudiendo dificultar el acceso en determinados ámbitos. El costo total del esquema depen derá de la combinación seleccionada.
Recomendación 4 (recomendación clave)
En pacientes con amiloidosis AL no elegibles para tras plante autólogo de células progenitoras hematopoyéticas y con contraindicación o inaccesibilidad al bortezomib, se recomienda el tratamiento de primera línea con agentes alquilantes (melfalán) asociados a corticoides dado que es probable que logre la respuesta hematológica y la respuesta de órgano y mejore la sobrevida.
Calidad de la evidencia: moderada
Fuerza: fuerte a favor
Justificación
- La calidad de la evidencia disponible es moderada, basada en una revisión sistemática de calidad críticamen te baja, dos ensayos clínicos aleatorizados, multicéntricos, abiertos y estudios observacionales. Las dosis de melfalán y de dexametasona fueron variables intra e interestudios lo que influyó en la validez externa de los resultados.
- El balance entre efectos deseables e indeseables es a favor de los primeros. En un ensayo clínico se comparó melfalán oral + dexametasona versus altas dosis de mel falán con trasplante de células progenitoras hematopoyé ticas. La mediana de sobrevida global fue de 57 meses en el grupo de melfalán + dexametasona y 22 meses en el grupo de altas dosis de melfalán con trasplante de células progenitoras hematopoyéticas (HR 0.57, IC95% 0.32-0.99). Sin embargo, la tasa de mortalidad relaciona da al trasplante fue del 24%, lo que podría justificar los resultados. La tasa de respuesta hematológica fue de 52% (IC95% 37%-66%) para el grupo de melfalán oral con dexametasona y 36% (IC95% 23%-51%) para el grupo de altas dosis de melfalán con trasplante de células progeni toras hematopoyéticas28. En un estudio aleatorizado, en el que se comparó el bortezomib + melfalán + dexametasona versus melfalán + dexametasona, la sobrevida global para los pacientes tratados con melfalán + dexametasona fue de 34 meses, la tasa de respuesta hematológica completa al finalizar el tercer ciclo fue de 52% para el grupo de melfalán + dexametasona versus 79% para el grupo de bortezomib ´melfalán + dexametasona (p 0.002); a los 9 meses, la tasa de respuesta cardiaca fue de 28% (IC95% 14%-45%) y la tasa de respuesta renal de 43% (IC95% 26%-61%) sin diferencias entre grupos32.
Con respecto a los efectos indeseables, en un estudio observacional retrospectivo, que incluyó 259 pacientes tratados con melfalán + dexametasona, con dosis com pletas o atenuadas, el 18% experimentó eventos adversos grados 3 o 4, siendo el más frecuente la retención de líquidos33.
- No se identificaron estudios que consideren los valo res y preferencias de los pacientes. El panel de expertos consideró que no hay variabilidad en la aceptación del tratamiento, justificado por la administración oral de ambos fármacos que componen el esquema, con buena tolerancia.
- Con respecto a los recursos necesarios, el esquema melfalán + dexametasona se administra por vía oral, su costo es accesible en comparación con otras terapéuticas utilizadas para el tratamiento de la amiloidosis AL.
- Actualmente, existe una tendencia al uso de fármacos más novedosos, lo que puede dificultar la disponibilidad del melfalán oral.
Recomendación 5
En pacientes con amiloidosis AL, se sugiere el tratamiento de primera línea con regímenes basados en daratumumab (daratumumab-CyborD), siempre que esté disponible para su uso, ya que podría lograr la respuesta hematológica, la respuesta de órgano y mejorar la sobrevida.
Calidad de la evidencia: baja
Fuerza: condicional a favor
Justificación
- La calidad de la evidencia disponible es baja, basada en un análisis de seguridad de un ensayo clínico de fase III, multicéntrico, abierto. Los resultados de eficacia si bien son robustos, son preliminares.
- El balance entre efectos deseables e indeseables es a favor de los primeros. En el reporte preliminar del ensayo clínico ANDROMEDA, se incluyeron 26 pacientes con amiloidosis AL. La tasa de respuesta hematológica fue de 96% (IC95% 82%-99%); la tasa de respuesta cardíaca fue de 53% (IC95% 28%-77%) y la tasa de respuesta renal fue de 83% (IC95% 56%-96%). Los efectos indeseables se reportaron en un 43% (IC95% 24%-63%), siendo los más frecuentes las reacciones a la infusión, diarrea, fa tiga y edemas periféricos. Los eventos adversos serios más frecuentes fueron la lesión renal aguda, caídas, neumonía y celulitis no relacionada al sitio de infusión34. El daratumumab presenta un perfil seguro en pacientes con mieloma múltiple y compromiso renal y/o cardíaco, siendo entonces de particular interés en los pacientes con amiloidosis AL35.
- No se identificaron estudios que consideren los valo res y preferencias de los pacientes. El panel de expertos consideró que no hay variabilidad en la aceptación del tra tamiento, justificado por sus efectos deseables grandes.
- Con respecto a los recursos necesarios, el daratumu mab se debe administrar en un centro especializado, que cuente con unidad de terapia intensiva/unidad coronaria por eventuales eventos adversos. Su costo es elevado, con calidad de evidencia baja, lo que podría dificultar el financiamiento. Asimismo, los costos elevados podrían dificultar el acceso en ciertos ámbitos.
Recomendación 6 (recomendación clave)
En pacientes con amiloidosis AL con compromiso car díaco NYHA 3-4, se recomienda el tratamiento de pri mera línea con esquemas que incluyan daratumumab (daratumumab-dexametasona, daratumumab-Cybord) para respuesta hematológica, de órgano y sobrevida, siempre que esté disponible para su uso.
Calidad de la evidencia: baja
Fuerza: fuerte a favor
Justificación
- La calidad de la evidencia disponible es baja, basada en un análisis de seguridad de un ensayo clínico de fase III, multicéntrico, abierto. Los resultados de eficacia si bien son robustos, son preliminares.
- El balance entre efectos deseables e indeseables es a favor de los primeros. En el reporte preliminar del ensayo clínico ANDROMEDA, se incluyeron 26 pacientes con amiloidosis AL. La tasa de respuesta hematológica fue de 96% (IC95% 82%-99%); la tasa de respuesta cardíaca fue de 53% (IC95% 28%-77%) y la tasa de respuesta renal fue de 83% (IC95% 56%-96%). Los efectos indeseables se informaron en un 43% (IC95% 24%-63%), siendo los más frecuentes las reacciones a la infusión, diarrea, fatiga y edemas periféricos. Los eventos adversos serios más frecuentes fueron la lesión renal aguda, caídas, neumonía y celulitis no relacionada al sitio de infusión34. El daratumumab presenta un perfil seguro en pacientes con mieloma múltiple y compromiso renal y/o cardíaco, siendo entonces de particular interés en los pacientes con amiloidosis AL35.
- No se identificaron estudios que consideren los valo res y preferencias de los pacientes. El panel de expertos consideró que no hay variabilidad en la aceptación del tra tamiento, justificado por sus efectos deseables grandes.
- Con respecto a los recursos necesarios, el daratumu mab se debe administrar en un centro especializado, que cuente con unidad de terapia intensiva/unidad coronaria por eventuales eventos adversos. Su costo es elevado, con calidad de evidencia baja, lo que podría dificultar el financiamiento. Asimismo, los costos elevados podrían dificultar el acceso en ciertos ámbitos.
Recomendación 7
En pacientes con amiloidosis AL no elegibles para tras plante autólogo de células progenitoras hematopoyéticas, no se sugiere el tratamiento como primera línea con inmunomoduladores (lenalidomida, pomalidomida) para lograr la respuesta hematológica, la respuesta de órgano y mejorar la sobrevida.
Calidad de la evidencia: baja
Fuerza: condicional en contra
Justificación
- La calidad de la evidencia disponible es baja, basa da en un estudio observacional, retrospectivo, en el que se usa un esquema con lenalidomida + dexametasona + bortezomib, siendo el último una piedra angular del tratamiento, lo que puede justificar los resultados. El grupo control es no concurrente, con diferente tiempo de seguimiento.
- El balance entre efectos deseables e indeseables es a favor de los segundos. En cuanto a los efectos deseables, si bien se comunicó una respuesta hematológica del 88%, el esquema de tratamiento incluye al bortezomib, lo que puede estar sobreestimando los resultados. En cuanto a los efectos indeseables, los más frecuentes fueron las erupciones cutáneas, las infecciones, las alteraciones hematológicas (citopenias) y la trombosis36.
- No se identificaron estudios que consideren los valo res y preferencias de los pacientes El panel de expertos consideró que posiblemente hay incertidumbre o varia bilidad importantes, justificado por su baja efectividad y mala tolerancia.
- Con respecto a los recursos necesarios, los inmu nomoduladores, si bien se administran por vía oral, el tratamiento debe ser indicado y supervisado por un mé dico especializado que conozca el manejo adecuado de la droga y con acceso a centro especializado. Su costo es elevado, con calidad de evidencia baja, lo que podría dificultar el financiamiento.
- El uso de inmunomoduladores como tratamiento de primera línea para la amiloidosis AL debería reservarse cuando no haya otro tratamiento disponible.
Recomendación 8 (recomendación clave)
En pacientes con amiloidosis AL refractarios o con recaí da, no elegibles para trasplante autólogo de células pro genitoras hematopoyéticas, se recomienda el tratamiento con regímenes basados en bortezomib: bortezomib + dexametasona, CyBorD (ciclofosfamida + bortezomib + dexametasona), bortezomib + melfalán + dexametasona, siempre que no haya recibido esquemas basados en bortezomib como tratamiento previo, dado que proba blemente logre mayor tasa de respuesta hematológica, respuesta de órgano y aumente la sobrevida.
Calidad de la evidencia: moderada
Fuerza: fuerte a favor
Justificación
- La calidad de la evidencia disponible es moderada, basada principalmente en un ensayo clínico de fase III, aleatorizado, multicéntrico, abierto. Existen revisiones sistemáticas con calidad de evidencia baja. Los estudios observacionales son, la mayoría, de una sola rama de intervención. Los esquemas basados en bortezomib son variables respecto a la dosis, frecuencia, vía de adminis tración, números de ciclos, combinación con otras drogas y el estado basal de los pacientes lo que introduce hetero geneidad entre los estudios, afectando la validez externa.
- El balance entre efectos deseables e indeseables es a favor de los primeros.
Respecto a los efectos deseables, en el ensayo clínico, el esquema bortezomib + melfalán + dexametasona logró una tasa de respuesta hematológica a los 3 meses de 79% versus 52% para el grupo control (p 0.002), con tasas más altas de muy buena respuesta parcial o respuesta completa (64% versus 39%; HR 2.47; IC95% 1.30-4.71) y una mejora en la sobrevida (HR 0.50; IC95%, 0.27-0.90).
Respecto a los efectos indeseables, los eventos ad versos de grado 3 y 4 (los más comunes fueron citopenia, neuropatía periférica e insuficiencia cardíaca) en el grupo de bortezomib + melfalán + dexametasona ocurrieron en el 20% frente al 10% de los ciclos realizados en el grupo control32.
- No se identificaron estudios que consideren los valo res y preferencias de los pacientes. El panel de expertos consideró que no hay variabilidad en la aceptación del tratamiento, justificado por sus efectos deseables mode rados, con calidad de evidencia moderada.
- Con respecto a los recursos necesarios, los esque mas basados en bortezomib deben ser administrados en centros especializados, que manejen adecuadamente las infusiones o aplicaciones de la droga. El costo del bortezomib es elevado, pudiendo dificultar el acceso en determinados ámbitos. El costo total del esquema depen derá de la combinación seleccionada.
Recomendación 9
En pacientes con amiloidosis AL refractarios o con recaí da, se sugiere el tratamiento con daratumumab, siempre que esté disponible para su uso, ya que podría lograr la respuesta hematológica, la respuesta de órgano y mejorar la sobrevida.
Calidad de la evidencia: baja
Fuerza: condicional a favor
Justificación
- La calidad de la evidencia disponible es baja, ba sada en estudios observacionales, siendo la mayoría con tiempo de seguimiento corto y de una sola rama de intervención.
- El balance entre efectos deseables e indeseables es a favor de los primeros. En un estudio observacional, prospectivo, multicéntrico, en el que se incluyeron 72 pacientes, la sobrevida global al año fue del 95%, la tasa de respuesta hematológica fue de 83% (IC95% 75-92), la tasa de respuesta cardíaca fue de 29% (IC95% 15-45) y la tasa de respuesta renal de 60% (IC95% 45-76). En cuanto a los efectos indeseables, el 19% presentó eventos adversos grado 337. En la administración endovenosa, el evento adverso más frecuente fue la reacción alérgica a la infusión con presentación variable (desde prurito hasta anafilaxia). El daratumumab presenta un perfil seguro en pacientes con mieloma múltiple y compromiso renal y/o cardíaco, siendo entonces de particular interés en los pacientes con amiloidosis AL35.
- No se identificaron estudios que consideren los valo res y preferencias de los pacientes. El panel de expertos consideró que no hay variabilidad en la aceptación del tra tamiento, justificado por sus efectos deseables grandes.
- Con respecto a los recursos necesarios, el daratumu mab se debe administrar en un centro especializado, que cuente con unidad de terapia intensiva/unidad coronaria por eventuales eventos adversos y el manejo adecuado de volumen. Su costo es elevado, con calidad de evidencia baja, lo que podría dificultar el financiamiento. Los costos elevados podrían dificultar el acceso en ciertos ámbitos.
Recomendación 10
En pacientes con amiloidosis AL refractarios o con recaí da, no se sugiere el tratamiento con inmunomoduladores (lenalidomida, pomalidomida), para lograr la respuesta hematológica, la respuesta de órgano y mejorar la sobre vida, de haber otros fármacos disponibles.
Calidad de la evidencia: baja
Fuerza: condicional en contra
Justificación
- La calidad de la evidencia disponible es baja, basada en estudios observacionales, en su mayoría retrospecti vos, de una sola rama de intervención.
- Los efectos deseables son moderados con efectos indeseables moderados. En cuanto a los efectos deseables, en un estudio en el que se incluyeron 153 pacientes con diagnóstico de amiloidosis AL refractarios o con recaída, se les realizó terapia con pomalidomida + dexametasona. La mediana de sobrevida fue de 29 meses; la tasa de respuesta hematológica fue de 44% (IC95% 36%-53%); la tasa de res puesta cardíaca fue de 8% (IC95% 3%-15%) y la respuesta renal de 11% (IC95% 5%-19%). Con respecto a los efectos indeseables, los más frecuentes fueron las erupciones cutáneas, las infecciones, las alteraciones hematológicas (citopenias) y trombosis38. En un estudio en el que se utilizó lenalidomida como tratamiento en pacientes refractarios o con recaída, se reportó una hemorragia intracraneal fatal39.
- El panel de expertos consideró que posiblemente hay incertidumbre o variabilidad importantes, justificado por su baja efectividad y mala tolerancia.
- Con respecto a los recursos necesarios, los inmu nomoduladores, si bien se administran por vía oral, el tratamiento debe ser indicado y supervisado por un mé dico especializado que conozca el manejo adecuado de la droga y con acceso a centro especializado. Su costo es elevado, con calidad de evidencia baja, lo que podría dificultar el financiamiento.
- El uso de inmunomoduladores como tratamiento de segunda o tercera línea para la amiloidosis AL debería reservarse cuando no haya otro tratamiento disponible.
Recomendación 11 (recomendación clave)
En pacientes con amiloidosis AL refractarios o con recaí da, no se recomienda el tratamiento con talidomida para lograr la respuesta hematológica, la respuesta de órgano y mejorar la sobrevida.
Calidad de la evidencia: muy baja
Fuerza: fuerte en contra
Justificación
- La calidad de la evidencia disponible es muy baja, limitada a estudios observacionales descriptivos, con es caso número de pacientes, y con antigüedad de diez años.
- El balance entre efectos deseables e indeseables es a favor de los segundos. En un estudio observacional descriptivo en el que se incluyeron 31 pacientes con amiloidosis AL refractaria o con recaída, se administró talidomida + dexametasona. La tasa de respuesta he matológica fue de 48% (IC95% 30%-67%); la tasa de respuesta de órganos fue de 26% (IC95% 12%-45%). La toxicidad relacionada con el tratamiento fue del 65% (IC95% 45%-81%), siendo la bradicardia sintomática el evento adverso más frecuente.
- No se identificaron estudios que consideren los valo res y preferencias de los pacientes. El panel de expertos consideró que hay variabilidad importante en la aceptación del tratamiento, justificado por su baja efectividad y mala tolerancia.
- Con respecto a los recursos necesarios, la talidomi da se administra por vía oral, su costo es accesible en comparación con otras terapéuticas utilizadas para el tratamiento de la amiloidosis AL.
Conclusiones
El manejo de los pacientes con amiloidosis implica un de safío debido a la baja incidencia de la enfermedad, la va riabilidad de sus manifestaciones clínicas, la ausencia de aprobación de medicamentos por los entes reguladores, los altos costos con precios no regulables y la evidencia científica global de moderada-baja calidad con escasez de ensayos clínicos proporcionan un escenario adverso en la estandarización del manejo de los pacientes. Las buenas prácticas y recomendaciones en el tratamiento de la amiloidosis AL se basan en una combinación de la evidencia disponible y la experiencia del panel de exper tos, en un escenario de recursos disponibles limitados acorde a los países desarrollados.