El accidente cerebrovascular (ACV) constituye la principal causa de discapacidad de origen neurológico en los adultos mayores a 40 años y la cuarta causa de muerte en nuestro país1. Se estima que aproximadamente entre un 15 y 20% de los eventos son hemorrágicos y de éstos la presentación más frecuente es como hematoma intraparenquimatoso espontáneo (HIPe)2. En los últimos diez años las actualizaciones indexadas de guías en el tratamiento agudo del ACV isquémico (ACVi) fueron considerablemente más numerosas en comparación con las de ACV hemorrágico (ACVh). El objetivo de este material es proporcionar recomendaciones locales y actualizadas del manejo de pacientes con HIPe durante la internación.
Métodos
Para la confección de este documento se siguieron los lineamientos de la Sociedad Neurológica Argentina para la publicación de guías y consensos3.
El alcance de esta guía está orientado a profesionales de la salud que asisten pacientes mayores de 18 años con HIPe durante su estancia hospitalaria. Su objetivo es intentar brindar recomendaciones simples, actualizadas y adaptadas a nuestro medio, de interrogantes diarios que se plantean en el enfoque de esta afección. No es objetivo de este documento realizar una revisión exhaustiva de esta entidad.
Para la selección de temas se generó un listado de tópicos (Tabla 1) considerados centrales para el abordaje de esta enfermedad. Estos tópicos fueron abordados con el sistema de preguntas PICO (Población Intervención Comparación y Outcome). En consenso de los autores, se incluyeron hasta 5 preguntas PICO por tópico, priorizando las que plantean mayor controversia en la actualidad. Para la mejor comprensión, los interrogantes planteados se expresan desglosados en cada componente.
Las respuestas fueron expresadas en forma de fundamentación con recomendación final según la mejor evidencia disponible a criterio de los autores. Las recomendaciones fueron sometidas a análisis según GRADE4 para evaluar calidad o certeza de recomendación. Para dicho análisis se utilizó el software GRADEpro5 y las tablas resumen se expresan en el Anexo 1.
La dirección o grado de la recomendación se simplificó como a favor (condicional o fuerte) o en contra (condicional o fuerte) en base a cuatro parámetros: 1. Balance de riesgos y beneficios; 2 Calidad de la evidencia; 3 valores y preferencias de los pacientes y 4: estimación del consumo de recursos6,7.
Para cada tópico se conformó un grupo de trabajo integrado por 5 a 10 médicos de diferentes especialidades medicas relacionadas al manejo de esta enfermedad. En cada grupo se seleccionó un secretario cuya función fue coordinar el trabajo interno y mantener reuniones virtuales mensuales de avance junto a otros secretarios. Previo a la etapa de redacción se realizó un entrenamiento a todos los autores en sistema GRADE a fin de homogeneizar los conocimientos.
Para la búsqueda bibliográfica se realizó una revisión sistemática en PubMed con límites de búsqueda a 30 años de antigüedad, en humanos, artículos en español o inglés. Se excluyeron por lectura de abstracts a trabajos recuperados relacionados a hemorragia subaracnoidea, malformación vascular, hematoma subdural o trauma de cráneo. En el Anexo 2 se expresa la metodología de búsqueda. Los artículos incluidos para análisis fueron puestos a disposición de los autores mediante gestor bibliográfico (gráfico PRISMA, Anexo 2), pero no se limitó la inclusión de otros trabajos considerados relevantes para los autores.
Se trazó una línea de trabajo, con deadlines pre establecidos para la entrega del material. El tiempo empleado para la formulación de preguntas, redacción y elaboración de recomendaciones fue de 9 meses (julio 2021 a abril 2022). Luego de la unificación del mismo, se realizó reunión final con votación por parte de todos los autores acerca de las recomendaciones finales. En este encuentro, participaron representantes de pacientes de la Asociación Por Una Vida Libre de ACV, para valorar sus preferencias en el abordaje de esta enfermedad.
El documento preliminar fue sometido a evaluación externa por 3 especialistas que no participaron de la redacción ni la ejecución del proyecto.
1. EPIDEMIOLOGÍA
1.1
P Pacientes con hematoma intraparenquimatoso espontáneo
I Estudios epidemiológicos
C Estudios epidemiológicos en pacientes con accidente cerebrovascular isquémico
O Prevalencia e incidencia
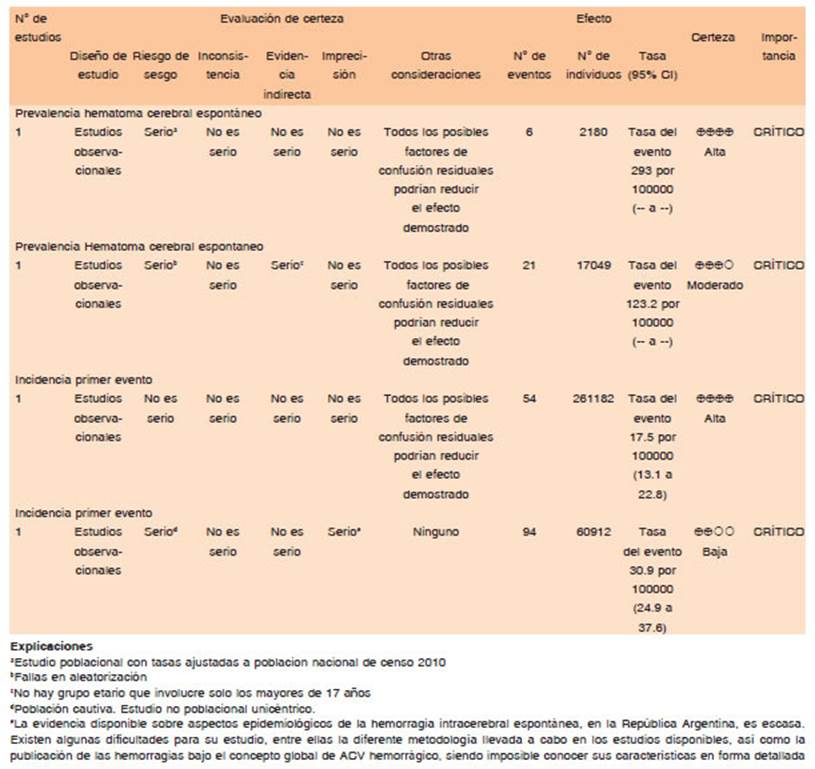
La evidencia sobre aspectos epidemiológicos del HIPe en nuestro país se ha incrementado en la última década. No obstante, existen algunas dificultades para su interpretación, como la diferente metodología aplicada y utilización de nomenclatura bajo el concepto global de ACVh.
En un estudio realizado en la localidad de Junín (Provincia de Buenos Aires), se informó, mediante una encuesta sistemática de hogares seguida de una confirmación del caso por equipo de especialistas, una prevalencia global (ajustada para dicha población al año 1991) de ACV de 1841.6 casos/100 000 habitantes mayores de 40 años. Los eventos ocurrieron con mayor frecuencia en varones y con rango etario entre los 50 y 80 años. La prevalencia ajustada de ACVh fue de 123.2 casos/100 000 habitantes (99.1 en mujeres y 150.5 en varones), representando el 20.4% de los ACV informados. Estos casos eran más frecuentes en las mujeres entre los 40 y 49 años y en los varones mayores de 50 años de edad. La diferenciación por subtipos de ACVh arrojó los siguientes resultados: 2.9% para hemorragia subaracnoidea (HSA) y 17.5% para hematoma intracerebral (HIC)2.
Un estudio más reciente, de diseño similar al anterior y efectuado en la ciudad de General Villegas (Provincia de Buenos Aires), reportó que la prevalencia ajustada (al año 2016) de ACV global para la población argentina en mayores de 40 años fue de 1974/100 000 habitantes. Dicha variable es mayor en varones (2627 casos/100 000 habitantes [IC 95% 1635-3619]) en comparación con las mujeres (1317 casos/100 000 habitantes [IC 95% 626- 2007] p < 0.01). El promedio de edad fue de 68.9 años. Al momento de presentar el primer episodio de ACV, el 78% tenía más de 60 años. El ACVh representó el 17% de los casos, con una prevalencia de 293 casos/100 000 habitantes8.
Prevista es el nombre de una investigación prospectiva, realizada en la ciudad de Tandil (Provincia de Buenos Aires) entre 2013 y 2015, que encontró una incidencia anual ajustada y global de ACV de primera vez de 127.9 casos/100 000 habitantes, como proyección para dicha comunidad. Dentro del tipo hemorrágico, las incidencias fueron las siguientes: 20.7 casos/100 000 habitantes (IC 95% 15.5-27.0) y 6.5 casos/100 000 habitantes (IC 95% 3.8-10.4), para la HIC y la HSA respectivamente. Calculando una incidencia anual estandarizada para la población en la República Argentina las tasas de incidencia para HIC fueron de 17.5 casos/100 000 habitantes (IC 95% 13.1-22.8), y utilizando la estandarización para la población mundial según la Organización Mundial de la Salud el valor es 15.2 (IC 95% 11.3-20.0)9.
Un estudio prospectivo realizado en la ciudad de Mar del Plata (Provincia de Buenos Aires) entre los años 2008 y 2012, encontró que la incidencia ajustada de ACVh en personas mayores de 21 años fue de 30.9 casos/100 000 habitantes (IC 95% 24.9-37.6), con una predominancia en hombres (37.6 casos/100 000 habitantes versus 27 casos/100 000 habitantes en mujeres). Dicha incidencia es significativamente menor frente al ACV isquémico (201.3 casos/100 000 habitantes/año). Se evidenció además que la incidencia anual por 100 000 habitantes aumenta con la edad, siendo 7.9 entre los 51 y 60 años, y de 66.4 entre los 81 y 90 años. Posiblemente, en este trabajo hayan existido dificultades metodológicas, en vista de que, a pesar de tratarse de una población cautiva, se utilizó una muestra poblacional perteneciente a un hospital, ya que la tasa ajustada de ACVh para la población argentina registrada en el Censo Nacional de 2010 es de 7 casos/100 000 habitantes10.
Todavía es escasa la información publicada sobre población nativa en nuestro país. Un estudio prospectivo, realizado entre los 1997 y 1999, en un hospital de la Ciudad Autónoma de Buenos Aires, encontró una proporción de ACVh de 31% (76% HIC, 24% HSA) y diferenció a la población según su ascendencia, considerando nativos a aquellas personas sin ancestros europeos o asiáticos informados. En este estudio los ACVh tuvieron una tasa significativamente más elevada que en el resto (34% versus 27%)11.
1.2
P Personas mayores de 18 años en la República Argentina
I Presencia de factores de riesgo vascular (hipertensión arterial, diabetes, dislipidemia, obesidad, tabaquismo)
C Ausencia de factores de riesgo vascular
O Riesgo de HIPe
En el año 2018 se publicó la 4ta Encuesta Nacional de Factores de Riesgo (ENFR) en mayores de 18 años, la cual forma parte del Sistema de Vigilancia de Enfermedades No Transmisibles de la República Argentina8,12. Los resultados globales más importantes se muestran en la Tabla 2 y se comparan con los resultados de las encuestas previas 2005, 2009 y 2013.

Tabla 2 Prevalencia de Factores de Riesgo en las cuatro ediciones de Encuesta Nacional de Factores de Riesgo
Durante las 4 ediciones de esta encuesta observamos un incremento significativo en la obesidad y la diabetes, así como una disminución significativa en la prevalencia de tabaquismo. Respecto de la hipertensión arterial (HTA) y dislipidemias se mantiene sin cambios significativos.
Tenemos publicaciones descriptivas de factores de riesgo en artículos de prevalencia e incidencia de hematoma intracerebral espontáneo. El estudio de la localidad de General Villegas, provincia de Buenos Aires reportó que la HTA es el factor de riesgo más frecuente con 100% de prevalencia, 14% para dislipemia y 14% para obesidad8,10,13. Otro estudio del 2018 de la localidad de Mar del Plata, provincia de Buenos Aires, comunicó prevalencia de 68% de HTA, 28.7% de dislipemia, 17% de tabaquismo, 13.8% de diabetes en pacientes con HIPe10. Un estudio multicéntrico en pacientes jóvenes con ataques cerebrovasculares, entre 18-50 años, describe una prevalencia de 66.7% de HTA, 45.83% de dislipemia, 29.2% de tabaquismo, 20.8% de sobrepeso/obesidad y 16.7% de diabetes13.
En Argentina contamos con información de prevalencia de factores de riesgo a nivel poblacional y en subgrupo de pacientes con hematoma intracerebral espontáneo, pero no hay publicaciones locales que permitan identificar relaciones de causalidad o medidas de riesgo entre factores de riesgo y el desarrollo de hematoma intracerebral espontáneo.
1.3
P Pacientes con HIPe en Argentina
I Desarrollo de ACVh
C Desarrollo de ACVi
O Funcionalidad posterior al evento
De acuerdo con un estudio de prevalencia de ACV en Argentina, en el que el porcentaje de hallazgo de la forma hemorrágica fue del 20.4%, se observaron los siguientes resultados: 35.8% de los sujetos evaluados se encontraban asintomáticos (recuperación dentro de los 6 meses posteriores al episodio del evento), 12.2% mostraron discapacidad leve, 25.7% moderada y 26.3% grave, requiriendo estos últimos asistencia permanente. Así, el grupo de pacientes asintomáticos y con discapacidad leve (con síntomas, pero independiente para las actividades de la vida diaria) representó el 48%. El grupo con moderada discapacidad (solicita ayuda con al menos una actividad de la vida diaria) y grave discapacidad (totalmente dependientes) representaron el 52%. Este grupo de sobrevivientes de un accidente cerebrovascular con discapacidades moderada y grave presenta una prevalencia ajustada de 452 casos por 100 000 habitantes. Si se considera solamente a los sobrevivientes requirentes de asistencia permanente, esta prevalencia se redujo a 229 por 100 000 habitantes. Debe aclararse que en este estudio epidemiológico no se aclaró el establecimiento de una escala de medición del grado de discapacidad2.
En otro estudio epidemiológico posterior, en el que el porcentaje de hemorragias intracerebrales espontáneas alcanzó el 17%, los sobrevivientes de accidente cerebrovascular tenían una mRS (escala modificada de Rankin) 2 en el momento de la evaluación. Al analizar el subgrupo de sujetos con ACVh, en la presentación clínica reportada el puntaje promedio en el NIHSS fue de 2.8, siendo la debilidad muscular el síntoma más frecuente. Al realizarse la evaluación clínica en el estudio, la distribución con respecto a la dependencia funcional fue la siguiente: 71% tuvo un mRS de 1-2 y 29% un mRS de 3-4. Resulta destacable que no se registraron diferencias significativas en la mRS entre los distintos subtipos de accidente cerebrovascular, o bien, entre sujetos menores y mayores de los 60 años de edad2,8.
Existen escasos reportes nacionales que comuniquen prevalencia, incidencia, factores de riesgo en el desarrollo de HIPe. Se recomienda profundizar la investigación en esta área con el desarrollo de trabajos donde el ACVh sea una entidad aislada y no vinculada al ACVi (Calidad de evidencia moderada. Dirección de recomendación: Fuerte a favor)
2. ATENCIÓN INICIAL
2.1
P Pacientes con HIPe y escala de Glasgow ≤ 8
I Vía aérea (VA) definitiva
C VA no definitiva
O Mortalidad hospitalaria (MH) y neumonía intrahospitalaria (NIH)
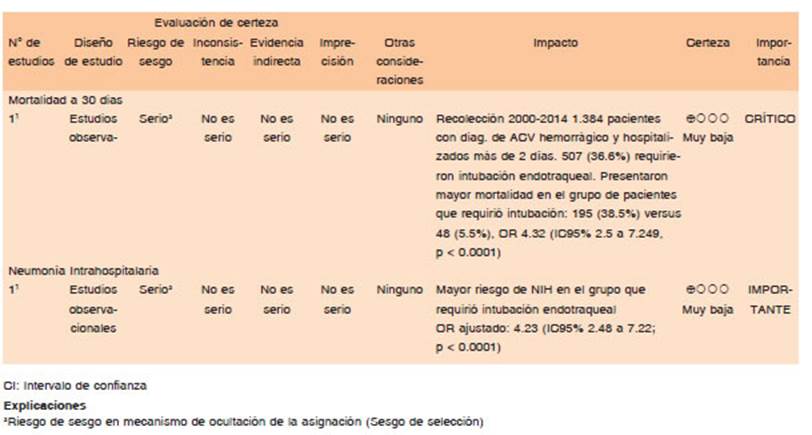
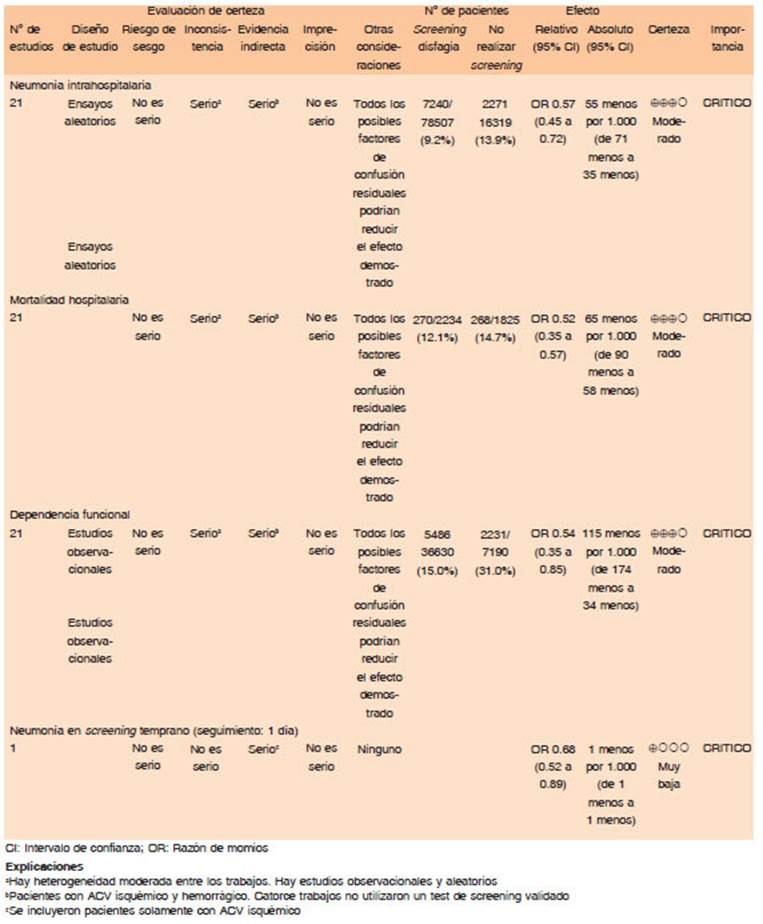
El manejo de la VA y la ventilación son componentes esenciales durante la reanimación de enfermos neurológicos14. Hasta un tercio de los pacientes con hemorragia supratentorial y prácticamente todos aquellos con hemorragia en fosa posterior presentan disminución del nivel de conciencia o alteración de la musculatura bulbar, lo que implica requerimiento de intubación15. La intubación precoz en casos de hemorragias de gran tamaño o disminución del nivel de conciencia puede ser de utilidad para la prevención de neumonías aspirativas15. Se considera la necesidad de manejo de la vía aérea definitiva ante hipoxia, alteración en la ventilación, falla en la protección de la VA y evolución clínica tórpida14. Clásicamente la intubación para la protección de las vías respiratorias está indicada en pacientes con GCS (Glasgow coma scale) ≤ 8 o dificultad respiratoria significativa16.
En el estudio de cohorte de Lioutas y col.17, se evaluaron pacientes con diagnóstico primario de una HIC. Se incluyeron 1384 pacientes con una media de edad de 62 años (DE 13.82); 507 (36.6%) fueron intubados; 133 (26.23%) en el grupo intubado desarrollaron NIH vs. 41 (4.67%) en el grupo no intubados (p <0.0001). La razón principal para la intubación fue la protección de las vías respiratorias; 195 (38.5%) pacientes intubados fallecieron durante la hospitalización vs. 48 (5.5%) pacientes no intubados (p <0.0001); Después de los ajustes de confusión, OR para NIH y MH, fueron OR 4.23 (IC 95%: 2.48 a 7.22; p < 0.0001) y OR 4.32 (IC del 95%: 2.5 a 7.49; p < 0.0001) respectivamente.
Un ensayo clínico aleatorizado sería necesario para abordar estas limitaciones y examinar las consecuencias del manejo de la vía aérea definitiva en pacientes con hematoma intracerebral (HIC). Sin embargo, realizar una prueba de este tipo será un desafío dado las preocupaciones éticas de los sujetos aleatorizados.
El panel considera que en base a la fisiopatología del ACVh, se recomienda el manejo de la vía aérea definitiva en aquellos pacientes con incapacidad de mantenimiento de la vía aérea permeable (Calidad de evidencia: Muy baja. Dirección recomendación: Fuerte a favor)
2.2
P Pacientes con HIPe
I Administración de ácido tranexámico
C No administración de ácido tranexámico
O Seguridad y eficacia
Diferentes estudios demostraron que más de un 30% de los HIPe se expanden dentro de las 24 horas y el crecimiento se correlaciona con mortalidad y funcionalidad18,19. La utilización de ácido tranexámico como agente antifibrinolítico fue evaluada en el estudio de Wang X y col.20 con la administración de 1 g en dosis de carga EV en 10 minutos, seguida de 1g en infusión EV durante 8 h. En este MA la administración de ácido tranexámico en comparación con su no utilización, disminuye la expansión Hematoma Intracerebral, definida como un incremento mayor a 6 ml o un 33% (RR 0.87, 95% CI 0.77-0.99) y el cambio en el volumen del hematoma en ml (− 1.28, 95% CI − 2.44 to − 0.12; p = 0.03). En cambio, es probable que no haya diferencias en los desenlaces críticos de mortalidad a los 90 días (RR 1.01, 95% CI 0.87-1.18; p = 0.86), buen estado funcional neurológico definido como Rankin modificado (mRs) < 2 a los 90 días (RR 1.10, 95% CI 0.92-1.32; p = 0.27) y eventos tromboembólicos (RR 1.20, 95% CI 0.85-1.69 p = 0.30)20.
En pacientes con HIPe, atendidos en el servicio de emergencias, no se sugiere el uso rutinario de ácido tranexámico. (Calidad de evidencia moderada. Dirección de recomendación: condicional en contra). La evidencia hasta el momento es insuficiente para apoyar decisiones a favor o en contra de la intervención.
3. IMÁGENES
3.1
P Pacientes con HIPe
I TC cerebro con contraste
C TC cerebro sin contraste
O Expansión del hematoma y mortalidad
En pacientes con deterioro neurológico agudo donde la sospecha inicial es un evento vascular, la neuroimagen inicial habitualmente es la TC, que permite diferenciar un evento isquémico de un hemorrágico.
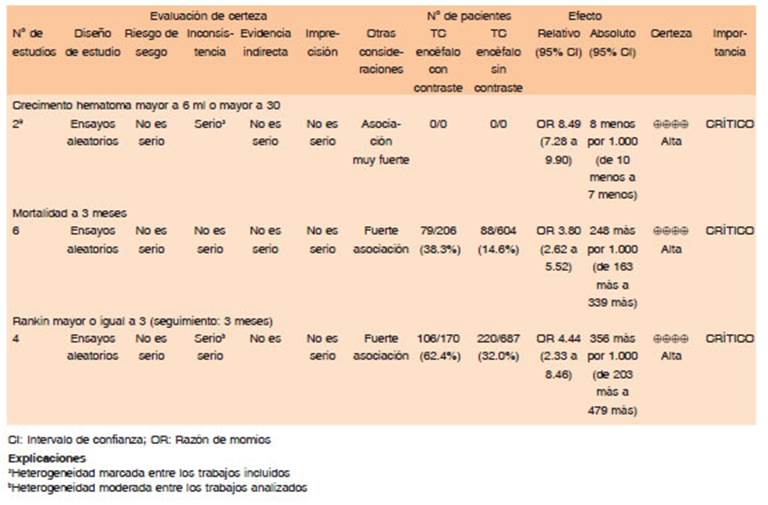
En los últimos años, diferentes guías de la práctica clínica recomiendan utilizar estudios contrastados para predecir la expansión del hematoma21-23. Este aspecto fue analizado en el MA de Xu X y col.24 donde el desenlace primario fue la expansión del HIC y los desenlaces secundarios fueron muerte y mRS >3. Se incluyeron estudios con una definición clara de expansión del HIC (aumento volumen >6 ml o mayor a 30% del volumen inicial) con presencia de spot sign y que informaran prevalencia, sensibilidad, especificidad, mortalidad y discapacidad. La prevalencia de spot sign fue del 23.4%, existió una correlación estadística significativa entre spot sign y mayor riesgo de expansión del hematoma OR 8.49 (IC 95% 7.28-9.9, p< 0.001). Spot sign mostró una sensibilidad 62% (IC 54-69) y especificidad del 88% (IC 85-91%) para predecir expansión del hematoma.
Dentro de los desenlaces secundarios, se evidenció que los pacientes con spot sign el riesgo de muerte a los 3 meses fue mayor OR 3.8 (IC:2.62-5.52) y tuvieron un mRS > 3 al momento del alta de 89% (IC: 84.3-95.6) vs. 59.3% (IC; 35-82.7) p < 0.0124. Este metanálisis es el único al momento con este número de pacientes, mostrando que la presencia del spot sign es sustancial y favorece a la predicción de expansión del hematoma, además de asociarlo con mayor mortalidad y discapacidad.
Se recomienda realizar una TC de cerebro con contraste a pacientes con déficit neurológico agudo para predecir expansión del hematoma, mortalidad y funcionalidad.
(Calidad de evidencia alta. Dirección de recomendación: Fuerte a favor)
3.2
P Pacientes con HIPe
I Utilización de score mSICH (Modified Secondary Intracerebral Hemorrhage Score) predictor de malformación vascular
C Utilización de score SICH (Secondary Intracerebral Hemorrhage Score) predictor de malformación vascular
O Hallazgo de malformación vascular causante del sangrado
La hemorragia intraparenquimatosa espontánea es el subtipo de ACVh más frecuente y se encuentra asociada a HTA crónica o angiopatía amiloide. Las causas secundarias engloban al 13-28% de los hematomas intraparenquimatosos, entre sus etiologías se describen la transformación hemorrágica de accidentes cerebro-vasculares isquémicos, los tumores y las anomalías estructurales vasculares (malformaciones vasculares, aneurismas, trombosis venosas, etc.)25. Es en este último grupo de pacientes, en el que está justificada la realización de un estudio angiográfico de imágenes ya sea mediante angiografía por sustracción digital (aSD), AngioTC (aTC) o AngioRM (aRM)] para la evaluación de las estructuras vasculares intracraneales.
Una herramienta que permita seleccionar a aquellos pacientes con alto riesgo de poseer una anomalía vascular subyacente al hematoma, basado en las características clínicas, demográficas y/o radiológicas, sería de gran utilidad.
Para tal fin se han desarrollado sistemas de scoring como el SICH (Secondary Intracerebral Hemorrhage Score)26 y el mSICH (Modified Secondary Intracerebral Hemorrhage Score)26,27.
Para el desarrollo del SICH se utilizó una base de datos de 623 pacientes con HIP que poseían TC de cerebro sin contraste (TCSC) y aTC multidetector durante un período de 9 años. El sistema de scoring se basó en características clínicas (edad, sexo e historia de HTA o alteraciones en la coagulación) y radiológicas de la TCSC (Tabla 3), con la intención de predecir el riesgo de poseer lesiones vasculares como etiología del HIC. El score se probó en una cohorte prospectiva de validación que incluyó 222 pacientes. La aTC confirmó la presencia de una etiología vascular en 120 de los 845 pacientes con HIC (14.2%). Utilizando el análisis de curvas ROC (receiver operating characteristic), se arribó a un punto operativo máximo considerando un score SICH > 2, con una sensibilidad del 85.8% y especificidad del 72.3% y una performance global para ambas cohortes (retrospectiva y prospectiva) con áreas bajo la curva de 0.86 y 0.87 respectivamente26.
Si bien el score SICH posee estudios de validación externa con distintos grados de sensibilidad y especificidad, su utilidad clínica es limitada, ya que muy pocos pacientes poseen scores dentro de la categoría de riesgo del 0%, por lo cual un muy bajo porcentaje quedaría exceptuado de realizar un estudio angiográfico28,29.
Basado en la baja utilidad clínica del score SICH, se desarrolló el mSICH con la intención de detectar a aquellos pacientes con HIP y bajo riesgo de enfermedad vascular subyacente, en quienes se podría prescindir de imágenes vasculares, reduciendo la morbilidad asociada a dichos procedimientos. Se realizó un análisis retrospectivo en una cohorte de 575 pacientes con HIP atraumático en un período de 8 años de los cuales 60 (10.4%), tenían una etiología vascular subyacente. Mediante un modelo de regresión logística multivariada se identificaron predictores independientes de enfermedad vascular y se utilizaron para el desarrollo del score. Los predictores estadísticamente significativos fueron: edad sexo femenino, presión sistólica al ingreso < 160 mmHg, localización distinta a los ganglios basales, tálamo, mesencéfaloo protuberancia, presencia de características radiológicas de alto riesgo y proximidad de menos de 3 mm a cisternas con vasos de gran calibre (Tabla 4.A y 4.B). El análisis ROC arrojó un área bajo la curva de 0.886 (95% IC, 0.84 -0.93) alcanzando, con una puntuación mSICH > 1, una sensibilidad de 90% y una especificidad de 67.6%. Esta puntuación mSICH, clasificó a un 25.5% más de pacientes en el grupo de riesgo 0%, maximizando el rendimiento del estudio neurovascular y limitando la obtención de imágenes vasculares innecesarias y evitar los posibles riesgos de los estudios vasculares. El mSICH puede predecir con mayor exactitud el riesgo de enfermedad vascular subyacente en paciente con HIC, así como la identificación de aquellos con bajo riesgo de enfermedad vascular27.
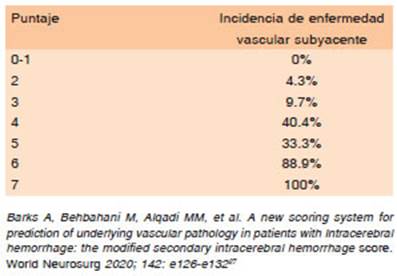
Tabla 4B Incidencia de enfermedad vascular subyacente según puntaje de Modified Secondary Intracerebral Hemorrhage Score
Se sugiere la utilización del score mSICH para la identificación de pacientes con HIC en los cuales la posibilidad de encontrar una malformación vascular subyacente es baja. La obtención de un score mSICH < 2, avalaría la no realización de estudios angiográficos. (Calidad de evidencia muy baja. Dirección de recomendación: Condicional a favor)
3.3
P Pacientes con HIPe
I Angiografia digital (aSD)
C Estudio vascular no invasivo como angiotomografia (aTC) o angiorresonancia (aRM)
O Malformación vascular subyacente
El 2015 Van Asch CJJ y col.30, realizaron un estudio prospectivo, multicéntrico de 298 pacientes adultos, tratados en 22 hospitales en los Países Bajos con diagnóstico de HIPe durante seis años, se excluyeron mayores de 45 años con hipertensión e HIC en los ganglios de la base y tálamo. El estudio inicial a estos pacientes era una TC y aTC, en caso negativo se realizó una aRM. La aSD se realizó cuando los resultados de la aTC o la aRM fueron no concluyentes o negativos. El rédito diagnóstico de la aTC fue de 17% (13-33%). En los pacientes que se adicionó la aRM el rédito diagnóstico fue de 18% (14-23%). La adición de aSD a este último grupo, incrementó el rédito diagnóstico a 23% (18-28%).
En el modelo de regresión30 logística multivariable, la HIC no traumática en la fosa posterior fue el predictor más fuerte (OR: 13.0, IC del 95 % de 3.7 a 46.5), seguido de la ausencia de signos de enfermedad de vasos pequeños en la TC sin contraste (8.5, 2.9 a 25.3), localización lobar de la HIC no traumática (5.5, 2.0 a 15.3) y edad (0.96, 0.93 a 0.99). Este estudio nos muestra que la aTC es una investigación inicial apropiada para detectar causas macrovasculares de HIC no traumática, pero la precisión es baja a modesta. La RM y aRM adicionales pueden encontrar cavernomas o diagnósticos alternativos, pero se necesita aSD para diagnosticar causas macrovasculares no detectadas por aCT o aRM. Sin embargo, es un estudio con pocos pacientes, no especifica características particulares de la hemorragia cerebral que nos indiquen pasar directamente a la angiografía cerebral, sin RM. Si bien la aTC es una herramienta inicial apropiada para la detección de causas macrovasculares en el contexto de un HIC no traumático, su exactitud es modesta. Por lo tanto, la aSD es necesaria en casos con aRM o aTC normal30.
El estudio angiográfico no está indicado de manera rutinaria en los pacientes con ACVh. La indicación de un estudio angiográfico queda restringida a aquellos en los que luego de la realización de aTC y aRMN, persiste duda diagnóstica (Calidad de evidencia moderada. Recomendación: Condicional a favor)
La hemorragia de fosa posterior, la ausencia de enfermedad microvascular, la ubicación lobar y la edad podrían ser predictores de malformación vascular subyacente (Calidad de evidencia moderada. Recomendación: Condicional a favor)
En opinión de los autores, se propone el algoritmo diagnóstico expresado en la Figura 1.
3.4
P Pacientes con HIPe en periodo agudo (< 7 días) I Realizar RM de encéfalo
C No realizar RM de encéfalo
O Lesión estructural subyacente
Actualmente la TC sin contraste es el estudio de elección para diagnóstico inicial de HIPe por su elevada sensibilidad, disponibilidad y agilidad en la adquisición de imágenes, aunque no siempre permite diagnosticar la presencia de enfermedades subyacentes. La costo-efectividad y la baja disponibilidad de la RM en nuestro medio, tampoco permiten recomendar su utilización rutinaria ante todo evento agudo de HIPe. Por otra parte, estos pacientes presentan con frecuencia deterioro del sensorio, vómitos, agitación e inestabilidad hemodinámica, lo cual imposibilita su realización sistemática en todos31. Es por esto que es importante contar con datos demográficos, clínicos y radiológicos, los cuales puedan tamizar a aquellos pacientes en los cuales existe una indicación clara de realizar una RM de encéfalo en el período agudo.
El rédito diagnóstico para hallazgo de lesión estructural subyacente de la RM en el período agudo, presenta variaciones principalmente relacionadas con la edad del paciente y la localización del HIPe, variando de un 0% en mayores de 65 años con HIPe ganglio basal y/o talámico o en mayores de 85 años con HIPe de cualquier localización a un 37% de rendimiento en menores de 50 años y 23% de rendimiento en menores de 65 años. Como factores de riesgo independientes para hallazgo de lesión subyacente se encontraron la edad decreciente, ausencia de factores de riesgo vascular y ubicación no profunda32.
Adicionalmente Mouchtouris y col., no identificaron lesiones estructurales en una segunda RM de seguimiento a los 106 ± 62 días de la primera RM negativa en una cohorte ambispectiva de 113 sujetos con HIPe31.
La RM en el periodo agudo no es recomendable de rutina para la detección de lesión estructural en pacientes mayores de 65 años con compromiso profundo (ganglios de la base o tálamo), o en mayores de 85 años con HIPe en cualquier topografía. Tampoco recomendamos la realización rutinaria de una RM de seguimiento tardío habiendo tenido una RM negativa en periodo agudo. (Dirección de recomendación: Condicional en contra. Calidad de evidencia: Baja)
4. CONTROL DE LA PRESIÓN ARTERIAL
4.1
P Pacientes con HIPe dentro de las 6 h de iniciados los síntomas
I Descenso de la presión arterial
C No descenso de la presión arterial
O Expansión del hematoma (crecimiento >6 ml o 33% del volumen inicial) y seguridad
La HTA es frecuente en el inicio de los síntomas tras un hematoma intracerebral espontáneo. Esto puede ser secundario a diversos factores como el dolor o la elevación de la presión intracraneana, entre otros. La HTA se ha asociado con crecimiento del hematoma, deterioro neurológico y peores resultados funcionales. Se ha demostrado que el descenso de los valores de presión arterial sistólica (PAS) menor o igual a 140 mmHg disminuye la posibilidad del crecimiento del hematoma, si se alcanza ese objetivo tensional dentro de las 6 horas33.
Cuando se comparó el descenso a un valor de PAS menor o igual a 140 mmHg contra las recomendaciones clásicas de 180 mmHg, se vio una reducción significativa del crecimiento del hematoma 0.82 (0.68-0.99 p 0.03), sin un impacto igual de positivo en la recuperación funcional o mortalidad 0.95 (0.84 to 1.08 p 0.41)34,35.
Cuando se comparó la presencia de eventos adversos serios relacionados con el tratamiento antihipertensivo como la hipotensión arterial, deterioro neurológico, renal o cardiaco, no se encontraron diferencias estadísticamente significativas entre los grupos tratamiento estándar PAS 140 mmHg) vs. tratamiento convencional (TAS 180 mmHg) OR 1.13 (0.99 to 1.29) 0.07 en pacientes con HIPe moderados a graves34,35.
El descenso de la PAS menor o igual a 140 mmHg en pacientes con HIPe es seguro y disminuye la expansión del hematoma (Calidad de evidencia moderada). Existe insuficiente evidencia a favor del uso rutinario dado el incierto beneficio clínico (Dirección de recomendación: Condicional a favor)
4.2
P Pacientes con HIPe dentro de las primeras 24 h de iniciados los síntomas
I Descenso de presión arterial sistólica (PAS) a 140 mmHg
C Descenso de PAS a 180 mmHg
O Funcionalidad y mortalidad
Las guías para el manejo de la hemorragia cerebral editadas en mayo de 2015 y basadas en los estudios llevados adelante hasta ese momento recomiendan que para los pacientes con HIPe que presentan PAS entre 150 y 220 mmHg y sin contraindicación para el tratamiento de la PA aguda, la reducción aguda de la PAS a 140 mmHg es segura y puede ser eficaz para mejorar el resultado funcional21.
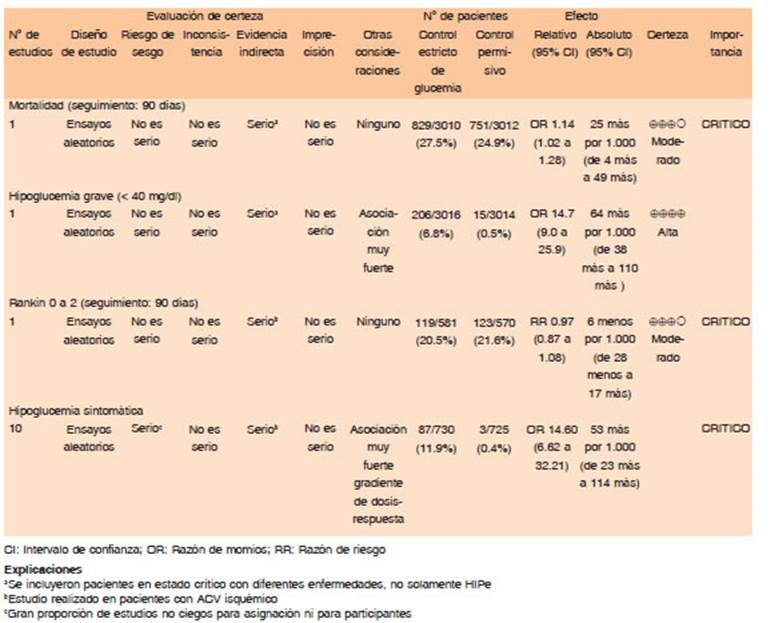
El trabajo publicado en 2013 y denominado INTERACT2 reclutó a 2794 pacientes con HIPe dentro de las 6 horas posteriores al inicio de los síntomas. El ensayo aleatorizó pacientes a un objetivo de PAS < 140 mmHg vs. < 180 mmHg. El tratamiento antihipertensivo fue a discreción de los médicos tratantes. INTERACT2 no mostró una reducción en el resultado primario de muerte o discapacidad, definida como una puntuación de 3 a 6 en la escala mRs (OR para una mayor discapacidad con tratamiento intensivo 0.87; IC del 95%: 0.77-1.01). La mortalidad fue del 11.9% en el grupo que recibió tratamiento intensivo y del 12.0% en el grupo que recibió el tratamiento recomendado por las guías21,36.
En 2014 ATACH II evaluó la hipótesis en que se planteaba que la disminución temprana de la presión arterial mejoraría los resultados funcionales. El ensayo aleatorizó a 1000 pacientes dentro de las 4.5 horas de inicio a un grupo de tratamiento estándar (objetivo de PAS 140 - 179 mmHg) vs. un brazo de descenso intensivo (objetivo PAS 110-139 mmHg). El ensayo utilizó nicardipina intravenosa como tratamiento antihipertensivo. El promedio de PAS durante las dos primeras horas fue de 128.9 mmHg en el intensivo y 141.1 mmHg en el brazo de tratamiento estándar. El resultado primario de mRs ≥ 4 ocurrió en el 38.7% de los pacientes del brazo de tratamiento intensivo de PA y en el 37.7% de los del brazo estándar. Los eventos adversos durante los 3 meses posteriores a la aleatorización fueron mayores en el grupo de tratamiento intensivo (25.6% vs. 20.0%, riesgo relativo ajustado, 1.30, IC del 95%: 1.0-1.7), que en gran medida involucraron eventos adversos renales asociados con un aumento de la creatinina sérica37.
Descender la presión arterial sistólica hasta 140 mmHg es seguro, si bien alcanzar este objetivo no produce beneficios en términos de discapacidad y muerte (Calidad de evidencia alta. Dirección de recomendación: Condicional a favor).
4.3
P Pacientes con HIPe de menos de 12 h de evolución
I Nicardipina
C Otros antihipertensivos titulables
O Alcance de objetivo de presión arterial sistólica de 140 mmHg
Recientemente se publicó una revisión sistemática para evaluar los efectos de los antihipertensivos intravenosos (nicardipina, clevidipina, labetalol, esmolol y nitroprusiato) para el control de la presión arterial (PA) en urgencias neurológicas agudas, con evidencias muy limitadas para apoyar el uso en particular de un antihipertensivo intravenoso sobre otro38.
No obstante, en comparación con labetalol, la nicardipina parecería alcanzar el objetivo de PA más rápido, además de mostrar una menor variabilidad de la PA38,39. Esto último adquiere trascendencia clínica ya que la variabilidad de la PA durante el descenso en las fases iniciales podría relacionarse con peores resultados funcionales a 90 días40.
En un reciente estudio retrospectivo, que incluyó 89 pacientes con HIPe, la nicardipina en comparación con la clevidipina mostró resultados similares en cuanto a la eficacia y seguridad para lograr los objetivos de reducción de presión arterial, aunque los datos siguen siendo aún limitados41.
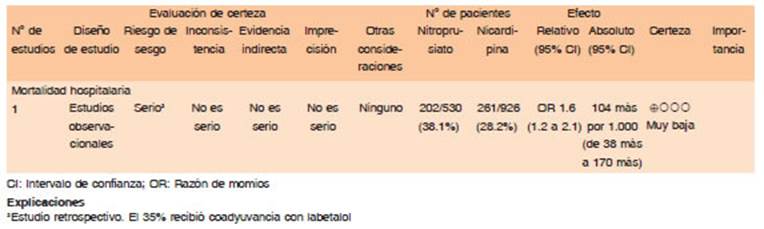
Por otra parte, si bien la nicardipina en comparación con el nitroprusiato parece ser similar en la reducción de la PA en comparación con el nitroprusiato, un gran estudio observacional sugiere que el nitroprusiato se asocia con una mayor MH, sumado al potencial aumento de la presión intracraneal secundaria a vasodilatación cerebral42.
Por último, las recomendaciones canadienses (Canadian Stroke Best Practice Recommendations) mencionan que ante la falta de pruebas sólidas para guiar la elección de los agentes iniciales para reducir la presión arterial se propone considerar el uso de labetalol parenteral, hidralazina, nicardipina y/o enalapril23.
Se sugiere considerar a la nicardipina, labetalol, hidra-azina y enalaprilato como drogas antihipertensivas parenterales durante el periodo agudo en pacientes con HIPe (Calidad de evidencia baja. Dirección fuerte a favor) El nitroprusiato no debería considerarse como droga de primera elección. (Calidad de evidencia muy baja. Dirección de evidencia: Condicional en contra)
La clevidipina podría usarse con seguridad con la evidencia que se cuenta en la actualidad, aunque hasta la fecha no se encuentra disponible en el país. (Dirección de evidencia: Condicional a favor)
5. REVERSIÓN DE ANTITROMBÓTICOS
5.1
P Pacientes con HIPe en tratamiento antiagregante previo (simple o doble antiagregación)
I Restauración de la función plaquetaria (desmopresina o transfusión de plaquetas)
C Manejo con tratamiento médico estándar
O Expansión del hematoma, funcionalidad y mortalidad
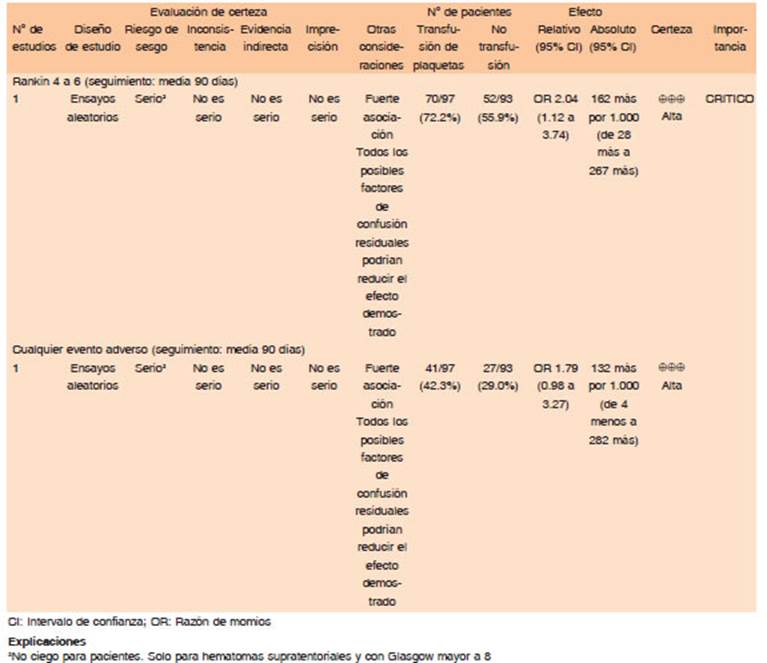
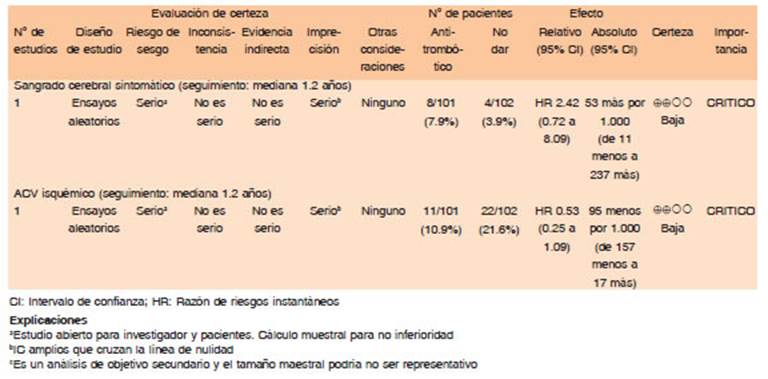
Actualmente no se cuenta con estrategias farmacológicas capaces de revertir rápidamente el efecto de los antiagregantes plaquetarios en escenarios que así lo requieran43. La transfusión de plaquetas ha sido propuesta como una estrategia potencial para revertir el efecto anti- trombótico de los antiagregantes plaquetarios en pacientes con hemorragia intracraneal. En un estudio aleatorizado de transfusión de plaquetas para pacientes tratados con AAS que presentaban HIC aguda (<6 horas de instalación), se observó daño en aquellos tratados con esta intervención44. Posibles explicaciones de este fenómeno fueron: 1) que algunos de los casos hayan sido en realidad ACVi con transformación hemorrágica en lugar de ACVh, 2) que la circulación colateral alrededor del área del hematoma esté alterada, resultando en isquemia cerebral. De este modo, la transfusión de plaquetas podría incrementar el riesgo de trombosis.
En un gran estudio observacional, pacientes con estados protrombóticos que recibieron transfusión de plaquetas, tuvieron mayor mortalidad y IAM comparados con aquellos sin transfusión45,46. Además, las plaquetas tienen efectos proinflamatorios y las transfusiones aumentarían la permeabilidad vascular relacionada con inflamación y consumo de plaquetas.
En cuanto al uso de desmopresina como droga prohemostática, se encuentra aprobada para revertir drogas antiplaquetarias en las guías estadounidenses47 pero no en las del Reino Unido48. Si bien la desmopresina ha sido testeada en cuatro series de casos y parece ser segura, estas series fueron pequeñas, no aleatorizadas y sin placebo en el brazo control. Por esto, hasta que no haya evidencia para recomendarla, no se encuentra apta para su uso en ACVh. El estudio DASH (Desmopressin for Reversal of Antiplatelet Drugs in Stroke due to Haemorrhage), pretende aclarar cuestiones acerca de seguridad y eficacia49.
Por lo anterior expuesto, no es segura la transfusión de plaquetas en pacientes con ACVh que se encuentren bajo tratamiento con antiplaquetarios, de hecho, hay una tendencia al daño con esta intervención. (Calidad de evidencia: Alta. Dirección de recomendación: Fuerte en contra)
No hay suficiente información acerca de la seguridad y eficacia con desmopresina, por lo tanto, tampoco se recomienda al momento. (Calidad de evidencia: Baja. Dirección de recomendación: Condicional en contra)
5.2
P Pacientes con HIPe en tratamiento con antagonistas de la vitamina K (AVK)
I Reversión farmacológica plasma fresco congelado (PFC)
C Reversión farmacológica con concentrado de factores (PCC)
O Expansión del hematoma, funcionalidad y mortalidad
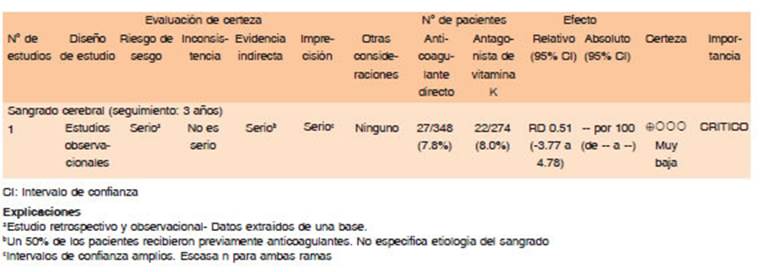
Las guías de la American Society of Hematology 2018 recomiendan el uso de PFC, PCC como así también vitamina K para la corrección del RIN a valores < 1.4 lo más rápido posible50.
El PFC es un hemoderivado que proporciona una reposición inespecífica de factores de coagulación, sin lograrse una reversión completa del RIN en 24 hs, por lo tanto, sería un tratamiento poco efectivo en la reducción temprana de la expansión del hematoma. Una de las desventajas es la gran cantidad de volumen a transfundir incrementando el riesgo de falla cardiaca, edema pulmonar y otros efectos adversos51,52.
El PCC, contiene factores dependientes de vitamina K, 25 veces más elevados que PFC. Comparaciones entre PFC vs. PCC en lo que respecta a seguridad y eficacia en la reversión de sangrados mayores asociados a AVK, se inclinan en favor de este último por su rápida corrección del RIN, menor sobrecarga de volumen y sin diferencias significativas a lo que refiere eventos trombóticos51,52.
El INCH trial (INR Normalization in Coumadin Associated Intracerebral Hemorrhage) comparó PFC y PCC para la reversión de sangrado cerebral asociado a AVK, con dosis de 30 UI / kg para PCC y 20 ml/kg para PFC. El CCP fue superior en lograr reducir el RIN a menos de 1.3 dentro de las 3 horas comparado con PFC y lograr menor expansión del hematoma a las 24 horas. Estos parámetros no tuvieron traducción en mejores resultados clínicos en desenlaces secundarios de funcionalidad y mortalidad53.
La administración sola de vitamina K no sería suficiente en el manejo agudo, por su efecto diferido en la síntesis de factores de coagulación, por lo tanto, debe ser usado en combinación de PFC o PCC para alcanzar la reversión temprana.
Se recomienda la utilización del CCP por sobre el PFC para lograr la normalización del RIN más rapida y menor expansión del hematoma (Calidad de evidencia alta. Dirección de recomendación: Fuerte a favor). El beneficio clínico de uno sobre otro es desconocido.
Se sugiere utilizar la vitamina K EV como coadyuvante de la reversión, pero no como único agente. (Dirección de recomendación: Fuerte a favor)
5.3
P Pacientes con HIPe en tratamiento con anticoagulantes orales directos (AOD)
I Reversión con antagonistas específicos
C No reversión
O Expansión del hematoma, funcionalidad y mortalidad
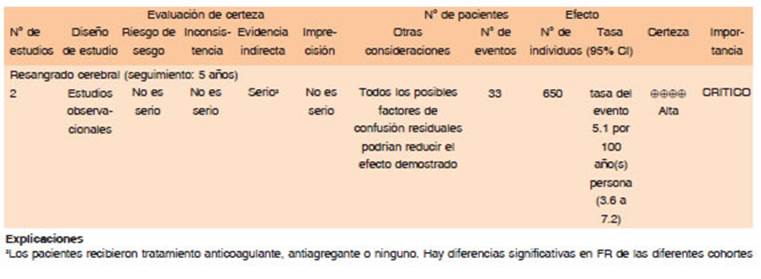
Las guías actuales de neurointensivismo sugieren dentro de las buenas prácticas clínicas la de discontinuar los anticoagulantes directos cuando se sospecha o confirma una hemorragia intracraneal47. Se debe determinar el tiempo desde la última dosis del medicamento y las posibles interacciones farmacológicas para determinar el grado de exposición a anticoagulación y la necesidad de revertir el efecto del anticoagulante. En el caso de que hayan pasado más de 3-5 vidas medias desde la presentación, y el paciente no tenga falla renal, no se recomienda la reversión con agentes dado que el efecto anticoagulante posterior a este rango es nulo.
Existen tres antídotos que han sido estudiados para revertir los anticoagulantes directos en hemorragia cerebral: idarucizumab (reversor del inhibidor factor II), andexanet alta (reversor para inhibidores del factor Xa) y ciraparantag (reversor para inhibidores factor Xa y factor II).
El ciraparantag es una pequeña molécula sintética soluble que se une tanto a heparina como a anticoagulantes directos FXa y factor II, desacoplando estas drogas de sus targets. El mismo no está disponible en el país.
El andexanet alfa54 es una proteína recombinante modificada e inactiva del factor Xa humano, designado específicamente para unirse y reducir su actividad. Si bien ya ha sido aprobado por la FDA en 2018, hasta el momento no está disponible en nuestro país.
En caso de sangrado cerebral en contexto de ingesta de un inhibidor FXa, teniendo en cuenta que hasta el momento no están disponibles en el país los reversores específicos, se sugiere por guías47 el siguiente manejo:
- Dentro de las 2 h de ingestión: Carbón activado (50 g)
en pacientes intubados con hemorragia intracraneal con acceso enteral o aquellos con bajo riesgo de aspiración.
- Dentro de las 3-5 vidas medias de exposición o en pacientes con falla hepática: CCP (50 U/kg).
- El uso de CCP está recomendado por sobre el de rF-VIIa por menor riesgo de eventos trombóticos. Es escasa la evidencia para recomendar plasma fresco congelado en la reversión de inhibidores FXa.
El dabigatrán cuenta con un antídoto reversor capaz de neutralizar su efecto en minutos, el idarucizumab. Este es un fragmento de Ac monoclonal 350 veces más afín a dabigatrán que a la trombina55. Su acción es inmediata y completa y sin efectos protrombóticos56. Las indicaciones aprobadas para su uso son sangrado mayor que amenace la vida o previo a un procedimiento invasivo de urgencia con alto riesgo de sangrado. La dosis recomendada es de 5 g de idarucizumab (2 viales de 2.5 g/50 ml).
Se propone el siguiente esquema de manejo en caso de no disponer del antídoto para inhibidores directos de la trombina:
- Dentro de las 2 h de la toma del inhibidor de trombina: carbón activado (50 g) en pacientes intubados con hemorragia intracraneal con acceso enteral o aquellos con bajo riesgo de aspiración.
- Dentro de las 3-5 vidas medias sin falla renal: se recomienda fuertemente la administración de idarucizumab (5 g IV dividido en dos dosis).
- Pacientes con insuficiencia renal que por esto estén expuestos a la droga más allá de sus 3-5 vidas medias: idarucizumab (5 g IV dividido en dos dosis). En caso de no disponer de idarucizumab, se recomienda la hemodiálisis en pacientes con insuficiencia renal expuestos a la droga.
- En caso de no disponer de idarucizumab: concentrado de complejo protrombínico (50 U/k) dentro de las 3-5 vidas medias.
En caso de sospecha o confirmación de una hemorragia intracraneal se debe discontinuar el tratamiento anticoagulante y administrar antídoto específico. (Calidad de evidencia moderada. Dirección de recomendación: Fuerte a favor)
En caso de no contar con antídoto, discontinuar anticoagulante y determinar el tiempo desde la última toma. La reversión farmacológica está indicada si ocurre antes de las 3-5 vidas medias desde la presentación. (Dirección de recomendación: Fuerte a favor)
5.4
P Pacientes con HIPe que hayan recibido infusión de HNF y/o HBPM dentro de las últimas 12 h
I Suspensión inmediata/reversión farmacológica temprana
C Suspensión inmediata sin reversión
O Expansión del hematoma/mortalidad/dependencia
Uno de los objetivos terapéuticos más importantes es limitar la expansión del hematoma ya que es un determinante del deterioro neurológico precoz y los malos resultados clínicos observados. Dentro de los factores de riesgo cabe destacar el uso de tratamientos anticoagulantes por diferentes enfermedades.
En el caso de pacientes que están recibiendo tratamiento con infusión de HNF durante el evento agudo de un HIC, se debe proceder a interrumpir inmediatamente la misma y considerar la administración de protamina23. El sulfato de protamina se debe dosificar para su administración a razón de 1 mg IV por cada 100 U de HNF, dentro de las 2-3 h y en el caso de que el KPTT continúe prolongado se debe repetir la dosis de 0.5 mg cada 100 U HNF, con un máximo de 50 mg57.
Si el paciente se encuentra bajo tratamiento con HBPM no existe un antídoto específico, por lo que se debe considerar la administración de protamina IV lenta, por un periodo de 10 minutos a pesar del escaso efecto sobre el factor23,57.
En el caso de enoxaparina, el tiempo es fundamental para adecuar la dosis, es por ello que dentro de las 8 h se debe administrar protamina a dosis de 1 mg IV por cada 1 mg de enoxaparina. Si se administró enoxaparina dentro de las 8-12 h, una dosis de protamina de 0.5 mg IV por cada 1 mg de enoxaparina. En el caso de que hayan transcurrido 12 h o 3-5 vidas medias desde la dosificación, la utilidad de la protamina para revertir la misma es mínima57. Para las otras HBPM como dalteparina, nadroparina y tinzaparina, se debe administrar protamina de 1 mg IV por 100 U de HBPM dentro de las últimas 3-5 vidas medias del fármaco.
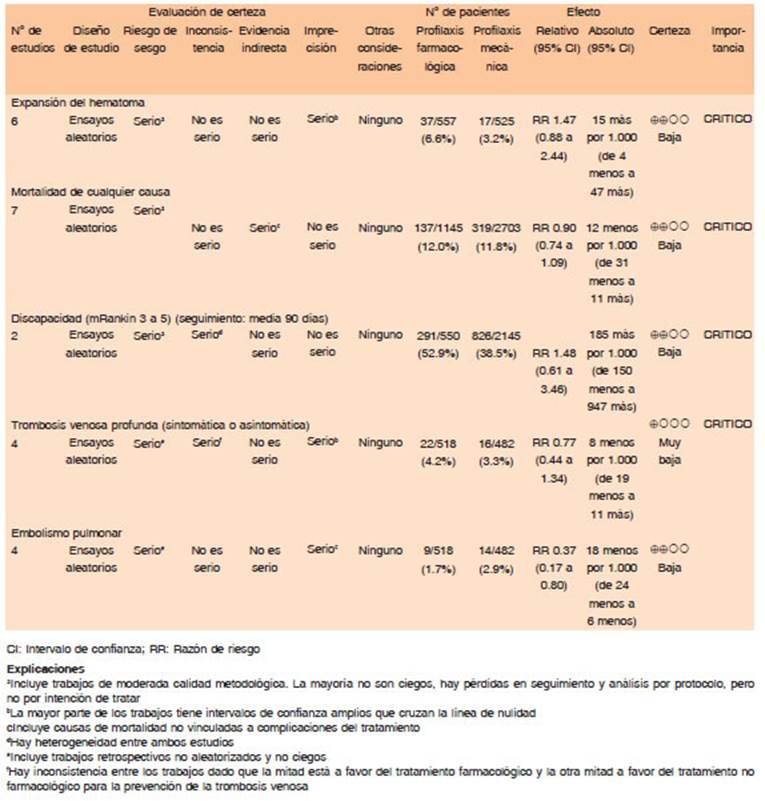
Para los pacientes que estén recibiendo tratamiento con infusión de HNF y/o HBPM dentro de las últimas 8-12 h se debe suspender la administración y/o infusión de las mismas y revertir de manera urgente el efecto anticoagulante para evitar expansión del hematoma, así como también aumento de mortalidad y dependencia. (Dirección de recomendación: Fuerte a favor)
En el caso de pacientes que presenten cuadro de HIC, insuficiencia renal y tratamiento con HNF y/o HBPM se recomienda administrar protamina 1 mg IV y dosis adicional de 0.5 mg IV. (Dirección de recomendación: Fuerte a favor) En el caso de que la protamina esté contraindicada se sugiere rFVIIA a dosis de 90 ug/kg IV (Dirección de recomendación: Condicional a favor)
En pacientes que se encuentran recibiendo profilaxis se recomienda no revertir la HNF subcutánea y/o HBPM, excepto que el KPTT esté prolongado. En esta situación, se sugiere administrar sulfato de protamina IV (Dirección de recomendación: Fuerte a favor)
6. CIRUGÍA
6.1
P Paciente con HIPe supratentorial
I Tratamiento quirúrgico
C Tratamiento médico estándar no quirúrgico
O Discapacidad al seguimiento (3-12 meses)
De acuerdo a la publicación de Andrews y col., en teoría, la evacuación del hematoma puede mejorar el efecto de masa, la inflamación circundante, reducir la PIC y prevenir la hernia58.
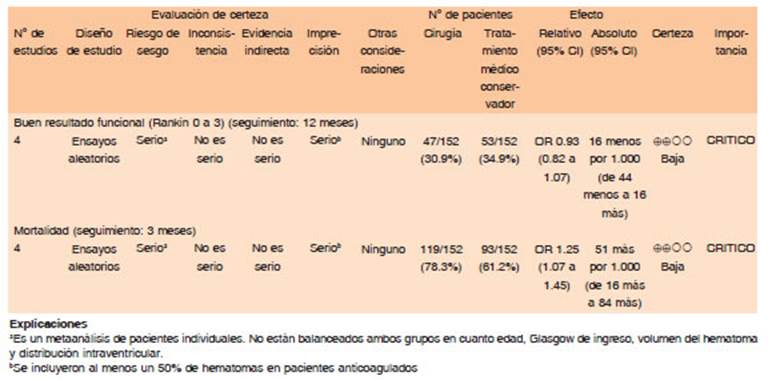
Hay dos estudios de calidad metodológica, el ensayo clínico prospectivo y aleatorizado sobre cirugía temprana vs. tratamiento conservador inicial en pacientes con hematomas intracerebrales lobares supratentoriales espontáneos, STICH I59 y el STICH II60.
El ensayo STICH I reclutó a 1033 pacientes con HIPe supratentorial. Se comparó la eficacia de evacuación temprana del hematoma versus el tratamiento médico sólo para mejorar el resultado funcional a los 6 meses, medido por la Escala de Resultados de Glasgow ampliada/ extendida. STICH I evidenció que 26% de los pacientes intervenidos precozmente tuvieron discapacidad leve a 6 meses vs. 24% de los sometidos a tratamiento conservador inicial (OR 0·89 0·66-1·19 p=0·414). Uno de cada cuatro pacientes que fueron asignados al azar al brazo de tratamiento médico fueron tratados con cirugía de manera tardía y esta alta tasa de cruzamiento limita la capacidad de STICH I para abordar si el resultado se debió a la falta de beneficio de la cirugía en sí mismo, el momento de la cirugía u otros aspectos relacionados con la selección del paciente. Los análisis de subgrupos sugieren que los pacientes con hematomas lobares superficiales (a menos de 1 cm de la superficie cortical) podrían beneficiarse de la cirugía y que aquellos en coma (GCS ≤ 8) en la presentación puede que no59.
El ensayo STICH II se diseñó sobre la base de los análisis del STICH I, en el que se incorporaron 601 pacientes con HIC supratentorial (superficial, lobar, tamaño de hematoma de 10 a 100 ml, sin hemorragia intraventricular y consciente en el momento de la presentación) dentro de las 48 h posteriores al inicio de los síntomas. STICH II también comparó la evacuación temprana del hematoma y el tratamiento médico solo. STICH II tampoco mostró diferencias en los resultados funcionales entre los dos grupos, pero un análisis post hoc sugirió que los pacientes con un mal pronóstico, según lo determinado por una ecuación específica basada en varias características del paciente, podrían beneficiarse de la cirugía. Uno de cada cinco pacientes en el grupo médico en STICH II pasó al grupo de cirugía. Ambos ensayos han sido criticados por sus estrechos criterios de inclusión, el uso de cirugía temprana solamente y una alta tasa de cruce de la médica a la cirugía tardía60.
Las pautas de la AHA/ASA de 201521 reconocen tanto los logros y las limitaciones de STICH y STICH II. Por lo tanto, si bien una política de cirugía temprana para los pacientes que cumplen los criterios de inclusión de STICH o STICH II no parece ser ni dañina ni beneficiosa, la evacuación del hematoma aún podría considerarse como una medida para salvar la vida de los pacientes en deterioro.
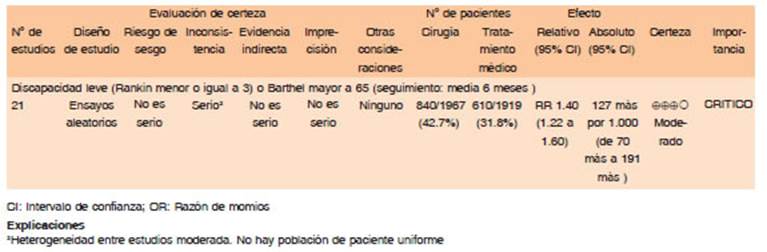
La revisión sistemática y el MA de Sondag y col.61, incluyó 21 estudios de tratamiento quirúrgico, cualquier tipo de cirugía, en pacientes con HIPe supratentorial. El análisis global evidencia superioridad de la cirugía por sobre el tratamiento médico conservador OR 1.4 (1.22-1.65) en términos de discapacidad a 6 meses. Este beneficio desaparece cuando solo se analizan los trabajos de alta calidad metodológica. Asimismo, la heterogeneidad de los pacientes incluidos, no permite sacar conclusiones sobre el subgrupo de pacientes que se benefician del tratamiento quirúrgico. Cuando se considera la mortalidad como desenlace, la craniectomía descompresiva ha mostrado ser superior al tratamiento médico RR 0.62 (0.46 -0.91) en pacientes con deterioro del estado neurológico.
Para la mayoría de los pacientes con HIPe supratentorial, la utilidad de la cirugía no está bien establecida (Calidad de evidencia: Moderada). La evacuación temprana del hematoma no es claramente beneficiosa en comparación con la evacuación del hematoma cuando los pacientes se deterioran (Calidad de evidencia: Alta) Se sugiere realizar craniectomía descompresiva como una medida para salvar vidas (Calidad de evidencia baja. Fuerza de recomendación: Fuerte a favor)
6.2
P Paciente con HIPe de fosa posterior
I Tratamiento quirúrgico
C Tratamiento médico estándar no quirúrgico
O Discapacidad al seguimiento (1 a 12 meses)
La hemorragia de la fosa posterior es la que tiene lugar en el cerebelo y/o el tronco encefálico. El compartimiento infratentorial es muy estrecho, lo que aumenta el riesgo de deterioro neurológico debido a la progresión de la hidrocefalia obstructiva o al efecto de masa local que conduce a la compresión del tronco encefálico. Es un subtipo grave de HIPe que pone en peligro la vida y que se produce en aproximadamente el 5 al 13% de todos los casos de las HIPe62.
Las hemorragias infratentoriales son un factor de riesgo independiente de mortalidad e independientemente del volumen del hematoma63. No hay ningún ensayo clínico controlado aleatorizado que compare la evacuación quirúrgica precoz ± craniectomía descompresiva suboccipital frente al tratamiento conservador de la hemorragia de la fosa posterior, y es muy poco probable que se realice un estudio de este tipo63,64. Los estudios observacionales han encontrado que los pacientes con HIC cerebelosa pueden evolucionar bien después de la evacuación del hematoma y que las características específicas de estos pacientes pueden incluir aquellos con hemorragia cerebelosa de 3 cm o más de diámetro, presencia de hidrocefalia obstructiva o con compresión del tronco encefálico65-67.
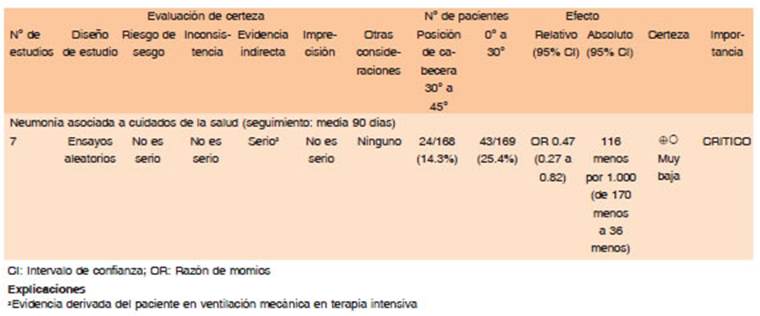
Las estrategias de tratamiento disponibles, como la craniectomía descompresiva suboccipital, la inserción de drenaje ventricular externo (DVE) para el tratamiento de la hidrocefalia o el tratamiento conservador, se basan en estudios de clase III. Estos estudios reflejados en las guías de la AHA/ASA de 2015 recomiendan que las hemorragias cerebelosas de 3 cm de diámetro o las hemorragias cerebelosas que comprimen el tronco encefálico o causan hidrocefalia aguda, pueden tratarse mejor con una cirugía precoz65.
Los pacientes con nivel de conciencia conservado [escala de Glasgow (GCS) 15 o 14] asociado con hematomas cerebelosos <3 cm de diámetro pueden tratarse inicialmente de forma conservadora; sin embargo, en caso de deterioro neurológico agudo (GCS ≤ 13), debe realizarse una craniectomía suboccipital urgente ± drenaje del hematoma66,68.
Da Pian y col. fue uno de los primeros grupos en estudiar los efectos del tratamiento quirúrgico de los hematomas de la fosa posterior. Realizaron un estudio retrospectivo multicéntrico en 22 hospitales italianos, con un total de 205 pacientes (155 hematomas cerebelosos y 50 hematomas del tronco encefálico). La mortalidad fue del 38% para los hematomas cerebelosos frente al 57% para los hematomas del tronco encefálico. En las hemorragias cerebelosas, el manejo médico fue mejor en comparación con el tratamiento quirúrgico, excepto en pacientes con hidrocefalia por obliteración del cuarto ventrículo o hemorragia intraventricular. El nivel de conciencia 3 horas después de la hemorragia inicial (es decir, pacientes despiertos) y el tamaño del hematoma (<3 cm) se asociaron significativamente con un mejor resultado69.
Kirollos y col. desarrollaron un sistema de clasificación basado en el tamaño, la configuración y la ubicación del cuarto ventrículo que se encuentran en la TC. Los pacientes con una GCS ≥13 y un cuarto ventrículo de Grado I (normal) y II (comprimido o distorsionado) podrían tratarse de forma conservadora. En caso de deterioro neurológico, GCS < 13, en presencia de hidrocefalia, los autores sugieren insertar una DVE, seguida de la evacuación del hematoma si no hay mejoría clínica. Para los pacientes con cuarto ventrículo de Grado III (completamente comprimido), independientemente del GCS, los autores sugieren realizar una evacuación del hematoma más drenaje del líquido cefalorraquídeo por medio de la de la inserción de un DVE62.
Recientemente, Kuramatsu y col. en un trabajo retrospectivo, se evaluó el impacto de la evacuación quirúrgica del hematoma cerebeloso sobre el resultado funcional. Los autores realizaron un metaanálisis de datos de pacientes individuales de cuatro estudios observacionales de HIPe tratados en 64 hospitales de EE.UU. y Alemania. El resultado primario fue la proporción de pacientes con resultado favorable (mRS = 0-3) a los 3 meses. Los resultados secundarios incluyeron lo siguiente: supervivencia a los 3 meses, resultado funcional dicotomizado (mRS 0-3 frente a 4-6) a los 12 meses y supervivencia a los 12 meses. De un total de 578 pacientes con hemorragia cerebelosa incluidos en la base de datos, 152 con evacuación quirúrgica del hematoma fueron emparejados por puntaje de propensión con 152 pacientes con tratamiento conservador. La evacuación del hematoma no se asoció con un mejor resultado funcional a los 3 meses (30.9% vs. 35.5%, p = 0.39). Sin embargo, la evacuación del hematoma se asoció significativamente con una mejor supervivencia a los 3 y 12 meses (78.3% vs. 61.2%, p = 0.001; 71.7% vs. 57.2%, p = 0.008, respectivamente). Se encontró que la evacuación quirúrgica de hematomas ≤ 12 ml era dañina (resultado funcional favorable reducido 30.6% vs. 62.3%, p = 0.003), mientras que la evacuación de hematomas ≥ 15 ml se asoció con una mejor supervivencia (mejor supervivencia 74.5% vs. 45.1%, p <0.001) sin un efecto beneficioso sobre el resultado funcional70.
La evacuación del hematoma de una hemorragia del tronco encefálico puede ser perjudicial en muchos casos y la hemorragia del tallo encefálico suele tratarse de forma conservadora65,71,72. El rol del tratamiento quirúrgico sigue siendo controvertido.
Las hemorragias del tronco encefálico, la pérdida inicial de conciencia y el tamaño del hematoma fueron los principales factores asociados con el resultado, independientemente de la presencia de hidrocefalia. El 93% de los pacientes con pérdida inicial de conciencia y el 100% de los pacientes comatosos 3 horas después del ACV experimentaron un desenlace desfavorable. Según los autores: “el tratamiento médico parece ser la mejor política para los hematomas del tronco encefálico de tamaño limitado; para lesiones más grandes (es decir, >1.8 cm), el resultado parece ser uniformemente fatal, independientemente del tratamiento empleado”.
Para la mayoría de los pacientes con HIPe cerebelosa 3 cm de diámetro, con compresión y/o deformidad del IV ventrículo la utilidad de la craniectomía occipital con drenaje del hematoma cerebeloso con o sin drenaje ventricular externo está bien establecida para disminuir la mortalidad (Calidad de evidencia baja. Dirección de recomendación: Fuerte a favor)
Para la mayoría de los pacientes con hemorragia del tronco encefálico, la intervención quirúrgica no es de utilidad. (Dirección de recomendación: Condicional en contra)
6.3
P Paciente con HIPe
I Tratamiento quirúrgico mínimamente invasivo
C Tratamiento médico estándar no quirúrgico
O Discapacidad al seguimiento (3 meses-12 meses)
La práctica de la craneotomía abierta no está exenta de riesgos y complicaciones. El tejido cerebral sano se daña durante este proceso. El uso de técnicas mínimamente invasivas tiene el beneficio teórico de producir un trauma quirúrgico mínimo en el tejido cerebral normal durante el proceso de drenaje del hematoma73.
El primer ensayo controlado de cirugía mínimamente invasiva para el HIPe se realizó en la década de 1980 y comparó el uso de la evacuación endoscópica (endoscopio de primera generación y no guiado por imágenes) del hematoma con el tratamiento conservador74. Auer y col. realizaron un estudio que incluyó a 100 pacientes con HIPe espontáneo, que presentaban déficits focales ± alteración del nivel de conciencia; hematoma cerebral ≥10 ml, y que fueron tratados dentro de las 48 h posteriores al ACVh. Los resultados se evaluaron a los 6 meses después de la hemorragia mediante una escala similar a la de Rankin modificada. El grupo quirúrgico con hemorragias subcorticales que estaban alertas o somnolientos perioperatoriamente mostró beneficios, logró una mortalidad más baja (42 frente a 70%, p < 0.01) y tasas más altas de resultados favorables (40 frente a 25%, p < 0.01). Por el contrario, en los pacientes en coma y/o en estupor y en hemorragias profundas (putaminales o talámicas) estos resultados fueron malos74. Los resultados promisorios aún deben replicarse en un ensayo clínico aleatorizado con adecuada potencia.
Vespa y col. publicaron el ensayo ICES (Cirugía Endoscópica Guiada por TC Intraoperatoria para Hemorragias Cerebrales)75. Un ensayo piloto multicéntrico controlado aleatorizado que evaluó la seguridad y eficacia del drenaje endoscópico de HIPe guiado por TC. El ensayo incluyó pacientes adultos con HIPe supratentorial dentro de las 48 h posteriores al ACV, que tenían un volumen de hematoma > 20 ml + GCS> 5 + NIHSS > 5. Catorce pacientes se sometieron a cirugía endoscópica guiada por imágenes tomográficas computarizadas intraoperatorias. Resultó en una disminución instantánea del volumen del hematoma en 68 ± 21.6% (rango intercuartílico 59-84.5), dentro de las 29 horas de la hemorragia. Los procedimientos quirúrgicos fueron muy rápidos con mediana 1.9 horas (RIC 1.5-2.2 horas), y solo se describió una complicación quirúrgica. En comparación con el grupo médico del ensayo MISTIE76, el grupo quirúrgico tuvo una tasa más alta no significativa de resultado neurológico favorable medida por mRS a los 12 meses (42.9% vs. 23.7%; p = 0.19). El estudio no tenía el poder estadístico suficiente para evaluar el resultado funcional y la mortalidad.
Una segunda aproximación de cirugía mínimamente invasiva para la HIPe es la colocación estereotáctica o guiada por imágenes de un catéter dentro del hematoma, seguida de la trombolisis dentro de la hemorragia/hematoma, con el objetivo final de mejorar la lisis y el drenaje del hematoma. Por lo general se deja un catéter dentro del hematoma, donde se administran con frecuencia pequeñas cantidades de un activador de plasminógeno de tipo tisular recombinante (r-TPa) para drenar el coágulo durante unos días.
La técnica de evacuación con catéter mínimamente invasiva seguida de trombolisis (MISTIE) puede ser un desafío técnico para cirujanos con niveles variables de experiencia. Un estudio de fase II ha demostrado la importancia de la colocación ideal del catéter para lograr una evacuación óptima del hematoma77. Con el fin de garantizar la precisión de la inserción del catéter y la eficacia del drenaje del hematoma, los estudios que utilizan la técnica MISTIE deben unificar los protocolos de formación del neurocirujano sobre la mejor selección de trayectorias quirúrgicas múltiples para la inserción del catéter en diferentes localizaciones del hematoma77,78. Esta técnica mínimamente invasiva parece ser segura76, factible, eficaz76,78 y reproducible78,79 y también se asocia con la reducción del volumen del hematoma y el edema perihematoma80. Sin embargo, los datos recientes derivados de ensayos controlados aleatorios no mostraron un beneficio significativo de esta técnica en comparación con el tratamiento conservador.
El estudio de fase 2 del MISTIE fue un ensayo aleatorizado, controlado, abierto, realizado en 26 centros de América del Norte y Europa77. Los pacientes adultos con HIPe + volumen de hematomas ≥ 20 ml se asignaron al azar a un tratamiento conservador o al protocolo MISTIE + alteplasa (0.3 mg o 1.0 mg cada 8 h hasta nueve dosis). Según el protocolo del estudio, los neurocirujanos debían seguir un procedimiento de 10 pasos, con el objetivo final de lograr una disminución del tamaño del coágulo a menos de 15 ml. La administración de trombolíticos se interrumpió cuando el hematoma residual era ≤15ml, o cuando se administraron las nueve dosis máximas de alteplasa, o en caso de complicación hemorrágica, definida como una disminución persistente ≥ 2 puntos en el GCS motor, asociada con un aumento en el volumen del hematoma confirmado por TC. El total de pacientes incluidos en el estudio fue de 96. La mortalidad a los 30 días [9.5%, (IC del 95%: 2.7 a 22.6) frente a 14.8%, (6.6 a 27.1), p = 0.542], hemorragia sintomática [2.4%, (0.1 a 12.6) frente a 9.3%, (3.1 -20.3), p = 0.226] y las infecciones cerebrales [2.4%, (0.1-12.6) frente a 0%, (0- 6.6), p = 0.438] no fueron diferentes entre los grupos de intervención y conservadores, respectivamente. Solo la hemorragia asintomática fue más frecuente en el grupo de intervención [22.2%; (IC del 95%: 12.0 a 35.6) frente al 7.1%; (1.5-19.5); p = 0.051).
Este estudio piloto de fase 2 demostró que la HIC puede dirigirse y drenarse de forma segura mediante inyecciones trombolíticas seriadas a través de un catéter dirigido estereotácticamente; por lo tanto, se llevó a cabo un ensayo de fase 3.
El ensayo MISTIE III fue un ensayo abierto de fase 3 que se llevó a cabo en 78 hospitales de América del Norte, Europa, Australia y Asia76. La dosis de alteplasa se limitó a 1.0 mg cada 8 horas hasta un máximo de nueve dosis. Pacientes adultos con HIPe supratentorial + volumen de hematoma ≥ 30 ml + GCS ≤ 14 o NIHSS ≥ 6, y estabilidad del hematoma (expansión del hematoma <5 ml) durante al menos 6 horas después de la TC diagnóstica. Se aleatorizó un total de 506 pacientes, 255 al grupo MISTIE frente a 251 al tratamiento conservador. El resultado primario fue el porcentaje de pacientes con resultado funcional favorable según la mRS (0 a 3) a los 12 meses. Aunque MISTIE condujo a una reducción media del tamaño del hematoma en un 69% en comparación con el 3% en el tratamiento conservador, no se encontró ningún beneficio en el resultado. A los 12 meses, 110 pacientes (45%) en el grupo MISTIE vs. 100 pacientes (41%) en el grupo conservador lograron un resultado favorable [diferencia de riesgo ajustada 4% (IC 95% - 4 a 12); p = 0.33]. El número de eventos adversos graves, como hemorragia sintomática e infecciones cerebrales, fue similar entre los dos grupos. La principal conclusión del estudio fue que MISTIE es seguro, pero no mejora el resultado funcional a largo plazo. Los autores realizaron un metaanálisis que incluía solo ensayos de MISTIE en varios sitios en los que el resultado funcional se evaluó mediante mRS o la escala de resultado de Glasgow ampliada evaluada a los 180 días. No se encontró ningún beneficio significativo en el MISTIE (OR 0.61; IC del 95%: 0.29 a 1.26).
La cirugía mínimamente invasiva con trombolisis (protocolo MISTIE) es segura pero no ha mostrado un beneficio en términos de funcionalidad a largo plazo. (Calidad de evidencia: Alta) Su uso rutinario no puede ser recomendado en pacientes con HIPe (Dirección de recomendación: Condicional en contra)
7. PROFILAXIS ANTICONVULSIVANTE
7.1
P Paciente con HIPe
I Observación
C Población general
O Desarrollo de crisis epilépticas a largo plazo
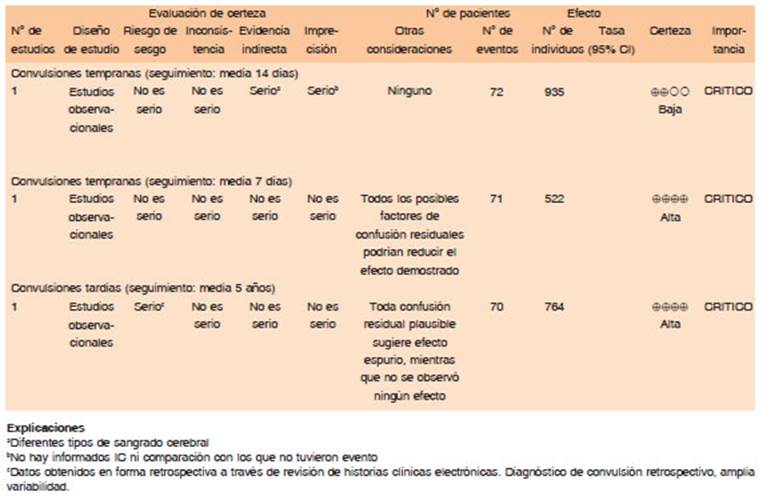
Una actualización de la literatura realizada en 2021, centrada en epidemiología de las crisis epilépticas posterior a la hemorragia intracraneal, realizó una revisión de las convulsiones en etapa aguda y de aparición tardía. En la etapa aguda, las convulsiones son más frecuentes en los ACVh que en los isquémicos, pero la incidencia informada es muy variable. Las comparaciones entre estudios son difíciles debido a las diferentes poblaciones, criterios para definir crisis y períodos de seguimiento. En estudios prospectivos, las crisis agudas variaron entre el 5 al 14%, en comparación con el 5-6% en pacientes con ACV isquémico. La mayoría de los episodios comiciales se producen en las primeras 72 horas luego del evento, lo que apoya la recomendación de monitorear en unidad de cuidados intensivos (UCI). Respecto a las crisis tardías, un estudio retrospectivo de 615 pacientes con ACVh que sobrevivieron más de 3 meses, en 83 (13.5%) desarrollaron epilepsia. El riesgo de epilepsia de nueva aparición posterior a un ACVh fue mayor durante el primer año con una incidencia acumulada del 6.8%. Otro estudio con un seguimiento más prolongado mostró una acumulación de riesgo del 11.8% a 5 años luego de un ACVh81,82.
Un estudio de cohortes prospectivo en pacientes con ACVh, evaluó la incidencia, factores asociados e influencia de las convulsiones en el pronóstico de los pacientes. Entre 2004 y 2009, reclutó 562 adultos con ACVh espontáneo, 40 fueron excluidos del análisis por presentar crisis previas. Las crisis tempranas ocurrieron en 71 casos (14%; intervalo de confianza [IC] del 95% 11-17) de 522 pacientes (274 varones; mediana de edad 72 años, rango intercuartílico 58-79 años)83.
Un análisis retrospectivo del estudio observacional de Helsinki ICH (n = 993; mediana de seguimiento, 2.7 años) y de la cohorte de pronóstico de Lille de HIC (n = 325; 2.2 años) de pacientes consecutivos con ACVh ingresados entre 2004 y 2010, evaluó los registros electrónicos de los pacientes para detectar: 1) convulsiones tempranas dentro de los 7 días posteriores al ACVh y entre los sobrevivientes de 7 días (n = 764) y 2) convulsiones tardías (epilepsia) que ocurrieron luego de los 7 días del ACVh. De los pacientes evaluados, el 11% tuvo convulsiones tempranas dentro de los 7 días posteriores al ACVh. Entre los sobrevivientes, 70 (9.2%) desarrollaron epilepsia. El riesgo acumulado de epilepsia fue de 7.1%, 10.0%, 10.2%, 11.0% y 11.8% en 1 a 5 años después del ACVh, respectivamente84.
Los pacientes con ACVh tienen riesgo incrementado de desarrollar epilepsia en comparación a la población general (Calidad de evidencia: Alta)
7.2
P Pacientes con HIPe
I Profilaxis antiepiléptica
C Observación clínica
O Crisis epiléptica sintomática temprana (≤ 7 días) o tardía (> 7 días)
En el año 2019 se publicó un MA cuyo objetivo fue evaluar si el uso de profilaxis antiepiléptica reduce el riesgo de resultados desfavorables y convulsiones en pacientes con HIPe. Se analizaron estudios observacionales y ensayos controlados aleatorios que evaluaron el uso de cualquier droga antiepiléptica (DAE) para la prevención primaria de convulsiones en pacientes adultos (≥ 18 años) con HIPe. El criterio principal de valoración fue la escala de mRS mayor a 3 en el seguimiento más prolongado registrado o mortalidad. También se evaluó la presencia de crisis tempranas y tardías. Identificaron 7 estudios con un total de 3241 pacientes para el análisis del resultado primario y 4 estudios con un total de 1861 pacientes para el análisis de los resultados secundarios. En general, el uso de fármacos antiepilépticos no se asoció con una mayor escala de mRS o con mayor mortalidad por todas las causas (OR: 0.99; IC 95 %, 0.66-1.49) o incidencia de crisis (OR: 0.89; 95 % IC, 0.52-1.51) en el tiempo de seguimiento más largo registrado. Cuando se evaluó solamente el riesgo de crisis tempranas, el OR fue de 0.94 (0.46-1.95)85.
Otro estudio analizó los datos del grupo placebo del ensayo Cerebral Hemorrhage and NXY-059 (CHANT), un ensayo aleatorizado multicéntrico internacional de un neuroprotector potencial que enroló a pacientes dentro de las 6 horas posteriores al inicio de un ACV hemorrágico agudo. Se realizó un análisis de regresión logística para determinar si el uso temprano de DAE se asoció con un mal resultado en el día 90, definido como una escala de mRS de 5 o 6. El análisis primario incluyó a 295 pacientes. Se produjeron convulsiones en 5 pacientes (1.7%) después del enrolamiento y 82 pacientes (28%) tuvieron un mal pronóstico a los 90 días. Se iniciaron DAE en 23 pacientes (8%) sin convulsiones documentadas durante los primeros 10 días del ensayo. En la regresión logística, el inicio de las DAE se asoció con un mal resultado (OR 6.8; IC 95%: 2.2-21.2, p = 0.001) después del ajuste por otros predictores conocidos (edad, volumen inicial del hematoma, presencia de sangre intraventricular, escala de Glasgow inicial y uso previo de warfarina). Como conclusión, en esta cohorte, las convulsiones fueron raras después de las primeras horas posteriores al ACV hemorrágico y el uso profiláctico de DAE se asoció con malos resultados independientemente de otros predictores establecidos86.
Se identificó un único estudio aleatorizado que comparó valproato (n=36) con placebo (n=36) administrado directamente después de una HIC, sin diferencia entre los grupos con respecto a la prevención de crisis sintomáticas agudas. Todos los demás datos que informan la incidencia de crisis sintomática aguda posterior al ACV hemorrágico son observacionales. El riesgo estimado luego de un ACVh o HSA es del 10 al 16%. La afectación cortical en el ACVh aumenta el riesgo de crisis comicial (hasta un 35%). Teniendo en cuenta esta evidencia, en la Guía para el manejo de convulsiones y epilepsia post-ACV realizada para la Organización Europea de ACV concluye que en la mayoría de los pacientes el riesgo de desarrollar convulsiones es bajo (aproximadamente 5%) y que sus consecuencias son limitadas, por lo cual sugiere no emplear profilaxis primaria con DAE. Como información adicional, se menciona que en situaciones con mayor riesgo de aparición de crisis sintomáticas agudas (como la afectación cortical), tampoco está justificada la profilaxis con DAE. Pero que, si por alguna razón la misma fue iniciada, debe ser finalizada después de la etapa aguda86,87. El uso profiláctico de fármacos antiepilépticos no ha demostrado ser eficaz para reducir las probabilidades de convulsiones recurrentes y pueden estar asociado a mal pronóstico23.
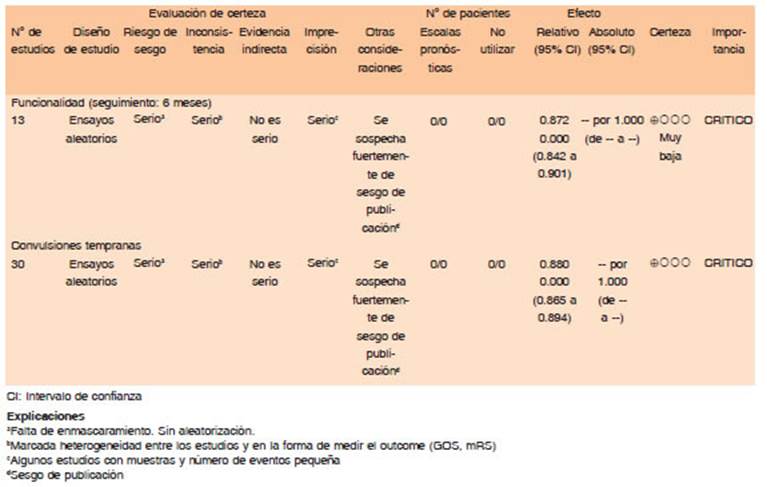
No se sugiere el uso profiláctico de DAE en pacientes con ACV hemorrágico para evitar crisis epilépticas tempranas o tardías. (Calidad de evidencia muy baja. Dirección de recomendación: Condicional en contra)
En el caso de haber iniciado tratamiento con DAE en forma profiláctica en pacientes con ACV hemorrágico, se sugiere finalizar el mismo luego de la etapa aguda. (Dirección de recomendación: Fuerte a favor)
7.3
P Pacientes con HIPe
I Utilizar profilaxis antiepiléptica
C No utilizar profilaxis antiepiléptica
O Discapacidad a largo plazo
La presencia de crisis epilépticas posterior a un HIPe se reporta entre un 2 a 40% de los casos88. La profilaxis de convulsiones en pacientes con HIPe actualmente es discutida. No está claro si existe beneficio a largo plazo con el uso de DAE y si su uso supera los potenciales efectos adversos. A la fecha, el uso rutinario profiláctico de DAE en pacientes con HIPe no se encuentra recomendado65.
Brian Spoelhof y col., realizaron un MA y una revisión sistemática sobre el impacto de las drogas antiepilépticas en el estado funcional a corto (3 meses) y largo plazo (12 meses) de los pacientes con HIPe. Se incluyeron 6 trabajos que cumplieron los criterios de inclusión y exclusión, con un total de 3193 pacientes. Se definió mal resultado a los pacientes con mRS mayor o igual a 3 o con NIHSS mayor o igual a 15. Aquellos con profilaxis antiepiléptica tuvieron un OR (95%IC) de 1.53 (0.81-2.82) para mal resultado. Dentro de este MA solo el estudio de Gilad y col., realizó seguimiento durante 1 año con OR (IC95%) 0.31(0.03 - 3.17). Los autores concluyen por lo tanto que no hubo diferencia significativa con el uso profiláctico de DAE en pacientes con HIPe en términos de discapacidad89. Estos resultados confirman los resultados del MA efectuado por Yao Z y col. el 2016 con 1285 pacientes90.
No se recomienda el uso de profilaxis anticonvulsivante en pacientes con HIPe para lograr mejores resultados funcionales (Dirección de recomendación condicional en contra. Calidad de evidencia: Baja)
7.4
P Pacientes con HIPe y deterioro del estado de conciencia en periodo agudo
I Realizar monitoreo con electroencefalograma (EEG) C No realizar monitoreo con EEG
O Crisis epilépticas no convulsivas (CENC)
Una actualización de la literatura efectuada en 2021 revisó la necesidad de realizar monitorización de electroencefalografía continua (mEEGc) en pacientes con ACVh internados en unidades de UCI. Se informan tasas de convulsiones sin manifestación clínica, en forma de crisis electroencefalográficas, entre el 28% al 63%81.
Un estudio retrospectivo de revisión de historias clínicas y trazados de EEGc realizado en 2007 tuvo como objetivo determinar la frecuencia y la importancia de las convulsiones electrográficas y otros hallazgos en el EEGc en pacientes con HIP. Se realizó la revisión de 102 pacientes consecutivos con HIP a los que se les realizó monitoreo EEGc. Las convulsiones ocurrieron en el 31% (n = 32) de los pacientes con HIP, y previo a la realización del EEGc en 19 pacientes. El 18% (n = 18) tuvo crisis electrográficas; solo uno de estos pacientes tuvo también convulsiones clínicas mientras estaba en EEGc. Como conclusión, arroja que las crisis epilépticas ocurrieron en un tercio de los pacientes con HIC y más de la mitad eran puramente electrográficas. Las convulsiones electrográficas se asociaron con la expansión del hematoma, y las descargas periódicas con HIC cortical y mal pronóstico91.
En un estudio unicéntrico de India, 57 pacientes con ACVh, con seguimiento de 24 meses, monitoreados con cEEG, mostró que 16 (28%) tuvieron crisis epilépticas con una duración media de 7.46 horas desde la conexión del EEG, de los cuales 15 (93%) solo tuvieron convulsiones electrográficas. La presencia de descargas periódicas lateralizadas con asociación a posteriores convulsiones clínicas tuvo significancia estadística. Otras variables, como ICH score (Intracerebral hemorrhage score), tamaño y la ubicación del hematoma, GCS y otros patrones de EEG, no se asociaron significativamente con las convulsiones92.
La recomendación de la Sociedad Europea de Terapia dice que: El uso de EEGc puede mejorar la detección de crisis epilépticas subclínicas. La sensibilidad del EEGc no es perfecta, ya que algunas descargas comiciales permanecen ciegas al EEG superficial. En la práctica, se recomienda el EEG de rutina en pacientes con ACVh con alteración de la conciencia inexplicable y persistente o en caso de sospecha de convulsiones con manifestación clínica asociada92,93.
En relación al tiempo de monitoreo, una revisión sistemática mostró un mejor rendimiento del mEEGc vs. monitoreo de rutina (mEEGr), en la detección de CENC (OR 2.57, IC95%: 1.11-5.9694. El último Consenso de la ACNS (American Clinical Neurophysiology Society) recomienda monitorear a los pacientes críticos con sospecha de CENC y/o Estatus Epiléptico No Convulsivo (EENC). El tiempo sugerido es de 24 h para los no comatosos y de 48 h para aquellos en coma95. En un estudio observacional retrospectivo de 242 pacientes la ausencia de actividad epileptiforme durante las primeras 2 h del mEEG se asoció a una probabilidad muy baja (1/101 pacientes) de hallar posteriormente dicha actividad si se continuaba el registro mientras que fue nula en los pacientes con trazados sin actividad epileptiforme durante las primeras 4 h96.
Los pacientes con ACVh en UCI tienen mayor incidencia de crisis subclínicas, por lo que el monitoreo EEGc es razonable (Calidad de evidencia muy baja. Fuerza de recomendación: Condicional a favor)
En centros que no cuentan con la posibilidad de realizar un mEEGc de 24 h, la presencia de un mEEG de al menos 2 h sin anormalidades epileptiformes se asocia a una muy baja probabilidad de hallar posteriormente actividad ictal. (Calidad de evidencia moderada. Fuerza de recomendación: Condicional a favor)
8. PRONÓSTICO
8.1
P Pacientes con HIpe
I Utilización de escalas clínicas preestablecidas
C Criterio clínico
O Predicción de mortalidad a 30 días
En una enfermedad con una mortalidad al mes del evento cercana al tercio de los casos, interesa reconocer a aquellos pacientes que presentan mayor probabilidad de que ocurra este desenlace97. Las escalas pronósticas en el hematoma intraparenquimatoso han sido ampliamente utilizados y estudiados en poblaciones heterogéneas. La necesidad de realizar un pronóstico en base a la presentación clínica o por imágenes motivó el desarrollo de numerosas herramientas, la mayoría de ellas analizadas en estudios de cohortes97,98. Dado que los estudios presentan poblaciones heterogéneas, con número de pacientes muy diversos, ausencia de cegamiento de datos y posibilidad de pérdida de datos en el seguimiento; existe riesgo de inconsistencia. De todas maneras, en el análisis conjunto de los estudios algunas escalas logran una buena precisión en la discriminación de pacientes que presentarán un resultado fatal.
Dentro de las escalas, la que cuenta con mayor número de estudios de validación es la escala de ICH score (validada en 53 estudios), sin diferencias significativas en superioridad con otras escalas como ICH Grading Scale (ICH-GS, validada en 14), FUNC (validado en 8) o ICH score modificada (mICH score, validada en 5)97-99. En Argentina, ha sido validada la escala ReC-HPC en HIC primaria en pacientes anticoagulados100,101.
Se sugiere la utilización de escalas pronósticas de mortalidad a 30 días, con el fin de facilitar el entendimiento y la comunicación entre colegas y con familiares (Calidad de evidencia baja. Dirección de recomendación: Condicional a favor).
8.2
P Pacientes con HIPe
I Scores clínico imagenológicos
C Criterio clínico
O Retiro de soporte terapéutico
Las escalas pronósticas en la HIC han demostrado utilidad en la predicción de mortalidad y buena evolución funcional102. La decisión de quite de soporte vital puede estar condicionada por vaticinios de mal pronóstico, que desencadenan conductas terapéuticas relacionadas a la profecía autocumplida, en pacientes que podrían tener una evolución favorable si hubieran recibido un tratamiento agresivo102-104. La mortalidad se ve claramente afectada por la decisión de mantener o quitar el soporte terapéutico en las primeras horas.
En un subanálisis del ensayo clínico INTERACT2, el quite de tratamiento activo se relacionó con incremento de la mortalidad y mala evolución funcional, siendo más frecuente esta decisión en los pacientes de mayor edad, mayor NIHSS, mayor volumen de hematoma o la presencia de hemorragia intraventricular105. En el registro multicéntrico publicado por Alkhachroum y col., la presencia de alteración de conciencia al ingreso se relacionó con mayor mortalidad intrahospitalaria y peor evolución funcional en los sobrevivientes, fuertemente influenciado por la decisión temprana del quite de soporte terapéutico103. En el estudio de Morgenstern y col. en una cohorte de pacientes con hemorragia intraparenquimatosa sin órdenes de no resucitación, la mortalidad a 30 días predicha por la escala de ICH score era de 50%, mientras que la mortalidad observada fue de 20.2%106. Los modelos pronósticos actuales podrían estar sesgados por no tener en cuenta la decisión de quite de soporte terapéutico de los pacientes103.
Debido a la escasa evidencia disponible respecto al uso de escalas pronósticas en la decisión de suspensión de soporte, sugerimos no utilizar dichas escalas para decidir el quite de soporte terapéutico en los pacientes con hemorragia intraparenquimatosa. (Calidad de evidencia muy baja. Recomendación: Condicional en contra)
9. PREVENCIÓN DE COMPLICACIONES
9.1
P Pacientes con HIPe
I Posición de cabecera 30° a 45° C Posición de cabecera a 0°
O Incidencia de neumonía asociada a cuidados de la salud (NACS)
La NACS es la infección más común entre los pacientes con enfermedades graves y especialmente aquellos que necesitan ventilación mecánica (VM), esta se ha asociado con un aumento de la mortalidad, la morbilidad, la duración de la estancia en UCI y la duración de la VM.
La cabecera elevada (30° a 45°), ha demostrado múltiples beneficios en los pacientes con injuria cerebral, ya que facilita el drenaje venoso del encéfalo, contribuyendo a la homeostasis cerebral y a la disminución de la hipertensión endocraneana.
La elevación de la cabecera genera beneficios que van más allá de los neurológicos, representa un procedimiento simple y de bajo coste, que es útil en el paquete de medidas para prevenir complicaciones de los pacientes gravemente enfermos como lo es la prevención de la NACS.
Con respecto a esto último, no existen estudios aleatorizados en la población específicamente con ACVh, solo estudios de baja calidad, por lo cual la evidencia deriva de los estudios de pacientes en VM críticamente enfermos.
En este contexto un MA publicado en el 2009, que analiza los datos extraídos de tres estudios controlados y aleatorizados que estudiaron la posición semisentada a 45° y cuatro ensayos clínicos aleatorizados que estudiaron la posición prona con un total de 337 y 1018 pacientes, respectivamente. Las probabilidades de desarrollar NACS diagnosticada clínicamente fueron significativamente menores entre los pacientes en la posición semisentada de 45° en comparación con los pacientes en la posición supina (OR = 0.47; IC del 95%, 0.27-0.82; 337 pacientes). El subanálisis con respecto a la incidencia de NACS documentada microbiológicamente, la duración de la estancia en UCI y la duración de la VM mostró que los pacientes en la posición semisentada de 45° tienen una tendencia moderada hacia mejores resultados clínicos107.
La elevación de la cabecera de 30° a 45° en pacientes con hemorragia intraparenquimatosa espontánea, sería seguro y efectivo en la prevención de NACS. (Calidad de evidencia moderada. Fuerza de recomendación: Fuerte a favor)
9.2
P Pacientes con HIPe
I Objetivo de glucemia < 140 mg/dl
C Objetivo de glucemia < 180 mg/dl
O Hipoglucemia sintomática y mortalidad
La hiperglucemia es un cuadro presente en pacientes críticos, siendo comunicada en hasta un tercio de los casos. Se describen como situaciones predisponentes ser diabético, infusión de soluciones dextrosadas y la respuesta al estrés en pacientes con resistencia a la insulina. Independientemente de la causa, la misma está asociada a peores resultados neurológicos108.
El estudio NICE-SUGAR enrolò 6104 pacientes críticos en un protocolo intensivo de control de glucemia (81 a 108 mg/dl) en comparación con un protocolo permisivo aceptando valores de glucemia hasta 180 mg/dl, reportando mayor tasa de hipoglucemia grave en el grupo intensivo OR 95% IC14.7 (9.0 to 25.9) así como mayor mortalidad a los 90 días OR (95% IC) 1.14 (1.02 a 1.28)109.
No encontramos estudios de calidad que evalúen los niveles de glucosa óptimos en pacientes con HIPe por lo que la evidencia se extrapola a aquellos con ACV isquémico.
El ensayo multicéntrico SHINE que asignó al azar a más de 1100 adultos con hiperglucemia y ACVi agudo a un tratamiento intensivo de hiperglucemia (infusión continua de insulina con una concentración de glucosa en sangre objetivo de 80 a 130 mg/dl) o tratamiento estándar (insulina subcutánea en una escala móvil con una glucosa objetivo de 80 a 179 mg/dl). A los 90 días, no hubo diferencia en la proporción de pacientes que alcanzaron un resultado funcional favorable entre los grupos de tratamiento intensivo y estándar (20.5% frente a 21.6%). Además, el retiro del tratamiento por hipoglucemia u otros eventos adversos fue más común en el grupo de tratamiento intensivo (11.2% frente a 3.2%)110.
De manera similar, una revisión sistemática de 2014 identificó 11 ensayos controlados que involucraron a casi más de 1500 adultos con ACVi agudo, que fueron asignados al azar a una terapia de infusión de insulina con monitoreo intensivo o al cuidado habitual; no hubo diferencia entre los grupos de tratamiento y control para el resultado combinado de muerte o dependencia, y no hubo diferencia entre los grupos para el resultado de déficit neurológico final. Además, el grupo de intervención tuvo una mayor tasa de hipoglucemia sintomática OR (IC 95%) 14.6 (6.63-32.21)108.
En pacientes con HIPe se recomienda el protocolo permisivo de glucemia (< 180 mg/dl) por sobre el estricto (81 a 130 mg/dl) dado el mayor riesgo de hipoglucemia grave en este último grupo. (Calidad de evidencia alta. Dirección de recomendación: Fuerte a favor)
En pacientes con HIPe se recomienda el protocolo permisivo de glucemia (< 180 mg/dl) por sobre el estricto (81 a 130 mg/dl) dado la mayor mortalidad en este último grupo. (Calidad de evidencia moderada. Dirección de recomendación: Fuerte a favor)
9.3
P Pacientes internados con HIPe
I Profilaxis farmacológica (HBPM o HNF)
C Profilaxis mecánica (medias de compresión gradual o compresión neumática intermitente)
O Incidencia de troemboembolismo venoso y mortalidad
El tromboembolismo venoso (TEV) es una de las complicaciones más frecuentes del ACVh, relacionada a la inmovilización. Se describen otros factores de riesgo como la edad, el déficit motor, el dímero D y PCR elevados, el NIHSS elevado y los antecedentes previos de un TEV111.
Existe controversia en relación al tiempo de inicio, tipo y duración de la profilaxis, basados en el riesgo de aumentar el sangrado y crecimiento del hematoma111,112.
De acuerdo a las guías NICE 2018 y canadienses 2021 el uso de dispositivos de compresión neumática intermitente (IPCD) es recomendado para prevenir el TEV hasta que el hematoma estabilice su tamaño y puedan utilizarse drogas antitrombóticas después de las 48 horas. El uso de IPCD, está contraindicado en fracturas, deformaciones óseas e insuficiencia cardíaca23,113.
Con respecto a la quimioprofilaxis, un MA publicado en el 2011 que incluyó cuatro trabajos controlados mostraron una reducción significativa de embolismo pulmonar con el uso de heparina profiláctica. Sin embargo, la preocupación continúa siendo por el riesgo de expansión del HIC y la recurrencia111.
Un segundo MA publicado en el 2019 intentó demostrar que tanto la heparina de bajo peso molecular (HBPM) como la heparina no fraccionada (HNF) versus profilaxis mecánica, basado en la revisión de 9 estudios, resultó concluir que son relativamente seguras con respecto al crecimiento del hematoma, la funcionalidad y mortalidad, incluso con dosis de HBPM de 30 mg 2 veces por día para pacientes de alto riesgo111,112. Una revisión del 2021 donde solo rescata dos trabajos prospectivos aleatorizados, concluye que la heparina profiláctica podría ser relativamente segura iniciarla dentro de las 24 a 48 h por no estar asociada al crecimiento o recurrencia del HIC, sin embargo, no parece ser efectiva para reducir el riesgo de TEV. Con respecto a la dosis de HBPM varía de 20 a 40 mg diarios o HNF 2500 a 5000 UI cada 8 a 12 h para los dos MA114.
La profilaxis antitrombótica debería iniciarse de inmediato para evitar las complicaciones tromboembólicas en pacientes con HIPe (Calidad de evidencia: Baja. Dirección de recomendación: Fuerte a favor)
Dentro de las primeras 48 horas, los sistemas de compresión neumática intermitente parecen ser efectivos y menos riesgosos. (Calidad de evidencia: Alta. Dirección de recomendación: Fuerte a favor)
El uso de HBPM en dosis de 40 mg/día o HNF 5000 UI cada 8 o 12 h no ocasiona mayor tasa de sangrados comparado con métodos mecánicos cuando se inicia 24 a 48 h posteriores al sangrado. (Calidad de evidencia: Baja. Dirección de recomendación: Fuerte a favor)
9.4
P Pacientes con HIPe
I Protocolo estandarizado de evaluación de disfagia
C Juicio clínico
O Neumonía por broncoaspiración
La alteración de la deglución se presenta en más del 50% de los pacientes con ACV agudo y se asocia con riesgo de neumonía, deshidratación y malnutrición. La presencia de deterioro del sensorio, pérdida del reflejo deglutorio, ausencia de reflejo tusígeno, disfonía, oclusión labial incompleta, compromiso de los pares craneanos o puntaje de score NIHSS, son signos de alerta y requieren un enfoque multidisciplinario115.
En un MA de 21 trabajos, la evaluación formal de la disfagia se asoció a menor incidencia de neumonía hospitalaria OR (IC) 0.57 (0.45-0.72), menor mortalidad OR (IC) 0.52 (0.35-0.57) y menor dependencia funcional OR (IC) 0.54 (0.35-0.85). Como desventajas, más de la mitad de los trabajos incluidos no informaron el método de screening utilizado y solo 12 informaron una herramienta de screening validada116.
Actualmente están validados distintos protocolos como Toronto Bedside Swallowing Sreening Test, Water-Swallow-Test y Multiple-Consistency-Test (previamente llamado GUSS). Existe poca evidencia de cuál es el óptimo protocolo de screening por falta de trabajos comparativos115. Con respecto al momento de realizarlo, una cohorte prospectiva de 12 276 pacientes observó que el screening de disfagia en las primeras 24 h de iniciados los síntomas, se asocia de manera independiente con disminución de riesgo de neumonía OR IC 0.68 (0.52-0.89) comparado con la no realización o la realización tardía116,117.
En todos los pacientes con HIPe se debe realizar evaluación de deglución para disminuir el riesgo de neumonía, discapacidad y mortalidad. (Calidad de evidencia: Moderada. Dirección de recomendación: Fuerte a favor) Se sugiere realizar screening dentro de las 24 h de iniciados los síntomas para disminuir el riesgo de neumonía (Calidad de evidencia: Muy baja. Dirección de recomendación: Fuerte a favor)
No existe evidencia para recomendar un protocolo en particular, pero se sugiere utilizar un instrumento previamente validado (Dirección de recomendación: Condicional a favor)
10. REINICIO DE ANTITROMBÓTICOS
10.1
P Pacientes con HIPe
I Reinicio de tratamiento con antiagregantes
C No reinicio
O Resangrado cerebral
El estudio RESTART es el primer estudio aleatorizado controlado que compara la reinstalación de antiplaquetarios (AAS, clopidogrel o dipiridamol, sujeto a indicación del médico tratante entre 29 y 146 días post ACVh, mediana 76,) vs. evitar los antiplaquetarios luego de ACVh ocurrido durante el uso de antitrombóticos. Con una mediana de seguimiento a 5 años, el grupo de reinicio de antitrombóticos no presentó mayor riesgo de sangrado cerebral recurrente sintomático HR 0.51 (IC) (0.25-1.03). Dado que los pacientes estaban bajo tratamiento con antitrombóticos, todos ellos tenían algún grado de riesgo de eventos vasculares isquémicos, hallando que el riesgo de recurrencia de HIC al reinstalar antiplaquetarios es demasiado bajo con respecto al riesgo de eventos isquémicos118. El Extended Follow-up of the RESTART Randomized Clinical Trial, prolongó el seguimiento a 7 años y tampoco encontró diferencias estadísticamente significativas en cuanto a recurrencia de HIPe en pacientes sometidos a reinicio de antitrombóticos (HR 0.87; 95% CI, 0.49-1.55)118,119.
Ambos estudios demuestran seguridad en la reinstalación del tratamiento con antiplaquetarios en pacientes que requieren prevención de eventos isquémicos.
El reinicio de fármacos antiplaquetarios luego de HIC es seguro en la prevención de nuevos eventos mayores isquémicos vasculares a largo plazo. (Calidad de evidencia: Moderada. Fuerza de recomendación: Condicional a favor)
10.2
P Pacientes con HIPe lobar
I Reinicio de anticoagulantes
C No reiniciar anticoagulantes
O Resangrado cerebral, oclusión de gran vaso y muerte de causa cardiovascular
Estudios observacionales sugieren que la reanudación de los anticoagulantes luego de ACVh se asocia a disminución de eventos isquémicos con bajo riesgo de recurrencia de ACVh, de modo que esta conducta se asociaría a mejor pronóstico vital y funcional. En el caso de pacientes con FA, la anticoagulación disminuye en dos tercios o más el riesgo de ACV isquémico, pero no hay información fehaciente en aquellos que hayan padecido HIPe.
El estudio SoSTART es el mayor estudio prospectivo aleatorizado que incluyó 203 pacientes con FA y sobrevivientes a ACVh, en grupos similares que recibieron anticoagulación (AVK o AOD) o no la recibieron, con seguimiento durante un año. Los investigadores no encontraron evidencia de inferioridad en instalar anticoagulación vs. evitarla en pacientes con HIPe previo. Asimismo, análisis secundarios de eficacia mostraron tendencia estadísticamente no significativa al beneficio en prevención de eventos isquémicos120.
Según otro estudio prospectivo en dos cohortes con ACVh, totalizando 674 pacientes, evaluando riesgo de eventos isquémicos (ACVi, IAM y otros eventos vasculares mayores) discriminados según la localización lobar o no lobar del HIPe, y presencia o no de FA, se observó que solo los pacientes con HIPe lobar sin FA tenían mayor riesgo de recurrencia de ACVh que de ACVi o eventos vasculares121.
El reinicio de tratamiento anticoagulante podría ser beneficioso y seguro en pacientes con HIPe no lobar y FA (Calidad de evidencia: Baja. Recomendación: Fuerte a favor)
En los pacientes con HIPe lobar y sin FA la decisión dependerá de la evaluación individual, sopesando riesgo de sangrado o riesgo de evento isquémico (Calidad de evidencia: Baja. Recomendación: Condicional en contra)
La aplicación de escalas CHA2Ds2- VASc y HAS- BLED serían herramientas de utilidad (Recomendación: Fuerte a favor)
10.3
P Pacientes con HIPe e indicación de anticoagulación para prevención secundaria
I Anticoagulantes orales directos
C Anticoagulantes antagonistas de vitamina K
O Resangrado cerebral
El reinicio de un tratamiento anticoagulante en pacientes con HIPe constituye un desafío actual. El riesgo de resangrado cerebral debe balancearse con el riesgo de eventos trombóticos en pacientes que tienen indicación de anticoagulación122. Un elemento fundamental constituye la elección del fármaco anticoagulante. Ensayos previos en prevención secundaria de ACVi evidenciaron que los AOD presentaron menores tasas de sangrado cerebral comparativamente con AVK123-125. En el caso de RELY123, por ejemplo, en la rama dabigatrán se presentaron hemorragias intracraneales en un 0.10% anual vs. 0.38% anual con warfarina RR IC 95 0.26 (0.14-0.49). De la misma manera, la mortalidad de causa vascular fue menor con dabigatrán vs. warfarina RR IC 0.85 (0.72-0.99). El uso de Rivaroxaban mostró menores tasas de hemorragia intracraneal 0.8% anual vs 1.2 % anual HR IC 0.67 (0.47-0.93) p 0.02, tras ser comparado con warfarina. sin diferencias estadísticas en relación a la mortalidad124. Por último, apiaxbán demostró una tasa menor de hemorragia intracraneal al ser comparado contra warfarina HR IC 0.42 (0.30-0.58) < 0.001 y menor tasa de mortalidad por cualquier causa HR 95 CI 0.89 (0.80-0.998) p0.047125. Es relevante mencionar que en estos ensayos se excluyeron pacientes con HIPe por lo que la interpretación de estos resultados en HIPe debe ser cuidadosa.
Un estudio observacional de 622 pacientes con historia de hemorragia intracraneal y requerimiento de anticoagulación por FA, realizó la comparación entre ambos grupos farmacológicos y demostró una tendencia no significativa de menor riesgo de sangrado cerebral a 1 y 3 años con el uso de AOD vs. warfarina RA 7.85% vs. 7.35%; RD 0.51% (−3.77% to 4.78%)122.
El ensayo ASPIRE de Fase III, actualmente en fase de reclutamiento programado hasta el 2024, intentará demostrar beneficio de apixabán sobre antiagregación en pacientes con ACVh y FA126.
La evidencia actual es insuficiente para recomendar el uso de un fármaco sobre otro en pacientes con HIPe que requieran anticoagulación. En casos de FA no valvular podría optarse por ACOD por sobre AVK dado su menor tendencia a sangrado. (Calidad de evidencia: Muy baja. Recomendación: Condicional a favor)
Conclusión
La morbimortalidad de esta entidad genera un desafío terapéutico en los profesionales que la asisten. Se intentó reunir un equipo multidisciplinario de profesionales con diferentes especialidades para generar recomendaciones actualizadas y concisas sobre el manejo de esta enfermedad. La participación de pacientes en la confección de este manuscrito, genera una visión inclusiva de sus expectativas y decisiones para lograr una toma de decisiones consensuada.