PUNTOS CLAVE
Conocimiento actual
• El carcinoma hepatocelular es una enfermedad agresiva que asienta la mayoría de las veces sobre hígado cirró tico. A pesar de su alta prevalencia y múltiples ensayos dedicados a su estudio, su pronóstico continúa siendo desfavorable, y su mejor posibilidad de curación es el trasplante hepático.
Contribución del artículo
• Este estudio describe de forma holística el hepatocar cinoma. La supervivencia global y tiempo libre de recu rrencia están en concordancia a aquellos informados a nivel global, pero el estudio deja en evidencia que aún hay mucho para hacer en la lucha contra el hepatocar cinoma.
El hepatocarcinoma (HCC) es el tumor hepático pri mario más frecuente, con 905 677 casos diagnosticados y 830 180 muertes en 2020 en todo el mundo, y una incidencia mundial ajustada por edad de 9.5 casos por 100 000 personas-año. El mismo ocupa el sexto lugar en cuanto a frecuencia, y el tercero en muertes por cáncer1. Las tasas más altas del mundo se encuentran en Asia y África. En Argentina, representa la 9na causa de muerte por cáncer en varones y la 10ma en mujeres, con una tasa ajustada entre 2007-2011 de 4.3 y 2.3 respectivamen te2. El 90% de los HCC asienta sobre una enfermedad hepática, secundaria a hepatitis virales (VHB o VHC) o consumo de alcohol. La vacunación universal contra el VHB y una amplia implementación de antivirales de acción directa (AAD) contra el VHC, por un lado y al aumento considerable de afecciones metabólicas y obesidad, por otro, están modificando el panorama epidemiológico del HCC a nivel mundial.
A diferencia de otros tumores altamente prevalentes, el nivel de evidencia científica de las opciones terapéu ticas para el HCC está mayoritariamente restringido a estudios de cohortes, careciendo actualmente de evi dencias científicas de peso. Los mejores resultados de supervivencia a largo plazo están dados por el abordaje quirúrgico: trasplante hepático (TH), resección hepática (RH) y ablación por radiofrecuencia (RFA). Los únicos tratamientos no curativos que mejoran la supervivencia son la quimioembolización transarterial3 (TACE) y el tratamiento sistémico con sorafenib4. Estudios recientes han intentado demostrar la no inferioridad de otras dro gas comparadas al sorafenib, como el atezolizumab y el bevacizumab5-8.
En términos epidemiológicos, la obtención de infor mación confiable acerca de la incidencia del HCC a nivel mundial continúa siendo dificultosa, ya que casi tres cuartas partes de la población mundial no se encuentra cubierta por los registros nacionales estadísticos de cán cer. La información acerca de la prevalencia, la incidencia y los factores de riesgo para el HCC en Latinoamérica es, cuando menos, limitada. Actualmente en la Argentina ca recemos de datos firmes acerca de la incidencia del HCC, factores de riesgo, asociación del mismo al uso de nuevas terapias contra el VHC basadas en AAD, aplicabilidad de los tratamientos, y supervivencia de los pacientes9. El objetivo del trabajo fue caracterizar epidemiológicamente a los pacientes con HCC en el Hospital Italiano de Bue nos Aires (HIBA) en un lapso de 12 años. Los objetivos secundarios fueron: describir el proceso diagnóstico de los casos de HCC; su caracterización demográfica, clínica y etiológica; conocer la evolución de los pacientes con HCC según el tratamiento recibido y, por último, conocer la incidencia y mortalidad por HCC en la población del sistema de medicina prepaga denominado Plan de Salud del HIBA (PS-HIBA).
Materiales y métodos
Se realizó un estudio retrospectivo de cohorte observacional analítico, cuantitativo, en mayores de 18 años con diagnós tico de HCC, entre enero de 2007 y diciembre del 2018 en el HIBA. Todos los datos del estudio fueron tratados con máxima confidencialidad, con acceso restringido solo para el personal autorizado.
El trabajo cuenta con la aprobación del Comité de Ética de Protocolos de Investigación (CEPI) del Instituto del Hospital Italiano de Buenos Aires (Número de protocolo 3474).
Se consideró población a toda persona con diagnóstico de HCC atendida en el HIBA en el período estudiado. Se seleccionaron casos con HCC confirmado y seguimiento o tratamiento en el HIBA. Se consideró como universo a la población de afiliados al PS-HIBA para conocer la tasa de incidencia y mortalidad por HCC.
Los datos utilizados se obtuvieron a partir del sistema de información hospitalario (SIH). La información fue obtenida de la historia clínica electrónica (HCE). Se revisaron manualmen te las HCE, para validar cada caso incidente y recolectar los datos. Se utilizó la información del padrón del PS-HIBA para la obtención de los denominadores en la conformación de tasas.
Se consideró al paciente con sospecha de pérdida de se guimiento, a aquel con diagnóstico de HCC sin contacto con el sistema de salud durante seis meses. En esos casos se proce dió al llamado telefónico para recabar datos del seguimiento.
Se utilizaron definiciones específicas para el diagnóstico del HCC, y su estatificación, la cirrosis, el tiempo libre de enfermedad y la supervivencia global.
Diagnóstico de HCC: Paciente atendido en el HIBA con diagnóstico de HCC por estudios de imágenes o anatomo patológicos. En aquellos pacientes diagnosticados previos al 2011, se utilizaron criterios estipulados por distintas guías y consensos para el diagnóstico por imágenes. A partir del 2011, se empezó a utilizar el sistema LI-RADS10, en al me nos un método de alta calidad (tomografía abdominopélvica trifásica, o resonancia magnética abdominal contrastada con gadolinio). Se cotejaron las imágenes previas al 2011 con el sistema LI-RADS, para una validación retrospectiva del mismo. La enfermedad a distancia se estudió con tomografía de tórax y centellograma óseo. El seguimiento se realizó con imagen dinámica hepática de forma trimestral, para el control y reestatificación tumoral.
Se usaron los criterios de Milán11 para la selección de candidatos a trasplante hepático y los estadios de Bar celona12, para establecer la clasificación pronóstica del tumor y abordaje terapéutico. Utilizando los conceptos desarrollados por Forner y col.13, se dividieron los trata mientos en tres grupos, según su objetivo: aquellos con intención curativa (TH, RH o RFA), aquellos con intención “no curativa”, (quimioembolización, radioembolización, quimioterapia y alcoholización), y por último el grupo de pacientes con tratamiento “paliativo” o sin tratamiento. La decisión de elegir un tratamiento fue tomada en ateneo interdisciplinario, teniendo en cuenta posibles dificultades técnicas, así como características generales. La RH fue el tratamiento de elección en pacientes con tumores únicos sin hipertensión portal clínicamente significativa, y con función hepática preservada. Para aquellos pacientes con tumores multicéntricos o con hipertensión portal o alteración de la función hepática, la decisión se tomó teniendo en cuenta las comorbilidades de los pacientes y la elegibilidad para TH. En aquellos casos sin posibilidad de trasplante, se optó por la RFA. Se registró a aquellos que recibieron terapias “puente” o “downstaging”, con el fin de contemporizar su enfermedad y poder acceder al trasplante hepático.
Supervivencia global: Período transcurrido desde la administración del tratamiento en estudio hasta el último contacto o el fallecimiento. Expresado en meses.
Tiempo libre de enfermedad: El tiempo desde el tra tamiento curativo del HCC hasta la recurrencia clínica, radiológica o analítica de la enfermedad. Solamente se analizó en los casos de tratamiento curativo, siendo éstos los únicos que se podrían considerar “libres de enfermedad”. Este tiempo se expresó en meses desde la intervención hasta la recurrencia de la enfermedad, o la pérdida del seguimiento.
Cirrosis: Se determinó mediante estudios del tejido hepático como la biopsia hepática o el fibroscan (utilizando la escala METAVIR14), o con la manifestación clínica de complicaciones extrahepáticas (varices esofágicas por endoscopia, asociadas a plaquetopenia). Se utilizó la clasificación de Child-Pugh, para establecer el pronóstico de la cirrosis hepática a 5 años15.
Se analizaron distintas variables demográficas relacio nadas al HCC. Las variables discretas fueron expresadas en valor absoluto y su porcentaje del total, mientras que las variables continuas fueron expresadas utilizando la media y el desvío estándar o la mediana y el rango inter cuartílico, dependiendo de su distribución. Los cálculos se realizaron utilizando el programa estadístico Stata MP 14 (Statacorp, Texas).
Se calculó la mediana de tiempo a la recurrencia y a la supervivencia desde el diagnóstico de HCC. Se estimó la tasa de letalidad de HCC según el método de Kaplan- Meier. Se calculó la tasa de incidencia acumulada de HCC, crudas y estandarizadas según edad (en estratos de 10 años) a la población mundial, cada 100 000 afiliados al PS HIBA con su IC95%. El dato del padrón de afiliados para el denominador se obtuvo realizando un corte a mitad de cada año del período de estudio. Se excluyeron los casos que ingresaron al PS-HIBA en un plazo menor a 1 año del diagnóstico de HCC, con el fin de excluir aquellos casos prevalentes. Se calcularon las tasas específicas por sexo y por edad en estratos cada 10 años de incidencia y mortalidad de HCC cada 100 000 afiliados con su IC95%, para todo el período de estudio. Por otro lado, se analizó la tendencia de las tasas de incidencia de HCC según causa en la población del PS-HIBA.
Resultados
En total se relevaron 3234 HCE, de los cuales el 20.7% (671 registros) presentaron HCC. Luego de eliminar registros duplicados y aquellos con datos insuficientes para ser incluidos en este estudio, se obtuvieron 521 pacientes (Fig. 1).
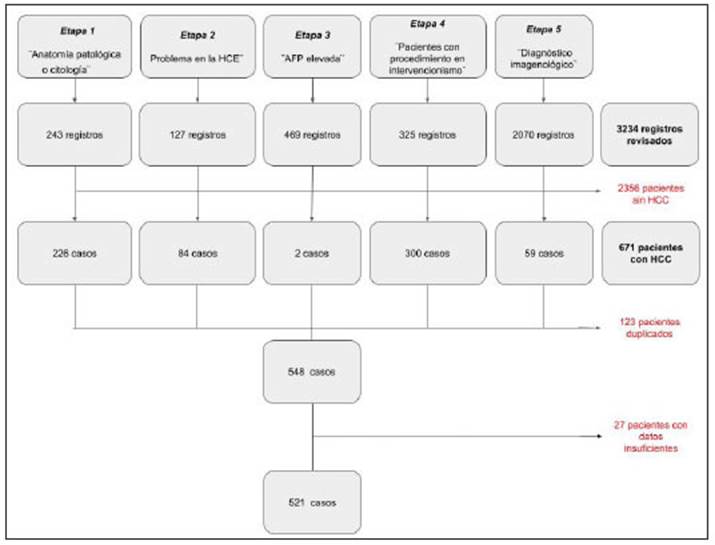
Fig. 1 Flujograma de selección de pacientes. Se describen las cinco etapas de búsqueda en el sistema informatizado. Del total de 3234 historias relevadas, solamente 671 tenían hepatocarcinoma. Se eliminaron 123 registros duplicados y 27 pacientes por datos insuficientes, para llegar al total de 521 pacientes
El 71% de nuestra población era masculina, con una edad promedio de 64 años. El 77% de los casos se asen taron sobre hígado cirrótico. Dentro de las causas de la cirrosis, casi el 50% respondió a causas virales, y el 31% a metabólicas (hepatitis alcohólica y no alcohólica). Los datos demográficos y características de los pacientes se muestran en la Tabla 1.

Tabla 1 Características demográficas y diagnósticas de los pacientes diagnosticados con HCC entre 2007 y 2018 (n= 521)
La supervivencia global para nuestra población a 1, 3 y 5 años fue de 58%, 46% y 36%. El total de fallecidos fue de 305 (58.5%). De aque llos sobrevivientes (216 pacientes), el 33.3% (71) tenía un seguimiento menor a 24 meses. Se estratificaron los pacientes según la presencia o no de cirrosis. Las curvas para cada población se ven representadas en la Figura 2. La supervivencia global a 1, 3 y 5 años para el grupo cirrótico fue de 73%, 48% y 35%, mientras que para el grupo sin cirrosis fue de 69%, 46% y 40% respectivamen te. La media de seguimiento para el grupo cirrótico y no cirrótico fue de 34.3 y 31.6 meses respectivamente, sin significancia estadística (p > 0.05).

Fig. 2 Supervivencia global de pacientes con hepatocarcinoma. Se muestran las cur vas de supervivencia global en pacientes con HCC en nuestra población, diferencian do entre aquellos pacientes con cirrosis y sin cirrosis. A los 100 meses, aún había 32 pacientes en seguimiento (22 en el grupo cirrótico y 10 en el grupo sin cirrosis)
Al analizar la supervivencia del grupo cirrótico, se ob servaron diferencias dependiendo del tratamiento. Estas diferencias se ven plasmadas en las curvas de Kaplan Meier (Fig. 3).
Fig. 3. Supervivencia según grupo de tratamiento. Se observaron diferencias signi ficativas en la supervivencia según el grupo de tratamiento, con una p < 0.05 al comparar a los tratamientos curativo y no curativo con el paliativo, y al comparar al tratamiento curativo y el no curativo
La supervivencia a 1, 3 y 5 años para los pacientes con tratamiento paliativo fue de 35%, 14% y 0%, mientras que para los pacientes con tratamiento no curativo fue de 70%, 32% y 14% respectivamente. Por último, los pacientes que recibieron tratamiento curativo tuvieron una supervivencia del 90%, 70% y 58% (Tabla 2). La diferencia entre los tres grupos fue estadísticamente significativa (p < 0.005) en la prueba de Log-Rank.

Tabla 2 Caracterización del seguimiento de los pacientes con diagnóstico de hepatocarcinoma durante los años 2007 al 2018 (N = 521)
Se analizó la recurrencia en los casos que recibieron tratamiento curativo. La supervivencia libre de enfermedad en pacientes cirróticos a 1, 3 y 5 años fue de 92%, 77% y 67%. Posteriormente se realizó un análisis de la recurrencia por subgrupos, desglosado en sus tres alternativas: TH, RQ o RFA (Fig. 4). Se realizaron pruebas de log-rank comparando los tres tipos de tratamiento, evidenciándose una diferencia estadísticamente significativa al comparar tanto el TH y la RFA con la RH (p < 0.005). El tiempo libre de enfermedad a 1, 3 y 5 años fue de 75%, 43% y 24% para el grupo resecado, 98%, 87% y 81% para el grupo trasplantado y 97% 88% y 77% para el grupo ablacionado. Al estratificar las pérdidas de seguimiento según el tra tamiento, se observó una diferencia significativa entre aquellos que recibieron tratamiento paliativo, y los que recibieron algún tipo de tratamiento, curativo o no. No se encontraron diferencias significativas al estratificar por sexo y edad (Tablas 3 y 4).
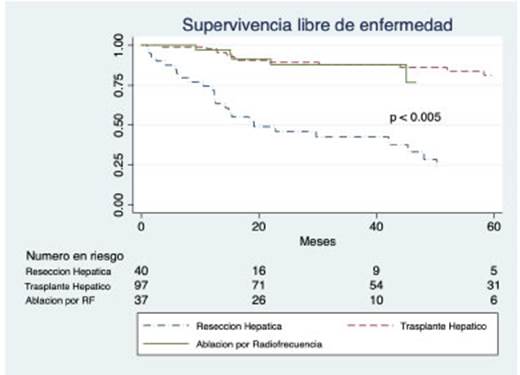
Fig. 4 Supervivencia libre de enfermedad según el subgrupo de tratamiento curativo en pacientes cirróticos. Se expresan las curvas de supervivencia según las tres opciones de tratamiento curativo (resección quirúrgica, trasplante hepático y ablación por radiofre cuencia). Tanto el trasplante como la ablación por radiofrecuencia mostraron diferencias significativas (p<0.005) comparados con la resección quirúrgica

Tabla 3 Distribución del tratamiento de los pacientes con hepatocarcinoma en el Hospital Italiano de Buenos Aires, 2007-2018 (n = 521)

Tabla 4 Diferencias en la pérdida de seguimiento a los 24 meses según grupos de tratamiento (n = 216)
Cabe destacar que, si bien la mediana de superviven cia fue de 32 meses para toda la cohorte, se encontraron diferencias significativas dependiendo del tratamiento ins taurado. En el grupo que recibió tratamiento paliativo fue de 5.3 meses, mientras que en aquellos con tratamiento no curativo y curativo fue de 23 y 75.1 meses respectiva mente. Las pruebas de Log-Rank comparando los grupos de tratamientos mostraron diferencias significativas tanto para los tratamientos no curativo y curativo comparados al tratamiento paliativo (p < 0.005), como también entre los tratamientos curativo y no curativo entre sí (p < 0.005).
Se analizaron a los pacientes cirróticos según el estadio BCLC asignado al momento del diagnóstico del HCC. Del total de 401 pacientes cirróticos, el 57.7% (231 pacientes) correspondían a BCLC A, 36.7% a BCLC B (147 pacientes), y 18 pacientes a BCLC C-D (4.4%). En 5 casos no fue posible recabar el estadio BCLC al momento del diagnóstico. Posteriormente, se revisaron los tratamientos efectuados según cada grupo de BCLC.
En lo que respecta a los pacientes BCLC A, el 63% recibió algún tipo de tratamiento curativo (147 pacientes), un 23% recibió tratamiento no curativo (más específica mente TACE), mientras que 31 pacientes no recibieron tratamiento en nuestro centro; 92 pacientes estratificados al momento del diagnóstico como BCLC A recibieron un trasplante hepático. De estos 92 pacientes, 50 fueron sometidos a algún tipo de terapia puente (TACE, RFA) para poder continuar en lista de trasplante y ser candi datos al mismo. De manera similar, los 53 pacientes de este grupo que recibieron TACE lo hicieron con el fin de contemporizar el trasplante hepático, al cual por diversos motivos no pudieron acceder. La supervivencia global para este grupo fue de 39 meses.
En el grupo BCLC B, el 65% de los pacientes (96 casos) recibieron tratamiento no curativo (TACE). Un cuarto de los pacientes no recibió tratamiento o recibió tratamiento paliativo (36 pacientes). Un 10% del total de este grupo, 15 pacientes, recibieron tratamiento con intención curativa. Al analizar este subgrupo de pacien tes tratados con intención curativa, podemos observar que tres pacientes recibieron RF, seis fueron tratados mediante RQ, y otros seis pacientes recibieron trasplante hepático. Todos estos pacientes fueron discutidos en ateneo interdisciplinario, y las decisiones para realizar un tratamiento u otro tuvieron que ver con características de cada caso. En lo que respecta a los 6 pacientes que recibieron un trasplante hepático, todos recibieron TACE a modo de downstaging, con el fin de poder acceder a lista de trasplante mediante criterios de Milán. El resto de los pacientes tratados con intención curativa se trataban de pacientes limítrofes, clasificados como BCLC B debido al tamaño principalmente.
No presentaban cirrosis 120 pacientes del total. De es tos, poco más de la mitad recibió algún tipo de tratamiento curativo (n: 64), mientras que casi el 30% (n: 35) recibió tratamiento no curativo, y otros 21 no recibieron ningún tipo de tratamiento o tratamiento paliativo. El promedio de seguimiento global para esta cohorte de pacientes fue de 31 meses. Al valorar el tipo de tratamiento específico por grupo, podemos observar que el 90% de los pacientes del grupo curativo fue sometido a resección quirúrgica (n: 58). Dos pacientes se trataron mediante trasplante hepático, y los restantes cuatro recibieron ablación por radiofrecuencia.
En lo que respecta a los 36 pacientes con tratamiento no curativo, 18 de ellos recibieron TACE como único tratamiento, y 5 TARE como monoterapia. Casi un 20% recibió un tratamiento que combinaba TACE y TARE, mientras que dos pacientes (5% del total) recibieron algún esquema de quimioterapia sistémica, y solamente cuatro un tratamiento con Sorafenib. Al desglosar la su pervivencia según el tratamiento, se observa que a 1, 3 y 5 años, fue de 88%, 72% y 64% para el grupo que fue tratado con intención curativa, 63%, 24% y 20% para el grupo de tratamiento no curativo, y de 16% para el grupo de tratamiento paliativo al año y 0% a los tres años.
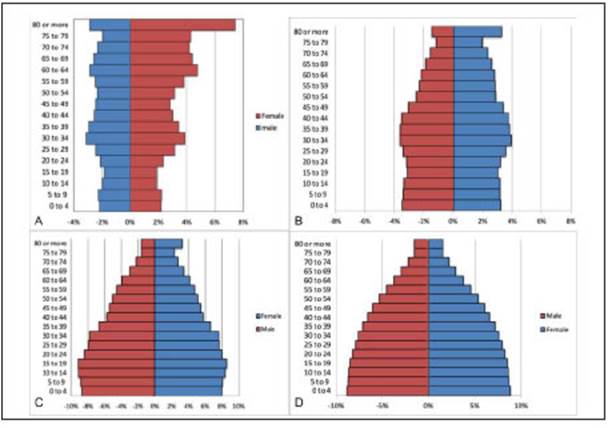
El total de casos de HCC en la población PS-HIBA fue de 113 pacientes en los 12 años analizados. El total de afiliados al PS-HIBA fue de 423 183 personas. Se calculó la densidad de incidencia por 100 000 personas/ año para nuestra población, con una tasa cruda de 5.33, y un intervalo de confianza del 95% de 4.43-6.41. Se ajustó nuestra tasa según sexo en primera instancia. Se utilizaron distintas estandarizaciones, incluidas las del censo de la Ciudad Autónoma de Buenos Aires (CABA) y de Argentina y la estandarización de la OMS para ex presar nuestras tasas de incidencia de HCC (Tabla 5). Se graficaron para referencia de nuestra población las pirámides poblacionales del PS-HIBA, la de CABA y la Argentina (Fig. 5).

Tabla 5 Tasas de densidad de incidencia de hepatocarcinoma en la población del plan de salud del Hospital Italiano de Buenos Aires cada 100 000 personas-año estandarizadas por sexo y edad
Discusión
Existen estudios previos que han caracterizado según etiología al HCC en la Argentina16. En este estudio se ana lizó de forma integral a los pacientes con HCC en nuestro medio: toda la población con HCC atendida en el HIBA entre 2007 y 2018. La presentación, evolución clínica, diagnóstico, tratamiento y supervivencia son similares a otras cohortes, teniendo en cuenta algunas salvedades que serán analizadas a continuación.
Nuestra búsqueda de casos de HCC constó de 5 etapas individuales en la HCE (Fig. 1), con el objetivo de alcanzar una elevada sensibilidad para el HCC. Tal es así que, de más de 3300 registros, solo el 20.7% (521) resultó ser HCC. El diagnóstico en la gran mayoría de los casos (85%) fue mediante estudios de imágenes. A partir del 2011, con la primera publicación del sistema de reporte LI-RADS10, se comenzó a utilizar este sistema de informe imagenológico en nuestra institución. Aquellos pacientes diagnosticados previamente a este sistema, fueron infor mados según las recomendaciones de distintas guías y sociedades17-21. Más de la mitad de los tratados para HCC no presentaban diagnóstico histológico previo al trata miento. Esto se debe a que, en cirróticos, la aparición de un nódulo con características de alta sospecha para HCC (realce arterial, washout portal y refuerzo o pseudocápsula tardía) permite un diagnóstico con una especificidad de prácticamente 100%21-23.
El 48% de los casos de HCC presentaba infección viral. Esto se condice con los números regionales publicados, que sugieren números cercanos al 30% para el VHC y cerca del 10% para el VHB16,25. También encontramos números similares en lo que respecta a las causas me tabólicas (en las cuales incluimos la hepatitis alcohólica y la no alcohólica, cercanas al 30%), y las inmunológicas (~15%). La concordancia entre los hallazgos se condice con la baja prevalencia local de VHB y VHC, de aproxi madamente 0.77% para el VHB y 0.5-1% para el VHC.
El HCC es un tumor agresivo que asienta > 90% de las veces sobre un hígado enfermo26, y la cirrosis su principal factor de riesgo20. Tal es así que los consensos actuales incentivan el tamizaje de HCC mediante ecografía bianual en pacientes cirróticos, portadores VHC con fibrosis avanzada (F3-F4 de la escala METAVIR) y cualquier portador de VHB19,27,28. En concordancia con esta tendencia, más de la mitad de nuestros pacientes (n:263) fueron detectados mediante seguimiento ecográfico, y solo 3 por metástasis del HCC. Esto se debe probablemente a la alta letalidad del HCC, a su crecimiento local expan sivo y enfermedad hepática concomitante, que hacen a las manifestaciones locales o secundarias a la cirrosis una forma de presentación mucho más frecuente que la metástasis. El porcentaje considerable de diagnósticos incidentales (12%), y presencia de una masa abdominal (“otros”, 18%), se relaciona con el 32% de HCC que se asentó sobre hígado no cirrótico. Estos no fueron diagnos ticados en contexto de tamizaje, dado que no presentaban una indicación formal para el mismo.
A pesar de su elevada prevalencia mundial, las tera pias actuales aún distan de lograr controlar efectivamente al HCC. La relación muerte/caso incidente es aproxima damente 0.99,29, indicando una alta letalidad. Los motivos son varios, el principal probablemente sea la enfermedad hepática avanzada. Esta condiciona la posibilidad de la multifocalidad o tumores de novo, y limita las opcio nes terapéuticas, debido a la imposibilidad de realizar grandes resecciones en pacientes con función hepática deteriorada, o la contraindicación de embolizaciones en trombosis/cavernomatosis portal. El trasplante hepático, considerado el “tratamiento de oro” para el HCC en pa cientes cirróticos, se encuentra limitado por la escasez de donantes. Múltiples estudios han demostrado que el beneficio del trasplante pasa a ser menor a medida que la carga tumoral aumenta, por lo que hoy en día se utili zan distintos criterios como los de Milán, UCSF o Hong Kong para definir la elegibilidad de un paciente para el trasplante hepático. El sistema de estatificación más validado y utilizado a nivel mundial continúa siendo en la actualidad el BCLC30. Este considera la carga tumoral, función hepática y estado funcional. No solo clasifica en distintos estadios, sino que también sugiere el tratamiento adecuado según las variables mencionadas. Se puede observar que los resultados de supervivencia y tiempo libre de enfermedad de nuestra serie se condicen en gran medida con las estimativas realizadas por los estadios del BCLC: Estadios iniciales (BCLC 0-A) más de 5 años de mediana de supervivencia, estadios intermedios (BCLC B) ~ 20-30 meses, estadios avanzados (BCLC C) 8-10 meses y terminal (BCLC D) 3 meses26. El manejo en nuestro centro fue realizado según las recomendaciones nacionales e internacionales, utilizando el sistema BCLC. Es importante tener en cuenta que las discrepancias re portadas en la supervivencia según BCLC entre nuestro grupo y los resultados globales se relacionan con la posibi lidad de acceder al tratamiento ideal para cada estadio. Al comparar según tipo de tratamiento (tratamiento curativo para BCLC 0-A, no curativo para BCLC B-C y tratamiento paliativo BCLC-D), los números reportados por nuestro grupo se asemejan mucho a aquellos a nivel global.
Una publicación reciente de nuestro grupo muestra los resultados de la cohorte cirrótica de 49 pacientes resecados31 en este lapso temporal. De éstos, solo el 39% estaba dentro de criterios de Milán y el 47% dentro de los USCF. Aun así, los resultados son comparables con los sugeridos por BCLC y en consonancia con diver sos estudios que defienden la ampliación e inclusión de pacientes con mayor carga tumoral a la resección32-34.
Un punto a destacar es el de los resultados de su pervivencia y tiempo libre de enfermedad para aquellos pacientes que recibieron TH, RFA o RQ. Se puede ob servar que el grupo de RQ tuvo mayor índice de recaída que aquel grupo de RFA. Es importante tener en cuenta que los resultados internacionales avalan la RFA para tumores de hasta 3 cm, con resultados óptimos para aquellos nódulos < 2 cm (BCLC-0), pero que, en líneas generales, los mejores resultados se alcanzan con la RQ36-38. Las diferencias encontradas entre lo reportado por nuestro grupo y los datos a nivel global probablemente correspondan a las diferencias en el tamaño tumoral total (promedio de 70.65 mm para el grupo de RQ de RQ vs. 46.62 mm para el grupo de RFA), y en la cantidad de pacientes con invasión vascular (44.7% en el grupo de RQ vs. 6.9% para el grupo de RFA), factores bien docu mentados como los de mal pronóstico para la recidiva. El grupo planea publicar resultados específicos de RFA y RQ para pacientes con tumores < 3 cm en otra instancia.
De aquellos clasificados como “BCLC intermedios”, solamente el 10% fue tratado con esquemas con in tención curativa. De estos 15 pacientes, seis recibieron un trasplante hepático, mediante algún tipo de “terapia neoadyuvante” a modo de downstaging. Este método ha sido validado por grandes cohortes que demostraron resultados de supervivencia global y libre de enfermedad, similares a los que tuvieron originalmente tumores den tro de criterios de Milán39. En la actualidad la AASLD40 solamente avala el downstaging para aquellos dentro de criterios UCSF20. Los pacientes restantes fueron discuti dos en ateneo interdisciplinario, y la decisión fue tomada en base a que eran tumores borderline criterios de Milán.
En aquellos pacientes con HCC sobre hígado no cirrótico, la ausencia de enfermedad hepática clínica mente significativa es un factor clave para la estrategia terapéutica, que suele ser la RQ. A pesar de presentarse en un hígado sano, el HCC en estos pacientes suele ser de mal pronóstico, debido a que el diagnóstico se realiza en etapas avanzadas de la enfermedad41. Esto se ve reflejado en nuestra serie, con tamaño tumoral mayor en pacientes no cirróticos vs. los cirróticos (120 mm vs. 63 mm) y un mayor porcentaje de pacientes diagnosticados en contexto de hallazgo incidental o síntomas inespecífi cos, comparado al grupo de cirróticos (32% y 39% vs. 6% y 5% respectivamente). Hay varias series en consonancia con nuestros reportes, mostrando el pronóstico ominoso del HCC, incluso en aquellos pacientes sin cirrosis. Wörns y col.42 en 2012 analizaron una cohorte de 105 pacientes, similar a la nuestra, reportando una supervivencia global de 66%, 47% y 29% a 1, 3 y 5 años, sin discriminar por grupo de tratamiento. Smoot y col.43 reportaron supervivencia a 1 y 5 años de 84.6% y 38.4% respectivamente, en pacientes resecados, muy similar a aquellos reportados por nuestro grupo. Por último, Gianini y col.44 en 2013 reportaron una supervivencia global en 54 pacientes no cirróticos de múltiples centros en Italia: 66% al año, 41% a los 3, y 23% a los 5 años.
Según la Agencia Internacional para el Estudio del Cáncer (IARC), la incidencia cruda de HCC en la Argenti na es de 5.4 por 100 000 habitantes45, con una incidencia estandarizada (ASR) de 3.7 por 100 000 habitantes. La tasa cruda en nuestra serie para pacientes afiliados al PS-HIBA es prácticamente idéntica a la registrada en la IARC (Tabla 5). Al estandarizar nuestra serie, se obser va una incidencia menor (2.15/100 000 habitantes). La población afiliada al PS-HIBA responde al formato de una pirámide invertida: predomina la población enveje cida y una franca asimetría a favor del sexo femenino en los estratos más añosos. Otro factor importante es que la gran mayoría de la población afiliada al PS-HIBA corresponde a pacientes de CABA y sus alrededores (Área metropolitana de Buenos Aires) y de ingresos medios. Por ende, es esperable que la población de afiliados del PS-HIBA no represente de forma fidedigna a todo el país. Otra diferencia con los valores informados por la IARC es que estos incluyen a todos los tumores hepáticos primarios, por ende, es probable que haya un sobre registro al tomar estos valores para comparar con el HCC.
Los autores consideran como fortalezas de este estu dio por un lado el alto número de pacientes, teniendo en cuenta la relativa baja prevalencia del HCC en nuestro medio. Al ser un centro nacional de referencia es frecuen te recibir enfermedades de alta complejidad, incluidos aquellos pacientes cirróticos que deben ser evaluados para un eventual trasplante hepático. Otra fortaleza yace en la cantidad y calidad de información disponible. Al ser un trabajo interdisciplinario que se desarrolló en un lapso de aproximadamente tres años se logró recabar gran cantidad de datos.
Sin embargo, no está libre de debilidades. La principal es su naturaleza retrospectiva que determina tanto un sesgo de información, como un sesgo de seguimiento. Varios pacientes fueron excluidos por datos insuficientes. Muchos no contaban con los recursos económicos para llevar a cabo su tratamiento y/o seguimiento en nuestra institución, y no es raro que luego del diagnóstico o tratamiento continúen sus controles en otros centros de CABA o de provincias. La pérdida de seguimiento en aquellos que realizaron tratamiento paliativo o no reali zaron tratamiento fue significativa, dejando en evidencia el posible sesgo de seguimiento en los que sabemos que el mismo fue pobre. Se intentó corregir este sesgo me diante comunicación telefónica para minimizar la pérdida de información.
El HCC es un tumor complejo, de biología agresiva. Su mal pronóstico radica fundamentalmente en la cirrosis, que condiciona por un lado la posibilidad de multicentri cidad y recaída, y por otro lado limita las posibilidades terapéuticas. A pesar de numerosos estudios retrospec tivos y prospectivos con el fin de estudiar y tratar al HCC, aún presenta mal pronóstico, con bajas posibilidades de curación. La mejor oportunidad yace en la prevención pri maria de la cirrosis mediante la reducción de los factores de riesgo (virales y metabólicos principalmente), y en el tamizaje de pacientes con riesgo aumentado con el fin de detectar precozmente la enfermedad, en estadios que posibiliten su curación.
Si bien existen estudios nacionales que describen principalmente la etiología del HCC, en este trabajo se analiza de manera holística a esta enfermedad, con un buen tamaño muestral y abarcando todas las esferas de su etiología, diagnóstico, tratamiento y seguimiento. El mismo pone en evidencia aspectos positivos, como por ejemplo los resultados alentadores en referencia al tratamiento, que están en consonancia con aquellos comunicados a nivel global, así como también aspectos a mejorar, como la necesidad de creación de bases de datos prospectivas y centros especializados en el mane jo del HCC a nivel nacional, y/o políticas sanitarias que busquen reducir activamente la incidencia de cirrosis y HCC. Es nuestra esperanza que este trabajo sirva para incrementar la visibilidad y resaltar la importancia de esta afección a nivel nacional.