PUNTOS CLAVE
Conocimiento actual
• El compromiso pulmonar intersticial puede hallarse hasta en el 80% de las tomografías de tórax de alta resolución de los pacientes con esclerosis sistémica. Es la princi pal causa de mortalidad en estos pacientes, por lo que su detección temprana es primordial para optimizar el tratamiento y mejorar el pronóstico.
Contribución del artículo al conocimiento actual
• El presente estudio muestra que, en el análisis univa riado, la enfermedad difusa se asoció con el desarrollo de EPI y, en el análisis multivariado, los anticuerpos anti-centrómero demostraron ser un factor protector para el desarrollo de EPI, no encontrándose asociación significativa con otros factores.
La esclerosis sistémica (ES) es una enfermedad hete rogénea, autoinmune, caracterizada por daño vascular, fibrosis de piel y otros órganos1.
El compromiso pulmonar es una manifestación fre cuente y con gran impacto en la morbimortalidad de los pacientes con ES, se presenta aproximadamente en el 80% de las tomografías de tórax de alta resolución (TA CAR), mientras que solo 40% son sintomáticas2-6.
Aunque la prevalencia de enfermedad pulmonar intersticial (EPI) aumenta durante el transcurso de la enfermedad, su aparición es más frecuente en los prime ros 7 años de evolución desde el inicio del fenómeno de Raynaud y raramente luego de 15 años del diagnóstico7. Siendo una complicación temprana, la EPI, rara vez es una manifestación inicial de ES, presentándose como compromiso inicial en aproximadamente el 4% de los pacientes8.
Múltiples trabajos han buscado factores asocia dos al desarrollo y a la progresión de la enfermedad intersticial en pacientes con ES. Algunos factores descritos son: el sexo masculino, la raza afroameri cana y enfermedad cutánea difusa, así como también la presencia de lesiones ungueales e hipertensión pulmonar, esta última medida por ecocardiograma o cateterismo cardiaco9-12.
Autores como Rotondo Cinzia y col., en Italia13; y Wanglong Wu y col., en Suiza14, encontraron como predictores de enfermedad pulmonar intersticial en ES el compromiso cutáneo, gastrointestinal y articular, así como la presencia de ciertos anticuerpos como anti SCL 70 y valores de DLCO y CVF.
La presencia de anticuerpos específicos se encuentra entre los factores importantes asociados al desarrollo del compromiso de órganos en estos pacientes3.
Existen escasos datos sobre dichos factores en la po blación latinoamericana. Un estudio realizado en Colom bia por Arbeláez Solera y col. caracteriza a los pacientes con EPI-ES describiendo una tendencia numérica mayor de compromiso pulmonar intersticial en los pacientes con SCL-70 y/o subtipo difuso, sin medidas de asociación15.
El objetivo del presente trabajo es describir los factores asociados al desarrollo de EPI en pacientes con diagnós tico de ES en seguimiento en la división Reumatología del Hospital de Clínicas José de San Martín.
Materiales y métodos
Se llevó a cabo un estudio retrospectivo, que incluyó pacien tes en seguimiento entre el año 2005 y 2021, en la División Reumatología del Hospital de Clínicas José de San Martín (HCJSM) de la Ciudad Autónoma de Buenos Aires. Los crite rios de inclusión fueron: edad mayor de 18 años, diagnóstico de esclerosis sistémica de acuerdo a la clasificación 2013 ACR-EULAR16, y de LeRoy para subtipo de enfermedad, que hubieran concurrido a la División Reumatología del HCJSM para seguimiento de su enfermedad y que tuvieran evaluado parénquima pulmonar por TACAR y examen funcional respi ratorio (espirometría).
Se excluyeron aquellos con infección pulmonar activa, sarcoidosis, enfermedad pulmonar obstructiva crónica, in suficiencia cardíaca, tuberculosis, neoplasias o metástasis pulmonares, también pacientes expuestos a sílice o asbesto u otras sustancias tóxicas ambientales o laborales.
Se definió compromiso pulmonar al hallazgo de manifesta ciones intersticiales en TACAR informadas como patrón NINE o NIU, y/o hallazgos en la prueba de función pulmonar (CVF menor al 80% y DLCO menor al 80%).
Se consideraron las siguientes manifestaciones en TA CAR (vidrio esmerilado bilateral con gradiente ápico-basal y preservación subpleural, infiltrado reticular, bronquiectasias por tracción y bronquioloectasias con similar distribución). Se identificaron pacientes con enfermedad pulmonar intersticial (casos) y sin ella (controles).
Se analizaron variables demográficas, clínicas y sero lógicas (anticuerpos) de todos los pacientes en los grupos denominados casos y controles.
Dentro de las características demográficas y clínicas de la población se incluyeron: edad, sexo, duración de la en fermedad (años desde el inicio del primer síntoma distinto al fenómeno de Raynaud), fenómeno de Raynaud, subtipo de esclerosis sistémica, artritis, lesiones vasculares, pa trón capilaroscópico (temprano, activo o tardío), compromiso gastrointestinal clínico: disfagia baja, pirosis y regurgitación como subrogantes de reflujo gastro-esofágico (RGE), diarrea, constipación, incontinencia, sobrecrecimiento bacteriano, y/o compromiso esofágico por manometría esofágica de alta re solución (MEAR) como esfínter esofágico inferior hipotensivo y peristalsis ausente o dilatación esofágica en TACAR (definida como una columna de aire >10 mm medida en el plano perpendicular al eje mayor del esófago17), medidas de función pulmonar (CVF y DLCO) que se consideraron disminuidas cuando se encontraban por debajo del 80%, hipertensión pul monar (PSAP > 35 mmHg) por ecocardiograma transtorácico y anticuerpos (ACA, anti-Scl-70, RNA Pol III).
Se realizó un estudio retrospectivo de casos y controles. Los datos se obtuvieron de los registros de las historias clíni cas, recolectados por los investigadores durante los años de seguimiento. El análisis estadístico se llevó a cabo mediante Epi Info v. 7.2. Se calcularon medidas de porcentaje, media con desvío estándar (DS) y mediana con rango intercuartílico (RIQ) en cada una de las variables. Para comparar cada uno de los grupos definidos, se utilizó para las variables cualitativas la prueba Chi cuadrado o la prueba de Fisher y para las variables cuantitativas se usó la prueba T Student o ANOVA de acuerdo a su distribución. Se estableció un valor de p < 0.05 como estadísticamente significativo. Se efectuó un análisis multivariado, mediante regresión logística, considerando aquellas variables que dieron estadísticamente significativos en el análisis univariado, para establecer su asociación con EPI.
El presente trabajo fue aprobado por el comité de ética de la institución donde fue realizado.
Resultados
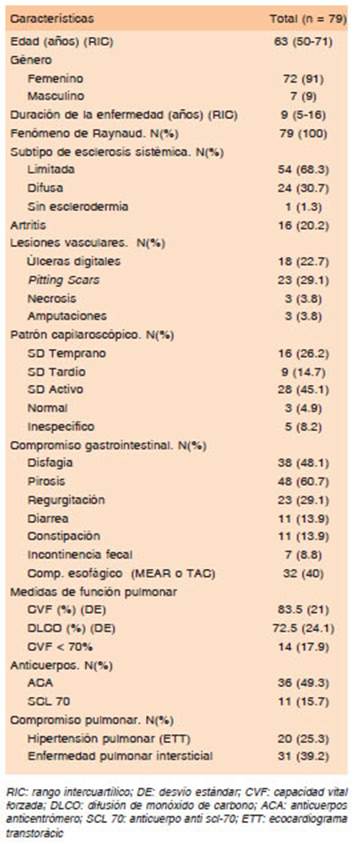
Se incluyeron 79 pacientes con diagnóstico de ES de acuerdo a los criterios ACR/EULAR, de los cuales 31 presentaron compromiso pulmonar intersticial (casos). De la población total 72 (91%) eran mujeres, la media na para la edad fue 63 con un RIC entre 50 - 71 y la mediana de la duración de la enfermedad fue de 9 con un RIC entre 5-16. En cuanto a los subtipos 54 (68.3%) presentaron esclerosis limitada y 24 (30.7%) presenta ron esclerosis difusa, hallándose solo un paciente con esclerosis sistémica sin esclerodermia. El promedio de la CVF fue de 83.5% y la media de DLCO de 72.5%. Las características demográficas y clínicas se describen en la Tabla 1.
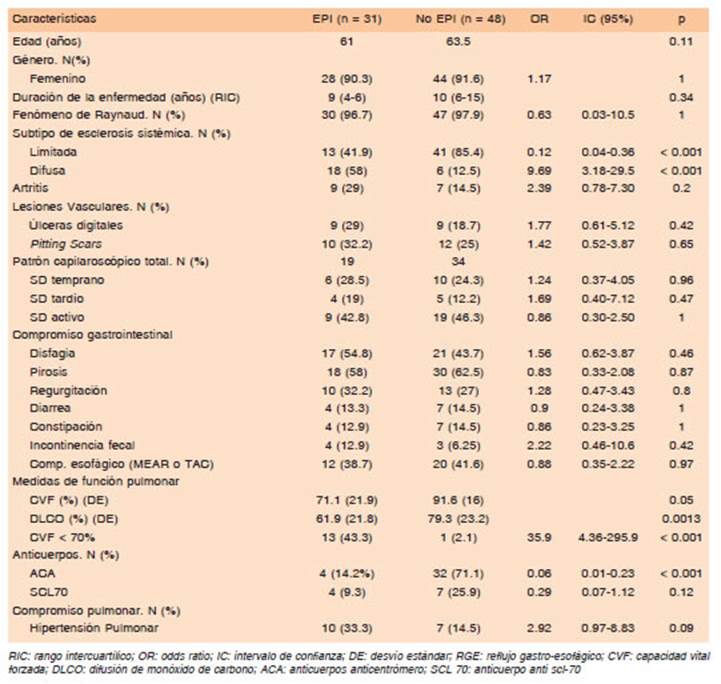
En el análisis univariado la comparación entre los pacientes con EPI y sin EPI arrojó que los factores es tadísticamente significativos fueron el subtipo de escle rosis de acuerdo a la clasificación de Le Roy (limitada, OR = 0.12, IC 0.04-0.36, p < 0.001; difusa, OR = 9.69, IC 3.18-29.5, p < 0.001), las medidas de función pulmonar (CVF % p = 0.05, DLCO % p = 0.0013) y la positividad del anticuerpo anti-centrómero (OR = 0.06, IC 0.01-0.23, p < 0.001). Los detalles se pueden observar en la Tabla 2.
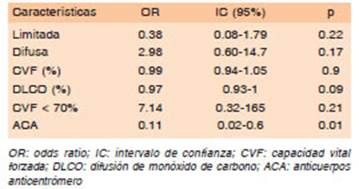
Cuando se incluyeron estos factores en el análisis multivariado, aplicando el modelo de regresión logística, se obtuvo que la positividad del anticuerpo anticentrómero persistía siendo estadísticamente significativo (OR = 0.11, IC 0.02-0.6, p = 0.01) (Tabla 3).
Discusión
La enfermedad pulmonar intersticial es, en la actualidad, la principal causa de mortalidad en los pacientes con es clerosis sistémica18,19. Por lo que es importante reconocer los factores asociados al desarrollo de esta complicación.
La detección temprana y el monitoreo de factores asociados al desarrollo de EPI, tendrían un rol beneficioso sobre la evolución y la intervención terapéutica temprana en los casos graves y progresivos.
En la población analizada se observó que el subtipo de esclerosis sistémica difusa, la CVF < 70% y la DLCO disminuida se asociaron al desarrollo de enfermedad pulmonar intersticial, mientras que el subtipo limitado y la positividad del anticuerpo anticentrómero se encontraron con mayor frecuencia en los pacientes sin enfermedad pulmonar intersticial, lo que podría considerarse como factores protectores y que concuerda con los datos de la literatura internacional.
Los factores de riesgo asociados al desarrollo de EPI descriptos en múltiples trabajos incluyen la positividad para el anticuerpo anti-Scl 70, CVF y DLCO disminuidas, aunque tanto la CVF Y DLCO podrían ser causadas por el compromiso intersticial y no estar presentes antes del inicio del compromiso pulmonar; de ahí surge la importan cia de buscar factores de aparición temprana asociados al desarrollo del compromiso intersticial20.
Se ha reportado la asociación entre el compromiso pulmonar y el reflujo gastroesofágico. Savarino y col. en Italia realizaron un estudio prospectivo analizando la asociación en RGE y EPI, hallando que los pacientes con EPI asociada a ES presentaban mayores episodios de RGE en la impedanciometría21. Xuli Jerry Zhang y col. en Canadá encontraron que la dismotilidad esofágica y el RGE parecen estar asociadas con CVF bajas en ES, y que algunos signos y síntomas del tracto GI superior ocurren más frecuentemente en pacientes con restricción moderada/grave22. En nuestra cohorte no se halló asocia ción entre el RGE y el compromiso pulmonar intersticial.
Cuando se aplicó el modelo de regresión logística en el análisis multivariado, la positividad del anticuerpo anticentrómero fue el único factor que persistió estadís ticamente significativo.
Jung E. y col. encontraron en una cohorte surcoreana de 108 pacientes con ES que los factores asociados al desarrollo de EPI fueron la positividad de anti-SCL 70 y la presencia de hipertensión pulmonar, mientras que la positividad del anticuerpo anticentrómero se asoció inversamente con el desarrollo de EPI en el análisis univariado3. Wangkaew S. y col. publicaron una muestra de 133 pacientes en Tailandia, con esclerosis sistémi ca, encontrando en el análisis univariado que el sexo masculino, la presencia de anti-SCL 70 y la ausencia de anticentrómero fue significativamente predictora de EPI. En el análisis de regresión de Cox la positividad del anticuerpo anti-centrómero se comportó como un factor protector [HR= 0.09, IC 0.01-0.73)]9. Esto último concuerda con lo observado en nuestro estudio. Se po dría adjudicar las diferencias a la distinta composición étnica de la muestra.
Wanlong Wu y Suzana Jordan presentaron una cohorte de pacientes de Suecia de 98 pacientes obteniendo como factor predictor para progresión de enfermedad pulmonar intersticial artritis y test de caminata alterado14. En nuestra población no se encontró asociación entre el compromiso articular y el desarrollo de EPI. No se pudo evaluar el test de caminata por falta de datos.
No hay aún un consenso definido sobre el inicio o progresión de los diferentes tratamientos disponibles, los médicos tratantes de acuerdo a su experiencia y conside rando los posibles factores de progresión deben definir el esquema terapéutico en cada caso. La identificación de aquellos pacientes con mayor riesgo de progresión de EPI permitiría el inicio de un tratamiento temprano.
Como conclusión: múltiples factores de riesgo o aso ciados a desarrollo o progresión de compromiso intersticial pulmonar fueron descriptos y propuestos, sin embargo, su real utilidad clínica y el poder para predecir daño pul monar es limitado. La combinación óptima de factores de riesgo para determinar progresión de daño pulmonar es de vital importancia para una implementación temprana del tratamiento lo que impactaría en la tasa de mortalidad de los pacientes con esclerodermia.