PUNTOS CLAVE
Conocimiento actual
• La intensidad de captación intraprostática del antígeno prostático específico de membrana valorada en SUV max puede diferenciar el tejido prostático normal del cáncer de próstata.
Contribución del artículo al conocimiento actual
• El presente análisis mostró una correlación no lineal creciente entre SUVmax y Gleason con una diferencia de medianas estadísticamente significativa (p = 0.01). Además, un punto de corte de SUVmax ≥ 9.5 tuvo una sensibilidad de 0.81 y una especificidad de 0.71 para discriminar cáncer de próstata clínicamente significativo del no significativo.
El cáncer de próstata (CP) es el cáncer más común entre hombres1. La mayoría de estos pacientes tienen tumores de bajo riesgo relativamente indolentes que conducen a un sobretratamiento2. Sin embargo, aproxi madamente el 20-30% de los hombres con CP localizado presentan tumores de alto riesgo que son propensos a mortalidad después del tratamiento3.
La prueba diagnóstica ideal para el CP sería aquella que permita la identificación del cáncer clínicamente significativo, pero la biopsia de próstata estándar no solo no detecta aproximadamente el 30% de los tumores, sino que también un 40% de los resultados patológicos tienen un aumento en el grado cuando se valora la pieza quirúrgi ca definitiva4-6. Se han postulado diferentes herramientas diagnósticas para mejorar la detección del cáncer clínica mente significativo y aunque estas herramientas tengan algún valor predictivo, una considerable cantidad de hombres con un CP no clínicamente significativo tendrán una enfermedad agresiva luego de la prostatectomía. Los calculadores de riesgo basados en antígeno prostático específico (PSA), estadio clínico y características de la biopsia prostática mostraron una asociación débil en la detección del cáncer clínicamente significativo7. Los bio marcadores como la isoforma pro PSA, el gen 3 del CP y posteriormente los perfiles de expresión genómica resultaron en una asociación con características patológicas agresivas en la pieza de prostatectomía, pero sin poder establecer su real eficacia8-11. La resonancia multipara métrica mostró una buena correlación entre las lesiones PIRADS ≥ 4 con el cáncer clínicamente significativo y un estudio de no inferioridad indicó que la biopsia prostática dirigida mejoraba un 12% la detección del cáncer clínicamente significativo en comparación con la biopsia de próstata estándar. No obstante, la resonancia magnética pierde un 16% del cáncer clínicamente significativo4,12. La tomografía por emisión de positrones (PET) con antígeno de membrana específico de la próstata (PSMA) no solo permite una mejor estadificación y reestadificación del CP, sino también una mejor detección inicial del mismo13-16. Así también, se evidenció que el PSMA presenta una mayor captación en el CP indiferenciado17. Debido a ello el objetivo de este estudio fue evaluar si la intensidad de captación de PSMA se asocia con un cáncer clínicamente significativo y poder conocer qué valor de captación de PSMA discrimina mejor esta relación.
Materiales y métodos
El diseño del estudio fue observacional-analítico, retrospectivo y de corte transversal.
La población fueron pacientes con diagnóstico de CP por biopsia que realizaron un PET/18F-PSMA-1007 como método de diagnóstico en la estadificación inicial previo a la realiza ción de radioterapia externa entre enero de 2021 a enero de 2022 en un centro privado de la ciudad de Santa Fe. La muestra para este proyecto fue de 40 pacientes.
Las variables incluidas fueron el Score de Gleason (cuali tativa ordinal), grado de la International Society of Urological Pathology (ISUP, cualitativa ordinal), clasificación de D’amico (cualitativa ordinal), edad (cuantitativa continua), mayor toma de muestra (cuantitativa continua), número de tomas (cuanti tativa discreta), PSA gatillo (cuantitativa continua) y maximum standardized uptake value (SUV max, cuantitativa continua). Se definió la variable riesgo de CP según la puntuación de Gleason.
Bioética
Todos los pacientes firmaron un consentimiento informado antes de ingresar y la investigación se llevó a cabo de acuer do con el protocolo, los principios de buena práctica clínica (según lo establecido en las guías de la OMS para la buena práctica clínica) y los requisitos legales y reglamentarios lo cales establecidos por el comité de bioética de la FCM-UNL (Facultad de Medicina de la Universidad Nacional del Litoral).
Tomografía por emisión de positrones (PET) con antígeno de membrana específico de la próstata (PSMA)
El marcador 18F-PSMA es producido en el ciclotrón de labora torios Bacon SAIC con el sintetizador IBA Synthera® de Radio Pharma Solutions utilizando el kit de síntesis de PSMA-1007 de ABX advanced biochemical compounds GmbH.
El PET 18F-PSMA-1007 se realizó siguiendo los protocolos publicados anteriormente por nuestro grupo en la utilización del PET/PSMA en la estadificación de la recaída del CP13. Es importante destacar el 18F-PSMA presenta una vida media más larga que el 68Ga-PSMA por lo que puede ser transportado lejos del ciclotrón. Además, este radioisótopo tiene una escasa secreción urinaria; lo que permite una mejor visualización de las lesiones prostáticas cercanas a la vía uri naria. Los resultados obtenidos fueron evaluados por médicos especializados en medicina nuclear con experiencia en PET (AMJ y FF). Se consideró PET/PSMA positivo al incremento focal de la captación del trazador mayor que el fondo y no asociado con la captación fisiológica de éste (Figs. 1 y 2).

Fig. 1 PET/18F-PSMA captación prostática con SUVmax 3.6 correlación con CP no clíni camente significativo
Maximum Standarized Uptake Value
Los valores de SUV max de las lesiones prostáticas fueron calculado dentro de los volúmenes de interés colocados sobre los sitios de acumulación de trazador compatible con la lesión tumoral principal.
Cáncer de próstata clínicamente significativo
Utilizando la versión modificada del National Comprehensive Cancer Network para el CP (versión 4.2022), se definió CP de alto riesgo o clínicamente significativo al tumor con un puntaje de Gleason 8 a 10. No se tuvo en cuenta el estadio del tumor ni el antígeno prostático específico.
Análisis estadístico
El análisis estadístico se llevó a cabo con el software IBM SPSS V28. Las variables cuantitativas se describen con media y desvío estándar o con mediana y cuartiles 1 (Q1) y 3 (Q3) según la distribución de probabilidades que presentaron. Las variables cualitativas se describen con frecuencias absolutas y sus respectivos porcentajes. La prueba U de Mann-Whitney se utilizó para comprar medianas entre grupos. Las correlaciones se evaluaron con estadístico Rho de Spearman. Sobre las curvas ROC se calcularon el área bajo la curva (AUC), sen sibilidad y especificidad. El punto de corte óptimo se obtuvo bajo el criterio de Youden. La significancia estadística se fijó en un valor de α igual a 0.05.
Resultados
En la Tabla 1 se observa que la categoría de mayor frecuencia de Gleason fue la puntuación 7 con un 52.5% (n = 21), mientras que la categoría ISUP 3 mostró una frecuencia del 37.5% (n = 15). En la Tabla 2 se presen tan las medidas de tendencia central y dispersión de las variables numéricas, observando una edad media de 68.6 ± 7.6 años; además, el SUV max presentó una mediana de 9.5 con un intervalo intercuartil igual a 10.

Tabla 2 Estadística descriptiva de variables cuantitativas. Medidas de tendencia central y dispersión de las variables numéricas
El diagrama de dispersión que relacionó el SUV max con puntuación de Gleason mostró una correlación no lineal creciente entre las variables (Fig. 3) con un coefi ciente Rho de Spearman entre el SUV max y la puntuación de Gleason igual a 0.42 (p = 0.007).
La comparación de SUV max entre CP no clínica mente significativo y significativo se puede observar en la Figura 4, donde las medianas fueron de 7.9 y 14.3 respectivamente, siendo esta diferencia estadística mente significativa según la prueba U de Mann-Whitney (U = 103; p = 0.01).
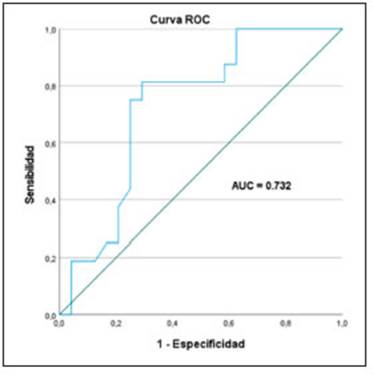
El AUC en la curva ROC fue de 0.73 (Fig. 5) mostran do el punto de corte óptimo en SUV max igual a 9.5 una sensibilidad de 0.81 y una especificidad de 0.71 (Tabla 3).
Discusión
El PSMA es una glicoproteína de membrana integral de tipo II que se identificó por primera vez en la línea celular LNCaP con niveles significativamente elevados de expre sión en el CP indiferenciado17. PET/PSMA no solo mejora la detección del CP en la estadificación y reestadificación del CP, sino también en la detección inicial de CP previo a la biopsia prostática13,14,16. Además, se constató que la intensidad de captación intraprostática del PSMA puede predecir resultados oncológicos clínicamente relevantes15.
El SUV max del PET/PSMA está estrechamente rela cionado con la expresión de PSMA. Woythal N. mostró que el valor de SUV max en el CP (14.10 ± 15.60) es significativamente mayor que en el tejido prostático normal (2.40 ± 0.60, p < 0.001)18. Prasad V. reportó que el valor promedio de SUV max era de 11.00 ± 7.80 en el CP y 2.70 ± 0.90 en el tejido prostático normal (p < 0.001)19. Demirci E. y Sachpekidis C. demostraron que los valores de SUV max promedios en el tejido prostático normal oscilaba entre 2.4 a 5.5 con un valor máximo de 8.320,21. Otros autores evaluaron valores de corte de SUV max para discriminar el CP del tejido prostático normal. Woythal N. identificó que un valor de corte de SUV max de 3.20 tuvo una sensibilidad del 94% y especificidad del 100%, pero no reportó el correlato histopatológico19. Este investigador luego presentó un análisis con correlato histopatológico donde evidenció un punto de corte de SUV max de 3.15 para discriminar el CP del tejido prostático normal conco mitante, con una sensibilidad de 97% y una especificidad de 90%18. Rahbar K. mostró que un valor de corte de SUV max de 4.00 logró una sensibilidad de 88% y una especificidad del 86.5% en detectar CP22. Posteriormente, otras investigaciones evaluaron los valores de corte de SUV max para discriminar el CP clínicamente significativo del tejido prostático normal. Donato P. identificó un valor de corte de SUV max de 6.30 para la detección de CP clínicamente significativo con una especificidad del 100%, una sensibilidad del 60% y un área debajo de la curva de 0.78823. Hicks R. constató que el punto de corte SUV max de 6.70 logró una sensibilidad del 88% y una especificidad del 96% en la discriminación de pacientes con un CP clínicamente significativo de aquellos con un CP clínicamente no significativo que realizaron PET/PSMA combinado con resonancia magnética24. Recientemente Jiao J. investigó el correlato imagenológico e histopatológico y mostró un punto de SUV max ≥ 5.30 para discriminar el CP clínicamente significativo del tejido prostático normal25. En nuestro estudio no solo se evidenció una correlación entre la intensidad SUV max y el CP clínicamente significativo, sino también que un punto de corte de SUV max ≥ 9.5 era el que mejor discrimi naba a los pacientes con un CP clínicamente significativo del clínicamente no significativo con un área bajo la curva de 0.73. Aunque Jiao J. constató que aproximadamente el 90% de los pacientes con un valor ≥ 5.30 presentaban una puntuación de Gleason ≥ 8, no evaluó un punto de corte de SUV max para discriminar el CP clínicamente significativo del no significativo25. En nuestro análisis evidenciamos un punto de corte de SUV max mayor al establecido en otras publicaciones, debido a que se comparó la captación en tejido neoplásico con diferente diferenciación sin realizar una comparación con tejido prostático normal, el cual presenta captación nula o extremadamente baja de PSMA.
En conclusión, la intensidad de captación del 18F-PSMA-1007 intraprostático puede ser una nueva herra mienta diagnóstica en la detección del CP de alto riesgo. Una intensidad de captación ≥ 9.5 tuvo una buena correlación con el CPde alto riesgo.