PUNTOS CLAVE
• Los inhibidores de la tirosina quinasa de Bruton cambia ron el paradigma del tratamiento de la leucemia linfática crónica y del linfoma del manto.
• Estos fármacos presentan un perfil de toxicidad especí fico, que incluye eventos cardiovasculares.
• No existen guías respaldadas por evidencia científica para el manejo y prevención de estos eventos.
Este artículo revisa las indicaciones, los estudios pivotales y el perfil de toxicidad cardiovascular de los inhi bidores de la tirosina quinasa de Bruton en el tratamiento de los síndromes linfoproliferativos.
Además, se consensua el manejo de la toxicidad car diovascular en base a la experiencia de una especialidad, como la cardio-oncología.
Los avances en el conocimiento incorporados en la última década han modificado en gran parte el paradig ma del tratamiento de las enfermedades hematológicas malignas.
Particularmente la introducción de los inhibidores de la Bruton tirosina quinasa (iBTK) y otras drogas blanco junto a nuevos anticuerpos monoclonales se han transformado en los agentes de elección tanto para la leucemia linfática crónica (LLC) como para otros linfomas “B” periféricos como el linfoma de células del manto (LCM)1,2.
Los resultados de eficacia frente a la terapia genotóxica son tan exitosos que el fin de la quimio inmunoterapia, sobre todo para la LLC, es ya un postulado reconocido por los principales grupos de investigación. Por otra parte, los nuevos fármacos modificaron el perfil de eventos adversos lo que obligó al desarrollo de nuevas subespecialidades como la cardio-oncología, la cual constituye actualmente un baluarte para el manejo racional de estos pacientes. La presente revisión tiene como objetivo destacar el estado actual de estas enfermedades, los principios farmacoló gicos junto a los nuevos eventos adversos de los iBTK y el invalorable aporte de la cardiología para un correcto tratamiento y control de estos pacientes
Leucemia linfática crónica
La leucemia linfática crónica (LLC) es una entidad pato lógica encuadrada dentro de los linfomas B periféricos de acuerdo a la clasificación de la OMS versión 20161. Las guías del iWCLL2 establecen claramente las reco mendaciones para su diagnóstico basadas en el hallazgo de una linfocitosis > 5 × 109/L, persistente, de al menos 3 meses de duración con un fenotipo caracterizado por la expresión de CD5, CD23, marcadores de linfocitos B (CD19, CD20) y una baja intensidad de la inmunoglobulina de superficie (sIg).
Las alteraciones genéticas con pérdida o ganancia de material cromosómico parecen constituir un hito importan te en el inicio de la LLC. La deleción del brazo corto del cromosoma 17 (del[17p13]) que se encuentra en menos del 10% de los pacientes al diagnóstico y en más del 30% en recaídos/refractarios es responsable de resistencia a los agentes genotóxicos con escasa respuesta a la quimioinmunoterapia.
La LLC se caracteriza por su notable heterogeneidad clínica, ya que algunos pacientes presentan una enferme dad indolente y pueden vivir muchos años sin tratamiento terapéutico, mientras que otros progresan rápidamente y requieren tratamiento apenas diagnosticados. Los sistemas de Rai y Binet3,4 utilizados desde hace 40 años permiten una clasificación clínica de riesgo de progresión y posibilidad de supervivencia.
Los avances registrados a partir del nuevo milenio han demostrado que estos sistemas resultan insuficientes por sí solos para conformar una evaluación confiable de un nuevo paciente con LLC. Las aberraciones cromosómicas definidas, principalmente la deleción del brazo corto del cromosoma 17, unidas a marcadores bioquímicos como la β-2-microglobulina, marcadores moleculares como el estado mutacional de la porción variable (V) de la cadena pesada (H) de la Ig (IGVH) expresada por la célula leucé mica, la edad, y el estadio clínico, combinados, aportaron un nuevo índice pronóstico nominado CLL International Prognostic Index (CLL-IPI) universalmente utilizado al presente5.
Hasta el primer lustro de la década pasada, la quimioin munoterapia fue considerada la base del tratamiento de la LLC, a pesar de sus eventos adversos y su escasa eficacia en pacientes con alto riesgo molecular o citogenético.
El aporte de la investigación básica desentrañando las vías de señalización que se activan con la estimulación del receptor antigénico (BCR-B cell receptor) y la cascada de eventos que se gatillan a continuación, favoreciendo la progresión e inhibiendo la apoptosis, identificaron nuevos blancos terapéuticos, y dieron lugar al desarrollo de las drogas “diana” que actúan en forma precisa sobre los mismos.
Linfoma de células del manto
El linfoma de células del manto (LCM) recibe su nombre por la apariencia histológica que remeda a las células que rodean los centros germinales de los folículos linfoides normales. Esta entidad puede proliferar con patrones nodulares o difusos y citológicamente pueden mostrar una forma típica o una variante de mayor tamaño y morfología blastoide de mayor agresividad6.
El inmunofenotipo resulta similar al de otras neopla sias “B” maduras, pero al igual que la LLC las células tumorales expresan el marcador CD5. Sin embargo, se diferencia de la LLC por la falta de expresión de CD23, mayores niveles de la sIg e intensa expresión de CD207. Su comportamiento clínico es heterogéneo con pacien tes que tienen una enfermedad indolente hasta formas agresivas con pronóstico reservado.
La sobreexpresión de la ciclina D1, proteína que promueve la proliferación celular e inhibe la apoptosis, es característica del LCM. Afecta frecuentemente a hombres y constituye del 5 al 10% de todos los linfomas no Hodgkin. La mayoría de los pacientes al diagnóstico se encuentran en estadios avanzados y la afectación extranodal es común.
En la actualidad, los factores pronóstico más rele vantes lo constituyen el MIPI (MantleCell International Prognostic Index), el índice de proliferación según la expresión de Ki 67 y la mutación de P 538.
En los últimos años las estrategias terapéuticas pasa ron de la quimioterapia al agregado de la inmunoterapia y más recientemente a esquemas de combinación con drogas “diana” y terapias de modulación epigenética9,10. La agencia FDA de EE.UU. aprobó en el último lustro varias drogas para el tratamiento del LCM: un agente inmuno modulador como la lenalidomida, inhibidores del proteosoma como el bortezomib, e iBTK como el ibrutinib y el acalabrutinib. No obstante, el tratamiento de las formas agresivas o recaídas/refractarias a múltiples líneas de terapia e incluso al trasplante alogénico continúa siendo un desafío11-13.
Señalización del receptor de células B
El receptor para el antígeno de los linfocitos B (BCR) es un complejo multimolecular proteico clave para el desarrollo (ontogenia B), proliferación, diferenciación funcional, mi gración y supervivencia de las células B normales. El BCR está formado por la sIg inserta en la membrana plasmática y asociada con las cadenas Ig alpha (Igα = CD79A) e Ig beta (Igβ = CD79B).
En condiciones fisiológicas, cuando el linfocito B reco noce al antígeno a través de la sIg, las cadenas CD79A y CD79B reclutan y activan por fosforilación una serie de enzimas como LYN, SYK y BTK. La cascada de activación continúa con las fosforilaciones secuenciales de PLCγ2, MAP quinasas y AKT, posibilitando la translocación al núcleo de factores de transcripción como NF-kB con el objetivo final de regular la proliferación, diferenciación y supervivencia del linfocito B (Fig. 1).
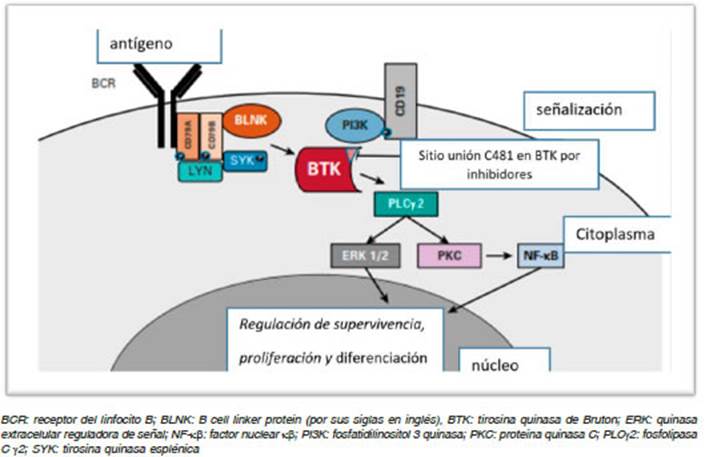
Fig. 1 Vías de señalización a través del receptor antigénico del linfocito B (BCR) inducidas por el antígeno
La terapia dirigida con inhibidores en las proteínas involucradas en la vía de señalización del BCR se con virtió en un enfoque terapéutico racional y atractivo para síndromes linfoproliferativos B crónicos, ya sea en LLC como en LCM. Al día de hoy los inhibidores de la enzima BTK son los que han demostrado mayor éxito terapéutico en estas enfermedades.
Inhibidores de la Bruton tirosina quinasa
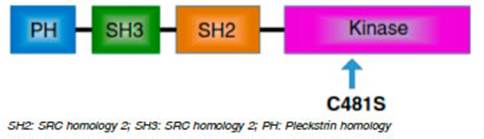
La Bruton tirosina quinasa (BTK) es una tirosina quinasa intracelular (no receptor de membrana) de 659 aminoáci dos cuyo gen se ubica en el cromosoma Xq21.33-q22. La BTK pertenece a la familia de tirosinas quinasas denomi nada TEC. Los dominios que conforman la estructura de la BTK son: dominio PH en región N-terminal (pleckstrin homology) que permite la unión a regiones lipídicas de fosfatidilinositol en membrana plasmática, dominio SRC homology 2 (SH2) involucrado en la interacción proteína-proteína que se une a tirosinas fosforiladas; dominio SH3 con unión a regiones ricas en prolina y dominio catalítico C-termina14-16 (Fig. 2).
Un hecho a destacar es que la inhibición farmacológica de la actividad de BTK no sólo interfiere con la señali zación a través del BCR sino también con señales del microambiente tumoral como, por ejemplo, las inducidas por quimiocinas y otros factores de supervivencia para la célula leucémica. De esta manera, los inhibidores de BTK promueven la salida del clon leucémico de sus nichos de supervivencia en los tejidos linfáticos direccionando a la muerte celular17.
Los iBTK son clasificados en reversibles o irreversibles, según el sitio de inhibición a la proteína. Los irreversi bles se unen covalentemente con un grupo sulfidrilo a la posición 481 aminoacídica, donde se encuentra una cisteína (sitio de actividad quinasa) y de esa manera se bloquea la unión al ATP; para restaurar la actividad se debe sintetizar nueva proteína.
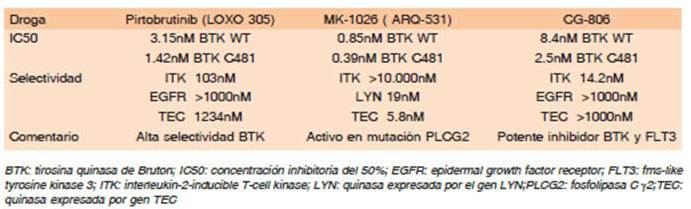
Los inhibidores reversibles se unen estrechamente a BTK pero no en forma covalente generando un bloqueo de ATP transitorio. Los iBTK irreversibles o reversibles se pueden unir potencialmente a otras quinasas con menor afinidad, en particular de la familia TEC. Esta unión puede generar efectos secundarios y perfiles de toxicidad particulares, dependiendo de cuáles y cuántas quinasas sean inhibidas. Por lo tanto, aumentando la selectividad por BTK se reducen los riesgos de toxici dades18 (Tabla 1 y 2).
Tratamiento con inhibidores de la Bruton tirosina quinasa en pacientes con leucemia linfática crónica
Como ya se mencionó, la quimioinmunoterapia demostró, en las décadas pasadas, presentar una eficacia superior a la quimioterapia en LLC. Más recientemente diversos ensayos compararon quimioinmunoterapia versus drogas “diana”. Sin embargo, es notable la escasez de ensayos que comparan drogas “diana” entre sí.
El desarrollo de iBTK cambia el paradigma del tra tamiento para la LLC y otras neoplasias de linfocitos B.
La aprobación de los iBTK en pacientes con del17p y/o mutaciones en p53 (Mp53) permite obtener resultados de SG que nunca fueran alcanzados anteriormente. Al momento de la escritura de este artículo los dos iBTK aprobados en Argentina son ibrutinib y acalabrutinib. En junio de 2020 las guías del National Cancer Center Net (NCCN) ubicaron a estos agentes como de preferencia en el tratamiento inicial de la LLC y los convirtieron en los agentes de elección entre los expertos norteamericanos19. En Argentina, ambos están aprobados para los pacientes con LLC en primera línea y recaídos y para aquellos con LCM recaídos, mientras que ibrutinib está aprobado para los pacientes con linfoma de la zona marginal recaídos y en aquellos con linfoma linfoplasmocitario20,21.
Estudios en leucemia linfática crónica en primera línea
En los pacientes con LLC en primera línea, el ensayo aleatorizado de fase III con mayor tiempo de seguimiento fue el estudio RESONATE-2 que enroló 269 pacientes sin del17p comparando ibrutinib en monoterapia versus clorambucilo, observándose una superioridad en términos de SLP y SG a favor del iBTK luego de una mediana de seguimiento de 60 meses22,23.
Actualmente, el clorambucilo puede considerarse un comparador débil a la hora de evaluar los nuevos fár macos para esta enfermedad, por lo que es importante compararlos contra quimioinmunoterapia (estándar de tratamiento en los últimos años), y por tal motivo se de sarrollaron 3 ensayos de esta naturaleza.
El estudio del grupo ECOG-ACRIN (E1912) enroló 529 pacientes menores de 70 años aptos para recibir tratamiento intensivo, excluyendo aquellos con del17p, comparando entre ibrutinib más rituximab (R) versus fludarabina más ciclofosfamida más R (FCR). Luego de una mediana de seguimiento de 33 meses se observó la superioridad de ibrutinib más R tanto en la SLP como en SG. Al realizarse el análisis de subgrupos de acuerdo al estatus mutacional de la IGVH la superioridad en la SLP con el iBTK se demostró solo en aquellos no mutados24.
El grupo Alliance enroló 547 pacientes no aptos para tratamiento intensivo a tres ramas terapéuticas: ibrutinib versus ibrutinib más R versus bendamustina más R, sin excluirse a los pacientes con alteraciones genéticas de alto riesgo. En este estudio, luego de una mediana de seguimiento de 38 meses, se observó superioridad en la SLP con ambas ramas con ibrutinib, en comparación con la quimioinmunoterapia. Además, en este estudio no se observó ventajas con la adición de R a ibrutinib, cuestionando el beneficio de añadir un anticuerpo anti- CD20 a los iBTK25.
En otro estudio de fase III (iLLUMINATE) se incluyeron 229 pacientes considerados no aptos para quimioinmu noterapia, ya sea por una edad mayor a 65 años o, en menores a esa edad, con un puntaje de comorbilidades alto (CIRS mayor a 6), un aclaramiento de creatinina menor a 70 ml/min o con del17p. En este ensayo se comparó obinutu zumab con ibrutinib versus obinutuzumab con clorambucilo, esta última combinación considerada hasta el momento el régimen estándar para este grupo de pacientes en base a los resultados del estudio CLL-11. Luego de una media de seguimiento de 31 meses se observó la superioridad en términos de SLP del brazo que contiene al iBTK. En este estudio no se enrolaron pacientes con ibrutinib en monoterapia perdiéndose la oportunidad de evaluar el beneficio del agregado de obinutuzumab a este fármaco26.
Los iBTK de segunda generación como acalabrutinib presentan una especificidad mayor sobre la BTK con escasa acción sobre otras quinasas. El estudio que llevó a su aprobación fue el ensayo ELEVATE-TN que enroló 535 pacientes no aptos a quimioinmunoterapia intensiva por edad o comorbilidades a tres ramas terapéuticas: acalabrutinib en monoterapia versus acalabrutinib más obinutuzumab versus clorambucilo más obinutuzumab. Nuevamente los brazos que contienen el iBTK resultaron netamente superiores a la quimioinmunoterapia, incluso en pacientes de alto riesgo como del17p/MP53 e IGVH no mutados. Actualmente y luego de una mediana de segui miento de 48 meses se observó la superioridad con ambas ramas con acalabrutiib versus la quimioinmunoterapia en términos de SLP, registrándose una diferencia de un 9% a favor de la combinación con el anticuerpo anti-CD2027.
Estudios en leucemia linfática crónica en pacientes recaídos
Con respecto a los pacientes con LLC recaídos o refrac tarios, los estudios que permitieron la aprobación de los iBTK fueron RESONATE para ibrutinib y ASCEND para acalabrutinib. En el primero se compararon 391 pacien tes con ibrutinib en monoterapia versus ofatumumab, con superioridad en la SLP con el primero luego de una mediana de seguimiento de 65 meses. Los resultados en SG fueron marginales debido al cruzamiento de los pacientes a la rama con ibrutinib28.
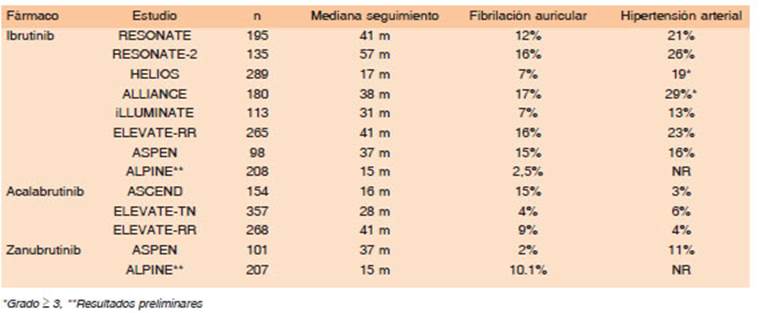
En el ensayo ASCEND se incluyeron 310 pacientes comparando acalabrutinib en monoterapia versus la com binación de idelalisib más R o bendamustina más R, de acuerdo a la elección del médico tratante, observándose luego de una mediana de seguimiento de 16.1 meses una SLP superior para el iBTK de segunda generación versus ambas ramas combinadas o versus cada una de ellas por separado. Este fue el primer estudio que comparó una droga “diana” versus otra droga “diana” en pacientes con LLC29. Más recientemente, en el Congreso Europeo de Hematología (EHA) del 2021 se presentaron los resultados de dos ensayos en pacientes LLC recaídos que trataron de demostrar la no inferioridad de los iBTK de segunda generación versus el ibrutinib. En el ensayo de fase 3 ELEVATE R/R se incluyeron 533 pacientes recaídos/refractarios, con alteraciones genéticas de alto riesgo (del17p o del11q) que fueron distribuidos al azar para recibir acalabrutinib 100 mg dos veces al día versus ibrutinib 420 mg una vez al día. Los resultados mostraron que el iBTK de segunda generación no es inferior al ibru tinib en términos de SLP y presenta beneficios en relación al perfil de efectos adversos, con una menor incidencia de fibrilación auricular (9,4% versus 16%), hipertensión arterial (9.4% versus 23.2%), hemorragias (38% versus 51%), artralgias y diarrea, luego de una mediana de seguimiento de 40,9 meses30.
Otro estudio de fase 3 (ALPINE), incluyó 652 pacientes con LLC recaídos, independientemente del riesgo gené tico, que fueron distribuidos al azar en igual proporción entre recibir zanubrutinib 160 mg dos veces al día (no aprobado en Argentina al momento de la redacción) versus ibrutinib a la dosis habitual, también observán dose la no inferioridad del iBTK de segunda generación en términos de SLP, con menor incidencia de fibrilación auricular a favor del primero (2.5% versus 10.1%) luego de una mediana de seguimiento de solo 14 meses31.
En ambos ensayos se excluyeron los pacientes con comorbilidad cardiovascular significativa.
Estudios en linfoma de células del manto
Como fuera mencionado previamente, ibrutinib y acala brutinib se encuentran aprobados en Argentina para los pacientes con LCM recaídos, entidad que se caracteriza por una duración de respuesta terapéutica, SLP y SG menor comparada con otros linfomas no Hodgkin B. Ibrutinib fue aprobado por FDA de forma acelerada luego de los resultados de un ensayo de fase 2 (estudio 1104) que enroló 115 pacientes recaídos a una o más líneas previas de tratamiento (no más de 5) para recibir ibrutinib a una dosis diaria de 560 mg. Luego de una mediana de seguimiento de 26,7 meses la tasa de respuesta global (RG) fue del 68% y de respuesta completa (RC) del 21%. La mediana de SLP fue de 13 meses, la mediana de SG de 22,5 meses, con una duración de la respuesta de 17.5 meses32.
Posteriormente en un estudio de fase 3 se enrolaron 139 pacientes con LCM recaído a recibir ibrutinib y 141 a la rama comparativa con temsirolimus. La RG fue del 77% y 47%, respectivamente. Luego de una mediana de seguimiento de 39 meses, la SLP fue significativamente superior para la rama con ibrutinib (16 vs 6 meses) con una tendencia a favor en términos de SG (30 vs. 24 me ses; p = 0.06)33.
En relación a acalabrutinib, también se realizó por parte de FDA una aprobación acelerada dados los resultados del ensayo de fase 2 y de rama única ACE-LY-004 que evaluó 124 pacientes con LCM recaído/refractario, que recibieron acalabrutinib a 100 mg dos veces al día hasta progresión o toxicidad inaceptable, presentando una tasa de RG del 81% y de RC del 43%. La mediana de SLP fue de 20 meses, la mediana de SG no fue alcanzada y la estimada a 24 meses fue de 72,4%, con una mediana de seguimiento de 26 meses34.
Complicaciones cardiovasculares. Abordaje terapéutico
Las tasas de supervivencia del cáncer han mejorado como resultado de los avances en el screening, la detección temprana y el tratamiento. Asimismo, disponemos de in formación creciente relacionada con los efectos adversos cardiovasculares del tratamiento oncológico35.
La cardio-oncología irrumpe como un concepto de tra bajo multidisciplinario enfocado a optimizar la prevención, el diagnóstico y la terapéutica de la cardiotoxicidad del tratamiento del paciente con cáncer36-38.
En este sentido, los iBTK son indicados en una pobla ción añosa portadora de LLC y otras enfermedades de las células B, que se caracterizan por presentar factores de riesgo coronario y comorbilidades que se asocian con compromiso de la tolerancia al tratamiento y al incremento del riesgo de toxicidad39.
La pregunta que responderemos en forma práctica es qué deben saber el hematólogo y el cardiólogo para abordar los riesgos cardiovasculares del tratamiento con iBTK. El tratamiento con ibrutinib modificó la historia natural de los pacientes con LLC, aunque planteó interro gantes en relación al aumento del riesgo de eventos tanto cardiovasculares (fibrilación auricular (FA), hipertensión arterial, insuficiencia cardíaca) como no cardiovasculares (sangrado, fiebre, artralgia, diarrea, infecciones). Los nuevos iBTK parecieran tener menor tasa de eventos cardiovasculares, pero la experiencia en el mundo real es limitada (Tabla 3). No disponemos de recomendaciones específicas basadas en la evidencia para el abordaje de dichos efectos adversos y en la selección de los diferen tes iBTK40-42. No obstante ello, no se recomienda utilizar iBTK en pacientes con historia de arritmia ventricular, muerte súbita, insuficiencia cardíaca grave, disfunción ventricular izquierda grave (FE < 30%) o hipertensión grave no controlada.
La FA no solo es la arritmia sostenida más prevalente en la población general sino también en pacientes onco lógicos, dada la asociación de factores predisponentes individuales (hipertensión arterial, diabetes, dislipemia, enfermedad cardiovascular y respiratoria previas) suma dos a los efectos del tumor y del tratamiento43-45.
Los scores de predicción de riesgo convencionales no evalúan el mayor riesgo de trombosis ni sangrado en presencia de cáncer activo36,37,43. En la población con cáncer hematológico se ha observado un aumento de la incidencia de FA asociada al uso de antraciclinas36,37,46.
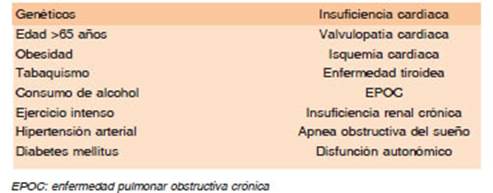
En LLC la prevalencia de FA al momento del diagnóstico es del 6%41,47. La incidencia de FA es mayor entre los pacientes tratados con ibrutinib48,49, sobre todo al inicio del tratamiento con una mediana de aparición de 6 a 14 meses. La tasa acumulada de FA en LLC es del 5.9% a los 6 meses y alcanza 16% a los 28 meses siendo la mayoría de los eventos adversos de FA de grado 2 (85.5%)49,51. En pacientes con LCM, la incidencia de FA es de 14.2% en un seguimiento a 24 meses. Se ha propuesto que el ibrutinib puede tener un efecto inhibidor de BTK y tirosina quina sas expresadas en miocitos humanos, que provocarían la disminución de la vía cardioprotectora PI3K-Akt48. Los pacientes con FA previa y aquellos mayores de 65 años, con control subóptimo de la presión arterial, diabetes, insuficiencia cardíaca, enfermedad coronaria o valvulo patías cardíacas tienen el mayor riesgo de desarrollar FA cuando reciben ibrutinib42,51.
Recientemente, en un estudio retrospectivo caso-control (n:778), se observó a 3 años mayor incidencia de FA (22.7% vs. 11.7%), sangrado (8.8% vs. 3.1%) e insu ficiencia cardíaca (7.7% vs. 3.6%) en el grupo ibrutinib52.
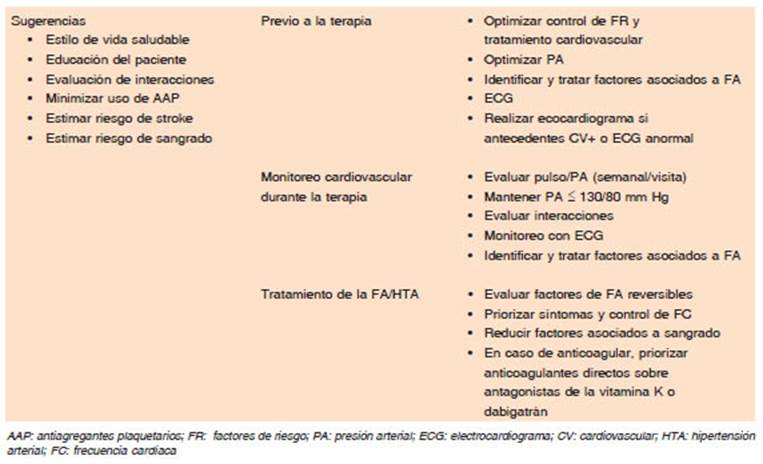
En todos los pacientes considerados para la terapia con ibrutinib deben evaluarse las comorbilidades y el riesgo cardiovascular con el objetivo de identificar y co rregir los factores predisponentes a la FA basal (Tabla 4, Tabla 5).
Ibrutinib se metaboliza principalmente en el hígado por la enzima del citocromo P450 3A4, que aumenta el potencial de interacciones medicamentosas. Es funda mental conocer las interacciones con los fármacos antihi pertensivos y antiarrítmicos. Es prioritario un seguimiento estrecho de los pacientes debido al incremento del riesgo de HTA fundamentalmente con el tratamiento con ibrutinib (14-23%), FA, fallo cardíaco, accidente cerebrovascular y hemorragia en hipertensos43,53,54. No obstante el mayor riesgo de eventos cardiovasculares, los pacientes se benefician con el tratamiento con ibrutinib, razón por la cual la evaluación debe estar orientada al tratamiento de los factores de riesgo, la detección y manejo de los efectos adversos y el replanteo del esquema terapéutico oncológico según corresponda con iBTK de segunda generación (acalabrutinib, zanubrutinib).
Previo al inicio del tratamiento se debe tener un adecuado control de la presión arterial El electrocardio grama basal debe realizarse para identificar FA y otras anomalías. Asimismo, la ecocardiografía nos ayudará a pesquisar parámetros asociados a FA como hipertrofia ventricular izquierda, dilatación auricular, valvulopatía significativa, disfunción ventricular izquierda55.
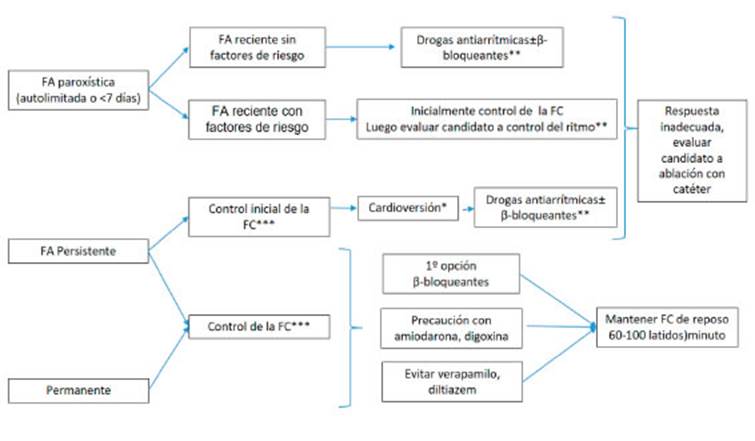
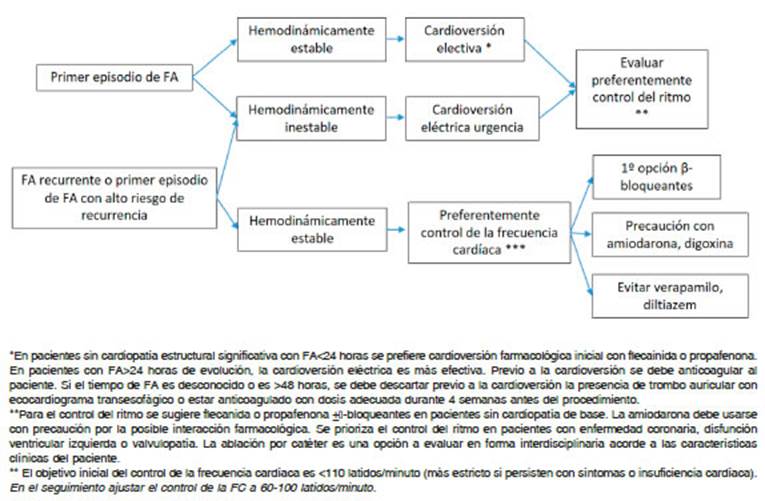
En pacientes con FA preexistente que necesitan tratamiento con ibrutinib, se recomienda la consulta de cardiología para optimizar el tratamiento cardíaco y analizar la necesidad de tratamiento anticoagulante (Fig. 3a, Tabla 5). Según las guías clínicas actuales de FA, en pacientes con FA paroxística, tratada con fármacos an tiarrítmicos, se prefiere la estrategia de control del ritmo, mientras que la terapia de control de frecuencia es la preferida en aquéllos con FA permanente. En pacientes con FA persistente se deberá evaluar individualmente el abordaje de control de la frecuencia cardíaca vs. mante nimiento del ritmo sinusal56,57.
Se deben evitar los inhibidores del citocromo CYP3A4 como diltiazem y verapamilo. La amiodarona o dronedarona se utilizan con precaución, porque au mentan los niveles de ibrutinib (si no pueden evitarse, se debe reducir la dosis de ibrutinib). No se observan interacciones farmacológicas con flecainida, propa fenona, vernakalant y β-bloqueantes. El ibrutinib es un potente inhibidor de la glicoproteína P razón por la que potencia el efecto de la digoxina con margen terapéutico estrecho, debiéndose administrar 6 horas alejada del ibrutinib54.
En pacientes con FA de reciente comienzo inestables o sin factores descompensantes asociados, se efectuará la cardioversión eléctrica o farmacológica como primera estrategia según corresponda (Fig. 3b). Asimismo, se iniciará tratamiento anticoagulante acorde a la evalua ción del riesgo de stroke y hemorrágico. La estrategia de control del ritmo tiene un éxito limitado durante el tratamiento con ibrutinib, sobre todo en pacientes con factores de riesgo o comorbilidades, razón por la cual deberá evaluarse la estrategia de control de la frecuencia cardíaca vs. modificar el esquema terapéutico en este grupo de pacientes37,50,58.
Asimismo, se debe considerar el mayor riesgo de he morragia en los tratados con ibrutinib, aspecto que hace que la anticoagulación sea un desafío. Se ha descripto 2-13% de trombocitopenia, 1-9 de sangrado mayor, va riable según edad, presencia de comorbilidades y terapia antiagregante plaquetaria y/o anticoagulantes40,50.
En ausencia de puntuaciones específicas que hayan sido validadas para pacientes con cáncer, se recomienda orientar la terapia de del accidente cerebrovascular utili zando los scores CHA2DS2-VASC y HAS-BLED36,37,43,59.
No se sugiere la antiagregación plaquetaria como una alternativa para reducir el riesgo tromboembólico55. En el caso de requerir simple o doble antiagregación por enfermedad coronaria o cerebral, se deberá definir con hemato-oncología el abordaje del tratamiento oncológico según fuera de corto plazo con eventual interrupción o de largo plazo con reemplazo del tratamiento con ibrutinib. No se recomienda el uso de antagonista de vitamina K en presencia de ibrutinib dado que los sometidos a estos tratamientos fueron excluidos de los estudios de fase II y III que llevaron a la aprobación regulatoria del ibrutinib22,60.
En aquellos que están siendo tratados con antagonista de la vitamina K, la continuación de estos medicamentos podría ser una opción solo si los pacientes tienen niveles de RIN estables o una prótesis mecánica43,61.
Se sugiere el tratamiento con anticoagulantes directos, evaluándose individualmente las interacciones farmacoló gicas y las comorbilidades40,59. Dado que el dabigatrán es un sustrato de la Gp-P, la coadministración con ibrutinib aumenta los niveles del anticoagulante, razón por la que se sugiere apixabán, rivaroxabán o edoxabán56,61,62.
La exposición a ibrutinib también se ha relacionado con el desarrollo de hipertensión. En el ensayo RESONATE, en un seguimiento hasta 71 meses después del inicio de la terapia con ibrutinib, el 21% de los pacientes desarro lló hipertensión de grado 3 o superior22. En un análisis de seguridad de cuatro ensayos controlados aleatorios que incluyeron 756 pacientes tratados con ibrutinib, se informó hipertensión de grado 3 o superior en el 4%. El tiempo medio hasta el inicio de hipertensión fue de 4.6 meses. Si bien ningún paciente requirió reducción de la dosis debido a la hipertensión, el 78% requirió el inicio o escalada de medicamentos antihipertensivos63. En un estudio de 562 pacientes seguidos durante un período promedio de 30 meses, el 78.3% desarrolló nueva hi pertensión o empeoramiento de hipertensión previa, con un aumento medio de la presión sistólica de 5.2 mmHg. De los que no tenían historia previa de hipertensión, el 17.7% desarrolló hipertensión de alto grado con una PA de 160 /100 mmHg o más. La hipertensión nueva o que empeoraba se asoció con un aumento del doble de los eventos cardíacos adversos importantes. Aunque el inicio de medicamentos antihipertensivos se asoció con un menor riesgo de efectos adversos importantes, no se identificó ninguna clase específica como superior en la prevención o el tratamiento en pacientes tratados con ibrutinib64. En un seguimiento alejado con una mediana de 87 meses se reportó HTA≥3 en el 28% de los sujetos tratados con ibrutinib65.
Las drogas de primera línea para el tratamiento de la hipertensión arterial son los inhibidores de la enzima convertidora de angiotensina o antagonistas del recep tor de angiotensina (preferentemente en presencia de insuficiencia cardíaca o proteinuria). Como segunda línea se pueden utilizar bloqueantes cálcicos o diuré ticos. En presencia de presión arterial > 160/100 mm Hg empezar con 2 drogas y aumentar a 3 drogas en pacientes que persisten con presión >160/100 mm Hg con 2 drogas antihipertensivas. Restringir la ingesta de sodio, monitorear la kalemia y evitar el uso de diltia zem/verapamilo por las interacciones farmacológicas. En pacientes con hipertensión arterial refractaria se evaluará con cardiología el esquema de tratamiento. Es importante el control de la presión arterial al inicio del tratamiento y semanalmente como así también limitar la ingesta de sodio acorde a las sugerencias de las guías66 (Tabla 5).
En el estudio ELEVATE-RR se observó luego de una mediana de seguimiento de 40,9 meses, menor tasa de eventos cardiovasculares (24 vs. 30%), HTA (9% vs. 23%), de FA (9% vs. 16%) y mayor tiempo al inicio de la FA (29 vs. 16 meses) en el grupo tratado con acalabru tinib versus ibrutinib. La mayoría de los pacientes que desarrollaron FA eran mayores de 75 años con historia de HTA y/o FA. La tasa de discontinuación del tratamiento con ibrutinib fue 5 veces mayor. Así mismo, se observó un caso de fibrilación ventricular y otro de muerte súbita en el grupo ibrutinib67.
El estudio abierto ASPEN, de diseño abierto, eviden ció menor tasa de FA o aleteo auricular (2% vs. 15%) e HTA grado ≥ 3 (11% vs. 16%) en el grupo zanubrutinib comparado con ibrutinib en pacientes con macroglobuli nemia de Waldenstrom68. Asimismo, el estudio ALPINE, fue concordante con relación a la menor tasa de FA con zanubrutinib vs. ibrutinib en pacientes con LLC/SLL30.
Una pregunta fundamental es cuándo deber referirse el paciente al cardiólogo (preferentemente con experiencia en oncología). En este sentido debe seleccionarse a los pacientes con FA u otras arritmias supraventriculares y/o arritmias ventriculares, hipertensión arterial no controlada con 2 drogas o insuficiencia cardíaca, previo al inicio o durante el tratamiento oncológico.
Conclusiones
Los inhibidores de la BTK han modificado la evolución de la LLC pero también han puesto en evidencia el aumento de los eventos cardiovasculares. En este aspecto, los nuevos inhibidores de BTK de segunda generación, con mayor selectividad, evidenciaron menor tasa de eventos cardíacos. En la búsqueda del esquema de tratamiento oncológico óptimo es fundamental no sólo identificar los pacientes de riesgo cardiovascular sino también definir un abordaje adecuado de la FA, la arritmia ventricular, la hipertensión arterial y la insuficiencia cardíaca.