El carcinoma tipo-linfoepitelioma pulmo nar (CTLP) es un subtipo raro de cáncer de pul món (CP) asociado con la infección del virus de Epstein-Barr (VEB), e histológicamente similar al carcinoma nasofaríngeo indiferenciado (CNI). Aun cuando el primer caso reportado fue en 1987 por Begin y col.1, el CTLP representa me nos del 1% de todos los CP2; sin embargo, ha sido informado en diferentes sitios, incluyendo glán dula mamaria3, tracto digestivo4 y timo5. Apro ximadamente una cuarta parte de los pacientes son asintomáticos y algunos de ellos son diag nosticados de forma incidental al momento de un examen físico de rutina. En aquellos pacien tes con manifestaciones clínicas, la tos ha sido informada en la mayoría. El estudio tomográfico de tórax frecuentemente muestra nódulos peri féricos de contornos lobulados, con atenuación homogénea, y en contacto directo con la pleura adyacente6.
El CTLP es una neoplasia poco diferenciada, prevalente es pacientes jóvenes y no fumado res. Los estudios moleculares han revelado baja frecuencia de mutaciones en EGFR, ALK, BRAF y KRAS, lo que sugiere que podrían no tener un papel crítico en la carcinogénesis del CTLP7,8.
Caso clínico
Hombre de 65 años, sin antecedentes heredofamilia res ni personales patológicos de relevancia. Inició su pa decimiento en el 2020 con tos productiva que se intensifi có y se agregó disnea de pequeños a medianos esfuerzos; así como pérdida de 10 kg de peso en un periodo de 4 meses. Acudió a un facultativo quien solicitó TAC de tórax que evidenció derrame pleural derecho masivo, multilo culado, con obstrucción del bronquio derecho y adenopa tías mediastinales. Se realizó toracocentesis con toma de biopsia del pulmón derecho y pleura parietal. El estudio histopatológico informó un carcinoma adenoescamoso. Su evolución fue mala, motivo por el cual fue referido a nuestra institución. A su ingreso, en la exploración física se encontró caquéctico, con hipoventilación pulmonar derecha, saturación del 92% y disfunción del Neumokit, sin datos de compromiso sistémico o hemodinámico. Se realizó radiografía de tórax que mostró opacidad comple ta del hemitórax derecho, y se procedió a colocar catéter pleural con débito serohemático. En el estudio histopa tológico del material de revisión, se observó parénquima pulmonar sustituido por neoplasia maligna poco dife renciada con patrón de crecimiento en mantos sólidos y sincicios, rodeados por abundantes linfocitos y células plasmáticas. Las células neoplásicas tenían núcleos gran des y ovoides, cromatina fina, nucleolo prominente y ci toplasma amplio y mal definido (Fig. 1 A-B). Se realizó estudio de inmunohistoquímica que resultó positivo en las células para CKAE1/AE3, CK 5/6, p63, EBER ISH, y negativo para Napsina A, TTF-1 y CK 7 (Fig. 2 A-F), lo que descartó el diagnóstico de referencia de carcinoma adenoescamoso y estableció el diagnóstico de CTLP. El estudio molecular en el bloque de parafina fue positivo para PD-L1 (SP263) +++ en aproximadamente 100% de las células neoplásicas, y negativo para EGFR, K-RAS, ALK, ROS1. Con la finalidad de confirmar el origen pulmonar de la neoplasia se realizó exploración de la nasofaringe que resultó negativa.
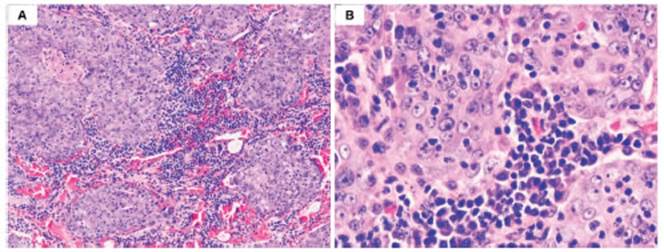
Figura 1 Aspecto histopatológico de CTLP. Las células neoplásicas se disponen en mantos sólidos de aspecto sincicial, rodeados por abundantes células plasmáticas y linfocitos reactivos (A) (Hematoxilina-eosina, 100X). A mayor aumento, las células neoplásicas tienen atipia citológica con núcleos ovoides, cromatina vesiculosa, nucleolo prominente y citoplasma amplio mal definido (B) (Hematoxilina-eosina, 400X)

Figura 2 Estudio de inmunohistoquímica e hibridación in situ. Las células neoplásicas son positivas para CK 5/6 (A), p63 (B), EBER ISH (C) y negativas para CK 7 (D), TTF-1 (E) y Napsina A (F) (A-E Inmunohistoquímica, F Hibridación in situ, 400X)
En abril de 2021 se realizó PET-TC que reportó lesión pulmonar parahiliar heterogénea que comprometía el bronquio principal y condicionaba atelectasia; así como múltiples adenopatías cervicales, mediastinales y pe rigástricas. Se retiró catéter por resolución parcial del derrame y se inició tratamiento con quimioterapia con gemcitabina/cisplatino más durvalumab. Recibió 6 ciclos, sin embargo, el paciente refirió hipoacusia y se documen tó lesión renal aguda AKIN I, por lo que se decidió cam biar cisplatino por carboplatino, posteriormente continuó con durvalumab de mantenimiento. En diciembre de 2021 se documentó progresión de la enfermedad y falleció en enero de 2022 por insuficiencia respiratoria.
Discusión
El CTLP es común en población asiática, sobre todo en mujeres jóvenes, pacientes no fumado res o con bajo índice tabáquico3; la edad prome dio al diagnóstico es 55 años. Más de la mitad de los pacientes se presentan con síntomas clíni cos, principalmente tos, expectoración, hemop tisis y dolor torácico. En los pacientes asintomáticos, en la gran mayoría se identifica de manera incidental un tumor pulmonar durante un exa men de rutina. El tamaño de estas lesiones varía de 1 cm a 10 cm de diámetro (promedio 4.2 cm)9.
Diferentes estudios han descrito que la ima gen característica del CTLP es principalmente un nódulo único de localización periférica, de contornos redondos o irregulares. La mayoría de estas lesiones se han reportado en los lóbulos inferiores, adyacentes a la pleura mediastinal con un SUVmax entre 5.4 y 11.610,11.
En el estudio microscópico, las células neoplá sicas se disponen en nidos o grupos irregulares, tienen núcleos redondos a ovales, cromatina vesicular, nucleolo prominente y citoplasma moderado. En el estroma se observan abundan tes células plasmáticas y linfocitos de aspecto maduro. En términos de inmunohistoquímica, las células neoplásicas del CTLP son positivas para p63, p40, EMA, CK AE1/AE3 y CK 5/6 y nega tivas para marcadores de diferenciación glandu lar como CK 7, CK 20, Napsina A y TTF-1, lo que indica una diferenciación similar al carcinoma epidermoide9,11,12. Kobayashi y col.13 informaron que los linfocitos asociados al tumor son predo minantemente linfocitos T citotóxicos (CD 8+ / TIA-1+). Muchos estudios han señalado que la patogénesis de este tumor está relacionado a la infección por VEB, aproximadamente 75% de los pacientes con CTLP son positivos para VEB; sin embargo, los mecanismos específicos de carci nogénesis no son claros14.
Liang y col. han señalado que en pacientes sin metástasis ganglionares la resección completa del tumor les permite alcanzar mejores tasas de supervivencia. Para pacientes con enfermedad localmente avanzada, el manejo está basado en quimioterapia concurrentemente con radiotera pia15. Al momento, esquemas de quimioterapia basados en platino constituyen la primera línea de tratamiento del CTLP10. La terapia dirigida utilizando inhibidores de cinasa de tirosina de EGFR es considerada una alternativa de trata miento para pacientes con carcinoma de pulmón de células no pequeñas, no así para pacientes con CTLP. Sin embargo, se ha documentado que estos pacientes pueden obtener un beneficio de la inmunoterapia usando anticuerpos monoclo nales anti-PD-1, anti-PD-L1 y anti-CTLA-4, como nivolumab o pembrolizumab9,14,15.
Wu y col. evaluaron la expresión de PD-L1 en 59 pacientes con CTLP tratados quirúrgicamen te, 29 de los cuales también recibieron quimio terapia y/o radioterapia después de la cirugía. El porcentaje de positividad para PD-L1 fue 96%, 91%, 83% y 61% para los puntajes de proporción tumoral > igual 1%, 5%, 10% y 50%, respectiva mente. Un punto para considerar es que PD-DL1 puede perder su antigenicidad con el tiempo, esto puede ser subestimado en la práctica clí nica, cuando se utilizan bloques de tejido em bebidos en parafina almacenados por mucho tiempo en el estudio de inmunohistoquímica. Por otro lado, se ha propuesto que podría exis tir una relación entre la expresión de PD-L1 y el pronóstico; sin embargo, hoy en día es un punto de controversia9. El estudio molecular del CTLP ha informado mutaciones somáticas que in volucran 50 genes; de los cuales P53 es el más común, seguido por mutaciones en CDKN2A, CYLD, MDM2, MYC, NFKBIA y TNFAIP39. En este sentido comparte un perfil molecular más cer cano al carcinoma epidermoide.
El diagnóstico diferencial incluye linfomas no Hodgkin y otros tipos de CP. Es importante des cartar CNI antes de establecer el diagnóstico de CTLP; no obstante, la confirmación diagnóstica depende del estudio histopatológico e inmuno histoquímico.
El pronóstico de pacientes con CTLP es fre cuentemente mejor que el de pacientes con otros tipos de CP; la supervivencia global a 5 años de pacientes en etapas I/II puede alcanzar casi el 100%. Liang y col. informaron una super vivencia media de aproximadamente 32 meses y una supervivencia global a 2 años y 5 años del 88% y 62%, respectivamente15.
En conclusión, el CTLP fuera de la población asiática es un subtipo raro de CP con caracterís ticas morfológicas similares al CNI. La estrecha asociación con el VEB y la alta expresión de PD-L1 en las células neoplásicas, ofrece una alter nativa de manejo terapéutico con inhibidores de PD-1/PD-L1; sin embargo, es necesario analizar un mayor número de pacientes en nuestra po blación.














