PUNTOS CLAVE
• El análisis citológico mediante PAAF es el paso inicial en el diagnóstico de nódulos tiroideos que son sospechosos de cáncer.
• Se ha descrito que alteraciones moleculares de las células foliculares tiroideas en el gen BRAF o en NRAS están asociadas con el proceso de carcinogénesis.
• En los pacientes estudiados las mutaciones en BRAF V600 y NRAS Q61 se observan en un número significativo de carcinomas papilares y foliculares de tiroides, respec tivamente.
• La mutación BRAF V600 se asocia significa tivamente con metástasis en los ganglios linfáticos y con las categorías de riesgo de recurrencia intermedio/alto según el Con senso Intersocietario Argentino.
El cáncer de tiroides es el tumor endocrino más prevalente. Si bien las tasas de incidencia varían a nivel internacional, diversos estudios demuestran que la prevalencia ha aumentado tres veces en los últimos treinta años con un cambio en los perfiles histológicos y gené ticos a lo largo de este tiempo1. Los datos más recientes indican una incidencia en EE. UU. de 15.7 nuevos casos/100 000 habitantes/año se gún el Instituto Nacional del Cáncer durante el período 2013-20172. En cuanto a Latinoamérica, se han informado 14.9 casos/100 000 mujeres y 3.9 casos/100 000 hombres en San Pablo (Brasil) durante los años 1998-20023. En la Argentina se encuentran pocos estudios estadísticos, como el de Faure y col., con 6.51 casos /100 000 habitan tes/año (2003-2011)4, y el realizado en la provin cia de Neuquén durante los años 2001-2012 en el cual se encontró una incidencia de 4.7 nuevos casos/100 000 habitantes/año5. El carcinoma pa pilar de tiroides (CPT) es la variante histológica más prevalente (aproximadamente 90%), segui do por el carcinoma folicular (CFT, 7%) y el car cinoma anaplásico (2%), mientras que en nues tra población el carcinoma medular de tiroides comprende alrededor del 1% de todos los casos de cáncer reportados en esta glándula4.
Es sabido que la iniciación y progresión del cáncer de tiroides ocurre como resultado de la acumulación gradual de alteraciones genéticas y epigenéticas a nivel celular. Se ha descrito que un gran número de mutaciones asociadas a esta enfermedad están presentes en genes que co difican para proteínas de la vía de señalización de proteínas quinasas activadas por mitógenos (MAPK), específicamente los genes homólogo del oncogén viral del sarcoma murino v-Raf B1 (BRAF) y RAS, además de la vía PI3K/Akt, entre otras. Los CPT que albergan la mutación BRAF generalmente se caracterizan por una muta ción puntual T1799A que da como resultado un cambio de valina por glutamato en el codón 600 (BRAF V600E)6.
Por otro lado, mutaciones en la familia de ge nes RAS (NRAS, KRAS y HRAS) y otros eventos, como el rearreglo PAX8/PPARγ son característi cos del CFT y otras lesiones foliculares6,7, sien do la mutación NRAS en el codón 61 (NRAS Q61) la más frecuente de todas las mutaciones RAS en los distintos tipos de cáncer de tiroides deri vados de células foliculares8-10 y mutaciones en este gen se encuentran en los tumores clasifi cados como RAS-like a partir del estudio TCGA (patrón folicular)1,7.
El objetivo del presente estudio fue determi nar el desempeño diagnóstico y la frecuencia de los cambios moleculares de BRAF y NRAS a partir de muestras de punción aspirativa con aguja fina (PAAF) de una cohorte de pacientes que asisten a nuestro centro y correlacionar los hallazgos con diversas características clínico-patológicas de aquellos de los que, tras la tiroidectomía, se contó con los datos de la anatomía patológica.
Materiales y métodos
Muestras tiroideas: este estudio fue llevado a cabo en tre 2016 al 2019. Un total de 193 muestras fueron obteni das para el estudio molecular a partir del material rema nente de la PAAF, procedimiento realizado para el estudio citológico de nódulos tiroideos sospechosos (38 hombres y 155 mujeres). De estos pacientes con nódulos biopsia dos, un total de 115 se sometieron a cirugía después de los hallazgos citológicos o por síntomas compresivos, en tre otras razones, según criterio médico. Se recolectaron datos demográficos de edad, sexo y motivo de punción junto con otros datos clínicos de relevancia al momento del ingreso al servicio. La mediana de edad de los pacien tes al momento del diagnóstico fue de 57 años (rango: 20-77 años). Adicionalmente se analizaron los datos del estudio anatomo-patológico de la biopsia de aquellos en los que se le ha practicado la cirugía correspondiente se gún evaluación médica.
Extracción de ADN genómico: se procedió a partir del lavado de aguja en solución estabilizante para ácidos nu cleicos del material residual de la punción, conservándo se a -20 °C hasta su procesamiento. El DNA genómico fue extraído usando MagMAX Total Nucleic Acid Isolation Kit (Thermo Fisher Scientific, Waltham, MA, USA), de acuerdo a las instrucciones del fabricante.
PCR cuantitativa y análisis de curvas de melting: las mutaciones en BRAF codón 600 (mutaciones V600E/K/ D/R) y NRAS codón 61 (mutaciones Q61R/K/L/H/P/E), se detectaron mediante PCR LightCycler 2.0 en tiempo real (Roche, Suiza) y análisis de curva de melting por fluores cencia como se describió previamente11,12. Brevemente, para cada mutación, se diseñaron un par de primers y dos sondas de hibridación (según Nikiforov YE y col.11) y la amplificación se realizó usando 5-50 ng de templado en 5 μl con 15 μl de la mezcla de reacción conteniendo, en concentración final, 4 μM de cada primer, 0.75 nM de cada sonda de hibridación, 4 mM de Cl2Mg, DMSO 1% y enzi ma 1X según LightCycler FastStart DNA Master HybProbe Kit (Roche, Suiza). La mezcla de reacción se sometió a 40 ciclos de amplificación por PCR que consiste en desnatu ralización a 95° C durante 5 s, annealing a 54° C durante 20 s y extensión a 72° C durante 12 s. El análisis de la curva de melting de fluorescencia posterior a la amplificación se realizó mediante calentamiento gradual de las muestras a una velocidad de 0.1° C/s de 45° C a 95° C.
Se identificaron pares coincidentes de PAAF nodular preoperatoria y biopsias tiroideas con hallazgos benignos (por ejemplo, hiperplasia nodular, tiroiditis). Este con junto de muestras sirvió como control negativo para el ensayo de PCR. Para cada análisis mutacional, el ADN de uno o más tumores portadores de una mutación específi ca confirmada por secuenciación se utilizó como control positivo.
Análisis estadístico
Para cada categoría diagnóstica de la clasificación de Bethesda, se calculó el riesgo de malignidad según la si guiente fórmula: riesgo de malignidad (%) = n casos de anatomía patológica malignax100/ n total de casos, co rrespondiente a cada categoría citológica. Además, se calculó la sensibilidad (%) como la tasa de verdaderos positivos/total de casos de la correspondiente categoría histológica y la especificidad (%) se estimó como la tasa de verdaderos negativos/total de casos según la anatomía patológica. Los indicadores de diagnóstico de la clasifi cación Bethesda se calcularon como método para iden tificar malignidad (resultados de las categorías V y VI se categorizaron como verdadero positivo si el resultado histológico fue maligno mientras que para el resto de las categorías se consideró verdadero positivo si el resultado histológico fue benigno).
Todo análisis estadístico fue realizado usando el soft ware GraphPad Prism versión 8.2 (GraphPad Software Inc, EE.UU.). Para determinar la asociación de las mutaciones de BRAF o NRAS con las distintas variables se realizó el test exacto de Fisher. Considerando que los valores espe rados deben ser mayores a 1 para poder realizar el cálcu lo, se evitó el problema combinando dos o más variables según se indique en cada tabla. Un valor de p < 0.05 fue considerado significativo.
Responsabilidades éticas
Todos los procedimientos en este estudio se realizaron de acuerdo con los estándares éticos de la Declaración de Helsinki de 1964 de la Asociación Médica Mundial y sus enmiendas posteriores o estándares éticos compa rables, y tras la obtención del consentimiento informado correspondiente. Las autoridades de TCba aprobaron este protocolo de estudio cumpliendo con nuestras directrices nacionales.
Resultados
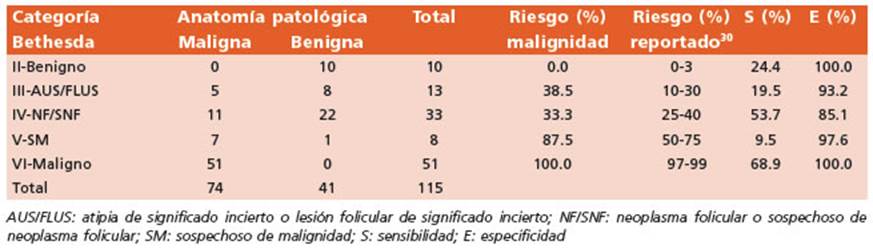
En este trabajo se incluyeron un total de 193 muestras de la PAAF, que en la mayoría de los casos (61.1%) se corresponden con las categorías citológicas Bethesda II (32.1% de las muestras, n = 62) y Bethesda VI (29.0%, n = 56). El resto de los hallazgos citológicos obtenidos en el presen te estudio fueron: 8.3% de atipia de significado incierto o lesión folicular de significado incierto (Bethesda III, n = 16); el 24.9% de los casos, correspondió a muestras reportadas como neo plasma folicular o sospechas de neoplasma fo licular (Bethesda IV, n = 48); mientras que en el 4.7% de los casos restantes, correspondió a muestras reportadas como sospechoso de ma lignidad (Bethesda V, 4.7%, n = 9). Solo en 2 casos (1.0%) se consideró insatisfactorio o Bethesda I. Con respecto a la mutación de BRAF, el estu dio molecular pudo realizarse en el 96.9% de las muestras adecuadas para el estudio citológico ya que en algunas, el contenido de ADNg fue insufi ciente. El 74.1% de las muestras correspondiente a la categoría Bethesda VI, resultó positiva para mutaciones en este gen, siendo un 44.4%, 4.3% y 6.2% para las categorías V, IV y III, respectiva mente. En las muestras que involucraron enfer medades tiroideas benignas, no se encontró en ningún caso BRAF mutado (Tabla 1).

Tabla 1 Estado mutacional de BRAF V600 en 193 muestras de PAAF en relación con la categoría citopatológica correspondiente
De los 115 individuos sometidos a tiroidecto mía, 41 casos (el 35.6%) correspondieron a patolo gía benigna (tiroiditis, hiperplasia nodular o ade noma folicular), 67 casos (58.3%) correspondieron a CPT (47 casos variante clásica, 15 variante foli cular, 2 casos con variante esclerosante, 2 con on cocítica mientras que en 1 caso no se especificó), 6 casos (5.1%) a CFT (5 mínimamente invasor y 1 oncocítico) y solo un caso fue diagnosticado his tológicamente como carcinoma medular.
En la población estudiada, el riesgo de malig nidad de las categorías Bethesda III a V fue del 38.5%, 33.3% y 87.5%, respectivamente, al com parar el resultado citológico con el estudio ana tomopatológico, como se detalla en la Tabla 2.
De los 54 casos estudiados histológicamente que se categorizaron los PAAF como citologías categorías III, IV y V, se observaron 16 casos de CPT de los cuales 7 se correspondieron con BRAF mutado, mientras que sólo el 19.1% fueron CPT de los casos que no presentaron la mutación (9/47 casos), como se muestra en la Figura 1. El valor predictivo negativo de BRAF V600 mutado para CPT en estas categorías citológicas fue del 79.2% (IC95%: 65.7-88.3) y el positivo del 100.0% (IC95%: 61.0-100.0). Además, se obtuvo un riesgo relativo de BRAF para CPT de 4.8 (IC95%: 2.5-5.6) en estas categorías.

Figura 1 Utilidad del marcador BRAF V600 para carcinoma papilar de tiroides (CPT) en categorías citológicas III, IV y V
De las 115 muestras analizadas histológica mente, en 44 biopsias de las 67 correspondientes a CPT por anatomía patológica (65.7%) se corres pondió con el hallazgo de la mutación en BRAF en el ADNg extraído en el PAAF. En el resto de las variantes histológicas (CFT, medular o lesio nes benignas) no se halló mutaciones en BRAF V600 (48/115 muestras de PAAF). La mayor pre valencia de mutaciones en BRAF en nuestra po blación se correspondió al CPT variante clásica (70.2%), mientras que el CPT variante folicular u otras, la prevalencia fue significativamente más baja, 40.0% y 20.0% respectivamente (p = 0.0132, CPT variante clásica vs. el resto de las variantes, test exacto de Fisher). Un resultado BRAF V600 mutado en PAAF aumentó en un 59.1% el riesgo de presentar CPT variante clásica en la anato mía patológica (riesgo relativo 1.59, IC95%: 1.13 a 2.47).
Teniendo en cuenta que las mutaciones en NRAS son más prevalentes en lesiones tiroideas con patrón folicular (Ras-like) y que además son mutuamente excluyentes con BRAF, decidimos evaluar retrospectivamente el estatus mutacio nal de este marcador en las muestras de PAAF correspondientes a lesiones foliculares ma lignas y benignas según anatomía patológica, como ser el adenoma folicular (n = 15), el CFT (n = 6) y el CPT variante folicular (n =15). Como control de especificidad del marcador, muestras de CPT variante clásica (n = 30) fueron incluidas. Los pacientes con CPT variante clásica fueron negativos para NRAS (siendo 24 BRAF positivos y 6 negativos para la mutación de este gen) y tam bién las muestras correspondientes a los indivi duos con CPT variante folicular. De los pacientes con adenoma folicular, solo uno resultó positivo para NRAS de los casos evaluados. Los pacien tes con CFT (que les corresponde una categoría Bethesda IV o V a las muestras en el análisis ci tológico del PAAF), presentaron una frecuencia de mutación para NRAS significativamente ma yor (3 de 6 muestras CFT vs. 1 de 30 casos No CFT, p = 0.0104, test exacto de Fisher) y un riesgo relativo de 8.0 como se indica en la Figura 2. El valor predictivo negativo de NRAS Q61 mutado para CFT en estas muestras analizadas fue del 90.6% (IC95%: 75.8-96.8) y el positivo del 75.0% (IC95%: 30.1-98.7).
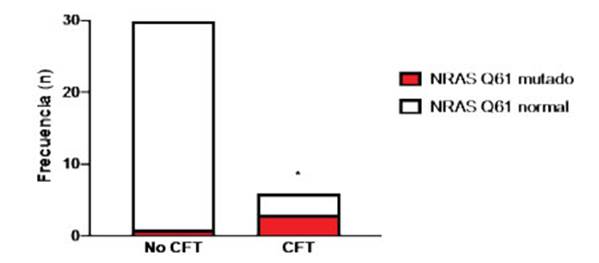
Figura 2 Estado mutacional de NRAS en punción con aguja fina (PAAF) y su relación con el tipo de lesión neoplásica folicular
Finalmente, se determinó el desempeño diag nóstico considerando ambos marcadores mole culares en las muestras correspondientes a las citologías III, IV y V. Para los marcadores BRAF V600 más NRAS Q61 se obtuvo una sensibilidad del 43.5% (IC95%: 25.6-63.2), especificidad del 96.8% (IC95%: 83.8-99.8), valor predictivo positi vo del 90.9% (IC95%:62.3-99.5) y un valor predic tivo negativo del 69.8% (IC95%: 54.9-81.4), consi derando las lesiones benignas o malignas según la anatomía patológica. Para estas categorías citológicas, el riesgo relativo de los marcadores BRAF V600 y NRAS Q61 fue de 3.01 (IC95%: 1.78- 4.99, p = 0.0004, test exacto de Fisher). Además, se calculó el riesgo de malignidad post-test mo lecular que resultó en 100%, 75% y 100% para las categorías III, IV y V respectivamente si el resultado es positivo (mutado) para BRAF V600 o NRAS Q61.
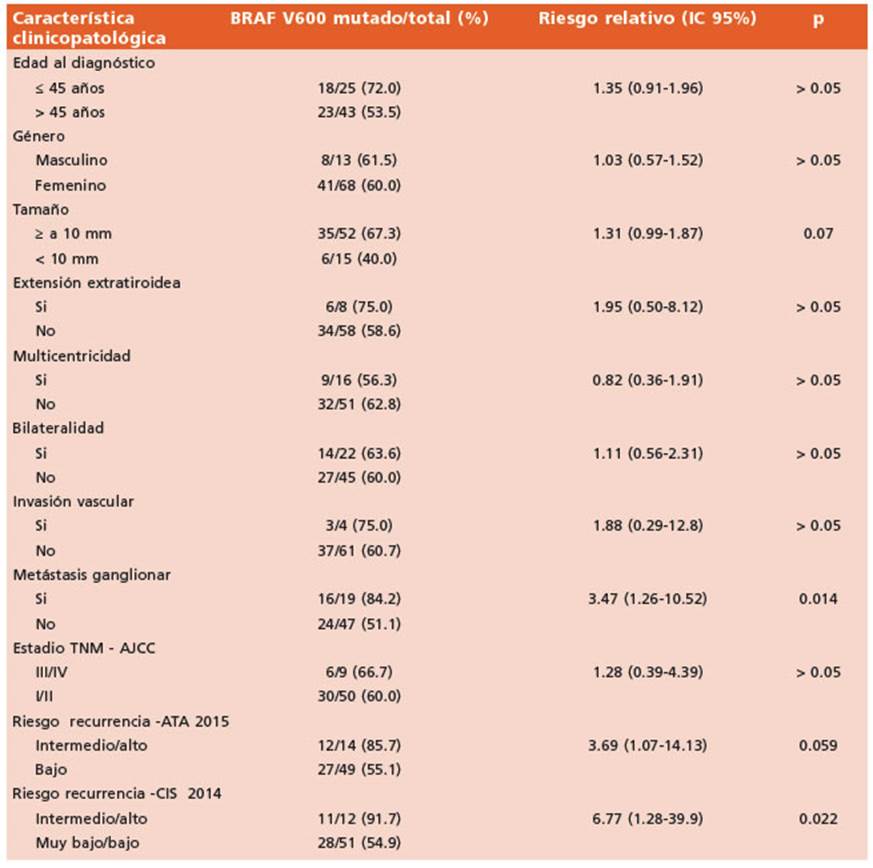
Dado que las variantes moleculares a nivel de DNA podrían asociarse con diferentes caracte rísticas de agresividad, realizamos un estudio de asociación entre el estatus mutacional de BRAF con diferentes características clínico-pa tológicas de los pacientes con CPT, que se listan en la Tabla 3. El análisis estadístico dio un va lor significativo de asociación entre la presencia de la mutación con metástasis en los ganglios linfáticos (riesgo relativo de 3.47, IC95%: 1.26- 10.52, p = 0.014, test exacto de Fisher) y con las categorías de riesgo de recurrencia intermedio/ alto según el consenso argentino (riesgo relativo de 6.77, IC95%: 1.28-39.90, p = 0.022, test exacto de Fisher), aunque no según las categorías ATA 2015 (riesgo relativo de 3.69, IC95%: 1.07-14.13, p=0.059, test exacto de Fisher). No se encontra ron asociaciones estadísticamente significativas en el resto de las características detalladas en la tabla 3.
Discusión
Según Jung CK y col. el aumento en la inci dencia de cáncer de tiroides en las últimas cua tro décadas está fuertemente relacionado con el aumento de la mutación BRAF en CPT clásico y el aumento de la mutación RAS en la variante folicular. En contraste, la frecuencia de reorde namientos cromosómicos específicos del cáncer de tiroides está disminuyendo13. En este con texto, estudiamos la frecuencia mutacional de BRAF y NRAS en cáncer de tiroides en muestras de PAAF de nuestra población.
La prevalencia de la mutación BRAF en CPT se ha informado en diferentes estudios con un ran go de 29% a 83%, siendo mayor en Asia que en países occidentales como Estados Unidos, Italia o España14,15. En este trabajo estamos reportan do una frecuencia del 65.7% de la mutación en muestras de PAAF por qPCR de los pacientes con CPT.
Encontramos una concordancia estricta en tre el estado de mutación BRAF y el diagnóstico histológico final de CPT, principalmente variante clásica, hallándose diferencias significativas con los otros subtipos histológicos. Dado que en el resto de las variantes histológicas (CFT o lesio nes benignas) no se encontró mutación en BRAF, este marcador fue altamente específico en nues tra población para el CPT, similar con lo publica do en otros trabajos6,16.
Los 54 nódulos compatible con citología ca tegorías III a V y mutación BRAF V600 positiva fueron CPT en comparación con el 19.1% de los nódulos que dieron negativo (Fig. 1). Limita el análisis de estos resultados el hecho de que la positividad para la mutación en dichas categorías fue en un número reducido de casos, aunque la diferencia fue estadísticamente significativa.
Las mutaciones en RAS representan la segun da alteración genética más comúnmente identi ficada en cáncer de tiroides, principalmente en tumores con patrones foliculares, como adeno ma o CFT, y la variante folicular del CPT. Hay al gunas evidencias de que el estado de mutación RAS tendría utilidad diagnóstica para las lesio nes con citología indeterminada, para las cua les la detección de RAS puede tener un impacto en la toma de decisión para el seguimiento del paciente8,17, aunque el valor diagnóstico de este marcador es heterogéneo entre los diferentes es tudios18 principalmente porque se ha detectado en muestras de adenoma. En nuestro estudio solo analizamos el gen mutado más frecuentemente de la familia de genes RAS, NRAS. La frecuencia de las mutaciones de NRAS fue concordante con la informada anteriormente, especialmente en CFT9,19 aunque una limitación de este estudio es el pequeño número de pacientes con CFT, dada la baja prevalencia de este carcinoma en nuestra población4. Tolaba y col. observaron una frecuen cia del 10.3% en adenoma folicular y del 66.6% en CFT de NRAS mutado (en categorías III y IV estudiadas)20, de manera similar a lo observado en este trabajo (6.7% y 50.0%, respectivamente). Si bien las mutaciones NRAS en los tumores de tiroides se asociaron previamente con un mayor riesgo de metástasis a distancia9 nuestros limitados datos no permitieron establecer esta asociación.
En nuestro estudio, la combinación de análi sis molecular y examen citológico en categorías III, IV y V que presentó una tasa mutacional baja (7 muestras presentaron BRAF V600 mutado y 4 NRAS Q61 mutado de 54 muestras con diag nóstico histológico), el valor predictivo positivo fue alto (90.9%) mientras que el valor predictivo negativo fue del 69.8% a expensas de una alta especificidad de BRAF V600 mutado para CPT y, en menor medida por NRAS Q61 mutado para CFT, dado que este marcador dio positivo en el 6.7% de los casos de AF, además de verse afec tado este cálculo por la proporción en estas ca tegorías citológicas de lesiones malignas y be nignas. Estos resultados fueron consistentes con estudios previos donde se analizan un marcador o un panel de marcadores con mutaciones pun tuales que incluyen a BRAF y NRAS10,11,20-23.
Conocer si existen asociaciones entre algún marcador molecular preoperatorio con carac terísticas clinicopatológicas de mal pronós tico es relevante dado que permite tomar decisiones clínicas importantes. En este sentido BRAF V600E se ha asociado con marcadores de agresividad clínica (tumores más grandes, edad avanzada, extensión extratiroidea, metás tasis en los ganglios linfáticos y mayor riesgo de recurrencia)24-27. En nuestro estudio, sin em bargo, esta asociación no pudo establecerse de manera inequívoca. Incluso, no pudo predecir el riesgo de recurrencia según ATA 2015 aun que sí considerando el Consenso Intersocieta rio Argentino. Además, la asociación hallada entre BRAF mutado con N1 concuerda con lo observado por otros autores por lo que podría estar involucrado en el proceso de metástasis local dentro del entorno del CPT. Sin embargo, Kurtulmus N y col.28 observaron que la preva lencia de la mutación BRAF V600E en el tumor no mostró una correspondencia uno a uno con el estudio molecular en los ganglios linfáticos metastásicos, por lo que seguramente otras ca racterísticas del tumor y de su microambiente serían determinantes en este proceso. Incluso algunos autores han propuesto reconsiderar la relevancia clínica como marcador pronóstico de la mutación BRAF V600E en CPT29.
Este estudio preliminar muestra que la muta ción BRAF V600E solo estaba presente en pacien tes con CPT (con una alta frecuencia) aunque no pudimos establecer una correlación estricta con características de peor pronóstico del tumor en nuestra población, mientras que la mutación en NRAS Q61, por lo general asociada con lesiones tiroideas con patrón folicular, se encontró en un 50% de los pacientes con CFT. Estudios adicio nales serían necesarios con otros marcadores de valor pronóstico (como ser el caso de mutacio nes en el promotor del gen TERT o TP53) además de NRAS y BRAF.