PUNTOS CLAVE
• El tratamiento anticoagulante es un pilar fundamental en el abordaje de los síndro mes coronarios agudos.
• La elección del tipo de tratamiento anti coagulante y su duración debe ser basada en el tipo de síndrome coronario agudo, la estrategia de revascularización emplea da y el balance entre el riesgo isquémico-hemorrágico.
• La estratificación del riesgo hemorrágico y el manejo del sangrado agudo son herra mientas sumamente útiles en la práctica clínica diaria.
El tratamiento antitrombótico en los síndro mes coronarios agudos (SCA) con y sin interven ción coronaria percutánea, constituye la piedra fundamental para la prevención de la recurren cia isquémica, fisiopatológicamente asociada a la progresión del fenómeno trombótico.
En los últimos años se ha publicado mucha información respecto al tratamiento antipla quetario, sus combinaciones y su duración. Sin embargo, poco se ha escrito sobre el tratamiento anticoagulante, fundamental para la estabiliza ción inicial de estos pacientes en la fase hospita laria. En la práctica diaria el tipo de tratamiento anticoagulante y su duración dependerán de: el tipo de SCA, los riesgos isquémicos y hemorrá gicos, y la necesidad de intervención coronaria; lo que establece múltiples escenarios de trata miento a analizar y conforman el objetivo de la presente revisión bibliográfica.
Síndrome coronario agudo con supradesnivel del ST
Pacientes que reciben trombolíticos
La utilización de anticoagulación en el con texto de la terapia de reperfusión con trombolí ticos se basa fisiopatológicamente en el benefi cio potencial sobre la progresión y disolución del trombo, antes y después de la administración de estos últimos con el objetivo de reducir el riesgo de reoclusión coronaria.
La generación de trombina en la cascada de la coagulación es un paso fundamental en la formación de coágulos de fibrina, junto con la activación plaquetaria. La disponibilidad local de trombina aumenta paradójicamente por la acción de agentes fibrinolíticos, al liberar la trombina activa que está atrapada en la malla de fibrina. Enzimáticamente activa, la trombina juega un papel clave en la reoclusión después de una reperfusión coronaria exitosa, proporcio nando la justificación para la terapia anticoagu lante como tratamiento adyuvante en pacientes con infarto agudo de miocardio con elevación del segmento ST (IAMCEST) que hayan recibido fibrinolíticos1-3.
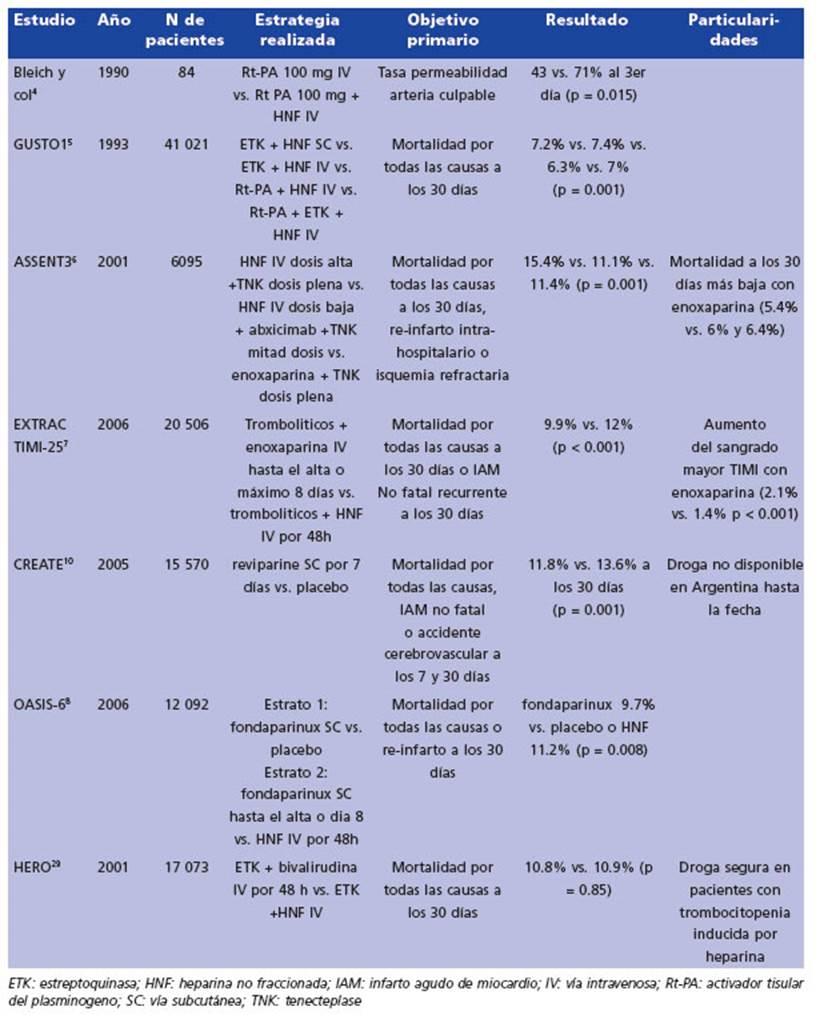
Esta hipótesis ha sido comprobada con traba jos (Tabla 1) que mostraron reducción de la carga trombótica con la anticoagulación y mayor permeabilidad de la arteria responsable del infarto horas o días después de la terapia fibrinolítica inicial, con una reducción del riesgo de reoclu sión del vaso expresado como angina postinfar to o reinfarto. Todo este beneficio debió balan cearse frente al aumento del riesgo hemorrágico que ya de por sí, producen los fibrinolíticos.
Heparina no fraccionada
En un estudio piloto publicado por Bleich y col., 84 pacientes fueron tratados dentro de las 6 horas posteriores al inicio del infarto agudo de miocardio (media de 2.7 horas) con la dosis estándar de 100 mg de rt-PA durante 3 horas4. Cuarenta y dos pacientes fueron aleatorizados para recibir anticoagulación con HNF intrave nosa (IV) inmediata adicional (5000 U de bolo IV seguido de 1000 U/hora ajustado a un tiempo de coagulación activado (TCA) de 1.5 a 2.0 veces el control) mientras que 42 pacientes recibieron rt- PA solo. La angiografía coronaria realizada el día 3 (48 a 72 horas, media 57) después de la tera pia con rt-PA reveló tasas de permeabilidad de la arteria del infarto del 71 y el 43% en pacientes anticoagulados y del grupo control, respectiva mente (p = 0.015). El sangrado leve, moderado y grave ocurrió en el 52, 10 y 2% del grupo anti coagulado, respectivamente y en el 34, 2 y 0% de los pacientes del grupo control, respectivamente (p = 0.006), a expensas de un aumento del san grado leve. Estos datos indican que después de la terapia con rt-PA, la administración de hepa rina no fraccionada (HNF) se asocia con tasas de permeabilidad coronaria sustancialmente más altas 3 días después de la fibrinólisis, con mayor incidencia de complicaciones hemorrágicas me nores, en pacientes con IAMCEST.
El estudio GUSTO 1 incluyó 41 021 pacientes que se aleatorizaron a 4 grupos, grupo 1: estrep toquinasa más HNF en dosis fija de 12 500 UI subcutánea (sc) cada 12 h; grupo 2: estreptoqui nasa más HNF IV; grupo 3: activador tisular del plasminógeno más HNF IV con un KPTT obje tivo 1.5 veces el normal; y grupo 4: activador tisular del plasminógeno más estreptoquinasa y HNF IV. La mortalidad fue del 7.2% para el gru po 1; 7.4% para el grupo 2; 6.3% para el grupo 3; y 7.0% para el grupo 4. La combinación de t-PA y HNF en infusión por al menos 48 h mostró haber tenido el mejor balance de eficacia y se guridad5.
En otros trabajos en los cuales se aleatoriza ron pacientes para continuar con HNF o inte rrumpirla, no se pudo evidenciar beneficios con la prolongación del tratamiento más allá de las 48 h.
Heparinas de bajo peso molecular
El estudio ASSENT 3 fue un ensayo clínico aleatorizado y controlado que comparó la efica cia y seguridad de dos regímenes de anticoagu lación diferentes en combinación con la terapia trombolítica con tenecteplase (TNK) en pacien tes con infarto agudo de miocardio6. El estudio se llevó a cabo entre 2000 y 2002 y se incluyó a más de 6000 pacientes de 363 centros de todo el mundo. Los pacientes se dividieron en tres grupos de tratamiento: uno recibió heparina no fraccionada (HNF) con bolo intravenosa (IV) de 60 U/kg (máximo 4000 U) seguido de 12 U/kg/h (máximo 1000 U/h) con objetivo de KPTT 50 a 70 seg. y con dosis completa de TNK; otro HNF en dosis bajas (bolo IV de 40 U/kg, máximo 3000 U, seguido de una infusión de 7 U/kg/h (máximo 800 U/h) con un objetivo de KPTT entre 50 a 70 seg) junto con abciximab y TNK a mitad de do sis; y el otro recibió enoxaparina (bolo de 30mg IV seguido de 1 mg / kg cada 12 h) como anti coagulante en combinación con TNK a dosis ple na. El objetivo primario del estudio fue evaluar la mortalidad por todas las causas a los 30 días después del inicio del tratamiento. Los resulta dos del estudio mostraron una reducción de la tasa de eventos isquémicos en las ramas enoxa parina y abciximab combinado con HNF en dosis bajas frente a HNF en dosis convencional. Entre los pacientes mayores de 75 años, el compues to de eficacia y seguridad fue peor en el grupo de abciximab en comparación con el grupo de HNF: 36.9% versus 28% (p = 0.001), pero no en el grupo de enoxaparina (25.5%). Asimismo, entre los diabéticos, el riesgo del punto final primario compuesto de eficacia y seguridad fue mayor en el grupo de abciximab en relación con el grupo de HNF: 22.3 % frente a 16.5%, p = 0.0007, pero no en el grupo de enoxaparina (13.9%). Las tasas de hemorragia mayor aumentaron en el grupo de abciximab en relación con el grupo de HNF (4.3% frente a 2.2%, p = 0.0002), pero no aumentaron significativamente en el grupo de enoxaparina (3.0%, p = no significativa frente a heparina). La mortalidad a los 30 días fue más baja en el grupo de enoxaparina (5.4%).
El estudio EXTRACT-TIMI 25 publicado en el año 2006, incluyó 20 506 pacientes con IAMCEST o nuevo bloqueo de rama izquierda7. Los pacien tes recibieron tratamiento de reperfusión con trombolíticos asociado a dosis anticoagulante de HNF por 48 h o enoxaparina con un promedio de uso de 7 días (4.5-7.5 días) o hasta el alta. La hipótesis era que la seguridad de la enoxaparina favorecería su uso prolongado. La utilización de enoxaparina demostró reducción de la mortali dad y del infarto de miocardio en un 17% (9.9% vs. 12%; p < 0.001), con un aumento del sangrado mayor 2.1% vs. 1.4% pero sin aumento significa tivo del sangrado intracraneal (el tratamiento con enoxaparina tuvo una mediana de duración de 7 días vs. 2 días en HNF).
El beneficio de la heparina de bajo peso mole cular (HBPM) sobre la HNF podría explicarse, en parte, por su mayor tasa de inhibición de los fac tores Xa y IIa que es 4:1 comparado con la HNF que es 1:1. La inhibición de una sola molécula de factor Xa inhibe la producción aguas abajo de muchas moléculas de trombina (por actuar en una etapa más temprana en la cascada de la coagulación). Por otro lado, la mayor estabi lidad en cuanto a efecto terapéutico y la menor inhibición sobre las plaquetas parece justificar el menor riesgo hemorrágico y de esta manera obtener beneficio con la prolongación del trata miento más allá de las primeras 48 h, hecho que no se ha evidenciado con el uso de HNF.
Fondaparinux
Este pentasacárido es muy específico, solo tiene actividad anti Xa y no posee efectos sobre el factor IIa. El estudio OASIS 6 publicado en el 2006, incluyó 12 092 pacientes con IAMCEST o nuevo bloqueo de rama izquierda8. Los pacien tes recibieron tratamiento de reperfusión con trombolíticos y se dividieron en 2 estratos. Es trato 1: los pacientes eran aleatorizados a recibir 2,5 mg/día de fondaparinux por vía subcutánea (SC) vs. placebo (5658 pacientes). Estrato 2: los pacientes eran aleatorizados a bolo IV de fonda parinux 2.5 mg seguido de 2.5 mg SC/día hasta el día 8 o el alta (lo que ocurra primero) vs. HNF por 48 h. Estos estratos se dividían de acuerdo a la consideración del médico tratante sobre la necesidad de HNF. La muerte o el reinfarto a los 30 días se redujo significativamente de 11.2% en el grupo de control a 9.7% en el grupo de fon daparinux (HR 0.86: IC95%: 0.77-0.96, p = 0.008), con una reducción significativa de la mortalidad a los 30 días (7.8% vs. 8.9%, p = 0.03) explicada por la reducción de la muerte cardíaca. Estos be neficios se observaron a los 9 días y al final del estudio. No hubo heterogeneidad de los efectos de fondaparinux en los 2 estratos según el uso de HNF. Sin embargo, se evidenció una interac ción significativa, con aparente menor beneficio en aquellos que se sometieron a angioplastia primaria. Desde el punto de vista de la seguri dad, se halló una tendencia no significativa a menor sangrado grave en fondaparinux (1% vs. 1.3%) con significancia estadística en la tasa de sangrado fatal.
Bivalirudina
El estudio HERO-2 aleatorizó 17 073 pacientes con IAMCEST a recibir bivalirudina o HNF aso ciada a estreptoquinasa9. Los pacientes recibie ron un bolo, seguido de infusión IV de bivalirudi na durante 48 horas (n = 8516), o HNF (n = 8557), junto con una dosis estándar de 1.5 millones de unidades de estreptoquinasa. El punto final pri mario fue mortalidad a los 30 días. Los puntos finales secundarios incluyeron reinfarto dentro de las 96 horas y sangrado. A los 30 días, la mor talidad fue 10.8% en el grupo de bivalirudina y 10.9% en el grupo HNF (p = 0.85). Se halló me nos reinfarto dentro de las 96 h en el grupo de bivalirudina que en el grupo de HNF (0.70 [0.56- 0.87]; p = 0.001). Se produjo hemorragia grave en 58 pacientes (0.7%) del grupo bivalirudina frente a 40 pacientes (0.5%) del grupo HNF (p = 0.07), y se produjo hemorragia intracerebral en 47 (0.6%) y 32 (0.4 %), respectivamente (p = 0.09). Las ta sas de sangrado moderado y leve fueron signifi cativamente más altas en el grupo bivalirudina comparadas con el grupo de HNF (p < 0.0001). Es importante recordar que la droga ha demostra do ser fisiopatológicamente segura en pacien tes con trombocitopenia inducida por heparina. Esta droga no está disponible en nuestro medio al momento de la publicación de este trabajo.
En la Tabla 2 se muestran las dosis recomen dadas para el tratamiento anticoagulante como coadyuvante a los fibrinoliticos.
Conclusiones
- En los pacientes que solo reciben terapia fi brinolítica, la utilización de enoxaparina o fon daparinux sería beneficiosa mientras dure la hospitalización o hasta 8 días.
- En los pacientes tratados con estrategia far macoinvasiva dentro de las 3 a 24 h, la evidencia parece respaldar el beneficio en primer lugar de enoxaparina y en segundo lugar de la HNF y fon daparinux.
- En pacientes que recibieron tratamiento fi brinolítico y se realizará la cinecoronariografia de forma diferida (mayor a 48 h), las opciones de fondaparinux o enoxaparina son convenientes desde el punto de vista de seguridad, eficacia y practicidad hasta la angioplastia.
- En pacientes en los cuales no se ha indica do terapia de reperfusión, el fondaparinux o la enoxaparina parecen ser estrategias beneficio sas hasta la revascularización o mientras dure la internación y hasta no más de 8 días.
- En el caso de utilizar fibrinolíticos fibrinoes pecíficos, el inicio de la anticoagulación impre siona ser beneficiosa cuando se lleva a cabo de manera conjunta. Mientras que en el caso de los no fibrinooespecíficos se sugiere postergar el inicio de la anticoagulación una vez que mejo ren los niveles de fibrinógeno (>100 mg/dl) y/o KPTT.
Pacientes que reciben angioplastia primaria
La anticoagulación durante la intervención coronaria percutánea (ICP) primaria para el IA MCEST, tradicionalmente ha sido realizada con HNF, en gran parte, debido a la evidencia extra polada de estudios de angioplastia electiva y de la práctica habitual. La utilización de catéteres aumenta el riesgo de formación de trombos y la anticoagulación es una estrategia que en la práctica demuestra una reducción de los mis mos (Tabla 3).
Heparina no fraccionada
No ha habido ningún ensayo controlado con placebo que evalúe la HNF en ICP primaria, pero existe una gran cantidad de experiencia con este agente, la cual valida su utilización.
Enoxaparina
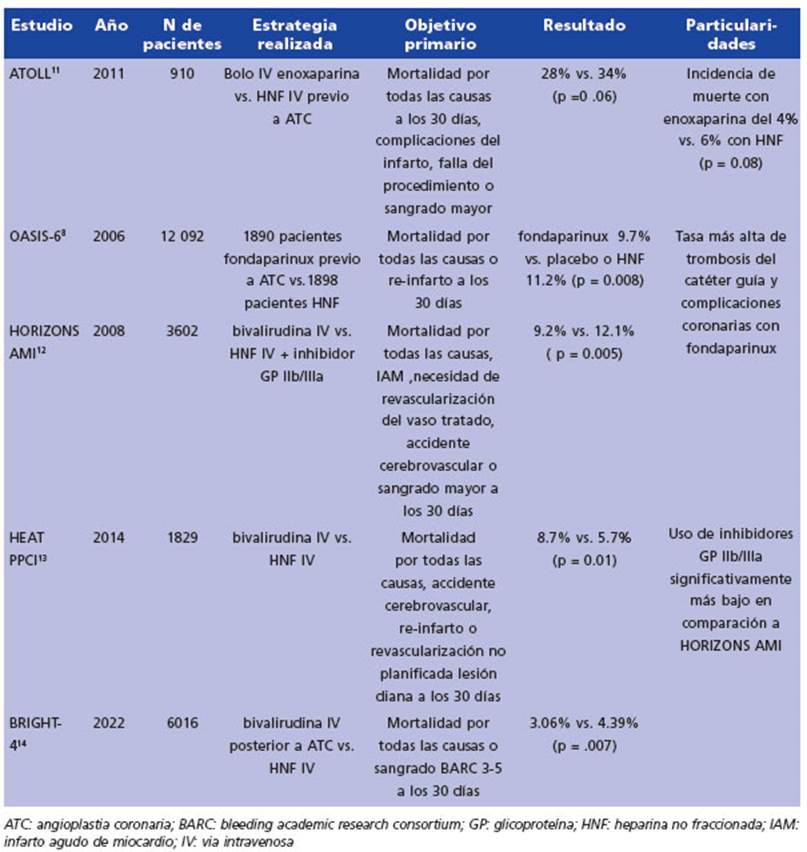
El estudio ATOLL, publicado en el año 2011, in cluyó 910 pacientes con IAMCEST tratados con ICP primaria, aleatorizados a recibir antes de la misma, un bolo IV de enoxaparina 0,5 mg/kg o HNF en infusión IV11. El punto final primario fue un compuesto de muerte a los 30 días, com plicaciones del infarto, falla del procedimiento o sangrado mayor. Este se produjo en 126 (28%) pacientes después de la anticoagulación con enoxaparina frente a 155 (34%) pacientes trata dos con HNF (RR 0.83, IC95% 0.68-1.01, p = 0.06). La incidencia de muerte fue del 4% en el gru po enoxaparina vs. 6% del grupo HNF (p = 0.08). Asimismo, no existieron diferencias en las tasas de complicación de infarto de miocardio (4% vs. 6%; p = 0.21), y en el sangrado mayor (5% frente a 5%; p = 0.79). En el grupo enoxaparina se ob servó una reducción significativa del punto final secundario principal, compuesto por: muerte, revascularización de urgencia o síndrome coro nario agudo (SCA) recurrente a 30 días (7 % fren te a 11%, RR 0.59: IC95%: 0.38-0.91, p = 0.015). Y de la misma manera, la enoxaparina fue supe rior en la reducción de los puntos finales secun darios combinados de: muerte, síndrome coro nario agudo recurrente, fallo del procedimiento o sangrado mayor (7 % frente a 11%, RR 0.59: IC95%: 0.38-091, p = 0.015), así como también del combinado de: muerte, infarto de miocardio re currente o revascularización urgente (5% frente a 8%; p = 0.04). No hubo diferencias en las tasas de sangrado.
Fondaparinux
En el estudio OASIS 6, 1898 pacientes asig nados a recibir HNF y 1890 pacientes asignados para recibir fondaparinux se sometieron a ICP primaria8. Todos los pacientes en el grupo con trol recibieron HNF durante el procedimiento (por protocolo) comparado con un 20.8% en el grupo fondaparinux. La tasa de muerte e infarto de miocardio (IAM) no difirieron significativa mente entre los 2 grupos a los 30 días (93 HNF vs 114 fondaparinux, respectivamente). Las tasas de hemorragias graves también fueron similares (9 vs. 16). Sin embargo, hubo una tasa más alta de trombosis del catéter guía (0 vs. 22; P = 0.001) y más complicaciones coronarias (oclusión agu da de la arteria coronaria, imagen angiográfica de trombo nuevo, trombo en el catéter, fenó meno de no reflow, disección o perforación; 225 contra 270; p = 0.04) en el grupo fondaparinux. Entre los 496 pacientes que recibieron HNF an tes de la ICP primaria, estas diferencias no se ob servaron, porque las tasas de muerte o reinfar to a los 30 días (9 controles vs. 8 fondaparinux), complicaciones coronarias (24 vs. 24), trombo sis de catéter (0 vs. 2), y sangrado grave (1 vs. 4) fueron similares. Aunque la experiencia total con uso combinado de HNF y fondaparinux es relativamente modesta en este ensayo, es con sistente con datos similares del estudio OASIS-5 y por este motivo se recomienda enfáticamente el uso de HNF con fondaparinux durante la ICP, para reducir el riesgo de trombosis del catéter y complicaciones relacionadas. En estos casos, se recomienda la administración de un bolo IV de HNF de 50 U/kg al momento de la cinecoro nariografia (CCG). Esta recomendación se basa también, en los hallazgos del estudio FUTURA/ OASIS 8 (Fondaparinux with Unfractionated Heparin During Revascularization in Acute Coronary Syndro mes) que comparó la utilización de dosis bajas de HNF (50 U/kg) vs. dosis estándar (85 U/kg) en pacientes con síndromes coronarios agudos sin elevación del segmento ST (SCASEST), sin obser var diferencias en las tasas de sangrado o trom bosis del catéter periprocedimiento.
Bivalirudina
Los ensayos aleatorizados previos con bivali rudina frente a HNF en pacientes con IAMCEST sometidos a una ICP primaria han informado re sultados contradictorios, probablemente debido al tratamiento con diferentes regímenes farma cológicos.
El estudio HORIZONS AMI se publicó en 2008 y tuvo como objetivo evaluar la eficacia y se guridad de la bivalirudina en comparación con la HNF en pacientes con síndromes coronarios agudos sometidos a ICP primaria12. Los puntos finales primarios del estudio incluyeron una combinación de eventos cardiovasculares mayores, como la muerte, el infarto de miocardio, accidente cerebrovascular o la necesidad de re vascularización del vaso tratado, a los 30 días de seguimiento. Los puntos finales secundarios incluyeron la tasa de sangrado mayor a los 30 días, la necesidad de transfusión sanguínea, la duración de la estancia hospitalaria y la inciden cia de trombosis del stent. Sobre un total de 3602 pacientes que se presentaron dentro de las 12 horas posteriores al inicio de los síntomas y que se sometieron a una ICP primaria, fueron alea torizados a recibir HNF más un inhibidor de la glicoproteína IIb/IIIa o a tratamiento con bivali rudina sola. La anticoagulación con bivalirudina sola, en comparación con HNF más inhibidores de la glicoproteína IIb/IIIa, resultó en una dismi nución de los eventos clínicos adversos netos a los 30 días (9.2% frente a 12.1%; HR 0.76: IC95%: 0.63-0.92; p = 0.005), debido a una menor tasa de hemorragia mayor (4.9 % frente a 8.3%; HR 0.60: IC95%: 0.46-0.77; p < 0.001). Hubo un mayor riesgo de trombosis aguda del stent dentro de las 24 horas en el grupo de bivalirudina, pero no hubo un aumento significativo a los 30 días. El tratamiento con bivalirudina sola, resultó en ta sas significativamente más bajas de muerte por causas cardíacas (1.8% frente a 2.9%; HR 0.62: IC95%: 0.40 a 0.95; p = 0.03) y muerte por todas las causas (2.1% frente a 3.1%; HR 0.66: IC95%: 0.44 a 1.00; p = 0.047) a 30 días.
El estudio HEAT PPCI se llevó a cabo entre 2012 y 2013, y los pacientes con IAMCEST so metidos a ICP primaria fueron aleatorizados a HNF (70 U/kg) o bivalirudina (bolo de 0.75 mg/ kg; infusión de 1.75 mg/kg por hora). Los pa cientes fueron seguidos durante 28 días13. El resultado primario de eficacia fue una com binación de mortalidad por todas las causas, accidente cerebrovascular, reinfarto o revascu larización no planificada de la lesión diana. El principal resultado de seguridad fue la inciden cia de hemorragia mayor BARC 3-5. El resultado primario de eficacia ocurrió en 8.7% del grupo bivalirudina y 5.7% del grupo de HNF (HR 1.52: IC95%: 1.09-2.13; p = 0.01). El resultado primario de seguridad ocurrió en 3.5% del grupo de bivalirudina y 3.1% del grupo de HNF (p = 0.59). En este estudio la tasa de utilización de inhi bidores de la glicoproteína IIb/IIIa fue del 14%, significativamente más baja que en HORIZONS. Se detectaron diferencias significativas a favor de HNF en las tasas de reinfarto (2.7% vs. 0.9%), y trombosis del stent (3.4% vs. 0.9%).
El estudio BRIGHT-414 se publicó a fines de 2022. Fue un ensayo controlado, aleatorizado, abierto, realizado en 87 centros clínicos, en 63 ciudades de China, que incluyó 6016 pacientes y que comparó una infusión durante 2-4 h de bi valirudina a dosis alta vs. HNF, luego de ICP pri maria por vía radial en pacientes con IAMCEST dentro de las 48 h posteriores al inicio de los síntomas que no habían recibido tratamiento fi brinolítico previo, anticoagulantes o inhibidores de la glicoproteína IIb/IIIa. El punto final prima rio fue un combinado de mortalidad por todas las causas o sangrado BARC 3-5 a los 30 días. En comparación con la monoterapia con HNF, la bi valirudina redujo la tasa del punto final prima rio a 30 días (4.39% en el grupo de HNF frente a 3.06% en el grupo de bivalirudina; (HR 0.69: IC95%: 0.53-0.91, p = 0.007). La mortalidad por todas las causas dentro de los 30 días se produjo en 3.92% de los pacientes asignados a HNF y en 2.96% de los pacientes asignados a bivalirudina (HR 0.75: IC95%: 0.57-0.99; p = 0.042). El sangrado tipo BARC 3-5, ocurrió en 0.80% de los pacien tes asignados a HNF y en 0.17% de los pacientes asignados a bivalirudina (HR 0.21: IC95%: 0.08- 0.54; p = 0.0014). No hubo diferencias significati vas en las tasas de reinfarto, accidente cerebro vascular o revascularización del vaso culpable a los 30 días entre ambos grupos. Dentro de los 30 días, se produjo trombosis del stent en 11 (0.37%) de los pacientes asignados a bivalirudina y en 33 (1.10%) de los pacientes asignados a HNF (p = 0.0015).
Conclusiones
- En pacientes tratados con angioplastia pri maria, la utilización de HNF parece ser segura y eficaz.
- La enoxaparina cuenta con evidencia sufi ciente para ser una opción razonable, aunque no impresiona ser superior a la HNF.
La bivalirudina mostró mayor seguridad y efi cacia que la HNF cuando se la utiliza en infusión durante 2-4 horas posteriores al procedimiento, para reducir eventos trombóticos. Debido a su alto costo, podría ser una opción para pacientes con alto riesgo hemorrágico o con trombocitope nia inducida por heparina.
En la Tabla 4 se observan las dosis recomen dadas para el tratamiento anticoagulante du rante la angioplastia primaria.
Síndrome coronario agudo sin elevación del segmento ST
En los síndromes coronarios agudos sin ele vación del segmento ST, la utilización de anti coagulantes aporta un beneficio comprobado (Tabla 5), adicional al tratamiento antiagregan te plaquetario. La elección del tipo de anticoa gulante a utilizar dependerá: de la decisión de realizar la cinecoronariografía, del momento evolutivo del cuadro (emergente, urgente o programada), y del riesgo de sangrado del paciente.
Heparina sódica
En el año 1990 el grupo RISC, publicó un análi sis de 796 hombres con angina inestable o infar to de miocardio sin onda Q, que fueron aleato rizados para recibir un tratamiento doble ciego, controlado con placebo, de aspirina oral 75 mg/ día y/o 5 días de HNF intermitente15. La aspi rina mostró reducción del riesgo de infarto de miocardio y muerte a los 5 días (HR 0.43: IC95%: 0.21-0.91), al mes (HR 0.31: IC95%: 0.18-0.53) y a los 3 meses (HR 0.36: IC95%: 0.23-0.57). La HNF no tuvo una influencia significativa en la tasa de eventos, aunque el grupo tratado con aspirina y heparina tuvo un menor número de eventos du rante los 5 días iniciales.
En el año 1994 se publicaron los resultados del estudio ATACS, donde 214 pacientes fueron alea torizados a recibir 162.5 mg/día de aspirina (109 pacientes) o una combinación de 162.5 mg/día de aspirina más HNF (105 pacientes)16,17. El punto fi nal fue un combinado de infarto de miocardio, angina recurrente y/o muerte. A los 14 días, hubo una reducción significativa en los eventos isqué micos totales en el grupo combinado versus as pirina sola (10.5% vs. 27%, p = 0.004). Un análisis de eficacia de los eventos primarios a las 12 se manas también reveló una gran reducción en los eventos isquémicos totales en el grupo combi nado vs. aspirina sola (13% vs. 25%, p = 0.06). Las complicaciones hemorrágicas fueron un poco más frecuentes con terapia combinada.
Un metaanálisis publicado en 1996 incluyó seis ensayos aleatorizados17. El riesgo relativo global de infarto de miocardio o muerte duran te el tratamiento fue de 0.67 (IC95%: 0.44-1.02) en pacientes con angina inestable tratados con aspirina más heparina en comparación con los tratados con aspirina sola. Los riesgos relativos para los criterios de valoración secundarios en pacientes tratados con aspirina más heparina en comparación con los tratados con aspirina sola fueron 0.68 (IC95%: 0.40-1.17) para el dolor isquémico recurrente; 0.82 (IC95%: 0.56-1.20) para infarto de miocardio o muerte de 2 a 12 se manas después de la aleatorización; 1.03 (IC95%: 0.74-1.43) para revascularización; y 199 (IC95%: 0.52-7.65) para hemorragia mayor.
Enoxaparina
En el estudio ESSENCE, publicado en 1997, un total de 3171 pacientes con síndrome coronaria agudo sin elevación del ST (SCASEST) fueron asignados aleatoriamente a enoxaparina 1 mg/ kg dos veces al día por vía subcutánea (SC), o a HNF intravenosa continua, durante un mínimo de 48 horas hasta un máximo de 8 días18. A los 14 días, el riesgo de presentar el criterio princi pal de valoración, compuesto de: muerte, infarto de miocardio o angina recurrente con cambios electrocardiográficos o intervención urgente, fue significativamente menor en los pacientes asig nados a enoxaparina en comparación con HNF (16.6% frente a 19.8%; OR 1.24: IC95%: 1.04-1.49; p = 0.019). A los 30 días, el riesgo del criterio de valoración compuesto de: muerte, infarto de miocardio o angina recurrente permaneció sig nificativamente más bajo en el grupo de enoxa parina en comparación con el grupo de HNF (19.8% frente a 23.3%, OR 1.23: IC95%: 1.0-1.46; p = 0.016). La incidencia a 30 días de complica ciones hemorrágicas graves fue del 6.5 % frente al 7.0% (p = no significativa).
En el estudio TIMI 11B, publicado en 1998, un total de 3910 pacientes con SCASEST fueron aleatorizados para recibir HNF IV durante ≥ 3 días, seguidos de inyecciones subcutáneas de placebo o terapia ininterrumpida de anticoagu lación con enoxaparina durante la fase aguda (bolo IV inicial de 30 mg seguido de inyecciones de 1 mg/ kg SC cada 12 horas) y fase ambulato ria (inyecciones SC cada 12 horas de 40 mg para pacientes con peso < 65 kg y 60 mg para aquellos con peso ≥ 65 kg)19. El criterio principal de va loración (muerte, infarto de miocardio o revas cularización urgente) se produjo a los 8 días en el 14.5% de los pacientes del grupo HNF y en el 12.4% de los pacientes del grupo de enoxaparina (OR 0.83: IC95%: 0.69-1.00; p = 0.048) y a los 43 días en el 19.7% del grupo HNF y el 17.3% del grupo enoxaparina (OR 0.85: IC95%: 072-1.00; P = 0.048). Durante las primeras 72 horas y tam bién durante toda la hospitalización inicial, no hubo diferencia en la tasa de hemorragia mayor. Durante la fase ambulatoria, se produjo una he morragia importante en el 1.5 % del grupo tra tado con placebo y en el 2.9% del grupo tratado con enoxaparina (p = 0.021).
Un metaanálisis que incluyó ensayos que compararon enoxaparina vs. HNF en el SCA SEST, verificó que los pacientes con enoxaparina tuvieron un beneficio marginal en el punto final combinado de muerte e infarto a 30 días (10% vs. 11%; OR 0.90: IC95%: 0.810-0.996; p = 0.043)20. Otro metaanálisis que incluyó 30 966 pacientes demostró una superioridad de la enoxaparina vs. HNF en el punto final combinado de muerte e infarto y también una menor tasa de sangrado.
En el estudio SYNERGY se reclutó un total de 10 027 pacientes de alto riesgo con SCASEST para ser tratados con una estrategia invasiva temprana21. Se aleatorizaron a enoxaparina sub cutánea o HNF intravenosa. El resultado prima rio de eficacia fue el compuesto de muerte por todas las causas o infarto de miocardio no fatal durante los primeros 30 días después de la alea torización. El resultado de seguridad primario fue hemorragia mayor o accidente cerebrovas cular. No se hallaron diferencias en el criterio principal de eficacia (14.0% en enoxaparina y en el 14.5% en HNF). Se observó más sangrado con enoxaparina, con un aumento estadísticamente significativo en sangrado TIMI mayor (9.1% fren te a 7.6%, p = 0.008).
Fondaparinux
El estudio ASPIRE fue un ensayo en el que 350 pacientes sometidos a angioplastia coronaria fueron asignados de manera aleatorizada a reci bir fondaparinux (2.5 mg o 5 mg) vs. HNF. La do sis reducida de fondaparinux se asoció a menor sangrado respecto de la HNF22.
El estudio OASIS-5 asignó al azar a más de 20 000 pacientes con SCASEST para recibir fon daparinux (2.5 mg al día) o enoxaparina (1 mg por kilogramo de peso corporal dos veces al día) evaluando un punto final primario combinado de muerte, infarto de miocardio o isquemia re fractaria a los nueve días (resultado primario) y sangrado mayor23. El número de pacientes con eventos del punto final primario fue similar en los dos grupos (5.8% para fondaparinux frente a 5.7% en el grupo HNF) satisfaciendo los criterios de no inferioridad. El tratamiento con fondapa rinux se asoció con una cantidad significativa mente menor de muertes a los 30 días (295 frente a 352, p = 0.02) y a los 180 días (574 frente a 638, p = 0.05). La tasa de sangrado mayor a los nue ve días fue más baja con fondaparinux que con enoxaparina (2.2% frente 4.1%, HR 052: IC95%: 0.44- 0.61; p< 0.001). Fondaparinux se asoció con una reducción significativa en: el número de pa cientes con sangrado fatal (7 vs. 22, p = 0.005), el número de pacientes con hemorragia que requi rió intervención quirúrgica (41 vs. 77), sangrado retroperitoneal (9 vs. 37), transfusiones (164 vs. 287), y sangrado asociado con la muerte al final del estudio (38 vs. 79) (P<0.001 para todas las comparaciones). Independientemente del tra tamiento, los pacientes que tuvieron sangrado mayor durante la hospitalización presentaron tasas significativamente más altas de muerte (13.2% vs. 2.8%), reinfarto (11.9% frente a 3.6%) o accidente cerebrovascular (3.5% a 0.7%) a los 30 días (P < 0.001).
En relación al tipo de tratamiento recibido, el 63% de los pacientes se sometió a una cineco ronariografía, y las proporciones de pacientes sometidos a intervención percutánea temprana (IPC) (39.5% en el grupo de fondaparinux y 39.5% en el grupo de enoxaparina) o cirugía de revas cularización coronaria (15.3% y 14.5%, respecti vamente) fueron similar en los dos grupos. Se observó un aumento de la tasa de formación de trombos en el catéter guía con fondaparinux (29 episodios [0.9%], frente a 8 episodios con enoxa parina [0.3%]). Las tasas de otras complicaciones en el contexto de la IPC fueron significativamen te menores con fondaparinux que con enoxapa rina (pseudoaneurismas que requirieron cierre, 1.0% vs. 1.6% [p = 0.04]; hematoma grande, 1.6% frente a 4.4% [p < 0.001]; y complicaciones invo lucrando el sitio de acceso vascular, 3.3% vs. 8.1% [p < 0.001]). La tasa de muerte, infarto de miocar dio, accidente cerebrovascular, hemorragia ma yor o cualquier complicación del procedimiento a los nueve días fue de 16.6% con fondaparinux, en comparación a 20.6% con enoxaparina (HR 0.81: IC95%: 0.73-0.90; p < 0.001).
El estudio FUTURA/OASIS 8, evaluó la seguri dad de dos diferentes dosis de HNF como terapia adyuvante durante la angioplastia de pacientes con SCASEST de alto riesgo inicialmente trata dos con fondaparinux24. Se comparó la dosis es tándar de 85 U/kg en bolo con dosis adicional para lograr un TCA de 300 a 350 segundos (para pacientes con inhibidores GpIIb/IIIa: 60 U/kg/d y TCA objetivo de 200 segundos) versus una do sis fija de 50 U/kg independientemente del uso de inhibidores y sin medición de TCA durante el procedimiento. El punto final primario fue el compuesto de sangrado mayor, sangrado menor y complicaciones en el sitio de acceso vascular; que ocurrió en el 4.7% del grupo de dosis baja vs. 5.8% del grupo de dosis estándar (OR 0.80: IC95%: 0.54-1.19; p = 0.27). Las tasas de sangrado mayor no fueron diferentes, pero las tasas de sangrado menor fueron menores en el grupo de dosis baja respecto de la dosis estándar (0.7% vs. 1.7%, OR 0.40: IC95%: 0.16-0.97; p = 0.04). El punto final se cundario de: muerte, infarto de miocardio o nue va revascularización del vaso culpable, fue del 4.5% en el grupo de dosis baja frente al 2.9% del grupo de dosis estándar (OR 1.58: IC95%: 0.98- 2.53; p = 0.06). Las tasas de trombosis del catéter fueron muy bajas (0.5% en el grupo de dosis baja y 0.1% en el grupo de dosis estándar, p = 0.15).
Los estudios de la vida real como los del re gistro escandinavo de pacientes con SCASEST que incluyó 40 616 pacientes, observaron me nores tasas de sangrado (1.1 vs. 1.8% OR 0.54: IC95%: 0.42-0.70) y menor mortalidad intrahos pitalaria (2.7 vs. 4.0%, aOR 0.75: IC95%: 0.63-0.89) en pacientes tratados con fondaparinux versus enoxaparina25.
Bivalirudina
En el ensayo REPLACE-2, la monoterapia con bivalirudina se comparó con HNF más inhibido res de la glicoproteína IIb/IIIa en pacientes con SCASEST de alto riesgo26. El criterio principal de valoración compuesto fue la incidencia a los 30 días de muerte, infarto de miocardio, nueva revascularización urgente o hemorragia mayor intrahospitalaria; el criterio de valoración com puesto secundario fue la incidencia a los 30 días de muerte, infarto de miocardio o nueva revas cularización urgente. Se administró inhibidores de la Gp IIb/IIIa al 7.2% de los pacientes del gru po de bivalirudina. A los 30 días, el criterio prin cipal de valoración compuesto se produjo en el 9.2% de los pacientes del grupo de bivalirudina frente al 10.0% de los pacientes del grupo de HNF más inhibidores Gp IIb/IIIa; p = 0.32). El criterio de valoración compuesto secundario se produjo en el 7.6% del grupo de bivalirudina frente al 7.1% de los de los grupos de HNF más inhibidores Gp IIb/ IIIa (OR 1.09: IC95%: 0.90-1.32; p = 0.40). Se cum plieron los criterios estadísticos preespecificados de no inferioridad frente a HNF más inhibidores Gp IIb/IIIa para ambos criterios de valoración. Las tasas de hemorragia mayor intrahospitalaria se redujeron significativamente con la bivalirudina (2.4% frente a 4.1%; p < 0.001).
En el estudio ACUITY, 13 819 pacientes con SCASEST de moderado a alto riesgo, se asigna ron al azar a uno de tres regímenes antitrombó ticos: HNF o enoxaparina más un inhibidor de la GP IIb/IIIa, bivalirudina más un inhibidor de la GP IIb/IIIa o bivalirudina sola27. Los puntos fi nales primarios fueron un punto final compues to de isquemia (muerte, infarto de miocardio o revascularización no planificada por isquemia), hemorragia mayor y el resultado clínico neto, definido como la combinación del compuesto de isquemia o hemorragia mayor. La bivalirudina más un inhibidor de la GP IIb/IIIa, en compara ción con la heparina más un inhibidor de la GP IIb/IIIa, se asociaron con tasas no inferiores a los 30 días del criterio de valoración compuesto de: isquemia (7.7% y 7.3%, respectivamente), hemo rragia mayor (5.3% y 5.7%) y el punto final de re sultado clínico neto (11.8% y 11.7). La bivalirudi na sola, en comparación con la heparina más un inhibidor de la GP IIb/IIIa, se asoció con una tasa no inferior del criterio de valoración compues to de isquemia (7.8 % y 7.3%, respectivamente; p = 0.32) y redujo significativamente las tasas de hemorragia mayor (3.0% frente a 5.7%; p<0.001; RR 0.53: IC95%: 0.43 a 0.65).
En la Tabla 6 se detallan las dosis recomen dadas para el tratamiento anticoagulante en síndromes coronarios agudos sin elevación del segmento ST.
Conclusiones
- En pacientes con SCASEST de alto riesgo, en donde la recomendación es una CCG dentro de las 2 h, la utilización de HNF impresiona ser la mejor estrategia, desde el punto de vista de practicidad y evidencia. La bivalirudina en infu sión continua hasta 4 h posteriores al procedi miento, podría ser una opción.
- En pacientes con CCG dentro de las 24 h, la utilización de fondaparinux parece ser eficaz, muy segura y práctica. La enoxaparina es una opción razonable, pero con mayor riesgo de san grado. Fondaparinux requiere la utilización de HNF durante el procedimiento, mientras que enoxaparina puede requerir una dosis extra de la misma de acuerdo al momento de la aplica ción de la última dosis.
- En pacientes inicialmente definidos para una estrategia conservadora o CCG más allá de las 24 h, la opción con más evidencia impresiona ser el fondaparinux durante el tiempo que dure la internación o hasta 8 días. La enoxaparina es una estrategia aceptable con mayor riesgo de hemorragias.
Manejo e importancia del sangrado Introducción e importancia del sangrado
El sangrado es el principal efecto secundario de cualquier tratamiento anticoagulante, cau sa de mayor morbilidad y mortalidad asociada al tratamiento, principal motivo de consulta a emergencias y la razón más frecuente de aban dono de este tratamiento28. Las complicaciones por sangrado luego del cateterismo cardíaco y las intervenciones coronarias están, además, asociadas con un incremento significativo del costo, la necesidad de transfusiones y la estadía hospitalaria. La efectividad de un tratamien to antitrombótico, es decir su beneficio clínico neto, depende del delicado equilibrio entre la reducción de eventos isquémicos y el aumento en el sangrado29. En la década pasada el uso de agentes anticoagulantes y antiagregantes cada vez más potentes, como los inhibidores del re ceptor GP IIb/IIIa, provocaron un aumento de la tasa de sangrados y mortalidad en la unidad co ronaria. En la cohorte de 34 146 pacientes con síndrome isquémico agudo de los estudios CURE y OASIS ocurrió sangrado mayor en el 2.3%. Sin embargo, incluso en poblaciones con comorbi lidades o con mayor edad, la tasa de sangrado puede llegar al 17%.
Los pacientes con sangrado tuvieron una mortalidad 5.37 veces mayor con respecto a los que no sangraron en los primeros 30 días (p < 0.001). Esta mayor mortalidad relacionada al sangrado, obedece a tres causas: a) el sangra do agudo puede desencadenar hipotensión ar terial y shock con aumento del riesgo de eventos isquémicos, b) la inmediata suspensión de todo el tratamiento antitrombótico, incluidos los an tiagregantes plaquetarios, expone al paciente a nuevos eventos isquémicos y c) la necesidad de transfusiones de sangre que provocan inflama ción y aumento de eventos fatales. El manejo del sangrado en pacientes con enfermedad cardio vascular comienza con su prevención.
Existe una recomendación muy fuerte res pecto de no efectuar entrecruzamiento de hepa rinas durante el tratamiento anticoagulante en los síndromes coronarios agudos y/o angioplas tias programadas ya que dicha práctica se aso cia con un mayor riesgo de sangrado y eventos trombóticos.
Estratificación del riesgo de sangrado utilizados en el síndrome coronario agudo
Todos los sangrados, independientemente de su localización y gravedad, deben manejar se evaluando riesgos y beneficios. Cualquier sangrado que en la clasificación BARC sea > 3 debe considerarse como un sangrado grave. La selección de las estrategias para disminuir el sangrado en aquellos pacientes con alto riesgo de desarrollar complicaciones hemorrágicas, es fundamental. Para esto se han desarrollado di ferentes clasificaciones de riesgo de hemorragia, a partir de registros o cohortes de estudios clíni cos en el contexto del síndrome coronario agudo (SCA). La más utilizada en nuestro medio es la generada en el registro CRUSADE que se desa rrolló a partir de una cohorte de 71 277 pacien tes y después se validó en 17 857 pacientes30. Los pacientes que presentaron bajo puntaje (< 20 puntos) tuvieron tan solo 3% de sangrado, mien tras que los que obtuvieron puntaje alto (> 50 puntos) presentaron tasas de sangrado de hasta 20%. Otro score más reciente es el ARC-HBR que clasifica a los factores de riesgo de sangrado se gún 20 criterios31,33. Existe riesgo alto de sangra do si el BARC es 3-5 o si el cálculo que estima el ARC-HBR indica una incidencia mayor del 4% al año de la angioplastia o el riesgo de hemorragia intracraneana es ≥ 1%. (> 4% de riesgo de san grado BARC > 3 al año). Hay que enfatizar que ningún score reemplazará a la evaluación clíni ca del paciente individual.
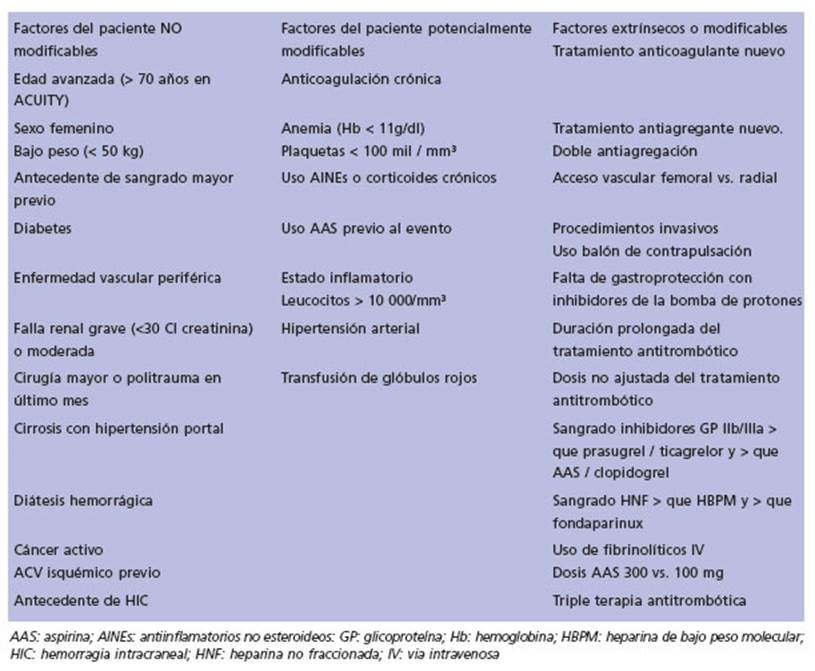
Hemos clasificado, por practicidad, a los mar cadores de riesgo de sangrado en la unidad co ronaria como factores propios del paciente que son NO modificables, factores del paciente po tencialmente modificables y factores relaciona dos al tratamiento o modificables.
En la Tabla 7 se enumeran los factores de ries go para sangrado.
Manejo del sangrado
Ante cualquier episodio de sangrado se debe evaluar el contexto clínico en el que se produce, qué consecuencias hemodinámicas le genera al paciente, la proximidad del even to coronario, la gravedad del mismo y bajo qué tratamiento antitrombótico se encuentra. Cada centro debe desarrollar su propio proto colo de manejo de sangrados que incluirá me didas generales de soporte y el uso eventual de agentes reversores o de factores prohemostá ticos, además de recomendaciones de control hemodinámico, manejo de fluidos y monitoreo de la coagulación acorde con la gravedad de la hemorragia (Fig. 1).