Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO  uBio
uBio
Compartilhar
El hornero
versão impressa ISSN 0073-3407versão On-line ISSN 1850-4884
Hornero v.20 n.1 Buenos Aires jan./ago. 2005
Estado poblacional, ecología y conservación del Petrel Gigante del Sur (Macronectes giganteus) en Argentina
Flavio Quintana 1,2,4, Adrián Schiavini 2,3 y Sofía Copello 1
1 Centro Nacional Patagónico (CONICET). Boulevard Brown 3500, U9120ACV Puerto Madryn, Chubut, Argentina.
2 Wildlife Conservation Society. 2300 Southern Boulevard, Bronx, New York, NY 10460, EEUU.
3 Centro Austral de Investigaciones Científicas (CONICET). B. Houssay 200, V9410BFD Ushuaia, Tierra del Fuego, Argentina.
4 quintana@cenpat.edu.ar
Resumen
El Petrel Gigante del Sur (Macronectes giganteus) es un ave marina pelágica con distribución circumpolar en el Hemisferio Sur y está considerado como especie Vulnerable. Es el único procellariiforme que nidifica en la costa argentina (a excepción de las Islas Malvinas). En Argentina, sus sitios de nidificación están restringidos a dos colonias en la provincia de Chubut (Isla Arce e Isla Gran Robredo) y dos colonias en Isla de los Estados (Isla Observatorio y Península López). La población reproductiva se estima en 2600 parejas, el 90% de las cuales pertenece a las colonias de Chubut. La puesta de un único huevo se inicia durante la última semana de octubre y la eclosión durante la última semana de diciembre. La independencia de los pichones ocurre hacia la segunda semana de marzo y principios de abril. La dieta está compuesta principalmente por pingüinos y cefalópodos (principalmente calamar) y por restos de mamíferos marinos, peces y decápodos. La basura constituye un componente importante de su dieta. Las áreas de alimentación durante el período reproductivo se localizan al borde del talud, en la plataforma media y en áreas costeras, con una marcada segregación sexual en el uso del espacio. Dichas áreas tienen una marcada superposición espacio-temporal con las pesquerías de langostino, calamar y merluza. El monitoreo de las poblaciones, el registro de parámetros reproductivos básicos, el conocimiento del comportamiento en el mar y la determinación de las áreas de alimentación del Petrel Gigante del Sur constituyen información prioritaria para desarrollar pautas de manejo y conservación de sus poblaciones.
Palabras clave: Argentina; Aves marinas; Conservación; Macronectes giganteus; Petrel Gigante del Sur; Plataforma continental argentina.
Abstract
Population status, ecology and conservation of the Southern Giant Petrel (Macronectes giganteus) in Argentina
The Southern Giant Petrel (Macronectes giganteus) is a pelagic seabird considered Vulnerable with a circumpolar distribution restricted to the Southern Hemisphere. It is the only representative of procellariiforms breeding at the Argentine coast (with the exception of the Malvinas Islands). In Argentina, its nesting sites are confined to two colonies in the Chubut Province (Arce Island and Gran Robredo Island) and two colonies in the Staten Island (Observatorio Island and Península López). The breeding population size is estimated in 2600 pairs, 90% belonging to the colonies in Chubut . The laying period (clutch size: one) starts in late October and the first eggs hatch during the last week of December. The fledgling period goes from late March to late April. Southern Giant Petrel's diet is composed principally by penguins and cephalopods (mainly squid), and rests of marine mammals, fish and decapods. Marine debris is also an important component of the diet. During the breeding period, feeding areas are located at the break shelf, middle shelf and coastal areas, with a clear spatial segregation between sexes. Foraging areas also overlap with fisheries targeting on shrimp, squid and hake. The survey of population numbers and basic breeding parameters, together with the knowledge of behaviour-at-sea and the determination of the foraging areas of the Southern Giant Petrel, constitute a primary tool to develop management and conservation plans for their populations.
Key words: Argentina; Conservation; Macronectes giganteus; Patagonian shelf; Seabirds; Southern Giant Petrel.
Recibido 22 julio 2004, aceptado 13 junio 2005
El Petrel Gigante del Sur (Macronectes giganteus) es la única especie documentada del grupo de los Procellariiformes que nidifica en la costa argentina, a excepción de las Islas Malvinas, en donde se reproducen otras nueve especies de este grupo (un albatros, Diomedea melanophris; un petrel, Procellaria aequinoctialis; dos priones, Pachyptila belcheri y Pachyptila turtur; dos pardelas, Puffinus griseus y Puffinus gravis; dos petreles de las tormentas, Oceanites oceanicus y Garrodia nereis; y un petrel zambullidor, Pelecanoides urinatrix) (Woods y Woods 1997). Sin embargo, hay evidencias sobre la existencia de colonias de nidificación de la Pardela Oscura (Puffinus griseus) y de petreles zambullidores (Pelecanoides spp.) en la Isla de los Estados, que hasta el momento no han sido confirmadas (A Schiavini, obs. pers.). Este trabajo trata exclusivamente sobre aspectos poblacionales, ecológicos y de conservación del Petrel Gigante del Sur en colonias de reproducción en Argentina.
El Petrel Gigante del Sur es un ave marina de características pelágicas, con distribución circumpolar en el Hemisferio Sur. Sus colonias de reproducción se extienden desde el sur de Chile y el sudeste de Argentina hasta la isla Heard en el Océano Índico y el continente antártico (Harrison 1983). La especie está ubicada dentro de la categoría Vulnerable del Libro Rojo de la Unión Internacional para la Conservación de la Naturaleza (IUCN 2004) y es considerada Amenazada por la Convención para la Conservación de Especies Migratorias (CCEM). La población reproductiva mundial del Petrel Gigante del Sur ha sido estimada en 31500 parejas (Patterson et al. en prensa) con una tendencia decreciente de, al menos, el 20% en los últimos 60 años (BirdLife International 2004). Sin embargo, estudios recientes indican que esta tendencia no es generalizable a toda su distribución geográfica. Mientras que el número de parejas reproductivas de algunas colonias se encuentra en disminución (hasta en un 50%), en otras está en aumento (Patterson et al. en prensa). Los factores responsables de esta dinámica aún no han sido determinados. Se ha sugerido que algunas actividades humanas, tales como el desarrollo de pesquerías, la destrucción del hábitat, la introducción de predadores y el disturbio causado por el hombre, podrían ser algunas causas de la variación en el tamaño poblacional de las distintas colonias (Croxall 1998).
A diferencia de otros sitios reproductivos de la especie, las colonias de Patagonia (ver Distribución y Abundancia) están ubicadas en aguas oceánicas dentro de una plataforma continental de características excepcionales en cuanto a su extensión y productividad (Croxall y Wood 2002). La plataforma continental argentina es una planicie submarina poco profunda (menos de 100 m en la mayor parte de su extensión) que se encuentra entre las más grandes del mundo (106 km2). Sus aguas son templadas (6-18 °C) y están bajo la influencia de características oceanográficas persistentes como resultado del encuentro de la corriente fría de Malvinas y la corriente cálida de Brasil y de áreas de productividad más efímeras (e.g., frentes de marea, "eddies") que favorecen el reciclado de nutrientes tanto en zonas costeras como lejos de la costa (Acha et al. 2004). Las características oceanográficas de este ecosistema marino favorecen la producción de zooplancton y el desarrollo de poblaciones de peces y calamares que, a su vez, sustentan una abundante y rica diversidad de aves y mamíferos marinos (Croxall y Wood 2002). Las principales actividades económicas que tienen lugar sobre la plataforma son la pesca y la extracción de petróleo. La flota pesquera que opera en estas aguas alcanza unos 750 barcos que capturan más de un millón de toneladas de peces por año (Bezzi et al. 2000). La plataforma continental argentina es ampliamente utilizada como área de alimentación y migración por varias especies de aves y mamíferos marinos que se reproducen tanto en la región patagónica como en áreas distantes, como las islas antárticas y subantárticas, Nueva Zelanda y Chile (Favero y Silva 2005).
Distribución y abundancia
En la costa patagónica de Argentina (a excepción de las Islas Malvinas), el Petrel Gigante del Sur se reproduce en unos pocos sitios (Fig. 1, Tabla 1): en dos colonias ubicadas en el norte de la Patagonia (Isla Arce e Isla Gran Robredo, Chubut) y, al menos, en otras dos colonias conocidas en Isla de los Estados (Península López) y en Isla Observatorio (Schiavini et al. 1998, Yorio et al. 1998). De acuerdo a censos realizados en 1995, la población reproductiva del norte de la Patagonia es de 2310 parejas (Yorio et al. 1998). Por su parte, la colonia de Isla Observatorio no superaría los 200 nidos (Schiavini et al. 1994, 1998), mientras que la colonia localizada en Península López no excedería las 30 parejas (Imshaug 1972). De acuerdo a estas cifras, las colonias de Chubut albergan cerca del 90% de la población reproductiva de Petrel Gigante del Sur en Argentina (Tabla 1). Censos previos realizados en las temporadas 1982 (Humphrey y Livesey 1983), 1989 (Punta y Saravia 1991), 1990 (Yorio y Harris 1997), 1995 (Yorio et al. 1998) y 1996-1998 (Punta et al., datos no publicados) sugieren que al menos las dos colonias del norte de la Patagonia (Isla Gran Robredo e Isla Arce) han incrementado su población reproductiva en los últimos años. Lamentablemente, no existen registros previos para estas colonias que permitan precisar la magnitud y antigüedad de dicha tendencia a partir de series de tiempo lo suficientemente prolongadas. Tampoco existe información previa a 1994 sobre los tamaños poblacionales de las colonias de Isla de los Estados (unas pocas referencias anecdóticas aparecen en Schiavini et al. 1999). Durante la temporada 2003-2004 se estimó un total de 500 nidos activos en la colonia de Isla Observatorio (Copello et al., datos no publicados). Sin embargo, dichas estimaciones no son comparables a los valores registrados por Schiavini y colaboradores en 1995 (Schiavini et al. 1998), ya que en esa oportunidad se censó sólo parcialmente la superficie de la isla.
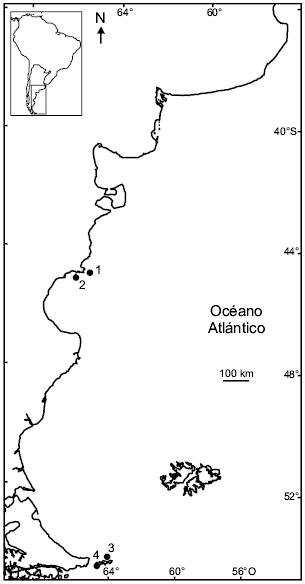
Figura 1. Ubicación de las cuatro colonias de nidificación conocidas de Petrel Gigante del Sur (Macronectes giganteus) a lo largo de la costa patagónica argentina. 1: Isla Arce; 2: Isla Gran Robredo; 3: Isla Observatorio; 4: Península López.
Tabla 1. Ubicación y tamaño (en parejas reproductivas) de las cuatro colonias de nidificación conocidas de Petrel Gigante del Sur (Macronectes giganteus) a lo largo de la costa patagónica argentina. Se presentan los valores correspondientes a los últimos censos terrestres disponibles, excepto para la colonia de Isla Gran Robredo (censo aéreo). Se indica también la fuente original de información (la referencia bibliográfica o los autores de la observación).

Biología reproductiva
Dado el estado de conservación del Petrel Gigante del Sur (ver más arriba), el conocimiento de aspectos básicos de su biología (e.g., dieta, requerimientos de hábitat, biología reproductiva) resulta esencial a la hora de implementar medidas de conservación y manejo. La información existente sobre su biología reproductiva es escasa y hasta hace muy poco tiempo se encontraba limitada exclusivamente a unas pocas colonias subantárticas (Hunter 1984, 1987, Voisin 1988, Cooper et al. 2001, Punta, datos no publicados).
Hábitat de reproducción
Estudios preliminares muestran que a lo largo de la costa patagónica, el Petrel Gigante del Sur nidifica en colonias con características ambientales muy diferentes (Copello et al., datos no publicados). Las colonias del norte de la Patagonia se encuentran sobre sustratos rocosos prácticamente libres de vegetación, a una altura promedio de 13 msnm (rango: 5-19 msnm; Copello y Quintana, datos no publicados). Los nidos de Isla Observatorio, en cambio, se encuentran sobre turbales graminosos donde se desarrollan comunidades de plantas con predominio de junquillo y murtilla (Empetrum rubrum) (Schiavini et al. 1999). En las islas del norte de la Patagonia, la totalidad de los nidos forman una colonia claramente definida en el sector norte y oeste de las islas Arce y Gran Robredo, respectivamente (Yorio et al. 1998), con una densidad promedio de 9 nidos/100 m2 (rango: 2-25 nidos/100 m2; Copello et al., datos no publicados). En Isla Observatorio la distribución de los nidos es mucho más laxa y la colonia está constituida por más de 70 grupos de nidos (tamaño promedio de grupo: 5.6; rango: 2-22) distribuidos por toda la superficie de la isla (Copello et al., datos no publicados). La altura máxima de la isla es de 53 msnm (Carta Náutica H471, Servicio de Hidrografía Naval).
Ciclo reproductivo y parámetros reproductivos básicos
En las colonias del norte de la Patagonia, la puesta se inicia durante la última semana de octubre, es relativamente sincrónica y los primeros huevos comienzan a eclosionar durante la última semana de diciembre (Copello y Quintana, datos no publicados). Durante dos temporadas consecutivas, la totalidad de los nidos estudiados (n = 163) presentó un tamaño de puesta de un huevo (Copello y Quintana, datos no publicados). Los adultos permanecen en el nido con el pichón durante casi dos semanas, momento a partir del cual los pichones comienzan a quedar solos en la colonia mientras los padres se alimentan en el mar. En la colonia de Isla Arce, el porcentaje de pichones independizados en función del total de huevos eclosionados (éxito de emancipación) se estimó en 93% y 88% para las temporadas 2001-2002 y 2002-2003, respectivamente, y el porcentaje de supervivencia a partir de los 45 días de vida fue de 100% (Copello y Quintana, datos no publicados). El éxito reproductivo total (porcentaje de pichones independizados en función del número de huevos puestos) en las colonias del norte de la Patagonia varía considerablemente entre años (54-100%; Punta et al., datos no publicados) y, en promedio, resulta superior al observado en colonias subantárticas tales como Isla Marion (Cooper et al. 2001) e Islas Georgias del Sur (Hunter 1984). En la Patagonia, la independencia de los pichones ocurre hacia la segunda semana de marzo y principios de abril, cuando alcanzan entre 86-125 días de vida (n = 21 pichones). La proporción de sexos de pichones independizados en las colonias de Isla Arce e Isla Gran Robredo es de 1:1 (Copello y Quintana, datos no publicados).
Lamentablemente, hasta el momento no existe información del ciclo y los parámetros reproductivos para las colonias de Isla de los Estados e Isla Observatorio, aunque observaciones preliminares sugieren una gran semejanza con la cronología y los parámetros registrados en las colonias del norte de la Patagonia (Copello et al., datos no publicados).
Morfometría externa y crecimiento de pichones
El Petrel Gigante del Sur es una especie sexualmente dimórfica, siendo los machos hasta un 20% más pesados que las hembras (Voisin y Bester 1981, Hunter 1987, González-Solís et al. 2000b). Las medidas externas del cuerpo de individuos reproductivos provenientes de Isla Arce e Isla Gran Robredo confirman esta característica. Copello y Quintana (datos no publicados) encontraron que, para esta latitud, los machos son más grandes que las hembras respecto a las siguientes variables morfométricas: longitud del pico (12%), ancho del pico (11%), longitud del tarso (11%), longitud del ala (4%) y peso (25%). A su vez, los petreles de las colonias patagónicas difieren de los de las colonias antárticas y subantárticas, presentando, en promedio, una coloración del plumaje más oscura y un tamaño menor. Sin embargo, las características externas del plumaje y el tamaño observados en las poblaciones de la Patagonia son similares a las descriptas en colonias ubicadas dentro del mismo rango de latitud: Islas Malvinas (52°00'S, 59°30'O) e Islas Gough (40°20'S, 9°54'O) (Devillers y Terschuren 1980, Voisin y Bester 1981, Voisin 1982) y podrían constituir una unidad taxonómica distinta (Voisin y Bester 1981).
Al momento de la independencia, los pichones alcanzan las medidas de los adultos. Esto posibilita la identificación de sexos a través de una función discriminante que, al igual que en los adultos, involucra exclusivamente a la longitud del pico y clasifica correctamente más del 90% de los individuos (Copello y Quintana, datos no publicados). Al igual que en otras especies de albatros y petreles, el crecimiento de los pichones del Petrel Gigante del Sur en el norte de la Patagonia es lento. Los valores asintóticos de las variables morfométricas estudiadas (ver arriba) se alcanzan después de los 70 días de vida y la discriminación de sexos a través de medidas morfométricas (e.g., longitud de pico y tarso) es posible a partir de la segunda semana de vida (Copello y Quintana, datos no publicados).
Ecología alimentaria
Dieta
El Petrel Gigante del Sur es considerado como una especie predadora y carroñera en todos los mares australes (Hunter 1983, 1985, Hunter y Brooke 1992, Ridoux 1994). En aguas de la plataforma continental argentina y durante el período de crianza de pichones se alimenta principalmente de restos de Pingüino de Magallanes (Spheniscus magellanicus), de cefalópodos (principalmente calamar, Illex argentinus) y, en menor proporción, de restos de mamíferos marinos (principalmente del lobo marino de un pelo, Otaria flavescens), peces y decápodos (langostino patagónico, Pleoticus muelleri) (Copello y Quintana, datos no publicados). Fueron encontrados ítems de origen humano (tales como plástico, madera y aluminio) en más del 50% de las muestras de dieta analizadas (Copello y Quintana 2003).
Comportamiento y áreas de alimentación
Durante los períodos de incubación y crianza de pichones, machos y hembras alternan viajes de alimentación al mar con períodos de permanencia en tierra para el cuidado de huevos y pichones. Los períodos de alimentación en el mar pueden ser prolongados (aproximadamente 7 días), en especial durante la etapa de incubación. La distancia máxima estimada de los viajes de alimentación de individuos de las colonias del norte de la Patagonia fue de 513 km; las aves fueron capaces de volar más de 400 km en un día. En los adultos reproductivos de Isla Gran Robredo, la distancia promedio recorrida por viaje de alimentación se estimó en 1674 km y la distancia máxima registrada fue de 2540 km (Quintana y Dell'Arciprete 2002).
El Petrel Gigante del Sur es considerado como una especie principalmente pelágica en cuanto al rango de sus viajes de alimentación. Sin embargo, datos recientes de localización de áreas de alimentación por medio de tecnología satelital muestran que, durante la etapa reproductiva, los individuos adultos utilizan tanto aguas pelágicas como sectores cercanos a la costa (González-Solís et al. 2000a, 2000b, Patterson y Fraser 2000, Quintana y Dell'Arciprete 2002). Datos de movimientos en el mar de 16 aves adultas equipadas con transmisores satelitales provenientes de las colonias del norte y del sur de la Patagonia muestran una clara segregación sexual en el uso de las áreas de alimentación. Las hembras son fundamentalmente pelágicas, mientras que los machos se alimentan principalmente en sectores costeros próximos a apostaderos de lobos marinos y colonias de pingüinos (Quintana et al., datos no publicados). Las áreas de mayor importancia, en términos de frecuencia de uso, de los adultos reproductivos provenientes de Isla Arce e Isla Gran Robredo fueron: (1) la plataforma media (aproximadamente a 200 km de la costa, al E-SE de la colonia), (2) el borde del talud, entre los 43-51°S (aproximadamente a 400 km de la costa), y (3) las áreas costeras al norte y al sur de la colonia (Quintana y Dell'Arciprete 2002, Quintana et al., datos no publicados).
Las áreas de alimentación del Petrel Gigante del Sur en la plataforma continental argentina parecen estar asociadas a sectores de alta productividad primaria (frentes térmicos y surgencias) en áreas costeras y en el borde del talud (Quintana et al., datos no publicados). Los machos, en particular, muestran una clara asociación espacial con áreas de alta concentración de pingüinos y lobos marinos (Quintana et al., datos no publicados). El uso de áreas específicas de la plataforma continental por parte de las hembras, con una marcada superposición espacio-temporal con las pesquerías de langostino, calamar y merluza común, resulta de particular interés debido al alto potencial de interacción entre las aves y dichas pesquerías (Quintana et al., datos no publicados).
Salud y parámetros hematológicos
Estudios recientes muestran que la población reproductiva de Petrel Gigante del Sur del norte de la Patagonia ha estado expuesta a un bajo número de enfermedades infecciosas que comúnmente se encuentran en otras aves marinas (Uhart et al. 2003). En estas colonias sólo se encontró evidencia serológica positiva para 2 (adenovirus aviar y Salmonella pullorum) de los 13 agentes infecciosos inspeccionados (Uhart et al. 2003). Los valores hematológicos y bioquímicos del plasma de esta especie han sido descriptos en Uhart et al. (2003).
Estado de conservación e interacción con actividades humanas
El Petrel Gigante del Sur está considerado como especie Vulnerable (IUCN) y Amenazada (CCEM) (ver más arriba). Estudios recientes indican que la población reproductiva de esta especie está disminuyendo en la mayoría de las colonias comprendidas en toda su distribución geográfica (Patterson et al. en prensa). Aunque los factores responsables no han sido aún determinados con precisión, algunas actividades humanas, tales como el desarrollo de las pesquerías comerciales, parecen jugar un papel importante en la disminución del tamaño poblacional en estas colonias. En algunas áreas de los océanos australes, la captura incidental en flotas pesqueras es mencionada como una de las causas que ejercen un efecto sostenido sobre las poblaciones y como la responsable de las tendencias poblacionales observadas para especies de albatros y de petreles gigantes (Nel et al. 2002). La presencia de flotas pesqueras comerciales parece jugar un papel importante en la disminución de la tasa de supervivencia de juveniles de petreles gigantes durante la dispersión en los océanos australes (Jouventin y Weimerskirch 1991, Patterson y Hunter 1998). Además de estos factores, los cambios poblacionales observados en algunas colonias podrían estar asociados a variaciones en la disponibilidad de carcasas de lobos y elefantes marinos en las playas (Woehler 1991, Briggs y Humpidge, datos no publicados) y a cambios en los patrones espacio-temporales de las áreas de surgencias y en la distribución de alimento (cefalópodos, crustáceos y peces). Sin embargo, la relación entre las características oceanográficas y la distribución y abundancia de especies presa del Petrel Gigante del Sur ha sido escasamente estudiada (ver González et al. 1997, Brunetti et al. 1998, Waluda et al. 2001). Con un amplio rango de áreas de alimentación en aguas oceánicas, el Petrel Gigante del Sur puede estar expuesto a amenazas distantes, tales como los residuos de pesticidas y otros contaminantes acumulados en las presas y la carroña (González-Solís et al. 2002).
La interacción de varias especies de aves marinas con la actividad pesquera es intensa y puede jugar un papel importante en la estructuración de sus poblaciones. Entre los efectos causados por esta actividad pueden mencionarse: (1) aumento en la mortalidad de adultos y juveniles como resultado de la captura incidental en redes de pesca y palangre (Brothers et al. 1999, Tasker et al. 2000, Furness 2003), (2) aumento de la población por utilización del descarte pesquero como fuente alternativa de alimento (Garthe et al. 1999, Oro 1999, Furness 2003), (3) deterioro ambiental por reducción de la abundancia de presas (Croxall y Wace 1992), y (4) contaminación del ambiente por plásticos, químicos y metales pesados (Sievert y Sileo 1993, Auman et al. 1997, 1998). Si bien la relación entre las pesquerías y el Petrel Gigante del Sur no ha sido aún analizada profundamente, estudios recientes muestran algún grado de asociación de esta especie con la actividad pesquera. De hecho, en la plataforma continental argentina existe una marcada superposición espacial entre sus áreas de alimentación y las zonas de operación de distintas pesquerías (Quintana et al., datos no publicados). Además, el Petrel Gigante del Sur ha sido frecuentemente observado aprovechando el descarte de los buques pesqueros a lo largo de toda su distribución geográfica (Johnstone 1974) y ha sido registrado en asociación con barcos arrastreros y palangreros en distintos sectores del Mar Argentino (Thompson 1992, Yorio y Caille 1999, González Zevallos y Yorio en prensa, Copello et al., datos no publicados), incluso en áreas tan alejadas como la zona del talud en las 200 millas (N García y N Brunetti, com. pers.). También ha sido reportado como víctima de capturas incidentales en palangres que operan sobre bacalao de profundidad (Dissostichus eleginoides) y abadejo (Genypterus blacodes) (Moreno et al. 1996, Favero et al. 2003, Gandini y Frere, datos no publicados) y en redes de arrastre (Schiavini et al. 1999).
Como se mencionó anteriormente (ver Distribución y abundancia), las colonias del norte de la Patagonia, en la provincia de Chubut, representan casi el 90% de la población reproductiva de la especie en Argentina. A pesar de su importancia, dichas colonias no cuentan en la actualidad con protección legal. Dada la alta sensibilidad del Petrel Gigante del Sur a la perturbación humana (Warham 1990, 1996, Patterson et al. en prensa, Punta y Yorio, datos no publicados), resulta necesario contar con legislación y medidas de control que permitan minimizar la perturbación durante visitas científicas o recreativas a estas colonias.
Aspectos prioritarios de investigación y lineamientos de manejo y conservación
Debido a sus hábitos alimentarios y a sus características pelágicas (ver Ecología alimentaria), es posible pronosticar un alto grado de asociación entre el Petrel Gigante del Sur y las distintas flotas pesqueras en toda la plataforma continental argentina y áreas adyacentes. Por este motivo, tanto el conocimiento de su comportamiento en el mar como la determinación de sus áreas de alimentación constituyen información prioritaria para el desarrollo de pautas de manejo y conservación de sus poblaciones, además de brindar datos hasta hoy desconocidos sobre su biología y su ecología. La información disponible hasta el momento proviene del uso de telemetría satelital en solo 16 adultos reproductivos de tres colonias de la costa patagónica. Por este motivo, resulta indispensable obtener más información sobre el comportamiento y movimientos en el mar de esta especie, ampliando el número de animales estudiados por telemetría satelital, incorporando individuos de colonias aún no estudiadas (e.g., Islas Malvinas) y registrando los movimientos en el mar tanto de los juveniles como de los adultos durante la etapa no reproductiva.
Aunque durante los últimos años se ha puesto particular atención al monitoreo de los tamaños poblacionales, especialmente en las colonias del norte de la Patagonia, aún no se cuenta con series de tiempo lo suficientemente prolongadas como para estimar tendencias poblacionales. Además, los resultados obtenidos no son fácilmente comparables, debido a las diferencias en los métodos de conteo utilizados. De esta forma, es tan necesario mantener la continuidad de los censos poblacionales a largo plazo en las diferentes colonias como estandarizar las técnicas utilizadas. Para las colonias del norte de la Patagonia, por ejemplo, los censos aéreos parecen ser adecuados para una correcta estimación del número de parejas reproductivas. Sin embargo, aspectos tales como el momento de la temporada reproductiva y la hora del día en la que se realizan los vuelos pueden influenciar el número de aves observado en las colonias y proporcionar estimaciones erróneas del número de parejas reproductivas. En este sentido, para una correcta estimación de los tamaños poblacionales es necesario realizar conteos desde tierra simultáneamente con los censos aéreos y determinar factores de corrección para cada localidad de reproducción.
La conservación de ecosistemas marinos extensos como la plataforma continental argentina requiere de modelos conceptuales capaces de explicar su funcionamiento, incorporando componentes físicos y biológicos y sus interacciones a escala de paisaje. En este sentido, la aplicación de enfoques tales como el de las llamadas "especies paisaje" ("Landscape/Seascape Species Approach") parece ser apropiada para la concreción de estos objetivos (ver Sanderson et al. 2002, Coppolillo et al. 2003, Redford et al. 2003). Las "especies paisaje" son aquellas que, en función de sus características biológicas, abarcan una gran parte del ecosistema extenso a conservar (Lambeck 1997, Noss 2000). Estas especies utilizan extensas áreas explotando diferentes ambientes, son claves en la estructuración del ecosistema y resultan vulnerables a las actividades humanas debido a sus requerimientos de tiempo y espacio (Sanderson et al. 2002). Los grandes albatros y petreles, como el Petrel Gigante del Sur, constituyen ejemplos de "especies paisaje" en el ecosistema marino del Atlántico Sudoccidental. El enfoque sobre la conservación de estas especies provee una forma práctica y efectiva para (1) determinar amenazas existentes y definir las acciones de conservación apropiadas, (2) establecer los efectos de dichas acciones, y (3) conservar la estructura, función y escala apropiada del paisaje. De esta forma, el enfoque de "especies paisaje" conduce a la conservación de la propia especie, de los paisajes de los cuales ella depende y de las otras especies que forman parte del ecosistema o paisaje (Caro y O'Doherty 1999).
El Petrel Gigante del Sur es una de las "especies paisaje" cuyo estudio y conservación contribuyen a la conservación de un gran ecosistema oceánico como es la plataforma continental argentina. Sin embargo, hasta hace unos pocos años los aspectos básicos de su biología y ecología permanecían prácticamente desconocidos en Argentina. Aún hoy los datos a largo plazo del tamaño poblacional de las colonias son insuficientes, tanto a escala regional como global, y la estructura genética de sus poblaciones es totalmente desconocida. Ambos aspectos son clave para su conservación y manejo.
Agradecimientos. Queremos dedicar este trabajo y agradecer en forma especial a todo el personal de la Armada Argentina que durante enero de 2004 compartió con nosotros el trabajo de campo en Isla Observatorio. Su contribución a este trabajo probablemente sea desconocida para ellos. Sin embargo, mientras reparaban las viejas y abandonadas instalaciones del faro nos ayudaron a comprender un poco más sobre la biología y la ecología del Petrel Gigante del Sur en esas latitudes. Agradecemos al Centro Nacional Patagónico y al Centro Austral de Investigaciones Científicas por el apoyo institucional durante el desarrollo de las tareas de campo, análisis de datos y elaboración de este trabajo. De la misma forma, a todas las personas que a lo largo de los años han participado en el trabajo de campo y el análisis de datos. La información aquí presentada proviene fundamentalmente del desarrollo de proyectos de investigación y conservación que contaron con el apoyo de Wildlife Conservation Society, CONICET, Agencia Nacional de Promoción Científica y Tecnológica y Ecocentro Puerto Madryn.
Bibliografía Citada
Acha EM, Mianzan H, Guerrero R, Favero M y Bava J (2004) Marine fronts at the continental shelves of austral South America: physical and ecological processes. Journal of Marine Systems 44:83-105 [ Links ]
Auman HJ, Ludwig JP, Giesy JP y Colborn T (1998) Plastic ingestion by Laysan Albatross chicks on Sand Island, Midway Atoll, in 1994 and 1995. Pp. 239-244 en: Robertson G y Gales R (eds) Albatross biology and conservation. Surrey Beatty and Sons, Chipping Norton [ Links ]
Auman HJ, Ludwig JP, Summer CL, Verbrugge DA, Froese KL, Colborn T y Giesy JP (1997) PCBs, DDE, DDT, and TCDD-EQ in two species of albatross on Sand Island, Midway Atoll, North Pacific Ocean. Environmental Toxicology and Chemistry 16:498-504 [ Links ]
Bezzi S, Akselman R y Boschi E (2000) Síntesis del estado de las pesquerías marítimas argentinas y de la Cuenca del Plata. Años 1997-1998, con actualización del 1999. SAGPyA, INIDEP, Mar del Plata [ Links ]
BirdLife International (2004) Threatened birds of the world 2004. BirdLife International, Cambridge [ Links ]
Brothers NP, Cooper J y Løkkeborg S (1999) The incidental catch of seabirds by longline fisheries: worldwide review and technical guidelines for mitigation. Food and Agriculture Organization of the United Nations, Roma [ Links ]
Brunetti NE, Elena B, Rossi GR, Ivanovic ML, Aubone A, Guerrero R y Benavides H (1998) Summer distribution, abundance and population structure of Illex argentinus on the Argentine shelf in relation to environmental features. South African Journal of Marine Science 20:175-186 [ Links ]
Caro TM y O'Doherty G (1999) On the use of surrogate species in conservation biology. Conservation Biology 13:805-814 [ Links ]
Cooper J, Brooke MDL, Burger AE, Crawford RJM, Hunter S y Williams T (2001) Aspects of the breeding biology of the Northern Giant Petrel (Macronectes halli) and the Southern Giant Petrel (M. giganteus) at sub-antarctic Marion Island. International Journal of Ornithology 4:53-68 [ Links ]
Copello S y Quintana F (2003) Marine debris ingestion by Southern Giant Petrels and its potential relationships with fisheries in the Southern Atlantic Ocean. Marine Pollution Bulletin 46:1513-1515 [ Links ]
Coppolillo PB, Gomez H, Maisels F y Wallace R (2003) Selection criteria for suites of landscape species as a basis for site-based conservation. Biological Conservation 115:419-430 [ Links ]
Croxall JP (1998) Research and conservation: a future for albatrosses? Pp. 267-288 en: Robertson G y Gales R (eds) Albatross biology and conservation. Surrey Beatty and Sons, Chipping Norton [ Links ]
Croxall JP y Wace N (1995) Interactions between marine and terrestrial ecosystems. Pp. 115-120 en: Dingwall PR (ed) Progress in conservation of the subantarctic islands. World Conservation Union, Gland [ Links ]
Croxall JP y Wood AG (2002) The importance of the Patagonian shelf for top predator species breeding at South Georgia. Aquatic Conservation: Marine and Freshwater Ecosystems 12:101-118 [ Links ]
Devillers P y Terschuren JA (1980) Les petrel geants (Macronectes) des Iles Falklands et du Sud de l'Amerique du Sud. Gerfaut 70:447-454 [ Links ]
Favero M, Khatchikian CE, Arias A, Silva Rodríguez MP, Cañete G y Mariano-Jelicich R (2003) Estimates of seabird by-catch along the Patagonian Shelf by Argentine longline fishing vessels, 1999-2001. Bird Conservation International 13:273-281 [ Links ]
Favero M y Silva Rodríguez MP (2005) Estado actual y conservación de aves pelágicas que utilizan la plataforma continental argentina como área de alimentación. Hornero 20:95-110 [ Links ]
Furness RW (2003) Impacts of fisheries on seabird communities. Scientia Marina 67:33-45 [ Links ]
Garthe S, Walter U, Tasker ML, Becker PH, Chapdelaine G y Furness RW (1999) Evaluation of the role of discards in supporting bird populations and their effects on the species composition of seabirds in the North Sea. Pp. 29-41 en: Diets of seabirds and consequences of change in food supply. Cooperative Research Report 232, ICES, Copenhague [ Links ]
González AF, Trathan PN, Yau C y Rodhouse PG (1997) Interactions between oceanography, ecology and fishery biology of the ommastrephid squid Martialia hyadesi in the South Atlantic. Marine Ecology Progress Series 152:205-215 [ Links ]
González-Solís J, Croxall JP y Wood AG (2000a) Foraging partitioning between giant petrels Macronectes spp. and its relationship with breeding population changes at Bird Island, South Georgia. Marine Ecology Progress Series 204:279-288 [ Links ]
González-Solís J, Croxall JP y Wood AG (2000b) Sexual dimorphism and sexual segregation in foraging strategies of northern giant petrels, Macronectes halli, during incubation. Oikos 90:390-398 [ Links ]
González-Solís J, Sanpera C y Ruiz X (2002) Metals and selenium as bioindicators of geographic and thropic segregation in giant petrels Macronectes spp. Marine Ecology Progress Series 244:257-264 [ Links ]
González Zeballos D y Yorio P (en prensa) Seabird use of waste and incidental capture at the Argentine hake trawl fishery in Golfo San Jorge Argentina. Marine Ecology Progress Series [ Links ]
Harrison P (1983) Seabirds: an identification guide. Croom-Helm, Beckenham [ Links ]
Humphrey PS y Livesey BC (1983) Giant petrels (Macronectes giganteus) nesting in Chubut, Argentina. Gerfaut 73:3-8 [ Links ]
Hunter S (1983) The food and feeding ecology of the giant petrels Macronectes halli and M. giganteus at South Georgia. Journal of Zoology 200:521-538 [ Links ]
Hunter S (1984) Breeding biology and population dynamics of giant petrel Macronectes at South Georgia (Aves: Procellariiformes). Journal of Zoology 203:441-460 [ Links ]
Hunter S (1985) The role of giant petrels in the Southern Ocean ecosystem. Pp. 534-542 en: Siegfried WR, Condy PR y Laws RM (eds) Antarctic nutrient cycles and food webs. Springer-Verlag, Berlin [ Links ]
Hunter S (1987) Species and sexual isolating mechanisms in sibling species of giant petrel Macronectes. Polar Biology 7:295-301 [ Links ]
Hunter S y Brooke MDL (1992) The diet of giant petrels Macronectes spp. at Marion Island, Southern Indian Ocean. Colonial Waterbirds 15:56-65 [ Links ]
Imshaug HA (1972) R/V Hero cruise 71-5 to Isla de los Estados (Staten Island). Antarctic Journal of the United States 7:42-44 [ Links ]
IUCN (2004) 2004 IUCN Red list of threatened species. World Conservation Union, Cambridge (URL: http://www.iucnredlist.org/) [ Links ]
Johnstone GW (1974) Field characters and behaviour at sea of Giant Petrels in relation to their oceanic distribution. Emu 74:209-218 [ Links ]
Jouventin P y Weimerskirch H (1991) Changes in the population size and demography of southern seabirds: management implications. Pp. 297-314 en: Perris CM, Lebreton JD y Hirons GJM (eds) Bird population studies: their relevance to conservation and management. Oxford University Press, Oxford [ Links ]
Lambeck RJ (1997) Focal species: a multi-species umbrella for nature conservation. Conservation Biology 11:849-856 [ Links ]
Moreno CA, Rubilar PS, Marschoff E y Benzaquen L (1996) Factors affecting the incidental mortality of seabirds in the Dissostichus eleginoides fishery in the Southwest Atlantic (subarea 48.3, 1995 season). CCAMLR Science 3:70-91 [ Links ]
Nel DC, Ryan PG, Crawford RJM, Cooper J y Huyser OAW (2002) Population trends of albatrosses and petrels at sub-Antarctic Marion Island. Polar Biology 25:81-89 [ Links ]
Noss RF (2000) Landscape species as conservation tools. Wildlife Conservation Society, Nueva York [ Links ]
Oro D (1999) Trawler discards: a threat or a resource for opportunistic seabirds? Pp. 717-730 en: Adams NJ y Slotow RH (eds) 22nd International Ornithology Congress. BirdLife South Africa, Johannesburgo [ Links ]
Patterson DL y Fraser W (2000) Foraging movements of Southern Giant Petrels Macronectes giganteus on the Antarctic Peninsula: preliminary findings of a satellite-tracking study during the breeding season. Marine Ornithology 28:142 [ Links ]
Patterson DL y Hunter S (1998) International Giant Petrel Banding Project. Interim Report. Bird Biology Subcommittee, Scientific Commitee on Antarctic Research, Cambridge [ Links ]
Patterson DL, Woehler EJ, Croxall JP, Cooper J, Poncet S y Fraser WR (en prensa) Breeding distribution and population status of the northern giant petrel Macronectes halli and the southern giant petrel M. giganteus. Marine Ornithology [ Links ]
Punta G y Saravia J (1991) A newly discovered colony of sourthern giant petrels Macronectes giganteus on isla Gran Robredo, Chubut Province, Argentina. Marine Ornithology 19:131-133 [ Links ]
Quintana F y Dell'Arciprete P (2002) Foraging grounds of southern giant petrels (Macronectes giganteus) on the Patagonian shelf. Polar Biology 25:159-161 [ Links ]
Redford KH, Coppolillo P, Sanderson E, Da Fonseca GAB, Dinerstein E, Groves C, Mace G, Maginnis S, Mittermeier RA, Noss R, Olson D, Robinson J, Vedder A y Wright M (2003) Mapping the conservation landscape. Conservation Biology 17:116-131 [ Links ]
Ridoux V (1994) The diets and dietary segregation of seabirds at the subantarctic Crozet Islands. Marine Ornithology 22:1-192 [ Links ]
Sanderson EW, Redford KH, Vedder A, Coppolillo PB y Ward SE (2002) A conceptual model for conservation planning based on landscape species requirements. Landscape and Urban Planning 58:41-56 [ Links ]
Schiavini ACM, Frere E, Yorio P y Parera A (1999) Las aves marinas de la Isla de los Estados, Tierra del Fuego, Argentina: revisión histórica, estado poblacional y problemas de conservación. Anales del Instituto de la Patagonia, Ciencias Naturales 27:25-40 [ Links ]
Schiavini A, Lizurume ME, Frere E, Bertellotti M, García N y Chizzini A (1994) Relevamiento aéreo otoñal de la fauna superior costera de Tierra del Fuego. Fundación Patagonia Natural, Puerto Madryn [ Links ]
Schiavini A, Yorio P y Frere E (1998) Distribución reproductiva y abundancia de las aves marinas de la Isla Grande de Tierra del Fuego, Isla de los Estados e Islas de Año Nuevo (Provincia de Tierra del Fuego, Antártida e Islas del Atlántico Sur). Pp. 179-213 en: Yorio P, Frere E, Gandini P y Harris G (eds) Atlas de la distribución reproductiva de aves marinas en el litoral patagónico argentino. Fundación Patagonia Natural y Wildlife Conservation Society, Buenos Aires [ Links ]
Sievert PR y Sileo L (1993) The effects of ingest plastic on growth and survival of albatross chicks. Pp. 212-217 en: Verneer K, Briggs KT, Morgan KH y Siegel Causey D (eds) The status, ecology and conservation of marine birds of the North Pacific. Canadian Wildlife Service, Ottawa [ Links ]
Tasker ML, Camphuysen C, Cooper J, Garthe S, Montevecchi WA y Blaber SJM (2000) The impacts of fishing on marine birds. ICES Journal of Marine Science 57:531-547 [ Links ]
Thompson KR (1992) Quantitative analysis of the use of discards from squid trawlers by Black-browed Albatrosses Diomedea melanophris in the vicinity of the Falkland Islands. Ibis 134:11-21 [ Links ]
Uhart M, Quintana F, Karesh W y Braselton WE (2003) Baseline hematology, biochemistries and disease serology of the Southern Giant Petrel in Patagonia, Argentina. Journal of Wildlife Diseases 39:359-365 [ Links ]
Voisin JF (1982) Observations on the Falkland Islands giant petrels Macronectes giganteus solanderi. Gerfaut 72:367-380 [ Links ]
Voisin JF (1988) Breeding biology of the Northern Giant Petrel Macronectes halli and the Southern Giant Petrel M. giganteus at Ile de la Possession, Iles Crozet 1966-1980. Cormorant 16:65-97 [ Links ]
Voisin JF y Bester MN (1981) The specific status of Giant petrels Macronectes at Gough Island. Pp. 215-222 en: Cooper J (ed) Proceedings of the Symposium on Birds of the Sea and Shore. African Seabird Group, Ciudad del Cabo [ Links ]
Waluda CM, Rodhouse PG, Trathan PN y Pierce GJ (2001) Remotely sensed mesoscale oceanography and the distribution of Illex argentinus in the South Atlantic. Fisheries Oceanography 10:207-216 [ Links ]
Warham J (1990) The petrels, their ecology and breeding systems. Academic Press, Londres [ Links ]
Warham J (1996) The behaviour, population biology and physiology of the petrels. Harcourt Brace, San Diego [ Links ]
Woehler EJ (1991) Status and conservation of the seabirds of Heard Island and the McDonald Island. Pp. 263-275 en: Croxall JP (ed) Seabird status and conservation: a supplement. International Council for Bird Preservation, Cambridge [ Links ]
Woods RW y Woods A (1997) Atlas of breeding birds of the Falkland Islands. Redwood Books, Trowbridge [ Links ]
Yorio P y Caille G (1999) Seabird interactions with coastal fisheries in northern Patagonia: use of discards and incidental captures in nets. Waterbirds 22:207-216 [ Links ]
Yorio P, García Borboroglu P, Bertellotti M, Lizurume ME, Giaccardi M, Punta G, Saravia J, Herrera G, Sollazzo S y Boersma PD (1998) Distribución reproductiva y abundancia de las aves marinas de Chubut. Parte II: norte del Golfo San Jorge, de Cabo Dos Bahías a Comodoro Rivadavia. Pp. 75-117 en: Yorio P, Frere E, Gandini P y Harris G (eds) Atlas de la distribución reproductiva de aves marinas en el litoral patagónico argentino. Fundación Patagonia Natural y Wildlife Conservation Society, Buenos Aires [ Links ]
Yorio P y Harris G (1997) Distribución reproductiva de aves marinas y costeras coloniales en Patagonia: relevamiento aéreo Bahía Blanca-Cabo Vírgenes, noviembre 1990. Informes Técnicos del Plan de Manejo Integrado de la Zona Costera Patagónica - Fundación Patagonia Natural 29:1-31 [ Links ]














