Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
El hornero
versión impresa ISSN 0073-3407versión On-line ISSN 1850-4884
Hornero v.20 n.1 Buenos Aires ene./ago. 2005
Estado poblacional y de conservación de gaviotas que se reproducen en el litoral marítimo argentino
Pablo Yorio 1,2,3, Marcelo Bertellotti 1 y Pablo García Borboroglu 1
1 Centro Nacional Patagónico (CONICET). Boulevard Brown 3500, U9120ACV Puerto Madryn, Chubut, Argentina.
2 Wildlife Conservation Society. 2300 Southern Boulevard, Bronx, New York, NY 10460, EEUU.
3 yorio@cenpat.edu.ar
Resumen
Tres especies de gaviotas se reproducen en el litoral marítimo argentino: la Gaviota Cocinera (Larus dominicanus), la Gaviota de Olrog (Larus atlanticus) y la Gaviota Austral (Larus scoresbii). Las tres especies presentan estrategias reproductivas y patrones de distribución y abundancia diferentes, que a su vez poseen importantes implicancias para el manejo y la conservación de sus poblaciones. La Gaviota Cocinera es una especie ampliamente distribuida y en expansión, con potenciales conflictos con otras especies costeras y con las poblaciones humanas. Por su parte, la Gaviota Austral y la Gaviota de Olrog son relativamente poco abundantes y poseen distribuciones reproductivas más restringidas, estando la segunda categorizada como especie Vulnerable. En este trabajo se actualiza la información sobre la distribución y abundancia de las tres especies, sintetizando los datos existentes sobre estimaciones poblacionales, tanto publicados como inéditos. Se efectúa también una revisión sobre aspectos de su biología (relativos al ciclo reproductivo, ecología alimentaria y requerimientos de hábitat) que puedan ser de utilidad para la elaboración de programas de monitoreo, planes de acción y estrategias regionales de conservación. Finalmente, se presenta una evaluación del estado actual de conservación y la problemática de manejo y se elabora una lista de recomendaciones.
Palabras clave: Argentina, aves marinas, conservación, gaviotas, Larus atlanticus, Larus dominicanus, Larus scoresbii.
Abstract
Population and conservation status of gulls breeding in coastal Argentina
Three gull species breed along the coasts of Argentina: the Kelp Gull (Larus dominicanus), the Olrog’s Gull (Larus atlanticus), and the Dolphin Gull (Larus scoresbii). These species present different breeding strategies and distribution and abundance patterns, which have important implications for the conservation and management of their populations. The Kelp Gull is a widely distributed species with expanding populations and potential conflicts with other coastal species and human populations. Dolphin and Olrog’s gulls have relatively small population sizes and more restricted breeding distributions, with the latter considered as a Vulnerable species. The distribution and abundance of these three gulls is updated, summarizing the published and unpublished existing information on population estimates. In addition, aspects of their breeding biology (such as those related to their breeding cycles, feeding ecology and habitat requirements) which could be useful for the development of monitoring programs, action plans and regional conservation strategies, are reviewed. Finally, an evaluation of the current conservation status and management issues and a list of recommendations are presented.
Key words: Argentina, conservation, gulls, Larus atlanticus, Larus dominicanus, Larus scoresbii, seabirds.
Recibido 4 junio 2004, aceptado 8 julio 2005
En Argentina se reproducen seis especies de gaviotas, cinco de las cuales frecuentan o dependen de ambientes marinos. Tres de estas gaviotas se reproducen en el litoral marítimo argentino: la Gaviota Cocinera (Larus dominicanus), la Gaviota de Olrog (Larus atlanticus) y la Gaviota Austral (Larus scoresbii). Las otras dos especies, la Gaviota Capucho Café (Larus maculipennis) y la Gaviota Cabeza Gris (Larus cirrocephalus) se reproducen mayormente en cuerpos de agua continentales, por lo que no son tratadas en este trabajo. Sin embargo, cabe mencionar que la Gaviota Capucho Café también nidifica en muy bajo número en unos pocos sitios del litoral marítimo de las provincias de Buenos Aires y Río Negro (González 1991, Yorio y Harris 1997, González et al. 1998) y que ambas frecuentan las costas marinas en busca de alimento (Bó et al. 1995). La Gaviota Cocinera también se reproduce en cuerpos de agua continentales (Bó et al. 1995), de manera que futuras consideraciones sobre el manejo y conservación de esta especie deberán tener en cuenta también a dichas poblaciones.
En este trabajo se presenta una actualización del estado poblacional y una revisión de la información sobre aspectos de la biología y los requerimientos ecológicos básicos de la Gaviota Cocinera, la Gaviota de Olrog y la Gaviota Austral, las cuales se reproducen en el litoral marítimo argentino. Estas tres especies presentan estrategias reproductivas y patrones de distribución y abundancia diferentes, los cuales, a su vez, poseen importantes implicancias para el manejo y conservación de sus poblaciones. Por un lado, la Gaviota Cocinera es una especie ampliamente distribuida y en expansión, con potenciales conflictos con otras especies costeras y las poblaciones humanas. Por otro lado, la Gaviota Austral y la Gaviota de Olrog son relativamente poco abundantes y poseen distribuciones reproductivas más restringidas, estando incluida la primera en una categoría de amenaza de extinción. No se ha intentado efectuar una revisión exhaustiva de la biología de estas especies, sino solo un análisis de la información que pueda ser de utilidad para la elaboración de programas de monitoreo, planes de acción y estrategias regionales de conservación. Finalmente, se presenta una evaluación del estado actual de conservación y de la problemática de manejo, y se elabora una lista de recomendaciones.
Gaviota Cocinera
Distribución, abundancia y tendencias poblacionales
La Gaviota Cocinera es una especie ampliamente distribuida en el Hemisferio Sur. Se reproduce en América del Sur, Australia, Nueva Zelanda, en islas subantárticas y en la Península Antártica (Burger y Gochfeld 1996). La población de Sudáfrica es actualmente considerada por algunos autores como una especie diferente, Larus vetula (Chu 1998). En el litoral marítimo argentino, la Gaviota Cocinera nidifica a lo largo de más de 5000 km de costa, desde Claromecó, provincia de Buenos Aires, hasta Bahía Ushuaia, en Tierra del Fuego (Tabla 1, Fig. 1; Yorio et al. 1998c). Evaluaciones efectuadas a mediados de la década de 1990 han permitido identificar un total de 104 colonias en la costa argentina, con un total poblacional de aproximadamente 75000 parejas reproductivas (Yorio et al. 1999). El tamaño de las colonias variaba desde unas pocas parejas hasta 12260, con una mediana de 183 parejas (Yorio et al. 1998c). En los años subsiguientes se han identificado sitios donde no se las había registrado reproduciéndose anteriormente y también se ha observado la desaparición de unas pocas colonias (Tabla 1). En la tabla 1 se presenta el listado de localidades donde la Gaviota Cocinera se ha reproducido en los últimos veinte años (ver también Fig. 1).
Tabla 1. Ubicación y tamaño (en parejas reproductivas) de las 115 colonias de nidificación conocidas de Gaviota Cocinera (Larus dominicanus) identificadas a lo largo del litoral marítimo argentino durante los últimos 20 años. El listado de la localidad no implica que allí se reproduzca la especie en la actualidad. Se presentan los valores correspondientes al último censo disponible. Se indica también la fuente original de información (la referencia bibliográfica o los autores de la observación). El número indicado para cada colonia corresponde a su ubicación en la figura 1. NC: no censado.

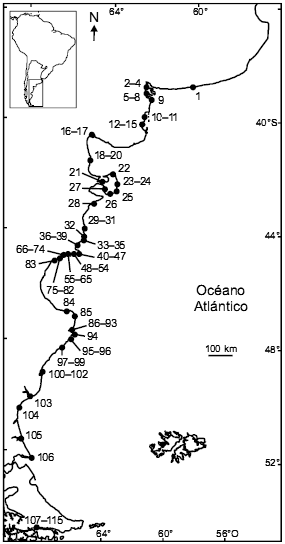
Figura 1. Ubicación de las 115 colonias de nidificación conocidas de Gaviota Cocinera (Larus dominicanus) a lo largo del litoral marítimo argentino durante los últimos 20 años. El número indicado para cada colonia corresponde al de la tabla 1.
La Gaviota Cocinera mostró una importante expansión poblacional durante las últimas dos décadas (Yorio et al. 1998a), aunque muchas colonias, después de variar en número durante algunos años, parecen haberse estabilizado. En el norte de Chubut, por ejemplo, todas las colonias estudiadas mostraron un incremento de 3.5–69.0% anual hasta mediados de la década de 1990 (λ promedio: 1.206). Sin embargo, a partir de entonces las mismas colonias mostraron una reducción en el número de parejas de 4–28% anual (λ promedio: 0.883) (Tablas 2 y 3; Bertellotti et al., datos no publicados). Las tres colonias de la provincia de Río Negro, en cambio, han mostrado un importante incremento poblacional en los últimos años, aunque debe considerarse que estos resultados están basados en solo dos censos por colonia (Tablas 2 y 3; Bertellotti et al., datos no publicados). En el norte del Golfo San Jorge, Chubut, 18 de las 20 colonias de Gaviota Cocinera estudiadas mostraron también un aumento en el número de parejas durante la última década (Yorio et al., datos no publicados). Además, al menos cinco nuevas colonias han sido identificadas en la provincia de Chubut en este mismo período (Tabla 1; Bertellotti et al., datos no publicados). La información obtenida en colonias de Ría Deseado, Monte León y Ría Gallegos, en la provincia de Santa Cruz, muestra también un incremento poblacional en las últimas dos décadas (E Frere, com. pers.).
Tabla 2. Número de nidos registrados en colonias de Gaviota Cocinera (Larus dominicanus) en las provincias de Río Negro y Chubut entre 1979 y 2002. Se indica también la fuente original de información (la referencia bibliográfica o los autores de la estimación). NC: no censado.

Tabla 3. Tasa de incremento poblacional de Gaviota Cocinera (Larus dominicanus) en colonias de las provincias de Río Negro y Chubut. Fuente: Bertellotti et al. (datos no publicados).

Requerimientos de hábitat
Estudios recientes muestran que en las costas de las provincias de Chubut, Río Negro y Buenos Aires la Gaviota Cocinera utiliza una amplia variedad de hábitats para nidificar (García Borboroglu y Yorio 2004a). Éstos incluyen áreas sin cobertura vegetal o con vegetación arbustiva y herbácea, con diferente composición del sustrato y con diferente pendiente, desde áreas niveladas hasta acantilados escarpados. Esta información obtenida en Argentina apoya la hipótesis que la Gaviota Cocinera es generalista en cuanto a la selección de hábitat, confirmando la gran plasticidad observada en otras regiones del Hemisferio Sur (Fordham 1964, Burger y Gochfeld 1981, Quintana y Travaini 2000). La Gaviota Cocinera tiene una fuerte preferencia por reproducirse en islas y ambientes con vegetación (García Borboroglu y Yorio 2004a).
A escala de microhábitat, la Gaviota Cocinera selecciona sitios con alta cobertura vegetal y baja pendiente, mostrando los individuos que seleccionan los sitios con estas características un mayor éxito reproductivo (Yorio et al. 1995, García Borboroglu y Yorio 2004b). A pesar de que la Gaviota Cocinera muestra preferencias por determinados sitios, estas preferencias son lo suficientemente flexibles como para permitirle aprovechar distintos microhábitats disponibles en las diferentes colonias (García Borboroglu y Yorio 2004c). Las densidades observadas fueron de 0.11–0.18 nidos/m2 en Isla de los Pájaros (Pagnoni et al. 1993), 0.109–0.136 nidos/m2 en Punta León (Malacalza 1987, Yorio et al. 1994) y 0.14 ± 0.03 nidos/m2 (promedio ± DE) en Isla Vernaci Sudoeste (Yorio y García Borboroglu 2002).
Ciclo reproductivo
La información sobre los patrones temporales de reproducción y los parámetros reproductivos básicos de la Gaviota Cocinera está disponible sólo para unas pocas colonias, mayormente en la zona central de la Patagonia. Esta información es importante para diseñar programas de monitoreo, interpretar tendencias poblacionales y planificar actividades en la costa, como el turismo o la recreación. El ciclo reproductivo de la Gaviota Cocinera en el litoral marítimo argentino se extiende mayormente desde septiembre hasta enero. El patrón temporal de reproducción varía entre colonias, pudiendo comenzar la puesta entre principios de octubre y principios de noviembre, dependiendo de la localidad. Por ejemplo, la puesta comienza a mediados de octubre en Punta Pirámide (42°35'S) (Bertellotti y Yorio 1999), a principios de octubre en Punta León (43°04'S) (Malacalza 1987, Yorio et al. 1994), a principios de noviembre en Punta Tombo (44°02'S) (Bertellotti y Yorio 1999) y en la segunda semana de noviembre en el Golfo San Jorge (45°11'S) (Yorio y García Borboroglu 2002).
El tamaño de puesta fue estimado en 2.3–2.5 huevos/nido en Isla Vernaci Sudoeste (Yorio y García Borboroglu 2002), 2.3–2.4 huevos/nido en Punta León (Yorio et al. 1995) y 2.4 huevos/nido en Punta Tombo (Reid 1987). El período de incubación es de aproximadamente 26–27 días (Malacalza 1987, Yorio y García Borboroglu 2002). En Punta León, el éxito de eclosión fue de 1.8–2.1 huevos/nido y el éxito reproductivo (a las cuatro semanas) fue 1.05–1.21 pichones/nido (Yorio et al. 1995). En Isla Vernaci Sudoeste, el éxito de eclosión fue de 1.7–1.8 huevos/nido y el éxito reproductivo (a las cuatro semanas) fue de 0.85 pichones/nido (Yorio y García Borboroglu 2002). En esta especie se observa una disminución estacional en el rendimiento reproductivo, con un mayor éxito de eclosión, mayor tamaño de pichones al mes de edad y mayor éxito reproductivo en los individuos que se reproducen más temprano (García Borboroglu y Yorio, datos no publicados).
Ecología alimentaria
La Gaviota Cocinera es una especie generalista y oportunista de hábitos de alimentación mayormente costeros, pudiendo variar ampliamente la forma en que obtiene su alimento. Estudios de dieta efectuados durante la temporada reproductiva en la provincia de Chubut (Punta Pirámide, Punta León y Punta Tombo) han registrado un total de 41 tipos diferentes de presas (Bertellotti y Yorio 1999, Yorio y Bertellotti 2002). La dieta en esa zona consiste principalmente en invertebrados del intermareal, aunque los peces son también un importante componente, especialmente durante la etapa de pichones. La Gaviota Cocinera también incorpora en su dieta pichones y huevos de otras aves (Malacalza 1987, Frere et al. 1992, Yorio y Boersma 1994, Punta et al. 1995, Yorio y Quintana 1997, Quintana y Yorio 1998a) y alimento robado a otras especies de aves como pingüinos, gaviotines y cormoranes (Quintana y Yorio 1999, Yorio, datos no publicados) y a otros individuos de Gaviota Cocinera (Bertellotti y Yorio 2001). Además, los hábitos de alimentación oportunistas permiten a la Gaviota Cocinera que se reproduce en la Patagonia incorporar a su dieta alimentos derivados de actividades humanas (ver Conservación y manejo). Estos incluyen residuos urbanos y residuos de pescado provisto por pesquerías comerciales, tanto el descartado durante las operaciones en el mar como el depositado en basurales costeros. En el estuario de Bahía Blanca, la Gaviota Cocinera también incorpora alimentos de origen humano durante la temporada reproductiva (Petracci et al. 2004). Aunque no existen hasta la fecha estudios sobre especialización individual en la alimentación, algunas observaciones indican que esta especie podría mostrar una especialización en el uso de métodos de captura, de áreas de alimentación y del tipo de alimento utilizado (Yorio et al., datos no publicados). La información existente muestra que un número limitado de individuos puede predar sobre el Cormorán Imperial (Phalacrocorax atriceps), el Gaviotín Real (Thalasseus maximus) y el Gaviotín Pico Amarillo (Thalasseus sandvicensis eurygnatha) (Yorio y Quintana 1997, Quintana y Yorio 1998a, Yorio, datos no publicados).
Gaviota de Olrog
Distribución, abundancia y tendencias poblacionales
La Gaviota de Olrog, también llamada Gaviota Cangrejera, es una especie endémica de la costa argentina. El rango de distribución reproductiva es relativamente pequeño y está restringido solamente a dos áreas de nidificación: el sector comprendido entre el estuario de Bahía Blanca y la Bahía Anegada, en el sur de la provincia de Buenos Aires, y el norte del Golfo San Jorge, en la provincia de Chubut (Tabla 4, Fig. 2; Yorio et al. 1997). A mediados de la década de 1990, el tamaño poblacional fue estimado en 2300 parejas, distribuidas en 10 colonias de 15–800 nidos (Tabla 4; Yorio et al. 1999). La zona sur de la provincia de Buenos Aires, en particular, es un amplio sector costero de compleja geografía y de difícil relevamiento que presenta numerosos ambientes apropiados para la reproducción de la Gaviota de Olrog. Por lo tanto, es posible que existan colonias no detectadas en algunos sectores inadecuadamente relevados (Yorio et al. 1997). Por ejemplo, desde la evaluación a escala regional efectuada a mediados de la década de 1990 se han identificado tres nuevos sitios de reproducción en el sur de la provincia de Buenos Aires (Tabla 4, Fig. 2; Delhey et al. 2001b, Yorio et al. 2001b, Rábano et al. 2002). La información obtenida muestra que la Gaviota de Olrog puede cambiar la ubicación de la colonia entre temporadas, tanto dentro como entre localidades (Yorio et al. 1997, García Borboroglu 2003), por lo que no puede descartarse que algunas de las gaviotas encontradas en las nuevas localidades se hayan reproducido en años anteriores en sitios previamente registrados. Debido a las características de historia natural de esta especie y a la complejidad e inestabilidad ambiental de las áreas reproductivas del sur de Buenos Aires, se requiere de evaluaciones exhaustivas a escala regional para lograr una estimación confiable del tamaño poblacional total y poder detectar cambios en el número de aves reproductivas. Los datos provenientes del norte del Golfo San Jorge, sin embargo, sugieren que, al menos en dicho sector, la población ha permanecido estable durante la última década (Tabla 4). Actualmente se están llevando a cabo estudios poblacionales a través del anillado de aves en el sur de la provincia de Buenos Aires (PF Petracci, com. pers.) y un análisis de la estructura genética de la población a lo largo de toda su distribución reproductiva (García Borboroglu y Yorio, datos no publicados). Esto permitirá avanzar en un enfoque metapoblacional para comprender mejor la relación entre las distintas unidades reproductivas, contribuyendo así a interpretar los patrones de distribución y abundancia.
Tabla 4. Ubicación y tamaño (en parejas reproductivas) de las 18 colonias de nidificación conocidas de Gaviota de Olrog (Larus atlanticus) identificadas a lo largo del litoral marítimo argentino. Se presenta información para los casos en los cuales se efectuó una visita en el año señalado; la ausencia de datos no implica que la especie no se haya reproducido en la localidad ese año. Se indica también la fuente original de información (la referencia bibliográfica o los autores de la observación). El número indicado para cada colonia corresponde a su ubicación en la figura 2. NC: no censado.
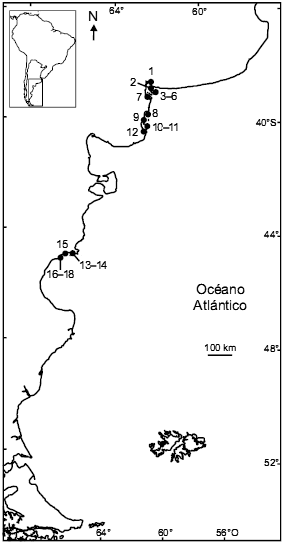
Figura 2. Ubicación de las 18 colonias de nidificación conocidas de Gaviota de Olrog (Larus atlanticus) a lo largo del litoral marítimo argentino. El número indicado para cada colonia corresponde al de la tabla 4.
Ciclo reproductivo
La información sobre los patrones temporales de reproducción de esta especie proviene mayormente del extremo sur de su distribución, específicamente de las colonias de Caleta Malaspina, aunque se cuenta también con observaciones de algunas colonias de la provincia de Buenos Aires (Devillers 1977a, Petracci, datos no publicados). Los individuos poseen una débil tenacidad al sitio de reproducción, construyen sus nidos inmediatamente después del asentamiento e inician la puesta pocos días más tarde. La Gaviota de Olrog se reproduce en grupos o subgrupos con altas densidades de nidos (Yorio y Harris 1992, Delhey et al. 2001b, Yorio et al. 2001b, García Borboroglu 2003).
Estudios en el norte del Golfo San Jorge, Chubut, mostraron que las gaviotas comienzan a construir nidos e inician la puesta en la última semana de octubre (García Borboroglu 2003). El período de incubación fue estimado en aproximadamente 30 días y las eclosiones comienzan a principios de diciembre (García Borboroglu 2003). En Buenos Aires, la mayor parte de las eclosiones tienen lugar durante la primera semana de noviembre (García Borboroglu, datos no publicados). Existe una marcada asincronía de puesta entre los grupos que componen las colonias en esa área.
Requerimientos de hábitat
Todas las colonias de esta especie se ubican en localidades insulares y próximas a intermareales con presencia de cangrejos (García Borboroglu 2003). La Gaviota de Olrog construye los nidos, por lo general, en áreas desprovistas de vegetación o sobre vegetación con una altura menor a 30 cm, próximas al agua y a muy escasa altura sobre el nivel del mar (Yorio et al. 2001b, García Borboroglu 2003). En todas las localidades de reproducción estudiadas, las colonias se encuentran adyacentes a las de Gaviota Cocinera.
Ecología alimentaria
La Gaviota de Olrog posee una dieta relativamente especializada durante la temporada reproductiva, predando mayormente sobre cangrejos grápsidos. Los antecedentes proporcionados por Daguerre (1933), Olrog (1967) y Devillers (1977a) ya indicaban que esta gaviota se alimenta mayormente de cangrejos en el sur de la provincia de Buenos Aires. Estudios cuantitativos recientes mostraron que los individuos que se reproducen en el estuario de Bahía Blanca se alimentan principalmente del cangrejo Chasmagnathus granulata (Delhey et al. 2001a). En esta zona se están llevando a cabo nuevos estudios sobre su dieta (Petracci, datos no publicados). La Gaviota de Olrog también muestra una especialización dietaria en el Golfo San Jorge, incluyendo mayormente a los cangrejos Cyrtograpsus altimanus y Cyrtograpsus angulatus en su dieta (Herrera et al. 2005). Estudios de sus patrones espacio-temporales de alimentación en esa misma zona confirman su ecología alimentaria especializada. Individuos reproductivos de la colonia de Caleta Malaspina equipados con radiotransmisores se alimentaron mayormente durante las mareas baja y media casi exclusivamente dentro de la caleta, en coincidencia con la extensión espacial de los ambientes intermareales con presencia de cangrejos (Yorio et al. 2004). Los cangrejos son también un importante componente de la dieta durante la temporada no reproductiva (Silva Rodríguez et al. 2005). A pesar de su especialización sobre cangrejos, la Gaviota de Olrog puede, en ocasiones, incorporar otras presas en su dieta, como Balanus glandula, Mytilus sp., pequeños peces y residuos de pescado, particularmente durante la temporada no reproductiva (Martínez et al. 2000, Delhey et al. 2001a, Silva Rodríguez et al. 2005).
Gaviota Austral
Distribución, abundancia y tendencias poblacionales
La Gaviota Austral, también denominada Gaviota Gris, se encuentra restringida a las costas del sur de América del Sur. Se reproduce desde los 42°S sobre el Pacífico y los 44°S sobre el Atlántico, hasta Tierra del Fuego, incluyendo las Islas Malvinas (Burger y Gochfeld 1996). Históricamente, se ha incluido a esta especie en los géneros Gabianus, Larus y Leucophaeus. A pesar de que por sus características únicas de plumaje, forma de pico y comportamiento Burger y Gochfeld (1996) la asignaron al género Leucophaeus, en este trabajo se la considera como perteneciente al género Larus. La Gaviota Austral es una gaviota relativamente pequeña, promediando 524 g (Yorio et al. 1996b). En las costas de Argentina, nidifica desde Punta Tombo, provincia de Chubut, hasta Islas Bridges, en el Canal Beagle, Tierra del Fuego (Tabla 5, Fig. 3). El número poblacional total estimado a mediados de la década de 1990 era de menos de 700 parejas, distribuidas solamente en 26 colonias (Tabla 5). Esta especie se reproduce en colonias relativamente pequeñas de entre unos pocos y aproximadamente 200 nidos (Tabla 5; Yorio et al. 1998c). El tamaño máximo de colonia registrado es de 218 nidos en Islas Bridges durante la temporada de 1992 (Schiavini y Yorio 1995).
Tabla 5. Ubicación y tamaño (en parejas reproductivas) de las 31 colonias de nidificación conocidas de Gaviota Austral (Larus scoresbii) identificadas a lo largo del litoral marítimo argentino. Se presenta información para los casos en los cuales se efectuó una visita en el año señalado; la ausencia de datos no implica que la especie no se haya reproducido en la localidad ese año. Se indica también la fuente original de información (la referencia bibliográfica o los autores de la observación). El número indicado para cada colonia corresponde a su ubicación en la figura 3. NC: no censado.

Figura 3. Ubicación de las 31 colonias de nidificación conocidas de Gaviota Austral (Larus scoresbii) a lo largo del litoral marítimo argentino. El número indicado para cada colonia corresponde al de la tabla 5.
La información disponible sobre la población de Gaviota Austral es inadecuada para estimar tendencias poblacionales. En Punta Tombo, la única localidad con varios censos efectuados a lo largo de dos décadas, la colonia no varió significativamente en abundancia; el número máximo observado en los últimos 30 años fue de 31 parejas (Tabla 5; W Conway, com. pers.). A diferencia de lo observado en la mayor parte de las gaviotas, pero en forma más similar a la Gaviota de Olrog (García Borboroglu 2003) y a algunas especies de gaviotines (Yorio et al. 1994), la Gaviota Austral puede cambiar entre años la ubicación de la colonia en una misma localidad de reproducción. En Punta Tombo, por ejemplo, la Gaviota Austral ha construido sus nidos en al menos cinco sitios diferentes en las últimas dos décadas (Yorio et al. 1996b, Yorio, datos no publicados).
Requerimientos de hábitat
Las colonias de esta especie cubren un área muy reducida, con un bajo número de individuos reproductivos y relativamente altas densidades de nidificación. En Punta Tombo, la distancia promedio entre nidos es de 41 cm (1.0–1.6 parejas/m2; Yorio et al. 1996b), en tanto que en tres colonias del Golfo San Jorge el promedio fue de 66 cm (Yorio y García Borboroglu, datos no publicados). Los nidos se ubican en suelos rocosos, en general de relieve irregular, suave declive (rango 1.0–2.5°), sin cobertura vegetal y alejados de la vegetación (Yorio y García Borboroglu, datos no publicados). Aunque parece existir una amplia disponibilidad de zonas que reúnen estas características, la reproducción de la Gaviota Austral se encontraría restringida a las adyacencias de colonias de aves y mamíferos marinos, de las cuales obtiene su alimento (ver Ecología alimentaria).
Ciclo reproductivo
La única información sobre la biología reproductiva de la Gaviota Austral en el litoral atlántico argentino proviene de un estudio efectuado en Punta Tombo (Yorio et al. 1996b), aunque existen antecedentes sobre algunos aspectos de su comportamiento reproductivo (Moynihan 1962, Devillers 1977b). La Gaviota Austral empieza a observarse en el área de Punta Tombo, aunque en bajo número, desde principios de septiembre. Las aves comienzan a establecerse en la zona que utilizarán para nidificar en la primera quincena de noviembre y a construir sus nidos a partir de la segunda quincena de ese mes. La puesta comienza después de 1–3 días desde que se construye el nido, y puede ser relativamente asincrónica, durando más de un mes. La información existente para el Golfo San Jorge, Chubut, sugiere que en localidades más australes la puesta ocurre más tarde (Yorio et al., datos no publicados). En Puerto Deseado el pico de puesta ocurre durante la última semana de noviembre (Gandini y Frere 1998a). El tamaño promedio de puesta en Punta Tombo es de dos huevos, aunque un porcentaje bajo de hembras puede poner tres. El período de incubación es de 24–27 días. Los pichones nacen desde mediados hasta fines de diciembre. Entre los 2–5 días después del nacimiento, los pichones se alejan del nido siguiendo a sus padres y se trasladan varios metros fuera de la colonia hacia el borde del agua, donde permanecen con sus padres pero separados de otras nidadas. A medida que crecen, comienzan a asociarse en guarderías (“creches”). El éxito reproductivo es altamente variable entre años, variando entre el fracaso reproductivo completo hasta 0.86 pichones por nido activo (Yorio et al. 1996b).
La Gaviota Austral se alimenta mayormente de presas traídas por otras aves coloniales a sus pichones y del excremento de mamíferos marinos (Devillers 1977b, Yorio et al. 1996b, Suárez y Yorio 2005). A pesar de las numerosas observaciones sobre este comportamiento, solo existen estudios cuantitativos para la colonia de la Reserva Punta Tombo. La información obtenida en esa localidad indica que, durante la reproducción, la Gaviota Austral se alimenta a menos de 5 km de su colonia y casi exclusivamente dentro de los límites del área protegida de la reserva. Las aves se alimentan regularmente de los regurgitados de Pingüino de Magallanes (Spheniscus magellanicus) y Cormorán Imperial y del excremento del lobo marino de un pelo (Otaria flavescens) (Suárez y Yorio 2005). Durante esta etapa, y en menor proporción, pueden también obtener restos de huevos de pingüino robados por otros predadores, predar sobre huevos de Cormorán Imperial y Gaviota Cocinera, y alimentarse en el intermareal, mayormente en etapas previas al nacimiento de los pichones de pingüinos y cormoranes (Yorio et al. 1996b).
Estado actual de conservación
La Gaviota de Olrog está considerada internacionalmente como especie Vulnerable (BirdLife International 2004). Además, debido a que parte de su población puede migrar hasta las costas de Uruguay (Collar et al. 1992), se encuentra actualmente listada en el Apéndice I de la Convención para la Conservación de Especies Migratorias. En el otro extremo, la Gaviota Cocinera está considerada en algunos sitios del país como “especie problema”, argumentándose que puede causar daños a las actividades ganaderas y, por lo tanto, podría estar sujeta a la persecución por el hombre (Humphrey et al. 1970, Vila y Bertonatti 1993). Su presencia en ciudades y sus efectos negativos sobre otras especies, particularmente la ballena franca austral (Eubalaena australis) (ver abajo), han llevado a solicitar la implementación de controles poblacionales.
Una proporción importante de la población de Gaviota Cocinera, aproximadamente 40 de las colonias (un 60% del tamaño poblacional total), se reproducía dentro de las áreas protegidas del litoral marítimo durante la década de 1990 (Yorio 2000). Por el contrario, solo ocho colonias de Gaviota Austral (un 30% del total poblacional estimado) se encontraban dentro de áreas protegidas en dicho período (Yorio 2000). Debido a que el conocimiento sobre la distribución reproductiva de la Gaviota de Olrog es todavía incompleto (ver arriba), es difícil evaluar el grado de protección conferido por las actuales áreas protegidas para esta especie. Varias localidades de reproducción se hallan todavía sin protección legal alguna, incluidas todas las ubicadas en la provincia de Chubut. La colonia de Isla del Puerto no posee protección alguna, a pesar de ser la principal colonia conocida, con posiblemente más de la mitad de la población reproductiva total de la especie (Delhey et al. 2001b). Dado que algunas colonias se encuentran relativamente próximas al límite de un área protegida (e.g., Isla del Puerto, Islote Arroyo Jabalí), es recomendable la ampliación de estas áreas para lograr así su inclusión. También es importante señalar que debido a la ecología alimentaria de la Gaviota Austral y la Gaviota de Olrog (y a diferencia de muchas aves marinas), el uso de áreas protegidas constituye una herramienta de gran utilidad para proteger tanto las áreas de nidificación como las de alimentación de las poblaciones reproductivas (Yorio et al. 2004, Suárez y Yorio 2005).
Más del 90% de la población reproductiva de la Gaviota de Olrog nidifica en el sur de la provincia de Buenos Aires (Yorio et al. 1997, Delhey et al. 2001b), un sector de costa expuesto a crecientes actividades humanas. El estuario de Bahía Blanca, por ejemplo, es un área sometida a actividades industriales, pesqueras, agrícolas y recreativas (Yorio et al. 1997). La zona de San Blas, por su parte, presenta una intensa actividad recreativa, donde también se ha reportado la recolección de huevos (Devillers 1977a, Yorio et al. 2001b). En la zona de Chubut donde se encuentran las colonias se realizan actividades extractivas artesanales (Yorio 1998), las cuales podrían perturbar a las aves durante su reproducción. La recolección de huevos de Gaviota Cocinera ha sido registrada en algunos sitios del litoral marítimo, como el estuario de Bahía Blanca, Bahía San Blas, San Antonio Oeste y Cabo Vírgenes (Yorio et al. 1998a, Delhey et al. 2001b), aunque esta actividad no puede ser considerada como preocupante en la actualidad. Pero el crecimiento de la actividad turística y recreativa en algunos sectores costeros podría afectar el éxito reproductivo de las tres especies de gaviotas si las visitas no son manejadas adecuadamente.
En cuanto a los aspectos relativos al estado de salud de las poblaciones de gaviotas, se han efectuado estudios para establecer parámetros de salud en algunas localidades del litoral marítimo. Estudios realizados en pichones de Gaviota Cocinera de la colonia de Punta León mostraron la presencia de anticuerpos para la bronquitis infecciosa aviar en 1 de 13 individuos muestreados y resultados negativos para las otras 14 enfermedades analizadas (Karesh et al., datos no publicados). Cabe destacar que, por ser pichones, los individuos muestreados podrían no haber tenido aún exposición a enfermedades y estar todavía protegidos por anticuerpos paternos (M Uhart, com. pers.). En adultos de Gaviota Austral de la provincia de Chubut se han encontrado anticuerpos para adenovirus aviar, encefalomielitis aviar, bronquitis infecciosa, Chlamydophila sp. y Salmonella pullorum, y no se detectó evidencia de exposición a las otras siete enfermedades analizadas (Uhart y Quintana, datos no publicados). También se están llevando a cabo evaluaciones del estado sanitario de la Gaviota de Olrog y la Gaviota Cocinera en el estuario de Bahía Blanca (LF La Sala y PF Petracci, com. pers.). Estas incluyen exposición a enfermedades y a contaminantes ambientales, principalmente metales pesados. En individuos de Gaviota Cocinera muestreados en la Patagonia se ha registrado la presencia de plomo, cadmio y plaguicidas organoclorados (pp’-DDE, un isómero del DDT) (Gil et al. 1997). Estudios en Puerto Madryn, Rawson y Puerto Deseado han mostrado la presencia de varios patógenos, incluidos Klebsiella sp., Salmonella sp. y Shigella sp., en muestras de heces de individuos que se alimentan en los basurales (Yorio et al. 1996a, Frere et al. 2000). En forma similar, estudios preliminares en Bahía Blanca muestran la presencia de patógenos fecales como Salmonella spp., Escherichia coli y Klebsiella spp. en Gaviota Cocinera y los dos primeros más Shigella spp. en Gaviota de Olrog (La Sala et al., datos no publicados).
Uso de fuentes de origen humano y conflictos potenciales
En forma similar a varias especies de gaviotas de otras regiones, las especies del litoral marítimo argentino utilizan en mayor o menor medida alimento de origen humano, incluyendo residuos urbanos y descartes provenientes de la industria pesquera, tanto durante como fuera de la temporada reproductiva (ver también Silva Rodríguez et al. 2005). De las tres especies, la Gaviota Cocinera es la que más aprovecha dichas fuentes de alimento, estando presente en ellas en grandes números a lo largo de todo el año (ver abajo). En la mayor parte de los censos efectuados durante las operaciones de pesca y en los basurales tanto urbanos como pesqueros se registraron adultos y subadultos de Gaviota Cocinera (e.g., Bertellotti y Yorio 2000a, Giaccardi y Yorio 2004). Las otras dos especies raramente son observadas durante la temporada reproductiva en fuentes de alimento de origen humano (Yorio et al. 1996a, Gandini y Frere 1998a, Yorio y Giaccardi 2002). La diferencia en el patrón de ocurrencia y abundancia en basurales podría estar relacionada con sus distribuciones, sus tamaños poblacionales y su ecología alimentaria.
La Gaviota Cocinera es una de las principales especies de aves marinas que se asocian a las pesquerías costeras de la Patagonia durante todo el año (Yorio y Caille 1999, Bertellotti y Yorio 2000a, 2000b). También es una de las que más aprovechan el descarte de la pesquería de altura de merluza común (Merluccius hubbsi) en el Golfo San Jorge (González Zevallos y Yorio en prensa). A pesar de no haberse cuantificado su presencia en otras pesquerías, se sabe que se asocia frecuentemente a pesquerías de arrastre que operan sobre langostino (Yorio et al., datos no publicados). Las plantas procesadoras de pescado en varias localidades costeras también producen grandes cantidades de residuos que son depositados dentro o cerca de los basurales urbanos (Yorio et al. 1996a). Por ejemplo, se estima que en la última década se ha generado un promedio de 50000 toneladas anuales de residuos pesqueros en las plantas procesadoras de Chubut (Yorio y Caille 2004). Estos descartes son depositados a cielo abierto, permaneciendo expuestos y disponibles para la Gaviota Cocinera por períodos de tiempo prolongados.
Los residuos urbanos son también un importante componente de la ecología alimentaria de esta especie, ya que, al igual que el residuo pesquero, es cubierto sólo ocasionalmente en algunos basurales (Giaccardi et al. 1997). La Gaviota Cocinera utiliza estos basurales costeros a lo largo de todo el litoral marítimo argentino (Yorio et al. 1996a, Yorio y Giaccardi 2002). En Puerto Madryn, la Gaviota Cocinera estuvo presente en todos los censos mensuales durante 1996 y 1997, con números totales de aves adultas altos y variables (promedio: 3660 y 3874 individuos en 1996 y 1997, respectivamente; Giaccardi y Yorio 2004). En Rawson, la Gaviota Cocinera estuvo presente en todos los muestreos quincenales a lo largo del año entre 1992–1994, en números que alcanzaron hasta varios miles de adultos durante algunos meses de la temporada reproductiva (Giaccardi et al. 1997). Muchas de las gaviotas adultas observadas podrían ser individuos no reproductivos. Sin embargo, los estudios muestran que los reproductivos también utilizan las fuentes de alimento de origen humano (Bertellotti y Yorio 1999, Bertellotti et al. 2001, Yorio y Bertellotti 2002).
El aporte alimentario de algunas pesquerías a la población de Gaviota Cocinera puede ser significativo. A modo de ejemplo, se estimó que los descartes producidos en el caladero del Golfo San Matías podrían proveer alimento a más de 30000 gaviotas (Bertellotti y Yorio 2000a). En forma similar se estimó que el residuo de pescado generado por las plantas procesadoras de Chubut podría sostener anualmente 100000–210000 individuos, dependiendo del año (Yorio y Caille 2004). Los basurales urbanos y pesqueros pueden ser una fuente de alimento muy importante para algunas poblaciones que se reproducen en la zona. Por ejemplo, se estima que el 54–69% de las gaviotas que se reproducen en Isla de los Pájaros utilizan los residuos de los basurales pesquero y urbano de Puerto Madryn, al menos durante el período de incubación (Bertellotti et al. 2001).
Las fuentes de origen humano como los basurales urbanos y descartes pesqueros ofrecen recursos que son, en general, relativamente predecibles y abundantes, y se ha argumentado que varias especies de gaviotas en el mundo han incrementado sus poblaciones gracias al uso de estas fuentes de alimento (Spaans y Blokpoel 1991, Belant 1997). A pesar de que en Argentina no se han efectuado estudios que demuestren los efectos de estas fuentes alternativas de alimento sobre la dinámica poblacional de la Gaviota Cocinera, la información existente sobre la ecología alimentaria y las tendencias poblacionales sugiere fuertemente que el uso de los basurales y del descarte pesquero podría estar favoreciendo el éxito reproductivo de las gaviotas, la condición física de aves reproductivas y la supervivencia individual durante el invierno, particularmente de las aves jóvenes.
El incremento en las poblaciones de Gaviota Cocinera podría resultar en impactos negativos sobre otras especies costeras a través de la predación, la competencia por el espacio para nidificar y el cleptoparasitismo. La Gaviota Cocinera nidifica junto a otras aves marinas en la mayor parte de las localidades de reproducción del litoral marítimo argentino y es la especie más abundante en muchas colonias mixtas (Yorio et al. 1998c). Como fuera mencionado anteriormente, la Gaviota Cocinera puede predar sobre huevos y pichones de varias especies, algunas de interés económico como el Pingüino de Magallanes o el Cormorán Imperial. La Gaviota Cocinera aprovecha también de forma oportunista los huevos que quedan expuestos debido a perturbaciones de origen humano (Frere et al. 1992, Yorio y Boersma 1994, Yorio y Quintana 1996). De forma similar, la Gaviota Austral es atraída por la actividad de los visitantes a las colonias de aves marinas, donde preda los huevos que quedan expuestos (Kury y Gochfeld 1975, Yorio et al. 1996b). Esto tiene particular relevancia considerando el actual crecimiento de las actividades turísticas y recreativas en el litoral marítimo (Yorio et al. 2001a).
Su flexibilidad en los requerimientos de hábitat para criar y su nidificación más temprana en muchos sitios convierten a la Gaviota Cocinera en buena competidora por el espacio, pudiendo afectar el asentamiento de gaviotines (Quintana y Yorio 1998b) y desplazar al Pingüino de Magallanes (Frere y Gandini, datos no publicados) y al Biguá (Phalacrocorax olivaceus) (Yorio et al. 1992). A pesar de que existen diferencias en las preferencias por sitios para nidificar entre la Gaviota Cocinera y la Gaviota de Olrog, estas dos especies muestran también una superposición en los requerimientos de hábitat, sugiriendo un potencial conflicto espacial (García Borboroglu 2003). Además, en Punta Tombo se ha observado una mortalidad significativa de pichones de Gaviota Austral como resultado del comportamiento territorial y predatorio de la Gaviota Cocinera que se reproduce en la periferia de su colonia (Suárez y Yorio, datos no publicados).
La Gaviota Cocinera también pueden afectar a gaviotines, pingüinos y cormoranes a través del cleptoparasitismo (Quintana y Yorio 1999, Yorio, datos no publicados). Esta especie también se alimenta de la piel y la grasa de la ballena franca austral, que se reproduce en el área de Península Valdés (Thomas 1988); la frecuencia de ataques a las ballenas se ha incrementado en la última década (Rowntree et al. 1998). Se argumenta que este comportamiento podría afectar negativamente a las ballenas, ya que resulta en un incremento de su desgaste energético, principalmente en madres con cría, durante un momento especialmente sensible de su ciclo de vida (Rowntree et al. 1998).
El incremento en las poblaciones de Gaviota Cocinera y su actividad cerca de ciudades podría resultar en conflictos con el hombre. Entre ellos figura el posible papel de la especie como transmisor de patógenos (Yorio et al. 1996a, Frere et al. 2000). De forma similar, el incremento en el número de gaviotas en las cercanías de aeropuertos puede representar una amenaza de colisión con aeronaves. Aunque en la actualidad la problemática asociada a los aeropuertos no es significativa, se han registrado casos en los cuales las gaviotas han afectado las actividades del transporte aéreo en los aeropuertos de Trelew, Comodoro Rivadavia y San Antonio Oeste (Yorio et al. 1998a).
Algunas técnicas de manejo como la remoción de fuentes de alimento de origen humano han sido exitosas en otros países y podrían también ser utilizadas en forma efectiva en los basurales de la Patagonia. Por ejemplo, la reducción en la abundancia de descartes de pescado disponibles para las gaviotas a través de la cobertura de los mismos y su utilización para harina de pescado resultaron en una disminución en la abundancia de Gaviota Cocinera en el basural de Rawson (Giaccardi et al. 1997). Estudios en gaviotas del Hemisferio Norte también han demostrado una reducción en el número de individuos (Patton 1988, Pons 1992) y una disminución en la fecundidad (Pons y Migot 1995, Oro et al. 1996) con la reducción de la oferta de alimento de origen humano. Los conflictos potenciales resultantes del uso de los basurales por la Gaviota Cocinera y los efectos sobre sus poblaciones podrían ser minimizados con un adecuado manejo de los residuos urbanos y pesqueros. Sin embargo, cualquiera sea la medida de manejo programada, deberían considerarse los posibles cambios en el comportamiento de alimentación de la Gaviota Cocinera que pudieran afectar a otras especies costeras a través de la predación y el cleptoparasitismo. La disminución en la provisión de alimento de origen humano puede resultar en un aumento en la predación sobre otras especies (Montevecchi 2002).
Recomendaciones
(1) Llevar a cabo un relevamiento exhaustivo durante una misma temporada reproductiva en toda la distribución geográfica de la Gaviota de Olrog, de manera de obtener una correcta estimación de la población reproductiva total de esta especie.
(2) Identificar las localidades donde se sospecha que no se detectaron colonias de Gaviota Austral durante los relevamientos debido a que allí se reproducen más tardíamente y efectuar visitas para confirmar su reproducción y evaluar los tamaños de las colonias.
(3) Establecer programas de monitoreo poblacional que incorporen sitios clave para la reproducción de las tres especies. Los monitoreos no deberían efectuarse sobre colonias aisladas, sino que deberían abarcar todas las colonias distribuidas en un sector costero relativamente extenso, de manera de poder detectar no solo cambios en las colonias individuales sino el patrón de cambios poblacionales a escala regional.
(4) Fortalecer la protección de la Gaviota de Olrog a través del uso de áreas costero-marinas protegidas. Extender el área de la Reserva Provincial Bahía San Blas y Bahía Anegada y de la Reserva Provincial Estuario Bahía Blanca, considerando particularmente el caso de la Isla del Puerto. Apoyar la creación del área protegida en el norte del Golfo San Jorge, de manera de incorporar la protección legal de las colonias de la provincia de Chubut.
(5) Identificar localidades de reproducción de las tres especies que deberían ser declaradas intangibles.
(6) En el marco de los actuales acuerdos internacionales, desarrollar una estrategia de trabajo conjunto con instituciones de Uruguay para fortalecer las acciones de conservación de la Gaviota de Olrog. En particular, coordinar esfuerzos para el análisis de los patrones de migración (ver también Silva Rodríguez et al. 2005).
(7) Implementar estudios de dinámica poblacional de las tres especies. Algunos de los aspectos sobre los cuales se carece de información en las tres especies incluyen la edad de primera reproducción, las tasas de supervivencia para las diferentes clases de edad, el porcentaje de individuos reproductivos para cada clase de edad, la fecundidad, las tasas de reclutamiento, la dispersión y fidelidad al área de cría, y la longevidad. Establecer programas de anillado de Gaviota Cocinera y Gaviota Austral, y fortalecer el programa de anillado de Gaviota de Olrog.
(8) Implementar estudios con un enfoque metapoblacional.
(9) Evaluar la variabilidad regional e interanual de los patrones temporales de reproducción y de los parámetros reproductivos básicos (e.g., tamaño de puesta, éxito de eclosión, éxito reproductivo). Transferir dicha información para su incorporación en el diseño de programas de monitoreo y manejo de poblaciones en cada localidad.
(10) Evaluar la variabilidad regional y temporal en los requerimientos ecológicos básicos de las tres especies. Implementar estudios sobre dieta, áreas de alimentación, estrategias alimentarias y requerimientos y selección de hábitat a diferentes escalas en los sectores costeros donde existen vacíos de información.
(11) Evaluar los factores que contribuyen a los cambios observados en el uso de sitios de reproducción por parte de la Gaviota de Olrog, incluyendo factores naturales y derivados de la acción del hombre (e.g., predación, disponibilidad de alimento, disturbios humanos).
(12) Efectuar estudios sobre especialización en estrategias alimentarias de la Gaviota Cocinera.
(13) Establecer un programa de monitoreo de la Gaviota Cocinera en su asociación con basurales costeros y operaciones pesqueras.
(14) Mejorar el manejo de los residuos urbanos y pesqueros en los basurales costeros y de los descartes pesqueros durante las operaciones en el mar, minimizando el alimento disponible para la Gaviota Cocinera.
(15) Explorar mecanismos de disuasión del uso de basurales por parte de la Gaviota Cocinera.
(16) Establecer un programa de monitoreo de las interacciones entre la Gaviota Cocinera y otras especies, particularmente la Gaviota de Olrog, gaviotines y la ballena franca austral, con el objeto principal de evaluar los efectos negativos de la Gaviota Cocinera sobre el éxito reproductivo y la abundancia poblacional de las otras especies. Evaluar los efectos de la expansión de la Gaviota Cocinera sobre otras especies, particularmente la interacción espacial con la Gaviota de Olrog y la Gaviota Austral.
(17) Promover estudios sobre los efectos de la contaminación en la Gaviota de Olrog en la provincia de Buenos Aires.
(18) Intensificar los estudios sobre el estado de salud de las tres especies y el papel potencial de la Gaviota Cocinera como transmisora de patógenos.
Agradecimientos. Agradecemos al Centro Nacional Patagónico por el apoyo institucional durante la elaboración de este trabajo. También agradecemos a todas las personas que a lo largo de los años han contribuido con el trabajo de campo y el análisis de la información, y a los colegas que gentilmente han contribuido con información inédita. La información proviene mayormente de trabajos publicados y de datos inéditos obtenidos en el marco de diferentes proyectos desarrollados gracias al apoyo de Wildlife Conservation Society, CONICET y Agencia Nacional de Promoción Científica y Tecnológica.
Bibliografía Citada
Albrieu C y Ferrari S (1994) Relevamiento de la fauna en la Reserva Provincial de Cabo Vírgenes, Isla Deseada y Laguna Nimes mediante el sistema de pasantías. Universidad Nacional de la Patagonia Austral y Consejo Agrario Provincial, Río Gallegos [ Links ]
Belant JL (1997) Gulls in urban environments: landscape-level management to reduce conflict. Landscape and Urban Planning 38:245–258 [ Links ]
Bertellotti M y Yorio P (1999) Spatial and temporal patterns in the diet of the Kelp Gull in northern Chubut, Patagonia. Condor 101:790–798 [ Links ]
Bertellotti M y Yorio P (2000a) Utilisation of fishery waste by Kelp Gulls attending coastal trawl and longline vessels in northern Patagonia, Argentina. Ornis Fennica 77:105–115 [ Links ]
Bertellotti M y Yorio P (2000b) Age-related feeding behaviour and foraging efficiency in Kelp Gulls Larus dominicanus attending coastal trawlers in Argentina. Ardea 88:207-214 [ Links ]
Bertellotti M y Yorio P (2001) Intraspecific host selection by kleptoparasitic Kelp Gulls in Patagonia. Waterbirds 24:182–187 [ Links ]
Bertellotti M, Yorio P, Blanco G y Giaccardi M (2001) Use of tips by nesting Kelp gulls at a growing colony in Patagonia. Journal of Field Ornithology 72:338–348 [ Links ]
BirdLife International (2004) Threatened birds of the world 2004. BirdLife International, Cambridge [ Links ]
Bó NA, Darrieu CA y Camperi AR (1995) Aves. Charadriiformes: Laridae y Rynchopidae. Pp. 1–47 en: Fauna de agua dulce de la República Argentina. Volumen 43. Fascículo 4c. PROFADU, La Plata [ Links ]
Boswall J y Prytherch RJ (1972) Some notes on the birds of Point Tombo, Argentina. Bulletin of the British Ornithologists’ Club 92:118–129 [ Links ]
Burger J y Gochfeld M (1981) Colony and habitat selection of six Kelp Gull Larus dominicanus colonies in South Africa. Ibis 123:298–310 [ Links ]
Burger J y Gochfeld M (1996) Family Laridae (gulls). Pp. 572–623 en: del Hoyo J, Elliott A y Sargatal J (eds) Handbook of the birds of the world. Volume 3. Hoatzin to auks. Lynx Edicions, Barcelona [ Links ]
Castellanos A (1935) Observaciones de algunas aves de Tierra del Fuego e Isla de los Estados. Hornero 6:22–37 [ Links ]
Chu PC (1998) A phylogeny of the gulls (Aves: Larinae) inferred from osteological and integumentary characteristics. Cladistics 14:1–43 [ Links ]
Collar N, Gonzaga L, Krabbe N, Madroño Nieto AG, Naranjo LG, Parker Ta y Wege D (1992) Threatened birds of the Americas: the ICBP Red Data Book. International Council for Bird Preservation, Cambridge [ Links ]
Daguerre JB (1933) Dos aves nuevas para la fauna argentina. Hornero 5:213–214 [ Links ]
Delhey JKV, Carrete M y Martínez M (2001a) Diet and feeding behaviour of Olrog’s Gull Larus atlanticus in Bahía Blanca, Argentina. Ardea 89:319–329 [ Links ]
Delhey JKV, Petracci PF y Grassini CM (2001b) Hallazgo de una nueva colonia de la Gaviota de Olrog (Larus atlanticus) en la ría de Bahía Blanca, Argentina. Hornero 16:39–42 [ Links ]
Devillers P (1977a) Observations at a breeding colony of Larus (belcheri) atlanticus. Gerfaut 67:22–43 [ Links ]
Devillers P (1977b) Comments on plumages and behaviour of Scoresby’s gull. Gerfaut 67:254–265 [ Links ]
Fordham RA (1964) Breeding biology of the Southern Black-backed Gull. I. Pre-egg and egg stage. Notornis 11:3–34 [ Links ]
Frere E y Gandini P (1998) Distribución reproductiva y abundancia de las aves marinas de Santa Cruz. Parte II: de Bahía Laura a Punta Dungeness. Pp. 153–177 en: Yorio P, Frere E, Gandini P y Harris G (eds) Atlas de la distribución reproductiva de aves marinas en el litoral patagónico argentino. Fundación Patagonia Natural y Wildlife Conservation Society, Buenos Aires [ Links ]
Frere E, Gandini Pa y Boersma PD (1992) Effects of nest type and location on reproductive success of the Magellanic Penguin Spheniscus magellanicus. Marine Ornithology 20:1–6 [ Links ]
Frere E, Gandini P y Martínez Peck R (2000) Gaviota Cocinera (Larus dominicanus) como vector potencial de patógenos en la costa patagónica. Hornero 15:93–97 [ Links ]
Gandini P y Frere E (1998a) Seabird and shorebird diversity in Puerto Deseado, Patagonia, Argentina and the associated conservation problems. Ornitología Neotropical 9:13–22 [ Links ]
Gandini P y Frere E (1998b) Distribución y abundancia de las aves marinas de Santa Cruz. Parte I: La Lobería a Islote del Cabo. Pp. 119–151 en: Yorio P, Frere E, Gandini P y Harris G (eds) Atlas de la distribución reproductiva de aves marinas en el litoral patagónico argentino. Fundación Patagonia Natural y Wildlife Conservation Society, Buenos Aires [ Links ]
García Borboroglu P (2003) Requerimientos, selección y partición de hábitat reproductivo en las gaviotas Cocinera (Larus dominicanus) y de Olrog (L. atlanticus). Tesis Doctoral, Universidad Nacional del Comahue, San Carlos de Bariloche [ Links ]
García Borboroglu P y Yorio P (2004a) Habitat requirements and selection by Kelp Gulls in central and northern Patagonia, Argentina. Auk 121:243–252 [ Links ]
García Borboroglu P y Yorio P (2004b) Effects of microhabitat preferences on kelp gull breeding performance. Journal of Avian Biology 35:162–169 [ Links ]
García Borboroglu P y Yorio P (2004c) Microhabitat selection by Kelp Gulls, Larus dominicanus, in Patagonia, Argentina. Emu 104:241–249 [ Links ]
Giaccardi M y Yorio P (2004) Temporal patterns of abundance and waste use by Kelp Gulls at a urban and fishery waste tip in northern coastal Patagonia, Argentina. Ornitología Neotropical 15:93–102 [ Links ]
Giaccardi M, Yorio P y Lizurume ME (1997) Patrones estacionales de abundancia de la gaviota cocinera (Larus dominicanus) en un basural patagónico y sus relaciones con el manejo de residuos urbanos y pesqueros. Ornitología Neotropical 8:77–84 [ Links ]
Gil M, Harvey M, Beldoménico H, García S, Commendatore M, Gandini P, Frere E, Yorio P, Crespo E y Esteves JL (1997) Contaminación por metales y plaguicidas organoclorados en organismos marinos de la zona costera patagónica. Informes Técnicos del Plan de Manejo Integrado de la Zona Costera Patagónica – Fundación Patagonia Natural 32:1–28 [ Links ]
González P, Bertellotti M, Giaccardi M, Lini R, Lizurume ME y Yorio P (1998) Distribución reproductiva y abundancia de las aves marinas de Río Negro. Pp. 29–37 en: Yorio P, Frere E, Gandini P y Harris G (eds) Atlas de la distribución reproductiva de aves marinas en el litoral patagónico argentino. Fundación Patagonia Natural y Wildlife Conservation Society, Buenos Aires [ Links ]
González PM (1991) Importancia de la Bahía de San Antonio y zona de influencia en el Golfo San Matías para las comunidades de aves costeras. Legislatura de la Provincia de Río Negro, San Antonio Oeste [ Links ]
González Zevallos D y Yorio P (en prensa) Seabird use of waste and incidental captures at the Argentine hake trawl fishery in Golfo San Jorge, Argentina. Marine Ecology Progress Series [ Links ]
Herrera G, Punta G y Yorio P (2005) Diet specialization of Olrog’s Gull Larus atlanticus during the breeding season at Golfo San Jorge, Argentina. Bird Conservation International 15:89–97 [ Links ]
Humphrey PS, Bridge D, Reynolds PD y Peterson RT (1970) Birds of Isla Grande (Tierra del Fuego). Smithsonian Institution, Washington DC [ Links ]
Kury CR y Gochfeld M (1975) Human interference and gull predation in cormorant colonies. Biological Conservation 8:23–34 [ Links ]
Long PD (1980) Censo de aves de la Isla de los Pájaros, Península Valdés, Provincia del Chubut, República Argentina. 16-17 de diciembre 1979. Informe Técnico. Dirección de Turismo de Chubut, Rawson [ Links ]
Malacalza VE (1987) Aspectos de la biología reproductiva de la gaviota cocinera, Larus dominicanus, en Punta León, Argentina. Physis, C 45:11–17 [ Links ]
Martínez MM, Isacch JP y Rojas M (2000) Olrog’s Gull Larus atlanticus: specialist or generalist? Bird Conservation International 10:89–92 [ Links ]
Montevecchi WA (2002) Interactions between fisheries and seabirds. Pp. 527–557 en: Schreiber EA y Burger J (eds) Biology of marine birds. CRC Press, Boca Raton [ Links ]
Moynihan M (1962) Hostile and sexual behaviour patterns of South American and Pacific Laridae. EJ Brill, Leiden [ Links ]
Olrog CC (1967) Breeding of the Band-tailed gull (Larus belcheri) on the Atlantic coast of Argentina. Condor 69:42–48 [ Links ]
Oro D, Jover L y Ruiz X (1996) Influence of trawling activity on the breeding ecology of a threatened seabird, Audouin’s gull Larus audouinii. Marine Ecology Progress Series 139:19–29 [ Links ]
Pagnoni G, Pérez D y Bertellotti M (1993) Distribución, abundancia y densidad de nidos en la Isla de los Pájaros, Chubut, Argentina. Pp. 134–141 en: Actas II Jornadas Nacionales de Ciencias del Mar ‘91. Puerto Madryn [ Links ]
Patton SR (1988) Abundance of gulls at Tampa Bay landfills. Wilson Bulletin 100:431–442 [ Links ]
Pérez F, Sutton P y Vila A (1995) Aves y mamíferos marinos de Santa Cruz. Recopilación de los relevamientos realizados entre 1986 y 1994. Boletín Técnico 26, Fundación Vida Silvestre Argentina, Buenos Aires [ Links ]
Petracci PF, La Sala LF, Aguerre G, Pérez CH, Acosta N, Sotelo M, y Pamparana C (2004) Dieta de la Gaviota Cocinera (Larus dominicanus) durante el período reproductivo en el estuario de Bahía Blanca, Buenos Aires, Argentina. Hornero 19:23–28 [ Links ]
Pons JM (1992) Effects of changes in the availability of human refuse on breeding parameters in a herring gulls Larus argentatus population in Brittany, France. Ardea 80:143–150 [ Links ]
Pons JM y Migot P (1995) Life-history strategy of the herring gull: changes in survival and fecundity in a population subjected to various feeding conditions. Journal of Animal Ecology 64:592–599 [ Links ]
Punta G (1989) Guaneras de la Provincia del Chubut. Potencialidad productiva y fundamentos para su manejo racional. Dirección de Intereses Marítimos y Pesca Continental de la Provincia del Chubut, Rawson [ Links ]
Punta G, Herrera G y Saravia J (1995) Aspectos de la biología reproductiva del ostrero negro (Haematopus ater) en las islas Isabel, Bahía Bustamante, Chubut. Hornero 14:42–44 [ Links ]
Quintana F y Yorio P (1998a) Kelp Gull Larus dominicanus predation on an Imperial Cormorant Phalacrocorax atriceps colony in Patagonia. Marine Ornithology 26:84–85 [ Links ]
Quintana F y Yorio P (1998b) Competition for nest sites between Kelp Gulls (Larus dominicanus) and Terns (Sterna maxima and S. eurygnatha) in Patagonia. Auk 115:1068–1075 [ Links ]
Quintana F y Yorio P (1999) Kleptoparasitism by Kelp Gulls on Royal and Cayenne terns at Punta León, Argentina. Journal of Field Ornithology 70:337–342 [ Links ]
Quintana RD y Travaini A (2000) Characteristics of nest sites of skuas and kelp gull in the Antarctic Peninsula. Journal of Field Ornithology 71:236–249 [ Links ]
Rábano D, García Borboroglu P y Yorio P (2002) Nueva localidad de reproducción de la Gaviota de Olrog Larus atlanticus en la provincia de Buenos Aires, Argentina. Hornero 17:105–107 [ Links ]
Reid WV (1987) Constraints on clutch size in the glaucous-winged gull. Studies in Avian Biology 10:8–25 [ Links ]
Rowntree VJ, McGuinness P, Marshall K, Payne R, Sironi M y Seger J (1998) Increased harassment of right whales (Eubalaena australis) by kelp gulls (Larus dominicanus) at Península Valdés, Argentina. Marine Mammal Science 14:99–115 [ Links ]
Schiavini A y Yorio P (1995) Distribution and abundance of seabird colonies in the Argentine sector of the Beagle Channel, Tierra del Fuego. Marine Ornithology 23:39–46 [ Links ]
Schiavini A, Yorio P y Frere E (1998) Distribución reproductiva y abundancia de las aves marinas de la Isla Grande de Tierra del Fuego, Isla de los Estados e Islas de Año Nuevo (Provincia de Tierra del Fuego, Antártida e Islas del Atlántico Sur). Pp. 179–221 en: Yorio P, Frere E, Gandini P y Harris G (eds) Atlas de la distribución reproductiva de aves marinas en el litoral patagónico argentino. Fundación Patagonia Natural y Wildlife Conservation Society, Buenos Aires [ Links ]
Silva Rodríguez MP, Favero M, Berón MP, Mariano-Jelicich R y Mauco L (2005) Ecología y conservación de aves marinas que utilizan el litoral bonaerense como área de invernada. Hornero 20:111–130 [ Links ]
Spaans AL y Blokpoel H (1991) Concluding remarks. Superabundance in gulls: causes, problems and solutions. Pp. 2396–2398 en: Bell BD, Cossee RO, Flux JEC, Heather BD, Hitchmough RA, Robertson CJR y Williams MJ (eds) Acta XX Congressus Internationalis Ornithologici. New Zealand Ornithological Congress Trust Board, Wellington [ Links ]
Suárez N y Yorio P (2005) Foraging patterns of breeding Dolphin Gulls Larus scoresbii at Punta Tombo, Argentina. Ibis 147:544–551 [ Links ]
Sutton P, Heinonen Fortabat S, Gil G, Bos A y Chebez JC (1988) Relevamiento de las colonias de nidificación de aves marinas del litoral marítimo de Santa Cruz, Argentina. Fundación Vida Silvestre Argentina, Buenos Aires [ Links ]
Thomas PO (1988) Kelp Gulls, Larus dominicanus, are parasites on flesh of the right whale, Eubalaena australis. Ethology 79:89–103 [ Links ]
Vila A y Bertonatti C (1993) Situación ambiental de la Argentina. Recomendaciones y prioridades de acción. Boletín Técnico 14, Fundación Vida Silvestre Argentina, Buenos Aires [ Links ]
Vila AR y Pérez F (1996) Apostaderos de aves y mamíferos marinos de Monte Loayza, Santa Cruz: pautas de manejo frente al potencial uso turístico del área. Informes Técnicos del Plan de Manejo Integrado de la Zona Costera Patagónica – Fundación Patagonia Natural 15:1–57 [ Links ]
Yorio P (1998) Zona costera patagónica. Pp. 137–167 en: Canevari P, Blanco DE, Bucher EH, Castro G y Davidson I (eds) Los humedales de la Argentina. Clasificación, situación actual, conservación y legislación. Wetlands International, Buenos Aires [ Links ]
Yorio P (2000) Breeding seabirds of Argentina: conservation tools for a more integrated and regional approach. Emu 100:367–375 [ Links ]
Yorio P y Bertellotti M (2002) Espectro trófico de la Gaviota Cocinera (Larus dominicanus) en tres áreas protegidas de Chubut, Argentina. Hornero 17:91–95 [ Links ]
Yorio P, Bertellotti M, Gandini P y Frere E (1998a) Kelp gulls Larus dominicanus breeding on the Argentine coast: population status and relationship with coastal management and conservation. Marine Ornithology 26:11–18 [ Links ]
Yorio P, Bertellotti M, García Borboroglu P, Carribero A, Giaccardi M, Lizurume ME, Boersma D y Quintana F (1998b) Distribución reproductiva y abundancia de las aves marinas de Chubut. Parte I: de Península Valdés a Islas Blancas. Pp. 39–73 en: Yorio P, Frere E, Gandini P y Harris G (eds) Atlas de la distribución reproductiva de aves marinas en el litoral patagónico argentino. Fundación Patagonia Natural y Wildlife Conservation Society, Buenos Aires [ Links ]
Yorio P, Bertellotti M y Quintana F (1995) Preference for covered nest sites and breeding success in kelp gulls Larus dominicanus. Marine Ornithology 25:121–128 [ Links ]
Yorio P y Boersma PD (1994) Consequences of nest desertion and inattendance for Magellanic Penguin hatching success. Auk 111:215–218 [ Links ]
Yorio P y Caille G (1999) Seabird interactions with coastal fisheries in northern Patagonia: use of discards and incidental captures in nets. Waterbirds 22:207–216 [ Links ]
Yorio P y Caille G (2004) Fish waste as an alternative resource for gulls along the Patagonian coast: availability, use, and potential consequences. Marine Pollution Bulletin 43:778–783 [ Links ]
Yorio P, Frere E, Gandini P y Conway W (1999) Status and conservation of seabirds breeding in Argentina. Bird Conservation International 9:299–314 [ Links ]
Yorio P, Frere E, Gandini P y Harris G (1998c) Atlas de la distribución reproductiva de aves marinas en el litoral patagónico argentino. Fundación Patagonia Natural y Wildlife Conservation Society, Buenos Aires [ Links ]
Yorio P, Frere E, Gandini P y Schiavini A (2001a) Tourism and recreation at seabird breeding sites in Patagonia, Argentina: current concerns and future prospects. Bird Conservation International 11:231–245 [ Links ]
Yorio P, Gandini P, Frere E y Giaccardi M (1996a) Uso de basurales urbanos por gaviotas: magnitud del problema y metodologías para su evaluación. Informes Técnicos del Plan de Manejo Integrado de la Zona Costera Patagónica – Fundación Patagonia Natural 22:1–24 [ Links ]
Yorio P y García Borboroglu P (2002) Breeding biology of Kelp Gulls (Larus dominicanus) at Golfo San Jorge, Patagonia, Argentina. Emu 102:1–7 [ Links ]
Yorio P, García Borboroglu P, Bertellotti M, Lizurume ME, Giaccardi M, Punta G, Saravia J, Herrera G, Sollazzo S y Boersma D (1998d) Distribución reproductiva y abundancia de las aves marinas de Chubut. Parte II: norte del Golfo San Jorge, de Cabo Dos Bahías a Comodoro Rivadavia. Pp. 76–117 en: Yorio P, Frere E, Gandini P y Harris G (eds) Atlas de la distribución reproductiva de aves marinas en el litoral patagónico argentino. Fundación Patagonia Natural y Wildlife Conservation Society, Buenos Aires [ Links ]
Yorio P y Giaccardi M (2002) Urban and fishery waste tips as food sources for birds in northern coastal Patagonia, Argentina. Ornitología Neotropical 13:283–292 [ Links ]
Yorio P y Harris G (1992) Actualización de la distribución reproductiva, estado poblacional y de conservación de la Gaviota de Olrog (Larus atlanticus). Hornero 13:200–202 [ Links ]
Yorio P y Harris G (1997) Distribución reproductiva de aves marinas y costeras coloniales en Patagonia: relevamiento aéreo Bahía Blanca-Cabo Vírgenes, noviembre 1990. Informes Técnicos del Plan de Manejo Integrado de la Zona Costera Patagónica - Fundación Patagonia Natural 29:1–31 [ Links ]
Yorio P, Punta G, Rábano D, Rabuffetti F, Herrera G, Saravia J y Friedrich P (1997) Newly discovered breeding sites of Olrog’s Gull Larus atlanticus in Argentina. Bird Conservation International 7:161–165 [ Links ]
Yorio P y Quintana F (1996) Efectos del disturbio humano sobre una colonia mixta de aves marinas en Patagonia. Hornero 14:89–96 [ Links ]
Yorio P y Quintana F (1997) Predation by Kelp Gulls Larus dominicanus at a mixed-species colony of Royal and Cayenne Terns Sterna maxima and S. eurygnatha in Patagonia. Ibis 139:536–541 [ Links ]
Yorio P, Quintana F, Campagna C y Harris G (1992) Ecology and conservation of seabirds and marine mammals at Punta León, Chubut. Final Report (1989–1991). Wildlife Conservation International, Nueva York [ Links ]
Yorio P, Quintana F, Campagna C y Harris G (1994) Diversidad, abundancia y dinámica espacio-temporal de la colonia mixta de aves marinas en Punta León, Patagonia. Ornitología Neotropical 5:69–77 [ Links ]
Yorio P, Quintana F, Gatto A, Lisniser N y Suárez N (2004) Foraging patterns of breeding Olrog’s Gull at Golfo San Jorge, Argentina. Waterbirds 27:193–199 [ Links ]
Yorio P, Rábano DE y Friedrich P (2001b) Habitat and nest site characteristics of Olrog’s Gull Larus atlanticus breeding at Bahía San Blas, Argentina. Bird Conservation International 11:25–32 [ Links ]
Yorio P, Rábano D, Rabuffetti F, Friedrich P y Harris G (1998e) Distribución reproductiva y abundancia de las aves marinas de la Provincia de Buenos Aires: de Bahía Blanca a Punta Redonda. Pp. 19–28 en: Yorio P, Frere E, Gandini P y Harris G (eds) Atlas de la distribución reproductiva de aves marinas en el litoral patagónico argentino. Fundación Patagonia Natural y Wildlife Conservation Society, Buenos Aires [ Links ]
Yorio P, Swann S y Boersma PD (1996b) Breeding biology of the dolphin gull (Larus scoresbii) at Punta Tombo, Argentina. Condor 98:208–215 [ Links ]
Zapata A (1965) Nuevas localidades de nidificación de Leucophaeus scoresbii y Sterna sandvicensis eurygnatha. Physis 25:383–385 [ Links ]














