Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
El hornero
Print version ISSN 0073-3407On-line version ISSN 1850-4884
Hornero vol.20 no.2 Buenos Aires Sept./Dec. 2005
Aves frugívoras de un relicto de selva subtropical ribereña en Argentina: manipulación de frutos y destino de las semillas
Norberto H. Montaldo
Cátedra de Botánica, Depto. de Recursos Naturales y Ambiente, Facultad de Agronomía, Universidad de Buenos Aires. Av. San Martín 4453, C1417DSE Buenos Aires, Argentina. montaldo@agro.uba.ar
Resumen
Se estudió la forma de manipulación del fruto de las principales especies de aves frugívoras de la selva ribereña de Punta Lara y el destino que siguen las semillas. En experimentos de alimentación se utilizaron 5 especies de aves (un individuo de cada una) y 12 especies de plantas ornitócoras (11 de ellas comunes en Punta Lara) con frutos o semillas que ofrecían amplia variación morfológica. Además, se realizaron observaciones de campo sobre el comportamiento de alimentación y la dispersión de semillas, y se capturaron varios individuos con redes de niebla. La forma de ingestión del fruto y el destino de las semillas varió con el tipo de ave. Las semillas grandes fueron regurgitadas o destruidas por las aves que tragan el fruto entero y descartadas por las que lo aplastan en el pico previo a la ingestión, mientras que las pequeñas fueron defecadas. El tipo de pulpa, su grado de adherencia a la semilla y el tipo de envoltura seminal también influyeron sobre las posibilidades de dispersión. Los datos confirman que el papel del ave frugívora y su calidad como dispersora dependen de su morfología y comportamiento y, fuertemente, de las características de la diáspora.
Palabras clave: Aves frugívoras; Dispersión de semillas; Frugivoría; Frutos carnosos; Ornitocoria.
Abstract
Fruit-eating birds of a subtropical riparian forest relic in Argentina: fruit-handling methods and seed fate
Fruit-handling methods by the most important fruit-eating birds of the Punta Lara riparian forest and seed fate were studied. Feeding experiments were conducted involving 5 species of birds (each one represented by an individual) and 12 species of ornithochorous plants (11 of them common at the Punta Lara forest) with fruits or seeds that showed ample variation in their morphological traits. Feeding behaviour and seed dispersal were also observed in the wild and several individuals were captured with mist nets. The mode of fruit handling and seed fate varied with the bird type. Larger seeds were regurgitated or destroyed by birds that swallow whole fruits and dropped by those that crush the fruits in their bills prior to consumption, while the small seeds were defecated. Pulp type, degree of adhesion of pulp to seed, and type of seed coating influenced seed dispersal ability. The results confirm that the bird's role as frugivore and its quality as seed disperser, while influenced by avian behaviour and morphology, are heavily dependent on plant dispersal-related traits.
Key words: Fleshy fruits; Frugivory; Fruit-eating birds; Ornithochory; Seed dispersal.
Recibido 14 junio 2002, versión corregida recibida 30 noviembre 2004, aceptado 16 septiembre 2005
Considerando el procesamiento que hacen de los frutos y las consecuencias potenciales para la dispersión de semillas, existen tres tipos básicos de aves frugívoras: (1) las dispersoras legítimas, que tragan el fruto entero y regurgitan o defecan las semillas intactas; (2) las predadoras de pulpa, que arrancan trozos mientras el fruto está suspendido del pedicelo o lo aplastan con el pico y aprovechan solo la pulpa, descartando las semillas (y si bien no las dañan, tampoco las dispersan en forma efectiva porque caen debajo de la planta madre); y (3) las predadoras de semillas, que las extraen del fruto y las trituran para ingerirlas (desechando la pulpa) o bien tragan el frutoíntegro y digieren el conjunto de pulpa y semillas (Jordano 1992; ver también Snow 1971 y Herrera 1984a, 1984b). Las formas en que las aves frugívoras ingieren o manipulan los frutos (y por ende el destino que siguen las semillas) tienen consecuencias potencialmente importantes tanto para las aves como para las plantas involucradas (Moermond y Denslow 1985, Levey 1987). Como los ensambles de frugívoros con frecuencia incluyen aves de las tres categorías, se podría esperar que el éxito de dispersión de semillas varíe de acuerdo con la importancia relativa de cada grupo (Jordano 1995). El manejo que recibe el fruto depende principalmente de rasgos intrínsecos de la interacción planta-ave; por ejemplo, el tamaño y la variedad de frutos que un ave puede incluir en la dieta está limitado fuertemente por la amplitud de sus fauces (Wheelwright 1985) y también influyen otros aspectos de su morfología (Jordano 1987). Además, las dimensiones de la semilla explican la mayor parte de la variación existente en la forma de ingestión, cantidad de alimento consumido, forma de dispersión y el papel que el frugívoro puede cumplir (Levey 1987).
Las interacciones entre las plantas dispersadas por animales y los vertebrados que se alimentan de sus diásporas deben ser corroboradas en cada caso particular, porque un dispersor puede tener esta relación mutualista con algunas especies y ser predador de otras (Herrera 2002). Sin embargo, cuando se comparan conjuntos de especies de aves y de plantas se pueden establecer algunos patrones generales de interacción (e.g., la relación entre el tamaño de la semilla y el tipo de procesamiento; Wheelwright 1985, Levey 1987). La selva de Punta Lara es un buen lugar para hacer este tipo de comparaciones por la diversidad de plantas con frutos carnosos y de aves frugívoras que alberga (Montaldo 2000). Además, estas aves tienen amplia distribución en Argentina (Narosky e Yzurieta 2003) y América del Sur (Meyer de Schauensee 1982) y consumen frutos de una gran variedad de plantas (e.g., Figueiredo et al. 1995, Argel de Oliveira y Figueiredo 1996, Aragón 2000, Rougès y Blake 2001), por lo que las conclusiones obtenidas podrían ser aplicadas o cotejadas en otras áreas. Los objetivos de este trabajo fueron: (1) interpretar cuál es el papel de las principales especies de aves frugívoras de la selva en su interacción con las plantas, y (2) identificar las características de las diásporas que influyen sobre el comportamiento de las aves, determinando la magnitud y el resultado de las interacciones en términos de eficacia biológica y demografía de las plantas (dispersión).
MétodosLa Reserva de Punta Lara, ubicada en la provincia de Buenos Aires (34°47'S, 58°01'O), alberga el relicto más meridional de las selvas subtropicales americanas y, por ello, se trata de un ecosistema empobrecido (Cabrera 1960). El principal núcleo selvático ocupa aproximadamente 10 ha y se encuentra ubicado sobre la ribera del Río de la Plata, constituyendo una prolongación de la Selva Paranaense que, en forma de galerías, sigue los cursos de los ríos Paraná y Uruguay (Cabrera 1976). El estrato arbóreo incluye unas 16 especies nativas (Cabrera y Dawson 1944), 9 de las cuales tienen síndrome de ornitocoria (i.e., de dispersión por aves; Van der Pijl 1982), y está invadido por Ligustrum lucidum (ligustro), una planta originaria de China y muy consumida por las aves de la zona (Montaldo 1993). Las especies más comunes son Ocotea acutifolia (laurel), Allophyllus edulis (chal-chal), Pouteria salicifolia (mata ojo) y Sebastiania brasiliensis (blanquillo), pero también son frecuentes Lonchocarpus nitidus (yerba del bugre), Citharexylum montevidense (espina de bañado), Myrsine laetevirens (canelón) y Blepharocalyx salicifolius (anacahuita). Los claros de la selva fueron colonizados por Rubus ulmifolius (zarzamora), arbusto nativo de la Región Mediterránea dispersado principalmente por aves frugívoras (Jordano 1982).
Según Klimaitis y Moschione (1987), en la selva de Punta Lara se encuentran unas 37 especies de aves, 18 de las cuales tienen hábitos frugívoros conocidos (Sick 1986). Una especie migratoria (Elaenia parvirostris) y otras siete residentes son los principales frugívoros de la comunidad (Montaldo 2000). Se mantuvo un individuo cautivo de cinco de estas especies (Columba picazuro, Pitangus sulphuratus, Turdus rufiventris, Stephanophorus diadematus y Thraupis sayaca), que representan a todas las familias involucradas. Las aves se mantuvieron en jaulas individuales y se les dio alimento balanceado (a Columba picazuro se le dio una mezcla para palomas). Estas especies fueron seleccionadas por su abundancia en el área (Klimaitis y Moschione 1987) y porque pertenecen a grupos que, a priori, difieren en la forma de ingerir los frutos y de procesar las semillas (Foster 1987, Levey 1987) o en la morfología y anatomía del aparato digestivo (Ziswiler y Farner 1972). Los cinco individuos que se utilizaron en las pruebas de alimentación controlada fueron obtenidos en diferentes momentos y de diversas fuentes a lo largo del estudio. Dos se capturaron en Punta Lara (Pitangus sulphuratus y Turdus rufiventris), otro (Columba picazuro) fue capturado y cedido en préstamo por un criador de palomas y los dos restantes (Stephanophorus diadematus y Thraupis sayaca) se compraron en pajarerías. El distinto origen y el pequeño número de individuos experimentales podrían restringir la validez de los resultados de este estudio. Sin embargo, las observaciones de campo y los antecedentes bibliográficos (e.g., Foster 1987, Levey 1987) señalan una baja variación intraespecífica en la forma en que las aves frugívoras manipulan su alimento y en el papel (dispersión, predación) que tienen. Por tal motivo, los resultados obtenidos serían potencialmente extrapolables a toda la población, al menos en el área de trabajo y sus cercanías. El período de cautividad varió con la especie (desde un mes en Columba picazuro y Thraupis sayaca hasta casi un año en Pitangus sulphuratus, Turdus rufiventris y Stephanophorus diadematus). El tiempo fue breve para las aves que se alimentaron con pocas especies de plantas (disponibles simultáneamente), pero debió prolongarse en el caso de las que se alimentaron con varias plantas no disponibles al mismo tiempo.
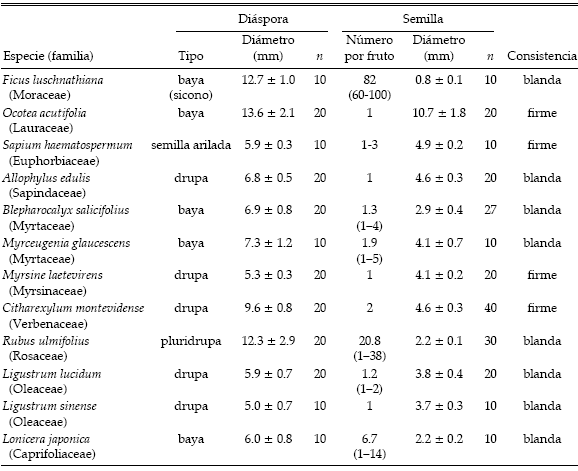
A los individuos cautivos se les dieron frutos (incluyendo una semilla arilada, Sapium haematospermum) de 11 especies de plantas que son comunes en la selva de Punta Lara. No se suministraron todas las plantas a todas las aves, sino que se procuró cubrir las principales interacciones observadas en el campo (ver más adelante). Además, en las pruebas se incorporó Ficus luschnathiana (= F. monckii), porque se la consideró una especie de interés por varios motivos: posee un tamaño de “semilla” menor que las otras, es muy apetecida por las aves (Figueiredo y Perin 1995, obs. pers.), integra las selvas ribereñas que llegan hasta las cercanías de Punta Lara (Delta del Paraná) y está ampliamente distribuida en los sistemas selváticos de América del Sur (Cabrera 1976). En este trabajo se emplea el término “semilla” en sentido amplio, incluyendo a los aquenios (Ficus luschnathiana) y a las que están encerradas en un endocarpo esclerificado (frutos drupa). Las plantas elegidas ofrecen una amplia variación en las características de sus diásporas, en la morfología del fruto y de la semilla y en el número de semillas por fruto (Tabla 1).
Tabla 1. Características de las diásporas, de las semillas y consistencia de la pulpa (o el arilo) de las plantas de la selva de Punta Lara utilizadas en los experimentos. Se muestran los valores promedio ± DE para los diámetros y el promedio y el rango (entre paréntesis) para el número de semillas por fruto. La pulpa se clasificó según un criterio arbitrario (Levey 1987).
Se desarrollaron experimentos de alimentación en un aviario externo con piso de cemento alisado (3×2×2 m y división central removible). Las aves eran transportadas al aviario el día previo a cada experiencia y cuando ya tenían por lo menos una semana de aclimatación en las jaulas. El piso fue cubierto con papel de diario parcialmente humedecido, sobre el cual se colocaron los comederos. Si a un ave se le suministró un material vegetal, se lo hizo en al menos tres oportunidades. La cantidad de frutos o semillas ofrecidas por vez fue variable, dependiendo de su disponibilidad. Transcurridos 15 min se retiraron los comederos, se contó el número de frutos consumidos y se verificó la presencia de semillas liberadas, estableciendo su origen (e.g., defecadas, regurgitadas). A los 30 y 45 min de iniciada la experiencia se repitió la verificación. Simultáneamente, el comportamiento de las aves fue observado con binoculares desde una casilla ubicada a 5 m del aviario. También en varias ocasiones en las jaulas se ofrecieron algunos de los materiales experimentales; las jaulas poseían comederos colgantes y fueron colocadas en un patio. Se siguió un protocolo similar al del aviario y el comportamiento fue observado desde el interior de una habitación. La utilización de estos dos protocolos de alimentación (en aviario y en jaula) respondió a que fue imposible mantener a las aves en forma permanente en el aviario, por limitaciones logísticas (disponibilidad de espacio y de personal) y por razones de seguridad (vandalismo y presencia de predadores). Los datos obtenidos con ambos protocolos se presentan en forma acumulativa (como el porcentaje del total).
Entre 1990 y 1997 se hicieron observaciones en el campo. Durante la época de fructificación de las plantas se capturaron individuos (n = 13) con redes de niebla, que fueron retenidos durante 30 min en bolsas de nylon negro para obtener sus deyecciones o regurgitados. En forma quincenal o mensual se recorrieron en la selva (a media mañana y al atardecer) dos transectas de aproximadamente 300 m, observando con binoculares el comportamiento de alimentación (la forma de manipular el fruto, la ocurrencia de regurgitación, la defecación o el descarte de semillas). Debajo de las plantas donde se alimentaban las aves se evaluó la existencia de deyecciones frescas, bolos de regurgitación, semillas limpias sin restos de pulpa (i.e., regurgitadas o descartadas, estas últimas muchas veces con algún resto) y partes de pericarpos de frutos. En particular para Leptotila verreauxi se inspeccionó el terreno debajo de los sitios de descanso o dormideros. El tiempo total de observación superó las 200 h y se examinaron más de 1500 muestras. Para complementar los datos morfológicos y el peso de las aves se consultó la colección de pieles del Museo Argentino de Ciencias Naturales “Bernardino Rivadavia” (especímenes provenientes de la provincia de Buenos Aires).
El efecto del tamaño de la semilla sobre su destino se evaluó mediante un Análisis de Correlación de Spearman entre el tamaño y la proporción de semillas regurgitadas (en las aves que son dispersoras legítimas de semillas: Turdus rufiventris y Pitangus sulphuratus), la proporción de semillas destruidas (en Columba picazuro, un predador de semillas) y la proporción de semillas descartadas (en Stephanophorus diadematus, un predador de pulpa) por los individuos cautivos. Como a Thraupis sayaca (también consumidor de pulpa) sólo se le suministraron frutos de dos especies de plantas, las cantidades de semillas descartadas vs. las ingeridas fueron comparadas con la Prueba de Chi-cuadrado. En las interacciones Ocotea acutifolia-Turdus rufiventris y Citharexylum montevidense- Stephanophorus diadematus, de particular interés por los comportamientos observados en las aves (ver más adelante), se utilizó la Prueba de t de Student para dos muestras independientes para evaluar las diferencias entre las dimensiones de las diásporas y las de las fauces. Previamente se comprobó el ajuste de las variables a la distribución normal (Prueba de Kolmogorov-Smirnov) y la homogeneidad de las varianzas (Prueba de Bartlett).
Resultados
Seis de las principales aves frugívoras de la selva de Punta Lara ingieren los frutos íntegros, mientras que otras dos los desintegran en el pico (Tabla 2). Las fauces de cuatro de las especies son lo suficientemente anchas como para ingerir diásporas de todas las plantas, mientras que las restantes tienen limitaciones en este sentido (Fig. 1). Columba picazuro es mucho más pesada que el resto de los integrantes del gremio, lo que podría dificultar su acceso a frutos ofrecidos en el extremo de ramas delgadas. Leptotila verreauxi también supera los 200 g pero, a diferencia de la anterior, nunca se la observó consumir frutos sobre las plantas.
Tabla 2. Longitud del pico (culmen), ancho de fauces (comisura rictal), peso y forma de ingestión de frutos de las principales aves frugívoras de la selva de Punta Lara. Se muestran los valores promedio ± DE, con el número de muestra entre paréntesis.

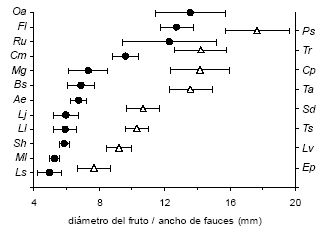
Figura 1. Comparación entre el diámetro del fruto de las plantas utilizadas en los experimentos (círculos negros) y el ancho de fauces de las principales aves frugívoras (triángulos blancos) de la selva de Punta Lara. Se muestran los valores promedio ± DE. Oa: Ocotea acutifolia, Fl: Ficus luschnathiana, Ru: Rubus ulmifolius, Cm: Citharexylum montevidense, Mg: Myrceugenia glaucescens, Bs: Blepharocalyx salicifolius, Ae: Allophylus edulis, Lj: Lonicera japonica, Ll: Ligustrum lucidum, Sh: Sapium haematospermum (semilla arilada), Ml: Myrsine laetevirens, Ls: Ligustrum sinense, Ps: Pitangus sulphuratus, Tr: Turdus rufiventris, Cp: Columba picazuro, Ta: Turdus amaurochalinus, Sd: Stephanophorus diadematus, Ts: Thraupis sayaca, Lv: Leptotila verreauxi, Ep: Elaenia parvirostris.
Cuatro de las plantas poseen frutos de 10 mm o más, que no pueden ser ingeridos por frugívoros pequeños que tragan el fruto entero (e.g., Elaenia parvirostris; Fig. 1). En Ficus y Rubus las semillas son chicas y la pulpa blanda (Tabla 1), mientras que Ocotea y Citharexylum tienen semillas grandes y pulpa firme (en la última fuertemente adherida al endocarpo). En las tres primeras el tamaño del fruto restringiría el elenco de dispersores a aves de fauces grandes, mientras que Citharexylum podría interactuar con mayor número de especies, aunque las características mencionadas dificultarían la manipulación del fruto por parte de Thraupis sayaca y Stephanophorus diadematus, que despedazan o aplastan los frutos antes de ingerirlos (Tabla 2). El resto de las especies tiene diásporas suficientemente pequeñas como para ser consumidas por todos los frugívoros del área (Fig. 1).
Experimentación con aves cautivas
Turdus rufiventris.— Esta especie dispersa todas las semillas que ingiere, ya sea defecándolas o regurgitándolas (Tabla 3) entre los 10-30 min de la ingestión. Las semillas son regurgitadas aisladas y se halló una correlación positiva entre el tamaño de la semilla y la proporción de semillas regurgitadas (Correlación de Rangos de Spearman, rs = 0.95, P < 0.01, n = 12).
Tabla 3. Destino de las semillas (en porcentaje) y número total de frutos ingeridos (semillas en el caso de Sapium haematospermum) por parte de las distintas aves frugívoras de la selva de Punta Lara en condiciones experimentales. Las especies de plantas están ordenadas por tamaño decreciente de sus semillas. REG: regurgitadas, DEF: defecadas enteras, DSC: descartadas, DST: destruidas o defecadas deterioradas.
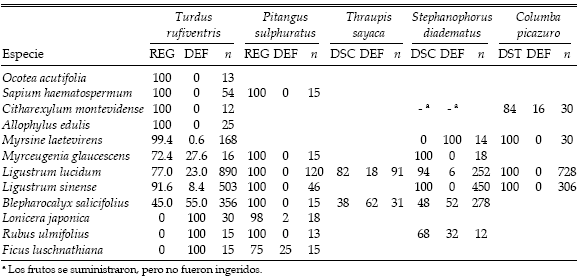
Pitangus sulphuratus.— También dispersa todas las semillas ingeridas (Tabla 3), pero lo hace casi exclusivamente regurgitando bolos que incluyen los restos no digeridos del pericarpo. Las semillas son eliminadas a los 10-15 min de la ingestión del fruto y su tamaño influye en la vía de eliminación (rs = 0.71, P < 0.05, n = 8), ya que solo aparecen en las deyecciones cuando son muy pequeñas (menores a 1-2 mm, como Ficus y Lonicera; Tabla 1).
Thraupis sayaca.— A diferencia de las anteriores (que tragan el fruto íntegro), esta especie desintegra el fruto en el pico para descartar las semillas. Las semillas que ingiere son dispersadas íntegras en las heces, donde comienzan a aparecer luego de transcurridos 10-20 min. De las dos especies que se le suministraron (Tabla 3), la de mayor tamaño de semilla (Ligustrum lucidum) resultó desfavorecida, con más descarte y menor dispersión (χ2 = 38.28, P < 0.01, n = 203).
Stephanophorus diadematus.— Su comportamiento es semejante al de Thraupis sayaca en la forma de manejar los frutos, el tratamiento que sufren las semillas y el tiempo en que permanecen en el tracto digestivo. Tomando el conjunto de las plantas que consumió (Tabla 3), el destino de las semillas no tuvo relación con su tamaño (i.e., no aumentó el descarte a mayor tamaño; rs = -0.03, P > 0.05, n = 6). Este resultado es atribuible a que todas las semillas de Myrsine (que tienen el mayor diámetro) fueron defecadas, mientras que todas las de Myrceugenia (tan grandes como las anteriores; Tabla 1) y Ligustrum sinense (algo menores) fueron descartadas. A diferencia de las otras especies, en Myrsine la pulpa es firme y está fuertemente adherida al endocarpo, por lo que Stephanophorus diadematus ingiere el fruto entero. Si se excluye a Myrsine del análisis se observa una relación positiva entre el destino de la semilla y su tamaño (rs = 0.72, P > 0.10, n = 5). Si bien esta tendencia no es significativa, concuerda con el patrón hallado en Thraupis sayaca, verificándose además que las dos semillas más pequeñas fueron menos descartadas (Tabla 3). Los frutos de Citharexylum no fueron ingeridos por Stephanophorus diadematus (Tabla 3), a pesar de que son algo menores que el ancho de sus fauces (t24= 2.62, P < 0.05; Tablas 1 y 2). Estos frutos tienen características de pulpa similares a los de Myrsine pero mayor tamaño (Tabla 1) y caen del pico antes de que el ave consiga engullirlos. Al ofrecérsele Rubus, cuyos frutos pueden ser todavía más grandes pero poseen pulpa blanda, el ave consiguió tragar buena parte de cada fruto (Tabla 3).
Columba picazuro.— Al igual que Turdus rufiventris y Pitangus sulphuratus ingiere los frutos íntegros, pero es fundamentalmente un predador de semillas (las destruye) y su rutina de alimentación es muy diferente. Llena el buche comiendo mucho alimento de una vez y luego permanece largos períodos digiriendo, posada en una percha. Aunque no se midió el tiempo transcurrido, la presencia de heces con restos de los materiales suministrados siempre ocurrió con posterioridad al lapso controlado en cada experiencia (45 min, ver Métodos). Solo algunos carozos de Citharexylum aparecieron enteros en las deyecciones (Tabla 3). Son los de mayor tamaño entre las drupas ofrecidas (rs = -0.77, P > 0.05, n = 4; Tabla 1), pero a la vez el endocarpo es mucho más duro y resistente que en las otras especies (obs. pers.) que sufrieron una destrucción total de sus diásporas.
Observaciones de campo
La observación de individuos de Turdus rufiventris (n = 25) alimentándose en la selva en árboles de Ocotea permitió comprobar que muchos frutos se les caen al manipularlos y, entonces, que las semillas no son dispersadas (i.e., alejadas del árbol parental). Estos frutos se encuentran en el extremo de ramas delgadas y deben ser tomados principalmente en vuelo; tienen pulpa firme y una gran semilla y no hay diferencias importantes entre el tamaño de los frutos y el de las fauces (t24= 0.62, P > 0.05; Tablas 1 y 2), todos factores que dificultarían la ingestión. En tres ocasiones se encontraron grupos de Stephanophorus diadematus (n = 15) que ingerían frutos enteros de Myrsine (de igual forma que lo hizo el individuo cautivo) y las deyecciones de un individuos de Thraupis sayaca capturado contenían semillas de esta especie. En Blepharocalyx ambas especies pueden descartar partes duras del pericarpo (= “cáscara”), además de las semillas, hecho no registrado en las pruebas de alimentación controlada. Elaenia parvirostris y Turdus amaurochalinus tienen comportamientos similares a los representantes de sus respectivas familias que estuvieron cautivos (Pitangus sulphuratus y Turdus rufiventris, respectivamente). En particular para Elaenia parvirostris, las observaciones de individuos (n = 37) alimentándose en Allophylus, Blepharocalyx y Myrsine, y la inspección del terreno bajo las copas (ver Métodos), sugieren que dispersa las semillas fundamentalmente por regurgitación (tampoco se encontraron semillas en las heces de un individuo capturado) y que no las elimina agrupadas (como lo hace Pitangus sulphuratus) sino en forma individual. Las dos palomas que habitan la selva de Punta Lara tienen distinto comportamiento: Columba picazuro se alimenta en lo alto de los árboles fructificados e interactúa por lo menos con tres especies de plantas (Montaldo 2000), mientras que Leptotila verreauxi se alimenta en el suelo y al parecer solo ingiere frutos caídos de Ligustrum. Nunca se encontraron semillas en las deyecciones de Leptotila verreauxi (n = 3 posaderos, ver Métodos). Las deyecciones de Columba picazuro no pudieron ser analizadas en el terreno porque no se hallaron sitios de descanso. En Punta Lara esta especie visitaría los núcleos selváticos principalmente para alimentarse (obs. pers.), aunque también puede nidificar en ellos (Klimaitis y Moschione 1987).
Discusión
En la selva de Punta Lara las especies de la familia Turdidae (Turdus amaurochalinus y Turdus rufiventris) son buenos vectores para la mayoría de las plantas ornitócoras, como ocurre con frecuencia en los hábitats templados (Herrera 2002). Son los principales dispersores de semillas del sistema y la forma de dispersión está condicionada por el tamaño de semilla (regurgitan las grandes y defecan las más pequeñas). Si bien es habitual que una proporción de las semillas ingeridas por Turdus spp. sea regurgitada debajo de la misma planta (Sallabanks 1992, obs. pers.) y que parte de los frutos arrancados caigan durante la manipulación (uno de cada cinco, Sallabanks 1992, 1993; 20-30%, Obeso y Fernández-Calvo 2002), en Punta Lara se comprobó que para ciertas especies de plantas (e.g., Ocotea) su eficiencia como dispersores sería menor, porque la pérdida de frutos puede ser muy elevada (aproximadamente 50%; Montaldo 2000) por un manejo deficiente del fruto atribuible a sus características y accesibilidad. A tal punto a Turdus rufiventris le resulta difícil el manejo de los frutos de Ocotea, que cuando los encuentra caídos en el suelo muchas veces intenta picar pedazos del pericarpo en lugar de consumirlos enteros (obs. pers.; ver también Rey y Gutiérrez 1996).
Las dos especies de Tyrannidae (Pitangus sulphuratus y Elaenia parvirostris) son también dispersores legítimos (sensu Snow 1971). La calidad como dispersor de Pitangus sulphuratus (omnívoro; e.g., Fitzpatrick 1980, Foster 1987) sería inferior porque regurgita la mayoría de las semillas agrupadas en bolos (lo mismo fue observado en Brasil; Sick 1986). Aunque hay especies de plantas que no se ven afectadas cuando sus semillas son dispersadas en grupos grandes (e.g., en heces de mamíferos; Campos y Ojeda 1997), en las plantas ornitócoras esta forma de liberación de semillas disminuye la germinación, influyendo también en los patrones espaciales de reclutamiento y similitud genética entre individuos vecinos (Herrera 1989, Barnea et al. 1992). La regurgitación de semillas solitarias que efectúa Elaenia parvirostris parece de mayor eficiencia demográfica. Coincidentemente, Elaenia es un género más frugívoro que Pitangus (Fitzpatrick 1980, Marini y Cavalcanti 1998) y una especie afín (Elaenia albiceps) tiene mucha importancia para la dispersión de semillas en los bosques del sur de América del Sur (Willson et al. 1996, Aizen et al. 2002).
En cuanto a las especies de la familia Thraupidae, tanto Thraupis sayaca como Stephanophorus diadematus dispersaron semillas únicamente con las deyecciones y su calidad como dispersores varió según la especie de planta. Las semillas que descartan se verían perjudicadas porque su germinación y la supervivencia de las plántulas tienden a ser mayores lejos de la planta madre (Willson 1992, Herrera 2002), aunque esta norma no se cumple para todas las especies (Howe y Smallwood 1982). Thraupis sayaca es un buen dispersor de plantas con semillas pequeñas (Figueiredo et al. 1995) y el tamaño de la semilla influye sobre las posibilidades de dispersión, ya que cuanto mayores son aumenta la chance de descarte (Levey 1987, este trabajo). Sin embargo, otras características del fruto (e.g., pulpa firme y difícil de separar de la semilla) pueden contrarrestar dicho efecto y entonces los Thraupidae son capaces de dispersar semillas relativamente grandes, como ocurre con Myrsine en la selva de Punta Lara. Por su habilidad de aplastar el alimento, estas aves pueden consumir frutos más grandes que sus fauces (Levey 1987); por ejemplo, Stephanophorus diadematus consume Rubus. Pero si la pulpa no es blanda y las dimensiones del fruto y semilla se aproximan a las dimensiones de las fauces el fruto se torna difícil de manipular y tragar, requiere más tiempo de maniobra en el pico (Sallabanks 1993, obs. pers.) y el ave abandona el intento o se le cae accidentalmente, como ocurre con Stephanophorus diadematus y Citharexylum. Por ello, es de esperar que los Thraupidae no interactúen con plantas con diásporas difíciles de manipular (Levey 1987) y, de hecho, en la selva solo se vieron individuos de Stephanophorus diadematus (n = 4) clavando el pico en los frutos de Citharexylum (sin arrancarlos de la infrutescencia). Este hábito tendría como finalidad succionar el jugo (Moermond 1983), que presenta alto contenido de hidratos de carbono disponibles (Montaldo 2000).
Por último, las especies de Columbidae se comportaron fundamentalmente como predadoras de semillas, pero pueden dispersar a las que son duras o están protegidas por fuertes carozos, como hace Columba picazuro con Citharexylum en Punta Lara o Columba palumbus con Prunus mahaleb (Jordano 1995). También las muy pequeñas podrían escapar a su poderoso sistema digestivo (Ziswiler y Farner 1972), porque en los frugívoros predadores que ingieren el fruto íntegro el tamaño de la semilla es crítico para determinar su destino (Santamaría y Franco 2000). Si bien no se le ofreció al individuo cautivo de Columba picazuro, éste sería el caso de Ficus, que fue incluido por Moermond y Denslow (1985) entre las semillas que atraviesan el tracto de palomas del género Columba.
Las observaciones realizadas confirman que el papel del ave frugívora (predador o dispersor) y su calidad como dispersora dependen de su morfología y comportamiento, y también de la forma de presentación y características de la diáspora con la que interactúa (Jordano 1992). De ellas, el principal factor determinante es el tamaño de la semilla (Levey 1987), pero en muchos casos influyen otros como la textura de la pulpa, su grado de adherencia a las semillas y la protección con que cuentan las mismas.
Agradecimientos. A. Chiappe y G. G. Roitman colaboraron en las tareas de campo y Roitman también en el cuidado de las aves. P. Aguirre me facilitó el individuo de Columba picazuro que utilicé en los experimentos. D. Medan y J. J. Valla leyeron críticamente el manuscrito y sus opiniones ayudaron a mejorarlo. En el mismo sentido contribuyeron las sugerencias de L. Malizia y de J. P. Torretta. El aviario utilizado en los experimentos fue construido con fondos de un subsidio de la Universidad de Buenos Aires. Dedico este trabajo a la memoria de mi padre, H. A. Montaldo, que en numerosas ocasiones me acompañó a la Reserva de Punta Lara.
Bibliografía citada
AIZEN MA, VÁZQUEZ DP Y SMITH-RAMÍREZ C (2002) Historia natural y conservación de los mutualismos planta-animal del bosque templado de Sudamérica austral. Revista Chilena de Historia Natural 75:79-97 [ Links ]
ARAGÓN R (2000) Especies exóticas como recursos para las aves en bosques secundarios de las Yungas. Pp: 21-35 en: GRAU HR Y ARAGÓN R (eds) Ecología de árboles exóticos de las Yungas argentinas. LIEY, Tucumán [ Links ]
ARGEL DE OLIVEIRA MM Y FIGUEIREDO RA DE (1996) Aves que visitam uma figueira isolada em ambiente aberto, Espírito Santo, Brasil. Iheringia 80:127-134 [ Links ]
BARNEA A, YOM-TOV Y Y FRIEDMAN J (1992) Effect of frugivorous birds on seed dispersal and germination of multi-seeded fruits. Acta Oecologica 13:209-219 [ Links ]
CABRERA AL (1960) La selva marginal de Punta Lara. Ciencia e Investigación 16:439-446 [ Links ]
CABRERA AL (1976) Regiones fitogeográficas argentinas. Pp. 1-85 en: Enciclopedia argentina de agricultura y jardinería. Tomo II. Fascículo 1. ACME, Buenos Aires [ Links ]
CABRERA AL Y DAWSON G (1944) La selva marginal de Punta Lara en la ribera argentina del Río de la Plata. Revista del Museo de La Plata 5:267-382 [ Links ]
CAMPOS CM Y OJEDA RA (1997) Dispersal and germination of Prosopis flexuosa (Fabaceae) seeds by desert mammals in Argentina. Journal of Arid Environments 35:707-714 [ Links ]
FIGUEIREDO RA DE, MOTTA JUNIOR JC Y DA SILVA VASCONCELLOS LA (1995) Pollination, seed dispersal, seed germination and establishment of seedlings of Ficus microcarpa, Moraceae, in southeastern Brazil. Revista Brasileira de Biologia 55:233-239 [ Links ]
FIGUEIREDO RA DE Y PERIN E (1995) Germination ecology of Ficus luschnathiana drupelets after bird and bat ingestion. Acta Oecologica 16:71-75 [ Links ]
FITZPATRICK JW (1980) Foraging behavior of Neotropical tyrant flycatchers. Condor 82:43-57 [ Links ]
FOSTER MS (1987) Feeding methods and efficiencies of selected frugivorous birds. Condor 89:566-580 [ Links ]
FRAGA RM (1983) Conducta vocal y reproducción de la Yerutí Común (Leptotila verreauxi) en Lobos, Buenos Aires. Hornero 12:89-94 [ Links ]
HERRERA CM (1984a) A study of avian frugivores, birddispersed plants and their interactions in Mediterranean scrublands. Ecological Monographs 54:1-23 [ Links ]
HERRERA CM (1984b) Adaptation to frugivory of Mediterranean avian seed dispersers. Ecology 65:609-617 [ Links ]
HERRERA CM (1989) Frugivory and seed dispersal by carnivorous mammals, and associated fruit characteristics, in undisturbed Mediterranean habitats. Oikos 55:250-262 [ Links ]
HERRERA CM (2002) Seed dispersal by vertebrates. Pp. 185-208 en: HERRERA CM Y PELLMYR O (eds) Plantanimal interactions. An evolutionary approach. Blackwell Science, Oxford [ Links ]
HOWE HF Y SMALLWOOD J (1982) Ecology of seed dispersal. Annual Review of Ecology and Systematics 13:201-228 [ Links ]
JORDANO P (1982) Migrant birds are the main seed dispersers of blackberries in southern Spain. Oikos 38:183-193 [ Links ]
JORDANO P (1987) Frugivory, external morphology and digestive system in Mediterranean sylviid warblers Sylvia spp. Ibis 129:125-189 [ Links ]
JORDANO P (1992) Fruits and frugivory. Pp. 105-156 en: FENNER M (ed) Seeds: the ecology of regeneration in plant communities. CABI, Wallingford [ Links ]
JORDANO P (1995) Spatial and temporal variation in the avian-frugivore assemblage of Prunus mahaleb: patterns and consequences. Oikos 71:479-491 [ Links ]
KLIMAITIS JF Y MOSCHIONE F (1987) Aves de la Reserva Integral de Selva Marginal de Punta Lara y sus alrededores. Ministerio de Asuntos Agrarios de la Provincia de Buenos Aires, Buenos Aires [ Links ]
LEVEY DJ (1987) Seed size and fruit-handling techniques of avian frugivores. American Naturalist 129:471-485 [ Links ]
MARINI MÂ Y CAVALCANTI RB (1998) Frugivory by Elaenia flycatchers. Hornero 15:47-50 [ Links ]
MEYER DE SCHAUENSSE (1982) A guide to the birds of South America. Academy of Natural Sciences of Philadelphia, Wynnewood [ Links ]
MOERMOND TC (1983) Suction-drinking in tanagers (Thraupidae) and its relation to frugivory. Ibis 125:545-549 [ Links ]
MOERMOND TC Y DENSLOW JS (1985) Neotropical avian frugivores: patterns of behavior, morphology and nutrition, with consequences for fruit selection. Ornithological Monographs 36:865-897 [ Links ]
MONTALDO NH (1993) Dispersión por aves y éxito reproductivo de dos especies de Ligustrum (Oleaceae) en un relicto de selva subtropical en la Argentina. Revista Chilena de Historia Natural 66:75-85 [ Links ]
MONTALDO NH (2000) Éxito reproductivo de plantas ornitócoras en un relicto de selva subtropical en la Argentina. Revista Chilena de Historia Natural 73:511-524 [ Links ]
NAROSKY T E YZURIETA D (2003) Guía para la identificación de las aves de Argentina y Uruguay. Edición de Oro. Vazquez Mazzini Editores, Buenos Aires [ Links ]
OBESO JR Y FERNÁNDEZ-CALVO IC (2002) Fruit removal, pyrene dispersal, post-dispersal predation and seedling establishment of a bird-dispersed tree. Plant Ecology 165:223-233 [ Links ]
REY PJ Y GUTIÉRREZ JE (1996) Pecking of olives by frugivorous birds: a shift in feeding behaviour to overcome gape limitation. Journal of Avian Biology 27:327-333 [ Links ]
ROUGÈS M Y BLAKE JG (2001) Tasas de captura y dietas de aves del sotobosque en el Parque Biológico Sierra de San Javier, Tucumán. Hornero 16:7-15 [ Links ]
SALLABANKS R (1992) Fruit fate, frugivory, and fruit characteristics: a study of hawthorn Crataegus monogyna (Rosaceae). Oecologia 91:96-304 [ Links ]
SALLABANKS R (1993) Hierarchical mechanisms of fruit selection by an avian frugivore. Ecology 74:1326-1336 [ Links ]
SANTAMARÍA M Y FRANCO AM (2000) Frugivory of Salvin's Curassow in a rainforest of the Colombian Amazon. Wilson Bulletin 112:473-481 [ Links ]
SICK H (1986) Ornitología brasileira, uma introduçao. Vol. 2. Segunda Edición. Editora Universidade de Brasilia, Brasilia [ Links ]
SNOW DW (1971) Evolutionary aspects of fruit-eating by birds. Ibis 113:194-202 [ Links ]
VAN DER PIJL L (1982) Principles of dispersal in higher plants. Tercera Edición. Springer-Verlag, Berlín [ Links ]
WHEELWRIGHT NT (1985) Fruit size, gape width, and the diets of fruit-eating birds. Ecology 66:808-818 [ Links ]
WILLSON MF (1992) The ecology of seed dispersal. Pp. 61-85 en: FENNER M (ed) Seeds: the ecology of regeneration in plant communities. CABI, Wallingford [ Links ]
WILLSON MF, SMITH-RAMÍREZ C, SABAG C Y HERNÁNDEZ JF (1996) Mutualismos entre plantas y animales en bosques templados de Chile. Pp. 251-264 en: ARMESTO JJ, VILLAGRÁN C Y KALIN ARROYO M (eds) Ecología de los bosques nativos de Chile. Editorial Universitaria, Santiago [ Links ]
ZISWILER V Y FARNER DS (1972) Digestion and the digestive system. Pp. 343-430 en: FARNER DS Y KING JR (eds) Avian biology. Volume 2. Academic Press, Nueva York [ Links ]














