Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
El hornero
versión impresa ISSN 0073-3407versión On-line ISSN 1850-4884
Hornero v.21 n.1 Buenos Aires ene./ago. 2006
Reconstrucción de las características de historia de vida en los ancestros de los tordos: un análisis de las adaptaciones al parasitismo de cría
E. Manuela Pujol 1,2 y Myriam E. Mermoz 1
1 Laboratorio de Ecología y Comportamiento Animal, Departamento de Ecología, Genética y Evolución, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires. Piso 4, Pab. 2, Ciudad Universitaria, C1428EHA Buenos Aires, Argentina.
2 elianamanuela@yahoo.com.ar
Resumen
Los tordos parásitos de cría ponen sus huevos en los nidos de otras especies (hospederos), dependiendo de ellos para su reproducción. Se ha propuesto que los tordos habrían modificado ciertas características de historia de vida como adaptaciones para desarrollar este comportamiento. Específicamente, poseerían menor peso del huevo, menor período de incubación, mayor grosor de la cáscara del huevo, mayor tasa de crecimiento de los pichones y menor peso de los pichones cuando abandonan el nido. Un análisis reciente utilizando contrastes independientes filogenéticos encontró que los valores observados de estas características en los tordos solo difieren de los valores predichos para las especies no parásitas en el grosor de la cáscara del huevo. En este trabajo reanalizamos si estas características son potenciales adaptaciones al parasitismo de cría en los tordos a partir de la reconstrucción de ancestros bajo dos modelos de evolución de caracteres. Al comparar los valores ancestrales reconstruidos a partir de los tordos con los obtenidos a partir de las especies no parásitas, solo encontramos diferencias en el grosor de la cáscara del huevo. Esto demuestra que ambas técnicas (la reconstrucción de ancestros y los contrastes independientes filogenéticos) son consistentes, por lo cual el hecho de que solo el mayor grosor de la cáscara del huevo puede ser una adaptación potencial es un resultado muy robusto.
Palabras clave: adaptación, crecimiento de pichones, grosor de la cáscara del huevo, período de incubación, peso del huevo, reconstrucción de ancestros, tordos.
Abstract
Reconstruction of ancestral states of life-history traits in cowbirds: an analysis of adaptations to brood parasitism
Parasitic cowbirds lay their eggs in the nest of other species, the host, depending on the host's parental care for their successful reproduction. It has been suggested that cowbirds modified some life-history traits as adaptations to brood parasitism. Specifically, they would have developed small-sized eggs with thicker eggshells, would have shortened their incubation periods, and would have accelerated nestling growth. A previous analysis with independent phylogenetic contrasts found that observed values of those life-history traits in parasitic cowbirds only differ from the predicted ones by their non-parasitic relatives in their thicker eggshell. In this work, we reanalyzed these traits as potential adaptations to brood parasitism in cowbirds by reconstructing ancestral values under two models of character evolution. By comparing the ancestors reconstructed from the parasitic cowbirds with those reconstructed from their non-parasitic relatives, we only found differences in eggshell thickness. This demonstrates that both techniques (ancestor reconstruction and independent phylogenetic contrasts) are consistent, and that the increase in eggshell thickness as a potential adaptation to brood parasitism is a robust result.
Key words: adaptation, ancestor reconstruction, cowbirds, eggshell thickness, egg weight, incubation period, nestling growth.
Recibido 23 mayo 2005, aceptado 30 diciembre 2005
El parasitismo de cría es una estrategia reproductiva en la cual las especies parásitas ponen sus huevos en los nidos de otras especies, los hospederos, quienes realizan el cuidado parental. En las aves, esta estrategia evolucionó independientemente un total de siete veces en las familias y subfamilias Cuculinae (dos veces), Neomorphinae, Anatidae, Indicatoridae, Ploceidae e Icteridae (Lanyon 1992, Aragón et al. 1999). En esta relación, las especies parásitas dependen completamente de las hospederas para su reproducción y supervivencia (Rothstein 1990). Debido a esta dependencia, algunos autores han propuesto que ciertas características presentes en los parásitos de cría habrían surgido como adaptaciones a esta estrategia reproductiva. Por ejemplo, en los Cuculinae las hembras son territoriales, pueden predar un huevo del hospedero al mismo tiempo que lo parasitan, sus huevos son miméticos con los del hospedero y poseen períodos cortos de incubación (Payne 1973, 1977, Davies y Brooke 1989). En la mayoría de las especies, incluso, los pichones, al nacer, expulsan a otros huevos o pichones presentes en el nido (Payne 1973, Davies 2000). En todos los Indicatoridae y Neomorphinae los pichones parásitos matan a los demás pichones (Rothstein y Robinson 1998). En cambio, los pichones del género Vidua (Ploceidae) no son agresivos, aunque poseen marcas en el interior del pico muy similares a las de los pichones de sus hospederos, lo que podría favorecer su aceptación por parte de los padres (Friedmann 1960, Payne et al. 2000). En particular, las cinco especies de tordos parásitos de la familia Icteridae (Fig. 1) no poseen prácticamente ninguna de las características asociadas al parasitismo encontradas en los otros grupos. Sus hembras no son territoriales, sus pichones no son agresivos y ni sus huevos ni sus pichones son miméticos mientras están en el nido (sensu Grim 2005; Friedmann 1929, Smith 1968, Carter 1986, Fraga 1998), con la excepción de los volantones de Molothrus rufoaxillaris (Fraga 1998). Sin embargo, algunos autores sugirieron que los tordos parásitos habrían desarrollado adaptaciones menos evidentes, como por ejemplo huevos pequeños, de bajo contenido energético, de cáscara más gruesa y con cortos períodos de incubación (Rahn et al. 1988, Kattan 1995, Strausberger 1998). Además, se ha sugerido que los pichones tendrían un desarrollo acelerado en el nido (Ortega y Cruz 1992, Kattan 1996). El huevo pequeño sería energéticamente menos costoso, permitiendo que las hembras de tordo pongan muchos huevos en una misma temporada reproductiva, y, al mismo tiempo, facilitaría una rápida eclosión (Kattan 1995, Strausberger 1998). El período de incubación corto permitiría que los pichones de tordo eclosionen antes que los de sus hospederos (Rothstein y Robinson 1998). Asimismo, el desarrollo acelerado de los pichones de tordo les permitiría competir eficientemente por el cuidado parental con los de sus hospederos (Ortega y Cruz 1992, Kattan 1996). Finalmente, un mayor grosor de la cáscara del huevo dificultaría su rechazo por parte de hospederos de pico corto, que deben picarlos para poder manipularlos (Rohwer y Spaw 1988).

Figura 1. Árbol filogenético del grupo de los "Quiscalus y afines", basado en Johnson y Lanyon (1999), utilizado en el análisis. En el árbol se indican las cinco especies de tordos parásitos (P). El punto señalado por la flecha representa el ancestro que se intenta reconstruir.
En un sentido evolutivo estricto, una adaptación es aquella característica cuya evolución fue favorecida por selección natural para cumplir la función que tiene actualmente y que, además, le confiere una ventaja a los individuos que la poseen (Gould y Vbra 1982, citado en Reeve y Sherman 1993). La primera aproximación para evaluar adaptaciones suele ser algún tipo de comparación entre las especies de interés y las especies más cercanamente emparentadas. Sin embargo, este tipo de análisis no es correcto, ya que las especies no pueden ser consideradas estadísticamente independientes debido a las relaciones jerárquicas ancestro-descendiente que existen entre ellas (Felsenstein 1985). Por ello, es necesario incorporar en el análisis la información filogenética y una hipótesis del modelo de evolución de los caracteres de interés (Felsenstein 1985, Rezende y Garland 2003, Garland et al. 2005). La incorporación de la información filogenética y del modelo evolutivo aumentan tanto la calidad como el número de análisis, ya que existen tanto los llamados análisis de correlaciones como los análisis de inferencia, los cuales serían imposibles de realizar de no contarse con dicha información (Garland et al. 2005). Diversas aproximaciones, popularmente conocidas como métodos comparativos filogenéticos, han sido propuestas para realizar estos análisis. Entre ellas se pueden mencionar el análisis correlacional (el más frecuente), los contrastes independientes filogenéticos (Felsenstein 1985) y la reconstrucción de ancestros, que es un tipo de análisis de inferencia (Maddison 1991). Este tipo de análisis era difícil de desarrollar en el caso de los tordos parásitos, porque hace relativamente poco tiempo que se obtuvo un árbol filogenético de los "Quiscalus y afines" (Johnson y Lanyon 1999), el grupo al que pertenecen. Recientemente, Mermoz y Ornelas (2004) pusieron a prueba la existencia de adaptaciones al parasitismo de cría en los tordos utilizando una extensión de los contrastes independientes. Sobre la base de este análisis de correlación, concluyeron que solo el mayor grosor de la cáscara del huevo podía ser considerado como una adaptación potencial. Los métodos de reconstrucción de ancestros son una herramienta importante para la inferencia evolutiva, que es difícil de poner a prueba empíricamente debido a que el estado ancestral del carácter muy pocas veces es conocido con certeza (Oakley y Cunningham 2000). En consecuencia, en este trabajo nos proponemos utilizar la metodología de reconstrucción de ancestros, con sus correspondientes intervalos de confianza (Schluter et al. 1997), para poner a prueba la existencia de adaptaciones en los tordos parásitos. Específicamente, evaluamos si los tordos parásitos desarrollaron huevos más pequeños y de corto período de incubación, según la hipótesis de Kattan (1995) y Strausberger (1998), y con cáscara más gruesa, según lo sugerido por Rahn et al. (1988), en comparación con las especies no parásitas del grupo de los "Quiscalus y afines". En forma similar, evaluamos si las especies parásitas desarrollaron pichones con crecimiento acelerado en el nido respecto a las especies no parásitas (Ortega y Cruz 1992, Kattan 1996). Finalmente, comparamos nuestros resultados con los obtenidos en el trabajo previo de Mermoz y Ornelas (2004). Dentro del método comparativo, se ha sugerido que cuando diversas aproximaciones llevan a la misma conclusión los resultados obtenidos se robustecen (Garland y Adolph 1994). Para evaluar si ambas técnicas (reconstrucción de ancestros y contrastes independientes filogenéticos) son consistentes en sus resultados, analizamos el peso ancestral de la hembra. Para que los resultados sean robustos, esperamos encontrar que las especies parásitas hayan desarrollado un peso de sus hembras menor que el de las especies no parásitas.
Métodos
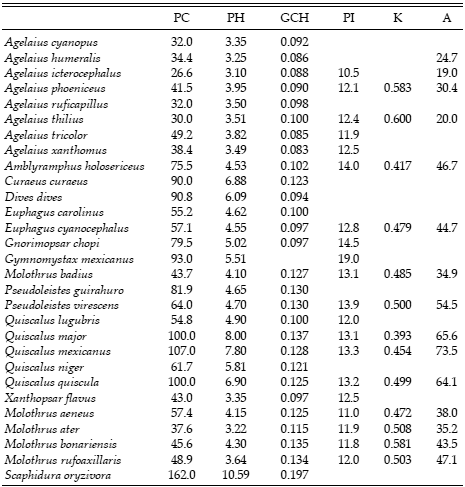
Los caracteres analizados fueron el peso corporal de la hembra, el peso del huevo, el grosor de la cáscara del huevo, el período de incubación y el desarrollo de los pichones en el nido. Se ha sugerido que un desarrollo acelerado podría obtenerse de dos formas: cuando la tasa de crecimiento es alta o cuando el peso de los pichones al abandonar el nido es menor al esperado en función del peso del adulto (Kattan 1996). En consecuencia, estimamos tanto la tasa de crecimiento como el peso al abandonar el nido. Obtuvimos la información para todos los caracteres principalmente del trabajo de Mermoz y Ornelas (2004). En la tabla 1 se muestran los valores correspondientes. Durante el análisis los datos fueron transformados logarítmicamente para homogeneizar las varianzas.
Tabla 1. Valores de los caracteres de historia de vida de las especies del grupo de los "Quiscalus y afines" utilizados en el análisis. La información fue obtenida a partir de Mermoz y Ornelas (2004), excepto el peso corporal de la hembra de Pseudoleistes guirahuro, que fue obtenido de Fraga y Di Giacomo (2004). La nomenclatura sigue a Johnson y Lanyon (1999). PC: peso corporal de la hembra (en g), PH: peso del huevo (en g), GCH: grosor de la cáscara del huevo (en μ), PI: período de incubación (en días), K: tasa de crecimiento (en días -1), A: peso al abandonar el nido (en g).
Los tordos parásitos son un grupo monofilético de cinco especies incluidas dentro del grupo de los "Quiscalus y afines" de la familia Icteridae (Fig. 1). El árbol filogenético utilizado para este grupo está basado en las secuencias de los genes mitocondriales citocromo-b y ND2 (Johnson y Lanyon 1999).
Para la reconstrucción de ancestros, con sus respectivos intervalos de confianza, utilizamos el programa PDTREE (Garland et al. 1999, Garland e Ives 2000), el cual reconstruye por parsimonia del cuadrado de los cambios (Maddison 1991). Reconstruimos el valor del nodo ancestral de los tordos parásitos (Fig. 1) para cada uno de los caracteres. Por un lado, lo reconstruimos a partir del grupo de los tordos parásitos, y, por otro lado, a partir de las especies no parásitas del grupo de los "Quiscalus y afines". Usamos dos modelos de evolución de caracteres continuos: el Modelo Browniano (Felsenstein 1985) y el Modelo Browniano Especiacional (Martins y Garland 1991). Bajo el Modelo Browniano los cambios en el estado del caracter ocurren continuamente, mientras que bajo el otro modelo los cambios ocurren solo luego de un evento de especiación. Ambos modelos fueron corregidos según Björklund (1997), quien sugiere prolongar las ramas de la filogenia que pierden especies en el análisis por falta de información en los caracteres. Bajo el Modelo Browniano Especiacional la corrección de Björklund (1997) prolonga las ramas en una unidad por cada especie perdida, mientras que bajo el Modelo Browniano la corrección suma la longitud de la rama de cada especie perdida a la rama que queda. Esto último fue posible aplicando primero los modelos evolutivos y luego eliminando las especies para las cuales se carecía de información (Mermoz y Ornelas 2004). Las longitudes de rama utilizadas en el análisis bajo el Modelo Browniano fueron obtenidas de Mermoz y Ornelas (2004).
La estimación del nodo del ancestro de los tordos parásitos a partir de las especies no parásitas del grupo de los "Quiscalus y afines" (un nodo interno) no es óptima, es decir que el valor no minimiza la suma de cuadrados de los cambios en toda la filogenia (Garland et al. 1999). Para optimizarla debimos re-enraizar el árbol en dicho nodo. La estimación óptima de ancestros realizada por el programa PDTREE se basa en el supuesto de que los valores de todos ellos siguen una distribución normal con el número de nodos como grados de libertad. De esta suposición surge la generación de los errores estándar y de los intervalos de confianza correspondientes (Schluter et al. 1997). Usando esta información, comparamos los valores del nodo ancestral obtenidos a partir de los tordos parásitos con el obtenido a partir de los "Quiscalus y afines" mediante de una Prueba de t de Student con Varianzas Desiguales (Zar 1996). En esta prueba utilizamos la cantidad de nodos como tamaño de muestra y los grados de libertad fueron calculados según Zar (1996) (ver Pujol 2005). En Pujol (2005), los árboles comparados tenían 136 y 34 especies, mientras que nuestros árboles están formados por un máximo de 29 y 5 especies (Fig. 1 y Tabla 1). En consecuencia, los grados de libertad de la prueba en algunos casos se redujeron demasiado por la falta de información de las especies. Por dicho motivo, también mostramos la comparación convencional de los intervalos de confianza (e.g., Garland et al. 1997, 1999, Schluter et al. 1997).
Resultados
Los análisis realizados bajo ambos modelos de evolución de caracteres (Modelo Browniano y Modelo Browniano Especiacional) mostraron resultados similares; por esta razón, mostramos solo los resultados obtenidos bajo el Modelo Browniano.
No encontramos diferencias entre el valor del peso del huevo para el ancestro reconstruido a partir de las especies parásitas y el del ancestro reconstruido desde las especies no parásitas (t = 1, gl = 4, P > 0.05; Fig. 2). El intervalo de confianza generado a partir de los tordos parásitos y el generado a partir de las especies no parásitas se superpusieron totalmente, mostrando que no hay diferencias en los valores reconstruidos a partir de cada grupo (Tabla 2). Lo mismo se observó al comparar el período de incubación: el valor reconstruido del ancestro a partir de las especies parásitas y a partir de las especies no parásitas no difirieron (t = 1, gl = 13, P > 0.05; Fig. 2), tendencia que se verificó al examinar la superposición de sus respectivos intervalos de confianza (Tabla 2). Finalmente, el valor del grosor de la cáscara del huevo fue mayor cuando se lo reconstruyó a partir de las especies parásitas que de las no parásitas (t = 2, gl = 5, P < 0.01; Fig. 2). Los intervalos de confianza generados en ambos casos no se superpusieron (Tabla 2).
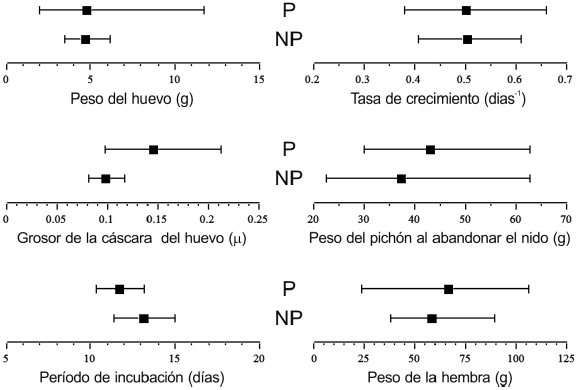
Figura 2. Valores ancestrales promedio (e intervalos de confianza del 95%) para cada uno de los caracteres de historia de vida analizados, reconstruidos a partir del grupo de los tordos parásitos (P) y a partir de las especies no parásitas del grupo de los "Quiscalus y afines" (NP) bajo el modelo de evolución de caracteres browniano.
Tabla 2. Intervalos de confianza del 95% de los valores ancestrales de cada uno de los caracteres de historia de vida analizados, reconstruidos a partir del grupo de los tordos parásitos y a partir de las especies no parásitas del grupo de los "Quiscalus y afines" bajo el modelo de evolución de caracteres browniano. Los intervalos se muestran conservando la transformación logarítmica.

El valor de la tasa de crecimiento de los pichones en el nido no difirió cuando fue reconstruido a partir de las especies parásitas o de las no parásitas (t = 1, gl = 5, P > 0.05; Fig. 2). En forma similar, el valor ancestral del peso de los pichones al abandonar el nido reconstruido a partir de las especies parásitas no difirió del reconstruido a partir de las especies no parásitas (t = 1, gl = 10, P > 0.05; Fig. 2). Para ambos caracteres, los intervalos de confianza generados a partir de los parásitos y los no parásitos se superpusieron totalmente, mostrando que no hay diferencias en los valores reconstruidos a partir de cada grupo (Tabla 2).
Finalmente, encontramos que el valor de peso corporal de la hembra reconstruido a partir de los tordos parásitos no difirió significativamente del reconstruido a partir de las especies no parásitas (t = 1, gl = 5, P > 0.05; Fig. 2). Además, los correspondientes intervalos de confianza se superpusieron totalmente, mostrando que no hay diferencias en los valores reconstruidos a partir de cada grupo (Tabla 2).
Discusión
La estimación del estado ancestral de un caracter y de su variación puede ser utilizada para evaluar cambios evolutivos en el estado del caracter, para evaluar si el ancestro difiere de sus descendientes y para evaluar la confianza de dicha estimación (Garland et al. 1999, Martins 1999). Al igual que otras aproximaciones basadas en el método comparativo, la reconstrucción de ancestros depende fuertemente de las relaciones evolutivas de las especies involucradas en el análisis (Felsenstein 1985, Martins y Garland 1991, Garland et al. 1999). Un análisis molecular de la especie Hypopyrrhus pyrohypogaster, también basado en la secuencia de los genes citocromo-b y ND2, sugirió que esta especie pertenece al grupo de los "Quiscalus y afines", incorporándose al clado de Gymnomystax mexicanus y Lampropsar tanagrinus (Cadena et al. 2004). Sin embargo, dicho resultado se basa en el análisis de solo 16 de las especies utilizadas por Johnson y Lanyon (1999). Como no podemos asegurar que dicha incorporación se mantuviera al repetir el análisis con todas las especies, preferimos no modificar aquí nuestra hipótesis filogenética. Asimismo, Martins (1999) demostró por medio de simulaciones que la estimación del estado ancestral del caracter es precisa solo bajo el modelo de evolución de caracteres browniano (una aproximación a la evolución por deriva genética). De nuestro análisis podemos concluir que también bajo el Modelo Browniano Especiacional (en el cual los cambios evolutivos están asociados a eventos de especiación) la estimación del estado ancestral del caracter es precisa. El mismo trabajo de Martins (1999) mostró que la estimación del error estándar estaría subestimada aún suponiendo un modelo browniano de evolución de caracteres. Además, la estimación tanto del error estándar como del intervalo de confianza depende del número de especies en la filogenia, de la señal filogenética del caracter, de la topología del árbol y del modelo de evolución de caracteres (Schluter et al. 1997, Garland et al. 1999, 2005), por lo cual estos autores sugieren que dicha estimación no es precisa. Sin embargo, los intervalos de confianza obtenidos en nuestro análisis no son demasiado amplios (Tabla 2), sugiriendo que la amplitud sería más atribuible al tamaño de la muestra pequeño (Garland et al. 2005) que a la subestimación del error estándar. Finalmente, tanto el análisis estadístico que proponemos (Prueba de t de Student) como el análisis convencional (superposición de los intervalos de confianza) muestran los mismos resultados, lo que indicaría que nuestra propuesta puede ser utilizada como método alternativo.
Utilizando la técnica de reconstrucción de ancestros, encontramos que el ancestro de los tordos parásitos reconstruido desde las especies parásitas solo difiere del ancestro reconstruido a partir de las especies no parásitas del grupo de los "Quiscalus y afines" en el grosor de la cáscara del huevo. Este resultado coincide con el obtenido por Mermoz y Ornelas (2004), quienes encontraron que los tordos parásitos poseen cáscaras de huevo más gruesas que lo esperado considerando a las especies no parásitas del grupo y su posición en el árbol filogenético. Además, el hecho de obtener el mismo resultado usando diferentes aproximaciones del método comparativo (un análisis de correlaciones y un análisis de inferencia) y dos modelos de evolución de caracteres hace que éste sea robusto (Garland et al. 1999, Martins 1999). Estos resultados evidencian que la reconstrucción de ancestros es una técnica estadísticamente consistente con la utilización de contrastes independientes para poner a prueba hipótesis adaptativas. El mayor grosor de la cáscara del huevo puede ser considerado entonces una potencial adaptación al parasitismo de cría en los tordos, mientras que las demás características relacionadas con el huevo (peso del huevo y período de incubación) y con el desarrollo de los pichones (tasa de crecimiento y peso al abandonar el nido) no lo serían.
Nuestros resultados, al igual que los de Mermoz y Ornelas (2004), muestran que los tordos habrían desarrollado una cáscara del huevo más gruesa. Se han propuesto tres hipótesis para explicar la ventaja adaptativa de un mayor grosor de la cáscara del huevo en los tordos parásitos. Una de ellas está asociada al costo para las especies hospederas de rechazar los huevos del parásito (Rahn et al. 1988, Rohwer y Spaw 1988). En los hospederos se observan dos mecanismos de rechazo de los huevos del parásito: la manipulación sin previo daño de los huevos y la picadura de los huevos antes de sacarlos del nido (Rothstein 1990). En las especies que deben picarlo, un mayor grosor de la cáscara del huevo implicaría que fuera más costoso rechazar los huevos parásitos que aceptarlos (Rohwer y Spaw 1988). Sin embargo, solo tres especies hospederas, todas ellas de Molothrus ater, pican los huevos antes de sacarlos del nido (Rohwer y Spaw 1988, Sealy y Neudorf 1995), mientras que la mayoría de los hospederos manipulan los huevos sin dañarlos (Mason 1986, Rothstein 1990, Mermoz 1996, Fraga 1998). Por tal motivo, no se espera que esta característica sea ventajosa para las cinco especies de tordos parásitos (Mermoz y Ornelas 2004). La segunda hipótesis está asociada a que todas las hembras de especies parásitas del género Molothrus pican huevos en los nidos que parasitan (Friedmann 1929, Carter 1986, Fraga 1998). El mayor grosor de la cáscara del huevo lo protegería de las picaduras de conespecíficos en los nidos parasitados por más de una hembra (Hudson 1874, Brooker y Brooker 1991, Mermoz y Ornelas 2004). El parasitismo por más de una hembra es una estrategia muy frecuente, al menos en Molothrus bonariensis y Molothrus rufoaxillaris (Fraga 1998, Mermoz y Reboreda 1999). Finalmente, la última hipótesis propone que la dureza de la cáscara del huevo parásito lo protegería de golpes accidentales producidos por el incremento en el número de huevos en el nido de hospederos que no los rechazan (Weatherhead 1991).
El hecho de que los tordos parásitos posean tan pocas características que puedan ser consideradas potenciales adaptaciones sigue resultando paradójico. Esto es más llamativo cuando se las compara con las numerosas adaptaciones descriptas en otros grupos parásitos, como poseer pichones tempranamente agresivos (e.g., Indicatoridae, Neomorphinae, Cuculinae), huevos (e.g., Cuculinae) o pichones (e.g., Vidua) miméticos, o hembras territoriales que parasitan con una muy alta eficiencia (e.g., Cuculinae) (ver la revisión de Rothstein y Robinson 1998). No podemos descartar que, por ejemplo, la rápida puesta del huevo (Sealy et al. 1995) o el mayor desarrollo de las estructuras cerebrales relacionadas con la memoria espacial (Clayton et al. 1997) sean adaptaciones potenciales, pero no existe hasta el momento suficiente información en otros "Quiscalus y afines" no parásitos como para ponerlas a prueba. Hasta que sean posibles más análisis de potenciales adaptaciones no podrá confirmarse si este bajo número de adaptaciones al parasitismo en tordos es o no real.
Agradecimientos. Agradecemos a Gustavo J. Fernández y a tres revisores anónimos por sus enriquecedores comentarios a versiones previas de este manuscrito. Este estudio fue realizado con el apoyo de los subsidios del "Programa Cuauhtémoc" (México) y de la Universidad de Buenos Aires (Programación 2004–2007 UBACyT # X007: "Evaluación del efecto del riesgo de depredación sobre el comportamiento reproductivo de aves Passeriformes").
Bibliografía Citada
Aragón S, Moller AP, Soler JJ y Soler M (1999) Molecular phylogeny of cuckoos supports a polyphyletic origin of brood parasitism. Journal of Evolutionary Biology 12:495–506 [ Links ]
Björklund M (1997) Are "comparative methods" always necessary? Oikos 80:607–612 [ Links ]
Brooker LC y Brooker MG (1991) Eggshell strength in cuckoos and cowbirds. Ibis 133:406–413 [ Links ]
Cadena CD, Cuervo AM y Lanyon SM (2004) Phylogenetic relationships of the red-bellied grackle (Icteridae: Hyppyrrhus pyrohypogaster) inferred from mitochondrial DNA sequence data. Condor 106:664–671 [ Links ]
Carter MD (1986) The parasitic behavior of the bronzed cowbird in south Texas. Condor 88:11–25 [ Links ]
Clayton NS, Reboreda JC y Kacelnik A (1997) Seasonal change of hippocampus volume in parasitic cowbirds. Behavioral Processes 41:237–243 [ Links ]
Davies NB (2000) Cuckoo, cowbirds and other cheats. Academic Press, Londres [ Links ]
Davies NB y Brooke LC (1989) An experimental study of co-evolution between the cuckoo, Cuculus canarus and its host. II. Host egg markings, chick discrimination and general discussion. Journal of Animal Ecology 58:225–236 [ Links ]
Felsenstein J (1985) Phylogenies and the comparative data. American Naturalist 125:1–15 [ Links ]
Fraga RM (1998) Interactions of the parasitic screaming and shiny cowbirds (Molothrus rufoaxillaris and M. bonariensis) with a shared host, the bay-winged cowbird (Molothrus badius). Pp. 173–193 en: Rothstein SI y Robinson SK (eds) Parasitic birds and their hosts: studies in coevolution. Oxford University Press, Nueva York [ Links ]
Fraga RM y Di Giacomo A (2004) Cooperative breeding of the yellow-rumped marshbird (Icteridae) in Argentina and Paraguay. Condor 106:671–673 [ Links ]
Friedmann H (1929) The cowbirds, a study in the biology of the social parasitism. CC Thomas, Springfield [ Links ]
Friedmann H (1960) The parasitic weaverbirds. United States National Museum Bulletin 223:1–196 [ Links ]
Garland Jr T y Adolph SC (1994) Why not to do two species comparative studies: limitations on inferring adaptations. Physiological Zoology 67:797–828 [ Links ]
Garland Jr T, Bennett A y Rezende EL (2005) Phylogenetic approaches in comparative physiology. Journal of Experimental Biology 208:3015–3035 [ Links ]
Garland Jr T e Ives AR (2000) Using the past to predict the present: confidence intervals for regression equation in phylogenetic comparative methods. American Naturalist 155:346–364 [ Links ]
Garland Jr T, Martin KML y Díaz-Uriarte R (1997) Reconstructing ancestral trait values using squared-change parsimony: plasma osmolarity at the origin of amniotes. Pp. 425–501 en: Sumida SS y Martin KLM (eds) Amniote origins: completing the transition to land. Academic Press, San Diego [ Links ]
Garland Jr T, Midford PE e Ives AR (1999) An introduction to phylogenetically based statistical methods, with a new method for confidence intervals on ancestral states. American Zoology 39:374–388 [ Links ]
Gould SJ y Vbra ES (1982) Exaptation —a missing term in the science of form. Paleobiology 8:4–15 [ Links ]
Grim T (2005) Mimicry vs. similarity: which resemblances between brood parasites and their hosts are mimetic and which are not? Biological Journal of the Linnean Society 84:69–78 [ Links ]
Hudson WH (1874) Notes on the procreant instincts of the three species of Molothrus found in Buenos Ayres. Proceedings of the Zoological Society of London 9:153–174 [ Links ]
Johnson KP y Lanyon SM (1999) Molecular systematics of the grackles and allies, and effect of additional sequence (Cyt b and ND2). Auk 116:759–768 [ Links ]
Kattan GH (1995) Mechanism of short incubation period in brood parasitic cowbirds. Auk 112:335–342 [ Links ]
Kattan GH (1996) Growth and provisioning of shiny cowbirds and house wren host nestling. Journal of Field Ornithology 67:434–441 [ Links ]
Lanyon SM (1992) Interspecific brood parasitism in blackbirds (Icterinae): a phylogenetic perspective. Science 225:77–79 [ Links ]
Maddison WP (1991) Squared-changed parsimony reconstruction of ancestral states for continuous-valued character on a phylogenetic tree. Systematic Zoology 40:304–314 [ Links ]
Martins EP (1999) Estimation of ancestral states of continuous character: a computer simulation study. Systematic Biology 48:642–650 [ Links ]
Martins EP y Garland Jr T (1991) Phylogenetic analyses of the correlated evolution of continuous character: a simulation study. Evolution 45:534–557 [ Links ]
Mason P (1986) Brood parasitism in a host generalist, the Shiny Cowbird: I. The quality of different species as hosts. Auk 103:52–60 [ Links ]
Mermoz ME (1996) Interacciones entre el tordo renegrido Molothrus bonariensis y el pecho amarillo Pseudoleistes virescens: estrategias del parásito de cría y mecanismos de defensa del hospedador. Tesis doctoral, Universidad de Buenos Aires, Buenos Aires [ Links ]
Mermoz ME y Ornelas JF (2004) Phylogenetic analysis of life-history adaptations in parasitic cowbirds. Behavioral Ecology 15:109–119 [ Links ]
Mermoz ME y Reboreda JC (1999) Egg laying behaviour by shiny cowbirds parasitizing brown-and-yellow marshbirds. Animal Behaviour 58:873–882 [ Links ]
Oakley TH y Cunningham CW (2000) Independent contrasts succeed where ancestor reconstruction fails in known bacteriophage phylogeny. Evolution 54:397–405 [ Links ]
Ortega CP y Cruz A (1992) Differential growth patterns of nestling brown-headed cowbirds and yellow-headed blackbirds. Auk 109:368–376 [ Links ]
Payne RB (1973) Individual laying histories and the clutch size and numbers of eggs of parasitic cuckoos. Condor 75:414–438 [ Links ]
Payne RB (1977) The ecology of brood parasitism in birds. Annual Review of Ecology and Systematics 8:1–28 [ Links ]
Payne RB, Payne LL y Woods JL (2000) Imprinting and the origin of parasite-host species associations in brood-parasitic indigobirds, Vidua chalybeata. Animal Behaviour 59:69–81 [ Links ]
Pujol EM (2005) Evolución de las características de historia de vida en el grupo que dio origen a los tordos parásitos (Aves: Icteridae). Tesis de Licenciatura, Universidad de Buenos Aires, Buenos Aires [ Links ]
Rahn H, Curran-Everet L y Booth DT (1988) Eggshell differences between parasitic and nonparasitic Icteridae. Condor 90:962–964 [ Links ]
Reeve HK y Sherman PW (1993) Adaptation and the goals of evolutionary research. Quarterly Review of Biology 68:1–31 [ Links ]
Rezende EL y Garland Jr T (2003) Comparaciones interespecíficas y métodos estadísticos filogenéticos. Pp. 79–98 en: Bozinovic F (ed) Fisiología ecológica y evolutiva. Teoría y casos de estudio en animales. Ediciones Universidad Católica de Chile, Santiago [ Links ]
Rohwer S y Spaw CD (1988) Evolutionary lag versus bill-size constraints: a comparative study of the acceptance of cowbirds eggs by old hosts. Evolutionary Ecology 2:27–36 [ Links ]
Rothstein SI (1990) A model system for coevolution: avian brood parasitism. Annual Review of Ecology and Systematics 21:481–508 [ Links ]
Rothstein SI y Robinson SK (1998) The evolution and ecology of avian brood parasitism: an overview. Pp. 3–58 en: Rothstein SI y Robinson SK (eds) Parasitic birds and their hosts: studies in coevolution. Oxford University Press, Oxford [ Links ]
Schluter D, Price T, Moores AO y Ludwig D (1997) Likelihood of ancestor state in adaptative radiation. Evolution 51:1649–1711 [ Links ]
Sealy G y Neudorf DL (1995) Male northern orioles eject cowbird eggs: implications for the evolution of rejection behavior. Condor 97:369–375 [ Links ]
Sealy G, Neudorf DL y Hill DP (1995) Rapid laying by brown-headed cowbirds Molothrus ater and other parasitic birds. Ibis 137:76–84 [ Links ]
Smith NG (1968) The advantage of being parasitized. Nature 219:690–694 [ Links ]
Strausberger BM (1998) Temperature, egg mass, and incubation time: a comparison of brown-headed cowbirds and red-winged blackbirds. Auk 115:863–850 [ Links ]
Weatherhead PJ (1991) The adaptive value of thick-shelled eggs for brown-headed cowbirds. Auk 108:196–198 [ Links ]
Zar JH (1996) Biostatistical analysis. Tercera edición. Prentice Hall, Upper Saddle River [ Links ]














