Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
El hornero
versión impresa ISSN 0073-3407versión On-line ISSN 1850-4884
Hornero v.22 n.2 Buenos Aires dic. 2007
Pérdida y fragmentación de la Selva Paranaense: efectos sobre las aves rapaces diurnas
Gustavo A. Zurita 1,2 y M. Isabel Bellocq 1
1 ECOMA - Laboratorio de Ecología de Comunidades y Macroecología, Departamento de Ecología, Genética y Evolución, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires. Piso 4, Pab. 2, Ciudad Universitaria, C1428EHA Buenos Aires, Argentina.
2 gazurita@ege.fcen.uba.ar
Resumen
Las aves rapaces constituyen un grupo potencialmente sensible a la pérdida y la fragmentación de su ambiente natural debido a sus requerimientos de hábitat extensos y a su baja densidad poblacional. Sin embargo, las rapaces parecen responder de modo diferente a la pérdida del hábitat en ecosistemas templados (donde se observan pocos efectos) y en selvas tropicales y subtropicales (con efectos más marcados). El objetivo de este trabajo es estudiar la respuesta de un grupo de aves rapaces diurnas a la pérdida y la fragmentación de la Selva Paranaense. La Selva Atlántica o Selva Paranaense en Argentina y Paraguay ha sido drásticamente reemplazada y en la actualidad solo permanece menos del 7% de su cobertura original. En relevamientos que cubrieron 4300 km2 de selva con distintos niveles de degradación y usos de la tierra, se registró un total de 14 especies de aves rapaces diurnas. Cinco especies fueron afectadas por la pérdida y la fragmentación de la selva, ya que solo fueron registradas en paisajes con una cobertura de selva mayor al 60%. Siete especies fueron registradas en paisajes con baja y alta cobertura de selva, mientras que dos especies propias de ambientes abiertos incrementaron su abundancia al aumentar la superficie de selva deforestada. La baja capacidad de las rapaces de selva para utilizar las matrices humanas, en comparación con la de especies de ecosistemas templados, sería uno de los factores que determinan la alta sensibilidad de estos ensambles. La conservación de las rapaces en la Selva Paranaense, particularmente las especies muy asociadas a la selva, implica el mantenimiento de grandes superficies continuas de selva o de grandes fragmentos conectados por corredores.
Palabras clave: Deforestación; Fragmentación; Rapaces diurnas; Selva Atlántica; Selva Paranaense.
Abstract
Loss and fragmentation of the Paranaense Forest: effects on diurnal raptors
Raptorial birds are affected by forest loss and fragmentation because of their low density and requirements of large habitat. However, the response of raptors to habitat loss in temperate ecosystems (where low effects were observed) and tropical and subtropical forests (with more important effects) seems to be different. Our objective was to evaluate the response of diurnal raptors to forest loss and fragmentation in the Atlantic Forest. The Atlantic Forest, or Paranaense Forest in Argentina and Paraguay, has been drastically reduced to less than 7% of its original extent. In an area covering 4300 km2 of forest and different land uses, we recorded 14 raptor species. Five species were sensible to habitat loss and fragmentation because they were only recorded in landscapes with more than 60% of forest cover. Seven species were recorded in landscapes with low and high forest cover and two species typical from open habitats increased their abundance with forest loss and fragmentation. The low capacity of rainforest raptors to adapt to human matrices, compared to raptors in temperate ecosystems, seems to be one of the factors accounting for the high sensitivity of this community. The conservation of rainforest raptors in the Paranaense Forest requires the maintenance of large areas of continuous forest and large fragments linked by forest corridors.
Key words: Atlantic Forest; Deforestation; Diurnal raptors; Fragmentation; Paranaense Forest.
Recibido 15 noviembre 2006, aceptado 10 diciembre 2007
La pérdida y la fragmentación de los ambientes naturales han sido consideradas las causas principales de extinción de especies a nivel global (Brooks et al. 2002). Este impacto resulta particularmente trascendente en las selvas tropicales y subtropicales donde se concentra la mayor parte de las especies y donde está ocurriendo un acelerado proceso de degradación y reemplazo de estos ambientes (Myers et al. 2000). Los mecanismos de extinción de especies asociados a la pérdida y la fragmentación de los ambientes naturales incluyen la reducción de las poblaciones por debajo del tamaño mínimo viable (por la degradación de los fragmentos remanentes y el efecto borde), el incremento en la vulnerabilidad de las poblaciones (por reducción de la variabilidad genética) y la presión de la caza y de la explotación forestal (Fahrig 2003). Si bien éstos son efectos generales, no todas las especies presentan la misma vulnerabilidad: son altamente sensibles las especies con poblaciones intrínsecamente pequeñas, baja densidad poblacional, baja capacidad de dispersión o reducida habilidad para atravesar las matrices de origen humano (i.e., ambientes modificados por las actividades humanas) (Laurance y Bierregaard 1997). Debido a que las aves rapaces constituyen un grupo que reúne algunas de estas condiciones, porque requieren grandes extensiones de hábitat y presentan una baja densidad poblacional, han sido repetidamente consideradas un grupo sensible a la modificación y la fragmentación de los ambientes naturales. Sin embargo, en la mayor parte de los estudios realizados en ecosistemas templados no se han encontrado cambios marcados en las comunidades de rapaces asociados a la modificación de los ambientes (Kattan et al. 1994, Rodríguez-Estrella et al. 1998, Meunier et al. 2000, Filloy y Bellocq 2007). Por el contrario, las rapaces de selvas tropicales y subtropicales sí parecen constituir un grupo sensible (Thiollay 1989, 1996, 2006, Kattan et al. 1994, Jullien y Thiollay 1996, Renjifo 1999, dos Anjos 2006). Las diferentes respuestas de los ensambles de rapaces podrían deberse a una mayor capacidad de las especies propias de ambientes templados para utilizar los ambientes modificados y a una mayor dependencia del ambiente natural por parte de las especies tropicales y subtropicales.
La Selva Atlántica (Selva Paranaense en Argentina y Paraguay) es uno de los ecosistemas de mayor prioridad de conservación a nivel global debido a su alta biodiversidad, número de especies endémicas y grado de amenaza (Myers et al. 2000). En la actualidad, menos del 7% de su cobertura original persiste en Brasil, Argentina y Paraguay (Galindo-Leal y Câmara 2003). La riqueza de aves rapaces en la Selva Atlántica es alta (al menos 57 especies incluyendo Falconiformes y Strigiformes); sin embargo, solo 2 especies son endémicas de esta eco-región (Stotz et al. 1996, Brooks et al. 1999). En la Selva Paranaense de Argentina se encuentran presentes cerca del 60% de las especies de rapaces del país (46 de 77 especies), entre ellas 3 que están cercanas a la amenaza a nivel global: el Águila Monera (Morphnus guianensis), la Harpía (Harpia harpyja) y la Lechuza Listada (Strix hylophila) (BirdLife International 2004).
A pesar de su importancia en términos de riqueza de especies y grado de amenaza, ningún estudio ha reportado los efectos de la pérdida y la fragmentación de la Selva Paranaense sobre las aves rapaces a escala regional. En este marco, el objetivo de este trabajo fue estudiar la respuesta de un grupo de aves rapaces diurnas a la pérdida y la fragmentación de la Selva Paranaense.
Métodos
El estudio se realizó en un área total de aproximadamente 4300 km2 (3300 km2 en Argentina y 1000 km2 en Paraguay; Fig. 1) ubicada en la Selva Paranaense o Bosque Atlántico del Alto Paraná (Oliveira-Filho y Fontes 2000). En los muestreos se incluyeron áreas protegidas en Argentina (Parque Nacional Iguazú, parques provinciales Urugua-í y H. Foerster, entre otros) y Paraguay (Reserva Natural Mbaracayu y Reserva Privada Morombí), selva en fragmentos fuera de las áreas protegidas y los usos de la tierra más relevantes en la región (forestaciones de pino y araucaria, cultivos perennes y anuales y potreros para ganado). La Selva Paranaense representa el extremo sur de la distribución de la Selva Atlántica; es un ambiente formado por cinco estratos vegetales principales y, debido a la estacionalidad térmica, se considera una selva semidecidua.

Figura 1. Distribución original (gris claro) y remanentes actuales (gris oscuro) de Selva Paranaense o Bosque Atlántico del Alto Paraná en Argentina, Paraguay y Brasil (modificado de Di Bitetti et al. 2003). Los recuadros indican las dos áreas de muestreo correspondientes a este estudio.
El área de estudio se dividió en una cuadrícula con celdas de 10×10 km. Para cada celda se estimó el porcentaje de cobertura remanente de selva utilizado una imagen satelital clasificada y el programa Scion-Image (versión 7.01). En cada celda se establecieron 20 puntos de muestreo de aves. El número de puntos de muestreo en selva fue proporcional al remanente de selva en la celda (e.g., a 50% de selva remanente le correspondieron 10 puntos de muestreo en selva y 10 en el resto de los usos de la tierra presentes en la celda).
Se realizaron muestreos de aves rapaces diurnas durante septiembre-enero en dos periodos (2004-2005 y 2005-2006), utilizando el método de puntos con radio ilimitado (Bibby et al. 1998). En cada punto de muestreo se registraron durante 5 min todas las aves vistas u oídas (excluyendo las que se encontraban en vuelo) desde el amanecer (5:00-6:00 h) hasta las 10:30 h. En total se relevaron 860 puntos (500 en selva y 360 en el resto de los usos de la tierra) distribuidos en 43 celdas, cubriendo un gradiente de 10-100% de cobertura de selva. Posteriormente, las celdas se agruparon en nueve categorías de porcentaje remanente de selva: 10-20% (5 celdas), 20-30% (4), 30-40% (5), 40-50% (5), 50-60% (6), 60-70% (5), 70-80% (3), 80-90% (2) y 90-100% (8).
La abundancia relativa de cada especie se calculó como el promedio del número de individuos registrados por celda y la riqueza específica como el promedio del número de especies registradas. Para evaluar los efectos de la pérdida de hábitat se realizaron regresiones lineales y no lineales de la abundancia relativa de cada especie y de la riqueza específica en función del porcentaje de selva remanente. Se probó el ajuste a tres modelos diferentes, seleccionando el que tuvo el mejor ajuste a los datos (i.e., una mayor proporción de la variación explicada). Los modelos utilizados fueron el lineal, el exponencial y el sigmoideo. Estos modelos representan las respuestas más probables de las especies a la pérdida y la fragmentación de hábitat: un incremento o disminución (lineal o exponencial) o un incremento o disminución con un umbral a partir del cual la especie no está presente (sigmoideo) (Fahrig 2003). Cada especie fue clasificada en una de las siguientes categorías: especies que disminuyen su abundancia o desaparecen con la pérdida y la fragmentación del hábitat, especies que incrementan su abundancia y especies que no muestran una respuesta.
Resultados
Durante los muestreos se registró un total de 111 individuos pertenecientes a 14 especies de aves rapaces diurnas, correspondientes a las familias Cathartidae (3 especies), Falconidae (6), Accipitridae (4) y Strigidae (1) (Tabla 1). El número de especies registradas en selva y en zonas deforestadas fue similar (11 vs. 10; χ2 = 0.05, P = 0.83). Cinco especies fueron registradas solo en selva, tres solo en zonas deforestadas y siete en ambos tipos de ambientes (Tabla 1). La riqueza específica no estuvo relacionada con la cobertura remanente de selva en el paisaje (Fig. 2).
Tabla 1. Especies de aves rapaces diurnas registradas en el área de estudio en la Selva Paranaense de Argentina y Paraguay. Se muestra el número total de registros y, entre paréntesis, el porcentaje correspondiente a selva. Para cada especie se indica su sensibilidad a la pérdida y la fragmentación de la selva.


Figura 2. Riqueza de especies de aves rapaces diurnas en celdas de 10x10 km en función del porcentaje de selva remanente en el área de estudio en la Selva Paranaense de Argentina y Paraguay.
Las especies presentaron diferentes patrones de respuesta frente a la pérdida de hábitat. El Halcón Negro Chico (Falco rufigularis) y el Jote Real (Sarcoramphus papa) solo fueron registradas en celdas con 100% de cobertura de selva. El Carancho (Polyborus plancus), la Chimachima (Milvago chimachima), el Esparvero Común (Accipiter erythronemius), el Jote Cabeza Negra (Coragyps atratus), el Jote Cabeza Colorada (Cathartes aura), el Taguató Común (Buteo magnirostris) y el Milano Tijereta (Elanoides forficatus) no se ajustaron a los modelos probados y se encontraron, en general, en celdas con porcentajes de selva remanente que cubrían todo el rango observado. La Lechucita Vizcachera (Athene cunicularia) y el Halconcito Colorado (Falco sparverius) incrementaron su abundancia con el reemplazo y fragmentación del hábitat, mientras que las dos especies de halcón montés (Micrastur spp.) y el Milano Plomizo (Ictinia plumbea) disminuyeron su abundancia (Tabla 2, Fig. 3).
Tabla 2. Respuesta de las especies de aves rapaces diurnas a la pérdida y la fragmentación de la selva en el área de estudio en la Selva Paranaense de Argentina y Paraguay.
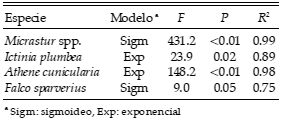

Figura 3. Abundancia de las especies de aves rapaces diurnas en celdas de 10×10 km en función del porcentaje de selva remanente en el área de estudio en la Selva Paranaense de Argentina y Paraguay.
Discusión
La pérdida y la fragmentación de la selva afectaron a la comunidad de aves rapaces diurnas en la Selva Paranaense. Cerca del 35% de las especies fueron afectadas por este proceso. Sin embargo, debe considerarse que los muestreos incluyeron un número limitado de especies con respecto al ensamble total de rapaces. Estos resultados son similares a los de otros estudios realizados en selvas tropicales, en los cuales se observó una alta dependencia del ambiente natural y una baja capacidad para utilizar las matrices humanas (Thiollay 1989, 1996, Kattan et al. 1994, Renjifo 2001). En contraste, las rapaces en ecosistemas templados no parecen constituir un grupo particularmente sensible al reemplazo y fragmentación del hábitat, debido probablemente a su capacidad para adaptarse y utilizar los agroecosistemas (Rodríguez-Estrella et al. 1998, Filloy y Bellocq 2007).
Cinco especies se vieron afectadas por el reemplazo y la fragmentación de la selva. El Jote Real, el Halcón Negro Chico, el Halcón Montés Chico (Micrastur ruficollis) y el Halcón Montés Grande (Micrastur semitorquatus) solo estuvieron presentes en paisajes con una cobertura de selva mayor al 60%, lo cual indica una alta sensibilidad a la deforestación y la fragmentación. Otros estudios en selvas de América del Sur identificaron al Halcón Montés Chico y al Halcón Montés Grande como especies muy sensibles y con baja capacidad para atravesar matrices humanas (Thiollay 1989, Renjifo 1999, Ribon et al. 2003, dos Anjos 2006). Asimismo, el Jote Real requiere grandes áreas de selva continua y es poco abundante en zonas fragmentadas de selva (Jullien y Thiollay 1996, Loures-Ribeiro y dos Anjos 2006). El Milano Plomizo también es considerado sensible al reemplazo y a la fragmentación de la selva (dos Anjos 2006); sin embargo, en este estudio estuvo presente en todo el gradiente de coberturas de selva, aunque fue mucho más abundante en paisajes con alta cobertura.
Las especies que no fueron afectadas por la fragmentación se caracterizan por tener, en general, una amplia área de distribución y por utilizar diferentes tipos de ambientes, incluyendo bosques abiertos y sabanas. En otros estudios, el Jote Cabeza Negra, el Milano Tijereta y el Taguató Común fueron igualmente abundantes en zonas de selva fragmentadas y continuas (Jullien y Thiollay 1996). Estas especies utilizan una gran cantidad de ambientes en su área de distribución, por lo que probablemente tengan pocas restricciones para moverse entre fragmentos y utilizar algunas matrices humanas como áreas de alimentación y nidificación (Loures-Ribeiro y dos Anjos 2006). El proceso de expansión del área de distribución de algunas especies a partir del reemplazo del ambiente original está generalizado en selvas tropicales y subtropicales (Daily et al. 2001, Petit y Petit 2003, Zurita et al. 2006). Este parece ser el caso de la Lechucita Vizcachera y del Halconcito Colorado, especies típicas de sabanas, pastizales y bosques abiertos, en el cual el reemplazo de la selva original por ambientes abiertos (principalmente potreros para ganado) facilitó su expansión. Ambas son particularmente abundantes en agroecosistemas (Bellocq 1997, Rodríguez-Estrella et al. 1998, Bellocq y Gómez-Insausti 2005). El reemplazo de grandes extensiones de selva por potreros para ganado y cultivos, tanto anuales como perennes, generó condiciones adecuadas para la nidificación y alimentación de ambas especies. Las consecuencias de este proceso de expansión de algunas especies a partir de la deforestación sobre las especies nativas son poco conocidos.
La conservación de las rapaces de selva requiere de la protección de grandes áreas, debido a su baja densidad y a sus requerimientos de grandes extensiones de hábitat (Thiollay 1989, 1996); sin embargo, la mayor parte de la Selva Paranaense ha sido reemplazada y los fragmentos remanentes se encuentran aislados (Di Bitetti et al. 2003). La conexión de los remanentes de selva a través de corredores facilitaría el intercambio de individuos para aquellas rapaces que no atraviesan las matrices humanas. No obstante, la eficacia de los corredores para las aves y su diseño óptimo en la Selva Paranaense se desconocen. En trabajos anteriores, por ejemplo, el Halcón Montés Chico fue capturado en un corredor entre dos áreas protegidas provinciales (Urugua-í y H. Foerster), lo cual indicaría que, al menos para esta especie, los corredores podrían ser funcionales (Zurita et al., datos no publicados).
Este estudio no incluyó a muchas especies de aves rapaces típicas de la Selva Atlántica, como las grandes águilas o a las rapaces nocturnas, que requieren metodologías de muestreo específicas. Sin embargo, dado que la mayoría de estas especies están fuertemente asociadas a la selva, se espera que constituyan un grupo particularmente afectado por la pérdida y la fragmentación del hábitat. Estudios específicos que evalúen los efectos del reemplazo, la fragmentación y la degradación de la selva sobre esas especies constituye una prioridad de investigación y conservación en la Selva Atlántica. A diferencia de lo que se observa en otros ecosistemas, el reemplazo y la fragmentación de grandes superficies de selva (más del 50% en el paisaje) resultan en cambios significativos en la comunidad de rapaces.
Agradecimientos. El Ministerio de Ecología, Recursos Naturales y Turismo de la provincia de Misiones, la Administración de Parques Nacionales y la Fundación Moisés Bertoni (Paraguay) facilitaron los permisos de muestreo en las áreas protegidas. Alto Paraná S.A. facilitó el acceso a sus predios y Conservación Argentina y la Fundación Moisés Bertoni (particularmente Myriam Velázquez) facilitaron apoyo logístico durante los muestreos. Este proyecto fue financiado por la Universidad de Buenos Aires, el Fondo Mundial para la Conservación de la Naturaleza (WWF) y el CONICET.
Bibliografía Citada
dos Anjos L (2006) Bird species sensitivity in a fragmented landscape of the Atlantic forest in southern Brazil. Biotropica 38:229-234 [ Links ]
Bellocq MI (1997) Ecology of the Burrowing owl in agrosystems of central Argentina. Journal of Raptor Research Reports 9:35-41 [ Links ]
Bellocq MI y Gómez-Insausti R (2005) Raptorial birds and environmental gradients in the southern Neotropics: a test of species-richness hypotheses. Austral Ecology 30:900-906 [ Links ]
Bibby C, Jones M y Mardsen S (1998) Expedition field techniques. Bird Surveys. Royal Geographical Society, Londres [ Links ]
BirdLife International (2004) Threatened birds of the world 2004. BirdLife International, Cambridge [ Links ]
Brooks TM, Mittermeier RA, Mittermeier CG, Da Fonseca GAB, Rylands AB, Konstant WR, Flick P, Pilgrim J, Oldfield S, Magin G y Hilton-Taylor C (2002) Habitat loss and extinction in the hotspots of biodiversity. Conservation Biology 16:909-923 [ Links ]
Brooks TM, Tobias J y Balmford A (1999) Deforestation and bird extinctions in the Atlantic forest. Animal Conservation 2:211-222 [ Links ]
Daily GC, Ehrlich PR y Sánchez-Azofeifa A (2001) Countryside biogeography: use of human-dominated habitats by the avifauna of southern Costa Rica. Ecological Applications 11:1-13 [ Links ]
Di Bitetti MS, Placci G y Dietz LA (2003) Una visión de biodiversidad para la ecorregión del bosque Atlántico del Alto Paraná: diseño de un paisaje para la conservación y prioridades para las acciones de conservación. World Wildlife Fund, Washington DC [ Links ]
Fahrig L (2003) Effects of habitat fragmentation on biodiversity. Annual Review of Ecology, Evolution and Systematics 34:487-515 [ Links ]
Filloy J y Bellocq MI (2007) Respuesta de las aves rapaces al uso de la tierra: un enfoque regional. Hornero 22:131-140 [ Links ]
Galindo-Leal C y Câmara IG (2003) The Atlantic forest of South America: biodiversity status, threats and outlook. Island Press, Washington DC [ Links ]
Jullien M y Thiollay JM (1996) Effects of rain forest disturbance and fragmentation: comparative changes of the raptor community along natural and human-made gradients in French Guiana. Journal of Biogeography 23:7-25 [ Links ]
Kattan GH, Alvarez-López H y Giraldo M (1994) Forest fragmentation and bird extinctions: San Antonio eighty years later. Biological Conservation 8:138-146 [ Links ]
Laurance WF y Bierregaard RO Jr (1997) Tropical forest remnants. Ecology, management, and conservation of fragmented communities. University of Chicago Press, Chicago y Londres [ Links ]
Loures-Ribeiro y dos Anjos L (2006) Falconiformes assemblages in a fragmented landscape of the Atlantic Forest in southern Brazil. Brazilian Archives of Biology and Technology 49:149-162 [ Links ]
Meunier FD, Verheyden C y Jouventin P (2000) Use of roadsides by diurnal raptors in agricultural landscapes. Biological Conservation 92:291-298 [ Links ]
Myers M, Mittermeir RA, Mittermeier CG, Da Fonseca GAB y Kent J (2000) Biodiversity hotspots for conservation priorities. Nature 403:853-858 [ Links ]
Oliveira-Filho AT y Fontes LAM (2000) Patterns of floristic differentiation among Atlantic Forests in southeastern Brazil and the influence of climate. Biotropica 32:793-810 [ Links ]
Petit LJ y Petit DR (2003) Evaluating the importance of human-modified lands for Neotropical bird conservation. Conservation Biology 17:687-694 [ Links ]
Renjifo LM (1999) Composition changes in a subandean avifauna after long-term forest fragmentation. Conservation Biology 1124-1139 [ Links ]
Renjifo LM (2001) Effect of natural and anthropogenic landscapes matrices on the abundance of subandean bird species. Ecological Applications 11:14-31 [ Links ]
Ribon R, Simon JE y De Mattos GT (2003) Bird extinctions in Atlantic forest fragments of the Viçosa region, southeastern Brazil. Conservation Biology 17:1827-1839 [ Links ]
Rodríguez-Estrella R, Donázar JA e Hiraldo F (1998) Raptors as indicators of environmental change in the scrub habitat of Baja California sur, Mexico. Conservation Biology 12:921-925 [ Links ]
Stotz DF, Fitzpatrick JW, Parker TA III y Moskovits DA (1996) Neotropical birds: ecology and conservation. University of Chicago Press, Chicago [ Links ]
Thiollay JM (1989) Area requirements for the conservation of rain forest raptors and game birds in French Guiana. Conservation Biology 3:128-137 [ Links ]
Thiollay JM (1996) Distributional patterns of raptors along gradients in the northern Andes and effects of forest fragmentation. Journal of Tropical Ecology 12:535-560 [ Links ]
Thiollay JM (2006) The decline of raptors in West Africa: long term assessment and the role of protected areas. Ibis 148:240-250 [ Links ]
Zurita GA, Rey N, Varela DM, Villagra M y Bellocq MI (2006) Conversion of the Atlantic forest into native and exotic tree plantations: effects on bird communities from the local and regional perspectives. Forest Ecology and Management 235:164-173 [ Links ]














